第10章_羧酸和取代酸_2010.6.2
合集下载
羧酸与取代羧酸

伯醇和仲醇成酯以“酰氧键断裂的机理”:
O CH3 C
-H2O
消除
OH
H+
+ OH HOC2H5
CH3 C OH
CH3
OH C OH
亲核加成 H O+C2H5
Ⅰ
Ⅱ
+ OH
-H+
CH3 C OC2H5
O CH3 C OC2H5
Ⅳ
Ⅴ
OH
+
CH3 C OH2 OC2H5
Ⅲ
11-28
伯醇和仲醇与酸成酯反应的特点: ①反应总的结果是亲核试剂醇分子中的-OR基取代了羧基中的羟基,是羧基的 亲核取代反应。 ②空间位阻对酯化反应的速度影响很大。 上述反应的中间体(Ⅱ)和 (Ⅲ)都是四面体结构,比较拥挤,如果羧酸和醇的α碳上连接的基团越多, 越大,这些中间体越不稳定,酯化反应越难进行。 酸或醇的烃基体积小、数目少,速度快。反应活性顺序如下:
11-13
问题11-2 分离苯甲酸、苯甲醇和苯酚的混合物。
COOH OH CH2OH
NaOH水溶液
水层 通CO2
溶液 H+ 晶体(苯甲酸) 晶体(苯酚)
醇层(苯甲醇)
羧酸酸性的应用: 分离、鉴别羧酸与酚
在制药工业中将羧酸制成钾盐、钠盐增加 药物的水溶性,提高药效
11-14
问题11-3 乙酸中也含有CH3CO基团,但不发生碘仿反应。为 什么?
AC
OH
性增强
O
当D为推电子基团, 酸
D C O H 性减弱
11-15
(1) 诱导效应
酸性排列顺序
HCOOH > CH3COOH >CH3CH2COOH
pKa 3.77
有机化学 第10章羧酸和取代羧酸

R C ONH4
R C NH2 + H2O
O R C OH + NH2R'
O
O R C ONH3R'
酰胺
R C NHR'+H2O
N-取代酰胺
易水解 酰胺键
O R C OH + NH3
O -H2ORCNH2
OR C OH
+NH3
OH R C OH
NH2
(4)酰卤的生成
O R C OH + PCl3
O R C OH + PCl5
COOH
一元酸
饱和酸 CH3CH2CH2COOH
多元酸
不饱和酸 HOOCCH=CHCOOH (二元酸)
羧酸有时根据其来源用俗名进行命名
HCOOH 蚁酸
CH3COOH
HOOCCOOH 草酸
HOOCCH2CH2COOH
琥珀酸
醋酸
CH3(CH2)7CH=CH(CH2)7COOH 油酸
COOH 安息香酸
羧酸的系统命名原则与醛相似:
※ ① β-酮酸的酮式分解
O R C CH2 COOH
O R C CH3 + CO2
OH
RC
O -CO2
CH2 C O
OH R C=O
※ •酸性影响因素
主要为电子效应
O AC
OH
当A为吸电子基团, 酸性增强
O
当D为推电子基团,
D C O H 酸性减弱
酸性排列顺序:
CH2FCOOH > CH2ClCOOH > CH2BrCOOH CH3CHClCOOH > CH2ClCH2COOH
O
C OH
-C6H5: -I 使酸性增强 +C 使酸性减弱
第10章 羧酸羧酸衍生物取代酸
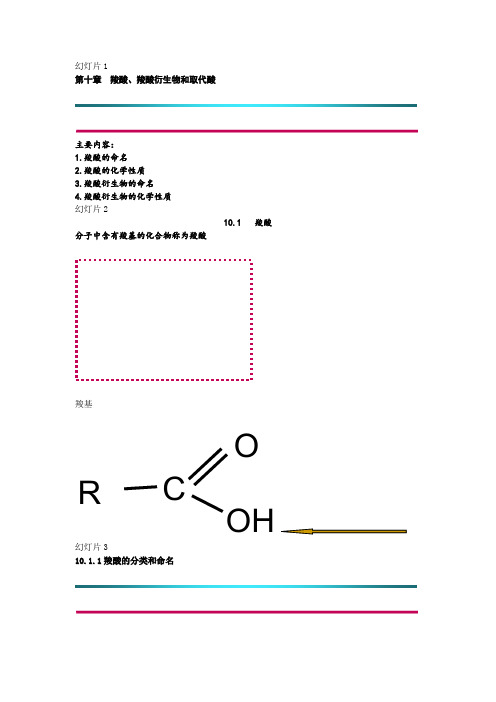
幻灯片1
第十章羧酸、羧酸衍生物和取代酸
主要内容:
1.羧酸的命名
2.羧酸的化学性质
3.羧酸衍生物的命名
4.羧酸衍生物的化学性质
幻灯片2
10.1羧酸
分子中含有羧基的化合物称为羧酸
羧基
幻灯片3
10.1.1羧酸的分类和命名
幻灯片4
2.命名
系统命名法(与醛相似)
(1)选主链:含– COOH与重键, Ar-取代基
幻灯片32
己二酸、3
4.α– H取代反应(相似于醛、酮)
α–卤代羧酸
反应一般在碘、硫或红磷催化下才能进行。
幻灯片34
应用:
幻灯片35
5.还原反应
LiAlH4具选择性的强还原剂,
羧酸、酰卤、酯等均能被还原为醇。
而C=C、C≡C不被还原,
幻灯片36
个别化合物:甲酸
1.36Å
醇中C-O单键键长为1.43Å
p -π共轭
幻灯片11
甲酸钠的x衍射实验结果:
1.27Å
1.27Å
两个碳氧键等长,完全离域。
幻灯片12
幻灯片13
1.酸性
幻灯片14
幻灯片15
(1)用途
①增加水溶性
②酸的分离提纯
例:分离下列化合物
幻灯片16
思考题:
影响羧酸酸性强弱的因素是什么?
如何解释下列物质的酸性强弱规律?
RCH2OH>R2CHOH>R3COH
幻灯片22
问题:
1.如何提高产率?
2.哪个物质脱羟基?
幻灯片23
叔醇———烷氧键断裂
幻灯片24
反应历程:(酸催化羰基氧原子发生质子化)
幻灯片25
(4)酰胺生成
第十章羧酸、羧酸衍生物和取代酸
主要内容:
1.羧酸的命名
2.羧酸的化学性质
3.羧酸衍生物的命名
4.羧酸衍生物的化学性质
幻灯片2
10.1羧酸
分子中含有羧基的化合物称为羧酸
羧基
幻灯片3
10.1.1羧酸的分类和命名
幻灯片4
2.命名
系统命名法(与醛相似)
(1)选主链:含– COOH与重键, Ar-取代基
幻灯片32
己二酸、3
4.α– H取代反应(相似于醛、酮)
α–卤代羧酸
反应一般在碘、硫或红磷催化下才能进行。
幻灯片34
应用:
幻灯片35
5.还原反应
LiAlH4具选择性的强还原剂,
羧酸、酰卤、酯等均能被还原为醇。
而C=C、C≡C不被还原,
幻灯片36
个别化合物:甲酸
1.36Å
醇中C-O单键键长为1.43Å
p -π共轭
幻灯片11
甲酸钠的x衍射实验结果:
1.27Å
1.27Å
两个碳氧键等长,完全离域。
幻灯片12
幻灯片13
1.酸性
幻灯片14
幻灯片15
(1)用途
①增加水溶性
②酸的分离提纯
例:分离下列化合物
幻灯片16
思考题:
影响羧酸酸性强弱的因素是什么?
如何解释下列物质的酸性强弱规律?
RCH2OH>R2CHOH>R3COH
幻灯片22
问题:
1.如何提高产率?
2.哪个物质脱羟基?
幻灯片23
叔醇———烷氧键断裂
幻灯片24
反应历程:(酸催化羰基氧原子发生质子化)
幻灯片25
(4)酰胺生成
第十章 羧酸、羧酸衍生物和取代酸

羧酸最重要的性质之一是具有酸性,在水中可离解出 质子,能使石蕊试纸变红。 R-COOH
Ka
R-COO- + H+
[H + ][RCOO - ] Ka = = 1.75×10 -5 [RCOOH] 羧酸的酸性强度,一般用解离常数Ka值或pKa值表示: pKa = -lgKa pKa 则酸性
羧酸的中和当量可用酸碱滴定法测定得: 中和当量 =
CH3COOH + NaHCO3
CH3COONa + CO2 + H2O
多数的羧酸是弱酸,pKa约为4-5 (大部分的羧酸是以未解离的分子形式存在)
取代基对羧酸酸性的影响
电子效应的影响: 吸电子取代基使酸性增大,供电子取代基使酸性减少。 HCOOH C6H5-COOH CH3COOH pka 3.37 4.20 4.73 空间效应: 利于H+离解的空间结构酸性强,不利于H+离解的空间 结构酸性弱. 分子内的氢键也能使羧酸的酸 性增强。
一、羧酸衍生物的命名
酰卤—— 由相应酸的酰基和卤素组成。 O CH3-C-Cl 乙酰氯 Br O CH3CH2CH-C-Br 2-溴丁酰溴 = O -C-Br 苯甲酰溴
可作为酰基的 卤化物,在酰基后 加卤素的名称。
p-CH3OC6H4COCl 对甲氧基苯甲酰氯
酰胺—— 由相应酸的酰基和“胺”组成它的名称。若氮上 有 O 取代基,在基名称前加N 标出。 CH3-C-NH2 -CONH2 CH2(CONH2)2 乙酰胺 环己烷甲酰胺 O CH3-C-NHCH2CH3 N-乙基乙酰胺 O -C -C NH O 丙二酰胺 O CH 3 H-C-N CH3 N,N -二甲基甲酰胺
酪酸
软脂酸 硬脂酸
Ka
R-COO- + H+
[H + ][RCOO - ] Ka = = 1.75×10 -5 [RCOOH] 羧酸的酸性强度,一般用解离常数Ka值或pKa值表示: pKa = -lgKa pKa 则酸性
羧酸的中和当量可用酸碱滴定法测定得: 中和当量 =
CH3COOH + NaHCO3
CH3COONa + CO2 + H2O
多数的羧酸是弱酸,pKa约为4-5 (大部分的羧酸是以未解离的分子形式存在)
取代基对羧酸酸性的影响
电子效应的影响: 吸电子取代基使酸性增大,供电子取代基使酸性减少。 HCOOH C6H5-COOH CH3COOH pka 3.37 4.20 4.73 空间效应: 利于H+离解的空间结构酸性强,不利于H+离解的空间 结构酸性弱. 分子内的氢键也能使羧酸的酸 性增强。
一、羧酸衍生物的命名
酰卤—— 由相应酸的酰基和卤素组成。 O CH3-C-Cl 乙酰氯 Br O CH3CH2CH-C-Br 2-溴丁酰溴 = O -C-Br 苯甲酰溴
可作为酰基的 卤化物,在酰基后 加卤素的名称。
p-CH3OC6H4COCl 对甲氧基苯甲酰氯
酰胺—— 由相应酸的酰基和“胺”组成它的名称。若氮上 有 O 取代基,在基名称前加N 标出。 CH3-C-NH2 -CONH2 CH2(CONH2)2 乙酰胺 环己烷甲酰胺 O CH3-C-NHCH2CH3 N-乙基乙酰胺 O -C -C NH O 丙二酰胺 O CH 3 H-C-N CH3 N,N -二甲基甲酰胺
酪酸
软脂酸 硬脂酸
第十章羧酸和取代羧酸

2.两个羧基间隔2个或3个碳原子,受热 发生脱水反应,生成环酐。
O CH2 C OH
CH2 C OH
O 丁二酸
O
CH2 C O CH2 C
O 丁二酸酐
O
CH3 CH C OH CH2 CH2 C OH O
2-甲基戊二酸
O
CH3 CH C
CH2
O
CH2 C
O
2-甲基戊二酸酐
3.两个羧基间隔4个或5个碳原子,受热发生脱水脱羧反应,
目前已分离出二十多种前列腺素,它们的结构有一 个共同的特点,都具有前列腺酸的基本骨架。
9 .....7
5
3 1COOH
11 13 15 17 19
前列腺酸
PG是一组含有二十个碳原子的不饱和脂肪酸,其 基本骨架为一个五碳环和两条侧链,五元环上8-位和 12-位侧链互为反式构型。根据五碳环上取代基和双链 的位置不同,分为九型(PGA、PGB、PGC、PGD、PGE、 PGF、PGG、PGH、PGl),每型又根据双键的数目分三类 (如PGE1、PGE2、PGE3), 表示取代基处于环戊烷平面 的下方(用虚线表示);表示取代基在环戊烷平面的上 方(用实线表示) 。
➢ a-H 的活性—— 降低
四、羧酸的化学性质 脱羧反应 氧化与还原
O
C O
R(Ar)
-H的取代
羟基被取代
酸性
H
-X 酰卤 -OCOR 酸酐 -OR 酯 -NH2 酰胺
(一) 酸性
O
R C OH
O R C O- + H +
羧酸一般都属于弱酸,比碳酸和苯酚的酸性强。羧酸
能分解碳酸氢钠,放出二氧化碳,而酚不能。利用此性质 可以区别羧酸与酚类。
第十章羧酸及其衍生物和取代酸详解演示文稿

保留双键
第十七页,共53页。
4、 羧酸的受热分解-脱羧反应
羧酸分子脱去CO2的反应叫脱羧反应,根据羧酸结构不同可以得 到不同产物
(1) 一元羧酸
R – COONa NaOH-CaO
共熔
R - H + Na2CO3
羧酸的α位上有强吸电子基团时,容易脱羧
CCl3 – COOH
△
CHCl3 + CO2↑
R'
浓H2SO4
R
O C
O
△
R' + H2O
CH2COOH 浓H2SO4
OH
CH2
CO O
H3O+
CH2COOH OH
第十六页,共53页。
3、 还原
用LiAlH4可以将羧酸还原为醇,该还原剂不影响化合物中的
不饱和键.
O R C OH
LiAlH4
R CH2 OH 伯伯醇醇
H2C CH CH2 COOH LiAlH4 H2C CH CH2 CH2 OH
⑴ 酰氯、酰胺:将相应的“酸”改为酰氯、酰胺即可。例如:
第二十七页,共53页。
⑵ 酸酐
由相应的酸来命名
两分子酸相同:
O CH3 C
O CH3 C
O
乙酸酐
O CH3 CH2 C
O CH3 CH2 C
O
丙酸酐
O C
O
C O
苯甲酸酐
两分子酸不同:
O CH3 C
O
CH3 CH2 C O
乙(酸)丙(酸)酐
第二十八页,共53页。
3、苯甲酸 安息香酸,苯甲酸钠作为防腐剂. 4、乙二酸 草酸,酸性最强的二元酸.具有很强的配位能力.在定量分析中
第十七页,共53页。
4、 羧酸的受热分解-脱羧反应
羧酸分子脱去CO2的反应叫脱羧反应,根据羧酸结构不同可以得 到不同产物
(1) 一元羧酸
R – COONa NaOH-CaO
共熔
R - H + Na2CO3
羧酸的α位上有强吸电子基团时,容易脱羧
CCl3 – COOH
△
CHCl3 + CO2↑
R'
浓H2SO4
R
O C
O
△
R' + H2O
CH2COOH 浓H2SO4
OH
CH2
CO O
H3O+
CH2COOH OH
第十六页,共53页。
3、 还原
用LiAlH4可以将羧酸还原为醇,该还原剂不影响化合物中的
不饱和键.
O R C OH
LiAlH4
R CH2 OH 伯伯醇醇
H2C CH CH2 COOH LiAlH4 H2C CH CH2 CH2 OH
⑴ 酰氯、酰胺:将相应的“酸”改为酰氯、酰胺即可。例如:
第二十七页,共53页。
⑵ 酸酐
由相应的酸来命名
两分子酸相同:
O CH3 C
O CH3 C
O
乙酸酐
O CH3 CH2 C
O CH3 CH2 C
O
丙酸酐
O C
O
C O
苯甲酸酐
两分子酸不同:
O CH3 C
O
CH3 CH2 C O
乙(酸)丙(酸)酐
第二十八页,共53页。
3、苯甲酸 安息香酸,苯甲酸钠作为防腐剂. 4、乙二酸 草酸,酸性最强的二元酸.具有很强的配位能力.在定量分析中
第十章 羧酸及取代

δ-戊内酯
ω-羟基酸
(C>9)在极稀溶液内,可形成大环内酯。
2 聚合(分 子 间 的 酯 化 反 应) nHO(CH2)8COOH
O HO(CH2)8C
Sb2O3
O [ O(CH2)8C ]n-1 OH
聚 酯
+
H2O
-H+
O CH 3C-OC2H5
1OROH,2OROH酯化时按加成--消除机制进行, 且反应速率为:
CH3OH>RCH2OH>R2CHOH HCOOH>CH3COOH>RCH2COOH>R2CHCOOH>R3CCOOH
2 碳正离子机制
(CH3)3C-OH
+
OH
+
H+
(CH3)3COH2
O
-H2O
CH3COOH 醋酸
b) IUPAC命名法
选取含羧基的最长碳链——主链 从靠近羧基的一端开始编号 取代基、重键的位置用阿拉伯数字标出
CH3 C CH COOH CH3 3-甲基-2-丁烯酸 NO2 COOH
CH3CH2CHCH2COOH CH3 β-甲基戊酸(3-甲基戊酸) 3-硝基苯甲酸(或间-)
R
C H
O C
酸性
O
H
羰基的亲核加成,然 后再消除(表现为羟 基的取代)。
-活泼H的反应
羰基的亲核加 成,还原。
(一) 成盐反应
强无机酸 > 羧酸 > 碳酸 > 酚 pKa
RCOOH + NaHCO3 羧酸可以和碳酸氢钠反应 ArONa + CO2 + H2O ArOH + NaHCO3 酚不能和碳酸氢钠反应
羧酸及取代羧酸—取代羧酸(药学有机化学课件)

➢ α-羟基酸:在两分子间脱水生成交酯。
H3C O H HO O
CH
C
C
CH
O OH H O CH3
H3C O
OO + H2O
O CH3
丙交酯
二、羟基酸的性质
脱水反应 ➢ β-羟基酸:分子内脱水生成不饱和酸。
CH3 CH CH COOH △ CH3 CH CH COOH + H2O OH H
β-羟基丁酸
二、羟基酸的性质
羟基酸具有醇、酚和羧酸的通性,既有-OH的性质,又 有-COOH的性质,酚酸可以使FeCl3显色。
① 酸性 ③ 羧基上羟基的酯化反应 ④ 脱羧反应 ② 醇羟基氧化反应、 脱水反应
二、羟基酸的性质
酸性:羟基酸具有酸性。羟基酸的酸性比相应的羧酸强。
OH
OH
CH3CHCOOH > CH2CH2COOH > CH3CH2COOH
酮酸的脱羧反应
α-酮酸和β-酮酸比对应的羧酸更易发生脱羧反应。
O CH3 C
COOH 稀 H2SO4 CH3
CHO + CO2
α-酮酸
醛
H3C C O
RC
O
CH2 COOH CH2 COOH
β-酮酸
H3C C O
RC
O
+ CH3
酮
有机化学/ 取代羧酸
羟基酸的命名和化学性质
羟基酸可以看成是羧酸分子中烃基上的氢原子被羟基取 代后生成的化合物,羟基(-OH )和羧基(-COOH)是 羟基酸的官能团。
醇酸:羟基酸分子中羟基连在脂肪烃基上
酚酸:羟基酸分子中羟基直接连在芳环上
CH3 CH COOH OH
醇酸
COOH
H3C O H HO O
CH
C
C
CH
O OH H O CH3
H3C O
OO + H2O
O CH3
丙交酯
二、羟基酸的性质
脱水反应 ➢ β-羟基酸:分子内脱水生成不饱和酸。
CH3 CH CH COOH △ CH3 CH CH COOH + H2O OH H
β-羟基丁酸
二、羟基酸的性质
羟基酸具有醇、酚和羧酸的通性,既有-OH的性质,又 有-COOH的性质,酚酸可以使FeCl3显色。
① 酸性 ③ 羧基上羟基的酯化反应 ④ 脱羧反应 ② 醇羟基氧化反应、 脱水反应
二、羟基酸的性质
酸性:羟基酸具有酸性。羟基酸的酸性比相应的羧酸强。
OH
OH
CH3CHCOOH > CH2CH2COOH > CH3CH2COOH
酮酸的脱羧反应
α-酮酸和β-酮酸比对应的羧酸更易发生脱羧反应。
O CH3 C
COOH 稀 H2SO4 CH3
CHO + CO2
α-酮酸
醛
H3C C O
RC
O
CH2 COOH CH2 COOH
β-酮酸
H3C C O
RC
O
+ CH3
酮
有机化学/ 取代羧酸
羟基酸的命名和化学性质
羟基酸可以看成是羧酸分子中烃基上的氢原子被羟基取 代后生成的化合物,羟基(-OH )和羧基(-COOH)是 羟基酸的官能团。
醇酸:羟基酸分子中羟基连在脂肪烃基上
酚酸:羟基酸分子中羟基直接连在芳环上
CH3 CH COOH OH
醇酸
COOH
有机化学-第六版-第10章-羧酸和取代羧酸

按酸性的强弱排出下列化合物的酸性顺序;
(1)草酸
1
(6)甲酸
4
(2)己二酸
3
(4)丁二酸
2
+2H
2、 脱羧反应
①、-酮酸
O
R C COOH
稀H2SO4
OH H3C CHCOOH
RCHO + CO2
②、 -酮酸 -酮 酸比 -酮酸更易脱羧
O RC
CH2 COOH
室温以上
O RC
CH3 + CO2
三、酮式-烯醇式互变异构现象
1、互变异构现象:同分异构体之间相 互转变,并以一定比例呈动态平衡存在 的现象。
1、醇酸:
OH H3C CH COOH
H3C CH CH2COOH OH
HOOC CH CH2COOH OH
2-羟基丙酸 (乳酸)
-羟基丁酸
羟基丁二酸 (苹果酸)
HO CH COOH HO CH COOH
2,3-二羟基丁二酸 (酒石酸)
H2C COOH HO C COOH
H2C COOH
L-(+)-酒石酸
(二)羧基中羟基的取代反应 1. 酯的生成: (酯化反应)
O
H+
O
R C OH + H-O-R’
R C O R' + H2O
△
2. 酰卤的生成:
O H3C C OH + PCl5
O CH3C Cl
+ POCl3 + HCl
3. 酸酐的生成
O-
+
RC
R
OH O- H
P2O5
△
R
RC
O
酐键
羧酸和取代羧酸

3-乙基-3-丁烯酸
COOH CH3
邻甲基苯甲酸
14
CO2H
CO2H
O
乙二酸(草酸)
OHC CH2 C CH2 COOH 3-氧代戊醛酸
OH HOOC CH2 C CH2 COOH
COOH
3-羧基-3-羟基戊二酸(柠檬酸)
15
第二节 羧酸的物理性质及光谱性质
一、物理性质
饱和一元羧酸中: C1~C3的低分子量羧酸是具有强烈酸 味和刺激性的液体; C4~C9的羧酸是具有 腐败气味的油状液体。
R CH A
O C OH
-A=-X,-OH,-NH 2
3
羧基中的-OH被其它原子或基团取 代后生成的化合物称羧酸衍生物。
O R CL
O L = -X ,-OR , R C O , -NH2 -NHR, -NR2
4
第一节 羧酸的分类与命名
5
一、羧酸的结构 羧基是由羰基和羟基组合而成。
R——
p-p共轭体系
19
Ms:
O CH3CH2CH2CH2C OH
+.
O
+CH2CH2CH2C OH m/z 87
+
HO C O m/z 45
γ-H麦氏重排(麦克拉费蒂Mclafferty):
H3C
H
CH2
+.
O
CH2
C
CH2
γH
OH
CH3
H O+.
CH +
C
CH2 CH2 OH
m/z60(基峰) 20
第三节 羧酸的化学性质
Gd:electron-donating group
Ga:electron-attracting group
COOH CH3
邻甲基苯甲酸
14
CO2H
CO2H
O
乙二酸(草酸)
OHC CH2 C CH2 COOH 3-氧代戊醛酸
OH HOOC CH2 C CH2 COOH
COOH
3-羧基-3-羟基戊二酸(柠檬酸)
15
第二节 羧酸的物理性质及光谱性质
一、物理性质
饱和一元羧酸中: C1~C3的低分子量羧酸是具有强烈酸 味和刺激性的液体; C4~C9的羧酸是具有 腐败气味的油状液体。
R CH A
O C OH
-A=-X,-OH,-NH 2
3
羧基中的-OH被其它原子或基团取 代后生成的化合物称羧酸衍生物。
O R CL
O L = -X ,-OR , R C O , -NH2 -NHR, -NR2
4
第一节 羧酸的分类与命名
5
一、羧酸的结构 羧基是由羰基和羟基组合而成。
R——
p-p共轭体系
19
Ms:
O CH3CH2CH2CH2C OH
+.
O
+CH2CH2CH2C OH m/z 87
+
HO C O m/z 45
γ-H麦氏重排(麦克拉费蒂Mclafferty):
H3C
H
CH2
+.
O
CH2
C
CH2
γH
OH
CH3
H O+.
CH +
C
CH2 CH2 OH
m/z60(基峰) 20
第三节 羧酸的化学性质
Gd:electron-donating group
Ga:electron-attracting group
第10章 羧酸及衍生物
投料 1 1 : : 1 10
②不断移走产物
H+
CH3COOC2H5 + H2O
产率 67% 97%
20
羧酸的化学性质 (3)还原反应
O C
还原
O H
R
C H
R-COOH
例:
①LiAlH4
② H3+O
RCH2OH
LiAlH4不还原C=C、 C≡C CH2=CH-CH2-CH2OH
O2N
79%
① LiAlH4 CH2=CH-CH2-COOH ② H +O 3
2
环丙基甲酸
3-环己基丙酸
Cl
2
反-1,2-环己基二甲酸
1
COOH
CH2CO O H
COOH
CO O H
COOH
苯甲酸 对氯苯甲酸 (安息香酸)
α- 萘乙 酸
对苯二甲酸
6
羧酸的命名 2.俗名(根据酸的来源P247) 羧酸 系统命名 俗名
HCOOH
CH3COOH HOOCCOOH
甲酸
乙酸 乙二酸
*蚁酸
>CH3COOH
③给电子基团越多 , 酸性↓
H COOH >CH3COOH > (CH3)C COOH (CH3) 2CH COOH > 3
13
羧酸的酸性与其结构的关系 ④芳香羧酸:环上有取代基时, 吸电子基使其酸性↑;给电子基使其酸性↓。
COOH COOH COOH COOH COOH
<
NH2
<
26
羧酸的化学性质
R
C H
O C
O
H
2.烃基的反应 (1)脂肪族羧酸的α-位卤代反应
CH3COOH
②不断移走产物
H+
CH3COOC2H5 + H2O
产率 67% 97%
20
羧酸的化学性质 (3)还原反应
O C
还原
O H
R
C H
R-COOH
例:
①LiAlH4
② H3+O
RCH2OH
LiAlH4不还原C=C、 C≡C CH2=CH-CH2-CH2OH
O2N
79%
① LiAlH4 CH2=CH-CH2-COOH ② H +O 3
2
环丙基甲酸
3-环己基丙酸
Cl
2
反-1,2-环己基二甲酸
1
COOH
CH2CO O H
COOH
CO O H
COOH
苯甲酸 对氯苯甲酸 (安息香酸)
α- 萘乙 酸
对苯二甲酸
6
羧酸的命名 2.俗名(根据酸的来源P247) 羧酸 系统命名 俗名
HCOOH
CH3COOH HOOCCOOH
甲酸
乙酸 乙二酸
*蚁酸
>CH3COOH
③给电子基团越多 , 酸性↓
H COOH >CH3COOH > (CH3)C COOH (CH3) 2CH COOH > 3
13
羧酸的酸性与其结构的关系 ④芳香羧酸:环上有取代基时, 吸电子基使其酸性↑;给电子基使其酸性↓。
COOH COOH COOH COOH COOH
<
NH2
<
26
羧酸的化学性质
R
C H
O C
O
H
2.烃基的反应 (1)脂肪族羧酸的α-位卤代反应
CH3COOH
羧酸及取代羧酸ppt课件

主要性质
羧
酸
酸性
羧酸衍生物的生 成
α-H的卤代反应 脱羧反应
水溶液中显酸性,其酸性强于碳酸,能与氢氧化 钠、碳酸氢钠等成盐,常用于与酚相区别
羧基中的羟基被卤素、酰氧基、烷氧基、氨基取 代,生成酰卤、酸酐、酯、酰胺等羧酸衍生物 α-H原子可逐个被卤素取代生成一系列卤代酸 一元羧酸在碱石灰的催化下脱羧,生成少一个碳 的烃;二元羧酸中乙二酸和丙二酸脱羧生成少一 个碳原子的一元羧酸
(乳酸) α–羟基丙酸
CH3 CH CH2 COOH
OH
3–羟基丁酸
β–羟基丁酸
HO CH COOH
CH2 COOH
羟基丁二酸 (苹果酸)
HO CH COOH
HO CH COOH
2,3–二羟基丁二酸 (酒石酸)
CH2 COOH HO C COOH
3–羟基C–H32–羧C基OO戊H二酸 (柠檬酸)
2、酚酸:羟基和羧基连在芳环上
O
O
RC
R
OH
C .. O
H
OH
羧基上的p-π共轭示意图
2、羧酸的分类 1、根据分子中烃基的结构,羧酸分为: 脂肪羧酸(饱和脂肪羧酸和不饱和脂肪羧酸) 脂环羧酸(饱和脂环羧酸和不饱和脂环羧酸) 芳香羧酸
2、根据分子中羧基的数目,羧酸分为:
一元羧酸、二元羧酸、多元羧酸
脂肪羧酸 C3HC2HC2HCOOCHH3 CH CH COOH
羧酸能与碱作用成盐,也可分解碳酸盐。此性质可用于醇、
酚、酸的鉴别和分离:不溶于水的羧酸既溶于NaOH也溶于
NaHCO3,不溶于水的酚能溶于NaOH不溶于NaHCO3,不
溶于水的醇既不溶于NaOH也不溶于NaHCO3。
10羧酸和取代羧酸

COOH
COOH CH3
COOH NO2
pKa
4.17
3.89
2.21
影响因素多,其作用一致或相反;主要因素决定 最终结果。
25
3、二元酸
酸性与两个羧基的相对距离有关。
HO2C-CO2H HO2CCH2CO2H HO2CCH2CH2CO2H
Ka1
Ka2
5.9×10-2
4.0×10-5
1.6×10-3
pKa 3.77
4.76
4.86
4.87
(3) CH3-CO2H FCH2-CO2H F2CH-CO2H F3C-CO2H
pKa
4. 76
2.66
1.24
0.23
27
4、成盐 羧酸能与碱中和生成羧酸盐和水。利用羧酸与 NaHCO3反应放出CO2,可以鉴别、分离苯酚和羧酸。
NaOH CO2H NaHCO3
d+
dNO 2
d+
NO 2
20
d+
d-
COOH
d+ dCH 3
dd+
CH3
CH3-是供电子基,主要发生供电子共轭效应, 其酸性小于苯甲酸。NO2-是吸电子基,主要发生 吸电子共轭效应,其酸性大于苯甲酸。
21
(2)
HCOOH
C6H5COOH
CH3COOH
pKa
3.77
4.17
4.76
苯环大π键与羧基构成共轭体系,主要发生供 电子共轭效应(+C),电子云向羧基偏移,减弱 了羧羟基的极性。
羧酸根负离子的 p-π 共轭
5
(二) 羧酸的分类
饱和酸
脂肪酸 脂环酸
《医用化学》第十章

草酸是二元酸,且两个羧基直接相连,结果导致其酸性比 一元羧酸和其他二元羧酸的酸性都强。
草酸具有还原性,在分析化学中可用作标定高锰酸钾的基 准物质。
三、常见的羧酸
(四)苯甲酸
苯甲酸最初是从安息香树的树胶中提取的,所以俗称安息 香酸。
苯甲酸是一种白色、有光泽的、鳞片状或针状的晶体,熔 点122℃,能升华,易溶于热水、乙醚和乙醇。
成
内脱水形成。
二、羧酸的性质 (二)羧酸的化学性质
酰
卤 羧酸(除甲酸外)能与三卤化磷、五卤化磷或亚硫酰氯(SOCl2)
的
反应,羧基中的羟基被卤素取代生成相应的酰卤。
生 成
酰卤的反应活性很高,被广泛地用于药物和有机合成中。
二、羧酸的性质 (二)羧酸的化学性质
3.脱羧反应
羧酸失去羧基放出 CO2 的反应称为脱羧反应。 不同羧酸的脱羧难易程度不同,一元羧酸难脱
生 羧酸与氨或胺(R—NH2)可以形成铵盐。这是一个可逆反应,低
成
温利于铵盐生成,加热铵盐分解为羧酸和氨或胺。
二、羧酸的性质 (二)羧酸的化学性质
酸 酐
羧酸(除甲酸外)在乙酸酐、P2O5 等脱水剂存在的条件下加热,可
的
发生两个分子间脱水生成酸酐。
生 五元环或六元环的环状酸酐(简称环酐),可由二元羧酸受热分子
苯甲酸及其钠盐能抑制多种微生物,它与水杨酸复配可用 于治疗成人皮肤真菌感染。
苯甲酸还常被用作食品和药品的防腐剂,浓度一般为0.2%。
第二节
取代羧酸
• 羟基酸 • 酮酸 • 常见的羟基酸和酮酸
一、羟基酸
(一)羟基酸的结构、分类和命名
羟基酸是指分子中同时含有羟基和羧基两种官能团的 化合物。
草酸具有还原性,在分析化学中可用作标定高锰酸钾的基 准物质。
三、常见的羧酸
(四)苯甲酸
苯甲酸最初是从安息香树的树胶中提取的,所以俗称安息 香酸。
苯甲酸是一种白色、有光泽的、鳞片状或针状的晶体,熔 点122℃,能升华,易溶于热水、乙醚和乙醇。
成
内脱水形成。
二、羧酸的性质 (二)羧酸的化学性质
酰
卤 羧酸(除甲酸外)能与三卤化磷、五卤化磷或亚硫酰氯(SOCl2)
的
反应,羧基中的羟基被卤素取代生成相应的酰卤。
生 成
酰卤的反应活性很高,被广泛地用于药物和有机合成中。
二、羧酸的性质 (二)羧酸的化学性质
3.脱羧反应
羧酸失去羧基放出 CO2 的反应称为脱羧反应。 不同羧酸的脱羧难易程度不同,一元羧酸难脱
生 羧酸与氨或胺(R—NH2)可以形成铵盐。这是一个可逆反应,低
成
温利于铵盐生成,加热铵盐分解为羧酸和氨或胺。
二、羧酸的性质 (二)羧酸的化学性质
酸 酐
羧酸(除甲酸外)在乙酸酐、P2O5 等脱水剂存在的条件下加热,可
的
发生两个分子间脱水生成酸酐。
生 五元环或六元环的环状酸酐(简称环酐),可由二元羧酸受热分子
苯甲酸及其钠盐能抑制多种微生物,它与水杨酸复配可用 于治疗成人皮肤真菌感染。
苯甲酸还常被用作食品和药品的防腐剂,浓度一般为0.2%。
第二节
取代羧酸
• 羟基酸 • 酮酸 • 常见的羟基酸和酮酸
一、羟基酸
(一)羟基酸的结构、分类和命名
羟基酸是指分子中同时含有羟基和羧基两种官能团的 化合物。
第十章__羧酸与取代酸-PPT课件

§10-1
分类和命名
一、分类 1.羧酸(Carboxylic acid, p242)
O R C OH
分类同醛 2.羧酸衍生物(Carboxylic acid derivatives , p258)
酰卤(Acyl halide)
R
O C X
O
酸酐(Anhydride)
O O R
R
酯(Ester)
பைடு நூலகம்
R
O C H H 3C 2C N H 2
丙酰胺
O C H H 6H 5C 2C N 2
O CH 3C NH
苯乙酰胺
乙酰苯胺
如果—NH2的氢原子被脂肪烃基取代, 命名时要在取代基名称前面加字母“N”以表 示烃基是连接在氨基的氮原子上。
O C H C H CN 3 2 O C H 3 C H 3 C H C H CN 6 5 2 C H 3 C H C H 2 3
3.取代酸(p268)
羧酸是母体化合物,卤素、羟基、氨基或氧 等作为取代基。 羰基酸也可用酮酸或醛酸作为母体命名。 一些天然取代酸常用俗名。 (1)羟基酸(Hydroxy acid)
C H C H C O O H 3 O H 2-羟基丙酸 乳酸
H O O C C H C H C O O H 2 O H 2-羟基丁二酸 苹果酸
N,N-二甲基丙酰胺
N-甲基-N-乙基苯乙酰胺
如果氮原子上连接两个酰基,则称为酰亚胺
O C NH C O
邻苯二甲酰亚胺
酸酐:根据相应的酸来命名。
O O O O C H C H C H C OC 2 3 3 C H C H C OC 6 5 6 5
乙(酸)丙(酸)酐
苯甲酸酐
羧酸和取代羧ppt
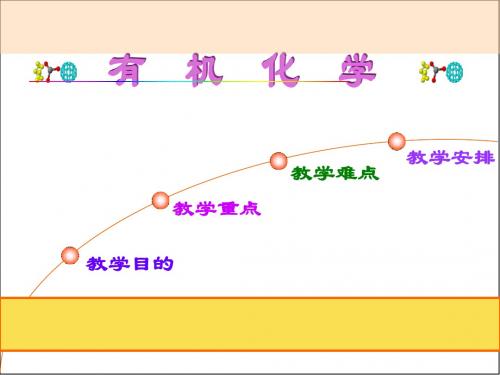
羧酸和醇作用生成酯和水的反应称酯化反应。
RCOOH
+
R'OH
酯化 水解
RCOOR'
+ H2O
1、反应特点 ① 反应可逆(酯化和水解都不能进行完全)。 ② 反应速度慢,催化剂同时加速酯化和水解反应。 增大产率:1)增加反应物; 2)减少生成物水(分水装置、带水剂)。
2、反应机理 (1)伯、仲醇:亲核加成-消除机理
(二)取代基对酸性的影响
若取代基有利于负电荷分散,羧酸根负离子稳定, ——酸性增强。
若取代基不利于负电荷分散,羧酸根负离子不稳,
——酸性减弱。
1、诱导效应
O R CH C OH Y
Y= - X、- NO2、- CN、- OH等电负性大的基团。
吸电性诱导效应(-I)相对强弱: -NO2>-CN>COOH>-F>-Cl>-Br>-I
用乙硼烷还原的反应机理
O BH2 H
RCOOH + BH3
O
R-C OH
OBH2 R-CH-OH
-BH2(OH)
RCHO
BH3
BH2
R-CH H
RCH2OBH2 H2O
RCH2OH
乙硼烷与羰基化合物的反应活性顺序:
-COOH > C=O > -CN > -COOR > -COCl
四、 α-氢的反应
② 取代基离羧基越近,对酸性影响越大。
H3C CH2 CH COOH > H3C CH CH2 COOH > H2C CH2 CH2 COOH Cl Cl Cl
③ 不同杂化态的S成份增加时,吸电子能力增强, 对酸性影响越大。
> H2C CH CH2 COOH>H3C CH2 CH2 COOH HC C CH2 COOH
RCOOH
+
R'OH
酯化 水解
RCOOR'
+ H2O
1、反应特点 ① 反应可逆(酯化和水解都不能进行完全)。 ② 反应速度慢,催化剂同时加速酯化和水解反应。 增大产率:1)增加反应物; 2)减少生成物水(分水装置、带水剂)。
2、反应机理 (1)伯、仲醇:亲核加成-消除机理
(二)取代基对酸性的影响
若取代基有利于负电荷分散,羧酸根负离子稳定, ——酸性增强。
若取代基不利于负电荷分散,羧酸根负离子不稳,
——酸性减弱。
1、诱导效应
O R CH C OH Y
Y= - X、- NO2、- CN、- OH等电负性大的基团。
吸电性诱导效应(-I)相对强弱: -NO2>-CN>COOH>-F>-Cl>-Br>-I
用乙硼烷还原的反应机理
O BH2 H
RCOOH + BH3
O
R-C OH
OBH2 R-CH-OH
-BH2(OH)
RCHO
BH3
BH2
R-CH H
RCH2OBH2 H2O
RCH2OH
乙硼烷与羰基化合物的反应活性顺序:
-COOH > C=O > -CN > -COOR > -COCl
四、 α-氢的反应
② 取代基离羧基越近,对酸性影响越大。
H3C CH2 CH COOH > H3C CH CH2 COOH > H2C CH2 CH2 COOH Cl Cl Cl
③ 不同杂化态的S成份增加时,吸电子能力增强, 对酸性影响越大。
> H2C CH CH2 COOH>H3C CH2 CH2 COOH HC C CH2 COOH
大学化学-第十章-羧酸和取代羧酸
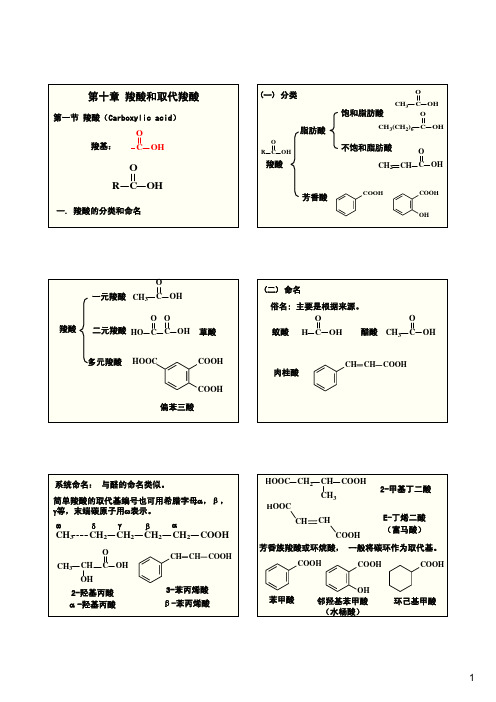
COOH
COOH
COOH
苯甲酸
OH 邻羟基苯甲酸
(水杨酸)
环己基甲酸
1
CH2COOH
CH2COOH
α-萘乙酸
O RC
酰基
O CH3 C
乙酰基
β-萘乙酸
O C6H5 C
苯甲酰基
二. 羧酸的物理性质
O HO
RC
CR
OH O
三. 羧酸的结构和化学性质
(一) 羧酸的结构
O
R
RC
OH
O C
OH
O + H+
R
G CH2 H
OO
1-2
4-5
6.4(pKa1)
9-10
15.7
16-19
RCOOH + NaOH RCOOH + NaHCO3
RCOONa + H2O RCOONa + CO2 + H2O
RCOOH + R'3N
RCO O NHR'3
HCl RCOOM
RCOOH + MCl
可用于分离提纯。
2
O R C OH
R供电,酸性减弱。 R吸电,酸性增强。
CH3 CH2 CH2 CH2 CH2 COOH
O
CH3 CH C OH OH
2-羟基丙酸 α -羟基丙酸
CH CH COOH
3-苯丙烯酸 β-苯丙烯酸
HOOC CH2 CH COOH CH3
2-甲基丁二酸
HOOC
CH CH COOH
E-丁烯二酸 (富马酸)
芳香族羧酸或环烷酸, 一般将碳环作为取代基。
(2) 生成酸酐 羧酸失水。加热、脱水剂:醋酸酐或P2O5等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. 酸性与成盐
CH3COOH + H2O OH RCOOH>H2CO3> pKa: 4~5 6.5 10.0
>H2O>ROH>RC≡CH> H2C=CH2
CH3COO- + H3+O
15.7
17
25
34
RCOOH + NaOH
RCOOH + NaHCO3 RCOONa + HCl –OH
RCOONa + H2O
NH2 COOH
4-氨基戊酸
O COOH
不可以说是 4-乙酰基丁酸
4-氧代戊酸 4-羰基戊酸 4-戊酮酸
命名
(E)-4-羟基-2-戊烯酸
完成反应式
4-氧代环己烷甲酸
一 卤代酸
复习:卤烃的两大特征反应:取代、消除
在卤代酸中,卤素原子依旧表现出这两大反应性 质,选择性由位置决定。
反应
α-卤代酸
Br + α COOH H 2 O /O H COOH NH2
NH3
吸电子羧基增加了碳卤键的极性
OH
用于制备
COOH
β-卤代酸
β R C H C H 2C O O H
OH
-
O R C H C H C OH
Br
γ, δ -卤代酸
Cl
Cl
O O4
O C O
-
δ
COOH
OH OH
--
6
5
3
2 1
生成产物 内酯
2
O
1
i-P r
6
O
i-P r
制备
α-卤代酸 复习:泽林斯基反应
少量红磷催化下发生此反应。反应历程(不要求) 生成酰卤,酰卤卤素的吸电子能力增加了α-氢的 活性。请和生成酰卤的条件区分开! 另,少量碘、硫等也能催化反应,略。
(五)脱羧
脱羧比较难,一般在α 、β位上有吸电子基 的羧酸才能脱羧。 α -酮酸的脱羧
α-C上连了吸电子基(以羰基和烯键为例) β -酮酸
3,4号C上连了烯键:脱羧+重排
请问,前述的β-酮酸是否也有重排? 为何其产物没有改变特征?
(六)二元酸受热的反应
1. C2-C3 直接脱羧
COOH COOH HCOOH + CO2
COOH H 3C C H COOH C H 3C H 2C O O H + CO2
2. C4-C5 脱水成环酐—五、六元环的稳定性
CH3–CH2COOH
>
>
4.88
—OH在非共轭体系中只有诱导效应,是吸电基团。
芳香族羧酸的酸性
取代苯甲酸的酸性不仅与取代基的种类有关,而且与取代 基在苯环上的位置有关。
COOH
COOH
COOH
COOH
COOH
NO2
Br
CH3
OCH3
(2)场效应 ——通过空间传递的静电作用
COOH O C–OCOOH NO2 2 COOH NO2 COOH
4.19
2.21
3.49
NO2 3.42
明显强于间位、对位
(3)氢键
COOH O C–OCOOH O–H OH COOH OH 4.19 2.98 4.08 COOH
OH 4.57
⑷空间效应 ——空间阻碍效应 COOH COOH CH3 COOH CH3 4.19 3.91 COOH
4.27
CH3 4.38
RCOONa + CO2 + H2O RCOOH + NaCl
+ NaHCO3
×
不反应
应用:① 能将RCOOH和 ② 能将RCOOH提纯
–OH
鉴别、分离开来
2. 影响羧酸酸性的因素
⑴电子效应 ——诱导效应、共轭效应
Cl–CH2COOH pKa 2.86 ClCH2COOH 2.86 H–CH2COOH 4.76 Cl2CHCOOH 1.26
第10章
羧酸和取代酸
Carboxylic acid
学习重点:
● 羧酸的化学性质 (羧酸衍生物的生成、羧酸中H的取代反应) 。
学习难点:
● 影响羧酸酸性的因素。
10.1 羧酸的分类和命名
10.1.1 羧酸的分类
饱和羧酸 CH3COOH
1. 根据与羧基相连 的烃基种类分
COOH
不饱和羧酸 CH3CH=CHCOOH
子质量相近的醇的沸点还要高。 O R—C H—O C—R
O—H
O
10.3 羧酸的结构和化学性质
羧酸的结构
⑤ O R—CH—C—O—H
O 官能团:− C−OH 羧基
sp2
还原,亲核加成反应, (难)
H
① 酸 性,比酚、醇酸性强。
② 羟基被取代的反应,(难)
③ 脱羧反应 ④ -H的反应,(难)
羧酸的化学性质
2-甲基-2-丙烯酸
H
H3 C
C=C
COOH H
(E)-2-丁烯酸(巴豆酸)
CH2COOH COOH
苯甲酸(安息香酸)
1-萘乙酸(α-萘乙酸)
H 3C
COOH
4-甲基-2-异丙基苯甲酸
CH(CH3)2
HOOC−CH2CH−COOH
2-甲基丁二酸
CH3
10.2
羧酸的物理性质(自学)
沸点高: 由于羧酸分子间可形成双氢键,其沸点比相对分
该反应参照格氏试剂的反应,锌试剂选择性反 应羰基,对酯基影响较小。
R C (R ')H
R C (R ')H O ZnBr
H 3O +
O + B rZ n C H 2 C O O R
R C (R ')H
OH
C H 2C O O R
C H 2C O O R
比较容易出错的是把起始的卤代物在哪一头记混, 需要特别注意下,卤素在酯上。
自此开始其他反应可以参照卤代酸
-羟基酸: 脱水生成 -不饱和羧酸
R C C H 2C O O H OH RCH CHCOOH
-、-羟基酸脱水生成内酯
HO COOH O O
制备
复习:水解法
Br
H 2 O /O H
-
② H 3O
+
CH2
C H C H 2C H 2O H
回忆:醛酮的LiAlH4还原也是两步反应,第二步也 要水解。
(四)α-氢的反应
Hell-Volhard-Zelinsky Reaction
C H 3C H 2C H 2 C O O H + B r2 红P 或 P B r3
C H 3C H 2C H C O O H + H B r Br
O COOH 乙酸酐 C O COOH C O
3. C6-C7 :脱羧又脱水,生成环状酮
CH3 C H C H 2C O O H C H 2C H 2C O O H + H 2O
B a (O H ) 2
H 3C O
+
CO2
B a (O H ) 2
O
H O O C (C H 2 ) 5 C O O H
少量红磷
R C H 2C O O H
X2
ห้องสมุดไป่ตู้
RCCOOH X
β-卤代酸
HX
RHC
CHCOOH
RHC X
CHCHOOH
二 羟基酸
反应
-羟基酸: 两分子交叉脱水, 生成交酯
O H 3C CH O
2
C H
OH H HO C O
O CH 2 C H 3
O H 3C CH O
2
-2H2O
C C O
O CH
2
交酯
LiAlH4能顺利地将羧酸还原为伯醇,并且分子中的 双键不受影响。但NaBH4还原性能比LiAlH4弱,不 能用来还原羧酸。
H 3C O OCH3 (1 ) L iA lH 4 COOH (2 ) H 3 O + C H 2O H H 3C O OCH3
CH2
C H C H 2C O O H
① L iA lH 4 / E t 2 O
H 2O
RCOOH
H 2O
H 2S O 4
C H 2C O O H
105℃
RCOOH
RCN
伯卤 R C l 代烷
生成物比卤烃多一个碳(回忆卤仿反应)
限制:
环上的 C 卤素无 X OOH 法取代
?
NaCN取代 RR CX O的条件易 O H 消除 RR
RR
(三)格氏试剂法
O R - M g +X + (A r) CO2 H 3O + R C (A r) O - M g + X RCOOH (A r)
合成
COOH
M gC l
Cl
1
氨基酸
COOH COOH C H 3C C H 2C O O H OH NH2 CO H O O C 羰基酸 O H
OH I O
卤代酸
酚酸 羟基酸
命名
Cl COOH
ω -氯戊酸 5-氯戊酸 (ω -末位)
OH
COOH
2-羟基环己烷羧酸
OH COOH
2-羟基苯甲酸 水杨酸
4 生成酰胺
O RCOOH
NH3
RCOONH4
R
C
O
N H 2 + H 2O
RCOOH
H N R '2
R C O O N H 2 R '2
R
C
N R '2 + H 2 O
CH3COOH + H2O OH RCOOH>H2CO3> pKa: 4~5 6.5 10.0
>H2O>ROH>RC≡CH> H2C=CH2
CH3COO- + H3+O
15.7
17
25
34
RCOOH + NaOH
RCOOH + NaHCO3 RCOONa + HCl –OH
RCOONa + H2O
NH2 COOH
4-氨基戊酸
O COOH
不可以说是 4-乙酰基丁酸
4-氧代戊酸 4-羰基戊酸 4-戊酮酸
命名
(E)-4-羟基-2-戊烯酸
完成反应式
4-氧代环己烷甲酸
一 卤代酸
复习:卤烃的两大特征反应:取代、消除
在卤代酸中,卤素原子依旧表现出这两大反应性 质,选择性由位置决定。
反应
α-卤代酸
Br + α COOH H 2 O /O H COOH NH2
NH3
吸电子羧基增加了碳卤键的极性
OH
用于制备
COOH
β-卤代酸
β R C H C H 2C O O H
OH
-
O R C H C H C OH
Br
γ, δ -卤代酸
Cl
Cl
O O4
O C O
-
δ
COOH
OH OH
--
6
5
3
2 1
生成产物 内酯
2
O
1
i-P r
6
O
i-P r
制备
α-卤代酸 复习:泽林斯基反应
少量红磷催化下发生此反应。反应历程(不要求) 生成酰卤,酰卤卤素的吸电子能力增加了α-氢的 活性。请和生成酰卤的条件区分开! 另,少量碘、硫等也能催化反应,略。
(五)脱羧
脱羧比较难,一般在α 、β位上有吸电子基 的羧酸才能脱羧。 α -酮酸的脱羧
α-C上连了吸电子基(以羰基和烯键为例) β -酮酸
3,4号C上连了烯键:脱羧+重排
请问,前述的β-酮酸是否也有重排? 为何其产物没有改变特征?
(六)二元酸受热的反应
1. C2-C3 直接脱羧
COOH COOH HCOOH + CO2
COOH H 3C C H COOH C H 3C H 2C O O H + CO2
2. C4-C5 脱水成环酐—五、六元环的稳定性
CH3–CH2COOH
>
>
4.88
—OH在非共轭体系中只有诱导效应,是吸电基团。
芳香族羧酸的酸性
取代苯甲酸的酸性不仅与取代基的种类有关,而且与取代 基在苯环上的位置有关。
COOH
COOH
COOH
COOH
COOH
NO2
Br
CH3
OCH3
(2)场效应 ——通过空间传递的静电作用
COOH O C–OCOOH NO2 2 COOH NO2 COOH
4.19
2.21
3.49
NO2 3.42
明显强于间位、对位
(3)氢键
COOH O C–OCOOH O–H OH COOH OH 4.19 2.98 4.08 COOH
OH 4.57
⑷空间效应 ——空间阻碍效应 COOH COOH CH3 COOH CH3 4.19 3.91 COOH
4.27
CH3 4.38
RCOONa + CO2 + H2O RCOOH + NaCl
+ NaHCO3
×
不反应
应用:① 能将RCOOH和 ② 能将RCOOH提纯
–OH
鉴别、分离开来
2. 影响羧酸酸性的因素
⑴电子效应 ——诱导效应、共轭效应
Cl–CH2COOH pKa 2.86 ClCH2COOH 2.86 H–CH2COOH 4.76 Cl2CHCOOH 1.26
第10章
羧酸和取代酸
Carboxylic acid
学习重点:
● 羧酸的化学性质 (羧酸衍生物的生成、羧酸中H的取代反应) 。
学习难点:
● 影响羧酸酸性的因素。
10.1 羧酸的分类和命名
10.1.1 羧酸的分类
饱和羧酸 CH3COOH
1. 根据与羧基相连 的烃基种类分
COOH
不饱和羧酸 CH3CH=CHCOOH
子质量相近的醇的沸点还要高。 O R—C H—O C—R
O—H
O
10.3 羧酸的结构和化学性质
羧酸的结构
⑤ O R—CH—C—O—H
O 官能团:− C−OH 羧基
sp2
还原,亲核加成反应, (难)
H
① 酸 性,比酚、醇酸性强。
② 羟基被取代的反应,(难)
③ 脱羧反应 ④ -H的反应,(难)
羧酸的化学性质
2-甲基-2-丙烯酸
H
H3 C
C=C
COOH H
(E)-2-丁烯酸(巴豆酸)
CH2COOH COOH
苯甲酸(安息香酸)
1-萘乙酸(α-萘乙酸)
H 3C
COOH
4-甲基-2-异丙基苯甲酸
CH(CH3)2
HOOC−CH2CH−COOH
2-甲基丁二酸
CH3
10.2
羧酸的物理性质(自学)
沸点高: 由于羧酸分子间可形成双氢键,其沸点比相对分
该反应参照格氏试剂的反应,锌试剂选择性反 应羰基,对酯基影响较小。
R C (R ')H
R C (R ')H O ZnBr
H 3O +
O + B rZ n C H 2 C O O R
R C (R ')H
OH
C H 2C O O R
C H 2C O O R
比较容易出错的是把起始的卤代物在哪一头记混, 需要特别注意下,卤素在酯上。
自此开始其他反应可以参照卤代酸
-羟基酸: 脱水生成 -不饱和羧酸
R C C H 2C O O H OH RCH CHCOOH
-、-羟基酸脱水生成内酯
HO COOH O O
制备
复习:水解法
Br
H 2 O /O H
-
② H 3O
+
CH2
C H C H 2C H 2O H
回忆:醛酮的LiAlH4还原也是两步反应,第二步也 要水解。
(四)α-氢的反应
Hell-Volhard-Zelinsky Reaction
C H 3C H 2C H 2 C O O H + B r2 红P 或 P B r3
C H 3C H 2C H C O O H + H B r Br
O COOH 乙酸酐 C O COOH C O
3. C6-C7 :脱羧又脱水,生成环状酮
CH3 C H C H 2C O O H C H 2C H 2C O O H + H 2O
B a (O H ) 2
H 3C O
+
CO2
B a (O H ) 2
O
H O O C (C H 2 ) 5 C O O H
少量红磷
R C H 2C O O H
X2
ห้องสมุดไป่ตู้
RCCOOH X
β-卤代酸
HX
RHC
CHCOOH
RHC X
CHCHOOH
二 羟基酸
反应
-羟基酸: 两分子交叉脱水, 生成交酯
O H 3C CH O
2
C H
OH H HO C O
O CH 2 C H 3
O H 3C CH O
2
-2H2O
C C O
O CH
2
交酯
LiAlH4能顺利地将羧酸还原为伯醇,并且分子中的 双键不受影响。但NaBH4还原性能比LiAlH4弱,不 能用来还原羧酸。
H 3C O OCH3 (1 ) L iA lH 4 COOH (2 ) H 3 O + C H 2O H H 3C O OCH3
CH2
C H C H 2C O O H
① L iA lH 4 / E t 2 O
H 2O
RCOOH
H 2O
H 2S O 4
C H 2C O O H
105℃
RCOOH
RCN
伯卤 R C l 代烷
生成物比卤烃多一个碳(回忆卤仿反应)
限制:
环上的 C 卤素无 X OOH 法取代
?
NaCN取代 RR CX O的条件易 O H 消除 RR
RR
(三)格氏试剂法
O R - M g +X + (A r) CO2 H 3O + R C (A r) O - M g + X RCOOH (A r)
合成
COOH
M gC l
Cl
1
氨基酸
COOH COOH C H 3C C H 2C O O H OH NH2 CO H O O C 羰基酸 O H
OH I O
卤代酸
酚酸 羟基酸
命名
Cl COOH
ω -氯戊酸 5-氯戊酸 (ω -末位)
OH
COOH
2-羟基环己烷羧酸
OH COOH
2-羟基苯甲酸 水杨酸
4 生成酰胺
O RCOOH
NH3
RCOONH4
R
C
O
N H 2 + H 2O
RCOOH
H N R '2
R C O O N H 2 R '2
R
C
N R '2 + H 2 O
