优先反应原则
初中化学反应之优先原则

初中化学反应之优先原则一、初中化学优先反应原则之一:当金属与混合盐溶液反应时,较活泼的金属优先置换出最不活泼的金属.如:将一定量的铁粉放入硝酸铜和销酸银的混合溶液中,铁优先置换出银,然后若铁粉有剩余,才能置换出铜(1)先:Fe+2AgNO3====2Ag+Fe(NO3)2(2)后:Fe+Cu(NO3)2====Cu+Fe(NO3)2金属Fe和Zn同时放入一份CuSO4溶液中。
Fe可以从CuSO4溶液中置换出Cu(生成FeSO4溶液),Zn也可以从CuSO4溶液中置换出Cu,但实际反应时,Zn先与CuSO4溶液反应,等Zn被反应完后,Fe才能与CuSO4发生反应。
因为Zn会把FeSO4溶液中的Fe元素再置换出来。
Fe可以和稀硫酸反应生成氢气,Zn也可以,但实际反应时,由于Zn的活动性强,等Zn全部反应完后,Fe才可以和稀硫酸反应。
【小结】:金属单质与盐溶液中的金属元素,在金属活动性顺序表中,距离越远越先反应。
原因是:最活泼的金属单质优先失去电子而最不活泼的金属的离子优先获得电子二、初中化学优先反应原则之二:酸与碱的反应优先于该酸与盐的反应.如将稀盐酸逐滴滴加到NaOH和Na2CO3的混合溶液中,先无明显现象,之后开始产生气泡(1)、(先)HCl+NaOH====NaCl+H2O此反应无明显现象,之后开始产生气泡,因为NaOH已被完全消耗,再发生反应(2)、(后)2HCl+Na2CO3====2NaCl+H2O+CO2↑此反应有气泡产生.原因是:NaOH和二氧化碳反应生成的Na2CO3会与Ca(OH)2反应生成NaOH。
Na2CO3 + Ca(OH)2 ==== CaCO3 ↓+2NaOH所以只有当Ca(OH)2先反应完时2NaOH才会与CO2反应。
1、向Na2CO3和NaOH的混合溶液中滴入稀HCl。
稀HCl能与Na2CO3反应生成CO2气体,也能与NaOH发生中和反应,但实际反应时,NaOH先和HCl中和,等NaOH被反应完后,Na2CO3才能和HCl反应放出CO2气体。
初中化学5个优先反应原则

初中化学5个优先反应原则一、初中化学5个优先反应原则(1)初中化学优先反应的原则一:金属和酸反应时,较活泼的金属优先反应,如将锌、铁合金投入稀盐酸中,锌优先与稀盐酸反应。
(2)初中化学优先反应的原则之二:当金属与混合盐溶液反应时,金属中最活泼的金属优先置换出最不活泼的金属。
例:将一定量的铁粉放入硝酸铜和销酸银的混合溶液中,铁优先置换出银,然后若铁粉有剩余,才能置换出铜。
因为先发生反应F e+2AgNO32Ag+Fe(NO3)2,后发生反应Fe+Cu (NO3)2Cu+Fe(NO3)2。
(3)初中化学优先反应的原则之三:当酸、碱、盐混合相互反应时,酸与碱的反应优先于酸与盐、碱与盐的反应.例:①将稀盐酸逐滴滴加到NaOH和Na2CO3的混合溶液中,先无明显现象,之后开始产生气泡。
因为先发生的反应是HCl+NaOH NaCl+H2O,此反应无明显现象,当NaOH已被完全消耗,又发生反应2HCl+Na2CO32NaCl+H2O+CO2↑,此反应有气泡产生。
①将NaOH溶液逐滴滴加到稀硫酸和硫酸铜的混合溶液中,先无明显现象,之后开始产生蓝色沉淀。
因为先发生的反应是H2SO4+2NaOH Na2SO4+2H2O,此反应无明显现象,当稀硫酸被完全消耗,又发生反应CuSO4+2NaOH Na2SO4+Cu(OH)2↓。
(4)初中化学优先反应的原则之四:当酸与两种盐混合溶液反应产生气体、沉淀时,产生“气体”优于产生“沉淀”。
例:向稀盐酸与氯化钡的混合溶液中逐滴滴加碳酸钠溶液时,先产生气泡,之后产生白色沉淀.因为先发生的反应是2HCl+Na2CO32NaCl+H2O+CO2↑,此反应产生气泡,当稀盐酸被完全消耗,又发生反应CaCl2+Na2CO32NaCl+CaCO3↓。
(5)初中化学优先反应的原则之五:当金属、金属氧化物与酸反应时,金属氧化物优先于金属与酸反应.例:将稀硫酸逐滴滴加到氧化铜和铁的固体混合物中,氧化铜优先与稀硫酸发生反应,当氧化铜被完全消耗时,铁再与硫酸反应,当硫酸铜被完全消耗时,过量的铁才与稀硫酸反应,即可观察到溶液变蓝,后析出红色固体,最后有气泡产生,发生反应依次为:CuO+H2SO4 CuSO4+H2O,Fe+CuSO4Cu+FeSO4,Fe+H2SO4FeSO4+H2↑。
化学反应中的优先反应原则
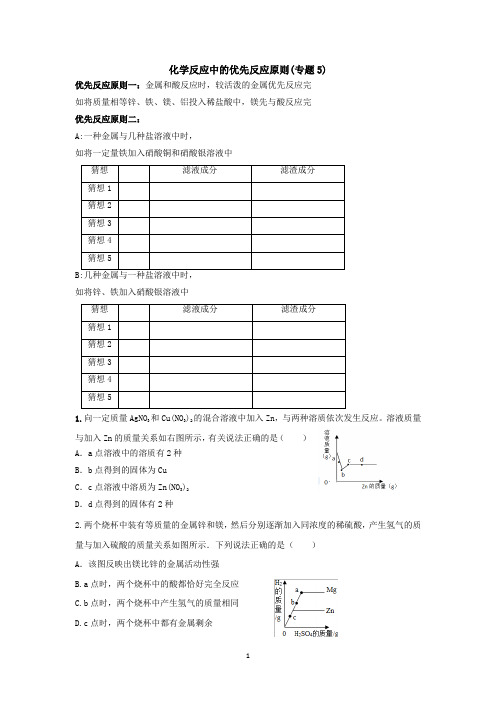
化学反应中的优先反应原则(专题5)优先反应原则一:金属和酸反应时,较活泼的金属优先反应完如将质量相等锌、铁、镁、铝投入稀盐酸中,镁先与酸反应完优先反应原则二:A:一种金属与几种盐溶液中时,如将一定量铁加入硝酸铜和硝酸银溶液中猜想滤液成分滤渣成分猜想1猜想2猜想3猜想4猜想5B:几种金属与一种盐溶液中时,如将锌、铁加入硝酸银溶液中猜想滤液成分滤渣成分猜想1猜想2猜想3猜想4猜想51.向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,与两种溶质依次发生反应。
溶液质量与加入Zn的质量关系如右图所示,有关说法正确的是()A.a点溶液中的溶质有2种B.b点得到的固体为CuC.c点溶液中溶质为Zn(NO3)2D.d点得到的固体有2种2.两个烧杯中装有等质量的金属锌和镁,然后分别逐渐加入同浓度的稀硫酸,产生氢气的质量与加入硫酸的质量关系如图所示.下列说法正确的是()A.该图反映出镁比锌的金属活动性强B.a点时,两个烧杯中的酸都恰好完全反应C.b点时,两个烧杯中产生氢气的质量相同D.c点时,两个烧杯中都有金属剩余优先反应原则三:当酸、碱、盐混合相互反应时,酸与碱的反应优先于酸与盐、碱与盐的反应。
A:将稀盐酸逐滴滴加到NaOH和Na2CO3的混合溶液中,先无明显现象,之后开始产生气泡。
因为先发生的反应是HCl+NaOH=NaCl+H2O,此反应无明显现象,当NaOH已被完全消耗,又发生反应2HCl+Na2CO3=2NaCl+H2O+CO2↑,此反应有气泡产生。
B:将NaOH溶液逐滴滴加到稀硫酸和硫酸铜的混合溶液中,先无明显现象,之后开始产生蓝色沉淀。
因为先发生的反应是H2SO4+2NaOH=Na2SO4+2H2O,此反应无明显现象,当稀硫酸被完全消耗,又发生反应CuSO4+2NaOH=Na2SO4+Cu(OH)2↓1.在含有H2SO4和CuSO4的混合溶液中,逐滴加入NaOH溶液至过量,下列图象能正确反映生成沉淀的质量(m1)与加入NaOH溶液的质量(m1)的关系是()2.将一定质量的Ba(OH)2溶液与Na2CO3溶液混合恰好完全反应,向反应后的混合物中加入稀盐酸,产生气体的体积与加入稀盐酸的体积的关系如右下图所示,下列说法中正确的()A.N 点时,所得溶液的pH=7B.Q点时,所得溶液中的溶质只含有BaCl2C.O至P段发生反应的化学方程式为NaOH+HCl=NaCl+H2OD.P至Q段发生反应的化学方程式为Ba(OH)2+2HCl=BaCl2+2H2O优先反应原则四:当酸与两种盐混合溶液反应产生气体,沉淀时,产生“气体”优于产生沉淀向盐酸和氯化钙的混合溶液中加入碳酸钠溶液,现象是开始冒气泡,后出现白色沉淀。
)初中化学5个优先反应原则

初中化学5个优先反应原则1.初中化学优先反应原则之一:当金属与混合盐溶液反应时,较活泼的金属优先置换出最不活泼的金属。
将一定量的铁粉放入硝酸铜和销酸银的混合溶液中,铁优先置换出银,然后若铁粉有剩余,才能置换出铜。
(1) Fe+2AgNO3==2Ag+Fe(NO3)2 (先)白色固体,无色溶液变浅绿色(2) Fe+Cu(NO3)2==Cu+Fe(NO3)2(后)红色固体,蓝色溶液变浅绿色2.初中化学优先反应原则之二:酸与碱的反应优先于该酸与盐的反应。
将稀盐酸逐滴滴加到NaOH和Na2CO3的混合溶液中时,稀盐酸优先与NaOH反应,当NaOH被完全消耗时,剩余的稀盐酸才与Na2CO3反应。
(1) HCl+NaOH==NaCl+H2O (先)无明显现象(2) 2HCl+Na2CO3==2NaCl+H2O+CO2↑(后)冒气泡3.初中化学优先反应原则之三:金属和酸反应时,较活泼的金属优先反应。
将锌,铁合金投入稀盐酸中,锌优先与稀盐酸反应。
(1) Zn + 2HCl == ZnCl2 + H2↑(先)冒气泡(2) Fe + 2HCl == FeCl2 + H2↑(后)无色溶液变浅绿色,冒气泡4.初中化学优先反应原则之四:欲检验某混合物溶液中同时含CO32-、SO42-和Cl-,应优先检验CO32-,之后检验SO42-,最后检验Cl-。
具体方法为:取混合溶液少量,先加入少量的稀硝酸,若产生能使澄清石灰水变浑浊的气体,则证明含有CO32- (注意此步不能加稀盐酸或稀硫酸);然后加入少量的硝酸钡溶液,若产生不溶于稀硝酸的白色沉淀,则证明含有SO42- (注意此步不能加入氯化钡溶液)。
最后再加入少量的硝酸银溶液,若产生不溶于稀销酸的白色沉淀,则证明含有Cl-。
(1)Na2CO3+2HNO3==2NaNO3+H2O+CO2↑(先)冒气泡(2)Ba(NO3)2+NaSO4==BaSO4↓+2NaNO3 生成白色沉淀(3)AgNO3+NaCl==AgCl↓+NaNO3 (后)生成白色沉淀5.初中化学优先反应原则之五:金属氧化物优先于金属与酸反应。
初中化学5个优先原则

初中化学优先反应原则之三
金属和酸反应时,较活泼 的金属优先反应,如将锌、铁 合金投入稀盐酸中,锌优先与 稀盐酸反应。
初中化学优先反应原则之四
金属氧化物优先于金属与酸反应。 如将稀硫酸逐滴滴加到氧化铜和铁的固体混 合物中,氧化铜优先与稀硫酸发生反应,当 氧化铜被完全消耗时,铁再与硫酸铜反应, 当硫酸铜被完全消耗时,过量的铁才与稀硫 酸反应即:
Na2CO3+2HNO3=2NaNO3+H2O+CO2↑
Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3
AgNO3+NaCl=AgCl↓+NaNO3
CuO+H2SO4=CuSO4+H2O(先) 溶液变蓝 Fe+CuSO4=Cu+FeSO4 析出红色固体
Fe+H2SO4=FeSO4+H2 ↑ (后)有气泡
碳酸根离子CO32-的检验
一般是先加稀盐酸,将产 生的气体再通入澄清的石 灰水,若澄清的石灰水变 浑浊,则说明含有CO32-。
硫酸根离子SO42-的检验
初中化学优先反应原则之二
当金属与混合盐溶液反应时,较活泼的金属 优先置换出最不活泼的金属(K,Ca,Na除外)。
如:将一定量的锌放入硝酸铜和硝酸银的混 合溶液中,锌优先置换出银,然后若锌粉有 剩余,才能置换出铜。 (1)先:Zn+2AgNO3=2Ag+Zn(NO3)2
(2)后:Zn+Cu(NO3)2=Cu+Zn(NO3)2
具体方法为:取混合液少量,先加入少量的稀硝酸,若产 生能使澄清石灰水变浑浊的气体,则证明含有CO32-(注意 此时不能加稀盐酸或稀硫酸);然后加入少量的硝酸钡溶 液,若产生不溶于稀硝酸的白色沉淀,则证明含有SO42(注意此时不能加入氯化钡溶液);最后再加入少量的硝 酸银溶液,若产生不溶于稀硝酸的白色沉淀,则证明含有 Cl-。相关反应。
酸碱盐的优先反应原则

酸碱盐的优先反应原则哎呀,我的天呐!一听到“酸碱盐的优先反应原则”,是不是感觉脑袋都要大啦?反正我刚开始学的时候,那真是一个头两个大!咱们先来说说什么是酸碱盐吧。
酸就像个脾气火爆的家伙,比如盐酸、硫酸;碱呢,就像个温柔的小姐姐,像氢氧化钠、氢氧化钙。
盐呢,就是它们俩在一起玩耍之后产生的“小宝贝”。
那这酸碱盐在一起,为啥还有个优先反应原则呢?这就好比一群小朋友排队买冰淇淋,总有个先来后到的顺序嘛!比如说,在一个溶液里,有酸、碱、盐同时存在,它们可不会乱哄哄地一起反应,而是有个先后的。
比如说,假如有盐酸、氢氧化钠和碳酸钠在一个溶液里,那盐酸会先和氢氧化钠反应,这就好像是盐酸这个“调皮鬼”更喜欢和温柔的碱小姐姐玩耍,而把碳酸钠这个“小淘气”先晾在一边。
有一次上化学课,老师就给我们做了一个实验。
那场面,可精彩啦!老师把这几种溶液混在一起,我们瞪大眼睛看着,心里都在猜到底谁会先和谁反应。
结果出来的时候,大家都“哇”地叫出声来。
我就问同桌:“你说这酸碱盐的反应咋就这么神奇呢?”同桌摇摇头说:“我也不太清楚,不过真的好有趣啊!”还有一次,我在家里自己尝试着做一些小实验,想搞清楚这个优先反应原则。
结果不小心弄得到处都是,妈妈看到了,气呼呼地说:“你这孩子,怎么这么调皮,把家里弄得乱七八糟的!”我赶紧认错,心里却还在想着那些酸碱盐的反应。
其实啊,搞清楚酸碱盐的优先反应原则真的很重要呢!如果以后我们要做更复杂的化学实验,或者解决一些实际的化学问题,不知道这个原则可就麻烦啦!你想想,要是医生在配药的时候不了解这个原则,那能行吗?或者工厂里生产东西的时候不注意,那不就出大乱子啦?所以说,学好这个,用处可大着呢!总之,酸碱盐的优先反应原则虽然有点复杂,但是只要我们多观察、多实验、多思考,就一定能把它拿下!你说是不是呀?。
初中化学优先反应的原则

初中化学优先反应的原则优先反应一:金属与酸反应,较活泼的金属优先反应。
如将铁锌合金投入稀盐酸溶液中,锌和稀盐酸优先反应。
优先反应二:当金属与混合盐溶液反应时,金属中最活泼的金属优先置换出不活泼的金属。
例如:将一定量的铁粉放入Cu(NO3)2和AgNO3的混合溶液中,铁优先置换出银,然后若铁粉有剩余,才能置换出铜。
因为先发生反应:Fe + Ag(NO3)2 == Fe(NO3)2 + 2Ag后发生:Fe + Cu(NO3)2 == Fe(NO3)2 + Cu优先反应三:当酸、碱、盐混合相互反应时,酸与碱反应优先于酸与盐、碱与盐当反应。
如:(1)将稀盐酸逐滴滴加到氢氧化钠溶液和碳酸钠溶液的混合溶液中,先无明显现象,之后开始产生气泡。
因为先发生的反应是:HCl + NaOH == NaCl + H2O此反应无明显现象,当氢氧化钠已被完全消耗,才发生反应:2HCl + Na2CO3 == 2NaCl + H2O + CO2↑此反应有气泡产生。
(2)将氢氧化钠溶液逐滴滴加到稀硫酸和硫酸铜的混合溶液中,先无明显现象,之后开始产生蓝色沉淀。
因为先发生的反应是:H2SO4 + 2NaOH == Na2SO4 + 2H2O此反应无明显现象。
当稀硫酸已被完全消耗,才发生反应:CuSO4 + 2NaOH == Cu(OH)2↓+ Na2SO4优先反应四:当酸与两种盐混合溶液反应产生沉淀、气体时,产生“气体”优先于产生“沉淀”。
若:向稀盐酸与氯化钡的混合溶液中滴于碳酸钠溶液时,先产生气体,之后产生沉淀。
因为:2HCl + Na2CO3 == 2NaCl + H2O + CO2↑此反应产生气泡,当稀盐酸已被完全消耗,又发生反应:Na2CO3 + BaCl2 == BaCO3↓ + 2NaCl优先反应五:当金属、金属氧化物与酸反应时,金属氧化物优先于金属与酸反应。
如:将稀硫酸逐滴滴加到氧化铜和铁的固体混合物中,氧化铜优先与稀硫酸反应,当氧化铜完全消耗时,铁再与硫酸铜反应,当硫酸铜被完全消耗时,过量的硫酸才与铁反应,即可观察到溶液变蓝,后析出红色固体,最后有气泡产生,发生反应依次为:CuO + H2SO4 == CuSO4 + H2O Fe + CuSO4 == Cu + FeSO4 Fe + H2SO4 == FeSO4 + H2↑。
九年级化学概念辨析与化学反应的五个优先反应原则

九年级化学概念辨析与化学反应的五个优先反应原则概念辨析往往是最让同学们头疼的知识点了,有的人还觉得这是反常识的,那么初三这些知识具体有哪些呢?小编在此整理了相关资料,希望能帮助到您。
九年级化学概念辨析题1.明明冰和水混合了,偏说它是纯净物这是关于混合物与纯净物的概念。
纯净物:由一种物质组成是纯净物;混合物:由多种物质组成的是混合物。
冰和水的混合物,虽然看上去是两种物质,但是水——冰之间的变化是物理变化,不是化学变化。
因此在化学上,冰水混合物还是纯净物。
明明物质中只含一种元素,偏说它可能是混合物与第一题相反,有时候由同一种元素沟成的物质,反而是混合物,例如:石墨和金刚石(均由碳元素构成)、红磷和白磷,等等。
明明原子核由质子中子构成,非说氢原子核不含中子原子由原子核构成,原子核由质子和中子构成,这是正确的。
但是有例外,元素周期表中的第1号元素、也是最轻的元素——氢原子的三种同位素中,有一种不含有中子。
明明一瓶水是无色透明的,还说它不一定是纯净物生活中的水中含有大量金属离子例如镁盐、钙盐、钠离子、钾离子等等,当然属于混合物。
有色无色,是否透明,不作为判断纯净物的标志。
明明说燃烧是物质跟氧发生的反应,又说没有氧气也行燃烧,通常情况下是可燃物与空气或氧气发生的反应。
后来扩充了定义为:燃烧是发光、光热的剧烈的化学反应所以有些可燃物也可以在氯气、氮气中燃烧,没有氧气也行。
明明说爆炸是急速燃烧造成的,却说锅炉爆炸不是化学变化锅炉爆炸,包括物理变化和化学变化。
锅炉中的可燃物质爆炸,属于化学变化;锅炉本身的金属破碎,是物理变化。
明明合金“合”的是金属,却说金属和非金属也能形成合金合金,是一种金属与其他物质熔化在一起形成的混合物。
铜和金属锡能形成合金(青铜),铁和非金属也能形成合金(钢)。
明明说二氧化碳可以灭火,又说镁着火不能用它来灭我们知道二氧化碳的化学性质:不能燃烧,也不支持燃烧。
这是一般情形,一些活泼金属可以在二氧化碳、氮气这样的惰性气体中燃烧,比如Mg就可以在CO2中燃烧,生成氧化镁和单质碳。
初中中考化学专题复习化学常见的优先反应原则学案

中考化学专题复习化学常见的优先反应原则学案1、初中化学优先反应的原则一:金属和酸反应时,较活泼的金属优先反应,如将锌、铁合金投入稀盐酸中,锌优先与稀盐酸反应2、初中化学优先反应的原则之二:当金属与混合盐溶液反应时,金属中最活泼的金属优先置换出最不活泼的金属。
3、初中化学优先反应的原则之三:当两种相对活泼的金属与相对弱的金属盐溶液反应时,金属中最活泼的金属优先置换出盐溶液中的金属。
4、初中化学优先反应的原则之四:当酸、碱、盐混合相互反应时,酸与碱的反应优先于酸与盐、碱与盐的反应。
5、初中化学优先反应的原则之五:当酸与两种盐混合溶液反应产生气体、沉淀时,产生“气体”优于产生“沉淀”。
6、初中化学优先反应的原则之六:当金属、金属氧化物与酸反应时,金属氧化物优先于金属与酸反应。
7、初中化学优先反应的原则之七:欲检验某混合物溶液中同时含CO32-SO42-和Cl-,应优先检验CO32-,之后检验SO42-,最后检验Cl-。
例1:将等质量、颗粒大小相同的X、Y、Z三种金属分别投入到相同浓度的足量的稀硫酸中,生成氢气的质量与时间的关系如图所示。
已知它们在化合物中均显+2价,则下列说法不正确的是()A、在时间为t1时,生成氢气的质量为:X>Z>YB、金属活动性:X>Z>YC、相对原子质量:X>Y>ZD、X、Y和Z可能分别是常见金属中的Mg、Fe、Zn例2:在AgNO3、Cu(NO3)2的混合溶液中加入一定量锌粉,充分反应后过滤,得滤渣和滤液。
①若滤液呈无色,则滤渣中一定含有的物质是(填化学式);②若向滤渣中滴加稀盐酸,无明显现象,则滤液中所含溶质的成分可能有种情况。
例3:将一定量的锌粉和铁粉放入一定量硝酸铜溶液中,充分反应后过滤,向滤出的固体中滴加稀盐酸:(1)若无气泡产生,则滤出的固体一定有;一定没有。
滤液中所含溶质一定有;可能有。
(2)若有气泡产生,则滤出的固体一定有;可能有。
滤液中所含溶质一定有;一定没有;可能有有。
初三化学酸碱盐优先反应原则

初三化学酸碱盐优先反应原则酸碱盐是我们化学中常见的概念,我们在日常生活中也经常接触到它们。
那么,在化学反应中,酸碱盐的反应顺序是如何确定的呢?这就涉及到初三化学中的一个重要概念——酸碱盐优先反应原则。
在化学反应中,酸碱盐的反应顺序是根据它们的活泼程度来确定的。
活泼程度较高的物质会优先与其他物质发生反应,而活泼程度较低的物质则会相对较慢地发生反应。
我们来了解一下酸碱盐的性质。
酸是指能够释放出氢离子(H+)的物质,碱是指能够释放出氢氧根离子(OH-)的物质,而盐是酸和碱反应后生成的物质。
在酸碱中,酸和碱的反应是非常重要的,它们可以互相中和。
酸碱中和的过程中,酸和碱会发生反应,生成盐和水。
在酸碱盐反应中,酸和碱的活泼程度是决定反应顺序的关键。
活泼程度高的物质会优先与其他物质发生反应,而活泼程度低的物质则会相对较慢地发生反应。
活泼程度高的酸会优先与活泼程度低的碱反应,生成盐和水。
活泼程度高的碱也会优先与活泼程度低的酸反应,同样生成盐和水。
例如,我们熟知的盐酸(HCl)和氢氧化钠(NaOH)的反应,就是酸和碱的中和反应。
在这个反应中,盐酸是活泼程度较高的酸,而氢氧化钠是活泼程度较低的碱。
所以,在反应中,盐酸会优先与氢氧化钠反应,生成氯化钠(NaCl)和水(H2O)。
酸碱盐优先反应原则在化学实验中也经常被应用。
在实验中,我们可以根据酸碱盐的活泼程度来确定反应顺序,从而合理安排实验步骤。
这样可以确保实验的顺利进行,同时也可以更好地理解化学反应的规律。
初三化学中的酸碱盐优先反应原则是根据物质的活泼程度来确定反应顺序的。
活泼程度高的物质会优先与其他物质发生反应,而活泼程度低的物质则会相对较慢地发生反应。
通过了解酸碱盐的性质和活泼程度,我们可以更好地理解化学反应的规律,并在实验中应用这一原则,使实验更加顺利。
希望大家能够通过学习初三化学,更好地理解酸碱盐的反应原则,为今后的学习打下坚实的基础。
初中化学优先反应原则

初中化学优先反应原则1:金属混合物与酸反应时,比较活泼的金属先与酸反应,如:锌和铁的混合物加入盐酸中,(1)锌+盐酸(2)铁+盐酸2:金属与混合盐酸溶液反应时,在金属活动性顺序表里,距离远的先置换(最先置换出来最不活泼的金属)另除了钾钙钠(太活泼了,无法置换),只能左边置换右边,活泼置换不活泼的金属。
如:向硝酸铜,硝酸银的混合溶液中加入锌(1)锌+硝酸银(2)锌+硝酸铜3:当金属与金属氧化物混合物与酸反应时,金属氧化物优先于金属与酸反应。
如:将稀硫酸滴入氧化铜和铁的混合物中,氧化铜先与硫酸反应。
(1)氧化铜+硫酸(2)铁+硫酸铜(3)铁+硫酸4:当酸与两种可溶性盐溶液混合产生气体,沉淀时,产生“气体”优先于产生“沉淀”。
如向盐酸和氯化钙混合溶液中加入碳酸钠(1)盐酸+碳酸钠(2)氯化钙+碳酸钠5:向碳酸钠和氢氧化钠混合溶液中加入稀盐酸,酸碱反应优先于其他反应(1)氢氧化钠+稀盐酸(2)碳酸钠+稀盐酸6:向一定质量硫酸和硫酸铜的混合溶液中加入氢氧化钠溶液(1)硫酸+氢氧化钠(2)硫酸铜+氢氧化钠能够溶于酸,不能在酸存在的情况下生成,所以必注:产生的沉淀为Cu(OH)2,须先把酸反应完才能产生存在。
7:向一定量的氢氧化钠和硝酸钡的混合溶液中滴加稀硫酸硫酸与氢氧化钠和硝酸钡同时反应,注:产生的沉淀为硫酸钡,硫酸钡不溶于酸,可以在有酸的情况下产生。
中考链接1.向一定量的硫酸铜和稀硫酸的混合溶液中滴加氢氧化钠溶液,反应过程中产生沉淀的质量与加入氢氧化钠溶液质量关系如图所示。
下列说法不正确的是()A.a 点溶液中的溶质有2种B.c 点溶液的溶质有3种C.ab 段(不包括a 点)有沉淀生成D.d 点溶液的pH>72.向一定量的盐酸和氯化钙混合溶液中逐滴加入碳酸钠溶液,用数字化实验设备测得溶液pH 变化情况如下图所示。
下列说法错误的是()A.AB 段反应现象为有气泡产生B.BC 段反应现象为有白色沉淀生成C.CD 段溶液中含有的溶质为碳酸钠和氯化钙D.CD 段溶液PH 大于7是因为碳酸钠溶液显碱性3.实验室制取CO2后残留溶液的pH 为2,向该溶液中滴入碳酸钠溶液可得到如图所示曲线,则AB 段反应的化学方程式为,BC 段反应的化学方程式为,CD 段曲线上升的原因是4.向一定量的硝酸银、硝酸铜和硝酸铝的混合溶液中加入一定量的锌,溶液质量与加入锌的质量关系如图所示。
化学反应中优先反应的原则有哪些

化学反应中优先反应的原则有哪些?
化学反应里的反应顺序是由化学物质的活动性决定的,活动性越强的物质会越先反应。
金属与酸的置换反应:若同时存在酸,那么活动性最强的会首先反应,第二强会在第一强反应完后才会与酸反应。
比如把Al和Fe同时放在盐酸中,则活动性较强的Al先与盐酸反应。
金属与盐溶液发生置换反应:其中混合溶液与一种金属发生置换反应顺序是“先远”、“后近”。
金属混合物与一种盐溶液发生置换反应顺序也是“先远”、“后近”。
例如:硝酸银溶液和硝酸铜溶液中,加入铁,按金属活动性顺序,铁离银的位置远,则铁先与硝酸银反应,只有硝酸银反应完,再与硝酸铜反应。
锌、铁加入硝酸银溶液中,按金属活动性顺序,锌离银远,则锌先与硝酸银反应,只有锌反应完,铁再与硝酸银反应。
盐与盐之间的反应顺序:要看生成的沉淀的溶解度,沉淀越是难溶,就越容易生成。
比如溶液中含有Cacl2 和Mgso4 加入Ca(OH)2 ,Mg(OH)2的溶解度要小于Ca(OH)2。
所以先生成Mg(OH)2,后生成Ca(OH)2。
酸与金属、金属氧化物、碱的反应。
基本顺序是先反应酸碱中和,然后是酸与金属氧化物,最后是与金属单质反应。
比如Fe和Fe2O3一起放进稀硫酸里,则Fe2O3优先与酸反应。
知识拓展:酸碱优先反应原则

例2、把足量H2SO4 加入NaOH 和 BaCl2 的混合溶液中。
H2SO4和NaOH 、BaCl2都能发生反应, 而且与BaCl2反应会有沉淀生成,BaSO4 沉淀是不溶于酸的。根据口诀, H2SO4 和NaOH、 BaCl2 同时反应,所以
沉淀立刻产生。
例3、把足量NaOH 加入HCl和 CuSO4 的混合溶液中。
NaOH和HCl、CuSO4都能发生反应,而且 与CuSO4反应会有沉淀生成,但Cu(OH)2 沉淀是溶于酸的。根据口诀,NaOH先和
HCl反应,当HCl
反应完后, NaOH
再和CuSO4反应生成 Cu(OH)2沉淀。
例4、把足量NaOH 加入H2SO4和 MgSO4 的混合溶液中。
NaOH和H2SO4、 MgSO4都能发生反应, 而且与MgSO4反应会有沉淀生成, 但 Mg(OH)2沉淀是溶于酸的。根据口诀, NaOH先和H2SO4反应, 当H2SO4反应完后, NaOH再和MgSO4反应 生成Mg(OH)2沉淀。
酸碱优先反应原则
口诀:
1、无沉淀生成或生成的沉淀溶于酸, 则酸碱优先反应。
2、生成的沉淀不溶于酸,则同时反应。
例1、把足量HCl 加入NaOH 和 Na2CO3 的混合溶液中。
HCl和NaOH 、Na2CO3都能发生反应,但 生成物都没有沉淀。根据口诀, HCl 和NaOH先反应,当ห้องสมุดไป่ตู้aOH反应完后, HCl 再和Na2CO3反应, 所以气体不会立 刻产生。
谢谢大家!
化学反应先后顺序原则

化学反应先后顺序原则一、引言化学反应是物质转化的过程,不同物质之间的相互作用导致了一系列的化学变化。
在化学实验中,我们常常需要按照一定的顺序进行反应,以达到预期的实验结果。
本文将探讨化学反应中的先后顺序原则,以及它在实验中的应用。
二、先后顺序的重要性化学反应中的先后顺序是指不同反应之间的时间顺序。
正确的先后顺序可以保证反应的顺利进行,避免产生意外的化学变化。
如果反应的先后顺序不正确,可能会导致反应物的过早消耗或产物的不完全生成,从而影响实验结果的准确性。
三、先后顺序的原则1. 反应物的浓度高的先反应反应物浓度高的反应通常会比浓度低的反应更快进行。
这是因为高浓度的反应物分子更加密集,相互之间的碰撞机会更多,从而增加了反应速率。
因此,在实验中,我们通常会先加入浓度较高的反应物。
2. 高温反应优先在一定温度范围内,反应速率随温度的升高而增加。
这是因为高温能够增加反应物分子的动能,使其更容易发生碰撞,从而促进反应的进行。
因此,在实验中,我们通常会先进行高温反应。
3. 先生成的产物反应优先有些反应会生成一些中间产物,这些中间产物可能会参与其他反应。
在这种情况下,我们通常会先生成中间产物,然后再进行其他反应。
这是因为中间产物的生成会提供反应的驱动力,促进其他反应的进行。
4. 反应速率较快的反应优先在实验中,我们通常会选择反应速率较快的反应进行。
这是因为反应速率较快的反应可以更快地达到平衡,从而使实验结果更加稳定。
而反应速率较慢的反应可能需要较长的时间才能达到平衡,从而增加了实验的时间和成本。
四、实验应用1. 酸碱中和反应在酸碱中和反应中,我们通常会先加入酸或碱,然后再加入另一种反应物。
这是因为酸碱中和反应是一个快速进行的反应,先加入酸或碱可以更快地达到中和的效果。
2. 氧化还原反应在氧化还原反应中,我们通常会先加入氧化剂,然后再加入还原剂。
这是因为氧化剂和还原剂之间的反应速率往往不同,先加入氧化剂可以更快地实现氧化还原反应。
初中化学中的优先反应

三、优先反应的图像特点
沉淀/气体
加入的物质
如图所示,当物质加入混合物中后,开始阶 段没有沉淀或者气体生成,表示另一种物质优 先反应。当该物质完全反应后,生成的沉淀或 者气体不再受其影响,逐渐增加。
4、金属氧化物优先于金属与酸反应。
例如:CuO和Fe中加入H2SO4,CuO优先反应。
END
初中化学中的 “优先反应”
Cu(NO3)2
Fe粉 AgNO3
一、优先反应的概念
在混合物中加入某种物质 时,如果混合物中有多种物质 均能与之反应,那就需要利用 优先原则考虑其先后顺序,这 类反应可以称为优先反应。
过程分析
AgNO3
Fe(NO3)2 + Ag Fe
Cu(NO3)2
Fe(NO3)2 + Cu
四、优先反应的原则
1、金属与盐反应,活动性弱的金属优先反应。
例如:Cu(NO3)2和AgNO3中加入Fe,AgNO3优先反应。
2、酸与碱的反应优先于酸(碱)与盐的反应。
例如:H2SO4和CuSO4中加入NaOH,H2SO4优先反应。
3、金属和酸反应,活动性强的金属优先反应。
例如:H2SO4中加入Zn和Fe,Zn优先反应。
初中化学优先反应原则

能大量共存的是( ) B
A. FeCl3 NaCl B. NaCl NaOH C. CaCl2 NaNO3 D. KNO3 H2SO4
KNO3 NaNO3 Na2CO3 NaCl
4
3.有一包固体粉末,可能是CaCO3、Na2SO4、KNO3、CuSO4、 BaCl2中的一种或几种组成,做实验得以下结果: (1)将此固体粉末j加入水中,得到白色沉淀,上层清夜为
蓝色
(2)该白色沉淀不溶于体粉末中,一定含有
;
一定没有 CaCO3 ;可能含有( ) Na2SO4 、 KNO3
5
(6)检验某溶液中是否含有CO32-、SO42-和Cl-, 先检验CO32-,之后检验SO42-,最后检验Cl-。 步骤: ①加入稀HNO3 ②加入Ba(NO3)2溶液 ③ 加 入AgNO3溶液 (7)粗盐中可溶性杂质CaCl2、MgCl2、Na2SO4 等的去除:步骤: ①加入过量Ba(OH)2溶液②加入 过量Na2CO3溶液 ③ 过滤④加入稀盐酸⑤蒸发
1.下列各组物质的溶液,不用其它试剂就
可以将它们区别开的是( B )
A. HCl NaOH Na2CO3 Na2SO4 B. HCl Cu(NO3)2 NaOH NaNO3 C. NaOH MgSO4 Na2CO3 H2SO4 D. BaCl2 Na2SO4 Cu(NO3)2 CaCl2
3
2.下列各组物质在某PH=14的无色溶液中,
初中化学反应的优先反应原则
(1)金属与酸反应时,较活泼的金属优先反应
(2)当金属与混合盐溶液反应时,较活泼的金属 优先置换出最不活泼的金属。如:Fe与AgNO3、 Cu(NO3)2混合溶液反应。 (3)“先表后里”:表面锈蚀的镁、铝、铁等金 属与酸反应时,表面的金属氧化物先与酸反应, 里面的金属后与酸反应 (4)“先中和后气体”:氢氧化钠与碳酸钠混合 物加入稀盐酸或稀硫酸,酸先与氢氧化钠中和反 应,后与碳酸钠反应放出气体二氧化碳。 (5)“先气体后沉淀”:盐酸与氯化钙(或氯化 钡)溶液中加入碳酸钠溶液,先生成气体,后生 成沉淀。
初中化学常见的优先反应原则

初中化学常见的优先反应原则1、初中化学优先反应的原则一:金属和酸反应时,较活泼的金属优先反应,如将锌、铁合金投入稀盐酸中,锌优先与稀盐酸反应。
若锌被反应完了,稀盐酸还有剩余,铁才可以跟稀盐酸发生反应;若锌有剩余,稀盐酸被锌反应完了,那铁就没有机会和稀盐酸发生反应。
.2、初中化学优先反应的原则之二:当金属与混合盐溶液反应时,金属中最活泼的金属优先置换出最不活泼的金属。
例:将一定量的铁粉放入硝酸铜和硝酸银的混合溶液中,铁粉先置换出银,然后若铁粉有剩余,才能置换出铜。
先发生反应Fe+2AgNO2=2Ag+Fe(NO3)2,后发生反应Fe+Cu(NO3)2=Cu+Fe(NO3)23、初中化学优先反应的原则之三:当两种相对活泼的金属与相对弱的金属盐溶液反应时,金属中最活泼的金属优先置换出盐溶液中的金属。
4、初中化学优先反应的原则之四:当酸、碱、盐混合相互反应时,酸与碱的反应优先于酸与盐、碱与盐的反应。
例:①将稀盐酸逐滴滴加到NaOH和Na2CO3的混合溶液中,先无明显现象,之后开始产生气泡。
因为先发生的反应是HC1+NaOH=NaC1+H2O,此反应无明显现象,沉当NaOH已被完全消耗,又发生反应2HC1+Na2CO3=2NaC1+H2O+CO2↑,此反应有气泡产生。
②将NaOH溶液逐滴滴加到稀硫酸和硫酸铜的混合溶液中,先无明显现象,之后开始产生蓝色沉淀。
因为先发生火的反应是H2SO4+2NaOH=Na2SO4+2H2O,此反应无明显现象,当稀硫酸被完全消耗,又发生反应CuSO4+2NaOH=Na2SO4+Cu(OH)2↓,此反应有蓝色沉淀生成。
5、初中化学优先反应的原则之五:当酸与两种盐混合溶液反应产生气体、沉淀时,产生“气体”优于产生“沉淀”。
例:向稀盐酸与氯化钙的混合溶液中逐滴滴加碳酸钠溶液时,先产生气泡,之后产生白色沉淀。
因为先发生的反应是2HC1+Na2CO3=2NaC1+H2O+CO2↑,此反应产生气泡,当稀盐酸被完全消耗,又发生反应CaCl2+Na2CO3= CaCO3↓+2NaCl6、初中化学优先反应的原则之六:当金属、金属氧化物与酸反应时,金属氧化物优先于金属与酸发生反应。
中考化学拔高之酸碱盐中优先反应原则

中考化学拔高之酸碱盐中优先反应原则
当两种物质均能与另一种物质发生反应时,若反应的实质是一种离子和另外两种离子发生反应,需要判断反应的先后顺序。
(1)H+优先与OH-发生反应
举例1:将NaOH溶液加入到CuSO4和H2SO4的混合溶液中画出生成沉淀的曲线变化图像
先:2NaOH+H2SO4== Na2SO4+2H2O
后:2NaOH+CuSO4 == Na2SO4+Cu(OH)2↓
举例2:将稀盐酸加入到NaOH和Na2CO3的混合溶液中画出生成气体的曲线变化图像
先:NaOH+HCl == NaCl+H2O
后:Na2CO3+2HCl == 2NaCl+H2O+CO2↑
(2)碳酸盐优先和H+发生反应。
举例:将碳酸钠加入到CaCl2和稀盐酸的混合溶液中,画出生成气体的曲线变化图像
先:Na2CO3+2HCl == 2NaCl+H2O+CO2↑
后:Na2CO3+CaCl2 == CaCO3↓+2NaCl
(3)若参与反应的物质中有酸,酸完全反应后,才会出现CaCO3、BaCO3、Cu(OH)2等溶于酸的沉淀;但是若反应物中分别含有Ba2+和SO42-(或Ag+和Cl-),即生成物中有硫酸钡,氯化银生成,则反应物一开始混合就有沉淀产生,反应同时进行。
举例:如向一定量的NaOH和Ba(NO3)2的混合溶液中逐滴加入稀硫酸时,画出生成沉淀的曲线变化图像。
因为H+只发生一个化学反应,所以不存在先后顺序,生成沉淀和酸碱中和反应是两个独立的过程,两个反应同时发生,则生成沉淀的曲线变化图像如下图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6. 初中化学5个优先反应原则
(1)初中化学优先反应的原则一:金属和酸反应时,较活泼的金属优先反应,如将锌、铁合金投入稀盐酸中,锌优先与稀盐酸反应。
(2)初中化学优先反应的原则之二:当金属与混合盐溶液反应时,金属中最活泼的金属优先置换出最不活泼的金属。
例:将一定量的铁粉放入硝酸铜和销酸银的混合溶液中,铁优先置换出银,然后若铁粉有剩余,才能置换出铜。
因为先发生反应Fe+2AgNO32Ag+Fe(NO3)2,后发生反应Fe+Cu(NO3)2Cu+Fe(NO3)2。
(3)初中化学优先反应的原则之三:当酸、碱、盐混合相互反应时,酸与碱的反应优先于酸与盐、碱与盐的反应。
例:①将稀盐酸逐滴滴加到NaOH和Na2CO3的混合溶液中,先无明显现象,之后开始产生气泡。
因为先发生的反应是HCl+NaOH NaCl+H2O,此反应无明显现象,当NaOH已被完全消耗,又发生反应2HCl+Na2CO32NaCl+H2O+CO2↑,此反应有气泡产生。
②将NaOH溶液逐滴滴加到稀硫酸和硫酸铜的混合溶液中,先无明显现象,之后开始产生蓝色沉淀。
因为先发生的反应是H2SO4+2NaOH Na2SO4+2H2O,此反应无明显现象,当稀硫酸被完全消耗,又发生反应CuSO4+2NaOH Na2SO4+Cu(OH)2↓。
(4)初中化学优先反应的原则之四:当酸与两种盐混合溶
液反应产生气体、沉淀时,产生“气体”优于产生“沉淀”。
例:向稀盐酸与氯化钙的混合溶液中逐滴滴加碳酸钠溶液时,先产生气泡,之后产生白色沉淀。
因为先发生的反应是2HCl+Na2CO32NaCl+H2O+CO2↑,此反应产生气泡,当稀盐酸被完全消耗,又发生反应CaCl2+Na2CO32NaCl+CaCO3↓。
(5)初中化学优先反应的原则之五:当金属、金属氧化物与酸反应时,金属氧化物优先于金属与酸反应。
例:将稀硫酸逐滴滴加到氧化铜和铁的固体混合物中,氧化铜优先与稀硫酸发生反应,当氧化铜被完全消耗时,铁再与硫酸反应,当硫酸铜被完全消耗时,过量的铁才与稀硫酸反应,即可观察到溶液变蓝,后析出红色固体,最后有气泡产生,发生反应依次为:CuO+H2SO4CuSO4+H2O,Fe+CuSO4Cu+FeSO4,Fe+H2SO4FeSO4+H2↑。
