第四章 配位化学-2
配位化学ppt课件

1) Mononuclear coordination compounds
a) Ligands are named in alphabetical order followed by the name of the central metal atom. Note that, unlike in formulas, the
[Pt(NO2)(NH3)(NH2OH)(py)]Cl, 氯化硝基•氨•羟胺•(吡啶)合铂(II)
e) 若配位原子相同,配体中含原子的数目也相同,则按在 配体结构式中与配位原子相连的原子的元素符号字母顺序 排列; 如:
[PtNH2NO2(NH3)2] 氨基•硝基•二氨合铂(II)
精品课件
23
一个立体化学前缀(cis-, trans-, d 和l )加在配合物 名称前表示立体结构特点或手性, 如 : cis-二氯•二氨合铂(II);
[Co(ONO)(NH3)5]SO4 硫酸亚硝酸根•五氨合钴(III)。
也可在配体名称后标出参与配位的配位原子的元 素符号,如, (M-ONO)-, 亚硝酸-O; (M-NO2)-,亚 硝酸-N; (M-NCS)-, 硫氰酸-N; (M-SCN)-,硫氰酸S. 二硫代草酸根配体,有键合异构体
K2 Ni
精品课件
31
names of charged and neutral ligands are intermingled as dictated by alphabetization
b) When two or more same ligands are present, their number is indicated by a prefix (di-, tri-, tetra-, penta-, hexa-, etc.). However, when the ligand name itself contains one of these prefixes (as in ethylenediamine), then the multiplicative prefix is bis-, tris-, tetrakis-, pentakis-, hexakis-, etc. e.g.
配位化学课件 第四章 非经典配合物
271.1pm
255.1pm
配位化学
又如 : Co4(μ2 -CO)3(CO)9 其电子数为:27 × 4 + 12 × 2 = 132e/3 = 33e个 按EAN规则,每个Co原子还缺三个电子,因此每个Co原子 必须形成三个Co-Co键才能达到18个价电子。 ∴形成四面体原子簇结构
OC
OC
CO
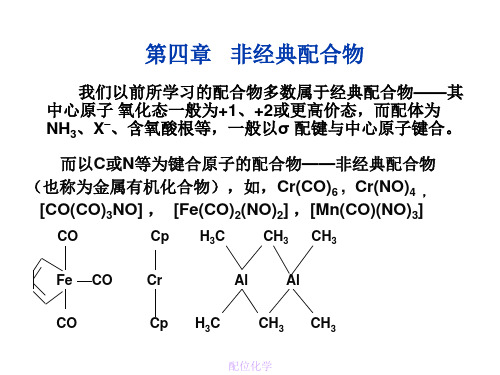
第四章 非经典配合物
我们以前所学习的配合物多数属于经典配合物——其 中心原子 氧化态一般为+1、+2或更高价态,而配体为 NH3、X–、含氧酸根等,一般以σ 配键与中心原子键合。 而以C或N等为键合原子的配合物——非经典配合物 (也称为金属有机化合物),如,Cr(CO)6 , Cr(NO)4 , [CO(CO)3NO] , [Fe(CO)2(NO)2] ,[Mn(CO)(NO)3]
Ru(acac)3 + CO + H2 ∟乙酰丙铜
2CoCO3 + 2H2 + 8CO
Ru3(CO)12
Co2(CO)8 + 2CO2↑+ 2H2O
④利用歧化反应制备羰基配合物
2NiCN + 4CO = Ni(CO)4 + Ni(CN)2 K2[Ni(CN)3] + 2CO = K2[Ni(CN)3CO]
CO
CO CO
Co
Co
OC CO
Co
Co
CO CO
配位化学
CO CO
但EAN规则有许多例外,如V(CO)6:35e,按EAN 应为V2(CO)12,但实际证明V(CO)6具有顺磁性, V(CO)6稳 定性大于V2(CO)12,是因为空间位阻阻碍二聚体的形成, 但容易被氧化成[V(CO)6]ˉ:
第四章 配位化学

配分子: Ni(CO) 4 , 配离子: 4 , BF
CoCl3 ( NH3 )3 Fe(CN)6 4- , Co(NH3 )5 (H 2O)3 , Cu(NH 3 ) 4 2 Co(NH3 )5 (H 2O)Cl3
Cu2[SiF6] 六氟合硅酸(IV)铜(I),
或六氟合硅酸(2-)铜 H4[Fe(CN)6] 六氰合铁(II)酸
4-1 配合物的基本概念
含配阳离子的配合物命名
命名时,阴离子在前,阳离子在后,与无机盐、无 机碱的命名同, 如: [Co(NH3)6]Cl3 三氯化六氨合钴(III) [Cu(NH3)4]SO4 硫酸四氨合铜(II) [Ag(NH3)2](OH) 氢氧化二氨合银(1+)
以罗马数 字Ⅱ、Ⅲ、 Ⅳ表示
4-1 配合物的基本概念
当配体是一很长名称的有机化合物或复杂配体时, 给该配体加一圆括号。如果中心离子有多种价态,则 应在中心离子名称后的括弧中以罗马数字表示其氧化 态。也可在配离子名称后头的圆括号内以阿拉伯数字 (如+1,-2)表明配离子所带的电荷。例如
[Co(NH3)6]3+ 六氨合钴(III)离子;
Cl
NH3 NH3 Cl
瑞士无机化学家.因创立配位化学而获得1913 年诺贝尔化学奖
Co
NH3
1923年,英国化学家西奇维克Sidgwick) 提出有效原子序数(EAN)法则….
XRD
③ 配位化学的蓬勃发展时期
20世纪40年代前后,第二次世界大战期间,无机化学家在围绕耕耘周期 表中某些元素化合物的合成中得到发展,在工业上,美国实行原子核裂变 曼哈顿(Manhattan)工程基础上所发展的铀和超铀元素溶液配合物的研究。 以及在学科上,195l年Panson和Miler对二茂铁的合成打破了传统无机和 有机化合物的界限。从而开始了无机化学的复兴。 Ziegler和Natta的金属烯烃催化剂,Eigen的快速反应。Lipscomb的硼烷 理论,Wnkinson和Fischer发展的有机金属化学,Hoffmann的等瓣理论 Taube研究配合物和固氮反应机理,Cram,Lehn和Pedersen在超分子化学 方面的贡献,Marcus的电子传递过程。在这些开创性成就的基础上,配 位化学在其合成、结构、性质和理论的研究方面取得了一系列进展。 我国配位化学的研究在中华人民共和国成立前几乎属于空白. 80年代后, 我国配位化学研究已步入国际先进行列。特别在下列方面取得了重要进 展:(1)新型配合物、簇合物、有机金属化合物和生物无机配合物,特别是 配位超分子化合物的合成及其结构研究取得丰硕成果,丰富了配合物的内 涵;(2)开展了热力学、动力学和反应机理方面的研究,特别在溶液中离子 萃取分离和均向催化等应用方面取得了成果;(3)现代溶液结构的谱学研究 及其分析方法以及配合物的结构和性质的基础研究;(4)随着高新技术的 发展,具有光、电、热、磁特性和生物功能配合物的研究正在取得进展。
第4章 配位化学

2. 价键理论
3,sp2杂化 配位数2,sp杂化 5,sp3d 或 dsp3杂化
4,sp3杂化
4,dsp2杂化 XeF6
6,sp3d2 或 d2sp3杂化
7,sp3d3杂化
2. 价键理论
配合单元构型与中心原子杂化方式及配位数之间的关系
配位数 2 3 4 5 6 7 中心原子杂化类型 sp杂化 sp2杂化 sp3杂化 dsp2杂化 sp3d杂化 或dsp3杂化 sp3d2杂化 或d2sp3杂化 sp3d3杂化 空间构型 直线形 平面三角形 四面体 平面四边形 三角双锥 八面体 五角双锥 配离子举例 [Ag(NH3)2]+ [Cu(CN)3]2 [Zn(NH3)4]2+ [PtCl4]- [Fe(CO)5] [Fe(CN)6]3 [ZrF7]3
氯化硝基•氨•羟氨•吡啶合铂(Ⅱ)
●
同一配体有两个不同配位原子: SCN- NCS- ; NO2- ,ONO硫氰酸根, 异硫氰酸根; 硝基, 亚硝酸根
K 3 Fe(NCS)6
六异硫氰根合铁(Ⅲ)酸钾
(四)多核配合物
OH / [(H2O)4Fe \ \ Fe (H2O)4]SO4 /
OH
硫酸二(羟基)•二[四水合铁(Ⅱ)]
旋光异构
一.结构异构
组成相同而原子间连接方式不同引起的异构现象。
●
键合异构 [Co(NO2)(NH3)5]Cl2 硝基 黄褐色 酸中稳定 [Co(ONO)(NH3)5]Cl2 亚硝酸根 红褐色 酸中不稳定
● 电离异构
[Co(SO4)(NH3)5]Br
[Co Br(NH3)5] SO4
[CoSO4(NH3)5] Br
3. 配位化合物的类型 (穴状配体,冠醚)
配位化学第四章

20
2.方程形式(近似后)
算符: 邋N
N轾 2
Hˆ 0 =
hˆ i =
i= 1
i=1 犏 犏 臌- ( 2m D i ) + V(ri )
(1)
Hˆ 0f 0 = Ef 0
Slater近似(参考:徐光宪,赵学庄,化学学报,1956,22,441)
V (ri )
z*e 2 ri
=
(2.275) 2 鬃r
p
e-
2.275r ?2
j
2 px
=
5
(2.275) 2 鬃r
p
e- 2.275r ?sin
q cos
f
5
j
2 py
=
(2.275) 2 鬃r
p
e-
2.275r ?sin
q cos
f
原子完全表示:Y = j
鬃j 1s1
1s2
j
鬃j 2 s1
2s2
j
?
1 p1
...
E = e1 + e2 + ... e8
m = 0. 北1. l m ? l
12
通常用字母表示 l值:
l 012345
代号 s p d f g h
13
类氢原子的径向波函数 (a = z / na0)
Rnl R10 R20 R21
表示式
2a 32e- a r
2a
3 2
e-
ar
(1-
a r)
(2
)a 3 2 re- a r
3
角度部分: Y = q l.m( q.j )
(z i )e2
第四章配合物中的化学键

显然, 分子构型决定于杂化轨道的类型: 配 位 数 杂化轨道 分子构型 配 位 数 2 3 4 4
sp
直线
5
sp2
三角形
5
sp3
正四面体
6
dsp2
正方形
杂化轨道 sp3d d2sp2, d4s 分子构型 三角双锥 四方锥
2
△ o <12,600 cm-1 (白色)
NH3
12,600 cm-1 (蓝色)
[Cu(NH3)4]2+ 15,100 cm-1(绛蓝色)
e) P 值的影响 P(d4)=26B P(d6) =18.5B
P(d5)=27.5B P(d7) =20B
因为 P(d5) > P(d4) > P(d7) > P(d6) 因此,d6 离子,例如 Fe2+, Co3+ 几乎总是形成低 自旋配合物。 而 d5 离子,例如 Fe3+, Mn2+,几乎总是形成高自 旋配合物。
Zn(NH3)62+(d10), CFSE= -4Dq×6+6Dq×4=0 例 2 Ni(H2O)62+(d8): CFSE= -4Dq×6+6Dq×2=-12 Dq 对自旋状态发生变化的配体场 (强场):
CFSE= -4Dq × nt + 6Dq×neg + (n2-n1)P
2g
例 3 对d4 组态 如果中心离子取低自旋构型,那么
Co 3d74s2: Co3+ 3d6: 在配位后, CoF63-: sp3d2 在CoF63-中, 杂化轨道的类型为sp3d2, 配离子有4个 单电子, 显顺磁性, 为外轨型配合物(也叫电价配合物)。 6CN- Co(CN)63-: d2sp3 6F-
配位化学第4章 配合物的立体化学与异构现象

迄今为止, 罕有五配位化合物异构体的实例报道, 无 疑这与TBP←→SP两种构型容易互变有关, 因为互 变将使得配体可以无差别的分布于所有可能出现的 位置.
尽管X-射线衍射和红外光谱结果显示, 在[Fe(CO)5] 和PF5中, 处于轴向(z轴)的配体和处于赤道平面(xy 平面)的配体, 其环境是不等价的, 但NMR研究却证 实, [Fe(CO)5]或PF5中所有五个配位位置的配体都 是完全等价的, 这些结果揭示出这些分子在溶液中 具有流变性(fluxional molecules), 即分子结构在溶 液中的不确定性.
217 pm 187 187
Ni
187 184
199 pm 183
190 Ni
185 191
四方锥
变形三角双锥
图 4–3 在配合物[Cr(en)3][Ni(CN)5]1.5H2O中, 配阴离 子[Ni(CN)5]3–的两种结构
b) 三角双锥结构
五配位的非金属化合物如PF5具有三角双锥结构, 轴向 和赤道平面的P–F键键长是非等价的. 一般说来, 在PX5 分子中, 轴向键长比赤道平面的键长要稍长些. 但在配 合物[CuCl5]3−中赤道平面的键长反而比轴向键长稍微长 一些, 见图 4–2.
欲从四方锥(SP)构型转变成三角双锥(TBP)构型的话, 结构上看, 只需要挪动其中一个配体的位置即可, 反之 亦然.
在图 4–3中列出了[Ni(CN)5]3−既可以采取四方锥结构也 可以采取歪曲的三角双锥结构. 将四方锥底的两个对位 配体向下弯曲可转变成三角双锥结构的两个赤道配体, 在这个扭变的三角双锥结构中, 赤道平面的另一个配体 源于原先的锥顶配体, 赤道平面上的其中一个C–Ni–C 夹角(142°)要明显大于另外两个C–Ni–C的夹角 (107.3°和111
《配位化学》课件

配位化合物的稳定性
总结词
配位化合物的稳定性
详细描述
配位化合物的稳定性取决于多个因素,包括中心原子或离子的性质、配位体的数目和类型、配位键的 数目和类型等。一般来说,配位数越大,配位化合物的稳定性越高。此外,具有强给电子能力的配位 体也能提高配位化合物的稳定性。
03
配位键理论
配位键的定义
总结词
配位键是一种特殊的共价键,由一个 中心原子和两个或更多的配位体通过 共享电子形成。
《配位化学》PPT课件
目录
• 配位化学简介 • 配位化合物 • 配位键理论 • 配位反应动力学 • 配位化学的应用
01
配位化学简介
配位化学的定义
配位化学是研究金属离子与有机配体 之间相互作用形成络合物的科学。
它主要关注配位键的形成、性质和反 应机制,以及络合物在催化、分离、 分析等领域的应用。
方向性是指配位键的形成要求中心原子和配 位体的电子云在特定的方向上重叠。这决定 了配合物的特定空间构型。饱和性则是指一 个中心原子最多只能与数目有限的配位体形 成配位键,这取决于中心原子的空轨道数量 和配位体的可用孤对电子数。
04
配位反应动力学
配位反应的动力学基础
反应速率
01
配位反应的速率是研究配位反应动力学的关键参数,它决定了
05
配位化学的应用
在工业生产中的应用
催化剂
配位化合物可以作为工业生产中的催化剂,如烯烃的氢化反应、 烷基化反应等。
分离和提纯
利用配位化合物的特性,可以实现工业生产中的分离和提纯过程 ,如金属离子的分离和提纯。
化学反应控制
通过配位化合物可以控制化学反应的速率、方向和选择性,从而 实现工业化生产中的优化。
配位化学

1 h
R
(R)i (R)N (R)
nA1 ’ =(1/12)(3 11+ 012+113+311+012+113)=1 nA2 ’ =(1/12)(311+012+1(-1)3+311+012+1(-1)3)=0 nE’ =(1/12)(321+0(-1)2+103+321+0(-1)2+103)=1
i
i
R
C2v
E
C2
σv
σv’
Rφ1
φ1
φ2 φ2 φ1
ψ(A1)=N(φ1+φ2+φ2+φ1)=(1/2)1/2(φ1+φ2)
ψ(B2)=N(φ1-φ2-φ2+φ1)=(1/2)1/2(φ1-φ2 )
附:归一化系数:
Ni
1
aij 2 j
A1
B2
B1
AO
2S,2Pz
2Py
2Px
GO
φ1+φ2
φ1-φ2
(5)根据对称性匹配原理画出分子轨道能级图
GO2 GO1 GO
2b2 3a1 21ab11 1b2 1a1
MO
2P 2S AO
举例分析2:BH3
(1)找点群确定特征标表
(2)以配体原子成键轨道为基求可约表示特征标 可约表示的特征标等于不被操作位移的成键轨道数目
D3h г(3σ)
(3)约化求群轨道对应的不可约表示
p
1t2
s
1a1
GO
MO
AO
例2、 [CrF6]3-的分子轨道图形处理
配位化学教材全文最新版

第1章配位化学导论配位化学(coordination chemistry)是无机化学的一个重要分支学科。
配位化合物(coordination compounds)(有时称络合物complex)是无机化学研究的主要对象之一。
配位化学的研究虽有近二百年的历史,但仅在近几十年来,由于现代分离技术、配位催化及化学模拟生物固氮等方面的应用,极大地推动了配位化学的发展。
它已广泛渗透到有机化学、分析化学、物理化学、高分子化学、催化化学、生物化学等领域,而且与材料科学、生命科学以及医学等其他科学的关系越来越密切。
目前,配位化合物广泛应用于工业、农业、医药、国防和航天等领域。
1.1 配位化学发展简史历史上记载的第一个配合物是普鲁士蓝。
它是1704年由柏林的普鲁士人迪斯巴赫(Diesbach)制得,它是一种无机颜料,其化学组成为Fe4[Fe(CN)6]3·nH2O。
但是对配位化学的了解和研究的开始一般认为是1798年法国化学家塔萨厄尔(B.M.Tassaert)报道的化合物CoCl3·6NH3,他随后又发现了CoCl3·5NH3、CoCl3·5NH3·H2O、CoCl3·4NH3以及其他铬、铁、钴、镍、铂等元素的其他许多配合物,这些化合物的形成,在当时难于理解。
因为根据经典的化合价理论,两个独立存在而且都稳定的分子化合物CoCl3和NH3为什么可以按一定的比例相互结合生成更为稳定的“复杂化合物”无法解释,于是科学家们先后提出多种理论,例如,布隆斯特兰德(W.Blomstrand)在1869年、约尔更生(S.M.Jørgensen)在1885年分别对“复杂化合物”的结构提出了不同的假设(如“链式理论”等),但由于这些假设均不能圆满地说明实验事实而失败。
1893年,年仅27岁的瑞士科学家维尔纳(A.Werner)发表了一篇研究分子加合物的论文“关于无机化合物的结构问题”,改变了此前人们一直从平面角度认识配合物结构的思路,首次从立体角度系统地分析了配合物的结构,提出了配位学说,常称Werner配位理论,其基本要点如下:(1) 大多数元素表现有两种形式的价,即主价和副价;(2) 每一元素倾向于既要满足它的主价又要满足它的副价;(3) 副价具有方向性,指向空间的确定位置。
第四章 配位键和配位化合物第一节 配位化合物的基本概念

∶B称电子对给予体。A称电子对接受体。配离子中,中心离子是 电子对接受体,配体是电子对给予体。配位键用一个指向电子对 接受体的箭头“→”表示
●配位键的形成条件
——成键原子中的一个原子的价电子层有孤对电子
——另一原子的价电子层有可接受孤对电子的空轨道
2023/2/19
2023/2/19
3
Байду номын сангаас
一、配合物的定义 1980年, IUPAC (International Union of Pure
and Applied Chemistry,国际纯化学与应用化学联合会)
●由可以给出孤对电子或多个不定域电子的一定数目的离子或分 子(称为配体)和具有接受孤对电子或多个不定域电子原子或离 子(统称中心离子),按一定的组成和空间构型形成的化合物称 配位化合物,简称配合物
[Ag(NH3)2]OH
氢氧化二氨合银(Ⅰ)
[CoCl(NH3)5]Cl2
二氯化一氯•五氨合钴(Ⅲ)
[PtCl(NO2)(NH3)4]CO3
碳酸一氯•一硝基•四氨合铂(Ⅳ)
[CrCl2(NH3)4]Cl•2H2O
二水合一氯化二氯•四氨合铬(Ⅲ)
[Cr(NH3)6][Co(CN)6]
六氰合钴(Ⅲ)酸六氨合铬(Ⅲ)
例,Fe3+与SCN-配位,随着SCN-浓度增加,可形成配位数为1~6 的配离子
2023/2/19
12
(五)配离子的电荷
是中心离子电荷和配体总电荷的代数和
例,Zn2+与CN-形成[Zn(CN)4]x,电荷数x为x=2+4(-1)=-2,故为 [Zn(CN)4]2-配离子,[Zn(NH3)6]x的电荷x为+2
第4章_配位化学

H4[Fe(CN)6] 六氰合铁(II)酸
含配阳离子的配合物命名
命名时,阴离子在前,阳离子在后,与无机盐、无 机碱的命名同, 如:
[Co(NH3)6]Cl3 三氯化六氨合钴(III) [Cu(NH3)4]SO4 硫酸四氨合铜(II) [Ag(NH3)2](OH) 氢氧化二氨合银(1+)
(5) 配离子与形成体的电荷数
A()g(S2O3)23, (P2)tC3l(NH3)
K3(F3e)(CN6) 赤血盐 , K4(F2e)(CN6)
C(3o)C3l(NH3)3 ,
(0)
Fe(CO5)
黄血盐
1.3 命名(nomenclature)
f) 配体中化学式相同但配位原子不同(如–SCN, – NCS), 则按配位原子元素符号字母顺序排列;若配位原子尚不清 楚,则以配位个体的化学式中所列的顺序为准。 如:
(2)多核配合物的命名
在桥联的配体前加前缀 “μ”,例如 [{Cr(NH3)5}2(μ-OH)]Cl5
五氯化 μ-羟-二(五氨合铬(III))
H
CN O F
P S Cl
As Se Br
Sb Te I 最常见的是N、O,其次是P、S。
配体的分类:
①、按成键方式不同可分为:
经典配体:提供孤电子对,形成配位键,亦称σ配体。例
NH3、en。其特征是含有孤对电子对的分子或离子。
非经典 配体:
π配体:C2H4、C2H2等提供不定域电子。 其特征:既是电子对给体,又是受体。
配位单元:由一个简单阳离子或原子和一定数目的中性分子或阴
离子以配位键结合,按一定的组成和空间构型形成一
配位化合物

4、 配位数及电荷 、
与中心离子(或 原子)成键的配 位原子的总数
配 数 = ∑配 体i 的 目 齿 位 位 数 × 数
单 配 齿 体 C H 3 ) 4+ u(N 多 配 齿 体 4 3 +1 = 4 2 + 2× 2 = 6 3× 2 = 6 1×6 = 6
[PtCl 3 (NH3 )]− [CoCl 2 (en)2 ]2+ [Al(C2O4 )3 ]3− [Ca(EDTA) ]2−
−
配离子与形成体 的电荷数
(+) (+2) l Ag(S2O3 ) 2 , Pt C 3 (NH3 ) (+3) (+2) K3 Fe (C 6 赤 盐, N) 血 K4 Fe (C 6 N) (0) (+3) o l H O) C C 3 (N 3 )3 , Fe(C 5
2价金属离子 Ca2+ 6 Mg2+ 6 Fe2+ 6 Co2+ 4,6 Cu2+ 4,6 Zn2+ 4,6
3价金属离子 Al3+ 4,6 Cr3+ 6 Fe3+ 6 Co3+ 6 Au3+ 4
19
三 类型 (types)
1、简单配合物 、 一个中心离子,每个配体均为单齿配体
4 如 Fe(CN)6− [Co(NH3 )5 (H2O)] 3+
维尔纳 (Werner, A, 1866—1919) 瑞士无机化学家.因创立配位化学 而获得1913年诺贝尔化学奖
5
4-1 配合物基本概念
让我们先看一个实验: 让我们先看一个实验:
[Cu(NH3)4]SO4溶液 Cu(OH)2沉淀 CuSO4溶液
配位化学 第4章 配合物的合成方法

3. 配体上的取代反应
当西佛碱、戊二酮和偶氮化合物作为配体时,可发生取代 反应并生成新配合物。例如
M C NH+ R'NH2 M C NH+ RNH2
具体的例子如将N-溴代丁二酰亚胺加到乙酰丙酮合铬 (III)的氯仿溶液中后搅拌,再蒸去溶剂,重结晶可得三(3- 溴代-2,4-戊二酮)合铬(III)配合物:
有时在直接加成合成时也用混合溶液,例如
H2OC2 H5OH [Fe(H2O)6 ]2 3bipy [ Fe(bipy)3 ]2(深红色) 6H2O
§6.1.2
取代反应合成法
取代合成也叫组份交换合成,即通过对配合物 中的某一组分进行交换,替代,并生成新的配合 物.一般可分为下列三种方法: 1. 配体取代 2. 中心金属离子取代 3. 配体上的取代反应
第四章
配位化合物的合成化学
请自学有关配合物的合成方法
广义地讲,配位化合物除经典的中心离 子与其它分子或离子(配体)通过授受电子 对形成配键结合而成werner型之外,还应包 括许多新型的化合物,如金属π配合物、夹 心配合物、笼状配合物、分子氮配合物,大 环配合物,金属有机化合物和簇合物。但习 惯上一般把含有金属-碳键的配合物称为金 属有机化合物;而把含有两上以上的金属原 子且分子内存在有金属-金属键的配合物称 为金属簇化合物(Cluster compounds或 Cluster complex)。
对Werner型配合物来说,最常用的方法是结晶,其 中包括:
(a)浓缩、蒸发除去溶剂,用冰盐浴等冷却,使产物析出。
(b)缓慢地加入与溶剂有互相混溶,但又不能溶解目标配合物 的溶剂使产物析出。 (c)若目标配合物是配阳离子,可加入能与它生成难溶盐的合 适阴离子将它分离出来,而要制备配阳离子时,可以加入一 种合适的阳离子使其分离出来。当一次结晶不能制得纯目标 化合物时,还需多次结晶,使其纯化。
配位化学讲义第四章(2)分子轨道理论

第三节分子轨道理论(MOT)一、概述要点:A、配体原子轨道通过线性组合,构筑与中心原子轨道对称性匹配的配体群轨道。
B、中心原子轨道与配体群轨道组成分子轨道。
形成LCAO-MO的三原则:二、金属与配体间σ分子轨道(d轨道能级分裂)1.可形成σ分子轨道的中心原子轨道(n-1)d x2-y2, (n-1)d z2, ns, np x, np y, np z (可形成σ分子轨道)三、ABn型分子构筑分子轨道的方法1、步骤1)列出中心原子A及配位原子B中参与形成分子轨道的原子轨道;2)将中心原子轨道按照以它们为基的不可约表示分类;3)将B原子轨道按等价轨道集合分类(由对称操作可彼此交换的轨道称为等价轨道);4)将每一等价轨道集合作为表示的基,给出表示;再将其分解为不可约表示;5)用每一组等价轨道集合构筑出对应于上一步所求出的不可约表示的配体群轨道;6)将对称性相同的配体群轨道与中心原子轨道组合得分子轨道。
2、以AB6(O h群)为例1)A原子用ns、np、(n-1)d 9个轨道,每个B原子用3个p(p x、p y、p z)轨道,共27个轨道形成分子轨道。
C、规定p z向量指向中心原子,则p x、p y向量应存在于垂直于p z向量的平面内;D、规定第一个B原子的p x向量与y 轴平行(* 方向相同),则该B原子的p y向量应与z轴平行(* 方向相同);E、其余(6-1)个B原子的p x和p y 向量的方向由O h群对称性决定。
2)A原子价轨道在O h群对称下,属于下列表示:A1g: sE g: d x2-y2,d z2T1u: p x,p y,p zT2g: d xy,d xz,dyz3)O h群将B原子的18个轨道分为如下等价轨道的集合:I、 6个p z轨道(可用于形成σ分子轨道)II、12个p x或p y轨道4)以上述轨道集合I为基,得出在O h群中的表示,并进行约化:Гσ = A1g + E g + T1u5)求出与中心原子价轨道相关的配体群轨道(用投影算符):中心原子轨道ψ(A1g) = (1/6)1/2(p z1+p z2+p z3+p z4+p z5+p z6) 匹配 sψ(E g) = (1/12)1/2(2p z5+2p z6-p z1-p z2-p z3-p z4) d z21/2(p z1-p z2+p z3-p z4)匹配d x2-y2ψ(T1u) = (1/2)1/2(p z1-p z3) p x(1/2)1/2(p z2-p z4)匹配p y(1/2)1/2(p z5-p z6)p z6)按照上述对应关系,构成分子轨道。
研究生配位化学第4章

配合物发生取代反应时配位数没有变
化,新键的生成和旧键的断裂几乎同
时进行,彼此相互影响,I机理又进一
步分为IA机理和ID机理。
交换机理(又称为I机理 ):
ID机理:取代反应中离去基团X的影响大于
进入基团Y,反应机理倾向于离解。 IA机理:取代反应中进入基团Y的影响大于离 去基团X,反应机理倾向于缔合。
1. 活性配合物和惰性配合物 : 在动力学上,将一 个配离子中的某一配体能迅速被另一配体所取代 的配合物称为活性配合物,而如果配体发生取代 反应的速率很慢称为惰性配合物。 目前国际上采用H.Taube所建议的标准:即在反 应温度为 25℃,各反应物浓度均为 0.1mol.L-1 的 条件下,配合物中配体取代反应在一分钟之内完 成的称之为活性配合物,而那些大于一分钟的称 之为惰性配合物。
碱性非常敏感 (κ y 也如此,但敏感性差些 ) 。
代了,这也反映了在速率决定步骤中,键
的断裂是重要的。
(3)中心金属离子的影响
不同的金属离子对取代反应速率影响不同,如:
取代反应速率的顺序为
Ni(Ⅱ)>Pd(Ⅱ)>>Pt(Ⅱ),这与形成五配 位配合物倾向的顺序是一致的,说明
愈容易生成五配位的中间配合物,就
假如对下列反应: 控制[Pt(diPy)Cl2]=1x10-5~1x10-4mol.L-1,而亲 核试剂[Py]=0.12~0.03mol.L-1之间变化,得到 的 κ 观 与 [Py] 作图是一直线 , 且截距 κ s=0, 如 下图 (κ 观 与 [Py] 的关系 ): κ s=0 意味着此溶 剂的配位能力差,所以κ s途径变得不重要.
2.亲核取代和亲电取代
配合物的取代反应包括两种类型:一是配合物 中的配体被另外的配体所取代;另一个是中心 金属离子被另一金属离子取代,前者称为亲核 取代,后者称为亲电取代。 亲核取代: SN M—X + Y → M—Y + X M一X +M, → M,一X + M 亲电取代: SE
配位化学ppt

镜面 D
M
C
C
A
B
B
D M
A
互为镜像的关系
42
2、六配位八面体型的三顺式配合物。见 书178页图4-12。
A
C M
B
C
m
A
A
A
M
BB
C
A A
C B
C B A MM
B
A C
B B
CC
对映异构体的特点: 偏振光旋转的角度相同但方向相反。
43
偏振光: 光波是电磁波。 电场或磁场振动的方向与光前进的方向 垂直,电场振动的平面与磁场振动的平面垂 直。
(2) 四羰基合镍(0)
⑶ 二水合溴化二溴·四水合铬(Ⅲ)
⑷ 二氯化亚硝酸根·五氨合铱(Ⅲ)
31
4-2 配合物的异构现象和立体结构
配合物的异构
结构异构 立体异构
几何异构
旋光异构(对映异构)
4-2-1 结构异构
概念:组成相同而配合物(包括配离子)结构 不同的异构现象。
32
类型:
(1)键合异构
[Co(NO2)(NH3)5]Cl2 硝基 黄褐色 酸中稳定 [Co(ONO)(NH3)5]Cl2 亚硝酸根 红褐色 酸中不稳定 (2) 电离异构
络盐(complex salt):如果一种复盐在其晶体中 和水溶液中都有络离子存在,属于配合物,称为络 盐。
例如: CsRh(SO4).4H2O, 其水溶液和 晶体中存 在
[Rh(H2O)4(SO4)2]-
24
4-1-3、配合物的命名 1、配离子的命名 命名顺序:
配体数
合
配体名称
中心离子 (氧化数)
L
L
M
配位化学(coordination.

4-1-3 composition of complex
根据上面的讨论,配合物的组成可表示为
[Cu(NH3)4] SO4
中
心 离 子
配配
位位 原体 子
配
位 数
外
界 离
子 内界(配离子) 外界
配合物
Ag(NH 3 ) 2 Cl
← 中 配 心 位 离 体 子 ← ← 外 界
Ni(CO) 4
← 中 配 心 位 原 体 子 ←
叶绿素、血红素结构参见p170
二、中心原子or中心离子(中央体、形成体、核体、 电子对接受体)central atom characteristic:具有一定的empty valence orbitals 空价轨道。
A.无论其氧化态是正是负还是零,但通常是metal cations, 特别是过渡金属阳离子transition metal cations,如
FeF63- 、 Fe(CO)5 H[Co(CO)4] 、[Cu(NH3)4]2+
B、中性原子:Fe(CO)5、Ni(CO)4 C、带负电的阴离子I3- [I->I-<—I]- D、高氯化物的非金属元素: SiF6-、Si4+、PF6-、P5+
桥基:联结的两个中心原子的配体
多核配合物:含两个or两个以上中心离子 的配合物 H2 H2
冶金 化学分析
配
生物化学—生物无机化学 有机化学—微量元素分析化学
医药
鞣革 染色 有机合成 原子能
高分子化学
位
物理化学 结构化学 有机合成化学—金属有机化学 工业化学
火箭
化学仿生 超导 化肥
化ቤተ መጻሕፍቲ ባይዱ
环境化学
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
要点:
(1)中心离子(或原子)空轨道杂化,配体提 供孤对电子。
(2)配位键的本质为共价键。
(3)配合物(配离子)的空间构型取决于中心 离子的杂化方式。
2020/8/16
精品课件
3
杂化轨道形式与配合物的空间构型
配 空间构型 杂化轨
位
道类型
数
实例
2 直线形 3 平面三角形 4 正四面体 4 四方形 5 三角双锥 5 四方锥 6 八面体
故可用磁矩的降低判断内轨型配合物的生成
2020/8/16
精品课件
21
例:Co(NH3)63+的μ =0 B.M,判断该配
离子的空间构型,中心离子所采用的杂化 轨道和内、外轨类型
解:
Co3+: 3d6
μ =0 B.M, 推出n=0ቤተ መጻሕፍቲ ባይዱ即单电子数为零,
如NiCl42-(正四面体),Ni(CN)42-(平面正方形)。
sp3杂化
dsp2杂化
2020/8/16
精品课件
7
4) 配位数为5(较少见):呈三角双锥和四方锥
如Ni(CN)53- (四方锥),[CuCl5]3- (三角双 锥)。
3-
N
2020/8/16
N C
C N
C
N
C
Ni
C N
精品课件
dsp3杂化
外轨型
配位键的键能:内轨型 > 外轨型
配合物的稳定性:内轨型 > 外轨型 稳定常数: 内轨型 > 外轨型
2020/8/16
精品课件
19
2)配合物的磁性(价键理论的实验依据) 磁性:磁矩(磁天平测出)
n(n2) B.M.
μ :磁矩,单位:玻尔磁子(B.M),n为单电子数
一般可分成顺磁性物质、反磁性物质和铁磁性物质
sp3d2杂化
3d8
sp3d2杂化轨
N3HN3HNH 3NH 3 NH 3NH 3
2020/8/16 外轨型配合物精品课,件 八面体构型
16
中心离子的d电子排列不变,仅用原有的外 层空轨道与配体成键,称之外轨型配合物。
特点:
配位键离子性较强,共价性较弱,稳定 性较内轨型配合物差
2020/8/16
精品课件
•外轨型
2020/8/16
精品课件
10
中心离子杂化轨道的形成
1)(n-1)d nS nP型(内轨型)
例1、讨论Ni(CN)42 –构型
2020/8/16
精品课件
11
Ni(CN)42 – Ni2+ (3d8):
3d
4s 4p
在CN-作用下,d电子重排
然后空d轨道进行杂化
2020/8/16
•• •• •• ••
dsp2杂化
精品课件
12
[Fe(CN)6]4-:
Fe2+ (3d6):
在CN-作用下,d电子重排后,空轨道进行杂化
•• ••
3d
•• •• •• ••
4s 4p
d2sp3杂化,内轨型配合物 (低自旋)
2020/8/16
精品课件
13
中心离子d电子排列发生了变化,空出内层 的d轨道与配体成键(或用原有的内层空轨 道与配体成键),称之内轨型配合物
C﹥ N ﹥ O ﹥ F 2020/8/16
精品课件
18
(b) 中心原子d3型, 如Cr3+,有空(n-1)d轨道, (n-1)d2 ns np3易形成内轨型
中心原子d8~ d10型,如Fe2+, Ni2+,Zn2+, Cd2+,
Cu+
无空(n-1)d轨道, (ns) (np)3 (nd)2易形成
配合物的化学键理论
一、价键理论 二、晶体场理论
2020/8/16
精品课件
1
4.2 价键理论
1. 理论要点
中心思想:
中心离子必须具有空轨道,以接受 配体的孤对电子形成配位共价键,为了增 加成键能力,中心离子能量相近的空轨道 杂化,以杂化轨道来接受配体的孤对电子 形成配合物
2020/8/16
精品课件
2
如 [HgI3]-, [Cu(CN)3]2-, [Pt0(PPh3)3], [CuCl3]2-。
三角锥形,VA族,含孤对电子,如 NH3, PH3, AsCl3,SbCl3。
2020/8/16
精品课件
6
3) 配位数为4: 呈正四面体型和平面正方形 非过渡金属配合物,如AlCl42-, SO42- (四面体型)。 过渡金属配合物可形成平面正方形和正四面体型。
4
d2sp3 Fe (CN) 3 – Co(NH )
1) 配位数为2:
直线型, 金属离子为d10的1B族元素, sp 杂化,如 [MCl2]- (M = Cu, Au), [M(CN)2]- (M = Ag, Au) 。
2020/8/16
精品课件
5
2) 配位数为3:
一般为平面三角形,金属离子组态为d10,sp2杂化
μ > 0 顺磁性物质
μ=0
反磁性物质
2020/8/16
精品课件
20
例:μ =5 B.M 则n=4,表现为顺磁性
外轨型配合物,中心原子的电子结构不发生改变, 未成对电子数多,µ 较大, 一般为高自旋配合物
内轨型配合物,中心原子的电子结构发生了重排, 未成对电子数减少, µ 较小,一般为低自旋配合物
特点:
键的共价性较强,稳定性较好,在水溶液 中,一般较难离解为简单离子。
2020/8/16
精品课件
14
2)nS nP nd型(外轨型) [FeF6]3–
[FeF ] 20206/8/136 – sp3d2杂化,精品八课件面体构型, 外轨型15 配合
Co(NH3)62+: Co2+: 3d7
4d 4p 4s 3d7
2020/8/16
sp Ag(NH3)2+ Ag(CN)2–
sp2 Cu(CN)32 – HgI3–
sp3 Zn(NH3)42+ Cd(CN)42–
dsp2 Ni(CN)42–
dsp3 Ni(CN)53– Fe(CO)5
d4s TiF52–
sp3d2 FeF63– AlF63- SiF62-
精品课P件tCl64-
8
5 ) 配 位 数 为 6 :呈八面体和畸变八面体 如Cu(en)2Cl2(拉长八面体)
偶尔形成三角棱柱,如[Re(S2C2Ph2)3]。
Cl 2.8
Ph Ph
S S
N
N
Cu
2.0
N
N
Cl
d sp 2020/8/16 2 3杂化
Re S S
精品课件
Ph
Ph
S S
Ph
9
Ph
2 .价键理论的应用
1)内层和外层的d轨道均可参与杂化 •内轨型
17
内外轨型取决于: 配位体(主要因素) 中心原子(次要因素)
(a) 强配体:CN –、 CO、 NO2 –等,使d电子,甚至s 电子重排,易形成内轨型(配位原子电负性小)
弱场配体: X – 、OH –易形成外轨型(不重排,配 位原子电负性大)
中等强度配体: H2O、NH3等,重排与否与中心体有关
