立体化学基础
有机化学:立体化学基础 总结

3、手性分子和非手性分子:
Ø 手性分子:
ü 化合物A和B 不能重合,A和B 不是 同一化合物。
ü A 和 B 互为 对映异构体。
手性分子有何特点?
3、手性分子和非手性分子:
Ø 非手性分子:
化合物C和D 能够重合,C和D 是同一化合物,C是 非手性分子。
化合物E和F 能够重合,E和F 是同一化合物,E是 非手性分子。
立体异构
(立体结构、空间排列)
stereoisomerism
构象异构
(后天)
conformational isomerism
非对映异构
diastereoisomerism
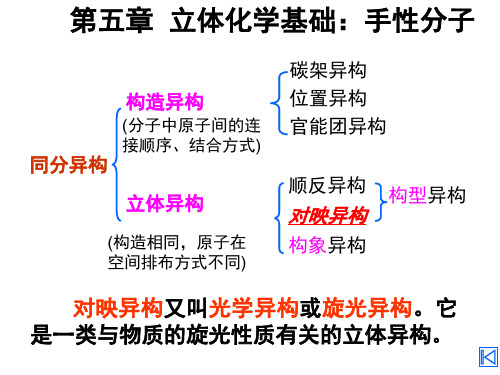
有机化合物同分异构
碳架异构
官能团位置异构
构造异构
官能团异构
互变异构
ห้องสมุดไป่ตู้
构象异构
立体异构
顺反异构
对映异构
(旋光异构)
第一节
概述
平面偏振光及比旋光度
3、手性分子和非手性分子:
手性分子
非手性分子
Ø 手性分子的一般特点:
ü 碳上连有4个不同基团,这个碳称为:
• 手性碳原子 (chiral carbon atom) 或 不对称碳原子
(asymmetric carbon atom)
• 手性中心 (chiral center) 或 不对称中心 (asymmetric
center)。
• 用 C* 表示。
3、手性分子和非手性分子:
Ø 手性分子
Ø 非手性分子
3、手性分子和非手性分子:
例:Linalool (里哪醇, 沉香醇, 芳樟醇)
用“*”标记手性碳原子
Me
O
立体化学基础
Cl大 HOCH2
Cl
键上,纸面 走向与实际
CH2Cl 走 向 相 同 ,
S-2,3-二氯丙醇
R-2,3-二氯丙醇
顺时针为R型, 逆时针为S型。
直接根据Fischer投影式命名的简便方法介绍
Problem 6: Give the names of the following compounds。(by R/S nomenclature)
有相等的距离。实物与镜像的关系叫对映关系。
镜面
实物与镜像
若实物与其镜像能够完全重合,则实物与镜像所 代表的两个分子为同一个分子。
OH
OH
CH H
CH3
HC H
CH3
OOHH
HH
CC HH 所有基团都重合 CCHH3 3
乙醇分子模型的重叠操作
对于某些分子,两个互为实物与镜像关系的分 子不能重合,如乳酸。
CO2H
CO2H
CO2H
NH2
NH2
H CH3
NH2 H
CH3 H
CO2H
CH3
H
NH2
CH3
即:固定*C上某个基团,其它三基团顺序轮换,不 改变其构型。
Problem 3: 下列Fischer式是否表示同一化合物?
COOH
CH2OH
H
OH
HO
H
--
CH2OH
COOH
镜 像
1
2
关
旋转180℃后可重叠
丙酸分子 的对称面
分子的对称面 具有对称面的分子为非手性分子
四、判断对映体的方法
1、看分子和它的镜像能不能重合。如果 不能重合,就具有对映异构现象。
2、寻找对称面和对称中心。如果分子没 有对称因素(对称面和对称中心),就 具有对映异构现象。
有机化学基础知识点整理立体化学基础概念

有机化学基础知识点整理立体化学基础概念有机化学基础知识点整理——立体化学基础概念引言:有机化学是研究碳元素化合物的构造、性质和变化的一门学科,而立体化学则是有机化学中重要的基础概念之一。
在有机化学中,分子的立体构型对于反应性、性质和生物活性有着重要影响。
本文将着重整理一些有机化学中的立体化学基础概念,以帮助读者更好地理解有机化学中的立体结构,进而对有机化学进行深入学习。
一、手性与手性中心手性是指分子或物体与其镜像体不可重合的性质。
在有机化学中,手性分子是指拥有手性中心或手性轴的分子。
手性中心是指一个碳原子上连接着四个不同基团的碳原子,它使得分子无法与自身的镜像体重合。
手性分子在光学活性、药物作用和化学性质等方面具有独特的特性。
二、立体异构与构象异构1. 立体异构立体异构是指分子的空间排列方式不同而产生的异构体。
常见的立体异构有以下两种类型:(1) 旋转异构:由于单键的自由旋转,骨架构型可以发生一定程度的旋转,产生旋转异构体。
(2) 互变异构:由于键的旋转受到某些限制,使分子无法通过旋转达到立体异构体之间的互变。
2. 构象异构构象异构是指分子在空间中采取不同的构象,但化学键没有发生断裂或形成新的键。
构象异构分为以下几种类型:(1) 键的旋转构象异构:分子在有某些限制的情况下,通过键的旋转而形成的构象异构。
(2) 环的变形构象异构:分子中含有环系统,通过环的弯曲或平面变形产生的构象异构。
(3) 键的翻转构象异构:分子中存在于键的两个端点之间的三个最佳位置,通过在这三个位置间进行翻转形成的构象异构。
三、立体化学的表示方法1. 常用的立体表示方法(1) 空间结构式:通过笛卡尔坐标系中的三维坐标表示分子的立体构型。
(2) 键切式:通过表示分子和化学键之间关系的切面图形来表示立体构型。
(3) 投影式:通过投影方式来表示立体构型,包括斜投影式、哈维利投影式等。
2. 立体异构体的命名方法(1) IUPAC命名法:使用希腊字母(R和S)来表示手性异构体,其中R表示顺时针方向,S表示逆时针方向。
化学反应中的立体化学与对映体选择性

化学反应中的立体化学与对映体选择性在化学反应中,立体化学和对映体选择性是理解和解释许多反应机理的重要概念。
立体化学关注于分子的三维结构,而对映体选择性则指的是对一对手性分子在反应中不对称形成的偏好性。
本文将探讨化学反应中的立体化学原理以及对映体选择性的机理和应用。
一、立体化学的基础原理立体化学是研究分子和化学反应中的空间构型的分支学科。
分子的立体构型取决于键角和键的旋转性质。
键角决定了分子的几何形状,而键的旋转性质则决定了分子的立体异构体。
常见的立体异构体有手性异构体和顺反异构体。
1.手性异构体:手性异构体是指分子在空间中无法与其镜像重叠的异构体。
其中最常见的类型是立体异构体分为左旋体和右旋体,也称为对映体。
对映体具有相同的化学性质,但与其他手性分子发生反应时,可以表现出显著的差异。
2.顺反异构体:顺反异构体是指分子在空间中可以通过旋转键来相互转化的异构体。
例如,环状化合物的立体异构体可以通过键的旋转来相互转化。
顺反异构体的存在可以影响反应速率、产物分布和反应途径的选择。
二、对映体选择性的机理和应用对映体选择性是指化学反应中针对手性物质选择性生成某个手性产物的趋势。
对映体选择性是由于反应条件、催化剂和反应物的立体特性共同作用的结果。
1.反应条件:温度、溶剂和反应物之间的相互作用可以影响反应的立体性质和对映体选择性。
例如,反应在不对称环境中进行时,产生的手性产物的对映体选择性通常会增强。
2.催化剂:催化剂在化学反应中起到非常重要的作用,可以有效地调控反应速率和对映体选择性。
手性催化剂可以通过选择性地与一对手性反应物中的一个互相作用,以产生具有高对映体选择性的产物。
3.反应物的立体特性:反应物的手性性质对于反应的对映体选择性也起着重要的影响。
对映体反应物的立体配置可以决定所生成产物的对映体选择性。
例如,具有R或S构型的手性反应物可能会导致不同对映体选择性的产物生成。
对映体选择性在药物合成和精细化学品的生产中具有重要的应用价值。
立体化学基础.
丙 丙 异构
二,对映异构体和手性分子 (一)对映异构体和手性分子
下图为一对互为镜像关系的乳酸分子的立体结构式(透视式 : 下图为一对互为镜像关系的乳酸分子的立体结构式 透视式): 透视式
镜子 C2OH C HO H CH3
a
C2OH H C CH3 OH
b
a和b互为镜像的一对乳酸分子 实线代表位于纸平面上的键; 实线代表位于纸平面上的键; 虚线… 代表伸向纸平面后面的键, 虚线… 代表伸向纸平面后面的键, 楔形线代表伸向纸平面前方的键
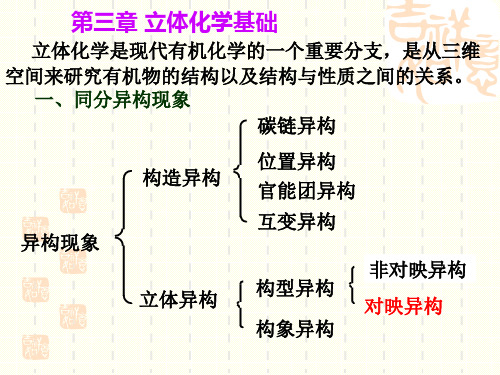
第三章 立体化学基础
立体化学是现代有机化学的一个重要分支, 立体化学是现代有机化学的一个重要分支,是从三 维空间来研究有机物的结构以及结构与性质之间的关系. 维空间来研究有机物的结构以及结构与性质之间的关系. 一,同分异构现象 碳 链异 构
构 造异 构 异 构现 象 立 丙异 构
位 置异 构 官 能团 异构 互 变异 构 构 丙 异构 构 象 异构
12
可用不同的方法表示同一立体异构体的立体结构 三羟基丁醛: 例:2R, 3S-2, 3, 4-三羟基丁醛: 三羟基丁醛
CHO H OH HO H CH2OH HO H HOH OH CHO H CH2OH OHC CH2OH H OH
Fischer投影式 投影式
锯架式
Newman投影式 投影式
13
-CH3 < -CH2CH3 < -CH2CH2CH3 < -CH(CH3)2
H3C C2H5 H OH
-OH >-CH2CH3 >-CH3 > H
R-2-丁醇 丁醇
18
(3)若手性碳连有含重键的基团时,则可看 若手性碳连有含重键的基团时, 作多次与同一原子相连.例如: 作多次与同一原子相连.例如:
第三章 立体化学基础

将下列化合物改写成Fischer投影式,并标出手性碳构型。
COOH C H CH3 Cl
COOH H Cl (R) CH3H3C来自COOH C Cl H
COOH H Cl (R) CH3
顺序最小的原子(或基团)在竖线上, 顺时针排列为R构型, 逆时针排列为S构型。 顺序最小的原子(或基团)在横线上, 顺时针排列为S构型,
第三章 立体化学基础 一. 概述 讨论分子的立体形象及与物理性
静态立体化学 质的关系等。 立体化学 动态立体化学
讨论分子的立体形象对化学反应 性的影响及产物分子和反应物分 子在立体结构上的关系等。
• 原子在分子内的空间位置; • 在反应中, 分子内或分子间的原子重新组合, 在空间上的 要求条件和变化过程如何及由此如何决定产物分子中各 原子的空间向位?
3) 旋转轴对称因素 (Cn)
H CH3 H CH3 HO H H H COOH H OH COOH
N
H H H CH3
CH3
C2
C2
C3
C2
无
有
无
有
只含旋转轴对称因素的分子是手性分子。
4) 反射轴对称因素(Sn)
Cl H3C H H H Cl H CH3
Cl
Cl
CH3 H
旋转180o
H H3C H H Cl
如何确定一个活性物质是+60o的右旋体还是-300o的左旋体 比旋光度 [] =
t
?
a
C(g/ml) l(dm)
(物理常数)
例:从粥样硬化动脉中分离出来的胆甾醇0.5g溶解于20ml 氯仿, 并放入1dm的测量管中, 测得旋光度-0.76o. 求其比
旋光度。(-30.4o)
有机化学基础知识点整理立体化学的基本概念与表示方法

有机化学基础知识点整理立体化学的基本概念与表示方法有机化学基础知识点整理——立体化学的基本概念与表示方法立体化学是有机化学中的重要分支,研究有机化合物中分子空间结构和立体异构体的性质与反应规律。
本文将对立体化学的基本概念与表示方法进行整理与介绍。
一、立体化学的基本概念1. 立体异构体:指在化学式相同、分子式相同的情况下,分子结构排列不同而具有不同性质的化合物,称为立体异构体。
立体异构体分为构象异构体和对映异构体两大类。
2. 立体异构体的原因:分子由于碳原子的四个价键都可以自由旋转,导致构象异构体的产生。
对映异构体则由于分子内部存在不对称碳原子或手性中心,使得它们的镜像体不能重合。
3. 立体异构体的性质:立体异构体在物理性质和化学性质上有所区别,例如物理性质如熔点、沸点、密度等差异明显,化学性质如对外界的反应、催化剂的选择等也有较大差异。
二、立体化学的表示方法1. 立体表示法:主要有盘状投影式、锥面式、楔面式和Fischer式等。
a. 盘状投影式:将分子按水平投影在纸面上,使用实线表示平面内的键,棱柱形状表示键在平面之上,圆圈表示键在平面之下。
b. 锥面式:将分子沿轴线向外投影,用三角形表示键在轴线上方,用带状表示键在轴线下方。
c. 楔面式:将分子通过楔形物理模型或立体图形展示,用楔形箭头表示键在垂直于纸面的方向上,用缺口箭头表示键在纸面下方。
d. Fischer式:以垂直于纸面的轴线为支架,将分子垂直展示,左右的羰基或羟基用垂直于轴线的线条表示。
2. 立体描述法:包括立体描述词、R/S命名法、E/Z命名法和Fukui-Liontelli规则等。
a. 立体描述词:用于描述分子中的任意一个手性中心或不对称碳原子的构型,一般为S、R两个字母的组合。
b. R/S命名法:适用于手性中心为单一物种构成的有机分子,根据规定的优先级顺序(按原子序数决定),通过相互对应的方式命名为R(草莓糖)或S(山梨糖)。
c. E/Z命名法:适用于存在双键的有机分子,根据优先级顺序,通过相互对应命名为E(德恩斯烯)或Z(沙通烯)。
有机化学基础知识点整理立体化学的基本概念与应用

有机化学基础知识点整理立体化学的基本概念与应用在有机化学中,立体化学是一个重要的分支领域,它研究的是分子和化合物的三维结构及其对化学性质的影响。
立体化学的概念和应用在有机化学领域具有举足轻重的地位。
本文将对有机化学中的立体化学进行基本概念的整理,并探讨其在化学研究与应用中的重要性。
一、立体化学的基本概念1. 手性:手性是立体化学的一个重要概念,指的是分子或离子的不可重合的镜像异构体。
手性分子无法通过旋转或挪动使其镜像与原分子完全重合,就好像左手和右手无法完全重合一样。
2. 构象异构体:构象异构体指的是同分子式、同结构式但不同空间构型的异构体。
构象异构体的存在是由于分子的键旋转或自由转位所引起的。
典型的构象异构体如反式异构体和顺式异构体等。
3. 立体异构体:立体异构体指的是具有不同立体构型的分子或化合物。
常见的立体异构体有立体异构体、顺反异构体、环异构体等。
立体异构体的存在表明分子或化合物在空间上具有多种不同的构型。
4. 立体中心:立体中心是指一个分子中与不同基团相连的一个原子。
立体中心通常是由于其所连接的基团不对称而导致的。
一个分子可以有一个或多个立体中心。
5. 伪旋光体系:伪旋光体系是一种没有旋光性质的化合物与另一种旋光体系混合而形成的旋光体系。
这种混合体系的旋光性质来源于两个(或多个)异构体存在的旋光性质的合成。
二、立体化学的应用1. 手性药物:手性药物是指那些由手性分子构成的药物。
由于手性药物和其镜像异构体具有不同的生物活性,所以对于手性药物的合成和分离有着重要的意义。
立体化学在药物研发和制备中发挥着重要作用。
2. 光学活性物质:光学活性物质是指那些能够旋转平面偏振光的化合物。
通过立体异构体的性质,光学活性物质可以用于制备偏光镜、偏振片等光学器件,同时也广泛应用于化学分析和手性分离等领域。
3. 反应立体化学:立体化学对于有机反应的研究和理解具有重要意义。
通过研究反应的立体选择性、选择性和环境中对于反应物立体异构体的识别能力,可以更好地设计有机反应和催化剂的设计。
第三章立体化学基础

2、D/L命名法 这是与(+)—甘油醛比较得出的,故用 这种方法标记的构型叫相对构型。 当一个光活性化合物在发生反应时,只 要不对称中心的键不发生断裂,分子的空 间构型就保持不变。例如:
CHO H OH CH 2OH D-(+)-甘油醛 [O] H COOH [H] OH CH 2OH D-(-)-甘油酸 H CH 3 D-(-)-乳酸 OH COOH
COOH
OH
H
OH
CH3
CH3
例如:(+)- 酒石酸
COOH H HO C C OH H
H HO COOH OH H COOH
透视式
COOH
Fischer投影式
例如: COOH
H C OH Fischer 投影式 HO
CH3
COOH H CH3
CHO H C CH3 Fischer 投影式 H CHO NH2 CH3
H3 C C2 H5 H OH
-OH >-CH2CH3 >-CH3 > H
R-2-丁醇
(3)若手性碳连有含重键的基团时,则可 看作多次与同一原子相连。例如:
-CHO < H,O,O
H3C CHO H CH2OH
-COOH O,O,O
< -CH2SH H,H,S (S>O)
-CHO>-CH2OH>-CH3>H
Fischer规定D-(+)甘油醛的Fischer投影式如下:
CHO H OH CH2OH HO CHO H CH2OH
D-(+)甘油醛
L-(-)甘油醛
羟基在右边即为D-型,在左边为L-型。 将其他手性化合物的Fischer投影式与甘油醛的 比较,若手性碳上的取代基写在碳的右边, 就称该化合物为D-型;反之,为L-型。
立体化学基础

(2)取代环己烷的构象
当环己烷分子中的一个氢被其它基团取代时,可取代 a键,也可以取代e键,得到两种不同的构象。
甲基环己烷:
优势构象(95%)
22
(2)取代环己烷的构象
取代环己烷优势构象判断的一般规律: 一元取代环己烷,e键取代最稳定; 多个相同取代基的环己烷,e键取代最多的
构象最稳定; 含不同的取代基的环己烷,较大的基团在e
键(平伏键)或e键。
18
椅式构象中的横键和竖键
竖键(a)
横键(e)
三上三下, 三左三右, ae夹角109°
19
(2)椅式构象中的横键和竖键
翻环作用: 当环己烷的一个椅式构象转变为另一个椅 式构象时,原来的a键将转变为e键,而e键也相应 转变为a键。
20
椅式构象中的横键和竖键 椅式构象的特点:
① 椅式构象中1.3.5碳在一个平面, 2.4.6碳在另一平面,两平面相距 0.5nm。 ② 分子中有6个α键(直立键),6个 e键(平伏键)。 ③ 构象具有转环作用(104~105次/秒)。
2 x 1.0 = 2.0
2 x 11.4 = 22.8
叔丁基是一个很大的基团,一般占据e键。
26
26
(2)二取代环己烷的构象
某些取代环己烷,张力特别大时,环己烷的椅 式构象会发生变形,甚至会转变为船式构象
CH3
H3C
CH3
C
H
H C(CH3)3
C(CH3)3 C(CH3)3
H
椅式
船式 优势构象
27
CH3
(2)
Br
(H3C)3C Br
H
OH OH
CH3 H
OH
H O
大一立体化学知识点

大一立体化学知识点化学是一门研究物质组成、性质和变化的科学,立体化学作为化学的一个重要分支,研究的是分子和它们之间的空间排列关系对化学性质的影响。
在大一学习化学的过程中,也会接触到一些立体化学的基础知识点。
本文将介绍一些大一阶段的立体化学知识点。
1. 手性与不对称在化学中,分子的手性与不对称性是非常重要的概念。
手性是指分子或物体与它的镜像非重合的性质。
分子的手性可以通过一个实验室常见的手性溶剂 - 果糖来研究。
果糖能够使光线偏振,而具有手性的分子可以使光线旋转。
手性分子中手性中心的数量与分子的手性有关。
2. 立体异构体立体异构体是指化学结构相同但空间构型不同的分子。
立体异构体包括构象异构体和对映异构体。
构象异构体是由于分子构型的空间旋转或振动引起的。
例如,环状化合物的构象异构体就是由于分子内部环的扭曲导致的不同构型。
对映异构体则是指立体异构体中,分子的镜像不重合。
对映异构体对许多化学现象有着重要的影响,例如药物效果和生物活性。
3. 构象表示法为了方便描述分子的构象,化学家发展了许多构象表示法。
其中最常用的是Newman投影式、Haworth式等。
Newman投影式适用于描述直线分子的构象,将分子按照键轴的不同方向展示。
Haworth式主要用于描述糖类化合物的构象,将分子呈环状结构,通过短线和长线表示不同的取向。
4. 立体化合物的合成在有机化学中,立体化合物的合成是一个重要的研究领域。
合成立体化合物的方法主要包括手性合成和对映选择性反应。
手性合成主要用于合成具有特定手性的分子,常用的手性合成方法包括对映选择性催化剂、手性求核试剂等。
对映选择性反应则是指在反应中选择性地生成对映异构体。
5. 立体化学在生物学中的应用立体化学在生物学中有着广泛的应用。
生物体内的许多分子都具有手性,手性的差异可以导致生物活性的差异。
例如,药物的对映异构体可能具有不同的药效和毒性。
另外,生物体内的酶对手性分子也具有高度的选择性,这种立体选择性对于生物反应的发生起着关键的作用。
有机化学基础知识点立体化学的基本概念

有机化学基础知识点立体化学的基本概念立体化学是有机化学中非常重要的一个概念,它涉及到分子的空间结构和构象。
在有机化学反应中,分子的立体构型对反应的速率和产物的选择性有着重要的影响。
本文将介绍立体化学的基本概念,包括立体异构、手性分子、构象等知识点。
1. 立体异构立体异构是指化学物质的分子在空间中的排列方式不同,从而导致其化学性质与物理性质的差异。
立体异构可以分为构造异构和空间异构两种类型。
1.1 构造异构构造异构是指分子结构的连接方式不同,分为链式异构、官能团异构和位置异构三种类型。
链式异构:同分子式下,碳骨架的排列方式不同,如正丁烷和异丁烷就是一对链式异构体。
官能团异构:同分子式下,分子中的官能团位置不同,如乙醇和甲醚就是一对官能团异构体。
位置异构:同分子式下,官能团位置相对于主链排列的位置不同,如2-丁醇和3-丁醇就是一对位置异构体。
1.2 空间异构空间异构是指分子在空间中的三维排列方式不同,分为立体异构和对映异构两种类型。
立体异构:分子中存在非自由旋转的键,由于旋转受限,使得分子结构不同,如顺式-反式异构。
对映异构:对称分子具有镜像关系,不能通过旋转重叠,如手性分子。
2. 手性分子手性分子是指与其镜像物不可重叠的化合物,也称为不对称分子。
手性分子通常包含一个或多个手性中心,手性中心是一个碳原子,与四个不同的基团连接。
手性分子的最重要特征是其对映异构体的存在。
对映异构体具有相同的分子式、相同的化学键,但是无法通过旋转或平移重叠。
这种现象称为手性体。
手性分子有很多实际应用,如生物活性物质、药物、拆分光等。
同时,手性分子还涉及到光学活性、旋光度等概念。
3. 构象构象是指分子在空间中的不同取向,由于化学键的旋转、振动等运动而引起的。
构象是立体化学中的重要概念之一,它与立体异构密切相关。
分子的构象由于化学键的自由旋转而产生,通常与键长、键角、键的取代基团等因素有关。
构象的改变可能会导致分子性能的变化。
有机化学基础知识点立体化学基础概念与手性化合物

有机化学基础知识点立体化学基础概念与手性化合物立体化学基础概念与手性化合物有机化学是研究有机物的结构、性质、合成及其在生物、化工、医学等领域中应用的学科。
其中,立体化学是有机化学的重要基础概念之一。
本文将对立体化学的基础概念以及手性化合物进行介绍。
一、立体化学基础概念1. 手性和对映异构体:在有机化合物中,当它们的空间结构不能通过旋转、平移相互重合时,这些化合物被称为手性化合物。
手性化合物存在对映异构体现象,即它们的立体异构体成对出现,并且互为镜像关系。
例如,人的左右手就是对映异构体。
这两个异构体被称为左旋体(S体)和右旋体(R 体)。
2. 手性中心:手性中心是指化合物中的一个碳原子,它与四个不同的官能团或原子键相连。
由于它的四个取代基在空间上的排列不同,使得它的对映异构体产生。
手性中心常用希腊字母α、β、γ等表示。
3. 还原混合原则:还原混合原则用来判断手性中心的对映异构体的数量。
当一个化合物中有n个手性中心且各个手性中心均是不对称的,那么该化合物的对映异构体数量为2^n。
二、手性化合物手性化合物具有重要的生物活性和光学活性,对人体和环境有着重要的影响。
以下是一些常见的手性化合物和它们的应用:1. 丙氨酸:丙氨酸是一种α-氨基酸,它是生物体内合成蛋白质所必需的。
丙氨酸具有手性中心,存在左旋体(L-丙氨酸)和右旋体(D-丙氨酸)。
它们在构型上相似,但在生物活性上却有很大差别。
2. 扑热息痛:扑热息痛是一种常见的退烧镇痛药。
它的左旋体(S-扑热息痛)具有镇痛和退烧的作用,而右旋体(R-扑热息痛)则没有这种作用。
这也是为什么在合成和制药过程中要求生产单一对映异构体的原因之一。
3. 手性催化剂:手性催化剂是一类广泛应用于有机合成领域的手性化合物。
它们能够在催化反应中选择性地促使某个位点的反应,从而获得高产率和高对映选择性的产物。
手性催化剂对于药物合成和农业化学品的合成具有重要的意义。
三、总结立体化学基础概念与手性化合物是有机化学中的重要内容。
2024年有机化学立体化学

有机化学立体化学一、引言有机化学是研究碳化合物及其衍生物的化学分支,而立体化学是有机化学的一个重要分支,主要研究有机化合物的立体结构、立体异构现象以及立体化学在有机反应中的应用。
在有机化学中,立体化学占据着举足轻重的地位,因为许多有机化合物的性质和反应都与它们的立体结构密切相关。
本文将简要介绍有机化学立体化学的基本概念、立体异构现象以及立体化学在有机反应中的应用。
二、立体化学基本概念1.立体结构:立体结构是指分子中原子在空间的排列方式。
在有机化学中,立体结构可以分为两类:构型和构象。
构型是指分子中原子固定的空间排列方式,如顺式异构和反式异构;构象是指分子中原子在空间可以自由旋转的排列方式,如船式构象和椅式构象。
2.立体异构:立体异构是指分子式相同、结构式不同的有机化合物。
立体异构体可以分为两类:对映异构体和非对映异构体。
对映异构体是指具有镜像对称关系的立体异构体,如左旋体和右旋体;非对映异构体是指不具有镜像对称关系的立体异构体,如顺式异构和反式异构。
三、立体异构现象1.对映异构:对映异构体是指具有镜像对称关系的立体异构体。
在有机化学中,对映异构体的存在导致了化合物的旋光性质。
旋光性质是指有机化合物能使偏振光旋转一定的角度。
对映异构体的旋光方向相反,旋光角度相等。
对映异构体的分离和制备是有机化学中一个重要的研究方向。
2.非对映异构:非对映异构体是指不具有镜像对称关系的立体异构体。
在有机化学中,非对映异构体的存在导致了化合物的化学性质和物理性质的不同。
非对映异构体的分离和制备也是有机化学中一个重要的研究方向。
四、立体化学在有机反应中的应用1.立体选择性反应:在有机反应中,立体选择性反应是指反应物优先与某种立体异构体发生反应。
立体选择性反应可以通过选择适当的反应条件和催化剂来实现。
立体选择性反应在合成手性化合物中具有重要意义。
2.立体专一性反应:在有机反应中,立体专一性反应是指反应物只与某种立体异构体发生反应。
有机化学第三章立体化学基础

H
HO
CHO
C H2O H
R
H
HO
CHO
C H2O H
结论:当最小基团处于竖键位置时,其余三个基 团从大到小的顺序若为顺时针,其构型为R;反 之,构型为S。
判断基团大小的依据是我们已经熟悉的顺 序规则
OH
COOH
COOH
COOH
CH HOOC CH3
(S)-
CH
CH3
OH
(S)-
C H
HO CH3 (R)-
Cl
Cl
H
H
-
H
(二) 判别手性分子的依据
A.有对称面、对称中心、交替对称轴的分子均可 与其镜象重叠,是非手性分子;反之,为手性分子。
至于对称轴并不能作为分子是否具有手性的判据。
B.大多数非手性分子都有对称轴或对称中心, 只有交替对称轴而无对称面或对称中心的化合物是 少数。
∴既无对称面也没有对称中心的,一般 判定为是手性分子。
如果在两个棱镜之间放一个盛液管,里面装 入两种不同的物质。
亮
丙酸
α
暗
亮
乳酸
结论: 物质有两类:
(1)旋光性物质——能使偏振光振动面旋转的性质, 叫做旋光性;具有旋光性的物质,叫做旋光性物质。
(2)非旋光性物质——不具有旋光性的物质,叫做 非旋光性物质。
旋光性物质使偏振光旋转的角度,称为旋光度,
以“α”表示。
COOH
H CH3CH2 COOH
CH3
COOH H CH2CH3
CH3
CH3 H COOH
CH2CH3
S
S
S
S
试判断下列Fischer投影式中与(s)-2-甲基丁酸成对 映关系的有哪几个?
[化学]第三章立体化学PPT课件
![[化学]第三章立体化学PPT课件](https://img.taocdn.com/s3/m/d5f5aa96f605cc1755270722192e453610665bdc.png)
.
39
具有对称轴的分子不一定没有旋光性
Cl C
H
H C
Cl
具有二重对称轴,有 对称面,没有旋光性
H Cl
H
HH
Cl
Cl
H
Cl Cl HH
.
具有二重对 H 称轴,有旋 Cl 光性
40
更替对称轴(Sn)
如果一个分子沿一根轴旋转了360°/n的角度以后, 再用一面垂直于该轴的镜象将分子反射,所得的镜 象如能与原物重合,此轴即为该分子的n重更替对称 轴(用Sn表示)。
常用比旋光度
t
来表示物质的旋光属性。
如:肌肉乳酸的比旋光度为
20
D
=+0.38°,发酵乳
酸的比旋光度为:
20
D
=-0.38°
t
B l
α: 旋光仪的旋光度
ρB: 质量浓度(g/ml) l: 盛液管的长度(分米) t: 测定时的温度
λ.: 光源的波长(一般采用3钠2 光
波长为589.3nm,用符号D表示)
HO
C H 3C
H
COOH
HOOC
OH
C CH3
H
O
HC
CH2
H 3C
O
H 2C
CH
CH3
.
38
对称轴(Cn)
如果穿过分子画一直线,分子以它为轴,旋转一 定角度后,可以获得与原来分子相同的形象,此直线 即为对称轴(Cn表示)。
当分子沿轴旋转360°/n,得到的构型与原来的分 子相重合,这个轴即为该分子的n重对称轴。
180o
CH3
OH
H
CH3
COOH
.
6
改变构型的操作: 1.在纸平面上旋转90º或270º, 2.离开纸面旋转,
有机化学基础知识点立体化学基础概念

有机化学基础知识点立体化学基础概念有机化学中的立体化学是研究有机分子空间构型和立体化学性质的重要分支。
立体化学关注分子中的空间排列方式,包括分子的手性、立体异构体和立体反应等内容。
本文将介绍有机化学中的一些基础立体化学概念。
1. 手性手性是指分子或物体与其镜像光学异构体不重合的性质。
一个手性分子可以分为左旋体和右旋体两种形式。
在化学中,手性分子的存在对于药物合成和酶催化反应等非常重要。
手性分子的手性来源于其分子结构中的手性中心,即一个碳原子上连接着四个不同取代基团。
2. 立体异构体立体异构体是指分子在空间中构型不同而又无法通过旋转单键使其相互转变的异构体。
立体异构体包括构象异构体和对映异构体两种类型。
2.1 构象异构体构象异构体是由于分子内部化学键的旋转而产生的不同构型的异构体。
构象异构体之间的转换是不需要断裂化学键的,只需要旋转共轭化学键即可。
其中最常见的构象异构体是顺反异构体,即环状化合物中取代基团的位置不同。
2.2 对映异构体对映异构体是指分子在空间中有镜像对称性,但不能通过旋转或挪移使其重合的异构体。
对映异构体分为手性对映异构体和平面对映异构体两种形式。
3. 立体反应立体反应是指在反应中发生分子构型的改变或从一个立体异构体转变为另一个立体异构体的反应。
立体反应可以是顺反异构体之间的互变,也可以是对映异构体之间的互变。
在立体反应中,空间位阻是一个关键的因素。
分子中的取代基团会引起空间位阻,从而影响分子的反应性质和选择性。
例如,在烷基化反应中,取代基团的位置对于反应速率和产物构型具有重要影响。
4. 立体化学表示法为了方便描述分子的立体构型,化学家们提出了多种立体表示法。
常见的立体化学表示法包括:4.1 立体式投影图立体式投影图是将分子在平面上投影成线条的方式,用来表示分子的立体构型。
在立体式投影图中,立体中心用一个交叉表示,取代基团则通过水平或垂直线条连接到立体中心。
4.2 锥式投影图锥式投影图是一种三维表示法,将分子在空间中呈锥形展开。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C H3
H
C H3
H
H
H
III 邻位12交0。叉式
H CH3
H H3C
H H
VI 部分30重0。叠式
注意:常温下,丁烷主要是以对位交叉式存在。
2.丁烷的构象
丁烷的构象能量曲线图:
稳定性次序: 对位交叉式>邻位交叉式>部分重叠式>全重叠式
3.1.2 环己烷及其衍生物的构象
(一)椅式构象和船式构象
椅式构象
3.1 构象异构
(一)烷烃的结构
甲烷分子的形成: ∵ CH4中的4个杂化轨道为四面体构型(sp3杂化) ∴H原子只能从四面体的四个顶点进行重叠(因为顶
点方向电子云密度最大),形成4个σsp3-s键。
乙烷、丙烷、丁烷中的碳原子也都采取sp3杂化:
sp3 -sp3
H
H
HC CH
H
H
sp3 -s
乙烷
内容提要: 3.1 构象异构
烷烃构象异构 环烷烃构象异构
3.2 顺反异构:产生的条件和标记。
3.3 对映异构:手性碳原子和构型标记。
教学要求与学时:
1.掌握讨论各类立体异构现象:构象异构、顺 反异构和对映异构的产生原因、表达方式、构 型标记以及相关的基本概念; 2.了解它们的性质及其在生物医学上的应用, 同时为后续章节的学习打下立体化学基础。
H
ee
A
ee
B
H
ea
H
B
A ae
H
反式(ee稠合) 顺式(ae稠合)
(五) 十氢化萘的构象
•十氢化萘有两个异构体,稠合碳(C1、C6) 上的两个氢位于萘环平面同侧的为顺式,异侧 的为反式。
•反式分子的排列平展开阔,无空间张力;顺 式分子呈盆状,排列拥挤。
•沿C1-C6键观察,反式结构中异环亚甲基都处 于对位交叉,而在顺式结构中异环亚甲基都处 于邻位交叉位,因此反式比顺式稳定。
CH3 CH3
C(CH 3)3 CH3
(2)
Br
H H3C
(H3C)3C
H
Br
CH(CH 3)2
CH3 H
H
CH3 H
练习
2.下列构象中哪一个是 的优势构象?
CH3 H
H C(CH3)3
(3)
CH3
C(CH3)3 A
C(CH3)3
CH3 C(CH3)3 B
CH3 C(CH3)3
(B)
CH3
C
D
3.2 烯烃的顺反异构
HH
重叠式:
H H
H H
能量高,不稳定(因非 键张力大),一般含
0.5%
H
交叉式: H
H
注意:
H
H
H
非键张力小,能量 低,稳定。一般含 99.5%
室温下不能将乙烷的两种构象分离,因单
键旋转能垒很低(~12.6KJ/mol)
以能量为纵坐标,以单键的旋转角度为横坐标作图, 乙烷的能量变换曲线如下:
HH
H3C C=C H
H
CH3
反-2-丁烯
II(B)
CH3 CH2=C-CH 3
2-甲基丙烯 (异丁烯)
III
1、形成顺反异构的条件: ①必要条件:有限制碳碳键自由旋转的因素 ②充分条件:每个双键碳原子必须连接两个 不同的原子或原子团。
H 例如,1-丁烯: CH2=C CH2CH3
没有顺反异构
2-丁烯的顺反异构:
H
H4 H5
6H
H
1
0.250nm
HH
HH
3
2
H
0.227nm H
10000
:
1
椅式
船式
/kJ·mol
半椅式
势 能
船式
5.4
46
-
1
扭船式
23.5
椅式
O
环己烷构象转换的势能图
(二)椅式构象中的横键和竖键
在12个碳氢键中,有6个键与对称轴平行,叫竖键 (直立键)或称a(axial)键。另外6个键几乎垂直于 对称轴,叫做横键(平伏键)或e(equatorial)键。
叔丁基是一个很大的基团,一般占据e键。
34
(四)二取代环己烷的构象
某些取代环己烷,张力特别大时,环己烷 的椅式构象会发生变形,甚至会转变为船 式构象
CH3
H3C
CH3
C
H
H C(CH3)3
C(CH3)3 C(CH3)3
H
椅式
船式 优势构象
(五) 十氢化萘的构象
10
2
9
1
3
8
6
4
7
5
Decahydronaphthalene
的范氏半径之和240pm,无范氏张力。
H
251pm
H
5
H
1
H H3
4
H 5H
H
6
H
H
2
6
H
4
H
3
H
249pm
H
2
H H
1
H H
250pm
椅式构象的Newman投影式
H
H
环己烷的椅式构象为无张力环
五、环己烷及其衍生物的构象
环己烷的船式构象
Hf
183pm
Hf
H4 H5
6H
H
1
250pm
HH
HH
3
2
H
22 (C)
-C CH 可看作 -C C-H -CH=CH2 可看作 -C C-H
(C) (C)
HH
∴ -CCH > -CH=CH2
例:
(H,H,C)C
CH3CH2 C=C CH3
(H,H,H)C
C(C,C,H)
CH(CH3)2
CH2CH2CH3
C(C,H,H)
Z-3-× ¡¡ ù -4-¡ ì ± ¡¡ ù -3-¡¡
(H,H,C)C,(H,H,C)C
C(C,C,C)
CH3CH2CH2 C=C C CH
CH3CH2
CH=CH2
(H,H,H)C,(H,H,C)C
2、分子中有6个α键(直立键),6个 e键(平伏键)。 3、构象具有转环作用(104-105次/秒)。
(三)一取代环己烷的构象
当环己烷分子中的一个氢被其它基团取代时,可取代 a键,也可以取代e键,得到两种不同的构象。 甲基环己烷:
优势构象(95%)
(四)二取代环己烷的构象
取代环己烷优势构象判断的一般规律: 一元取代环己烷,e键取代最稳定; 多个相同取代基的环己烷,e键取代最多的
(Chair form)
56 1
43
2
碳2、3、5、6在同一平面上是椅座。
碳1、2、6在同一平面上是椅背。
碳4、3、5在同一平面上是椅腿。
船式构象
(boat form)
4 5 3
1 6
2
碳2、3、5、6在同一平面上是船底。 碳1、4在同一侧是船头。
椅式构象张力分析:
角 张 力:键角为正常的109°28’,无角张力 扭转张力:相邻碳上的氢都是交叉式构象,无扭转张力 范氏张力:相互邻近氢之间的距离都大于两个氢原子
C
C
C
C
对称轴
Csp3— Csp3
σ键
图 13-3 σ 键的轨道呈轴对称
σ键的特点: ① σ键电子云重叠程度大,键能大,不易断
裂; ② σ键可自由旋转(成键原子绕键轴的相对
旋转不改变电子云的 形状); ③ 两核间不能有两个或两个以上的 σ键。
(二)烷烃的构象异构
1、乙烷的构象 (comformation of ethane) 构象:由于围绕C-C单键旋转而产生的分子中各原 子或原子团在空间的排列方式。
两种极限构象式:重叠式和交叉式。
构象的表示方法: 锯架式(sawhorse formula):
重叠式
交叉式
Newman投影式:
(1) 从C-C单键的延线上观察:
前碳
后碳
(2) 固定“前”碳,将“后”碳沿键轴旋转,得到乙烷的 各种构象。
1. 乙烷的构象 (comformation)
Newman投影式:
构象最稳定; 含不同的取代基的环己烷,较大的基团在e
键的构象较稳定。
(四)二取代环己烷的构象
下列异构体中哪一个最稳定?并指出其中的 构象异构体和顺反异构体。
CH3 CH3
C H3C H3
CH3 C H3
顺(a、e取代) 反(e、e取代) 反(a、a取代)
(最稳定) 1,3-和1,4-二甲基环己烷的情况如何?
(二)椅式构象中的横键和竖键
竖键(a)
横键(e)
(二)椅式构象中的横键和竖键
翻环作用: 当环己烷的一个椅式构象转变为另一个椅 式构象时,原来的a键将转变为e键,而e键也相应 转变为a键。
(二)椅式构象中的横键和竖键
椅式构象的特点:
1、椅式构象中1.3.5碳在一个平面, 2.4.6碳在另一平面,两平面相距 0.5nm。
(五) 十氢化萘的构象
反式十氢萘是刚性结构,不能翻环。顺十 氢萘可通过翻环作用,产生构象异构:
H
H8
91 2
10 4 3 7
5
6
1H 2 3 H 9 10 4
85
7
6
顺十氢萘的构象异体
顺十氢萘和反十氢萘两种稠合方式在自然 界广泛存在。
练习
1. 写出下列化合物的优势构象
CH(CH 3)2
(1)
H H
H H
12 .6 kJ/mol
位能
H
H
H
