二元及三元硼酸盐及硅酸盐系统玻璃生成规律
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
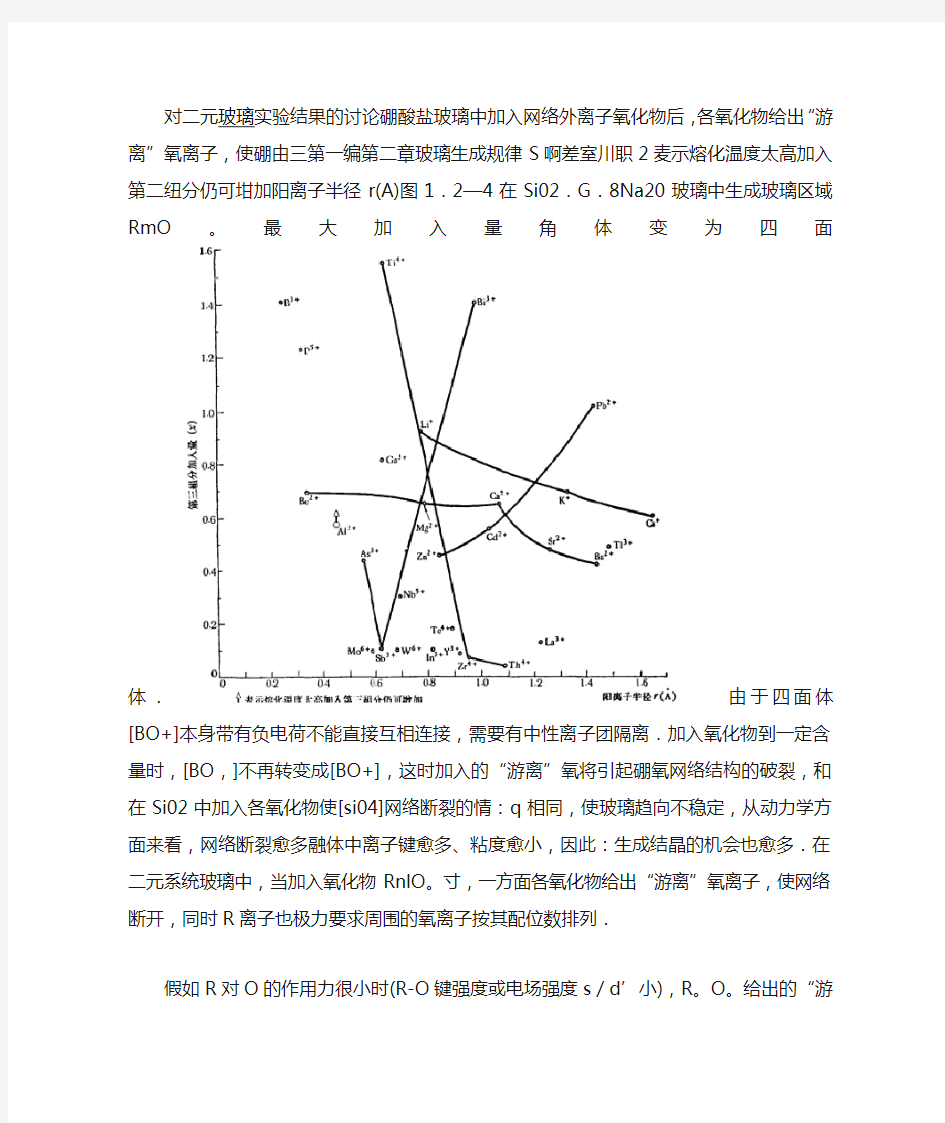
对二元玻璃实验结果的讨论硼酸盐玻璃中加入网络外离子氧化物后,各氧化物给出“游离”氧离子,使硼由三第一编第二章玻璃生成规律S啊差室川职2麦示熔化温度太高加入第二纽分仍可坩加阳离子半径r(A)图1.2—4在Si02.G.8Na20玻璃中生成玻璃区域RmO。最大加入量角体变为四面体.
由于四面体[BO+]本身带有负电荷不能直接互相连接,需要有中性离子团隔离.加入氧化物到一定含量时,[BO,]不再转变成[BO+],这时加入的“游离”氧将引起硼氧网络结构的破裂,和在Si02中加入各氧化物使[si04]网络断裂的情:q相同,使玻璃趋向不稳定,从动力学方面来看,网络断裂愈多融体中离子键愈多、粘度愈小,因此:生成结晶的机会也愈多.在二元系统玻璃中,当加入氧化物RnlO。寸,一方面各氧化物给出“游离”氧离子,使网络断开,同时R离子也极力要求周围的氧离子按其配位数排列.
假如R对O的作用力很小时(R-O键强度或电场强度s/d’小),R。O。给出的“游离”氧促使Si-O-Si断裂,网络结构受R的积聚作用较小,这寸玻璃结晶主要是断网作用所引起.但在阳离子R对O的作用力很大寸(郎窟/。’很大)则阳离子R有可能将周围的氧按其§I.2—4二元及三元硼酸盐及硅酸盐系统玻璃生成规律配位数来排列(图1.2-5)。这样会产生两种结果:i)如R能取得氧而自成带电的四面体[R04]时,则玻璃容易产生分相,如加入B20a,Gs203,A103后易生成[BO,),[Ga04],[A104]等;㈠如阳离子R不能成四面体,则玻璃容易结晶及分相.
因此阳离子R的极化率口小或场强度-/(1’大时,玻璃生成范围远小于斯梯弗斯(Ste~els)1171、慕尔和今冈稔等人所推得的极限.加入三价以上的非玻璃生成休氧化
物.Jx~lL-Xp-\,户o,.户/Nr-八(a)图1.2-5硅氧四面体围绕离子R情况(a)配位数为4;
(b)配位数为6时,则同时存在断网和积聚两种作用.一方面加入每一分子氧化物带入两个以上的氧,如R-O键强度或电场强度较小时,氧将参加到网络中,使两个键断裂.
如R-O键强度及s/d’较大时,则要求按本身需要的配位数排列,产生积聚作用,使玻璃分相和结晶.因此这类氧化物的成玻璃范围极小。氧化铅在硼酸盐或硅酸盐玻璃中,分子百分比超过50寸,仍能成稳定的玻璃.对这种现象,目前还有很多不同的解释,有人孰为由于铅及氧离子的相互极化生成了不对称的六面体[PbOs]‘”’,有人孰为PbO生成两个低矮的四面体‘19),合并成[PbOs],也有人孰为PbO中的pb2+可作为连接的桥,另外有入从吸收光谱改变得出生成四面体(Pb04]的结论[10I.根据玻璃生成范围的试验数据,在硼铅,硅铅玻璃中,氧化铅的分子合量可以超过75g6.在1)203-PbO—耻03玻璃系统中,PbO可达60一?59S;(分子gG),而作为玻璃生成体的B203低于8g6(分子g6)时,仍能成透明的玻璃.由此可见,除了PbO能起玻璃生成体的作用外,用其他观点是较难解释的.
