三层共挤输液用袋,质量标准
醋酸钠注射液,三层共挤输液用袋,相容性

醋酸钠注射液三层共挤输液用袋的相容性研究【摘要】三层共挤输液用袋,其组成材料、生产工艺、整体设计、使用方法是当今输液体系中最理想的包装形式,代表国际一流的最新水平,是今后直接接触输液用包装材料的发展趋势。
三层共挤输液用袋具有很多突出的优点,但依然存在诸多安全性风险,如与药品直接接触的包装材料中的成分有可能会迁移进入药液中,导致产品出现安全性风险。
另外,三层共挤输液用袋可能对主药或辅料产生吸附作用,导致药液中有效成分含量下降,从而影响产品的有效性。
因此,任何大输液药品一旦选择三层共挤输液用袋作直接接触的包装材料,都需要进行药品与三层共挤输液用袋的相容性系统研究。
本文对自主研发的酮洛芬醋酸钠注射液(大输液)与其直接接触的三层共挤输液用袋进行了相容性研究,旨在为该注射液(化学药品注册三类)新药注册及临床应用提供科学依据。
本文提及的包装材料,特指直接接触酮洛芬醋酸钠注射液的三层共挤输液用袋。
在提取试验中,采用了三种提取溶剂,一是用甲苯对三层共挤输液用袋中的抗氧剂进行提取,二是用甲醇浸泡的方式对三层共挤输液用袋袋身中的苯乙烯单体进行提取,测定直接接触的包装材料中抗氧剂及苯乙烯的实际含量;三是用酮洛芬醋酸钠注射液对三层共挤输液用袋进行提取,提取条件模拟灭菌条件,且提取时间比灭菌时间更长。
分别对三层共挤输液用袋袋身、聚丙烯接口及聚丙烯组合盖内盖进行了提取,测定了三层共挤输液用袋中的可提取物,建立了测定抗氧剂168、330、1010、1076与抗氧剂THP-EPQ的高效液相色谱法,建立了测定苯乙烯单体的气相色谱法,并进行了全面的方法学验证。
通过提取试验可以明确包装材料中抗氧剂及苯乙烯单体的种类和数量以及向注射液中迁移的难易程度。
结果:用甲苯对包装材料进行提取,提取液中能检测到上述各抗氧剂,用甲醇对袋身进行提取,提取液中能检测到苯乙烯,且各抗氧剂及苯乙烯的含量均符合欧洲药典对三层共挤输液用袋添加剂的限量规定,表明三层共挤输液用袋各添加剂的添加量符合注射液直接接触包装材料的质量要求,同时也反映出建立的抗氧剂及苯乙烯含量测定方法准确可靠,可用于提取、迁移等相容性试验检测三层共挤输液用袋中抗氧剂及苯乙烯的转移情况;用酮洛芬醋酸钠注射液对三层共挤输液用袋各部分进行提取,提取液中均检测不到各抗氧剂及苯乙烯,表明在模拟灭菌条件且灭菌时间更长的条件下,三层共挤输液用袋中的抗氧剂及苯乙烯,均未溶入酮洛芬醋酸钠注射液中。
三层共挤输液用袋密闭性验证报告

编号:容器密封性验证方案药业股份有限公司1、验证项目:容器密封性验证2、概述:本公司验证小组成员于年月日至年月日对三层共挤输液用袋密封性能进行了验证,考察三层共挤输液用袋在完全浸泡于高浓度运动性菌液4小时后,所有样品均无细菌侵入,可以确认容器密闭系统的完好性。
3、验证目的为考察三层共挤输液用袋的密封性能,通过微生物侵入试验证明三层共挤输液用袋密封性能完好。
4、验证范围:本验证方案适用于三层共挤输液用袋的生产。
5、验证人员5.1质量部QA:负责验证方案及报告的起草及验证的实施。
5.2质量部QC:负责按计划完成验证中的相关检验任务,确保检验结果的正确可靠。
5.3QA主管:负责验证工作的管理,协助验证方案的起草,组织协调验证工作,并总结验证结果。
5.4质量部部长:负责验证方案及报告的审查。
6、概括三层共挤输液用袋密封性试验即微生物侵入试验,是对最终灭菌容器密封系统完好性的挑战性试验。
在验证试验中,取输液袋灌装进培养基,在生产线上封口后灭菌。
然后,将整个袋子完全侵入高浓度运动性菌液中,取出、培养并检查是否有微生物侵入,以确认容器密封系统的完好性。
同时,作阳性对照试验,确认培养基是否有微生物侵入,以确认容器密封系统的完好性。
同时,作阳性对照试验,确认培养基的促菌生长能力。
7、验证内容7.1样品制备7.2营养性试验7.3挑战菌悬液的制备7.4微生物侵入试验8、验证步骤、评价方法及标准8.1试验样品的制备8.1.1试验方法于制袋灌封机分别取连续运行生产的袋子共计150个,按袋子的装量规格灌装SCDM/2(大豆胰蛋白胨肉汤)培养基,经焊盖后于115℃灭菌30分钟,然后将每袋试样编号平放,使培养基与袋子焊合部位内表面充分接触,在30~35℃下放置14天,并每天记录培养结果。
8.1.2判断标准:所有样品均不应长菌。
8.1.3试验结果:小结:检查人:日期:8.2确认培养基促菌生长能力——营养性试验8.2.1试验方法随机取20个试样,每个试样内接种0.1ml的铜绿假单胞菌(Pseudomonas aeruginosa)ATCC 9027,菌液浓度:10~100CFU/0.1ml。
非PVC多层共挤输液膜物理指标的测试方法

非PVC多层共挤输液膜物理指标的测试方法如果您正寻找非PVC三层共挤输液袋、非PVC五层共挤输液袋的质量提升与控制方案,那么您一定不要错过以下内容。
了解、控制产品质量对企业提升自身形象举足轻重,鉴于三层共挤输液袋、五层共挤输液袋物理指标的重要性,针对国家食品药品监督管理局>对于这些项目的检测要求,特整理如下内容供您参考。
查阅国家食品药品监督管理局>之规定,三层共挤输液用膜(Ⅰ)、袋和五层共挤输液用膜(Ⅰ)、袋需要检测的物理性能有:[b]一、水蒸气透过量测试[/b] 照水蒸气透过量测定法(YBB00092003)第一法(杯式法)测定。
采用温度38℃±0.6℃,相对湿度90%±2%的条件,不得过5.0g/(m2·24h)。
济南兰光机电技术有限公司可供参考的检测仪器1、TSY-T1H型透湿性测试仪执行杯式法标准,三腔测试。
全自动测量,自带微型打印机,方便操作,测试周期短,效率高。
2、TSY-T3型透湿性测试仪执行杯式法标准,全球唯一十二腔全自动测试,效率高。
测试周期短,更适合大测试量的检测要求。
[b]二、氧气透过量、氮气透过量测试[/b] 这两项指标均要求按照气体透过测定法(YBB00082003)第一法(压差法)测定,其中氧气透过量不得过1200cm3/(m2·24h·0.1MPa),氮气透过量不得过600 cm3/(m2·24h·0.1MPa)。
济南兰光机电技术有限公司可供参考的检测仪器1、V AC-V1型压差法气体渗透仪执行压差法原理,可对氧气、氮气、二氧化碳等气体的透过量进行测试,具备自控温功能,控温范围:室温~50℃,具拟合功能,可随意获取-273℃~200℃的材料透气量和透气系数、溶解度系数、扩散系数等数据。
测试模式单腔测试。
2、V AC-V2型压差法气体渗透仪执行压差法原理,可对氧气、氮气、二氧化碳等气体的透过量进行测试,具备自控温功能,控温范围:5℃~75℃,具拟合功能,可随意获取-273℃~200℃的材料透气量和透气系数、溶解度系数、扩散系数等数据。
三层共挤输液用袋,质量标准

Q/有限公司企业标准三层共挤输液用袋本标准适用于以聚丙烯为主体材料的三层共挤输液用袋三层共挤输液用袋系指由聚丙烯为主体材料的三层共挤输液用膜通过热合方法制成的输液袋。
【外观】取本品适量,在自然光线明亮处正视目测,应透明、光洁、无肉眼可见的异物。
【鉴别】*(1)显微特征取本品适量,切成适宜厚度,置显微镜下观察,横截面应显示清晰的三层。
(2)红外光谱取本品适量,用切片器切成厚度适宜(小于50卩m的薄片,置于显微红外仪上观察样品横截面。
照包装材料红外光谱测定法(YBB00262004第五法测定,每一层应分别与对照图谱基本一致。
【灭菌适应性试验】除另有规定外,取本品数个,加经0.45卩m孔径滤膜过滤的注射用水至标示容量,并圭寸口。
采用湿热灭菌法(标准灭菌15分钟)灭菌后,进行以下试验:F o值》8,如湿热灭菌121 r,温度适应性取上述样品数个,于-25 r± 2r条件下, ± 2r条件下,继续放置24小时,再在23r± 2 r条件下,放置24小时,然后在50r 放置24小时,将样品置于两平行平板之间,承受67KPa的内压,维持10分钟。
应无液体漏出。
抗跌落取上述样品数个,于-25 r± 2r条件下,放置24小时,然后在5or± 2r 条件下,继续放置24小时,再在23r± 2r条件下放置24小时,按表2的跌落高度,分别跌落于一硬质刚性的光滑表面上,不得有破裂和泄漏。
表2 跌落高度透明度取上述样品数个,另取空袋一个,装入级号为4号的浊度标准液,作为对照袋;在黑色背景下,用白炽灯以2000 lx〜3000 lx照射(避免照射试验人员的眼睛)观察,应能与对照袋区分。
不溶性微粒取上述样品数个,照包装材料不溶性微粒测定法(YBB00272004中输液瓶和输液袋项下的方法测定,粒子直径》5、10、25un粒子数,分别不得过100、20、2 个/ml。
【使用适应性试验】穿刺力除另有规定外,取本品数个,用符合一次性使用输液器重力输液式标准(GB8368-2010的穿刺器,在200mm/mir± 20mm/min的速度下,穿刺袋的穿刺部位,塑料穿刺器穿刺力不得过100N,金属穿刺器穿刺力不得过802 穿刺器保持性和插入点不渗透性除另有规定外,取数个装液袋,先用符合一次性使用输液器重力输液式标准(GB8368-2010)的穿刺器穿刺袋的插入点,然后以200mm/mi± 20mm/min的速度拔下穿刺器,塑料穿刺器分离力不得低于 5.0N,金属穿刺器分离力不得低于1.0N。
YBB00102005三层共挤输液用膜、袋

YBB00102005三层共挤输液用膜、袋国家药品包装容器(材料)标准(试行)YBB聚丙烯/聚丙烯/聚丙烯三层共挤输液用膜、袋Jübingxi/Jübingxi/Jübingxi Sanceng Gongji Shuyeyong Mo DaiPP/PP/PP 3-layer Co-extrusion Films and Bags Used for Infusion聚丙烯/聚丙烯/聚丙烯三层共挤膜系指以聚丙烯为主体,采纳共挤出工艺,不使用黏合剂所形成的三层输液用膜。
袋系指由聚丙烯/聚丙烯/聚丙烯三层共挤输液用膜通过热合方法制成的输液袋。
【外观】取本品适量,在自然光线明亮处正视目测,应透亮、光洁、无肉眼可见的异物。
【鉴不】*(1)显微特点取本品适量,切成适宜厚度,置显微镜下观看,横截面应显示清晰的三层。
(2)红外光谱取本品适量,用切片器切成厚度适宜(小于50μm)的薄片,置于显微红外仪上观看样品横截面。
照包装材料红外光谱测定法(YBB00262004)第五法测定,每一层应分不与对比图谱差不多一致。
【灭菌适应性试验】(袋)除另有规定外,取本品数个,加经0.45μm 孔径滤膜过滤的注射用水至标示容量,并封口。
采纳湿热灭菌法(标准灭菌F0值≥8,如湿热灭菌121℃,15分钟)灭菌后,进行以下试验:温度适应性取上述样品数个,于-25℃±2℃条件下,放置24小时,然后在50℃±2℃条件下,连续放置24小时,再在23℃±2℃条件下,放置24小时,将样品置于两平行平板之间,承担67KPa的内压,坚持10分钟。
应无液体漏出。
抗跌落取上述样品数个,于-25℃±2℃条件下,放置24小时,然后在50℃±2℃条件下,连续放置24小时,再在23℃±2℃条件下放置24小时,按表1的跌落高度,分不跌落于一硬质刚性的光滑表面上,不得有破裂和泄漏。
多层共挤输液用膜、袋检验标准操作规程

范围:多层共挤输液用膜、袋职责:检验室对本规程的实施负责正文:1.膜的检测1.1外观——取本品适量,在自然光线明亮处目测,应透明、光洁、内外应无肉眼可见的异物。
1.2鉴别——红外光谱取样品适量敷于微热的溴化钾晶片上,依法测定,应与对照图谱基本一致。
1.3水蒸汽渗透——取本品平整部位,照塑料薄膜和片材透水蒸汽性试验方法杯式法(GB/T1037-88)测定,采用温度23℃±2℃,相对湿度90%±5%的条件,不得过5.0g/(m2·24h)。
1.4氧气透过量——取本品平整部位,照塑料薄膜透气性试验方法(GB/T1038-2000)测定,不得过1.2×10cm3/(m2·24h·0.1MPa)。
1.5氮气透过量——取本品平整部位,照塑料薄膜和薄片气体透过性试验方法(GB/T1038-2000)测定,不得过600cm3/(m2·24h·0.1MPa)。
1.6拉伸强度——取本品平整部位,照塑料薄膜拉伸性能试验方法(GB/T13022-91)规定进行,试样为Ⅱ型,试验速度(空载)300mm/min±30mm/min,纵向、横向抗拉强度平均值均不得低于20Mpa。
1.7热合强度——取本品适量,均匀截取100mm×100mm试样若干片,将任意的两个试片的内层叠合,放入热封仪。
热合面采用平板式,热合条件:上下面压具温度: 160℃,压力:0.4Mpa,时间:1秒。
用标准试样裁切器,从每个热封部位各裁出15mm宽的试样10条,至少从3个热合面上裁取。
置于拉力试验仪上,将试样两端分别夹在试验仪上、下夹具上,开动拉力试验仪进行剥离,试验速度(空载)300mm/min±30mm/min,测得值均不得低于20N/15mm。
1.8金属元素——取炽灼残渣项下遗留残渣加盐酸(1→2)25ml溶解后,照原子吸收分光光度法测定,应符合以下规定:铜:324.8nm波长处测定,不得过百万分之三;镉:228.8nm 波长处测定,不得过百万分之三;铬:357.9nm波长处测定,不得过百万分之三;铅:217.0nm波长处测定,不得过百万分之三;锡:286.3nm波长处测定,不得过百万分之三;钡:553.6nm波长处测定,不得过百万分之三。
直接接触药品的包装材料和容器的选择依据及质量标准

资料5-5、直接接触药品的包装材料和容器的选择依据及质量标准一、直接接触药品的包装材料和容器:选用由三层共挤输液用膜、塑料输液容器用聚丙烯组合盖(拉环式)、塑料输液容器接口经热合而成的三层共挤输液用袋作为直接接触药品的包装材料和容器。
二、直接接触药品的包装材料和容器的选择依据:大容量注射液,多用于血管输入(静脉、动脉)、腹膜透析CIPD或手术洗液、其见效快,疗效显著,多用于临床急救。
大输液药品质量要求严格,对直接接触药液的药包材质量要求高:无颗粒、无菌、无热原。
自输液产品发明以来,经过近一个世纪的实践与发展,输液产品的包装容器经过了开放式、半开放式和密闭式几个阶段,其包装材料也从最初的普通玻璃瓶发展到现在的三层共挤输液用膜,形成了玻璃瓶、PE和PP塑料瓶及聚烯烃多层共挤输液用膜软袋输液容器共存的局面。
各个国家由于各自国情不同,输液容器的使用情况也有所不同,发达国家使用PP塑料瓶及聚烯烃多层共挤输液用膜软袋输液容器的比列较大,而一些发展中国家仍以使用普通玻璃瓶装输液为主,少量使用PP塑料瓶和聚烯烃多层共挤输液用膜袋装输液。
传统输液容器为玻璃瓶,玻璃瓶输液已经有近百年的历史,在这近百年发展历程中,玻璃瓶经过了几次变革,至今有多种玻璃瓶输液,^即I型、II型、III 型和非1型、非11型玻璃瓶,无论是何种玻璃瓶,都摆脱不了玻璃所存在缺陷的共性,即口部密封性差、产生脱落、胶塞与药液直接接触机率大、质量重、易破损、不便携带和运输能耗高、环境污染大等。
针对玻璃瓶输液容器存在的缺陷,在60年代,世界发达国家开始研究使用高分子材料制造输液容器。
日本在1965年开始开发PE (聚乙烯)塑料瓶做为输液容器,1972年日本大冢公司开始使用PP(聚丙烯)材料的塑料瓶容器,PP塑料瓶输液的性能特点主要为稳定性好,口部密封性好、无脱落物、胶塞不与药液接触、质轻、抗冲击力强、输液产品在生产过程中受污染的机率减少、节约能源,保护环境、使用方便、一次性使用免回收等。
YBB00102005三层共挤输液用膜、袋

YBB00102005三层共挤输液用膜、袋国家药品包装容器(材料)标准(试行)YBB聚丙烯/聚丙烯/聚丙烯三层共挤输液用膜、袋Jübingxi/Jübingxi/Jübingxi Sanceng Gongji Shuyeyong Mo DaiPP/PP/PP 3-layer Co-extrusion Films and Bags Used for Infusion聚丙烯/聚丙烯/聚丙烯三层共挤膜系指以聚丙烯为主体,采纳共挤出工艺,不使用黏合剂所形成的三层输液用膜。
袋系指由聚丙烯/聚丙烯/聚丙烯三层共挤输液用膜通过热合方法制成的输液袋。
【外观】取本品适量,在自然光线明亮处正视目测,应透亮、光洁、无肉眼可见的异物。
【鉴不】*(1)显微特点取本品适量,切成适宜厚度,置显微镜下观看,横截面应显示清晰的三层。
(2)红外光谱取本品适量,用切片器切成厚度适宜(小于50μm)的薄片,置于显微红外仪上观看样品横截面。
照包装材料红外光谱测定法(YBB00262004)第五法测定,每一层应分不与对比图谱差不多一致。
【灭菌适应性试验】(袋)除另有规定外,取本品数个,加经0.45μm 孔径滤膜过滤的注射用水至标示容量,并封口。
采纳湿热灭菌法(标准灭菌F0值≥8,如湿热灭菌121℃,15分钟)灭菌后,进行以下试验:温度适应性取上述样品数个,于-25℃±2℃条件下,放置24小时,然后在50℃±2℃条件下,连续放置24小时,再在23℃±2℃条件下,放置24小时,将样品置于两平行平板之间,承担67KPa的内压,坚持10分钟。
应无液体漏出。
抗跌落取上述样品数个,于-25℃±2℃条件下,放置24小时,然后在50℃±2℃条件下,连续放置24小时,再在23℃±2℃条件下放置24小时,按表1的跌落高度,分不跌落于一硬质刚性的光滑表面上,不得有破裂和泄漏。
低密度聚乙烯药用膜、袋标准

国家食品药品监督管理局国家药品包装容器(材料)标准(试行) YBB00007 2005低密度聚乙烯药用膜、袋标准(试行)本标准适用于以低密度聚乙烯树脂(LDPE)为主要原料采用流涎法、吹制法生产的药用薄膜,及由此薄膜通过热封制成的袋。
本品适用于非无菌固体原料药的包装。
【外观】取本品适量,在自然光线明亮处,正视目测。
表面应光洁、色泽均匀,不得有穿孔、异物、异味、粘连。
袋的热封部位应平整、无虚封。
【鉴别】* (1)红外光谱取本品适量,照包装材料红外光谱测定法(YBB00262004)第四法测定,应与对照图谱基本一致。
(2)密度取本品约2g,浸渍液选用无水乙醇,照密度测定法(YBB00132003)测定,本品的密度应为0.910~0.935g/cm3。
【阻隔性能】水蒸气透过量除另有规定外,取本品适量,照水蒸气透过量测定法(YBB00092003) 第一法杯式法测定,试验温度(38±0.6)℃,相对湿度(90±2)%,不得过15g/(m2·24h)。
氧气透过量除另有规定外,取本品适量,照气体透过量测定法 (YBB00082003)第一法测定,试验温度(23±2)℃,不得过4000cm3/(m2·24h·0.1Mpa)。
【机械性能】拉伸强度取本品适量,照拉伸性能测定法(YBB00112003)测定,试验速度(空载):300mm/min±30mm/min,试样为Ⅰ型。
纵向、横向拉伸强度平均值均不得低于10MPa。
断裂伸长率取本品适量,照拉伸性能测定法(YBB00112003)测定,试验速度(空载):300mm/min±30mm/min,试样为Ⅰ型。
厚度小于0.05mm的膜,纵向、横向断裂伸长率平均值均不得低于130%;厚度大于0.05mm的膜,纵向、横向断裂伸长率平均值均不得低于200%。
【热合强度】膜除另有规定外,裁取100mm×100mm膜片四片,将任意两个膜片叠合,置热封仪上进行热合,热合温度130℃~150℃,压力0.2MPa,时间1秒。
三层共挤输液用膜质量标准

三层共挤输液用膜质量标准国家药品包装容器(材料)标准(试行)YBB00102005三层共挤输液用膜(Ⅰ)、袋Sanceng Gongji Shuyeyong Mo(Ⅰ) Dai3-layer Co-extrusion Films and Bags Used for Infusion聚丙烯/聚丙烯/聚丙烯三层共挤膜系指以聚丙烯为主体,采用共挤出工艺,不使用黏合剂所形成的三层输液用膜。
袋系指由聚丙烯/聚丙烯/聚丙烯三层共挤输液用膜通过热合方法制成的输液袋。
【外观】取本品适量,在自然光线明亮处正视目测,应透明、光洁、无肉眼可见的异物。
【鉴别】*(1)显微特征取本品适量,切成适宜厚度,置显微镜下观察,横截面应显示清晰的三层。
(2)红外光谱取本品适量,用切片器切成厚度适宜(小于50μm)的薄片,置于显微红外仪上观察样品横截面。
照包装材料红外光谱测定法(YBB00262004)第五法测定,每一层应分别与对照图谱基本一致。
【灭菌适应性试验】(袋)除另有规定外,取本品数个,加经0.45μm孔径滤膜过滤的注射用水至标示容量,并封口。
采用湿热灭菌法(标准灭菌F值≥8,如湿热灭菌121℃,15分钟)灭菌后,进行以下试验:温度适应性取上述样品数个,于-25℃±2℃条件下,放置24小时,然后在50℃±2℃条件下,继续放置24小时,再在23℃±2℃条件下,放置24小时,将样品置于两平行平板之间,承受67KPa的内压,维持10分钟。
应无液体漏出。
抗跌落取上述样品数个,于-25℃±2℃条件下,放置24小时,然后在50℃±2℃条件下,继续放置24小时,再在23℃±2℃条件下放置24小时,按表1的跌落高度,分别跌落于一硬质刚性的光滑表面上,不得有破裂和泄漏。
表1 跌落高度标示容量(ml)跌落高度(m)50~749 1.00750~1499 0.751500~2499 0.50≥25000.25透明度取上述样品数个,另取空袋一个,装入级号为4号的浊度标准液,作为对照袋;在黑色背景下,用白炽灯以2000 lx~3000 lx照射(避免照射试验人员的眼睛),观察,应能与对照袋区分。
软袋密封性验证资料

三层共挤输液用袋密封性验证一.概述:1. 验证对象:三层共挤输液用袋2. 验证目的:通过验证确认三层共挤输液用袋的密封性在灭菌前及灭菌后无明显变化。
本次验证按国家药品包装容器(材料)标准YBB00102005 进行检验。
3. 验证小组成员及分工公司职务验证小组职务验证工作职责质量部经理组长验证总负责人,验证方案、验证报告批准,参与偏差处理质量部 QA 负责人组员验证方案、验证报告的审核,参与偏差的处理质量部 QC 负责人组员验证方案中检验项目及方法的审核及组织本部门按照批准的验证方案准确执行,复核部分检验数据,参与验证过程中偏差的调查处理质量部 QA 验证人员组员验证方案的起草及组织本部门按照批准的验证方案准确执行,复核部分检测数据,参与验证过程中偏差的调查处理质量部 QC 验证人员组员按照验证方案进行验证,检测方案中规定的检验项、及时记录并提供验证所需的全部检测数据二.验证内容:1. 温度适应性验证目的:确认使用三层共挤输液用袋的产品在灭菌前、灭菌后及置于不同温度条件下其密封性无明显变化。
检验方法:1)随机取未灭菌产品200 袋(装量为:常规装量),将其置于两平行平板之间,承受67kPa 的内压,维持10 分钟,观察有无液体漏出。
2)按企业确定的灭菌条件对该 200 袋产品进行灭菌。
3)灭菌后将该200 袋产品于-25±2℃条件下,放置24 小时,然后在50℃±2℃条件下,继续放置24 小时,再在23±2℃条件下,放置24 小时,将样品置于两平行平板之间,承受67kPa 的内压,维持10 分钟,观察有无液体漏出。
4)连续3 批产品,以观察其重现性。
接受标准:1)未灭菌产品加压维持后应无液体漏出2)灭菌后产品加压维持后应无液体漏出检查人:质量部 QC2. 抗跌落:验证目的:确认使用三层共挤输液用袋的产品在灭菌前灭菌后与一定高度跌落后其密封性无明显变化检验方法:1)随机取未灭菌产品200 袋(装量为:常规装量), 从1m 高度,分别跌落于异一硬质刚性光滑表面上,观察有无破裂和泄露。
食品包装用多层共挤膜、袋质量通则-最新国标

本文件不适用于多层共挤热收缩膜、袋。
2规范性引用文件下列文件中的内容通过文中的规范性引用而构成本文件必不可少的条款。
其中,注日期的引用文件,仅该日期对应的版本适用于本文件;不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 191包装储运图示标志GB/T 1037-2021 GB/T 1038.1GB/T 1040.3塑料薄膜与薄片水蒸气透过性能测定杯式增重与减重法塑料制品薄膜和薄片气体透过性试验方法第1部分:差压法塑料拉伸性能的测定第3部分:薄膜和薄片的试验条件(ISO 527-3:1995,IDT)透明塑料透光率和雾度的测定计数抽样检验程序第1部分:按接收质量限(AQL)检索的逐批检验抽样计划塑料试样状态调节和试验的标准环境塑料薄膜和薄片厚度的测定机械测量法塑料薄膜和薄片长度和宽度的测定平版装潢印刷品凹版装潢印刷品软质复合塑料材料剥离试验方法塑料薄膜和薄片抗冲击性能试验方法自由落镖法第1部分:梯级法商品条码零售商品编码与条码表示商品条码条码符号放置指南信息技术自动识别与数据采集技术条码符号印刷质量的检验柔性版装潢印刷品第2部分:塑料与金属箔类商品条码条码符号印刷质量的检验包装材料塑料薄膜和薄片氧气透过性试验库仑计检测法GB/T 2410GB/T 2828.1 GB/T 2918GB/T 6672GB/T 6673GB/T 7705GB/T 7707GB/T 8808GB/T 9639.1 GB 12904GB/T 14257GB/T 14258GB/T 17497.2 GB/T 18348GB/T 19789GB/T 26253GB/T 21302GB/T 33259QB/T 1130QB/T 2358塑料薄膜和薄片水蒸气透过率的测定包装用复合膜、袋通则数字印刷质量要求及检验方法塑料直角撕裂性能试验方法塑料薄膜包装袋热合强度试验方法食品包装用多层共挤膜、袋质量通则1范围本文件规定了食品包装用多层共挤膜、袋的分类、要求、试验方法、检验规则、标志、包装、运输和贮存。
116 多层共挤输液用膜、袋质量标准
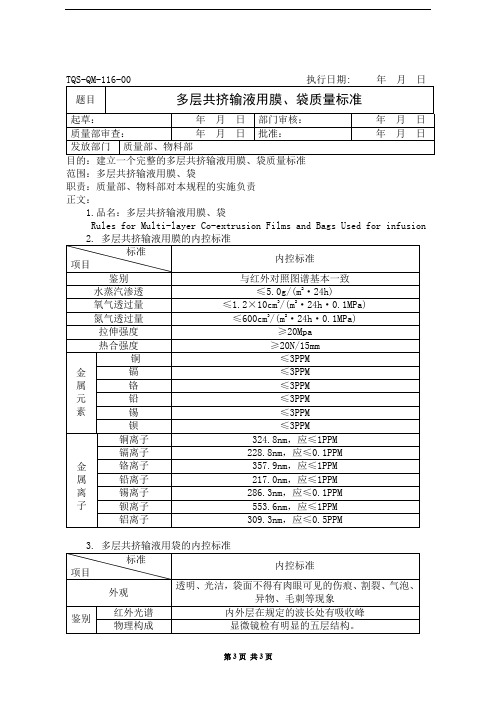
氮气透过量
≤600cm3/(m2·24h·0.1MPa)
拉伸强度
≥20Mpa
热合强度
≥20N/15mm
铜
≤3PPM
金
镉
≤3PPM
属
铬
≤3PPM
元
铅
≤3PPM
素
锡
≤3PPM
钡
≤3PPM
铜离子
324.8nm,应≤1PPM
镉离子
228.8nm,应≤0.1PPM
金
铬离子
357.9nm,应≤1PPM
属
铅离子
217.0nm,应≤1PPM
多层共挤输液用膜、袋质量标准
细菌内毒素
≤0.25EU/ml
细胞毒性
相对增殖度不得过 2 级
生物 试验
致敏试验 皮内刺激试验 急性全身毒性
无致敏反应 无刺激作用 无急性全身毒性
试验
溶血试验
溶血率不得过 5%
3.标准依据:国家药品监督管理局制定的《多层共挤输液用膜、袋通则》制定。
第3页 共3页
重金属
于-25℃±2℃条件下,放置 24 小时,然后在 50℃
±2℃条件下,继续放置 24 小时,再在 23℃±2℃条件
下放置 24 小时,将本品置两平行平板之间,承受 67kPa
ቤተ መጻሕፍቲ ባይዱ
的内压,保压 10 分钟。液体不得漏出。
于-25℃±2℃条件下,放置 24 小时,然后在 50℃
±2℃条件下,继续放置 24 小时,再在 23℃±2℃条件
≥10μ m ≤10 个/ml
≥25μ m ≤1 个/ml
≤80N
用穿刺器穿刺袋的穿刺部位,然后将袋置两个平行
平板之间,施加 20kPa 内压,维持 15 秒,穿刺部位不
多层共挤输液用膜袋通则

多层共挤膜系采用共剂出工工艺,不使用黏合剂所形成的2层以上的膜。
通过热合方法制成的袋输液包装容器的改革看,PVC软袋是针对玻璃瓶的缺点研制的,共挤复合膜是在研究PVC软袋的缺点后研制的替代品一非PVC塑料袋(聚烯烃复合膜/聚烯烃多层共挤膜)上世纪八十年代到九十年代发展起来的聚烯烃复合膜,由内层(聚乙烯)、中层(聚酰胺)、外层(聚丙烯)三层复合膜热合而成。
聚烯烃多层复合膜具有以下特性:1.这种材料坚韧透明,重量轻,有很强的热阻,耐高温灭菌,可在121℃消毒,气透性和水透性极低,可长期保存,不含氯化物和任何增塑剂,是一种理想的包装材料。
2.这种输液袋使用时既可挂,也可借患者自重进行输液(如患者躺着将其压在肩下),可完全自行收缩,输液时不用扎空气针,为真正的封闭输液,可避免输液环境对药液的污染。
3.膜材料的兼容性和稳定性较好,适合大多数药物的包装,如大输液的常规输液、透析液、甲硝唑、环丙沙星等治疗性输液,甚至氨基酸、血浆代用品、脂肪乳也可以使用。
4.生产自动化程度较高,其制袋、印字、灌装、封口可在同一生产线上完成,使用筒膜无需水洗,能更有效地避免生产环节的污染。
据报道Clea-flex复合膜软袋就是一种理想的包装材料。
软袋由三层薄膜组成:内层为聚乙烯,中层为聚酰胺,外层为聚丙烯。
经工艺处理,将三层薄膜粘压在一起,以代替聚氯乙烯,达到使用简单、不污染环境、可装各种药液的目的。
另据报道[12]日本、美国和德国的一些大制药厂已开始使用EVA基复合膜软包装材料。
它是一种以乙烯-乙酸乙烯共聚物(EVA)为基材,与其它高分子材料共混合的多层复合膜材料。
没有毒性、安全可靠,并在加工过程中不需加入任何增塑剂和稳定剂,具有高透明度、光泽性,优异的柔韧性、耐低温、耐老化性等优点。
复合膜为非PVC膜的早期产品,由于只能生产单幅平膜,对生产环境要求较高,而且聚烯烃复合膜在生产过程中在各层膜之间使用了粘合剂,这不利于膜材的稳定,同时粘合剂也对药液的稳定性由潜在的影响,因此目前在制药工业输液剂中的使用正逐渐减少。
HPLC测定三层共挤输液用袋中四种抗氧剂的含量

HPLC测定三层共挤输液用袋中四种抗氧剂的含量徐燕慧(福建省医疗器械与药品包装材料检验所,福建福州350001)摘要:目的 本文建立了测定三层共挤输液用袋中抗氧剂1010、330、1076、168含量的高效液相色谱(HPLC)方法。
方法 采用加热回流方法提取抗氧剂,HPLC检测其含量。
结果 抗氧剂1010、330、1076、168分别在质量浓度(1~200)μg·mL-1、(0 5~200)μg·mL-1、(2~200)μg·mL-1、(3~200)μg·mL-1内具有良好的线性关系(R≥09998),对应的平均回收率分别为99 1%(RSD=2 7%)、95 1%(RSD=1 9%)、97 7%(RSD=2 9%)和96 2%(RSD=2 4%)。
结论 本法操作简便、准确灵敏,可用于测定三层共挤输液用袋中抗氧剂的含量,同时为其使用安全性提供数据参考。
关键词:高效液相色谱法(HPLC);三层共挤输液用袋;抗氧剂中图分类号:R927 文献标识码:A 文章编号:1006 3765(2020) 11 0081 04作者简介:徐燕慧,女(1984 8-)。
厦门大学生物医学工程专业硕士研究生。
职称:工程师。
主要从事医疗器械与药品包装材料检验和药物相容性研究工作。
DeterminationofExtractionContentsforFourKindsofAntioxidantsin3 layerCo extrusionInfusionBagsbyHPLCXUYan hui(FujianProvincialInstituteforMedicalDevicesandPharmaceuticalPackagingMaterials,Fuzhou350001,China)ABSTRACT:OBJECTIVE Todevelopamethodfordeterminationextractioncontentsofantioxidants1010,330,1076and168in3 layerco extrusioninfusionbagsbyHPLC METHODS HeatingrefluxmethodwasadoptedtoextractantioxidantswhichcontentsweredetectedbyHPLC RESULTS Thecalibrationcurvesofantioxidants1010,330,1076and168werelinearovertheconcentrationrangeof(1~200)μg·mL-1、(0 5~200)μg·mL-1、(2~200)μg·mL-1、(3~200)μg·mL-1,respectively(R≥0 9998),thataveragerecoveriesofthean tioxidantscorrespondto99 1%(RSD=2 7%),95 1%(RSD=1 9%),97 7%(RSD=2 9%)and96 2%(RSD=2 4%)CONCLUSTION Theproposedmethodissimple,preciseandsensitive,andcanbeadoptedtodetectthecontentsofantioxidantsin3 layerco extrusioninfusionbag KEYWORDS:HPLC;3 layerco extrusioninfusionbag;Antioxidants 药品包装材料作为药品组成的一部分,其使用安全性一直备受关注。
三层共挤输液用膜、袋质量标准的起草说明英文版

聚丙烯/聚丙烯/聚丙烯三层共挤输液用膜、袋质量标准的起草说明一.概况为了有效地加强对药包材质量的控制,便于生产企业的使用。
聚丙烯/聚丙烯/聚丙烯三层共挤输液用膜、袋质量标准中项目及指标的设立是在参考药包材国家标准多层共挤输液用膜、袋通则(YBB00342002)、日本药局方(14版)及塑料输液容器(ISO 15747 :2003)的相关内容的基础上,按中国药典编写格式进行起草的。
二.关于标准项目设立及要求的说明1.名称根据一个品种一个名称的原则,本标准的名称拟定为聚丙烯/聚丙烯/聚丙烯三层共挤输液用膜、袋。
2.外观采用多层共挤输液用膜、袋通则(YBB00342002)中外观项下的规定。
3.鉴别为了有效的控制产品质量,加强对配方的监控,设置鉴别试验很有必要。
选择的方法皆具有专属性强、重现性好、灵敏度高、操作简便、快速等的特点。
与多层共挤输液用膜、袋通则(YBB00342002)相比,增加了观察材料层数的物理构成项目。
(1)显微特征与通则相比,增加了显微特征这一项目,采用显微镜观察法,可快速、简便的对材料的层数进行定性鉴别。
(2)红外光谱采用多层共挤输液用膜、袋通则(YBB00342002)中红外光谱项下的规定,方法采用包装材料红外光谱测定法(YBB00262004)第五法。
4.灭菌适应性试验、使用适应性试验均采用多层共挤输液用膜、袋通则(YBB00342002)中灭菌适应性试验、使用适应性试验项下的规定,经实验验证,产品基本符合规定。
5.物理性能(1)水蒸气渗透(膜)设置本试验的目的是考察膜材对水蒸气的阻隔能力,试验方法采用水蒸气透过量测定法(YBB00092003)中的第一法,指标采用多层共挤输液用膜、袋通则(YBB00342002)中的规定。
(2)水蒸气渗透(袋)试验方法采用水蒸气透过量测定法(YBB00092003)中的第一法,指标采用多层共挤输液用膜、袋通则(YBB00342002)中的规定。
三层共挤输液用袋标准英文版

The State food and Drug AdministrationNational drug packaging containers (material) standard(interim)YBB00102005 3-layer Co-extrusion Films and Bags Used for Infusion Polypropyrene/ polypropyrene/ polypropyrene three-tier film refers to polypropyrene as the main body to adopt the coextrusion process, do not use adhesive, formed by the three-tier IV film.Bags is made of polypropyrene / polypropyrene / polypropyrene three-tier IV film by rahfu used for infusion.[Appearance] regulations appearance an adequate amount of light in the nature of the rink, the Department should be addressed in a transparent and smooth, non-visible foreign matter.[Identification] * (1) Microscopic characteristics of this product by just the right amount, and cut into appropriate thickness is microscopically, cross section should display a clear third floor.(2) The product is Infrared Spectra taken in moderation, with the thickness of the slicer cut into colussoma (less than 50 μm) adjustableplate, situated at a micro-infrared instrument observation sample cross section. According to the packaging material infrared spectrometry (YBB00262004) method for the determination, each layer should be substantialagreement and electrophoretograms.[Sterilizaion adaptability of bags] except where otherwise provided, the product is a number, and by 0.45 μm pore size filtration of water for injection to nongraphite capacity, and seal. Use the method of sterilization (standard sterilizaion F0 value = 8, such as sterilization of 121℃for 15 minutes) to sterilizaion, make the following experiment:Temperature adaptability said samples or 25℃±2 ℃, placed under the condition of a 24-hour, and then in the 50℃±2 ℃ to continue to be placed under 24 hours, and then on the 23℃±2 ℃, placed under 24 hours, the sample is placed between two parallel plates, 67KPa of hyperteution, the maintenance of up to 10 minutes. Should have no liquid.Resistance to drop the said samples or 25℃±2 ℃, placed under the condition of a 24-hour, and then in the50℃±2 ℃ to continue to be placed under 24 hours, and then on the 23℃±2 ℃in 24 hours will be placed in the condition,according to table 1 drop drop height, respectively, in a stereoplasm on rigid smooth surface without rupture and leak.Transparency the said samples or another empty bag, mount the level number is 4 turbidimetrv of the standard solution, contrast bags; a black background, with gluehlampenwerk to 2000 lx to 3000 lx irradiation experiment (avoiding exposure), the person's eyes, should be able to distinguish between bag with a control.Particulate matter the said samples a few, as far as packaging material for determination of particulate matter (YBB00272004) infusion bottles and infusion bag under the method for the determination of the particle diameter ≥5, 10, 25 μm particles number not 100, 20, 2 pc/ml.[Using adaptive test] (bags) piercing except where otherwise provided, take the product, subject to a number of single-use infusion set gravity transfusion standards (GB8368-2005)puncturation, 200mm/min±20mm/min a puncturation of the pericardiocentesis, the plastic puncturation for piercing should be less than 100N, the metal puncturation for piercing should be less than 80N.Puncturation for retention and the insertion point is not permealbe except where otherwise provided, something like a liquid bag, in line with the single-use infusion set gravity transfusion standards (GB8368-2005) of puncturation with puncturation bag insertion point, and then to 200mm/min ± 20mm/min speed unplug puncturation, the plastic puncturation's separator force more than 5.0N, the metal puncturation's separator force shall not be less than 1.0N. Pull-out puncturation for then bag placed between two parallel plates, 20kPa hyperteution, the maintenance of 15 seconds, and the insertion point there shall be no leakage of liquid.Injection point airproof something like a liquid bag, with the outer diameter as 0.6mm injection needle aspiration injection point and 15 seconds, and unplug the needle, and then set the bags reset between two parallel plates, 20kPa hyperteution, the maintenance of 15 seconds, and injection point shall not be leak.Something like the hoisting of the force a liquid bag, imposed in accordance withtable 2, uponsize shall not break within 60 minutes.[Physical properties] WVT (film): as water vapor transmission measurements (YBB00092003) the first method for the determination. Temperature of 38℃±0.6 ℃and relative humidity 90% ±2% of the condition, not more than 5.0g /(m2·24h).(bags) by liquid bag several, as far as water vapor transmission measurements (YBB00092003) the third method for the determination. Each bag shall not reduce the weight of over 0.2%.The amount of oxygen through (film) according to the gas through measurements (YBB00082003) the first determination, not more than 1200cm3/ ( m2·24h·0.1MPa).The amount of nitrogen through (film) according to the gas through measurements (YBB00082003) the first determination, not more than 600cm3/ ( m2·24h·0.1MPa).Tensile strength (film) by the amount of the product, according to the determination of tensile properties (YBB00112003), typeⅱ, rheomolding choice test speed (loadless) to select a 500 mm/min ±50 mm/min, vertical and lateral tensile strength shall be more than the average 20MPa.Rahfu strength (bags) according to the rahfu method for determination of strength (compaund YBB00122003) for the determination of the bag, each rahfu parts shall not be lower than the average of 20N/15mm.[Light transmittance] provisions the product area, and cut into five sections of 0.9 respectively cm×4cm, vertically along the incident light into absorption, fill it up with water in the pool, with water as the blank, as far as UV-vis spectrophotometry (PRC Pharmacopoeia 2005 appendices ⅣA), in the determination of the transmittance of 450nm Department shall not be less than 75%.[Residue on ignition] provisions Alex this product 5.0g accurate, placed has constant weight of crucible. Heating to 100 ℃drying 1 hour later slowly Chi-amustion to the complete carbonification, cold, 550 ℃at the Chi-amustion a full ashing, move to the dryer, inside, when accurate, and then on to 550 ℃at theChi-amustion, that is, the constant heavy.[Metallic elements]* regulations metals butter under the rasidues and add chemonucleolysis(1→2) 25ml, according to the atomic absorption spectrometry (PRC Pharmacopoeia 2005 part 2 appendices ⅣD) determination, should satisfy the following requirements:Office of copper in 324.8nm wavelength, calculated at 3 shall not be more than 106;Cd in 228.8nm wavelength measurement shall not be more than 106 at 3;chromium in the determination of 357.9nm wavelength division shall not be more than 106 at 3;lead in 217.0nm wavelength division less a million determination shall be calculated at 3;Tin determination in 286.3nm wavelength division shall not be more than 106 at 3;barium 553.6nm wavelength measurement at the less than 106 shall be calculated at 3.[Dissolved matter test] regulations opinins experiments of article skinpass part of the surface area of 600cm2, and cut into small pieces of 5cm×0.5cm to post-drying at room temperature, situated at a 500 ml bottle of cone-shaped, add water 200ml, airproof, reset the high pressure steam sterilizer, 121℃for 30 minutes of heating, cooling and at room temperature, as oleiferous and as obtainingwater with the manipulation, as blank-control solution, make the following experiment: Clarity by oleiferous, as far as clarity inspection method (PRC Pharmacopoeia 2005 part 2 appendices Ⅸ B), the solution should be clarified;Colour such as chloroben muddily, and turbidimetrv No. 2, the volume may not be standard solutions. Color opinins oleiferous (according to the law of the people's Pharmacopoeia 2005 appendices Ⅸ a), the solution should be achromatous.pH value add 20 ml potassium chloride solution (1→1000) dispensable 1 ml, according to the determinationd method (PRC Pharmacopoeia 2005 part 2 appendices VI H) determination of the pH value should be 5.0 ~ 7.0.Ultraviolet absorption by oleiferous, with a blank solution for the control. According to the UV-vis spectrophotometry (PRC Pharmacopoeia 2005 part 2 appendices ⅣA), wavelength of 220 ~ 350nm carried out by the scan. 220 ~ 240nm biggest absorption value should 0.08; 241 ~ 350nm biggest absorption valuenot 0.05.Non-volatile matter opinins oleiferous 50ml, reset has been constant heavy handled, dehydrated, shuiyu and eyecoat 105℃ dry to constant weight, with the blank controlled trial. The difference of residue between the text solution and the control fluid does’t exceed 2.5mg.Easy-to-oxide precision measuring 20 ml opinins oleiferous, detrmincd precision by adding potassium permanganate solution (0.002mol/L) MB-amoxycillin and dilute sulfuric acid solution 10.0ml, 3-minute micro-boiling heat, cooling to room temperature. Plus 0.1g potassium iodide, Sodium Thiosulphate solution (tirtate 0.01mol/l) tirtate to light brown, and then add five drops of liquid starch indicates to achromatous after tirtate. At the same time carry out a blank test, oleiferous and blank titration with sodium thiosulfate reference consumption (liquid 0.01mol/L) of not 1.5ml.Ammonium 50ml oleiferous opinins alkline iodisatum multicomponeut 2ml, mercury potassium placed 15 minutes (or, in color, and ammonium chloride solution (opinins 31.5mg no ammoniawith water ammonium chloride and an adequate amount of diluting the dissolution and 1000ml) 4.0ml, 46ml with a blank solution and alkaline potassium iodide mercury multicomponeut 2ml made of reference comparison, not better. (0.00008 per cent)Barium ion * opinins oleiferous in moderation, if necessary, can be concentrated, as far as the determination of metals, believing that it is not in a million.Copper ion * opinins oleiferous in moderation, if necessary, can be concentrated, as far as the determination of metals, believing that it is not in a million.Cadmium * opinins oleiferous just the right amount, necessary, concentration, according to the determination of metal elements shall not be under, over a ten-thousand.Lead ions * opinins oleiferous in moderation, if necessary, can be concentrated, as far as the determination of metals, believing that it is not in a million.Tin oleiferous ion * take just the right amount, necessary, concentration, according to the determination of metal elements shall not be under, over a ten-thousand.Chromium ion * opinins oleiferous in moderation, if necessary, can be concentrated, as far as the determination of metals, believing that it is not in a million.Aluminium ion * opinins oleiferous just the right amount, necessary,concentration, according to the atomic absorption spectrometry (PRC Pharmacopoeia 2005 part 2 appendicesⅣD) determination of wavelength at 309.3nm, and 0.5 shall not be more than one million.Heavy metal precision measuring 20 ml opinins, and oleiferous acetate buffer (pH3.5) 2ml (according to the law of the people's Pharmacopoeia 2005 part 2 appendices Ⅷ H first method), not in a million.Foam test oleiferous 5 ml, situated at the inner diameter of the test tube with stopper (15mm -200mm) and a height of about, severe oscillation in the 3min, the resulting foam disappearing within should be 3min.[Bacterial Endotoxin] (bag) provisions, by adding an empty bag by nongraphite capacity noheat raw water, seaming, placed high pressure steam sterilizer, 121℃±2 ℃in sterilizaion for 30 minutes, inside, alternate, and a trial solution, as far as the bacterial endotoxins (PRC Pharmacopoeia 2005 part 2 appendices Appendix XI E) determination of method 1 gel, it may not have 0.25EU/ml.[biological test] ** provisions cytotoxicity according to cytotoxicity testing method (YBB00012003) the first determination to contain UN-treated for condations media; samples of surface area and condations media is 6cm2/ml, should conform to the requirements.Sensitization to test according to maximization test (YBB00052003), typeⅰreaction should.Intradermic challenge test according to the intradermic stimulation with (YBB00062003) should be no irritation.Acute systemic toxicity test according to acute systemic toxicity testing method (YBB00042003), samples of surface area and condations media is 6cm2/ml, the temperature is 37 ℃± 1 ℃in condations time for 24h ± 2 h should be no acute.systemic toxicity. According to the lysophosphatidyl test (lysophosphatidyl) with YBB00032003, not lysophosphatidyl rate of 5%.[storaging] provisions inner packaging with low density polyethylene bags, medical remains at cleaning, ventilate.Attachment:checking rule1, product testing is divided into parts of all tests and inspections.2. any of the following circumstances, should be based on standards for all surveys.(1) packsproduct(2) product material quality accident back production(3) inspection(4) product after regaining production of3, one of the following by standards nullahs “**” project.(1) inspection(2) product after regaining production4, is registered with the product, the drug packaging materials production, use enterprise in supplies, additives, production process, and so there is no change in the circumstances according to the standards “*” nullahs, “**” project.5. the film look and feel of each volume 2 m; bag appearance, temperature adaptability, Resistance to drop, diaphaneity, nonsoluble microparticulate, puncturation and puncturation for retention and the insertion point is not permealbe, injection point airproof, hanging power, water vapour permeability (bag), according to the sampling procedures part 1: according to receive restricted (AQL) to retrieve country-by-batch sampling plan (GB/T2828.1-2003) to test the quality of the project, qualified (AQL) and check the level of table 3.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
-----有限公司企业标准Q/------三层共挤输液用袋本标准适用于以聚丙烯为主体材料的三层共挤输液用袋三层共挤输液用袋系指由聚丙烯为主体材料的三层共挤输液用膜通过热合方法制成的输液袋。
【外观】取本品适量,在自然光线明亮处正视目测,应透明、光洁、无肉眼可见的异物。
【鉴别】*(1)显微特征取本品适量,切成适宜厚度,置显微镜下观察,横截面应显示清晰的三层。
(2)红外光谱取本品适量,用切片器切成厚度适宜(小于50μm)的薄片,置于显微红外仪上观察样品横截面。
照包装材料红外光谱测定法(YBB00262004)第五法测定,每一层应分别与对照图谱基本一致。
【灭菌适应性试验】除另有规定外,取本品数个,加经0.45μm孔径滤膜过滤的注射用水至标示容量,并封口。
采用湿热灭菌法(标准灭菌F值≥8,如湿热灭菌121℃,15分钟)灭菌后,进行以下试验:温度适应性取上述样品数个,于-25℃±2℃条件下,放置24小时,然后在50℃±2℃条件下,继续放置24小时,再在23℃±2℃条件下,放置24小时,将样品置于两平行平板之间,承受67KPa的内压,维持10分钟。
应无液体漏出。
抗跌落取上述样品数个,于-25℃±2℃条件下,放置24小时,然后在50℃±2℃条件下,继续放置24小时,再在23℃±2℃条件下放置24小时,按表2的跌落高度,分别跌落于一硬质刚性的光滑表面上,不得有破裂和泄漏。
表2 跌落高度透明度取上述样品数个,另取空袋一个,装入级号为4号的浊度标准液,作为对照袋;在黑色背景下,用白炽灯以2000 lx~3000 lx照射(避免照射试验人员的眼睛),观察,应能与对照袋区分。
不溶性微粒取上述样品数个,照包装材料不溶性微粒测定法(YBB00272004)中输液瓶和输液袋项下的方法测定,粒子直径≥5、10、25µm粒子数,分别不得过100、20、2个/ml。
【使用适应性试验】穿刺力除另有规定外,取本品数个,用符合一次性使用输液器重力输液式标准(GB8368-2010)的穿刺器,在200mm/min±20mm/min的速度下,穿刺袋的穿刺部位,塑料穿刺器穿刺力不得过100N,金属穿刺器穿刺力不得过80N。
穿刺器保持性和插入点不渗透性除另有规定外,取数个装液袋,先用符合一次性使用输液器重力输液式标准(GB8368-2010)的穿刺器穿刺袋的插入点,然后以200mm/min±20mm/min的速度拔下穿刺器,塑料穿刺器分离力不得低于5.0N,金属穿刺器分离力不得低于 1.0N。
拔出穿刺器后,再将袋置于两个平行平板之间,施加20kPa 内压,维持15秒,插入点不得有液体泄漏。
注药点密封性取数个装液袋,用外径为0.6mm的注射针穿刺注药点并维持15秒,拔出注射针后,然后将袋置两个平行平板之间,施加20kPa内压,维持15秒,注药点不得有泄漏。
悬挂力取数个装液袋,按表3施加拉力,60分钟内不得断裂。
表3 拉力【物理性能】水蒸气透过量取装液袋数个,精密称重,照水蒸气透过量测定法(YBB00092003)第三法测定。
每个袋减少的重量均不得过0.2%。
计算公式: W1-W2──────× 100% W1W1:试验前液体袋及水溶液的重量(g); W2:试验后液体袋及水溶液的重量(g)。
热合强度取样品数个,照热合强度测定法(YBB00122003)中复合袋的方法测定,每个热合部位的平均值均不得低于20N/15mm。
【透光率】取本品平整部位,切成5个0.9 cm×4cm的切片,分别沿入射光垂直方向放入吸收池中,加满水,并以水作为空白,照紫外-可见分光光度法(中华人民共和国药典2010年版二部附录Ⅳ A),在450nm处测定透光率,均不得低于75%。
【炽灼残渣】取本品5.0g,剪碎,精密称定,置于已恒重的坩埚。
加热至100℃干燥1小时后缓缓炽灼至完全炭化,放冷,在550℃炽灼使完全灰化,移至干燥器内,放冷,精密称定后,再在550℃炽灼至恒重,即得。
遗留残渣不得过0.05%。
【金属元素】* 取灼烧残渣项下残渣加盐酸(1→2)25ml溶解后,照原子吸收分光光度法(中华人民共和国药典2010年版二部附录Ⅳ D)测定,应符合以下规定: 铜在324.8nm波长处测定,不得过百万分之三;镉在228.8nm波长处测定,不得过百万分之三;铬在357.9nm波长处测定,不得过百万分之三;铅在217.0nm波长处测定,不得过百万分之三;锡在286.3nm波长处测定,不得过百万分之三;钡在553.6nm波长处测定,不得过百万分之三。
【溶出物试验】取本品平整部分内表面积(按膜:接口:内盖内表面积比例分别裁取袋的各个部位)600cm2,切成5cm×0.5cm的小块,水洗,室温干燥后,置于500ml 的锥形瓶中,加水200ml,密封,置高压蒸汽灭菌器中,121℃加热30分钟,放冷至室温,作为供试液;另取水同法操作,作为空白对照液,进行以下试验:澄清度取供试液,照澄清度检查法(中华人民共和国药典2010年版二部附录Ⅸ B)测定,溶液应澄清;如显浑浊,与2号浊度标准液比较,不得更浓。
颜色取供试液,依法检查(中华人民共和国药典2010年版二部附录Ⅸ A),溶液应无色。
pH值取供试液20ml,加入氯化钾溶液(1→1000)1ml,照pH值测定法(中华人民共和国药典2010年版二部附录Ⅵ H)测定,pH值应为5.0~7.0。
紫外吸收度取供试液,以空白液为对照。
照紫外-可见分光光度法(中华人民共和国药典2010年版二部附录Ⅳ A)测定,在波长220~350nm范围内进行扫描。
220~240nm间最大吸收值不得过0.08;241~350nm间最大吸收值不得过0.05。
不挥发物取供试液50ml,置已恒重的蒸发皿中,水浴蒸干,并在105℃干燥至恒重,同时进行空白对照试验,供试液与空白对照液残渣之差不得过2.5mg。
易氧化物精密量取供试液20ml,精密加入高锰酸钾滴定液(0.002mol/L)10ml和稀硫酸溶液10.0ml,加热微沸3分钟,冷却至室温。
加0.1g碘化钾,用硫代硫酸钠滴定液(0.01mol/L)滴定至浅棕色,再加入5滴淀粉指示液后继续滴定至无色。
同时进行空白试验,供试液与空白对照液消耗硫代硫酸钠滴定液(0.01mol/L)之差不得过1.5ml。
铵离子取供试液50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液(取氯化铵31.5mg加无氨水适量使溶解并稀释至1000ml)4.0ml,加空白液46ml与碱性碘化汞钾试液2ml制成的对照液比较,不得更深。
(0.00008%)钡离子*取供试液适量,必要时可浓缩,照金属元素项下测定,不得过百万分之一。
铜离子*取供试液适量,必要时可浓缩,照金属元素项下测定,不得过百万分之一。
镉离子*取供试液适量,必要时可浓缩,照金属元素项下测定,不得过千万分之一。
铅离子*取供试液适量,必要时可浓缩,照金属元素项下测定,不得过百万分之一。
锡离子* 取供试液适量,必要时可浓缩,照金属元素项下测定,不得过千万分之一。
铬离子* 取供试液适量,必要时可浓缩,照金属元素项下测定,不得过百万分之一。
铝离子*取供试液适量,必要时可浓缩,照原子吸收分光光度法(中华人民共和国药典2010年版二部附录Ⅳ D)在309.3nm的波长处测定,不得过百万分之零点零五。
重金属精密量取供试液20ml,加醋酸盐缓冲液(pH3.5) 2ml,依法检查(中华人民共和国药典2010年版二部附录Ⅷ H第一法), 不得过百万分之一。
泡沫试验取供试液5ml,置于具塞试管(内径15mm,高度约200mm)中,剧烈振摇3min,产生的泡沫应在3min内消失。
【细菌内毒素】取空袋,加入标示容量无热原水,封袋后,置于高压蒸汽灭菌器中,121℃±2℃灭菌30分钟,放冷, 备用,作为试验液,照细菌内毒素检查法(中华人民共和国药典2010年版二部附录附录XI E)方法1凝胶法测定,不得过0.25EU/ml 。
【生物试验】** 细胞毒性照细胞毒性检查法(YBB00012003)第一法测定,以含血清培养基为浸提介质;样品表面积与浸提介质的比例为6cm2/ml,应符合规定。
致敏试验照皮肤致敏检查法(YBB00052003)测定,致敏反应不得过Ⅰ度。
皮内刺激试验照皮内刺激检查法(YBB00062003)测定,应无刺激反应。
急性全身毒性试验照急性全身毒性检查法(YBB00042003)测定,样品表面积与浸提介质的比例为6cm2/ml,浸提温度为37℃±1℃,浸提时间为24h±2h,应无急性全身毒性反应。
溶血试验照溶血检查法(YBB00032003)测定,溶血率不得过5%。
【贮藏】内包装用低密度聚乙烯固体药用袋密封,保持于清洁、通风处。
【编制依据】国家食品药品监督管理局国家药品包装容器(材料)标准“三层共挤输液用膜(Ⅰ)、袋(YBB00102005)”。
附件检验规则1、产品检验分全项检验和部分检验。
2、有下列情况之一时,应按标准的要求,进行全项检验。
(1)产品注册(2)产品出现重大质量事故,重新生产(3)监督抽验(4)产品停产后,重新恢复生产3、有下列情况之一时,应按标准的要求,进行除“**”外项目检验。
(1)监督抽验(2)产品停产后,重新恢复生产4、产品注册批准后,药包材生产、使用企业在原料产地、添加剂、生产工艺等设备没有变更的情形下、可按标准要求,进行除除“**”外项目检验。
5、袋外观、温度适应性、抗跌落、透明度、不容性微粒、穿刺力、穿刺器保持性和插入点不渗透性、注药点密封性、悬挂力、水蒸气渗透、照计数抽样程序第1部分:按接收质量限(AQL)检索的逐批检验抽样计划》(GB/T2828.1-2003)的规定进行,检验项目、合格质量水平(AQL)及检查水平见表4。
表4检验项目、检验水平及合格质量水平三层共挤输液用袋质量标准的起草说明为了有效地加强对药包材质量的控制,便于企业在生产、检验、销售过程有据可循,制定本企业标准。
三层共挤输液用袋质量标准依照国家食品药品监督管理局国家药品包装容器(材料)标准“三层共挤输液用膜(Ⅰ)、袋(YBB00102005)”编写而成。
本标准引用了YBB00102005中所有“袋”的项目,同时,对其中引用到的药典检验方法均修改为《中国药典》2010年版对应的方法。
另外,YBB00102005标准中【炽灼残渣】项,由于印刷错误,没有规定残渣量的限量,因此我们根据YBB00102005的起草说明,在标准中规定了残渣量限度不得过0.05%。
在生产、检验、销售过程中,我们将严格执行本标准。
