0专题特辑 化学用语【中考化学专题复习】
2024年中考化学专题复习----化学用语

2024年中考化学 化学用语专题复习一、选择题1. 下列各物质的化学式对应的俗名不正确的是A. NaOH 烧碱B. Na 2CO 3 纯碱、苏打C. NaHCO 3 小苏打D. CaCO 3 熟石灰2. 未腌透的酸菜中含有大量亚硝酸钠(NaNO 2),食用后会损害人体健康。
亚硝酸钠中氮元素的化合价为A. -1B. +1C. +2D. +33. 同时含有氮、磷、钾中两种或三种元素的化肥属于复合肥。
下列属于复合肥的是A. 3KNOB. ()342Ca POC. KClD. 43NH HCO4. 下列反应属于中和反应的是A. 2442=Z Zn+H SO SO +H n ↑B. 2223CO +H O=H COC. 22CuCl +2NaOH=2NaCl+Cu OH ()↓D. 2HCl+KOH=KCl+H O5. 柠檬酸(C 6H 8O 7)是一种较强的有机酸,在水溶液中可以解离出来H +,从而呈现酸性,主要用于香料或作为饮料的酸化剂。
下列物质不能与柠檬酸反应的是A. MgB. Fe 2O 3C. CO 2D. NaOH6. 将下列各组物质分别混合后同时加入水中,能得到无色透明溶液的组别是A. FeCl 3、KNO 3、NaOHB. AgNO 3、NaNO 3、CaCl 2C. CuSO 4、Na 2SO 4、NaOHD. Na 2CO 3、Na 2SO 4、KCl7. 钋可用于制抗静电刷。
钋元素的信息如图所示,下列说法不正确...的是A. 属于金属元素B. 质子数为84C. 相对原子质量为209gD. 元素符号为Po8. 锆是一种稀有金属,具有惊人的抗腐蚀性能、极高的熔点、超高的硬度和强度等特性,被广泛应用在航空航天、军工、核反应等领域。
如图是锆元素在元素周期表中的相关信息及原子结构示意图。
下列有关说法错误的是A. 锆属于金属元素B. 锆元素的相对原子质量为91.22C. x=2D. 锆原子在化学反应中容易得到电子9. “中国高铁”已成为我国外交的新名片,高铁车身主要采用镍铬奥氏体不锈钢制成。
中考化学微专题考点详解:专题04 化学用语 化学式 化合价 化学方程式(学生版)

专题04 化学用语 化学式 化合价 化学方程式元素符号、离子符号、化学式一、元素符号的原子,核电荷数一定相同,而核电荷数相同的粒子不一定属于同种元素,如Na +和 NH 4+;③同种元素的离子因所带的电荷数不同,性质也不同,如Fe 2+和Fe3+;④同种原子和其所形成的离子一定是同种元素,如Na 和Na +。
在元素符号前加数字,该符号只表示微观意义,表示几个该原子,如5Fe 表示5个铁原子。
二、离子符号1.离子符号的表示方法:在元素符号的右上角用“+”或“-”表示离子的电性,数字表示离子所带的电荷数,数字在前、正负号在后,当数字为1时,省略不写,如Na +、Cl -。
2.离子符号的意义:离子符号前面的化学计量数表示离子个数。
3.确定离子所带电荷数的方法:离子所带的电荷数等于该原子失去或得到电子的数目。
(1)原子中:核电荷数=质子数=核外电子数,如Na 、Mg 、O 、Cl 。
(2)阳离子中:核电荷数=质子数>核外电子数,如Na +、Mg 2+。
表示每个镁离子带2个单位正电荷表示2个镁离子(3)阴离子中:核电荷数=质子数<核外电子数,如Cl-、O2-。
4.原子团:在许多化学反应里,作为一个整体参加,好像一个原子一样,这样的原子的集团,叫做原子团。
如:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH 其中OH-、CO32-作为整体参加反应。
注意:原子团并不是在任何反应中都保持不变。
如:在碳酸盐与酸反应时,碳酸根离子变成了二氧化碳:CaCO3+2HCl==CaCl2+CO2↑+H2O;氯酸钾受热分解,氯酸根离子分解产生氧气:2KClO3MnO2△2KCl+3O2↑。
5.离子的颜色:有些离子在水溶液中呈现不同颜色,如Fe3+呈黄色、MnO4-呈紫色,铜离子呈蓝色。
三、化学式1.概念:用元素符号和数字表示物质组成的式子2.表示的意义:3.化学式书写:1.(2022年四川省泸州市中考)“结构决定性质”是化学的核心观念。
中考化学专题复习:化学用语复习课课件(21张PPT)

表示某元素的化
- m n - 合价为+m(-m)
+
一个×离子带n个
+ 单位正(负) 电荷
aR 一个×分子中有 b b个×原子
表示微粒的个数
三、物质变化用语
【例7】如图为水通电分解的微观模拟图, 表示氢原子, 表示氧原子,请根据模拟图回答:
1、用微粒符号表示水分子分解示意图; 2、化学方程式的书写原则、步骤、意义
物质结构用语
化学用语 物质组成用语
物质变化用语
原子结构示意图 离子结构示意图 离子符号
元素符号
化学式
化学方程式
两图 两号 两式
考点1:原子结构示意图与离子结构示意图 根据下列示意图,回答相关问题
一、物质结构用语
⑤
⑥
属于稳定结构的原子是__⑥___; 表示离子的结构的是_②__⑤__;
化学性质相似的粒子是_①__③_; ⑤表示的符号是_S_2_-_.
A.Al
B.N2
C.Cl
D.H
考点5、化学式
(1)单质的化学式:
由双原子分子的构成单质有
,
金属、固态非金属和稀有气体直接用元素符号表示。
特殊:臭氧( )、足球烯( )
(2)化合物的化学式 酸、碱、盐、氧化物、有机物
【例】X、Y元素都有三个电子层,且X元素最外层有2个电子,Y元素最
外层有7个电子,则X和Y元素形成的化合物的化学式是( )
第三讲
物质构成奥秘复习课
物质的组成与构成
微观角度:物质由微观粒子构成的.
n1.氧气、氮气、水、干冰等都是由__分__子__构成, n2.铁、汞、金刚石等都是由__原__子__构成, n3.氯化钠、硫酸铜、碳酸钠等都是由___离__子__构成的。
中考化学 教材知识梳理 小专题(二)化学用语
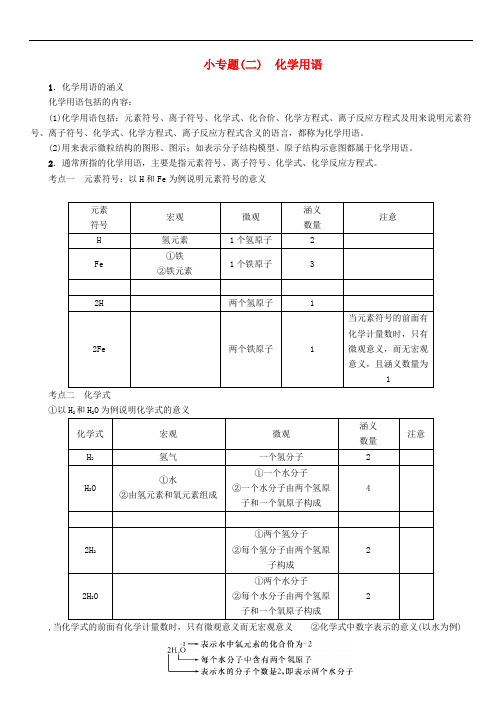
小专题(二) 化学用语1.化学用语的涵义化学用语包括的内容:(1)化学用语包括:元素符号、离子符号、化学式、化合价、化学方程式、离子反应方程式及用来说明元素符号、离子符号、化学式、化学方程式、离子反应方程式含义的语言,都称为化学用语。
(2)用来表示微粒结构的图形、图示;如表示分子结构模型、原子结构示意图都属于化学用语。
2.通常所指的化学用语,主要是指元素符号、离子符号、化学式、化学反应方程式。
考点一元素符号:以H和Fe为例说明元素符号的意义元素符号宏观微观涵义数量注意H 氢元素1个氢原子 2Fe①铁②铁元素1个铁原子 32H 两个氢原子 12Fe 两个铁原子 1 当元素符号的前面有化学计量数时,只有微观意义,而无宏观意义,且涵义数量为1考点二化学式①以H2和H2O为例说明化学式的意义化学式宏观微观涵义数量注意H2氢气一个氢分子 2H2O①水②由氢元素和氧元素组成①一个水分子②一个水分子由两个氢原子和一个氧原子构成42H2①两个氢分子②每个氢分子由两个氢原子构成22H2O①两个水分子②每个水分子由两个氢原子和一个氧原子构成2,当化学式的前面有化学计量数时,只有微观意义而无宏观意义②化学式中数字表示的意义(以水为例)考点三离子符号的意义(以Mg2+、SO2-4为例)考点四结构图、图示、模型和相关意义(常考点) ①原子结构示意图(以镁原子为例)②图示、元素周期表表中表格(以镁为例)考点五化学方程式(必考点)。
《化学用语》中考专题复习课件

高考总分:711分 毕业学校:北京八中 语文139分 数学140分 英语141分 理综291分 报考高校: 北京大学光华管理学院
北京市理科状元杨蕙心
表示离子所带电荷数:表示一个氧离子带2个单位
2O2-
负电荷
表示离子:表示氧离子
表示离子个数:表示2个氧离子
化学符号及其周围数字的意义
【例1】(2016·兰州)下列化学用语与意义对应不相符的是( ) A.O2:一个氧分子 B.4Ne:4个氖原子 C.SiO2:二氧化硅 D.2Mg2+:两个镁离子带两个单位的正电荷 【解析】O2宏观上表示物质氧气,微观上表示一个氧分子,A正确; 4Ne表示四个氖原子,B正确;SiO2宏观上表示物质二氧化硅,微观 上表示一个二氧化硅分子,C正确;2Mg2+只有微观意义,表示两个 镁离子,D错误。 【答案】D
化学图示 【例2】(2015·邵阳)根据下列粒子结构示意图,回答问题。
(1)图A、B、C、D四种粒子共表示
种元素。
(2)D原子在化学反应中易
(填“得”或“失”)电子。
(3)由C元素和D元素组成化合物的化学式为
。
【解析】(1)元素种类是由原子内的质子数决定的,质子数相同,就属 于同种元素,因此AC是同种元素,因此四种粒子共表示三种元素;(2 )最外层电子数≥4的易得到电子,D原子的最外层电子数是7,容易得到 一个电子达到8个电子的稳定结构;(3)由题目中的粒子结构示意图知 ,C元素是镁元素,最外层电子数是2,容易失去2个电子,化合价是+2 ,D元素是氯元素,最外层电子数是7,容易得1个电子,化合价是-1, 故形成的化合物是氯化镁。 【答案】(1)三 (2)得 (3)MgCl2
“同课异构”杯2020年度教学技能大赛
一等奖获奖作品
专题复习-中考化学用语-全面整理

化学用语专题训练一化学式和化合价Ⅰ、请熟记以下内容★1、写出下列原子团的离子符号铵根氢氧根硝酸根碳酸根硫酸根氯酸根磷酸根高锰酸根锰酸根★2、写出常用物质的化学式氢气氧气氮气氯气氦气氖气氩气红磷金刚石石墨碳六十臭氧氨气硫磺水银水过氧化氢氧化钾氧化亚铁氧化铁四氧化三铁氧化铜氧化镁氧化铝氧化锌二氧化锰五氧化二磷氧化钙氯酸钾高锰酸钾锰酸钾盐酸硫酸碳酸硝酸硫化氢甲烷乙醇氨水氯化铵硝酸铵硫酸铵★3、写出下列物质所含主要成分的化学式石灰石石灰水氨水铁锈赤铁矿磁铁矿煤气天然气苏打水★4、根据俗称写出化学式,或根据化学式写俗称双氧水生石灰金刚石石墨食盐水银干冰沼气酒精★5、熟记下列常见特殊物质的颜色:(1)固体颜色:黄色──,淡黄色——S (硫磺),暗紫色──红色──、黑色──、、、、(2)溶液颜色:蓝色溶液──(含的溶液)如:、Cu(NO3)2等。
浅绿色溶液──(含的溶液)如:、、Fe(NO3)2等。
附:7、练习用化合价书写下列化学式。
氢氧化钾氯化钾硝酸钾碳酸钾硫酸钾氢氧化钠氯化钠硝酸钠碳酸钠硫酸钠氢氧化钙氯化钙硝酸钙碳酸钙硫酸钙氢氧化钡氯化钡硝酸钡碳酸钡硫酸钡氨水氯化铵硝酸铵碳酸氢铵硫酸铵氢氧化镁氯化镁硝酸镁碳酸镁硫酸镁氢氧化铁氯化铁硝酸铁碳酸铁硫酸铁氢氧化亚铁氯化亚铁硝酸亚铁碳酸亚铁硫酸亚铁氢氧化铜氯化铜硝酸铜硫酸铜氢氧化铝氯化铝硫酸铝硝酸银Ⅱ、化学式和化合价练习1、用元素符号及数字表示:氧元素两个氧原子氧气两个氧分子氧离子 3个水分子;2个硫原子;+2价的镁元素;2个镁离子;2个硫酸根离子。
2个氦原子,4个硫酸根离子 。
+5价的磷元素 氯化氢分子3个氢氧根离子 4个铵根离子 5个硝酸根离子氯离子 铜离子 亚铁离子 碳酸根离子2、在化合物中,氧元素总是显 价,氢元素总是显 价,金属常显______价,非金属元素常显______价。
在化合物中,正负化合价的代数和为________。
在单质中,元素的化合价为______。
初三化学化学用语专题复习

初三化学化学用语专题复习化学用语是学习化学的重要工具,也是中考化学的重要考点之一。
对于初三的同学们来说,系统地复习化学用语,掌握其规律和应用,是提高化学成绩的关键。
一、元素符号元素符号是用来表示元素的化学符号。
它是国际通用的,每种元素都有一个独特的符号。
元素符号的书写要遵循一定的规则:1、由一个字母表示的元素符号要大写,如 H 表示氢元素,C 表示碳元素。
2、由两个字母表示的元素符号,第一个字母大写,第二个字母小写,如 Fe 表示铁元素,Cu 表示铜元素。
记住常见元素的符号是学好化学的基础。
例如,氧(O)、氮(N)、钠(Na)、氯(Cl)等等。
元素符号不仅表示一种元素,还表示这种元素的一个原子。
例如,H 既表示氢元素,又表示一个氢原子。
二、化学式化学式是用元素符号和数字的组合来表示物质组成的式子。
1、单质的化学式(1)由原子直接构成的单质,用元素符号直接表示,如金属单质铁(Fe)、铜(Cu);稀有气体单质氦气(He)、氖气(Ne)等。
(2)由分子构成的单质,在元素符号右下角写出分子中所含原子的个数,如氧气(O₂)、氮气(N₂)、氢气(H₂)等。
2、化合物的化学式(1)根据化合价来书写化学式。
化合价是元素在形成化合物时表现出来的一种性质。
例如,在化合物中,氧元素通常显-2 价,氢元素通常显+1 价。
(2)根据化合价写出化学式的步骤:按正价在前、负价在后的顺序写出元素符号。
在元素符号上方标出元素的化合价。
交叉化合价的数值,写在元素符号的右下角,作为原子个数。
检查化学式,各元素化合价的代数和是否为零。
例如,写出氧化铝的化学式。
铝元素显+3 价,氧元素显-2 价,先写出元素符号 Al 和 O,然后在铝元素上方标+3,氧元素上方标-2,交叉化合价的数值得到 Al₂O₃,检查代数和:(+3)×2 +(-2)×3 = 0 ,化学式正确。
三、化学方程式化学方程式是用化学式来表示化学反应的式子。
中考化学专题复习一 化学用语
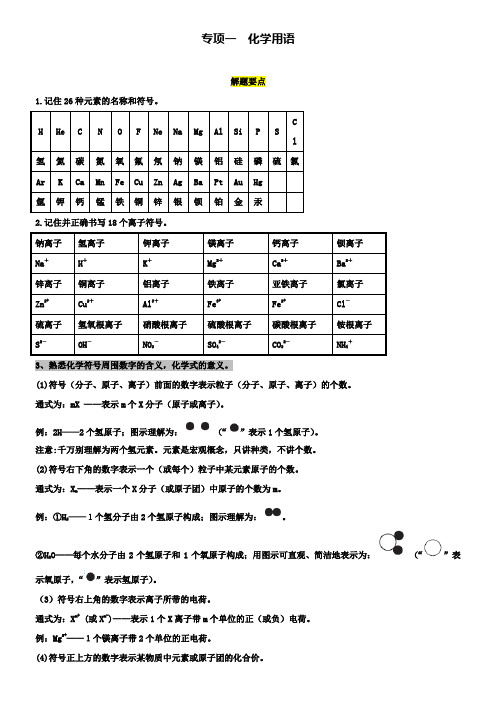
专项一化学用语解题要点1.记住26种元素的名称和符号。
CH He C N O F Ne Na Mg Al Si P Sl氢氦碳氮氧氟氖钠镁铝硅磷硫氯Ar K Ca Mn Fe Cu Zn Ag Ba Pt Au Hg氩钾钙锰铁铜锌银钡铂金汞2.记住并正确书写18个离子符号。
钠离子氢离子钾离子镁离子钙离子钡离子Na+H+K+Mg2+Ca2+Ba2+锌离子铜离子铝离子铁离子亚铁离子氯离子Zn2+ Cu2+Al3+Fe3+ Fe2+ Cl―硫离子氢氧根离子硝酸根离子硫酸根离子碳酸根离子铵根离子S2―OH―NO3―SO42―CO32―NH4+3、熟悉化学符号周围数字的含义,化学式的意义。
(1)符号(分子、原子、离子)前面的数字表示粒子(分子、原子、离子)的个数。
通式为:mX ——表示m个X分子(原子或离子)。
例:2H——2个氢原子;图示理解为:(“”表示1个氢原子)。
注意:千万别理解为两个氢元素。
元素是宏观概念,只讲种类,不讲个数。
(2)符号右下角的数字表示一个(或每个)粒子中某元素原子的个数。
通式为:X m——表示一个X分子(或原子团)中原子的个数为m。
例:①H2——1个氢分子由2个氢原子构成;图示理解为:。
②H2O——每个水分子由2个氢原子和1个氧原子构成;用图示可直观、简洁地表示为:(“”表示氧原子,“”表示氢原子)。
(3)符号右上角的数字表示离子所带的电荷。
通式为:X m+ (或X m-)——表示1个X离子带m个单位的正(或负)电荷。
例:Mg2+——1个镁离子带2个单位的正电荷。
(4)符号正上方的数字表示某物质中元素或原子团的化合价。
例:——氧化镁中,镁元素的化合价为+2。
(5)化学式的含义①由分子构成的物质 (以CO2为例) :宏观:A.表示物质:二氧化碳。
B.表示物质的组成: 二氧化碳由碳元素和氧元素组成。
微观:C.表示该物质的一个分子:1个二氧化碳分子。
D.表示分子的构成:1个二氧化碳分子由2个氧原子和1个碳原子构城的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
班级 姓名 学号 使用时间:2012年月日 计划专题特辑 化学用语【教材放大镜】1.元素符号 ⑴表示方法:“一____二____”⑵意义:以“氧O ”为例:①宏观_____________;②微观_________________■注意:①有的元素符号还可以表示一种物质(如金属、固态非金属、稀有气体)②如果在元素符号前面添上系数,就只表示该元素原子个数,不能表示该元素。
如:H 既表示氢元素,又表示一个氢原子;2H 只能表示两个氢原子。
(“金”旁,除汞以外) ⑶元素分类 “石”“气”“氵”等偏旁。
)■元素周期表的结构,共有 个周期。
⑵周期表每一个纵行叫做一 ,共有 个族(8、9、10三个纵行共同组成一个族)。
2.离子符号⑴表示方法:在元素符号(或原子团)右上角表明离子所带的电荷,数值在前,正、负号在后。
离子带1个单位的正电荷或1个单位的负电荷时,“1”省略不写。
如:阳离子:H +、Na +、Mg 2+ 、Al 3+ 、NH 4+;阴离子:Cl -、O 2-、S 2-、OH -、SO 42-、CO 32-、NO 3- ⑵表示意义:表示离子(或一个离子),如:Mg 2+——表示一个镁离子(一个镁离子带2个单位的正电荷)2Mg 2+ :表示两个镁离子(离子符号前面的化学系数表示离子的个数。
) 3.化合价符号⑴化合价:用来表示原子之间相互化合的数目,是不同元素的原子 时表现出来的一种 。
它与原子最外层电子数有非常密切关系。
⑵化合价的规律:①在化合物中氢通常显____价,氧元素通常显______价;②在金属化合物中金属元素一般显______价,非金属元素一般显_______价; ③单质中元素的化合价为_______;④在化合物里各元素的正负化合价的代数和为_________; ⑤一些元素在不同物质中可显______的化合价。
⑶化合价的表示方法:书写在元素符号的 。
); ③根据原子团计算某元素的化合价。
■原子团是指 ,又叫 。
氢+1,氧-2,银锂钠钾+l 价, 锌镁钙钡+2价,铝+3,硅+4; 只遇金属或是氢,氮磷-3、硫-2,氯碘氟溴总-1。
+l 价的是铵根;NH 4 -1氢氧,硝酸根,0H ,NO 3-1氯酸,高锰酸根;ClO 3,MnO 4-2碳酸,锰酸根;CO 3,MnO 4-2硫酸,亚硫酸,SO 4,SO 3 -3价记住磷酸根。
PO1.化学式⑴化学式:用 和 的组合表示物质组成的式子⑵每种纯净物的组成是 ,所以表示每种物质组成的化学式只有 个。
⑶化学式表示的意义:如① ; ②; ③ ; ④ 。
⑷元素符号周围数字的意义a :表示有a 个R 粒子(原子、分子或离子等)b :表示一个粒子中含有b 个某原子c :表示一个R 离子带c 个正(或负)电荷d :表示(某化合物中)R 元素的化合价为±d 价 化学式的意义: ①表示某种物质 ②表示物质的元素组成③表示某种物质的一个分子 ④表示一个分子的原子构成⑤表示物质的相对分子质量⑸化学式的书写:⑹化学式的读法:①固态单质直接读名称:如Cu 读作铜;气态单质在名称后加“气”,如H 2读作氢气。
②化合物一般从右向左读“某化某”,例如:ZnS 读作硫化锌。
有时还要读出化学式中各元素的个数,如Fe 3O 4读作四氧化三铁。
2.化学方程式⑴化学方程式:______________________________________________________ ⑵化学方程式提供的信息(意义):①________________________________________②________________________________________ ③________________________________________⑶化学方程式的读法(以右图化学方程式为例)①宏观: 和 在 的条件下反应生成 ; ②微观:每 个碳原子和 个氧分子反应,生成 个二氧化碳分子。
③质量:每 份质量的碳和 份质量的氧气完全反应,生成份质量的二氧化碳;⑷化学方程式的书写:①写化学式:根据事实,左边写反应物,右边写生成物,反应物或生成物不止一种时用“+”连接,反应物和生成物之间用“—”连接。
②配平:在化学式前配上适当的化学计量数(并使之成最简整数比),使反应物和生成物中各元素的种类和原子个数都相等(遵守质量守恒定律),切不可改动化学.......式中的数字.....!一般用最小公倍数法或观察法。
③标明反应条件&生成物状态:气体用“↑”,液体中生成固体用“↓”,但当反...应物和生成物中均有气体或固体时,不须注明!.....................将“—”改成“==”。
● 配平化学方程式的常用方法:①最小公倍数法;②奇数配偶法;③观察法。
1.原子结构示意图2.离子结构示意图22COO C 点燃====+“___” “反应条件” “______” __________生成物1.相对原子质量⑴概念:以为标准,其它原子的跟它相比较所得到的比,作为这种原子的相对原子质量(符号为Ar)。
⑵表达式Ar= ————————————⑶与构成原子的粒子数之间的关系:在原子中,电子的质量很小,所以,原子的质量主要集中在上,又因质子和中子的质量跟相对原子质量标准相比较,所以相对原子质量≈ + 。
2.相对分子质量=相对原子质量×个数之和【考点新突破】一、化合反应:1、镁在空气中燃烧:2Mg + O 2 点燃2MgO 现象:⑴发出耀眼的白光;⑵放出热量;⑶生成白色粉末 2、铁在氧气中燃烧:3Fe + 2O 2点燃Fe 3O 4 现象:⑴剧烈燃烧,火星四射;⑵放出热量;⑶生成一种黑色固体注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。
3、铜在空气中受热:2Cu + O 2 △2CuO 现象:铜丝变黑。
4、铝在空气中燃烧:4Al + 3O 2点燃2Al 2O 3 现象:发出耀眼的白光,放热,有白色固体生成。
5、氢气中空气中燃烧或爆炸:2H 2 + O 2 点燃 2H 2O 现象:⑴产生淡蓝色火焰;⑵放出热量;⑶烧杯内壁出现水雾。
6、红(白)磷在空气中燃烧:4P + 5O 2 点燃2P 2O 5 现象:生成大量白烟。
7、硫粉在空气中燃烧: S + O 2点燃SO 2 现象:A 、在纯的氧气中发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。
B 、在空气中燃烧⑴发出淡蓝色火焰;⑵放出热量;⑶生成一种有刺激性气味的气体。
8、碳在氧气中充分燃烧:C + O 2点燃CO 2现象:⑴发出白光;⑵澄清石灰水变浑浊9、碳在氧气中不充分燃烧:2C + O 2 点燃2CO10、二氧化碳通过灼热碳层: C + CO 2 高温 2CO (是吸热的反应)11、一氧化碳在氧气中燃烧:2CO + O 2点燃2CO 2现象:发出蓝色的火焰,澄清石灰水变浑浊。
12、二氧化碳和水反应:CO 2 + H 2O ==H 2CO 3 现象:石蕊试液由紫色变成红色。
13、生石灰溶于水:CaO + H 2O == Ca(OH)2(此反应放出热量) 二、分解反应:14、水在直流电的作用下分解:2H 2O 通电2H 2↑+ O 2 ↑15、实验室用双氧水制氧气:2H 2O 2 MnO2 2H 2O+ O 2↑现象:有气泡产生,带火星的木条复燃。
16、高温锻烧石灰石:CaCO 3高温CaO+CO 2↑ (工业制取氧化钙、二氧化碳)17、碳酸不稳定而分解:H 2CO 3 === H 2O + CO 2↑ 现象:石蕊试液由红色变成紫色 18、加热高锰酸钾制取氧气:2KMnO 4 △K 2MnO 4 + MnO 2 + O 2↑19、加热氯酸钾(有少量的二氧化锰)制氧气: 2KClO 32KCl + 3O 2↑20、加热碱式碳酸铜:Cu 2(OH)2CO 3 △2CuO + H 2O + CO 2↑ 现象:绿色粉末变成黑色三、置换反应:金属单质 + 酸 ------ 盐 + 氢气21、锌和稀硫酸反应:Zn + H 2SO 4 === ZnSO 4 + H 2↑(实验室制取氢气) 22、镁和稀硫酸反应:Mg + H 2SO 4 === MgSO 4 + H 2↑ 23、铝和稀硫酸反应:2Al + 3H 2SO 4 == Al 2(SO 4)3 + 3H 2↑ MnO 2 △24、锌和稀盐酸反应:Zn + 2HCl=== ZnCl2 + H2↑25、镁和稀盐酸反应:Mg+ 2HCl=== MgCl2 + H2↑26、铝和稀盐酸反应:2Al + 6HCl === 2AlCl3 + 3H2↑(1-6的现象:有气泡产生)27、铁和稀盐酸反应:Fe + 2HCl=== FeCl2 + H2↑28、铁和稀硫酸反应:Fe + H2SO4 == FeSO4 + H2↑有气泡产生,溶液由无色变成浅绿色金属单质 + 盐(溶液) --- 另一种金属 + 另一种盐29、铁与硫酸铜反应:Fe + CuSO4==Cu + FeSO4 现象:铁条表面覆盖一层红色的物质,溶液由蓝色变成浅绿色。
30、铝片放入硫酸铜溶液中:3CuSO4+2Al== Al2(SO4)3+3Cu现象:铝片表面覆盖一层红色物质,溶液由蓝色变成无色。
31、铜片放入硝酸银溶液中:2AgNO3 + Cu == C u(N O3)2 + 2Ag现象:铜表面覆盖银白色物质,溶液由无色变成蓝色。
金属氧化物+木炭或氢气→金属+二氧化碳或水32、焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑33、木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑34、氢气还原氧化铜:H2 + CuO △ Cu + H2O 现象:黑色粉末变成红色,试管内壁有水珠生成35、氢气与氧化铁反应:Fe2O3+3H2 高温2Fe+3H2O 现象:红色(氧化铁)粉末逐渐变成黑色,管内壁有水珠生成。
四、复分解反应:36、金属氧化物+酸→盐+H2OFe2O3+6HCl==2FeCl3+3H2O Fe2O3+3H2SO4==Fe2(SO4)3+3H2O现象:红色粉末逐渐溶解,溶液由无色变成黄色CuO+H2SO4==CuSO4+H2O 现象:黑色粉末逐渐溶解,溶液由无色变成蓝色37、碱+酸→盐+H2O(又叫中和反应)NaOH+HCl==NaCl+H2O2NaOH+H2SO4==Na2SO4+2H2O38、酸+盐→新盐+新酸CaCO3+2HCl==CaCl2+H2O+CO2↑(实验室制取二氧化碳)Na2CO3+2HCl==2NaCl+H2O+CO2↑现象:有大量的气泡生成。
HCl+AgNO3==AgCl↓+HNO3H2SO4+BaCl2==BaSO4↓+2HCl 现象:生成不溶于稀硝酸的白色沉淀。
