乳酸诺氟沙星可溶性粉(成品)检验记录
2%乳酸环丙沙星可溶性粉检验SOP

GMP管理文件一、目的:建立乳酸环丙沙星可溶性粉检验的标准操作规程,保证正确操作。
二、依据:《乳酸环丙沙星可溶性粉内控质量标准》。
三、适用范围:适用于乳酸环丙沙星可溶性粉的检验。
四、责任者:QC检验员五、正文:1.检验项目和指标2.检验方法:除特别注明外,试验中所用试剂为分析纯试剂,水为纯化水,仪器设备为一般实验室仪器设备。
2.1 性状取供试品5袋,肉眼在自然光下观察颜色,为白色或微黄色粉末,则判定该项合格。
2.2鉴别2.2.1 方法在含量项下记录的色谱图中,供试品峰的保留时间应与对照品峰的保留时间一致。
2.2.2 结果判定:上述各项均符合规定,则判定该项合格。
2.3 酸度:取本品5.0g,加水20ml溶解后,依法测定(详见PH值测定法标准操作规程),pH值应为4.5~5.5。
则判定该项合格。
2.4 干燥失重:取本品,在105℃干燥至恒重,减失重量不得过9.0%(详见干燥失重测定法标准操作规程)。
则判定该项合格。
2.5 有关物质:取本品适量,精密称定,用流动相溶解并分别定量稀释制成每1ml中含环丙沙星0.2mg的溶液(1)与0.003mg的溶液(2)。
照含量测定项下的方法,取对照品溶液20µl注入液相色谱仪,调节检测灵敏度,使主成分峰高为记录仪的满量程。
再分别取溶液(1)和溶液(2)各20µl注入液相色谱仪,记录色谱图至主成分峰保留时间的2倍。
溶液(1)显示各杂质峰面积及其总和分别不得大于溶液(2)主峰面积的1/3和2/3。
则判定该项合格。
2.6 溶液性:取本品50mg,加水100ml,搅拌,应溶解。
则判定该项合格。
2.7 外观均匀度取本品适量置光滑纸上,平铺约5cm2,将其表面压平,在亮处观察,应呈现均匀的色泽,无花纹、色斑。
则判定该项合格。
2.8 装量:照最低装量法(详见最低装量法标准操作规程)检查, 应为每袋装量98.0g-105.0g,平均装量不少于标示量100g。
则判定该项合格。
诺氟沙星的含量测定

诺氟沙星的含量测定本组采用高效液相色谱法进行试验。
诺氟沙星NuofushaxingNorfloxacinF本品为1-乙基-6-氟-1,4-二氢-4-氧代-7-(1-哌嗪基)-3-喹啉羧酸。
按干燥品计算,含C16H18FN3O3应为%~%。
【性状】本品为类白色至淡黄色结晶性粉末;无臭,味微苦;有引湿性。
本品在二甲基甲酰胺中略溶,在水或乙醇中极微溶解;在醋酸、盐酸或氢氧化钠溶液中易溶。
熔点本品的熔点为218~224℃(附录Ⅵ C)。
【含量测定】照高效液相色谱法(附录V D)测定。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;以L磷酸溶液(用三乙胺调节pH值至±)-乙腈(87:13)为流动相;检测波长为278nm。
称取诺氟沙星对照品、环丙沙星对照品、依诺沙星对照品和杂质B对照品各适量,加L盐酸溶液适量使溶解,用流动相A稀释制成每1ml中含诺氟沙星25μg、环丙沙星和依诺沙星各5μg的混合溶液,取20μl注入液相色谱仪,记录色谱图,诺氟沙星峰与与环丙沙星峰和依诺沙星峰的分离度均应不小于。
测定法取本品约25mg,精密称定,置100ml量瓶中,加L盐酸溶液2ml 使溶解后,用水稀释至刻度,摇匀,精密量取5ml,置50ml量瓶中,用流动相稀释至刻度,摇匀,精密量取20μl注入液相色谱仪,记录色谱图;另取诺氟沙星对照品,同法测定,按外标法以峰面积计算供试品中F的含量。
【方法学考察】线性关系考察:精密量取对照品溶液(L),,及对照品贮备液(L),,,,,置10ml量瓶中,用流动相稀释至刻度,摇匀,依法测定,以峰面积对相应质量浓度作回归处理,回归方程为A=*10^4+*10^5C,r=(n=)。
结果表明,诺氟沙星质量浓度在~910g/ml范围内与峰面积线性关系良好。
精密度试验:精密吸取对照品溶液10L,重复进样6次。
结果峰面积的RSD 为%(n=6)稳定性试验:取同一供试品溶液,按拟订的方法分别于0,2,4,6,8,10h时进样测定。
恩诺沙星可溶性粉成品检验记录

检查
装量
样品号
1
2
3
药+包装重
包装重
药重
平均
标准规定
每袋装量不得少于标示量,平均装量不得少于标示量
项目结论
溶解性
取本品1.0g,加水50ml,搅拌,应全部溶解
检验结果:
干燥
失重
天平室温度℃湿度%
干燥条件
105℃干燥至恒重
检品号
1
2
复核人:检验人:
有限公司
成品检验记录附页
文件编号:00第2页共3页
检验项目标准规定检验结果项目结论
1、性状应符合规定规定
2、鉴别应与对照品的规定
主斑点相同
3、装量应符合规定
规定
4、溶解性应符合规定规定
5、干燥失重减失重量不得过10.0%规定
6、含量测定:
含恩诺沙星应为
标示量的90.0%-110.0%规定
检验结论:
本品按<<恩诺沙星可溶性粉内控质量标准(半成品)>>检验,结果
规定。
备注:
负责人:复核人:检验人:
有限公司
成品检验报告单
文件编号: 00第3页共3页
检品名称
恩诺沙星可溶性粉
检验单号
批号
规格
请验车间
西药粉剂车间
取样地点
西药待包间
取样数量
取样人
送检日期
年月日
报告日期
年月日
检验依据
<<恩诺沙星可溶性粉内控质量标准(半成品)>>
检验项目标准规定检验结果项目结论
1、性状应符合规定规定
对照品制备:
取105℃干燥至恒重的恩诺沙星对照品,按上法同样操作。
诺氟沙星原料检验操作规程

1.目的:建立对诺氟沙星原料的检验操作方法,使检验操作规范化,标准化,保证检验结果的可靠性和准确性。
2.范围:对诺氟沙星原料的检验操作。
3.责任:化验员4. 质量标准5 操作5.1 性状本品为类白色至淡黄色结晶性粉末;无臭,味微苦;有引湿性。
5.2 熔点5.2.1仪器:WRS-3熔点仪(C09)5.2.2测定方法:本品的熔点为218℃~224℃(SOP-QM-821-00)。
5.2.3平行测定三份,取其平均值。
5.3 鉴别5.3.1仪器:FA2204B电子分析天平(C04)、薄层展开缸、硅胶G薄层板、BD-AAA暗箱式紫外检验灯(C31)、Waters2695高效液相色谱仪(C01)、容量瓶(10ml)、量筒(20ml)、刻度吸管(5ml)5.3.2试剂:诺氟沙星对照品、三氯甲烷(分析纯)、甲醇(色谱纯)、浓氨试液5.3.3测定方法:5.3.3.1取本品与诺氟沙星对照品25mg置10ml的容量瓶中,加三氯甲烷-甲醇(1:1)制成每1ml中含2.5mg的溶液,照薄层色谱法(SOP-QM-830-00)试验,吸取上述两种溶液各10μl,分别点于同一硅胶G薄层板上,以三氯甲烷-甲醇-浓氨试液(15:10:3)为展开剂,展开,晾干,置紫外光灯下(365nm)检视,供试品溶液所显主斑点的荧光与位置应与对照品溶液主斑点的荧光与位置相同。
5.3.3.2在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(5.3.3.1)(5.3.3.2)两项可选作一项。
5.4 检查5.4.1 溶液的澄清度5.4.1.1仪器:FA2204B电子分析天平(C04)、刻度吸管(10ml)5.4.1.2试剂:氢氧化钠试液、2号浊度标准液5.4.1.3测定方法:取本品5份,各0.5g,加氢氧化钠试液10ml溶解后,溶液应澄清,如显浑浊,与2号浊度标准液(SOP-QM-827-00)比较,均不得更浓。
乳酸菌检验原始记录

乳酸菌检验原始记录第页共页样品编号:环境温湿度:℃ %RH检验依据:GB 4789.35-2016检测地点:微生物室检验日期:检毕日期:培养开始时间:培养终止时间:仪器设备:培养箱ZYXYJC/S- □天平ZYXYJC/S- □pH计ZYXYJC/S-检测过程:以无菌操作取样品□g或□mL,用生理盐水制成10倍梯度稀释液。
选择2个~3个适宜稀释度的样品匀液(液体样品可包括原液),吸取1mL样品匀液于无菌平皿内,倾注□MRS培养基,36℃厌氧培养 h;□莫匹罗星锂盐和半胱氨酸盐酸盐改良MRS琼脂培养基,36℃厌氧培养 h;□MC琼脂培养基,36℃培养 h,计数并计算结果。
计算公式:1.只有一个稀释度平板上的菌落数在适宜(30~300CFU)计数范围内,计算两个平板菌落数的平均值,再将平均值乘以相应稀释倍数,作为每g( mL)样品中菌落总数结果。
2.有两个连续稀释度的平板菌落数在适宜计数范围内时,按式计算:N =∑C /( n 1+0.1n2)d。
式中: N—样品中菌落数;∑C—平板(含适宜范围菌落数的平板)菌落数之和;n1—第一稀释度(低稀释倍数)平板个数;n2—第二稀释度(高稀释倍数)平板个数;d—稀释因子(第一稀释度)。
3.所有稀释度的平板上菌落数均大于300CFU,则对稀释度最高的平板进行计数,其他平板可记录为多不可计,结果按平均菌落数乘以最高稀释倍数计算。
4.所有稀释度的平板菌落数均小于30CFU,则应按稀释度最低的平均菌落数乘以稀释倍数计算。
5.所有稀释度(包括液体样品原液)平板均无菌落生长,则以小于1乘以最低稀释倍数计算。
6.所有稀释度的平板菌落数均不在30CFU~300CFU之间,其中一部分小于30CFU或大于300CFU时,则以最接近30CFU或300CFU的平均菌落数乘以稀检测者:校核者:审核者:。
阿莫西林可溶性粉(成品)检验记录

检查
装量
量
样品号
1
2
3
药+包装重(g)
包装重(g)
药重(g少于标示量的98%平均装量不少于标示量
项目结论
干燥失重
天平室温度:℃湿度:%
干燥条件
60℃减压干燥3小时
检品号
1
2
称量瓶重W0(g)
瓶+药重W1(g)
干燥后瓶+药重W2(g)
计算公式
W1- W2
干燥失重=×100%
有限公司
成品检验记录首页
文件编号: 00第1页共3页
检品名称
阿莫西林可溶性粉
检验单号
商品名称
请验部门
生产日期
年月日
生产批号
生产总量
取样数量
规格
取样人
送检日期
年月日
报告日期
年月日
检验依据
《阿莫西林可溶性粉内控质量标准(成品)》
性
状
本品应为白色或类白色结晶性粉末;
检验结果:
鉴
别
在含量测定项下纪录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
标准规定:应为标示量的92.0%-108.0%。
项目结论:
检验结论:本品按《阿莫西林可溶性粉内控质量标准(成品)》检验,结果规定。
备注
复核人:检验人:
有限公司
成品检验报告单
文件编号:00第3页共3页
检品名称
阿莫西林可溶性粉
检验单号
商品名
请验部门
西药粉剂车间
生产日期
生产批号
生产总量
取样数量
规格
取样人
送检日期
W1- W0
成品检验操作规程

成品检验操作规程目录1 安乃近注射液成品检验操作规程 B.ZL.JY.C.00.0012 盐酸利多卡因注射液成品检验操作规程 B.ZL.JY.C.00.0023 芬苯达唑粉成品检验操作规程 B.ZL.JY.C.00.0034 烟酸诺氟沙星可溶性粉成品检验操作规程 B.ZL.JY.C.00.0045 三子散成品检验操作规程 B.ZL.JY.C.00.0056 健胃散成品检验操作规程 B.ZL.JY.C.00.0067 海南霉素钠预混剂成品检验操作规程 B.ZL.JY.C.00.0078 磷酸泰乐菌素-磺胺二甲嘧啶预混剂成品检验操作规程 B.ZL.JY.C.00.0089 氟苯尼考溶液成品检验操作规程 B.ZL.JY.C.00.00910 地克珠利溶液成品检验操作规程 B.ZL.JY.C.00.01011 稀戊二醛溶液成品检验操作规程 B.ZL.JY.C.00.01112 苯扎溴铵溶液成品检验操作规程 B.ZL.JY.C.00.012北京生安药业有限公司GMP 管理文件一、目 的:为规范芬苯达唑粉的测定方法和操作要求,特制定本操作规程。
二、标准依据:芬苯达唑粉质量标准。
三、适用范围:适用于本品的检验操作。
四、责 任 者:质控部经理、检验员。
五、正 文:本品为芬苯达唑与碳酸钙配制而成。
含芬苯达唑(C 15H 13N 3O 2S)应为标示量的93.0%~107.0%。
【鉴别】 1、仪器:752型紫外可见分光光度计 2、试剂与试液: 甲醇3、操作方法:取本品,加甲醇制成每1毫升中含芬苯达唑约15微克的溶液,滤过;取滤液,按《紫外分光光度法操作规程》进行测定。
4、判断标准:在218+2nm 与294+2nm 的波长处有最大吸收。
【检查】 干燥失重:1、仪器:101-1A 型干燥箱、电子天平(感量0.1mg )、干燥器(普通)、扁形称量瓶。
2、操作方法:取本品,按《干燥失重测定法操作规程》在105℃干燥至恒重。
盐酸沙拉沙星可溶性粉成品检验记录
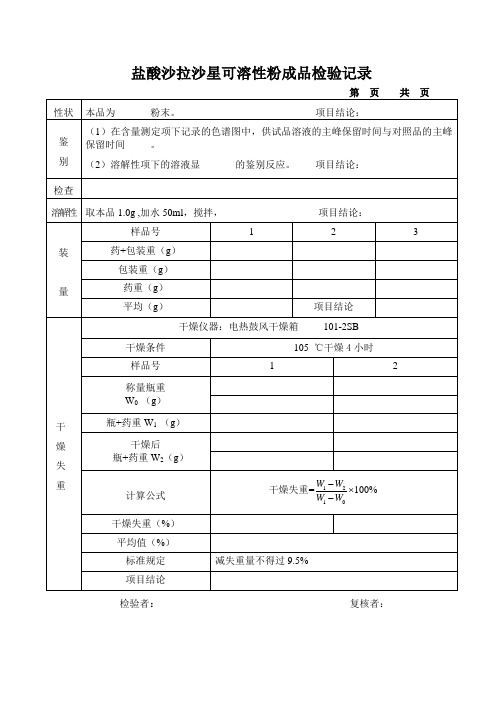
页
共
页
本品为
粉末。
项目结论:
(1)在含量测定项下记录的色谱图中,供试品溶液的主峰保留时间与对照品的主峰 保留时间 。 (2)溶解性项下的溶液显 的鉴别反应。 项目结论:
项目结论: 1 2 3
项目结论 101-2SB
105 ℃干燥 4 小时 1 2
柱温 ————
检测波长 ———— 274nm 进样量:20μι
供试品溶液的制备:精密称取本品约 2g,置 50ml 量瓶中,加 0.1mol/L 的氢氧化钠溶液溶解并 稀释至刻度, 精密量取 2ml, 100ml 量瓶中, 0.1mol/L 的氢氧化钠溶液溶解并稀释至刻度, 置 用 制成每 1ml 中含 20ug 沙拉沙星的溶液,精密量取 20ul 注入液相色谱仪,记录色谱图。 稀释倍数 DT:2500 对照品溶液的制备:精密称取沙拉沙星对照品 50mg,同法制成每 1ml 中含 20ug 沙拉沙星的溶 液,精密量取 20ul 注入液相色谱仪,记录色谱图。 内容 样品编号 样品质量 WT(g) 样品峰面积 AT 对照品质量 WS(g) 对照品峰面积 AS 1 稀释倍数 DS:2500 2
计算公式
X
AT WS N DT 100% AS WT DS S
样品规格 S= 对照品含量 CS=
% %
样品标示量的百分含量 X(%) 含量平均值(%)规定 项目结论 检验者: 含沙拉沙星应为标示量的 92.0%~108.0% 复核者:
盐酸沙拉沙星可溶性粉成品检验记录
第 性状 鉴 别 检查 溶解性 取本品 1.0g ,加水 50ml,搅拌, 样品号 装 药+包装重(g) 包装重(g) 量 药重(g) 平均(g) 干燥仪器:电热鼓风干燥箱 干燥条件 样品号 称量瓶重 W0 (g) 干 燥 失 重 瓶+药重 W1 (g) 干燥后 瓶+药重 W2(g)
诺氟沙星胶囊半成品检验操作记录

诺氟沙星胶囊半成检验操作记录编号:QC-R-SOP4-ZL-008-a-02 检验编号批号规格数量代码收检日期检验依据1 含量测定高效液相色谱仪型号及编号校验日期有效期至天平型号及编号校验日期有效期至分析方法检测器色谱柱柱温℃波长nm 流速ml/min进样量μl分离度(R)流动相对照品名称来源批号含量%对照品名称来源批号含量%对照品名称来源批号含量%对照品溶液的制备:精密称取诺氟沙星对照品mg,置50ml量瓶中,加0.1mol/L 的盐酸溶液1ml溶解,加水稀释至刻度,精密量取5ml,置50ml量瓶中,加流动相稀释至刻度,即得;分离度对照溶液的制备:精密称取诺氟沙星对照品mg、环丙沙星对照品mg、依诺沙星对照品mg,置50ml量瓶中,加0.1mol/L的盐酸溶液2ml溶解,加流动相稀释至刻度,精密量取5ml,置100ml量瓶中,加流动相稀释至刻度,即得;供试品溶液的制备:精密称取样品(1)mg;(2)mg,(3)mg;(4)mg,(5)mg;(6)mg,(7)mg;(8)mg,(9)mg;精密称定,置500ml容量瓶中,加0.1mol/L的盐酸溶液10ml溶解,加水稀释至刻度,精密量取5ml,置50ml量瓶中,加流动相稀释至刻度,即得。
测定结果(图谱附后):对照峰面积:①②③平均值RSD= %样(1)峰面积:① ② ③ 平均值 样(2)峰面积:① ② ③ 平均值 样(3)峰面积:① ② ③ 平均值 样(4)峰面积:① ② ③ 平均值 样(5)峰面积:① ② ③ 平均值 样(6)峰面积:① ② ③ 平均值 样(7)峰面积:① ② ③ 平均值 样(8)峰面积:① ② ③ 平均值 样(9)峰面积:① ② ③ 平均值计算公式:含量(%)=s t s s t C 505500W A 50550W A ⨯⨯⨯⨯⨯计算结果:样(1) % 样(2) % 样(3) % 样(4) % 样(5) % 样(6) % 样(7) % 样(8) % 样(9) % RSD = % 质量标准:含量为49.0-54.0%。
甲磺酸达氟沙星粉成品检验记录

检查
装量
样品号
1
2
3
药+包装重
包装重
药重
平均
标准规定
每袋装量不得少于标示量,平均装量不得少于标示量
项目结论
溶解性
取本品1.0g,加水50ml,搅拌,应全部溶解
检验结果:
干燥
失重
天平室温度 ℃ 湿度 %
干燥条件
105℃干燥至恒重
检品号
1
2
称量瓶重W0
瓶+药重W1
干燥后瓶+药重W2
负责人: 复核人: 检验人:
在282nm与348±2nm的
波长处有最大吸收 规定
3、装量 应符合规定 规定
4、溶解性 应符合规定 规定
5、干燥失重 减失重量不得过10.0% 规定
6、含量测定:
含甲磺酸达氟沙星应为
标示量的90.0%-110.0%规定
检验结论:
本品按<<甲磺酸达氟沙星可溶性粉内控质量标准(成品)>>检验,结果
规定。
ቤተ መጻሕፍቲ ባይዱ检验单号
批 号
规 格
请验车间
西药粉剂车间
取样地点
西药待包间
取样数量
取 样 人
送检日期
年 月 日
报告日期
年 月 日
检验依据
<<甲磺酸培氟沙星可溶性粉内控质量标准(成品)>>
检验项目 标准规定 检验结果 项目结论
1、 性状 应符合规定 规定
2、鉴别 应照分光光度法测定,
在282nm与348±2nm的
波长处有最大吸收 规定
文件编号: 00第3页共3页
检品名称
甲磺酸培氟沙星可溶性粉
恩诺沙星粉验证方案

1.目的:为评价恩诺沙星可溶性粉生产系统要素和生产过程中可能影响产品质量的各种生产工艺变量,特根据GMP要求制定本验证方案,对其整个生产过程进行验证,以保证在正常的生产条件下,连续3批(至少)生产出质量合格、均一、稳定的产品。
2.范围:本验证方案适用于在新厂房、新设施、设备,新工艺条件投入使用前的恩诺沙星可溶性粉工艺验证。
3.职责:生产技术部负责验证方案的具体实施。
物资供应部负责验证所需物料的供应。
工程设备部负责保证设备处于完好状态,负责组织试验所需仪器、设备的验证,负责仪器、仪表、量具等的校正,负责设备的维护保养。
质量管理部QC负责各项目检测。
质量管理部QA负责协调组织各项验证工作。
工艺验证小组负责审阅验证记录,进行分析、评价。
验证领导小组组长负责验证方案的批准。
4.有关背景材料4.1.产品概况:恩诺沙星可溶性粉为抗菌药,主要用于畜禽细菌和支原体感染。
性状:本品为类白色或淡黄色结晶性粉末。
规格: 100g: 恩诺沙星2.5g包装规格: 100g/包×100包/箱类别:氟喹诺酮药用法与用量:每1L水鸡25~75 mg(以恩诺沙星计)一日2次连用3~5天贮藏:遮光,密封,在干燥处保存。
有效期:二年生产工艺流程图4.2.生产厂房(一般生产区)恩诺沙星可溶性粉生产厂房按一般生产区设置,但厂房设施的要求应参照洁净生产区的标准,现场检查确认粉剂车间生产厂房应符合下列标准。
检查记录4.3.设备生产用的主要设备均经安装、运行和性能确认,符合生产工艺的要求。
4.4.相关文件、规程检查并确认下述文件已制订完毕,且签字下发:5.验证项目、评价方法及标准5.1.人员列出参加验证的生产操作及检验的所有人员名单,评价其培训及健康检查情况是否符合GMP 及操作的要求。
(列出所有生产操作人员和检验人员的名单,并注明体检和培训情况)5.1.1.培训查阅培训档案,确认是否对有关操作者进行了相关培训,包括:—兽药GMP及管理法规培训—安全防护规程—所在岗位相关设备的操作、清洁、维修保养规程—恩诺沙星可溶性粉生产工艺规程培训—岗位标准操作规程培训5.1.2.健康检查查阅生产操作人员健康档案,考察参加生产操作的所有人员是否进行了体检,各项指标正常,身体健康,体检检查结果在有效期内。
SOP-QC 诺氟沙星胶囊中间产品检验操作规程

诺氟沙星胶囊中间产品检验操作规程1. 目的建立诺氟沙星胶囊中间产品检验标准操作规程,使诺氟沙星胶囊中间产品检验操作规范化。
2. 范围适用于诺氟沙星胶囊中间产品的质量检验。
3. 术语或定义N/A4. 职责质量控制部对本规程的实施负责。
5. 程序5.1 检验依据5.1.1 《中国药典》2020年版二部(第1433页)。
5.1.2 诺氟沙星胶囊中间产品质量标准(质量标准编号:- );5.1.3 《中国药典》2020年版四部。
5.2 诺氟沙星胶囊中间产品(颗粒)5.2.1性状:本品为白色至淡黄色颗粒或粉末。
5.2.2 水分仪器与用具:烘干法水份测定仪操作步骤:⑴校正零位:在加码盘内加5g砝码,秤盘内不放试样,开启天平和红外线灯约20分钟后,等投影屏上的刻线不再移动时校正零位。
⑵样品测定:仪器经预热调零后,取下5g 砝码,把预先称好的试样均匀地倒在秤盘内,在加码盘内加适量的平衡砝码,然后开启天平和红外线灯泡开关,对试样进行加热,控制加热温度为105℃。
干燥一定时间后刻度移动静止,标志着试样内游离水已蒸发并达到了恒重点,读出记录数据。
本品水分不得过3.0%。
5.2.3 含量测定照高效液相色谱检验操作规程测定。
仪器与试剂:电子天平、高效液相色谱仪、0.1mol/L盐酸溶液、诺氟沙星对照品、环丙沙星对照品、依诺沙星对照品、0.025mol/L磷酸溶液、三乙胺、乙腈、供试品溶液的制备:取本品适量,混合均匀,精密称取适量(约相当于诺氟沙星125mg ),置500ml 量瓶中,加0.1mol/L 盐酸溶液10ml 使溶解后,用水稀释至刻度,摇匀,精密量取续滤液5ml ,置50ml 量瓶中,用流动相稀释至刻度,摇匀。
对照品溶液 取诺氟沙星对照品约25mg ,精密称定,置100ml 量瓶中,加0.1mol/L 盐酸溶液2ml 使溶解后,用水稀释至刻度,摇匀,精密量取5ml ,置50ml 量瓶中,用流动相稀释至刻度,摇匀。
诺氟沙星检验记录

诺氟沙星检验记录第一页【依据】《中国药典》年版二部【性状】本品为。
结论:熔点:仪器:取本品干燥后的细粉适量,以熔点测定法第一法测定:⑴初熔:℃全熔:℃⑵初熔:℃全熔:℃⑶初熔:℃全熔:℃三次平均:初熔:℃全熔:℃(规定:218~224℃)结论:【鉴别】称取本品 g 与诺氟沙星对照品 g ,分置100ml 与10ml量瓶中,加氯仿-甲醇(1:1)适量使溶解,并稀释至刻度,将供试品溶液过滤,照薄层色谱法试验,吸取上述两种溶液各10ul,分别点于同一硅胶H薄层板上,以氯仿-甲醇-浓氨溶液(15:10:3)为展开剂,展开后,晾干,置紫外光灯(365nm)下检视,。
(规定:供试品所显主斑点的荧光和位置应与对照品的主斑点相同)结论:【检查】室温:℃相对湿度:溶液的澄清度取本品0.50g,加氢氧化钠试液10ml溶解,(规定:溶液应澄清;如显浑浊,与2号浊度标准液比较,不得更深)结论:有关物质仪器:取本品 g,加0.1mol/L盐酸溶液(每12.5mg加1ml)使溶解,用含量测定项下的流动相制成每1ml中含0.001mg与0.1mg的溶液,分别作为对照溶液和供试品溶液。
照含量测定项下的方法试验,取对照溶液20ul注入液相色谱仪,调节检测器灵敏度,使主成分色谱峰高约为记录仪满量程的10%,再取供试品溶液和对照品溶液各20ul,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的2.5倍,。
(规定:供试品溶液的色谱图中如显示杂质峰,除溶剂峰外,各杂质峰面积总和不得大于对照溶液主峰的面积)结论:干燥失重仪器:105℃干燥至恒重空称量瓶重:①g / g ;②g / g检验人:复核人:年月日诺氟沙星检验记录单第二页精密称取样品:①样+瓶:②样+瓶:-瓶:-瓶:置105℃干燥2小时后,置干燥器中,放置30分钟使至室温称定重量,再干燥1小时,放置30分钟使至室温称定重量至恒重:①g / g ;②g / g减失重量:平均:%(规定:减失重量不得过2.0%)结论:炽灼残渣仪器:在500~600℃空坩埚恒重:①g / g ;②g / g精密称取样品:①样+坩埚:②样+坩埚:-坩埚:-坩埚:依炽灼残渣检查法将供试品炭化后,置500~600℃灰化30分钟后,降温至300℃后取出放置干燥器中放置30分钟使至室温,称定重量,再重复灰化直至恒重:①g / g ;②g /g遗留残渣:平均:%(规定:遗留残渣不得过0.2%)结论:重金属取炽灼残渣项下遗留的残渣,加硝酸0.5ml,蒸干,至氧化氮蒸气除尽后,放冷,加盐酸2ml,置水浴上蒸干后加水15ml,滴加氨试液至对酚酞指示液显中性,再加醋酸盐缓冲液(pH3.5)2ml,微热溶解后,移置纳氏比色管中,加水稀释成25ml,另取配制供试液的试剂,置瓷皿中蒸干后,加醋酸盐缓冲液(pH3.5)2ml 与水15ml,微热溶解后,移置纳氏比色管中,加标准铅溶液2ml,再用水稀释成25ml,放置2分钟同置白色纸上,自上向下透视,。
乳酸诺氟沙星检验SOP
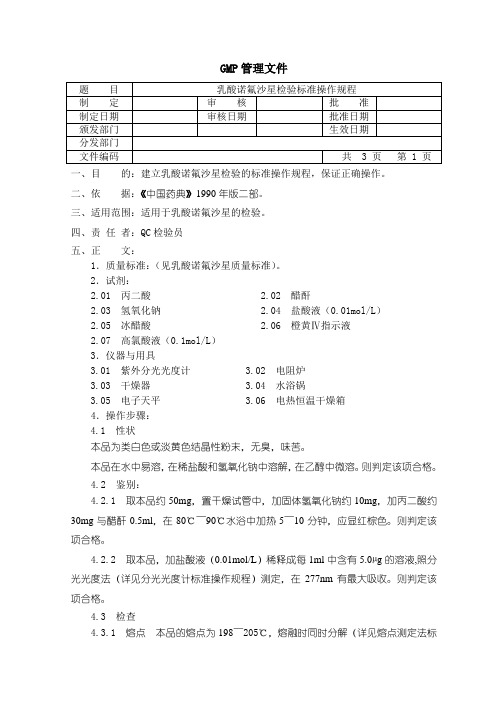
GMP管理文件一、目的:建立乳酸诺氟沙星检验的标准操作规程,保证正确操作。
二、依据:《中国药典》1990年版二部。
三、适用范围:适用于乳酸诺氟沙星的检验。
四、责任者:QC检验员五、正文:1.质量标准:(见乳酸诺氟沙星质量标准)。
2.试剂:2.01 丙二酸 2.02 醋酐2.03 氢氧化钠 2.04 盐酸液(0.01mol/L)2.05 冰醋酸 2.06 橙黄Ⅳ指示液2.07 高氯酸液(0.1mol/L)3.仪器与用具3.01 紫外分光光度计 3.02 电阻炉3.03 干燥器 3.04 水浴锅3.05 电子天平 3.06 电热恒温干燥箱4.操作步骤:4.1 性状本品为类白色或淡黄色结晶性粉末,无臭,味苦。
本品在水中易溶,在稀盐酸和氢氧化钠中溶解,在乙醇中微溶。
则判定该项合格。
4.2 鉴别:4.2.1 取本品约50mg,置干燥试管中,加固体氢氧化钠约10mg,加丙二酸约30mg与醋酐0.5ml,在80℃~90℃水浴中加热5~10分钟,应显红棕色。
则判定该项合格。
4.2.2 取本品,加盐酸液(0.01mol/L)稀释成每1ml中含有5.0µg的溶液,照分光光度法(详见分光光度计标准操作规程)测定,在277nm有最大吸收。
则判定该项合格。
4.3 检查4.3.1 熔点本品的熔点为198~205℃,熔融时同时分解(详见熔点测定法标准操作规程)。
应符合规定,则判定该项合格。
4.3.2 溶液的澄清度取0.5g,加水2ml溶解,再稀释至10ml,溶液应澄清,如果浑浊,与2号浊度标准液(澄清度检查法标准操作规程)比较不得更浓。
应符合规定,则判定该项合格。
4.3.3 PH值取溶液的澄清度项下的溶液,依法测定(详见PH值测定法标准操作规程)应为4.5~5.5。
应符合规定,则判定该项合格。
4.3.4 干燥失重取本品,在105℃干燥至恒重,减失重量不得过2.0%(详见干燥失重测定法标准操作规程)。
应符合规定,则判定该项合格。
诺氟沙星检测

诺氟沙星检测氟哌酸(又名诺氟沙星)检测摘要广谱抗生素。
无臭,味微苦;在空气中能吸收水分,遇光色渐变深。
本品在二甲基甲酰胺中略溶,在水或乙醇中极微溶解,在醋酸、盐酸或氢氧化钠溶液中易溶。
本品的熔点为218~224℃。
本品为胶囊剂,内容物为白色至淡黄色粉末。
药理毒理本品为氟喹诺酮类抗菌药,具广谱抗菌作用,尤其对需氧革兰阴性杆菌的抗菌活性高,对下列细菌在体外具良好抗菌作用:肠杆菌科的大部分细菌,包括枸椽酸杆菌属、阴沟肠杆菌、产气肠杆菌等肠杆菌属、大肠埃希菌、克雷伯菌属、变形菌属、沙门菌属、志贺菌属、弧菌属、耶尔森菌等。
对多重耐药菌亦具抗菌活性。
对青霉素耐药的淋病奈瑟菌、流感嗜血杆菌和卡他莫拉菌亦有良好抗菌作用。
诺氟沙星为杀菌剂,通过作用于细菌DNA螺旋酶的A亚单位,抑制DNA的合成和复制而导致细菌死亡。
实验分析方法名称高效液相色谱法测定氟哌酸的含量。
方法原理将待测品溶液注入高效液相色谱仪,利用C18色谱柱进行色谱分离,采用紫外吸收检测器于278nm波长处进行检测。
参照标准品谱图保留时间定性,外标法定量计算诺氟哌酸含量。
试剂1.0.025mol/L磷酸溶液(用三乙胺调节pH值至3.0)2.乙腈(色谱纯)3.三乙胺溶液4. 0.1mol/L盐酸溶液5.超纯水或二次蒸馏水仪器及设备1.高效液相色谱仪(紫外检测器)2.超声波3.溶剂过滤器装置4.针筒式过滤器5.振荡仪6.100ul微量进样器色谱条件色谱柱:Venusil ASB C18 色谱柱(4.6×250mm,5μm)S/N:S9520525B10050流动相:0.025mol/L磷酸溶液:乙腈=87%:13%(V:V)流速:1.0ml/min检测波长:280nm进样量:20ul(手动进样,20ul定量环)柱温:室温试样制备1. 标准品溶液的制备精密称取标准品适量,加流动相溶液溶解并配制成每mL含25μg 的溶液,即25μg/ml,振荡仪摇匀,微膜过滤,备用。
乳酸诺氟沙星原料药介绍及检测方法生产详情-精选文档

乳酸诺氟沙星检测方法
供试品溶液的制备 取适量,加水配制成每1ml中含1mg的溶液,作为供试品溶液,精密量取供试品溶 液10μl,注入色谱仪,调节灵敏度至主峰满量程的两倍以上,记录色谱图至主峰保留时间的两倍;以 峰面积归一法计算,各杂质峰面积的和不得大于总峰面积的1.0%。 干燥失重 取本品,在105℃干燥至恒重,减失重量不得过2%(中国药典1990年版二部附录55页)。 炽灼残渣 取本品1.0g的依法检查(中国药典1990年版二部附录56页)遗留残渣不得过0.2%。 重金属 取本品炽灼残渣项下遗留的残渣,依法检查(中国药典1990年版二部附录51页第二法)含重 金属不得过百万分之十五。 【含量测定】取约0.25g,精密称定,加冰醋酸20ml,溶解后加橙黄Ⅳ指示液10滴,用高氯酸液 (0.1mol/L)滴定至溶液显深红色,并将滴定的结果用空白试验校正。每1ml的高氯酸液(0.1mol/L) 相当于40.94mg的C16H18FN3O3· C3H6O3。 【类别】抗生素类药。 【制剂】乳酸诺氟沙星注射液。 【贮藏】遮光、密封、干燥处保存。
乳酸诺氟沙星包装
乳酸诺氟沙星包装
应为4.5-5.5。
溶液的澄清度 取0.5g,加水2ml溶解,再稀释至10ml,溶液应澄清,如果混浊,与2号浊 度标准液(中国药典1990年版二部附录58页)比较不得更浓。 有关物质 照高效液相色谱法(中国药典1990年版二部附录34页)测定。 用十八烷基硅烷键合硅胶为填充剂;以0.1%KH2PO4水溶液-乙腈(85∶15)为流动相; 检测波长为279nm;理论塔板数按乳酸诺氟沙星计算不低于1500,主峰与杂质峰的分离度 应符合规定。
相关产品
10.甲磺酸培氟沙星 70458-95-6
11.乳酸环丙沙星 97867-33-9 12.乳酸甲氧苄啶 23256-42-0 13.乳酸诺氟沙星 97867-34-0 14.烟酸诺氟沙星 118803-81-9 15.盐酸诺氟沙星 104142-93-0 16.诺氟沙星 70458-96-7 17.盐酸环丙沙星一水合物 86393-32-0 18.喹烯酮 81810-66-4 19.盐酸左氧氟沙星 177325-13-2 20.盐酸洛美沙星 98079-52-8 21.甲磺酸加替沙星 22.盐酸恩诺沙星 112732-17-9
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
取诺氟沙星对照品约50mg,精密称定,同上法制得。
计算结果:根据二者吸收度的比值计算,并将计算结果乘以1.28,即得.
样品编号
内容
1
2
样品取量VS(g)
样品吸收度AS
对照品取量Wc
对照品吸收度Ac
计算公式: X= AS*Wc*N*1.28/VS*S*Ac
N(对照品含量)= S=5%
样品百分含量
检验结论:
本品按<<乳酸诺氟沙星可溶性粉内控质量标准(成品)>>检验,结果规定。
备注:
负责人: 复核人: 检验人:
有限公司
成品检验报告单
文件编号:00第3页共3页
检品名称
乳酸诺氟沙星可溶性粉
检验单号
商 品 名
请验部门
西药粉剂车间
生产日期
年 月 日
规 格
生产总量
取样数量
生产批号
取 样 人
送检日期
年 月 日
报告日期
年 月 日
检验依据
<<乳酸诺氟沙星可溶性粉内控质量标准(成品)>>
检验项目 标准规定 检验结果 项目结论
(4)在335、323、273nm
波长处有最大吸收规定
(3)、检查
1.干燥失重 不得过10.0%规定
2.装量 应符合规定规定
3. 含量测定:
含乳酸诺氟沙星应为
标示量的92.0%~108.0% 规定
检验结论:
本品按<<乳酸诺氟沙星可溶性粉内控质量标准(成品)>>检验,结果规定。
备注:
负责人: 复核人: 检验人:
年 月 日
规 格
生产总量
取样数量
生产批号
取 样 人
送检日期
年 月 日
报告日期
年 月 日
检验依据
<<乳酸诺氟沙星可溶性粉内控质量标准(成品)>>
检验项目 标准规定 检验结果 项目结论
(1)、性状 本品应为类白色
或淡黄色结晶性粉末规定
(2)、鉴别 (1)应呈正反应规定
(2)应呈正反应规定
(3)应呈正反应规定
检验结果:
鉴别
(1)取本品适量(约相当于乳酸诺氟沙星50mg),置干燥试管中,加氢
氧化钠约10mg,丙二酸30mg,醋酐0.5ml,在80-90℃水浴中加热5-10分钟,应显红棕色。
检验结果:
(2)去本品适量(约相当于乳酸诺氟沙星25mg),置试管中,加水5ml
使溶解,加氢氧化钠溶液(0.5mol/L)0.3ml,显乳酸盐的鉴别反应。
含量平均值
标准规定:含乳酸诺氟沙星应为标示量的92.0%~108.0%。
项目结论:
检验结论:本品按<<乳酸诺氟沙星可溶性粉内控质量标准(成品)>>检验,结果
规定。
备注:
复核人:检验人:
有限公司
成品检验报告单
文件编号:00第3页共3页
检品名称
乳酸诺氟沙星可溶性粉
检验单号
商 品 名
请验部门
西药粉剂车间
生产日期
每袋装量不得少于标示量,平均装量不得少于标示量
项目结论
干燥
失重
天平室温度 ℃ 湿度 %
干燥条件
60℃真空干燥至恒重
检品号
1
2
称量瓶重W0
瓶+药重W1
干燥后瓶+药重W2
复核人: 检验人:
有限公司
成品检验记录附页
文件编号:00第2页共3页
计算公式
W1- W2
干燥失重=
W1- W0
干燥失重
平均值
标准规定
减失重量不得过10.0%
检验结果:
(3)取本品约1g,加水10ml使溶解,取2ml,显枸橼酸盐(1)的鉴别
反应;另取本品约0.1g,显枸橼酸盐(2)的鉴别反应。
检验结果:
(4)取含量测定项下的溶液,照分光光度法测定,在335、323和273nm
的波长处有最大吸收。
检验结果:
检查
装量
样品号
1
2
3
药+包装重
包装重
药重
平均
标准规定
项目结论
含量测定:乳酸诺氟沙星可溶性粉 室温: ℃ 湿度: %
主要分析仪器
名称
型号
精度
编号
分析天平
BT25S
0.0001Biblioteka MHT-002紫外分光光度计
UV-1800PC
---------
MHT-003
样品制备: 取本品适量(约相当于乳酸诺氟沙星64mg),精密称定,置200ml量瓶中,加氢氧化钠液(0.1mol/L)振摇使溶解,用氢氧化钠液(0.1mol/L)稀释至刻度,摇匀,精密量取2ml,置100ml量瓶中,用氢氧化钠液(0.1mol/L)稀释至刻度,摇匀。
(1)、性状 本品应为类白色
或淡黄色结晶性粉末规定
(2)、鉴别 (1)应呈正反应规定
(2)应呈正反应规定
(3)应呈正反应规定
(4)在335、323、273nm
波长处有最大吸收规定
(3)、检查
1.干燥失重 不得过10.0%规定
2.装量 应符合规定规定
3. 含量测定:
含乳酸诺氟沙星应为
标示量的92.0%~108.0% 规定
有限公司
成品检验记录首页
文件编号:00第1页共3页
检品名称
乳酸诺氟沙星可溶性粉
检验单号
商 品 名
请验部门
西药粉剂车间
生产日期
年 月 日
规 格
生产总量
取样数量
生产批号
取 样 人
送检日期
年 月 日
报告日期
年 月 日
检验依据
<<乳酸诺氟沙星可溶性粉内控质量标准(成品)>>
性状
本品为类白色或淡黄色结晶性粉末。
