硅及其化合物练习题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硅及其化合物练习题
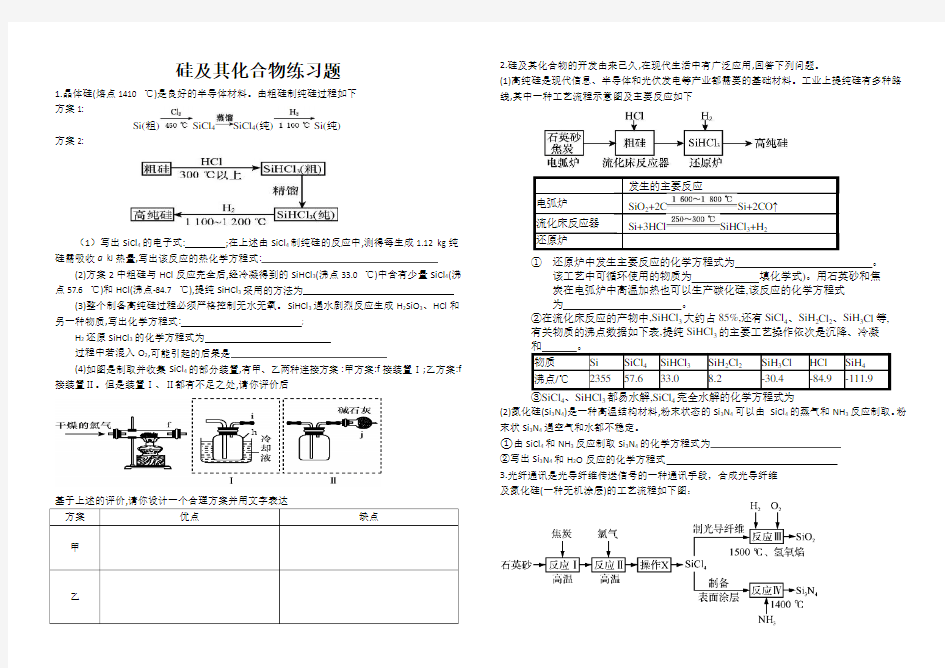
1.晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下
方案1:
方案2:
(1)写出SiCl4的电子式:;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:
(2)方案2中粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为
(3)整个制备高纯硅过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出化学方程式:;
H2还原SiHCl3的化学方程式为
过程中若混入O2,可能引起的后果是
(4)如图是制取并收集SiCl4的部分装置,有甲、乙两种连接方案:甲方案:f接装置Ⅰ;乙方案:f 接装置Ⅱ。但是装置Ⅰ、Ⅱ都有不足之处,请你评价后
基于上述的评价,请你设计一个合理方案并用文字表达
方案优点缺点
甲
乙2.硅及其化合物的开发由来已久,在现代生活中有广泛应用,回答下列问题。
(1)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下
(2)氮化硅(Si3N4)是一种高温结构材料,粉末状态的Si3N4可以由SiCl4的蒸气和NH3反应制取。粉末状Si3N4遇空气和水都不稳定。
①由SiCl4和NH3反应制取Si3N4的化学方程式为
②写出Si3N4和H2O反应的化学方程式
3.光纤通讯是光导纤维传送信号的一种通讯手段,合成光导纤维
及氮化硅(一种无机涂层)的工艺流程如下图:
Si(粗)SiCl4SiCl4(纯)Si(纯)
发生的主要反应
电弧炉SiO
2
+2C Si+2CO↑
流化床反应器Si+3HCl SiHCl
3
+H2
还原炉
①还原炉中发生主要反应的化学方程式为。
该工艺中可循环使用的物质为填化学式)。用石英砂和焦
炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式
为。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,
有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝
和。
物质Si SiCl4SiHCl3SiH2Cl2SiH3Cl HCl SiH4
沸点/℃2355 57.6 33.0 8.2 -30.4 -84.9 -111.9
434
(1)反应Ⅰ的化学方程式为________________________,氧化剂为________(填化学式)。
图中“操作X”的名称为____________;PCl3的电子式为
(3)反应Ⅲ和Ⅳ中尾气的用途为________;反应Ⅳ的化学方程式为
4.英国会议员代表团曾到广州、东莞、深圳考察,来中国取经“碳捕捉”技术,希望能与广东省合作开发潮汐能。科学家利用NaOH 溶液“捕捉”空气中的CO2,反应过程如下图所示。下列有关说法不正确的是( )
A.图中循环Ⅰ中的物质是NaOH
B.图中X 中物质分离的基本操作是蒸发结晶
C.用该方法捕捉到的CO2还可用来制备甲醇等产品
D.二氧化碳“捕捉”室中,将NaOH 溶液进行“喷雾”,有利于对CO2的吸收
5.水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如下图所示回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是________________还可使用__________代替硝酸。
(2)沉淀A 的主要成分是________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为_____________________
(3)加氨水过程中加热的目的是__________________。沉淀B 的主要成分为____________、____________(填化学式)
(4)草酸钙沉淀经稀硫酸处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:MnO-4+H++H2C2O4―→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为________
6.平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO 等物质),某小组以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4。
已知:CeO2不溶于强酸或强碱;Ce3+易水解,酸性条件下,Ce4+有较强氧化性
(1)滤液A 的主要成分为________(填写化学式),滤液B 所含金属阳离子为_________
(2)反应①的离子方程式是_________________________。
(3)反应①之前要洗涤滤渣B,对滤渣B 进行“洗涤”的实验操作方法是____________
(4)反应②的化学方程式是__________________________
(5)稀土元素的提纯,还可采用萃取法。已知化合物HT作为萃取剂能将铈离子从水溶液萃取出来,过程表示为Ce2(SO4)3(水层)+6HT(有机层) 2CeT3(有机层)+3H2SO4(水层),用
组分名称SiCl4SiHCl3SiH2Cl2HCl BCl3PCl3质量分数0.545 0.405 0.0462 0.0003 0.00193 0.00157 沸点/℃57.6 31.8 8.2 -85 12.5 75.5
