Western Blot实验指导教程
westernblot电泳原理及步骤

westernblot电泳原理及步骤一、概述西方印迹(w es te rnb l ot)是一种重要的蛋白质分析技术,广泛应用于分子生物学和生物化学研究中。
它通过将待检蛋白质进行SD S-P AG E电泳分离,再转移到聚合物膜上,利用特异性抗原与抗体结合的原理,检测目标蛋白质的存在与表达水平。
二、原理1.SD S-PA GE电泳分离-准备样品:将待检蛋白质样品加入去离子水、蛋白质缓冲液和还原剂混合,使蛋白质变性和解聚。
-加载样品:将样品加入聚丙烯酰胺凝胶(p ol ya cr yl am id eg e l)孔上。
-电泳分离:将准备好的凝胶置于电泳槽中,通电使蛋白质在凝胶中由负极向正极运动分离。
2.转膜-准备转膜装置:将P V DF或N C膜与吸水性纸张浸泡后,叠放在转膜装置中,并按压缩成一整体。
-预处理转膜:将转膜装置放入转渍缓冲液中浸泡,使其湿润。
-转移:将电泳完的凝胶与转膜装置层叠,加上固定层叠板,施加压力进行转膜。
3.免疫检测-封闭:将转膜后的膜置于封闭液中,阻断非特异性结合位点,减少背景信号。
-孵育:将膜与目标蛋白对应的一抗抗体孵育,使其与目标蛋白特异性结合。
-洗涤:用洗涤缓冲液洗去非特异性结合的抗体。
-二抗检测:将膜与与一抗相应的辣根过氧化物酶标记的二抗孵育,二抗与一抗结合形成复合物。
-显示:加入发色底物,与酶催化反应,生成可视化的蛋白质带谱。
三、操作步骤1.准备样品-将待检蛋白质样品加入适量去离子水、蛋白质缓冲液和还原剂混合。
-完全溶解样品,可加热至95°C处理。
2.SD S-PA GE电泳分离-准备分离凝胶:根据目标蛋白质的分子量选择合适浓度的凝胶。
-加载样品:用自动吸管或微量注射器将样品均匀地加载到聚丙烯酰胺凝胶孔上。
-启动电泳:将准备好的凝胶放入电泳槽中,加入电泳缓冲液,通电进行电泳。
3.转膜-准备转膜装置:按照转膜装置的说明书操作,准备好转膜膜和膜瓶。
-预处理转膜:将PVD F或N C膜与吸水性纸张浸泡,并放入转膜缓冲液中浸泡片刻。
Western Blot实验详细步骤

Western Blot实验技术一、制胶SDS-PAGE分离胶配方表1、检查制胶器是否漏水,吸干玻璃中水分2、配置分离胶,加入玻璃板中(注意:不能有气泡和杂物),距离玻璃上口1.5mL 停止加胶。
3、再加ddH2O或异丁醇水封除去气泡,凝胶后倒掉水,吸干水到浓缩胶插梳。
二、上样1、先在内槽加满电泳液才可以拔梳子。
2、拔梳子时垂直向上拔出,不可左右摇晃梳子。
3、拔完梳子后观察梳子孔,是否有缺口和歪,用针头拨正。
4、上样时从左到右依次上样。
5、若上样组不多时,左右第一孔不加样。
6、要预留Marker的上样孔。
三、电泳四、转膜PVDF膜即聚偏二氟乙烯膜(polyvinylidene fluoride)是蛋白质印迹法中常用的一种固相支持物。
PVDF膜是疏水性的,膜孔径有大有小,随着膜孔径的不断减小,膜对低分子量的蛋白结合就越牢固。
(转膜缓冲液:需4度预冷,现配现用,不能放太久。
)1、转印滤纸:全胶长8.5cm,宽5.5cm,需剪裁成7层滤纸,压平后约3mm。
需在转膜缓冲液中平衡浸泡备用。
2、海绵垫:在转膜液中平衡浸泡备用。
3、PVDF膜:剪裁8.5cm*5.5cm ,需在甲醇中浸润2min(活化膜上正电基团),然后在转膜缓冲液中平衡浸泡备用。
4、凝胶:凝胶也需要在预冷的转膜转膜缓冲液中平衡浸泡3-5分钟。
否则在转膜过程中会出现皱缩,导致出现转移的条带变形。
三明治夹心法:负极(黑)-海绵垫-滤纸-胶-PVDF膜-滤纸-海绵垫-正极(白)转膜时间:通电恒流,60V,一个槽100mA左右,1h(注意:在操作过程中用玻棒赶走气泡。
装置转膜仪时注意黑对黑(负对负),白对红(正对正)。
装置运行时需冰浴。
)五、封闭在进行抗体杂交之前,需要先对转印膜进行封闭,以防止抗体对非转印蛋白区域的非特异性吸附。
封闭一般采用异源性蛋白质或去污剂,本实验室常用的有5%BSA,10%脱脂奶等,至于选择哪一类封闭液,首先应考虑与检测目的相适应(做l酪氨酸磷酸化时不推荐non-fat milk 封闭)。
western blot实验步骤

一、提取组织蛋白新鲜肺组织取20-30mg,减去气管,组织匀浆机研磨,100W超声3S,12000r/min离心37℃孵育30min,测OD562。
按所得结果定量到50微升计算上样量,将20微升上清分装到一个1.5ml的EP管,加5微升上样缓冲液,-20℃冻存。
二、煮样95℃,煮10min,待温度降到室温关闭机器,煮后的组织离心7500r/min,1min备用三、安装玻璃板,倒入电泳缓冲液,拔梳子,用进样针吸取计算的上样量上样,装好正负极,倒满电泳液,设置80V,30min跑条带,结束后100V,60min,没跑到底酌情延长时间(30min),准备转膜所需工具:1.剪好6片滤纸,转膜液湿润海绵及滤纸,赶气泡。
2.PVDF膜,准备甲醇激活膜2min,蒸馏水5min电泳时间到关闭电源,取出玻璃板,准备切胶,切好后,按形状切稍大一圈的PVDF膜,覆盖到切好的胶上,标记好上下。
安好夹子,放入电泳槽准备转膜,转膜需冰浴。
四、转膜结束后,将膜取下,TBST清洗3遍,每遍5min。
五、7%牛奶(1.75g,加TBST 25毫升),封闭2小时,慢摇。
六、封一抗内参:β-actinα-SMA:1:10000配制波形蛋白:1:5000制备杂交袋,放入膜,滴入抗体,封口,4℃过夜七、将过夜的膜放入37℃恒温箱中孵育30min,结束后回收一抗,标记好第几次用,TBST清洗膜3遍,每遍10min。
八、封二抗:羊抗兔HRP(1:5000)稀释,配制10ml,慢摇1小时后回收二抗,标记好第几次。
TBST清洗膜3遍,每遍15min。
九、1:1配制发光液(避光保存),准备眼科镊、滤纸、托盘、曝光,先曝背景再报条带,先自动后手动。
Western blot实验技术全攻略!附详细操作步骤

随着生物学领域的不断发展,Western blot(蛋白质印迹)实验技术已成为研究蛋白质表达和相互作用的重要手段。
本文将为大家提供一份Western blot实验技术全攻略,附详细操作步骤,希望对大家的科研工作有所帮助。
Western blot实验技术全攻略第一步:制备样品Western blot实验需要使用蛋白质样品,因此首先需要制备样品。
一般来说,可以从细胞、组织或生物液中提取蛋白质。
提取蛋白质的方法有很多种,例如细胞裂解、超声波破碎、切片法等。
提取后的样品需要通过蛋白质定量方法确定蛋白质的浓度。
第二步:电泳分离蛋白质将制备好的样品经过蛋白质电泳分离,将蛋白质分离成不同的带状条带。
电泳分离可以采用SDS-PAGE或非变性PAGE方法。
SDS-PAGE适用于大多数蛋白质,这种方法可以将蛋白质分离成不同的分子量带状条带。
非变性PAGE则适用于大分子蛋白质和蛋白质复合物的分离。
第三步:转移蛋白质将分离好的蛋白质转移到聚丙烯酰胺凝胶膜(PVDF)或硝酸纤维素膜(NC)上。
转移蛋白质可以采用湿式电转移或半干式电转移方法。
湿式电转移适用于小分子蛋白质的转移,而半干式电转移则适用于大分子蛋白质的转移。
第四步:阻断和孵育将转移膜放入含有牛血清白蛋白(BSA)或非脂类干奶粉的TBST中,进行阻断。
然后将膜孵育于含有一定浓度的一抗体的TBST中,以便与目标蛋白结合。
第五步:检测和成像将膜孵育于含有适量的二抗体的TBST中,以便与一抗体结合。
二抗体通常被标记为辣根过氧化物酶(HRP)或碱性磷酸酶(AP)。
在使用HRP的情况下,将膜浸泡在ECL底物中,然后用射线或荧光成像系统观察蛋白质的信号。
在使用AP的情况下,将膜浸泡在BCIP 和NBT底物中,然后用射线或荧光成像系统观察蛋白质的信号。
下面是Western blot实验的详细操作步骤:1. 蛋白质提取:将待测样品(如细胞、组织等)进行裂解,以获得蛋白质样品。
2. SDS-PAGE电泳:将蛋白质样品进行电泳分离,以分离不同大小的蛋白质。
western blot 超详细步骤

一、蛋白质的样品制备:一、溶液:裂解液及蛋白酶抑制剂(每毫升裂解液加20ulcocktail)二、操作步骤:1、6孔板置于冰上,细胞经预冷的PBS漂洗3次,每孔加入100μl裂解液,5min 后用细胞刮刀刮取细胞,用枪头转移至1.5mlEP管中,编号置于冰上。
2、以上所得的样品用超声细胞破碎仪超声处理,超声时间为3S,间歇时间为10S,重复三次。
3、于4℃离心机(预冷)12000r离心15min,取上清,收集于0.5mlEP管中。
二、蛋白浓度的测定(BCA法测定蛋白浓度)1.取标准蛋白(2mg/ml)备用。
2.于标准蛋白稀释为2mg/ml 1mg/ml 0.5 mg/ml 0.25 mg/ml 0.125mg/ml 0mg/ml,96孔板中每孔加入10ul,设3个复孔,待测蛋白稀释8倍,每孔加入10ul,设3个复孔,每孔加入BCA工作液(A液:B液=50:1混匀)90ul,37℃温浴30min,酶标仪测出各吸光度值,EXCEL输入数据,绘制标准曲线。
测出待测蛋白浓度。
测完蛋白含量后,计算含30、50μl蛋白的溶液体积即为上样量。
按上样量取出样品至0.5ml的EP管中,加入5×SDS 上样缓冲液至终浓度为1×。
后蛋白于95℃煮5min(干湿温箱预热)。
样品于-80℃保存。
三、电泳1.制胶分离胶:电泳凝胶浓度试剂 10%H2O(ml) 4.030%丙烯酰胺 3.31.5mol/lTris.cl(PH8.8) (ml)2.510%SDS(ml) 0.110%AP(ml) 0.1TEMED(μl) 5总体积(ml) 10浓缩胶试剂浓度(5%)H2O(ml) 230%丙烯酰胺(T: 30%,C: 3%(ml) 0.51.0mol/lTris.cl(PH8.8) (ml) 0.510%SDS(μl) 4010%AP(μl) 30TEMED(μl) 4总体积(ml) 31、玻璃板对齐后放入夹中卡紧。
Westernblot实验技术

Western blot试剂配制1. 30%丙烯酰胺:29.2g丙烯酰胺用温热(利于溶解双丙烯酰胺)的去离子水(超纯水)溶后定容到100ml,过滤后于棕色瓶中储存0.8gN, N’-亚甲双丙烯酰胺注意:丙烯酰胺和双丙烯酰胺在贮存过程中缓慢转变为丙烯酸和双丙烯酸,这一脱氨基反映是光催化或碱催化的,故应核算溶液的pH值不超过7.0。
这一溶液置棕色瓶中贮存于4℃,每隔几个月须重新配制。
小心:丙烯酰胺和双丙烯酰胺具有很强的神经毒性并容易吸附于皮肤。
2. 10%SDS:称5gSDS,超纯水溶解后,定容到50ml。
贮存液保存于室温。
3. 10%AP(过硫酸铵):称1gAP,溶于8ml超纯水中,定容到10ml,小量分装(250ul/管)保存于-20℃,过硫酸铵提供驱动丙烯酰胺和双丙烯酰胺聚合所必需的自由基,每次使用均要用新鲜的。
4. 1.5MTris-HCl:称18.2gTris(Mr=121.14)加50ml超纯水溶解后,用浓HCl调pH值8.8,定容到100ml。
5. 0.5MTris-HCl:称3gTris(Mr=121.14)加25ml超纯水溶解后,调pH值6.8,定容到50ml。
6. TEMED (N,N,N’,N’-四甲基乙二胺):TEMED通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合。
一旦加入TEMED,立即开始聚合,故应立即快速旋动混合物并进入下步操作。
7. 10×Tris-甘氨酸电泳缓冲液【10×(25mMTris+0.25M+0.1%SDS)】pH8.330.3g Tris 15.15g Tris187.65g Glycine 溶于超纯水中,定容到1000ml 93.825g Glycine 5×缓冲液10g SDS 5g SDS8. 2×SDS上样缓冲液:2×(50mMTrispH6.8+2%SDS+10%甘油+0.1%溴酚蓝+50mMβ-巯基乙醇)loading buffer10ml 0.5M Tris-HCl (pH6.8)2g SDS10ml 甘油超纯水定容到50ml。
western blot实验步骤

蛋白质的提取(整个过程冰上进行)一.组织膜蛋白裂解液bufferA+1%蛋白酶抑制剂蛋白保存液40%SDS+60%RIPA+1%蛋白酶抑制剂1.-80°C冰箱中取出组织放入研磨管中(研磨管和配套的研磨棒事先用去离子水冲洗,用纸吸干水)按600-700μl/100mg组织加裂解液研磨(研磨后研磨管和研磨棒用去离子水冲洗,用纸吸干水)2.用1000枪转入1.5ml离心管中4°C离心,1500转15min3.用1000枪将上清转入差速离心专用离心管中(离心管事先用去离子水冲洗)用裂解液配平4.差速离心33000-35000转(45000g)30min5.弃上清,沉淀加入150μl左右蛋白保存液(根据沉淀的量调整)用枪来回吹打使沉淀溶解,枪头在液面下,尽量不要出沫6.将上述液体分装到0.5ml离心管中,每管20-25μl,留一管-20°C保存测浓度,其余放入-80°C保存二.组织总蛋白裂解液40%SDS+60%RIPA+1%蛋白酶抑制剂1.-80°C冰箱中取出组织放入研磨管中(研磨管和配套的研磨棒事先要用去离子水冲洗,用干净的纸擦干)按600-700μl/100mg组织加裂解液研磨(研磨后研磨管和研磨棒用去离子水冲洗,用纸吸干水)2.用1000枪转入1.5ml离心管中4°C离心,13500转30min3.取上清分装到0.5ml离心管中,每管20-25μl,留一管-20°C保存测浓度,其余放入-80°C保存三.细胞总蛋白裂解液RIPA+1%蛋白酶抑制剂1.将培养瓶中培养液倒掉,加入PBS冲洗5-6遍,倒掉PBS,用枪吸出倒不尽的PBS2.每瓶加100-150μl裂解液,用细胞刮刀尽量将细胞刮下来(刮刀用前去离子水冲洗,用纸吸干水,用完一样处理)用200枪转入1.5ml离心管中3.超声破碎细胞,频率80-100间,超声探头(用前用纸擦,用后用纸擦并盖上盖)插入液面下,超声3-5s停3-5s,总共20s左右,停止5min左右4.重复上步4-6次5.4°C离心13500转15min6.取上清分装到0.5ml离心管中,每管40μl,留一管-20°C保存测浓度,其余放入-80°C保存。
western blot实验实验步骤

western blot实验实验步骤
Western blot实验步骤如下:
收集蛋白样品:使用细胞裂解液,对贴壁细胞、悬浮细胞或组织样品进行裂解。
然后测定每个蛋白样品的蛋白浓度。
SDS-PAGE凝胶配制:参考一些文献资料进行配制。
样品处理:在收集的蛋白样品中加入适量浓缩的SDS-PAGE蛋白上样缓冲液。
例如2X或5X的SDS-PAGE蛋白上样缓冲液。
使用5X的SDS-PAGE蛋白上样缓冲液可以减小上样体积,在相同体积的上样孔内可以上样更多的蛋白样品。
5X的SDS-PAGE蛋白上样缓冲液可以参考相关文献资料配制,100℃或沸水浴加热3-5分钟,以充分变性蛋白。
上样与电泳:将处理后的蛋白样品冷却到室温后,直接上样到SDS-PAGE胶加样孔内即可。
Western blot步骤

Western blot操作步骤(一)BCA法测定蛋白质含量1.按照BCA方法,利用酶标仪建立蛋白标准曲线;2.测试样品蛋白含量,以计算出合理的上样量。
(二)SDS-PAGE凝胶电泳1.按装模具:取两块玻璃板(1.5 mm厚度),洗净风干后,安装玻璃板,确保下端对齐,不漏液。
2.制备分离胶,分离胶浓度依据所测蛋白分子量来确定。
3.分离胶的灌注:凝胶混匀后,灌入已安装好的玻璃板中,至玻璃板上缘约2cm左右止,缓缓加入超纯水,覆盖在分离胶顶部,防止因氧气扩散进入凝胶而抑制聚合反应,室温聚合。
4.配制浓缩胶,待分离胶聚合后,倒去超纯水,并用滤纸吸干残留的液体,灌制浓缩胶。
5.浓缩胶灌到已聚合的分离胶之上,保持短玻璃板齐平,并立即在浓缩胶溶液中插入干净的梳子,在此过程中应避免气泡的产生,室温聚合。
6.浓缩胶完全聚合后,小心拔出梳子,凝胶玻璃板固定于电泳装置上,放入电泳槽内。
在内外槽内加入1×SDS电泳缓冲液,使电泳装置底部的电极丝完全浸入缓冲液中。
7.样品准备:样品中加相应的上样缓冲液,放入沸水中加热3-5min,然后上样。
8.电泳:上样完成后,接通电源。
浓缩胶部分保持恒压80 V,分离胶保持120V,电泳至溴酚蓝到达分离胶的底部时停止。
(三)Western blot (免疫印迹法检)1.电泳结束后,从电泳装置上卸下玻璃板,取出凝胶。
去除上层的浓缩胶,将凝胶置于转移缓冲液中浸泡30 min;2.准备与胶同样形状、大小的PVDF膜和2张滤纸,将膜和滤纸置于转移缓冲液中浸泡20 min。
(PVDF膜必须先在甲醇溶液中浸泡激发);3.湿转:将凝胶、PVDF膜、滤纸、棉垫在转移缓冲液中充分浸泡后进行三明治叠板(由负极到正极依次为,棉垫-滤纸-凝胶-PVDF膜-滤纸-棉垫);4.接通电源,所转膜蛋白的分子量设置电压,开始转膜(转膜过程在冰浴环境中)。
(四)免疫检测1.将转好的PVDF膜放入培养皿中,加入适量的封闭液,在4℃冰箱中过夜(或室温封闭2 h);2.按抗体的效价用5%的BSA(或封闭液)稀释抗靶蛋白特异性抗体(一抗)。
完整版WesternBlot免疫印迹法实验方法步骤

Western Blot(免疫印迹法)实验方法步骤发布日期:2008-8-25 热门指数:4360Western Blot(免疫印迹法)主要包括以下4个基本步骤:n 样品制备n 电泳分离n 蛋白的膜转移n 免疫杂交与显色――蛋白检测溶液和试剂n 1X 磷酸盐缓冲液(PBS)n Modified RIPA bufferTris-HCl: 50 mM, pH 7.4 ; NP-40: 1% ;Na-deoxycholate: 0.25% ;NaCl: 150 mM ;EDTA: 1 mM ;PMSF: 1 mM ;Aprotinin, leupeptin, pepstatin: 1 microgram/ml each ;Na3VO4: 1 mM ;NaF: 1 mMn 1X SDS 样品缓冲液62.5 mM Tris-HCl (pH 6.8 于25°C), 2% w/v SDS, 10%甘油,50 mM DTT, 0.01% w/v溴酚蓝n 转移缓冲液25 mM Tris base, 0.2 M 甘氨酸, 20%甲醇(pH 8.3)n 10X Tris缓冲盐(TBS)准备1L 10X TBS: 24.2 g Tris base, 80 g NaCl;用1N HCl调pH为7.6n 脱脂奶粉或BSAn 甲醇n TBS/T缓冲液1X TBS, 0.1% Tween-20)TBS/T封闭缓冲液(n1X TBS, 0.1% Tween-20加5% w/v脱脂奶粉或BSAn 一抗的稀释1X TBS, 0.1% Tween-20 加5% BSA (多抗)或5%脱脂奶粉(单抗)Note: 一般来说, BSA被推荐用于多克隆抗体,脱脂奶粉用于单克隆抗体,这样可得到较高的信噪比。
抗体的稀释度参考抗体说明书或根据实验确定。
n 预染的蛋白质Marker,可用于监测转膜的效率样品制备原始样品可为细胞、组织、培养上清、免疫沉淀或亲和纯化的蛋白,以下为定性检测目的蛋白时细胞样品的处理方法,其余的样品制备方法参阅相关文献。
Western blot具体实验操作步骤
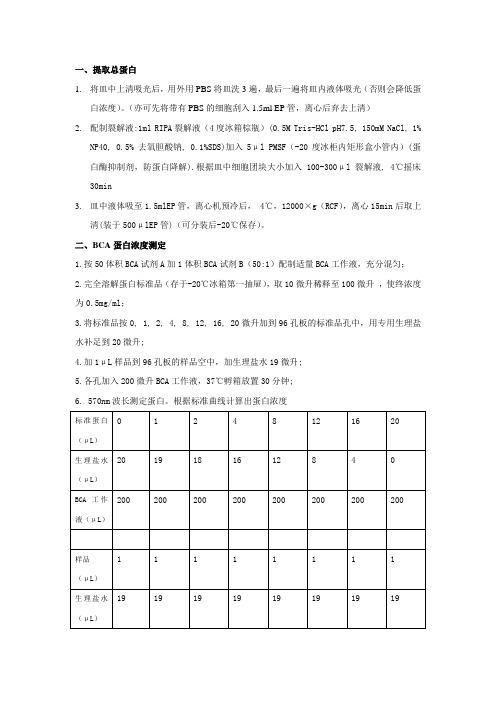
一、提取总蛋白1.将皿中上清吸光后,用外用PBS将皿洗3遍,最后一遍将皿内液体吸光(否则会降低蛋白浓度)。
(亦可先将带有PBS的细胞刮入1.5ml EP管,离心后弃去上清)2.配制裂解液:1ml RIPA裂解液(4度冰箱棕瓶)(0.5M Tris-HCl pH7.5, 150mM NaCl, 1%NP40, 0.5% 去氧胆酸钠, 0.1%SDS)加入5μl PMSF(-20度冰柜内矩形盒小管内)(蛋白酶抑制剂,防蛋白降解).根据皿中细胞团块大小加入100-300μl裂解液, 4℃摇床30min3.皿中液体吸至1.5mlEP管,离心机预冷后, 4℃,12000×g(RCF),离心15min后取上清(装于500μlEP管)(可分装后-20℃保存)。
二、BCA蛋白浓度测定1.按50体积BCA试剂A加1体积BCA试剂B(50:1)配制适量BCA工作液,充分混匀;2.完全溶解蛋白标准品(存于-20℃冰箱第一抽屉),取10微升稀释至100微升,使终浓度为0.5mg/ml;3.将标准品按0, 1, 2, 4, 8, 12, 16, 20微升加到96孔板的标准品孔中,用专用生理盐水补足到20微升;4.加1μL样品到96孔板的样品空中,加生理盐水19微升;5.各孔加入200微升BCA工作液,37℃孵箱放置30分钟;6. 570nm波长测定蛋白。
根据标准曲线计算出蛋白浓度EXCEL详细过程:标曲:上一行吸光度,下一行浓度(0,0.5,1,2,4,6,8,10),以此作标曲,标曲相关系数须达两个9,以这次的样品为例,算得两样品浓度分别为4.09和5.26 因为须上样100μg,所以算得须上样的蛋白体积=100/4.09=24.5μL所以上样须补水30-24.5=5.5μL及βme:6×SDS(2:3)为10μL现此样品蛋白体积足够煮10份,即按照245μL蛋白样品+55μL水+100μLβme:SDS(2:3)来配注意:SDS很粘,须涡旋再低速离心,使用枪时须慢吸三、煮蛋白:加样配制: 总体积:40μL(含蛋白液与dH2O混合物30μL+β-meSDS10μL)1.β-巯基乙醇(β-me):6×SDS(2:3)样品缓冲液10μL2.蛋白取量取一组蛋白中,样品蛋白加的体积=蛋白浓度最低的浓度*30μL/每个样品浓度3.剩余的体积即30μL-样品蛋白加的体积,即为各管需补加水的体积4.多加一点防煮时蒸发部分混和后file22-start100℃煮沸5 min。
Western Blot 详细实验步骤

Western Blot protocol1,制样:将获得的细胞用PBS洗涤,300gx4℃x5min,弃去上清。
加SDS loading buffer 搅拌转移到1.5ml离心管。
放到干浴锅100℃煮10min,放入冰上5min,最后存入-20℃冰箱待用。
2,将样品取出待用,可100℃煮2min,待上样。
3,配胶:浓缩胶5%,分离胶8%,10%或12%(分子大用低浓度,分子小用高浓度Caspase3 35kD,12%浓度(活性形式17kD);DAPK1/p-DAPK1 160KD 18%浓度):ddH2O,30%Acrylamide, 1.0M/1.5MTris-HCL, 10%SDS, 10% AP, TEMED按比例加。
1)夹好板子,用ddH2O捡漏,5min。
2)按照顺序加入试剂配胶配分离胶(50ml管子),混匀。
3)加胶7ml,大致与夹子的门平齐。
随后轻轻加3ml乙醇液封页面。
静置30min。
4)将乙醇倒掉,用ddH2O清洗3遍。
5)制备浓缩胶,加入3ml左右只玻璃板界面,插入梳子。
6)静置30min后拔掉梳子。
取下玻璃板用ddH2O 冲洗边缘。
7)若不立即使用可用保鲜膜将其包好放在4℃冰箱。
(TEMED在灌胶前加入)4,上样:1)固定好玻片,加入running buffer 没过底板,盖上盖子。
2)浓缩胶75-80V 30min左右,分离胶100V-120V 1h左右。
5,转膜:1)取出玻璃板,用切胶器轻轻撬动取掉小玻片,切去浓缩胶(将分离胶放入放入ddH2O水中浸泡5min,重复三次)再放入trans buffer中放置10min。
2)剪一块与胶一样大的PVDF膜放在甲醇中浸泡,使其带正电。
3)将PVDF,海绵垫,滤纸放入trans buffer浸泡几分钟。
4)在黑色面板依次放入海绵垫,至少3层滤纸,胶,转移膜,注意不能有气泡,再放滤纸,海绵垫形成夹心结构。
(大分子用0.4 um PVDF 膜,小分子用0.25um PVDF膜)。
WB-Western Blot实验步骤及讲解

概念
通过特异性抗体对凝胶电泳处理过的细胞或生物组织样品 进行着色,通过分析着色的位置、深度获得特定蛋白质在 所分析的细胞或组织中表达情况的信息。
一个基因表达终极结果是产生相应的蛋白质(或酶)。 因此检测蛋白质是测定基因表达的主要标志。
分类
➢ SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)
蛋白提取步骤
为了防止蛋白降解、去磷酸化,各种蛋白 酶抑制剂、磷酸酶抑制剂都是必须的。
1. 于-20℃冰箱取出蛋白裂解液及PMSF等,常温下溶解;BCA测试盒、5×Buffer置冰 上备用;将已高压消毒的匀浆器及弯镊置冰上冷却备用;开启低温离心机调至4℃ 备用、烤箱调至37℃备用。
2. 组织样本于冰上冻融后,称取适量组织(约30-50mg)放入匀浆器中,准确记录所 夹取组织重量。
蛋白提取步骤
5. 上述裂解液于低温离心机内离心,12000rpm×15min,4℃。 6. 离心完成后,小心取出离心管,可见液体分成3层,上层为白色脂肪层,中层为 澄清蛋白质溶液,下层为组织沉淀,用适当量程的移液枪小心吸取中间层蛋白溶 液于1.5mlEP管中,记录所吸取体积(ul)。 注意:宁可少吸不可多吸!
实验步骤
5、一抗孵育 根据目的蛋白选择对应的一抗及合适的稀释比例,用封闭液对抗体
进行稀释。一抗孵育条件:4℃冰箱,过夜(>12h)。
建议孵育抗体之前一定要仔细看抗体说明书, 了解抗体的种属来源和抗体的建议稀释比例。
实验步骤
6、洗涤一抗。PBST,摇床(80-90r/min),3次×15 min或4次×10 min 。
选择二抗抗体取决于一抗抗体的种属来源。 例如,如果一抗抗体是小鼠来源单克隆抗体,二抗抗 体必须是抗小鼠的抗体;如果一抗抗体是兔来源多克 隆抗体,二抗抗体必须是抗兔的抗体。
Western blot 实验步骤详尽版

Western bolt 实验步骤详尽版蛋白质SDS-PAGE凝胶电泳实验目的:分离目的蛋白实验仪器:移液枪,玻璃瓶,胶模,垂直板电泳槽,电泳仪,水浴锅,通风橱,染色和脱色用器皿实验材料:ddH2O,30%丙烯酰胺溶液(Acrylamide-Bisacrylamide 29:1),1.5M Tris-HCl,0.5M Tris-HCl,10%SDS,10%APS,TEMED,1*蛋白上样缓冲液,5*蛋白上样缓冲液,考马斯亮蓝R250,0.2M KCl溶液,欲染蛋白marker,1*SDS-PAGE电泳缓冲液实验步骤:1.安装制胶模具。
2.调制5ml 12%的分离胶,立即灌注至模具高度的70%(绿杠下缘)。
5ml 12%分离胶的配方:1.8ml ddH2O,2.0ml丙烯酰胺溶液,1.3ml 1.5M的Tris-HCl缓冲液,0.05ml 10%SDS,0.05ml 10%APS,0.002ml TEMED。
3.加一层ddH2O,约30分钟后聚合(胶凝固),胶层和水层可见折光界面。
4.倒出水并用滤纸把剩余的水分吸干。
5.调制1ml 5%浓缩胶,立即灌注,插入梳子。
静置。
1ml 5%浓缩胶配方:0.55mlddH2O,0.17ml丙烯酰胺溶液,0.26ml 0.5M的Tris-HCl缓冲液,0.01ml 10%SDS,0.01ml 10%APS,0.001mlTEMED。
6.胶凝后装配垂直板电泳槽,向电泳仪倒入1*SDS-PAGE电泳缓冲液,内槽倒满,外槽倒至一半高度。
7.取16μl蛋白样品与4μl的5*蛋白上样缓冲液混合,水浴锅内煮沸5分钟。
取6μl蛋白marker与6μl 1*蛋白上样缓冲液混合。
8.加样电泳,每孔加样12μl。
电泳参数为:70V 15分钟左右,150V 30分钟左右。
(时间可以调整,以欲染Marker各条带清晰为准)9.卸下玻板,剥离凝胶放在盛有转膜缓冲液的器皿内,切下目的蛋白所在区域的凝胶,注意保留欲染Marker,且最好保留多条欲染Marker条带(因此电泳时间也不要太长,让Marker紧凑一些)。
蛋白质印迹(Western blotting)实验操作步骤

蛋白质印迹/Western blotting实验操作步骤一、总蛋白的提取单层贴壁细胞总蛋白的提取:1)吸除培养液2)每皿细胞加4℃预冷的 PBS。
平放轻轻摇动 1min 洗涤细胞,然后弃去洗液。
重复上操作两次,共洗细胞三次以洗去培养液。
将PBS弃净后把培养瓶置于冰上。
(PBS会降低细胞裂解液的效价和总蛋白的浓度)3)加裂解液于冰上裂解 30 min,为使细胞充分裂解,培养瓶要经常来回摇动(可放置在4℃摇床裂解)。
4)裂解完后,用干净的刮棒将细胞刮于培养瓶的一侧(动作要快),然后用枪将细胞碎片和裂解液移至 1.5mL 离心管中。
(整个操作尽量在冰上进行)5)在EP管中将细胞震碎(10s/次,3次)6)于4℃下 12000rpm 离心 20-30 min。
(离心机提前预冷至4℃)7)将离心后的上清分装转移倒 1.5mL 的离心管中放于-20℃保存。
二、BCA法测蛋白浓度1)将BCA protein assay每孔 A液200μL,B液4μL混合,96孔板每孔加入22.5μLdd水,2.5μL蛋白提取液,200μLA+B混合液2)在烘箱中37℃,90r,孵育30min3)使用酶标仪测出吸光度后,使用公式y=0.9154x-0.118计算出蛋白浓度(浓度需要×10)4)将蛋白配成等浓度等体积(使用配置好的裂解液配),按照4:1加入5X loading buffer然后煮5min(100℃),放入-20℃保存三、SDS-PAGE电泳板子1.5mm,梳子1.5mm1)清洗玻璃板:一只手扣紧玻璃板,另一只手蘸点洗衣粉轻轻擦洗。
两面都擦洗过后用自来水冲洗2)验漏:玻璃板对齐后放入夹中卡紧,然后垂直卡在架子上,加满水验漏3)灌胶:验漏结束后用纸吸干水分,按方法配制下层胶(4mL+4mL+80μLAP),灌胶时,可用 1mL 枪吸取胶沿玻璃放出,待胶面升到绿带中间线高度时即可。
然后胶上加1 mL水,液封后的胶凝的更快。
Western Blot 实验方法

WB Protocol准备:提前在-80冻装水冰袋,检查各项溶液,甲醇等。
1、SDS-PAGE2、Western Blot1)转膜(湿转)48 mM Tris,39 mM glycine,20% methanol。
(半湿转)25mM Tris,192 mM glycine,20% methanol。
(湿转)如果蛋白<100kD,加入200ml甲醇,如果>100kD,加入100ml甲醇。
如果蛋白较大(>100KD,可以加入SDS至终浓度为0.1%。
)配制好的转膜缓冲液,-20度预冷1h后使用。
配制10⨯转膜缓冲液(1000 ml)(半湿转)Tris 58.147g M Tris=121.14Glycine 29.289g M Glycine=75.1定容至1000 ml。
配制10⨯转膜缓冲液(1000 ml)(湿转)Tris 30.3g M Tris=121.14Glycine 144g M Glycine=75.1定容至1000 ml。
溶解后室温保存。
用时稀释10倍,并加入甲醇至20%通常取80ml母液,加560ml蒸馏水,最加160ml甲醇,配制成800ml即可。
(先加甲醇易产生沉淀)。
最好现配现用,-20度预冷1h后使用。
(1)将样品在SDS-PAGE 电泳,移去平板,将凝胶剪成适当大小以进行转印。
在凝胶上作记号以确定方向,浸泡在电转液中。
(2)剪 1 张PVDF膜和6 张吸附滤纸,其大小与凝胶相当。
(3)将PVDF膜放入甲醇中浸泡3min 然后将膜转入转印缓冲液中浸泡30min。
同时将支持垫和滤纸浸泡于1 转膜缓冲液中浸湿。
(4)组装转印夹层组合:依次为负极(黑色)-支持垫-3张滤纸-胶-膜-3张滤纸-支持垫-正极(红色)。
将组装好的夹层组合放入转印槽中,并使膜靠近正极。
注:1. 海绵、滤纸均用电转液浸湿;2. 胶用电转液清洗;3. 小心地将支持垫及滤纸与膜中的气泡用玻璃棒排出4. 膜两边的滤纸不能相互接触,接触后会发生短路。
WesternBlot实验方法

WesternBlot实验⽅法⼀、溶液配制1.100mM NaF (NaF MW=41.99) 10 ml称取NaF 41.99mg,超纯⽔8ml溶解后定容⾄10ml2.30%聚丙烯酰胺凝胶液(交联度3%):100ml丙烯酰胺29 gN,N'-甲叉双丙烯酰胺 1 g加去离⼦⽔⾄100 ml 混匀,棕⾊瓶中避光保存3.0.01mol/L ⼄酸钠NaOAc(pH 5.2)(MW=136.08)25ml136.08×0.01×25×10-3=34 mg,称取34 mg⼄酸钠,加⼊20ml蒸馏⽔,待其溶解后,⼄酸调pH值⾄5.2,再定容⾄25ml。
4.1M DTT 10 mlDTT(⼆硫苏糖醇) 1.545g0.01mol/L ⼄酸钠(pH 5.2)8ml溶解后定容⾄10ml,0.22µm滤膜抽滤。
5.4×SDS-PAGE Loading Buffer 10ml0.2M Tris-HCl(pH=6.8) 1M 4 ml8% SDS 10% 0.8 g0.4% 溴酚蓝40 mg40% Glycerol 4 ml三蒸⽔定容⾄10 ml0.4M DTT 临⽤前1M贮存液按400 µl/ ml⽐例加⼊上述溶液中。
6. 1.5M Tris(pH 8.8) 100 mlTris 18.171 g加⼊三蒸⽔80 ml,溶解后加⼊浓HCl调pH值⾄8.8,定容⾄100ml7.1M Tris(pH 6.8) 100 mlTris 12.114 g加⼊三蒸⽔80 ml,溶解后加⼊浓HCl调pH值⾄6.8,定容⾄100ml8.1×电泳缓冲液:1000 ml0.25M Tris 3 g0.19M Glycine 14.4 g0.1% SDS 1g三蒸⽔定容⾄1000 ml9.1×Transfer Buffer:1000 ml0.25M Tris 3 g0.19M Glycine 14.4 g三蒸⽔定容⾄900 ml使⽤前加⼊甲醇100ml10.PBS Buffer137 mM NaCl 8g2.7 mM KCl 0.2 g10 mM Na2HPO4 1.44 g2 mM KH2PO4 0.24 g三蒸⽔定容⾄1000 ml调节pH值⾄7.4,⾼压灭菌,4℃保存11.PBST Buffer500 ml PBS中加⼊250 µl Tween-20。
Western blot-实验操作

Western blot-生物素标记蛋白配方:1.1转移缓冲液(TB)(48mmol/L Tris,39 mmol/L甘氨酸,20%甲醇)甘氨酸(MW75.07) 2.9gTris(MW 121.14) 5.8g甲醇 200mlDDI H2O 800ml共计1000ml溶解后室温保存,次溶液可重复使用3-5次。
1.2TBS缓冲液( 100 mmol/L Tris-HCl pH7.5,150 mmol/L NaCl)1 mol/L Tris-HCl (pH7.5)100ml 或12.1gNaCl 8.8gHCL调PH7.5DDI H2O 调至1000ml共计1000ml1.3 TBST缓冲液(含0.05%Tween20的TBS缓冲液)20%Tween20 1.65mlTBS 700ml1.4封闭液(含5%脱脂奶粉的TBST缓冲液)脱脂奶粉 5gTBST 100ml溶解后4保存。
使用时,恢复室温,用量盖过膜面即可,一次性使用。
1、平衡将要转移的胶置于转移缓冲液TB中(配方见2.1),平衡10min。
2、根据膜的大小剪取滤纸片、膜。
装配时滤纸片若是进口厚片只需2片,国产滤纸片需要6片,放入转移缓冲液平衡10min。
如用PVDF膜则在甲醇溶液中泡3-5S。
3、装配3明治,黑色面开始依次放海绵、滤纸(进口1层、国产3层)、胶、膜、滤纸(进口1层、国产3层)、海绵。
锁紧夹子。
注意每层放好后滤去气泡,胶放于负极面(黑色面)。
4、将转移槽装配好后,黑色面与黑色面相对,倒入转移缓冲液TB,置于冰浴中(可在脸盆中加入冰袋),插入电极,100V 2h,(电流约为0.3A)。
注意:应再次检查三明治和电极是否装配正确,电源是否接通。
5、转膜结束后,切断电源、取出杂交面。
6、免疫杂交与显色1)用25mlTBS(配方见2.2)洗膜5min、室温摇动。
2)把膜置于25ml封闭液(配方见2.5)中37o C,2h摇动。
3)15mlTBS/T洗3次(5min/T)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白免疫印迹杂交(Western Blot,WB)一、蛋白提取与样本制备(一)操作步骤1.提前解冻RIPA(蛋白裂解液),一定要完全融化;2.根据样本数配制混合溶液:PMSF(丝氨酸蛋白酶抑制剂):RIPA=1:100,现用现配);3.裂解组织:每个样品称取50mg,加1ml混合液,在冰上用组织剪剪减为碎屑,电动匀浆后4 ℃静置2h使其充分裂解,离心12000g,4 ℃15min,取上清;4.蛋白定量:1)取少量上清稀释10倍:2ul上清,加18ul生理盐水;2)标准品按5ug/ul至0.3125ug/ul的梯度进行倍比稀释(制作平行样的标准曲线:5mg/ml标准品取80ul + 生理盐水80ul);3)配制显色剂BCA混合液:a液:b液=50:1。
配制量=200ul*(孔数+6);4)加入稀释完成的各样到酶标板的孔中及BCA混合液200ul/孔;5)贴上封口胶,37℃震荡混匀30min;6)562nm波长处测吸光度OD;7)根据数据制图、添加趋势线、方程及R2。
5.样品OD值带入方程,计算出各样本原液蛋白浓度;6.样本蛋白浓度均一化(一般样品蛋白浓度为3-4mg/ml);7.100℃变性5min。
8.分装并存于-20 ℃,避免反复冻融。
二、配置相关试剂(一)10%的SDS(戴口罩称取):试剂剂量SDS (g)10双蒸水(ml)80用磁力加热搅拌助溶,然后定容至100ml。
室温保存,如在长期保存中出现沉淀,加温溶化后,仍可使用。
(二)1.5M Tris/HCl(pH8.8)试剂剂量Tris base (g)18.17双蒸水(ml)80用浓盐酸调至pH 8.8,最后定容至100ml。
室温下保存。
(三)0.5M Tris/HCl(pH6.8)试剂剂量Tris base (g) 6.06双蒸水(ml)80用浓盐酸调至pH6.8,最后定容至100ml。
室温下保存。
(四)丙/双丙(戴口罩称取)试剂剂量丙烯酰胺(Acr)(g)75亚甲双丙烯酰胺(g) 2去离子水(ml)230加热溶解后,定容至250ml,4℃棕色瓶避光保存。
使用时注意恢复至室温且无沉淀。
(五)10X电泳涤缓冲液试剂剂量Tris base (g)15甘氨酸(g)72SDS(g) 5去离子水(ml)500用HCl调pH至8.3。
已经配制了500ml的储存液。
室温保存。
(六)10X的TBS溶液配制试剂剂量Tris base(g)24.2NaCl(g)80去离子水(ml)1000用HCl调整PH为7.6,己经配制了1000ml的10X的TBS液。
室温保存。
(七)洗涤液的配制(TBST)试剂剂量10X TBS (ml)50TWeen-20 (ul)500去离子水(ml)450TWeen-20的体积为TBST的0.1%。
室温保存。
三、制胶(一)制作分离胶1.注意要点:(1) 下表中的数据为配制一板胶的用量;(2) 10%过硫酸铵溶液现用现配;(3) 根据所测蛋白分子量大小选择配制合适浓度的凝胶;(4)胶的凝固速度与10%过硫酸铵和IEMED的使用量呈正相关,冬天可适当加量或提高室温;(5) 加胶(水)时,从左上角沿着边缘缓慢匀速加入,避免混入气泡(或胶面不平整);(6) 加入的胶中混有小气泡时可轻弹玻璃板使之浮出;2.操作方法:(1) 配制10%过硫酸铵溶液500ul:选用1.5ml的EP管,在微量天平上去皮,称取过硫酸铵粉末50mg,加入去离子水500ul,在振荡器上混匀至过硫酸铵完全溶解。
(2) 取酒精棉球擦拭干净玻璃板正反两面。
(3)固定玻璃板到底座上:先对齐下缘和左右缘,再夹左右的夹子(4)测试是否泄漏:向玻璃夹缝中加入约3ml的去离子水,静置1分钟,检查玻璃板下缘与胶条相交处是否有漏出的水。
无泄漏则连底座一起拿起向一侧倾斜倒掉玻璃夹缝中的水,并伸入干净的滤纸条吸干残留的水。
有泄漏则需重新固定玻璃板。
(5)按照下表中的剂量和顺序依次添加并混合均匀各种试剂。
适用蛋白分子量〈20 kDa 20 - 60 kDa 60 - 100 kDa 〉100 kDa 试剂胶浓度15% 12% 10% 7.5% 水(ml) 1.44 2.04 2.46 2.94 1.5M Tris (pH8.8)(ml) 1.5丙/双丙(ml) 3.0 2.4 1.98 1.5 10%SDS(ul)6010%过硫酸铵(ul)30TEMED(ul)9(6)加入配制好的胶,量为略高于两侧夹子上缘为宜(1mm玻璃板加4.3ml)。
(7)在分离胶上方加满水封闭(1mm玻璃板加1.6ml)。
(7)待可观察到明显的水胶分界线时,倒掉水并用干净的滤纸条吸干残留的水珠。
(二)制作浓缩胶1.注意要点:(1) 插入梳子时,注意正反面,上缘光滑的一面对着大玻璃插入(2) 待EP管内剩余的浓缩胶凝固后即可水平拔出梳子2.操作方法:(1) 按照下中的剂量和顺序依次添加并混合均匀各种试剂。
试剂剂量水(ml) 1.80.5MTris(pH6.8)(ul)750丙/双丙(ml)40210%SDS(ul)3010%过硫酸铵(ul)30TEMED(ul) 6四、加样(一)注意要点:1.加样前混匀各样本。
2.两侧靠边的孔加1倍的上样缓冲液,第二孔加marker,其他孔加入样本。
3.每加入以一次,加样针在外槽电泳缓冲液中抽吸冲洗3次。
4.加样量20-30ul,保证所加的样量中蛋白含量30—50ug。
五、电泳(一)电泳缓冲液的配制1.800ml 1倍电泳缓冲液的配制:试剂剂量10倍电泳缓冲液(ml)80水(ml)720(二)注意要点:1.固定玻璃板时,大玻璃板在外侧,小玻璃板在内侧。
2.只做一板胶时,另一侧用配套的塑料板固定,塑料板两侧有凹槽的一面向外。
3.加电泳缓冲液时,要保证内槽中加满,再加外槽。
外槽的电泳缓冲液量要足够淹没内槽底部的导线。
六、转膜(半干法)(一)转移缓冲液的配制1.1200ml转移缓冲液的配制:试剂剂量Tris base(g) 3.636甘氨酸(g)17.28水(ml)960甲醇(ml)240 转膜一次所需用量为1200ml。
4℃密封保存。
(二)蛋白转移至膜上1.注意事项:1)PVDF膜在使用之前要先用甲醇活化(活化PVDF膜上面的正点基团,使它更容易跟带负电荷的蛋白质结合)。
2)夹板的前后两块的颜色与内槽前后的颜色要对应。
(转移方向:负极→正极,胶→膜,黑色夹板→红色夹板)3)转移缓冲液的量以能完全淹没海绵中的滤纸、胶和膜为宜,但不能淹没两侧的导线金属接头,以免发生短路。
2.操作方法:1)剪膜和滤纸,尺寸为8x4.5cm。
2)在膜的右侧边缘竖着用铅笔标记上日期。
3)倒约35ml甲醇到45ml的EP管中,把膜放入活化3-5min。
4)取出活化过的膜,与剪好的滤纸和海绵一起浸入装有转移缓冲液的容器中。
5)用小塑料板从下缘撬开玻璃板,切除胶上部的浓缩胶和下缘多余的分离胶。
6)用小塑料板把胶条移入容器中的转移缓冲液里。
7)转膜夹板的黑色面在下,其上按顺序摆放:海绵—4张滤纸—胶—膜—4张滤纸—海绵。
8)扣紧夹板放入内槽和外槽中,加满转移缓冲液。
9)调整电源,100mA,2h。
七、封闭(一)配制封闭液4%的BSA(Albumin bovine serum)1.40ml的BSA溶液配制:TBST 40ml + BSA粉末1.6g(二)膜的封闭1.把膜放入装有TBST洗涤液的盒中,放在振荡器上洗脱2次,5min/次。
2.把之前配制好的4%BSA封闭液倒入避光盒中,取出洗脱好的膜放入,4℃,封闭1h。
八、洗涤把膜放入装有TBST洗涤液的盒中,放在振荡器上洗脱3次,15min/次。
九、孵育(一)抗体的稀释1.一抗B-Actin:(1:1000)B-Actin Mouse Ab 3ul Solution 1 for primary 3000ul2.一抗Akt:(1:2000)Akt Mouse Ab 1.5ul Solution 1 for primary 3000ul3.一抗P-Akt:(1:1000)P-Akt Mouse Ab 3ul Solution 1 for primary 3000ul4.一抗IRS-1:(1:1000)ISR-1 Rabbit Ab 3ul Solution 1 for primary 3000ul5.一抗P-IRS-1:(1:3000)P-ISR-1 Rabbit Ab 1ul Solution 1 for primary 3000ul6.二抗山羊抗鼠IgG :(1:5000)山羊抗鼠IgG 1ul 4%BSA溶液(封闭液)5000ul 7.二抗抗兔:(1:3000)抗兔二抗1ul 4%BSA溶液(封闭液)3000ul十、显影。
