第7章 配位化合物
无机化学7配位化合物

第七章 配位化合物
二、配位化合物的组成 1.配合物的内界和外界 配合物根据其化学键特点和在水溶液中的离解方式不同 而分成两大部分:内界和外界。内界是配位键结合的配离子 部分,通常用方括号括起。外界是与配离子以离子键结合的 带相反电荷的离子,写在方括号外面。配位分子是只有内界 没有外界的反离子,内界配离子部分是由中心离子和配位体 组成。
第七章 配位化合物
2.中心离子(或中心原子) 中心离子是在配位个体中提供空轨道的金属离子或原子, 是配合物的核心部分,是孤对电子的接受体,如[Cu(NH3)4] 2+中的Cu2+就是中心离子。常见的中心离子多是过渡元素金属 离子如Fe2+、Cu2+、Zn2+等,这些离子的半径小,电荷多,吸 引孤对电子能力强。少数金属原子和少数高氧化态的非金属 元素也可作配合物的形成体,如Fe(CO)5]、Ni(CO)4中的Fe、 Ni及[SiF6]2-、[BF4]-中的Si(Ⅳ)、B(Ⅲ)等。
第七章 配位化合物
4.配位数 配合物中直接与中心离子配位键结合的配位原子的总数 称为该中心离子的配位数,即中心离子与配体形成配位键的 数目。中心离子的配位数取决于配离子所含配体的种类和数 目。 单齿配体形成配位键的数目等于配体的个数,多齿配体 形成配位键的数目等于配体数乘以配体中所含配位原子的数 目。如[Co(en)2(NH3)2]3+ 中的Co3+ 的配位数是6而不是4, 因为每个乙二胺配体含有两个N配位原子。通常中心离子的 配位数是2、4、6。有些中心离子在特定条件下具有一定的 特征配位数。
第七章 配位化合物
根据配位体中所含有配位原子的数目和与中心离子配位情况,配位体 还可分为以下几种。 单啮配位体:在一个配位体中,能与金属离子配位的点称为配位点, 只有一个配位点的配位体叫单啮配位体,如NH3,H2O,配位后阻碍了正 负离子间的吸引而使溶解度增大。 非螯合多啮配位体:配位体有多个配位点,但由于空间位阻使同一配 位体的几个配位点不能直接与同一个金属离子配位,例如PO43-,一般情况 下,每个配位体要和一个以上金属离子配位,而每个金属离子为了满足配 位要求又要与若干个这样的配位体配位,这样形成的多核配位化合物,往 往是不溶性的沉淀,所以非螯合多啮配位体在化学中常作沉淀剂。 螯合配位体:一个配位体中的几个配位点能直接相同一个金属离子配 位,称为螯合配位体,如EDTA。不带电的单核螯合分子一般在水中的溶 解度很小,但能溶于有机溶剂中,这种配位体在水溶液中是一种沉淀剂, 在有机溶液中能起萃取络合剂的作用,如乙酰丙酮。带电的单核螯合离子 一般很难从水溶液中沉淀出来,这种配位体可作掩蔽剂,如酒石酸盐、 EDTA。
配位化合物

• 配位反应与氧化还原反应的关系 配位离解平衡与氧化还原平衡的关系,主 要体现在配位化合物的生成对电极电势的影 响。
根据能斯特方程: 若氧化型生成配位化合物,浓度减小,则E减小; 若还原型生成配位化合物,浓度减小,则E增大。
中心原子(阳离子或原子)与一定数目的配体(离子或 中性分子) ,通过配位键结合,并按一定组成和空间 构型形成的复杂离子称为配离子
例如, [Cu(H2O)4] 2+
含有配离子的化合物以及中性配位分子统称为 配合物。 例如, H[AuCl4] 、[Co(NH3)Cl3]
配位键 配体 中心原子
[Cu (NH3)4]SO4 [Cu (NH3)4]2+
• 当配位体接近中心离子时,为了增强成键 的能力,中心离子用能量相近的空轨道进 行杂化,形成数目相同,能量相等的具有 一定方向性的杂化空轨道,以容纳配位体 提供的电子形成配位键。配离子的空间构 型、配位数及稳定性等主要取决于杂化轨 道的数目和类型。 • M :L(L代表配位体)
第三节 配位化合物的离解平衡
中 心 离 子 配 位 配 体 位 原 子 配 位 数 离 子 电 荷
内界(配离子)
外界 SO42-
内界
在配合物化学式中用方括号表示内界。 配合物的内界能稳定地存在于晶体及水溶液中。 它是配合物的特征部分,它的结构和性质与其他离 子不同。 如: [ Cu (NH3) 4 ]2+
外界
不在内界的其他离子,如SO42- 构成配合物的外界。 写在方括号外,
单齿配体:一个配体中只有一个配位原子 例如: Ag+ 与NH3 结合
第七章_配位化合物

第七章 配位化合物第一节 配合物的组成及命名一、配合物的组成 一、配合物配离子:由两种不同离子或一种离子与一种分子形成的复杂离子称之。
如:[]+23)(NH Ag 、[]+243)(NH Cu 、[]-36)(CN Fe 、[]-46)(CN Fe配合物:含配离子的化合物。
如:[]Cl NH Ag 23)(、[]443)(SO NH Cu 、[]63)(CN Fe K 、[]64)(CN Fe K 有时也把配离子笼统称为配合物。
二、配合物的组成配合物结构较复杂,但一样都有一个成份作为配合物的核心,其它部份围绕这一核心有规那么地排列。
(1)中心离子(配合物的形成体):位于配合物中心的离子或原子。
多为具有空轨道的过渡元素的金属离子(d 区、s d 区)。
少数为高氧化数非金属原子,如:[]-26SiF 、[]-6PF 。
个别为中性原子,如:[]4)(CO Ni 、[]5)(CO Fe 。
(2)配位体★含义:与中心原子结合的分子或离子。
多为含孤对电子的分子或离子。
如3NH 、O H 2、-Cl 、-CN 、-SCN 等。
★分类:依照一个配体中所含配位原子数量的不同,可将配体分为单齿配体和多齿配体。
单齿配体:一个配位体只含一个配位原子。
多齿配体:一个配位体只含两个或两个以上的配位原子。
(3)配位原子:配位体中直接与中心离子结合的原子。
配位原子大多为电负性较大的非金属原子,如:N 、O 、F 、C 、S 、x 等。
(4)配位数:★含义:直接与中心原子结合的配位原子数。
单齿配体:配位数=配位体数。
多齿配体:配位数=配位体数×一个配位体所含配位原子的个数(齿数)。
如:[]+22)(en Pt★阻碍因素中心离子正电荷:电荷数↑,配位数↑ 半径:中心离子半径↑,配位数↑配体半径↑,配位数↓外界因素:浓度,配体浓度高有利于形成高配位数。
温度,温度低有利于形成高配位数。
★体会:中心离子 +1 +2 +3 +4 配位数 2 4(6) 6(4) 6(8)(5)内界:即配离子,用“[ ]”括起。
第七章 配位化合物

1 1.73
2 2.83
3 3.87
4 4.90
5 5.92
如:实验测出 [FeF6]3﹣的µ= 5.9 → n = 5 可知它是外轨型配合物 再如: 再如:实验测出 [Fe(CN)6]3﹣的µ= 1.9 → n = 1 可知它是内轨型配合物 外轨型,中心离子电子结构未变, 外轨型,中心离子电子结构未变,单电子数未变 内轨型,中心离子电子结构改变, 内轨型,中心离子电子结构改变,单电子个数改变
配
配
4
7.1.2 配位化合物的组成
[Cu(N 配 [Cu(NH3)4] SO4
中 心 离 子 配 位 原 子 界 位 体
配 离 子 电 荷
2+
配 位 数
外 界
配位化合物
5
中心离子(原子) ① 中心离子(原子):位于配位化合物的中心位置的离子 或原子,是配合物的核心, 或原子,是配合物的核心, 通常是某些金属阳离子或金属原子以及高 氧化态的非金属元素
和中心离子配合的负离子或分子, ② 配位体: 和中心离子配合的负离子或分子,简称配体
③ 配位原子:直接与中心原子配位的原子。配位原子上均 配位原子:直接与中心原子配位的原子。
有孤对电子, 有孤对电子,N、O、S、Cl、C、F、Br、I等 Cl、 Br、 直接与中心离子(或原子) ④配位数:直接与中心离子(或原子)结合成键的配位原子 数目,常见的为2 数目,常见的为2、4、6。
14
§7.2 配合物的化学键理论
中心离子和配位体之间是怎样结合的? 中心离子和配位体之间是怎样结合的? 关于配合物的化学键理论主要有: 关于配合物的化学键理论主要有: 价键理论√ 晶体场理论 配位场理论 分子轨道理论
15
南昌大学大学化学第七章习题答案
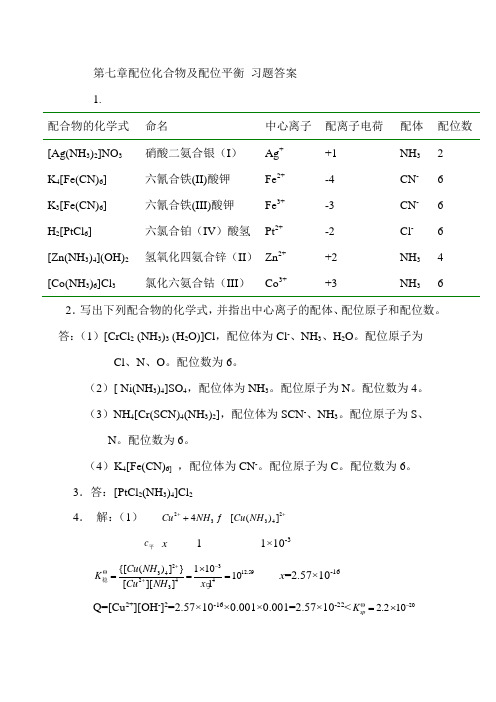
第七章配位化合物及配位平衡 习题答案 1.配合物的化学式 命名 中心离子 配离子电荷 配体 配位数 [Ag(NH 3)2]NO 3 硝酸二氨合银(I ) Ag + +1 NH 3 2 K 4[Fe(CN)6] 六氰合铁(II)酸钾 Fe 2+ -4 CN - 6 K 3[Fe(CN)6] 六氰合铁(III)酸钾Fe 3+-3 CN - 6 H 2[PtCl 6] 六氯合铂(IV )酸氢 Pt 2+ -2 Cl - 6 [Zn(NH 3)4](OH)2 氢氧化四氨合锌(II ) Zn 2+ +2 NH 3 4 [Co(NH 3)6]Cl 3氯化六氨合钴(III )Co 3++3NH 362.写出下列配合物的化学式,并指出中心离子的配体、配位原子和配位数。
答:(1)[CrCl 2 (NH 3)3 (H 2O)]Cl ,配位体为Cl -、NH 3、H 2O 。
配位原子为Cl 、N 、O 。
配位数为6。
(2)[ Ni(NH 3)4]SO 4,配位体为NH 3。
配位原子为N 。
配位数为4。
(3)NH 4[Cr(SCN)4(NH 3)2],配位体为SCN -、NH 3。
配位原子为S 、N 。
配位数为6。
(4)K 4[Fe(CN)6] ,配位体为CN -。
配位原子为C 。
配位数为6。
3.答:[PtCl 2(NH 3)4]Cl 24. 解:(1) 223344[()]Cu NH Cu NH +++ c 平 x 1 1×10-32312.59342443{[()]}11010[][]1Cu NH K Cu NH x +-Θ+⨯=== 稳x =2.57×10-16 Q=[Cu 2+][OH -]2=2.57×10-16×0.001×0.001=2.57×10-22<202.210sp K Θ-=⨯无沉淀。
(2) Q=[Cu 2+][S 2-]=2.57×10-16×0.001=2.57×10-19>366.310sp K Θ-=⨯,有沉淀。
第七章_配位化合物

第七章 配位化合物
•(2)配体命名次序: • 简单负离子-复杂负离子-有机酸根离子-中性分子 (H2O - NH3 -有机分子);不同配体之间用中圆点分开。 例如:H2[PtCl6] 六氯合铂(Ⅳ)酸 [Cr(H2O)4Cl2]Cl 一氯化二氯· 四水合铬(Ⅲ) (3)配体数用中文数字“一、二、三·· ·”表示,标在配体名 · 称之前。 (4)中心离子的电荷数用罗马数字“Ⅰ、Ⅱ 、 Ⅲ 、 Ⅳ” 标明,用圆括号括起来标在中心离子名称之后。
课本220页:表7-2 杂化轨道类型与配合物
–14 –
第七章 配位化合物
第七章 配位化合物
2、d 2sp3杂化:
[Fe(CN)6]3-,Fe3+:3d 5 与CN-配位时,Fe3+采取的是d2sp3杂化。
[Zn(NH3)4]2+, Zn:3d 104s2 →Zn2+:3d 10(4s04p0) 在NH3作用下,Zn2+采取了sp3杂化,形成正四 面体型的杂化空轨道,与配体中NH3中N原子的4对 孤对电子形成四个配位键。空间构型:正四面体 再如: [Ni(NH3)4]2+、 [CoCl4]2-、 [HgI4]2-
夹心配合物示意图
Fe
根据成环原子数目,可以分成四元环、五元环、六元 环、七元环,其中五元环和六元环最稳定,而且,环数 越多越稳定,[Cu(en)2]2+中有两个五元环,[CaY]2-有五 个五元环。 大多数螯合物都有特征颜色,难溶于水,所以分析中 常用EDTA来做配位滴定,其二钠盐易溶于水。
第七章 配位化合物
第七章 配位化合物
第七章
配位化合物 P208
1、掌握配合物的定义、组成及命名
2、掌握配合物价键理论的要点,并能运用杂化轨道理 论解释配离子的空间构型;
大学化学 第七章 配位化合物''

College Chemistry
3.配体类型相同,按配位原子元素符号英文字母顺 序排列;[Co(H2O)(NH3)5]Cl3 三氯化五氨·一水合钴(Ⅲ) 4.配体类型、配原子都相同,原子数少的在前;
[Pt(Py)2(en)2]Cl2 氯化二吡啶·二乙二胺合铂(Ⅱ)
第七章 配位化合物
大 学 化 学
(二)螯合物(chelate)
多齿配体与中心离子形成的具有环状结构的 配合物。 最常见的螯合剂:en,EDTA
第七章 配位化合物
大 学 化 学
College Chemistry
五个五元环
第七章 配位化合物
大 根据成环原子数目,可以分成四元环、五元 学 环、六元环、七元环,其中五元环和六元环最稳 化 定,而且环数越多越稳定。[Cu(en)2]2+中有两个五 学 2-
元环, [CaY] 有五个五元环。分析中常用 EDTA 来做配位滴定。 大多数螯合物都有特征颜色,难溶于水。
College Chemistry
第七章 配位化合物
大 学 化 学
(三)金属有机化合物: 金属原子与有机配体中的C原子结合而形成的 配合物。
1973 年 慕 尼 黑 大 学 的 恩 斯 特 ·奥 托 ·菲舍尔及伦敦帝国学院的杰弗 里 ·威尔金森爵士被授予诺贝尔化 学奖,以表彰他们在有机金属化学 领域的杰出贡献。
2
College Chemistry
反过来,根据配离子的电荷数和配体的电荷 数,也可以推算出中心离子的电荷数。
第七章 配位化合物
大 配合物的种类非常多,主要有两大类: 学 化 (一)简单配合物(complex) 学
单齿配体与中心离子形成的配合物。
三、配合物的类型
College Chemistry
第七章 配位化合物

sp 3d 2杂杂 sp3d 2杂杂杂杂
3d
3d 7
NH3 NH3 NH3 NH 3 NH 3 NH 3
8
外轨型配合物,高自旋 µ = 3.87B.M. 八面体构型
说明 Co(CN)64–不稳定,易被氧化
4d 4p 4s 3d 7
激激 3d6
d 2 sp 杂杂 3d
CN
-
Co(CN)64 –氧化成Co(CN)63–
(3).多核配合物 一个配位原子与二个中心离子结合所成的配合物称多核 配合物,例如:
(4).金属有机配合物 有机基团与金属原子 之间生成碳—金属键 的化合物。A)金属与 碳直接以σ键合的配合 物;B)金属与碳形成 不定域配键的配合物。
7-2 配合物的化学键理论
用来解解释配合物化学键的本质,配合物的结构、稳定性以及一 般特性(如磁性、光譜等)的主要理论有①价键理论、②晶体场理 论、③分子轨道理论。 一,价键理论
4d 4p 4s
4d
CN CN - CN
-
-
CN - CN -
(3).磁性——可通过磁矩来判断内轨型配合物或外轨型的 配合物
形成外轨型的配合物,中心离子电子结构未发生变化,单电子数 与原来自由离子相同; 而形成内轨型的配合物,中心离子的成单电 子数一般会减少,比自由离子的磁矩相应降低,所以可通过磁矩来判 断内、外轨型配合物。. 物质的永磁矩主要是电子的自旋造成的,永磁矩µ与原子或分子中 未成对电子数n有如下关系式:
大学化学 第七章 配位化合物

螯合物:中心离子或原子与多齿配位体形成 的具有环状结构的配合物。
螯合物中的环称为螯环。多齿配位体 又称为螯合剂。中心离子与螯合剂个数之 比称为螯合比。
例:[Cu(en)2]2+ 中,螯合比 = 1︰2 [Zn(EDTA)]2-中,螯合比 = 1︰1
螯合物具有特殊的稳定性,其中又以 五员环、六员环最稳定,环越多越稳定。
+
+
3OH- 6H+
[FeF6]3-
水解效应 Fe(OH)3 6HF 酸效应
7.3.2配位平衡的移动
配位体的酸效应
[FeF6]3- + 6H+
Fe3+ + 来自HFK1 K稳 Ka
K稳和 Ka越小,则K越大,在酸性条件 下,配离子越易离解。
K稳 和 Ka越大,则K越小,在酸性条件 下,配离子不易离解。
K
不稳=
1 K稳
稳定常数的应用-计算配离子的平衡浓度
例.在1.0mL0.040mol·L-1的AgNO3溶液中,加 入1.0mL2.0mol·L-1的NH3·H2O溶液。计算 在平衡后溶液中的c(Ag+)=? 已知: K稳θ=1.62×107
7.3.2配位平衡的移动
1、酸度对配位平衡的影响
Fe3+ + 6F-
K稳 = 1.58 ×1020
K K稳 K稳 [F(e(FC2eO6F34))33]
K越大,反应越易向右进行,因此,反 应总是向着生成K稳大的配离子方向进行.
第四节 螯合物
简单配合物: 中心离子或原子与单齿配位体形成的配合物。
配位化合物

H2O、NH3、CO、X-、CN-、SCN-、EDTA、en等
以[Co(NH3)6]Cl3为例: 1、内界与外界靠离子键结合
[Co(NH3)6]Cl3
2、中心原子:能接受孤对电子的阳 离子或原子
(2)五氯·一水合铁(Ⅲ)酸氨 (3)二氯化亚硝酸根·五氨合铱(Ⅲ) (4)五羰基合铬(Ⅱ)酸钠
对于-NO2,以N原子为配位原子称硝基(-NO2),以O 为配位原子称亚硝酸根(-O-N-O-)
例题
2、写出下列配合物(配离子)的化学式 (1)硫酸四氨合铜(Ⅱ) (2)四硫氰·二氨合铬(Ⅲ)酸氨 (3)二羟基·四水合铝(Ⅲ)离子 (4)二苯合铬 解:(1)[Cu(NH3)4]SO4
(2)NH4[Cr(SCN)4(NH3)2] (3)[Al(OH)2(H2O)4]+ (4)Cr(Ph)2
7.2 配位化合物的形成
一、配位键的定义和本质
配位键:由配位体的某一原子或离子单方面提供电子对 ,而中心原子提供空轨道,依靠中心离子和配位体之间 吸引与排斥所形成的化学键
M L L代表配位体, 表示配位键 本质:共价性质(所以具有一定方向性和饱和性)
第7章 配位化合物
本章教学要求
1. 掌握配位化合物的组成和命名; 2. 了解配位化合物的分类; 3.了解配位键的本质;掌握常见的配位化合物的构型;
History
第一个配合物:
1704年普鲁士人狄斯巴赫为寻找蓝色染料, 而将牛血同碳酸钾在铁锅中强烈煮沸得到黄血 盐,即K4[FeII(CN)6]3。将其加到FeCl3中得到 FeIII4[FeII(CN)6]3-----普鲁士蓝。
无机化学第7章 配位化合物

(没有不成对电子)
d2sp3杂化
7.2.3 价键理论的应用
(1) 中心原子(或离子)接受电子的二种方式: a. 中心原子用外层轨道接纳配体电子 例如:[FeF6]4–,3d 6,
2. 软硬酸碱结合原则 软亲软,硬亲硬;软和硬,不稳定。 软硬酸碱理论在解释某些配合物的稳定性和元素在 自然界的存在状态等方面很成功。
1. 配位化合物定义 由中心原子(或离子)和几个配体分子(或离子) 以配位键相结合而形成的复杂分子或离子,通常称为配位
单元,含有配位单元的化合物称为配位化合物。
配位阳离子: [Co ( NH3 )6 ]3+ 和 [Cu ( NH3 )4 ]2+ 配位阴离子: [Cr(CN)6]3- 和 [Co(SCN)4]2- 中性配合物分子:Ni(CO)4 和Cu(NH2CH2COO)2
Co(NH3)63+: Co3+: 3d6
内轨型配合物,µ = 0 ,正八面体构型
4d 4s 4p
3d
4d 调整 3d 4s 4p
d 2 sp 杂 化 3d
NH3 NH3 NH3 NH 3 NH3 NH3
3
d 2 sp3杂 化 轨 道
CoF63– : Co3+: 3d6
外轨型配合物,µ = 4.90B.M.,正八面体构型
没有磁场
样 品 磁 铁 磁 铁
Question
根据实验测得的有效磁矩,判断下 列各种离子分别有多少个未成对电子? 哪个是外轨?哪个是内轨?
2 ① Fe(en) 2 5.5 B.M. ② Mn(SCN) 4 6 6.1 B.M. 2 4.3 B.M. ③ Mn(SCN) 4 1.8 B.M. ④ Co(SCN) 6 4 2 ⑤ Pt(CN) 4 0 B.M.
化学试题

10.CuSO4?5H2O中,中心离子(Cu2+)的配位水分子数是( D )
A.5 B.2 C.1 D.4
11.Fe3+离子能与下列( C )配位体形成具有五元环的螯合离子
A.碳酸根离子 B.乙酰丙酮
C.丁二酸根 D.丙二酸根
26.向前一体系中加入大量NaOH,平衡移动的方向是( A )
A.向左; B.向右; C.不移动; D.无法确定。
27.Na2S2O3可作为重金属中毒时的解毒剂,这是利用它的( C )
A.还原性; B.氧化性; C.配位性; D.与重金属离子生成难溶物。
28.Ks([Cu(NH3)4]2+) = 1.0×1013 。 向0.10 mol?L–1 CuSO4溶液中通入氨气,当[NH3]=1.0 mol?L–1时,溶液中[Cu2+]的数量级为( A )(mol?L–1)
A.Cu2+和NH3之间以配位键结合
B.[Cu(NH3)4]2+和SO42-之间以离子键结合
C.Cu2+和NH3之间以离子键结合
D.[Cu(NH3)4]SO4在水中全部电离成[Cu(NH3)4]2+和SO42-
7.下列配合物中,中心原子的杂化轨道类型属外轨型的是( D )
A.d2sp3 B.dsp2 C.dsp3 D.sp3d2
4.[Cu(NH3)4]SO4中Cu2+的配位数是( D )
A.1 B.2 C.3 D.4
5.下列关于配合物的叙述正确的是( A )
A.配合物的组成一般有内界外界之分 B.配位数是中心离子的两倍
C.配位体都是中心离子 D.外界离子都是阴离子
第七章 配位化合物

7.1 配合物的组成
1.配合物的组成
配合物由中心离子(原子)和配体组成。 中心离子主要是金属离子。 配体是指与中心离子有化学键作用的
分子或基团。 配体与中心离子间的化学键称为配位键。
例如在右图中, Fe2+离子是中心离子, H2O分子是配体, SO42-离子NH4+离子都不是配体。 (硫酸根与配合物阳离子之间存在氢键(虚线))
每个硫酸根离子同时连接着两个Cu2+离子。 同时与两个或多个中心离子形成配位键的配体,称为桥配体, 意思是指它像桥梁连接着相邻的中心离子。
3.配体的配位方式
1)单齿配位 配体的一个配原子与一个中心离子
配位,称为单齿配位。
2)螯合配位(双齿,多齿)
吡啶与铜的单齿配位
多齿配体可采取螯合配位方式与一个中心离子配位,
实例
2
sp
直线型
A g (C N )2-
3
sp2
平面三角型
H
g
I
3
4
sp3
正四面体型
Z
Байду номын сангаас
n (N
H
) 2+
34
4
dsp2
平面正方型
P
tC
l
2 4
-
6
sp3d2
正八面体
F e(H
2O
)
2 6
6
d2sp3
正八面体
F
e (C
N
)
4 6
3)碳-金属配位键 碳原子上含孤对电子的原子轨道(杂化轨道),也可以与
金属离子的空轨道重叠,形成碳-金属配位键。 含有碳-金属配位键的化合物称为金属有机化合物
2)金属离子的杂化轨道
第七章配位化合物

第七章-配位化合物第七章配位化合物一、单项选择题1. 下列物质中不能作为配体的是( B )A. NH3B. NH4+C. OH-D. NO2-2. 下列离子或化合物中,具有顺磁性的是( B )A. Ni(CN)-24B. CoCl-24C.Co(NH3)+36D. Fe(CO)53.在配合物[Co(NH3)4(H2O)]2(SO4)3中,中心离子的配位数为( B )A. 4B. 5C. 9D. 124. 配离子[Co(NH3)6]2+的空间构型为( A )A. 八面体B. 四方锥形C. 四面体D. 三角双锥5. EDTA 是四元弱酸,当其水溶液pH ≥ 12时,EDTA的主要存在形式为( C )A. H4Y;B. H3Y ;C. Y4-;D. HY3-6.下列关于价键理论对配合物的说法正确的是( C )A. 任何中心离子与任何配体都可形成外轨型化合物;B. 任何中心离子与任何配体都可形成内轨型化合物;C. 中心离子用于形成配位键的原子轨道是经过杂化的等价轨道;D. 以sp3d2和d2sp3杂化轨道成键的配合物具有不同的空间构型。
7.下列物质中能被氨水溶解的是( B )A. Al(OH)3B. AgClC. Fe(OH)3D. AgI8. 下面哪一个不属于EDTA与金属离子形成螯合物的特点( B )A. 具有环状结构 B . 稳定性差C. 配位比一般为1:1D. 易溶于水9. 下列说法欠妥的是:( C )A. 配合物的形成体(中心原子)大多是中性原子或带正电荷的离子。
B. 螯合物以六员环、五员环较稳定。
C. 配位数就是配位体的个数。
D. 二乙二胺合铜(Ⅱ)离子比四氨合铜(Ⅱ)离子稳定。
10. AgCl 在11mol L -⋅氨水中比在纯水中的溶解度大,其原因是 ( B )A. 盐效应B. 配位效应C. 酸效应D. 同离子效应11. 离子以dsp 2杂化轨道成键而形成的配合物,其空间构型是 ( A )A. 平面正方形B. 四面体形C. 直线形D. 八面体形12. 22Cu(en)+的稳定性比234Cu(NH )+大得多,主要原因是前者 ( B )A. 配体比后者大;B. 具有螯合效应;C. 配位数比后者小;D. en 的分子量比NH 3大。
第七章 配位化合物

第一节 配位化合物的基本概念 第二节 配位化合物的价键理论简介 第三节 配位平衡 第四节 螯合物 第五节 与医药学有关的配位化合物
第一节 配合物的基本概念
例如:
(1)单齿配体 NH3 Ag+ + 2NH3 → [H3N:→ Ag ←:NH3]+ (2)多齿配体 乙二胺NH2 - CH2-CH2-NH2 (en)(2
个),EDTA(6个)
有少数配体虽含有两个配原子,但两个配原 子距离太近,只能选择其中一个配原子与中 心原子形成一个配位键,故仍属于单齿配体。
如:[Ag(NH3)2]+ 、 [Cu(NH3)4]2+、 [ Fe(CN)6]3- 、Ni(CO)4 、[Co(NH3)3Cl3 ] 配离子电荷 分别为 +1、+2、-3 、0 、0
三、配合物的命名
内界的命名次序是: 配位体数—配位体名称—合—中心离子(中心离子氧化数)
配体命名原则:
(1)先无机配体,后有机配体
cis - [PtCl2(Ph3P)2] 顺-二氯 ·二 (三苯基磷)合铂(II)
(2)先阴离子配体,后中性分子配体;
K[PtCl3NH3] 三氯·一氨合铂(II)酸钾
(3) 同类配体(同为阴离子配体或同为中性分子配体) 按配位原子元素符号的英文字母顺序排列。
[Co(NH3)5H2O]Cl3 三氯化五氨·一水合钴(III)
第七章 配位化合物
配位化合物在生命过程中的重要作用
1、生物体内各种酶都是金属螯合物 。
2、生物体内许多蛋白质是金属螯合物 。如 铁是血红蛋白和肌红蛋白的组成成份 ,在体内 参与氧的运输和贮存。铁在血红蛋白、肌红 蛋白和细胞色素分子中都以 Fe2+ 与原卟啉环 形成配合物的形式存在。
第七章 配位化合物与配位平衡测验题与答案

第七章. 配位化合物与配位平衡测验题一、选择题1、欲用EDTA测定试液中的阴离子,宜采用: ()A.直接滴定法;B.返滴定法;C.置换滴定法;D.间接滴定法2、用EDTA测定Cu2+,Zn2+,Al3+中的Al3+,最合适的滴定方式是: ()A.直接滴定;B.间接滴定;C.返滴定;D.置换滴定(已知lg K CuY=18.8,lg K ZnY=16.5,lg K AlY=16.1)3、EDTA滴定Al3+的pH一般控制在4.0~7.0范围内。
下列说法正确的是: ()A.pH<4.0时,Al3+离子水解影响反应进行程度;B.pH>7.0时,EDTA的酸效应降低反应进行的程度;C.pH<4.0时,EDTA的酸效应降低反应进行的程度;D.pH>7.0时,Al3+的NH3配位效应降低了反应进行的程度4、在Fe3+,Al3+,Ca2+,Mg2+的混合液中,用EDTA法测定Fe3+,Al3+,要消除Ca2+,Mg2+的干扰,最简便的方法是采用: ()A.沉淀分离法;B.控制酸度法;C.溶液萃取法;D.离子交换法5、用指示剂(In),以EDTA(Y)滴定金属离子M时常加入掩蔽剂(X)消除某干扰离子(N)的影响。
不符合掩蔽剂加入条件的是: ()A.K NX<K NY;B.K NX>>K NY;C.K MX<<K MY;D.K MIn>K MX6、已知lg K BiY=27.9;lg K NiY=18.7。
今有浓度均为0.01mol⋅L−1的Bi3+,Ni2+混合试液。
欲测定其中Bi3+的含量,允许误差<0.1%,应选择pH值为: ()pH 0 1 2 3 4 5lgαY(H)24 18 14 11 8.6 6.6A.<1;B.1~2;C.2~3;D.>47、某配离子[M(CN)4]2-的中心离子M2+以(n-1)d、ns、np轨道杂化而形成配位键,则这种配离子的磁矩和配位键的极性将...........................................................................................()。
第七章 配位化合物

b
b a c c a
b
a b
a
一反二顺: 3 种
b
c b 总之,配体数目越多,种类越多,异构现象则越复杂。 -18-
2°旋光异构
配体的相互位置关系不一致形成几何异构,当相
互位置的关系一致时,也可能不重合。比如人的 两只手,各手指、手掌、手背的相互位置关系一 致,但不能重合,两者互为镜像。 配体相互位置关系相同,两者互为镜像但又 不能重合, 则互为旋光异构。
可重合,不存在旋光异构
不能重合,互为旋光异构
-19-
旋光异构体的熔点相同,但光学性质不同。
自然光
起偏镜
偏振光
旋光物
发生偏转
-20-
互为旋光异构体的两种物质, 使偏振光偏转的方向不同。使偏振光向左(逆
时针)旋转的称左旋异构体;使偏振光向右旋转(顺时针)的称左旋异构体。 例如:存在于烟草 中左旋尼古丁的毒 性要比人工合成出 来的右旋尼古丁毒 性大得多。
不同的旋光异构体在生物体内的作用不同。
顺式 Ma2b2c2 有旋光异构体,如下图所示:
b b
a a c c
a
a a c c b b
a b c b c d
-21-
4 配位的正四面体: Mabcd 旋光异构体:
d
7.1.2 配合物的命名
基本遵循一般无机化合物的命名原则
1.整体命名:先阴离子,后阳离子
配离子为阳离子 外界是简单阴离子(OH-、Cl-),“某化某” [Ag(NH3)2]OH [Pt(NH3)6]Cl4
-9-
常见单齿配体 单击此处编辑母版标题样式 中性分子 H2O NH3 CO CH3NH2 配体 水 氨 羰基 甲胺 单击此处编辑母版文本样式 O N C N 配位原子 第二级 1. 镧系、锕系元素通性 阴离子 F Cl- Br- I- OH- CN- NO2第三级 配体 氟 氯 溴 碘 羟基 氰 硝基 第四级 2. 我国稀土元素资源和提取 O C N 配位原子 F Cl Br I 第五级 SCNNCS阴离子 ONO3. 核反应类型 配体 亚硝酸根 硫氰酸根 异硫氰酸根 O S N 配位原子
第七章 配位化合物

n(n 2)
波尔磁子(μB)。
分别测定自由离子和配合物的磁矩,确定各 自的单电子数n,若二者单电子数一致则为 从外轨型,不同则为内轨型。例如[FeF6]3配离子,实验测得磁矩为5.88μB,与根据 上式n = 5时所计算出磁矩理论值5.92μB接 近,由此可推知[FeF6]3-保留着5个单电子, 属于外轨型配离子。
1. 中心原子与配体中的配位原子之间以配位 键结合,即配位原子提供孤对电子,填入中心原 子的价电子层空轨道形成配位键。配体为电子对 给予体 ( Lewis碱 ),中心原子为电子对接受体 (Lewis酸),二者的结合物——配离子或配位分子 是酸碱配合物。
2. 为了增强成键能力和形成结构匀称的配 合物,中心原子所提供的空轨道首先进行杂化, 形成数目相等、能量相同、具有一定空间伸展 方向的杂化轨道,中心原子的杂化轨道与配位 原子的孤对电子轨道在键轴方向重叠成键。
[Ni(NH3)4]2+
3d
sp3
[Ar]
电子由 NH3 中N提供
外轨配合物
dsp2
-
[Ni(CN)4]2-
3d
4p
[Ar]
电子由 CN 中C提供
内轨配合物
4. 26Fe2+的价层电子组态为3d6,磁矩μ=4.9μB, 说明有4个单电子。形成6配位化合物时有2种不 同的杂化类型:[Fe(CN)6]4-,μ=0 μB。说明 配体CN-对中心原子d电子产生较强的排斥作用, 致使其重排,空出2个3d轨道,然后进行d2sp3杂 化,d2sp3杂化轨道接受来自CN-中C原子提供的 6对孤对电子,形成六个配位键,空间构型为正 八面体。由于该配离子无未成对电子,具有反 磁性,内轨型。过程如下所示:
3d
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2
4 6
Cl-
K+ K+
14
三、 配合物的命名
1.配离子:
阴离子配位体-中心分子配位体-合-中心离子-价数 (罗马字母); 举例: [Ag(NH3)2]+ 二氨合银(Ⅰ)配离子 [Fe(CN)6]3- 六氰合铁(Ⅲ)配离子 “某酸某”,“某化某”
2.配合物:
2017年6月
15
三、 配合物的命名
B.把上述的深蓝色溶液分装在二支试管里,
在一支试管中加入少量氯化钡溶液,即生成 白色硫酸钡沉淀—表明溶液中仍含有硫酸根离 子。 在另一支试管中加入少量氢氧化钠溶液,并 无氢氧化铜沉淀和氨气产生。 经分析证实,在这种深蓝色的溶液中,生成 了复杂的四氨合铜(Ⅱ)配离子—[Cu(NH3)4]2+。 CuSO4 + 4NH3= [Cu(NH3)4]SO4
通常有色金属离子与配位体形成配离子时,离子颜色 改变,大多颜色加深
表7-3常见离子颜色改变
金属离子 Ni2+ 金属离子颜色 绿
配离子 配离子颜色
Cu2+ 蓝
Co3+ 红
CoY- 紫红
Mn2+ 肉色
Fe3+ 淡黄
NiY2 - CuY2- 蓝绿 深蓝
MnY2- FeY- 紫红 黄
根据颜色的变化,可以判断配离子生成。在分析化学中, 常利用某些配合物和金属离子的特殊显色反应来鉴定金 属离子。在染料工业上,也常利用这一特点,获得所需 要的颜色。
2017年6月
13
二、配合物的组成
表7-2 常见配合物的分子组成
配合物 [Cu(NH3)4]SO4
配 离 子 中心离子 配位体 配位数 外界离子 Cu2+ NH3 4 SO42- Ag+
Hg2+ Fe3+
[Ag(NH3)2]Cl
K2[HgI4] K3[Fe(CN)6]
2017年6月
NH3
I- CN-
29
N-CH 2CH2-N
2017年6月
三、 医学上常见的螯合剂
几点说明:
1.EDTA简写为 H4Y,在水中溶解度小, 实际用其二钠盐Na2H2Y (易溶) ,仍简称 EDTA 2.EDTA与金属离子形成螯合物的特点:
(1)组成一定, 配位比1﹕1; (2)稳定; (3)大都可溶。
在第二支中加入少量氯化钡溶液,即出现白色硫酸钡 沉淀,表明溶液中有硫酸根离子存在。 CuSO4 + BaCl2==BaSO4↓+ CuCl2 在第三支中加入适量的氨水,先出现浅蓝色碱式硫酸 铜[Cu2(OH)2SO4]沉淀,继续加入氨水,至沉淀刚好消 失,变成深蓝色的溶液。
2017年6月
6
一、 配合物的概念
2. 配位体:
3. 配位原子:
2017年6月
10
二、 配合物的组成
4. 配位数:
中心离子所接受的配位原子的数目。
配合物中距离中心离子较远的简单离子或原子团,与 配离子以离子键相结合。 中心离子电荷数与配位体电荷数的代数和。 例:[Ag(NH3)2] +配离子的电荷数为+1,
5. 外界离子:
K稳
1 K 不稳
, K稳大, K不稳小。
(4)实际工作多用K稳 ;通常K稳很大,故常用lgK稳表示。
2017年6月
24
七、 配合物的应用
1、分析化学:
A.定性分析; B.定量分析;
A.EDTA解毒 B.制药工业:EDTA除金属离子; C.生物体内多种金属离子均以配合物形式存在;
2、医药上:
举例:
[Ag(NH3)2]Cl 氯化二氨合银(Ⅰ) [Cu(NH3)4]SO4 硫酸四氨合铜(Ⅱ) K4[Fe(CN)6] 六氰合铁(Ⅱ)酸钾 K3[Fe(SCN)6] 六硫氰合铁(Ⅲ)酸钾 [Co(NH3)4Cl2]Cl 氯化二氯四氨合钴(Ⅲ) [Pt(NH3)2Cl2] 二氯二氨合铂(Ⅱ) [Co(H2N-CH2CH2-NH2)2Cl2]Cl 氯化二氯二乙二胺合钴(Ⅲ)
8
2017年6月
一、 配合物的概念
3、配合物与复盐的区别:
在水溶液中复盐能完全电离成组成它的简单离子; 配合物在水中只能电离出配离子和外界离子,不能完全 电离出组成它的简单离子。 复盐:
例如:
KAl(SO4)2· 12H2O=K++Al3++2SO42-+2H2O
[Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-
Cu2+
+ 4NH3
[Cu(NH3)4]2+
2017年6月
[Cu(NH3 ) 4 ] K稳= [Cu 2 ][NH ]4 3
23
(二) 配合物的不稳定常数K不稳和稳定常数K稳
2.几点说明:
(1)K稳表示配合程度;K稳越大,说明生成配离子的倾向越大, 而离解的程度越小,即配离子越稳定。
(2) K不稳表示离解程度; K不稳越大,表示越易离解,即配离 子越不稳定。 (3)稳定常数和不稳定常数互为倒数,即
3.螯合物结构很复杂
30
2017年6月
三、 医学上常见的螯合剂
4.生物体内许多金属离子以螯合物形式存在
a.血红蛋白中的Fe2+ b.植物体内叶绿素中的Mg2+ c.治疗恶性贫血的药物V-B12中的Co2+
31
2017年6月
目标测试
1.什么是配合物、中心离子、配位体、配位数和外界 离子?举例说明。 2.试述配合物的结构和形成条件。 3.什么是螯合物、螯合剂?螯合物形成的条件是什么? 4.试述配合物的稳定常数、不稳定常数和相互关系。 5.指出下列各配合物中的内界、外界及中心离子。
在定影时用硫代硫酸钠(俗名海波)洗去难溶的 AgBr,其原理也是形成了可溶性配合物: AgBr + 2Na2S2O3=Na3[Ag(S2O3)2] + NaBr
2017年6月
20
六、 配合物的稳定性和配位平衡
(一)配位平衡: 取试管二支,分别加入1ml硫酸铜氨溶 液。
在一支试管中,滴入氢氧化钠溶液,没有 氢氧化铜沉淀生成,说明溶液中可能没有或 含极少量的铜离子。 在另一支试管中,滴入硫化钠溶液,即有 黑色的硫化铜沉淀生成,说明溶液中有少量 的铜离子存在。
6.配离子的电荷数:
因为中心离子为Ag+,带1个单位正电荷,配位体氨 分子不带电,配离子的电荷数为:+1+0×4 = +1。
11
2017年6月
二、 配合物的组成
由于配合物是电中性的,因此,也可以从外
界离子的电荷数来决定配离子的电荷数。
例:Na2[Cu(CN)3]配合物:
它的外界有2个Na+离子,所以[Cu(CN)3]2- 配离子的电荷数为-2,从而可推知中心离子
4
第一节 配合物
一、 二、 三、 四、 五、 六、 七、
配合物的概念 配合物的组成 配合物的命名 配合物的价键理论 配合物的性质 配合物的稳定性和配位平衡 配合物的应用
2017年6月
5
一、 配合物的概念
[Cu(NH3)4]2+的形成:
A.取三支试管,分别加入硫酸铜溶液1m1。 在第一支中加入少量氢氧化钠溶液,即出现蓝色氢氧 化铜沉淀,表明溶液中有铜离子存在。 CuSO4 + 2NaOH==Cu(OH)2↓+ Na2SO4
无机化学
“十二五”职业教育国家规划教材
主编
黄晓英 郭小仪
化学工业出版社
目 录
第一章 第二章 第三章 第四章 第五章 第六章 第七章 第八章 第九章
2017年6月
物质结构 溶液和胶体溶液 化学反应速率和化学平衡 电解质溶液 氧化还原和电极电势 缓冲溶液 配位化合物 常见非金属元素及其化合物 常见金属元素及其化合物
27
螯合剂:
2017年6月
二、 螯合物的形成条件
1.中心离子必须具有空轨道能接受配位体提供的 孤对电子。 2.螯合剂必须含有两个或两个以上都能给出孤对 电子的原子(配位原子),这样才能与中心离子配 合成环状结构。 3.这两个能给出电子对的原子应该在它们之间相 互隔着二个或三个其它原子,以便形成稳定的五元 环或六元环。
2017年6月
25
第二节 螯合物
一、 螯合物的概念 二、 螯合物的形成条件 三、 医学上常见的螯合剂
2017年6月
26
一、螯合物的概念
H2
H2C N
Cu
2+
+2
H2C NH2 CH2 NH2
H2
N
2+
CH2 CH2
Cu
CH2 N
螯合物:
H2
H2
N
具有稳定环状结构的配合物 (内配合物)。 形成螯合物的配位体;
是Cu+离子,而不是Cu2+离子。
2017年6月
12
二、 配合物的组成
通常每种金属离子有它特征的配位数。
一些离子的常见配位数见表6-1。
