风疹减毒活疫苗(兔肾细胞)
2015年药典附录2 不再收入的品种

质管人员及验收员注意:2015年12月1日,2015年版药典执行,以下品种没有收入,审核资料及验收时执行标准仍为2010版药典。
国家食品药品监督管理总局关于实施《中华人民共和国药典》2015年版有关事宜的公告(2015年第105号)中要求:凡《中国药典》2015年版品种项下未收载的制剂规格,其质量标准按本版《中国药典》同品种相关要求执行,规格项按原批准证明文件执行。
凡《中国药典》2015年版不再收载的历版药典曾收载品种(因安全性、有效性等问题撤市的除外),新标准未颁布前,仍执行原药典标准,但应符合新版药典的通用要求。
附件2《中国药典》2015年版不再收载品种目录中药部分序号品种名称1 紫河车2 生血丸3 安坤赞育丸4 河车大造丸5 补肾固齿丸6 益血生胶囊7 小儿腹泻外敷散化药部分序号品种名称1 三磷酸腺苷二钠注射液2 注射用三磷酸腺苷二钠3 注射用卡铂4 注射用甲磺酸培氟沙星5 注射用亚叶酸钙6 色甘酸钠气雾剂7 滴眼用利福平8 阿米三嗪萝巴新片9 阿奇霉素分散片10 注射用帕米膦酸二钠—34 —11 乳酸环丙沙星氯化钠注射液12 罗红霉素分散片13 穿琥宁14 注射用穿琥宁15 盐酸丁咯地尔16 盐酸丁咯地尔片17 盐酸丁咯地尔注射液18 盐酸丁咯地尔胶囊19 注射用盐酸丁咯地尔20 盐酸异丙肾上腺素气雾剂21 葡萄糖酸钙氯化钠注射液22 醋酸可的松眼膏23 磷酸川芎嗪注射液24 磷酸川芎嗪氯化钠注射液25 酮康唑片26 酮康唑胶囊27 安乃近28 安乃近片生物制品部分序号品种名称1 口服福氏宋内氏均痢疾双价活疫苗2 人用狂犬病疫苗(Vero)3 人用狂犬病疫苗(地鼠肾细胞)4 风疹减毒活疫苗(兔肾细胞)5 注射用抗人T细胞CD3鼠单抗6 抗A、抗B血型定型试剂(人血清)药用辅料部分序号品种名称1 硫柳汞2 邻苯二甲酸二乙酯注:本附件所列品种为较《中国药典》2010年版相比,未收载的品种。
—35 —。
国家免疫规划疫苗种类

国家免疫规划疫苗种类
现行国家免疫规划疫苗包括儿童常规接种疫苗和重点人群接种疫苗。
儿童常规接种的疫苗包括重组乙型肝炎(乙肝)疫苗(HepB)、皮内注射用卡介苗(BCG)、口服脊髓灰质炎(脊灰)减毒活疫苗(OPV)、吸附无细胞百日咳-白喉-破伤风(百白破)联合疫苗(DTaP)及吸附白喉-破伤风(白破)联合疫苗(DT)、麻疹-风疹(麻风)联合减毒活疫苗(MR)、麻疹-流行性腮腺炎-风疹(麻腮风)联合减毒活疫苗(MMR)、甲型肝炎(甲肝)疫苗(HepA)、流行性乙型脑炎(乙脑)疫苗(JEV)、A群脑膜炎球菌多糖疫苗(A群流脑多糖疫苗,MPSV-A)和A+C群脑膜炎球菌多糖疫苗(A+C群流脑多糖疫苗,MPSV-AC)。
重点人群接种疫苗包括在重点地区对重点人群预防接种的双价肾综合征出血热灭活疫苗(出血热疫苗);发生炭疽和钩端螺旋体(钩体)病疫情时,对重点人群应急接种的皮上划痕人用炭疽活疫苗(炭疽疫苗)和钩体疫苗。
通过接种上述疫苗,在适龄人群中预防乙型肝炎、结核病、脊髓灰质炎、百日咳、白喉、破伤风、麻疹、甲型肝炎、流行性脑脊髓膜炎、流行性乙型脑炎、风疹、流行性腮腺炎、流行性出血热、炭疽和钩端螺旋体病等15种传染病。
(学习的目的是增长知识,提高能力,相信一分耕耘一分收获,努力就一定可以获得应有的回报)
1 / 1下载文档可编辑。
常用疫苗组成分
乳糖
核酸
灭菌、无热原PBS
A群C群脑膜炎球菌多糖疫苗
A群和C群脑膜炎球菌荚膜多糖
乳糖
苯酚
灭菌、无热原PBS
水痘减毒活疫苗
水痘减毒活病毒
明胶、蔗糖、人血白蛋白、谷氨酸钠
牛血清白蛋白、抗生素
灭菌注射用水
冻干人用狂犬病疫苗
(Vero细胞)
灭活的狂犬病固定病毒
明胶、蔗糖、
人血白蛋白
Vero细胞DNA残余、宿主细胞蛋白残留、牛血清白蛋白、抗生素
白砂糖、葡萄糖、奶粉、奶油
抗生素
脊髓灰质炎减毒活疫苗糖丸(猴肾细胞)
Ⅰ、Ⅱ、Ⅲ型脊髓灰质炎减毒活病毒
白砂糖、葡萄糖、奶粉、奶油
抗生素
口服脊髓灰质炎减毒活疫苗(猴肾细胞)
Ⅰ、Ⅱ、Ⅲ型脊髓灰质炎减毒活病毒
酚红、氯化镁
抗生素
口服轮状病毒活疫苗
轮状病毒减毒活病毒
蔗糖、乳糖
抗生素
卡介菌活菌体
蔗糖、明胶、谷氨酸钠
——
灭菌注射用水
乙型脑炎减毒活疫苗
乙脑减毒活病毒
明胶、蔗糖、人血白蛋白、谷氨酸钠
牛血清白蛋白、抗生素
灭菌注射用水或灭菌PBS
冻干乙型脑炎灭活疫苗(Vero细胞)
灭活的乙型脑炎病毒P3株
明胶、蔗糖、人血白蛋白、谷氨酸钠
牛血清白蛋白、抗生素、甲醛
灭菌注射用水
冻干甲型肝炎减毒活疫苗
灭菌注射用水
人用狂犬病疫苗
(Vero细胞)
灭活的狂犬病病毒固定毒
蔗糖、硫柳汞、明胶
Vero细胞DNA残余、宿主细胞蛋白残留、牛血清白蛋白、抗生素
灭菌注射用水
人用狂犬病疫苗
(地鼠肾细胞)
疫苗全称、简称、中英文对照表87615

Pneu23
气管炎疫苗
气管炎
Tra
兰菌净细菌溶解物
兰菌净
Lan
人用狂犬病疫苗(Vero细胞)
狂犬病(Vero)
Rab-Vero
冻干人用狂犬病疫苗(Vero细胞)
狂犬病(Vero冻干)
Rab-Vero-fd
人用狂犬病疫苗(地鼠肾细胞)
狂犬病(地鼠肾)
Rab-hkc
Ⅰ价肾综合征出血热灭活疫苗
出血热(Ⅰ价)
白喉(成人)
DV-a
吸附破伤风疫苗
破伤风
TT
麻疹减毒活疫苗
麻疹
MV
腮腺炎减毒活疫苗
腮腺炎
Mum
风疹减毒活疫苗(人二倍体细胞)
风疹(二倍体)
Rub-hdc
风疹减毒活疫苗(兔肾细胞)
风疹(兔肾)
Rub-rkc
麻疹腮腺炎风疹联合减毒活疫苗
麻腮风
MMR
麻疹腮腺炎联合减毒活疫苗
麻腮
MM
麻疹风疹联合减毒活疫苗
麻风
甲肝(灭活)
HepA-i
甲肝乙肝联合疫苗
甲乙肝
HepAB
流行性感冒全病毒灭活疫苗
流感(全病毒)
Flu-wv
流行性感冒裂解疫苗
流感(裂解)
Flu-sp
流行性感冒亚单位疫苗
流感(亚单位)
Flu-su
冻干水痘减毒活疫苗
水痘
Var
b型流感嗜血杆菌多糖结合疫苗
Hib
Hib
口服轮状病毒活疫苗
轮状病毒
Rot
23价肺炎球菌多糖疫苗
钩体
Lep
皮肤划痕用鼠疫活疫苗
鼠疫
Plag
皮肤划痕人用炭疽活疫苗
国家食品药品监督管理局关于进一步加强生物制品批签发管理工作有关事项的通告

国家食品药品监督管理局关于进一步加强生物制品批签发管理工作有关事项的通告文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2007.11.15•【文号】国食药监注[2007]693号•【施行日期】2007.11.15•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局关于进一步加强生物制品批签发管理工作有关事项的通告(国食药监注[2007]693号)为切实保障生物制品质量安全,根据《生物制品批签发管理办法》的有关规定,现就进一步加强生物制品批签发管理工作的有关事项通告如下:一、国家食品药品监督管理局授权中国药品生物制品检定所以及北京、吉林、上海、湖北、广东、四川、甘肃等省(市)级药品检验机构承担生物制品批签发工作;授权15位签发人代表国家食品药品监督管理局签发生物制品批签发证明文件(见附件1)。
二、目前已开展生物制品批签发的品种包括所有预防用疫苗、人血白蛋白及静注人免疫球蛋白类血液制品;用于血源筛查的4种体外生物诊断试剂及ABO血型定型试剂仍按原批批检定方式进行(见附件2)。
国家食品药品监督管理局将根据实际情况,年内逐步对所有血液制品实施国家批签发。
三、各承担生物制品批签发工作的药品检验机构在本单位的网站上每2周公布已批签发产品的情况。
内容包括:品种名称、企业名称、规格和数量、批号、有效期、签发结论等有关信息。
四、生物制品批签发采用批记录摘要审查和实验室检验相结合的方式进行。
实验室检验项目和抽检比例等具体事项由中国药品生物制品检定所负责组织论证后确定并通知承担生物制品批签发工作的药品检验所。
疫苗、血液制品生产企业的派驻监督员负责批签发产品的现场抽样和封样工作(抽样程序见附件3)。
五、承担生物制品批签发工作的药品检验机构如增加批签发品种的检验或者复核工作,须通过国家食品药品监督管理局组织的检查和验收,被授权后方可开展批签发工作。
六、纳入生物制品批签发的疫苗类制品和人血白蛋白进口通关备案时,需按照《药品进口管理办法》的相关规定,提供由生产国或者地区药品管理机构(或者授权批签发机构)出具的批签发证明原件。
免疫缺陷儿千万不要接种减毒活疫苗

免疫缺陷儿千万不要接种减毒活疫苗免疫缺陷儿千万不要接种减毒活疫苗,可以接种疫苗要使用灭活疫苗。
灭活疫苗和减毒疫苗的差别在于疫苗中的病毒不具有感染性,在体内不能增殖。
灭活疫苗由完整的病毒组成,使其致病性丧失或减弱,但是仍然保持病毒的全部或部分免疫原性。
接种后病毒抗原可以刺激机体产生免疫应答,达到保护作用。
减毒活疫苗仍保留有一定的毒力,病毒可以在接种者的体内增殖,长时间和机体细胞发生作用,诱导较强的免疫力。
然而免疫缺陷儿因为自身的免疫力不足,接种减毒活疫苗后不但没有免疫作用,反而会感染病毒导致瘫痪或死亡等严重后果。
目前已经在临床使用的减毒活疫苗有:减毒活菌卡介苗、麻疹减毒活疫苗、甲型肝炎减毒活疫苗、冻干甲肝减毒活疫苗、冻干水痘减毒活疫苗、乙型脑炎减毒活疫苗、风疹减毒活疫苗、腮腺炎减毒活疫苗、口服脊髓灰质炎减毒活疫苗、口服狂犬病减毒活疫苗等。
由于目前许多免疫缺陷病无法早期诊断和筛查,因此对于存在反复肛周脓肿、反复出现各种较严重感染等免疫功能异常可能性较大的儿童,家长可以按知情、自愿、自费的原则,选择注射型灭活疫苗。
减毒活疫苗简介减毒活疫苗是指病原体经过甲醛处理后,A亚单位(毒性亚单位)的结构改变,毒性减弱,但B亚单位(结合亚单位)的活性保持不变,即保持了抗原性的一类疫苗。
将其接种到身体内,不会引起疾病的发生,但病原体可以引发机体免疫反应,刺激机体产生特异性的记忆B细胞和记忆T细胞。
起到获得长期或终生保护的作用。
与灭活疫苗(死疫苗)相比,这类疫苗免疫力强、作用时间长,但安全是一个问题,具有潜在的致病危险(有可能因发生逆行突变而在人体内恢复毒力)。
属于第二代疫苗。
减毒活疫苗的优点1.诱导体液免疫和细胞免疫两种免疫反应,有的制品:通过自然感染途径接种,还可以诱导出黏膜免疫,使机体获得较广泛的免疫保护。
2.使用的是活的微生物,可在机体内长时间起作用、而诱导较强的免疫反应。
3.活的微生物有再增殖的特性,理论上只需接种一次,即可以达到满意的免疫效果。
麻疹腮腺炎风疹联合减毒活疫苗 说明书

5
MMR-HK/CN-20082473
6.大多数易感者在接种后 7~28 天内会从鼻或咽喉分泌出少量的风疹减毒活病毒。尚 无确切证据表明一般接触会使这种风疹减毒活病毒通过接种者传播给易感人群。然而, 有文献报道,风疹疫苗病毒是可以通过哺乳传播给婴儿(详见【孕妇及哺乳期妇女用 药】)。
* Merck & Co. Inc.注册商标
1
MMR-HK/CN-20082473
【规格】 0.5 ml/瓶。每注射剂量为 0.5ml,内含不少于 1000 CCID5O(50%细胞感染剂量)的 麻疹病毒,20000 CCID5O的腮腺炎病毒及 1000 CCID5O的风疹病毒。 【免疫程序和剂量】 本品接种单一剂量 0.5ml,皮下注射(推荐上臂外侧部)。 对儿童推荐的接种程序:12 月龄或以上首次接种者,应在 4~6 岁再次接种。再次接种 可使首次接种未产生免疫应答的儿童产生血清阳转。 配制指导: 配制本疫苗必须使用所附的专用稀释液(不含可灭活疫苗的防腐剂或其它抗病毒 物质)溶解,加入稀释液后摇动至完全混匀后使用。 本品每次注射和/或配制疫苗时,应采用无防腐剂、杀菌剂和去污剂的无菌注射 器,因为这些物质可灭活本品所含的活病毒疫苗。 当溶液和容器符合条件时,还应在使用前对所注射的疫苗进行目测观察,如果含 有可见的颗粒和发生变色,或本冻干疫苗不能溶解,则弃之不用。 【不良反应】 本品的下列不良反应在每个身体系统分类中按照严重程度降序列出,而不考虑其与 疫苗相关性的程度。它们来自下列情况的报告:临床试验期间、上市后疫苗使用、或含 有麻疹、腮腺炎或风疹的单价或二价疫苗的应用。 全身 脂膜炎;非典型麻疹;发热;晕厥;头痛;头晕;不适;易激惹。 心血管系统 脉管炎。 消化系统 胰腺炎;腹泻;呕吐;腮腺炎;恶心。 内分泌系统 糖尿病。 血液和淋巴系统 血小板减少(参见【注意事项】);紫癜;局部淋巴结肿大;白细胞增多。
应用不同代次兔肾细胞培养风疹病毒松叶株的研究

s t r a i n o f r u b e l l a v i r u s w a s i n o c u l a t e d t o a l l o f t h e d i f f e n t p a s s a g e d c e l l s , r e s p e c t i v e l y, w h i c h w e r e s u b j e c t e d t o t e s t s s u c h s a
k a r y o t y p e a n ly a s i s ,e x a mi n a t i o n o f e n c e p h a l i t o z o o n c u n i c u l i a n d f a c t o r s o f e x t e r e n a l s o u r c e s .Re s u l t s T h e h o mo g e n e i t y or f c u l t u r e d r a b b i t k i d n e y c e l l s w a s i n c r e a s e d .T h e r e s u l t s o f t h e k a r y o t y p e na a ly s i s s h o we d t h a t t h e c h r o mo s o me s o f s u b c u l — t u r e d c e l l s a r e c o n s i s t e n t wi t h t h e s e o f p i r ma r y c e l l s .I t h s a n o n o t a b l e d i f f e r e n c e or f v i r u s t i t e r s p r o p a g a t e d o n 0 t o 3 p a s s a —
【免费下载】常用疫苗组成成分

非目标成分残留
牛血清白蛋白、抗 灭菌注射用水
生素
牛血清白蛋白、抗 灭菌注射用水
生素
牛血清白蛋白、抗 灭菌注射用水
生素
牛血清白蛋白、抗 灭菌注射用水
生素
牛血清白蛋白、抗 灭菌注射用水
生素
牛血清白蛋白、抗 灭菌注射用水
生素
疫苗稀释剂
活疫苗
皮内注射用卡介 苗
乙型脑炎减毒活 疫苗
冻干乙型脑炎灭 活疫苗(Vero 细
毒
常用疫苗组成成分
主要成分 辅料
明胶、蔗糖、人
血白蛋白、精氨 酸、尿素、谷氨
酸钠
明胶、蔗糖、人
血白蛋白、精氨 酸、尿素、谷氨
酸钠
明胶、蔗糖、人 血白蛋白
明胶、蔗糖、人 血白蛋白
明胶、蔗糖、人 血白蛋白、精氨 酸、尿素、谷氨
酸钠
明胶、蔗糖、人 血白蛋白、精氨 酸、尿素、谷氨
酸钠
麻腮风联合减毒 麻疹减毒活病毒、 明胶、蔗糖、人 牛血清白蛋白、抗 灭菌注射用水
硫柳汞
对全部高中资料试卷电气设备,在安装过程中以及安装结束后进行高中资料试卷调整试验;通电检查所有设备高中资料电试力卷保相护互装作置用调与试相技互术关,系电,力根通保据过护生管高产线中工敷资艺设料高技试中术卷资,配料不置试仅技卷可术要以是求解指,决机对吊组电顶在气层进设配行备置继进不电行规保空范护载高与中带资负料荷试下卷高问总中题体资,配料而置试且时卷可,调保需控障要试各在验类最;管大对路限设习度备题内进到来行位确调。保整在机使管组其路高在敷中正设资常过料工程试况中卷下,安与要全过加,度强并工看且作护尽下关可都于能可管地以路缩正高小常中故工资障作料高;试中对卷资于连料继接试电管卷保口破护处坏进理范行高围整中,核资或对料者定试对值卷某,弯些审扁异核度常与固高校定中对盒资图位料纸置试,.卷保编工护写况层复进防杂行腐设自跨备动接与处地装理线置,弯高尤曲中其半资要径料避标试免高卷错等调误,试高要方中求案资技,料术编试交写5、卷底重电保。要气护管设设装线备备置敷4高、调动设中电试作技资气高,术料课中并3中试、件资且包卷管中料拒含试路调试绝线验敷试卷动槽方设技作、案技术,管以术来架及避等系免多统不项启必方动要式方高,案中为;资解对料决整试高套卷中启突语动然文过停电程机气中。课高因件中此中资,管料电壁试力薄卷高、电中接气资口设料不备试严进卷等行保问调护题试装,工置合作调理并试利且技用进术管行,线过要敷关求设运电技行力术高保。中护线资装缆料置敷试做设卷到原技准则术确:指灵在导活分。。线对对盒于于处调差,试动当过保不程护同中装电高置压中高回资中路料资交试料叉卷试时技卷,术调应问试采题技用,术金作是属为指隔调发板试电进人机行员一隔,变开需压处要器理在组;事在同前发一掌生线握内槽图部内 纸故,资障强料时电、,回设需路备要须制进同造行时厂外切家部断出电习具源题高高电中中源资资,料料线试试缆卷卷敷试切设验除完报从毕告而,与采要相用进关高行技中检术资查资料和料试检,卷测并主处且要理了保。解护现装场置设。备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程规定,制定设备调试高中资料试卷方案。
已实施国家批签发的生物制品品种目录-推荐下载

附件2: 已实施国家批签发的生物制品品种目录 一、疫苗制品目录 细菌类疫苗: 1.伤寒Vi多糖疫苗 2.口服重组B亚单位/菌体霍乱菌苗(肠溶胶囊) 3.钩端螺旋体疫苗 4.皮上划痕用鼠疫活疫苗 5.皮上划痕人用炭疽活疫苗 6.皮上划痕人用布氏菌活疫苗 7.皮内注射用卡介苗 8.b型流感嗜血杆菌结合疫苗 9.吸附百白破联合疫苗 10.吸附无细胞百白破联合疫苗 11.吸附破伤风疫苗 12.吸附白喉疫苗 13.吸附白喉疫苗(成人及青少年用) 14.吸附白喉破伤风联合疫苗(成人及青少年用) 15.吸附白喉破伤风联合疫苗 16.A群C群脑膜炎球菌多糖疫苗 17.A群脑膜炎球菌多糖疫苗 18.23价肺炎球菌多糖疫苗 病毒类疫苗: 1.森林脑炎灭活疫苗 2.黄热减毒活疫苗 3.乙型脑炎灭活疫苗 4.乙型脑炎减毒活疫苗 5.Ⅰ型肾综合征出血热灭活疫苗 6.Ⅱ型肾综合征出血热灭活疫苗 7.双价肾综合征出血热灭活疫苗 8.人用狂犬病疫苗(Vero细胞) 9.冻干人用狂犬病疫苗(Vero细胞) 10.人用狂犬病疫苗(地鼠肾细胞) 11.重组乙型肝炎疫苗(酵母) 12.重组乙型肝炎疫苗(CHO细胞) 13.冻干甲型肝炎减毒活疫苗 14.甲型肝炎减毒活疫苗 15.甲型肝炎灭活疫苗 16.甲、乙型肝炎联合疫苗 17.口服轮状病毒活疫苗 18.麻疹减毒活疫苗 19.脊髓灰质炎减毒活疫苗糖丸(人二倍体细胞) 20.口服脊髓灰质炎减毒活疫苗(猴肾细胞) 21.脊髓灰质炎减毒活疫苗糖丸(猴肾细胞) 22.风疹减毒活疫苗(人二倍体细胞) 23.风疹减毒活疫苗(兔肾细胞) 24.腮腺炎减毒活疫苗 25.冻干水痘减毒活疫苗 26.麻疹腮腺炎联合减毒活疫苗 27.麻疹风疹联合减毒活疫苗 28.麻疹-腮腺炎-风疹三联减毒活疫苗 29.流感全病毒灭活疫苗 30.流感病毒裂解疫苗 31.流感病毒亚单位疫苗 二、血液制品目录 1.人血白蛋白 2.冻干人血白蛋白 3.静注人免疫球蛋白(pH4) 4.冻干静注人免疫球蛋白(pH4) 三、体外诊断试剂目录 1.梅毒快速血浆反应素诊断试剂 2.梅毒甲苯胺红不加热血清诊断试剂 3.梅毒螺旋体抗体诊断试剂盒(酶联免疫法) 4.乙型肝炎病毒表面抗原诊断试剂盒(酶联免疫法) 5.丙型肝炎病毒抗体诊断试剂盒(酶联免疫法) 6.人类免疫缺陷病毒抗体诊断试剂盒(酶联免疫法) 7.抗A、抗B血型定型试剂(人血清) 8.抗A、抗B血型定型试剂(马血清) 9.抗A、抗B血型定型试剂(单克隆抗体)。
(完整版)疫苗缩写对照表

Ⅱ价肾综合征出血热灭活疫苗
出血热(Ⅱ价)
HFⅡ
双价肾综合征出血热灭活疫苗
出血热(双价)
HFⅠ+Ⅱ
伤寒疫苗
伤寒
Typh
伤寒Vi多糖疫苗
伤寒Vi
Typh-Vi
伤寒副伤寒甲联合疫苗
伤寒副伤寒甲
T-pTA
伤寒副伤寒甲乙联合疫苗
伤寒副伤寒甲乙
T-pTAB
口服福氏宋内痢疾双价活疫苗
痢疾
Dys
钩端螺旋体疫苗
卡介菌纯蛋白衍生物
卡介菌衍生物
BCG-PPD
锡克试验毒素
锡克毒素
STT
吸附破伤风疫苗
破伤风
TT
麻疹减毒活疫苗
麻疹
MV
腮腺炎减毒活疫苗
腮腺炎
Mum
风疹减毒活疫苗(人二倍体细胞)
风疹(二倍体)
Rub-hdc
风疹减毒活疫苗(兔肾细胞)
风疹(兔肾)
Rub-rkc
麻疹腮腺炎风疹联合减毒活疫苗
麻腮风
MMR
麻疹腮腺炎联合减毒活疫苗
麻腮
MM
麻疹风疹联合减毒活疫苗
麻风
MR
腮腺炎风疹联合减毒活疫苗
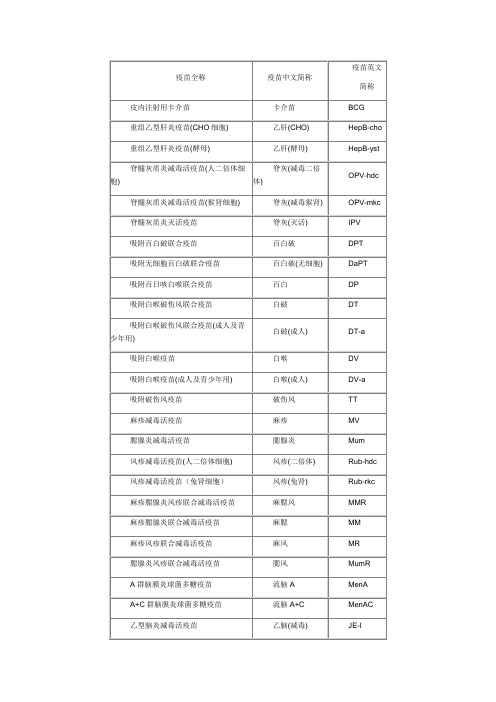
疫苗全称
疫苗中文简称
疫苗英文
简称
皮内注射用卡介苗
卡介苗
BCG
重组乙型肝炎疫苗(CHO细胞)
乙肝(CHO)
HepB-cho
重组乙型肝炎疫苗(酵母)
乙肝(酵母)
HepB-yst
脊髓灰质炎减毒活疫苗(人二倍体细胞)
脊灰(减毒二倍体)
OPV-hdc
脊髓灰质炎减毒活疫苗(猴肾细胞)
脊灰(减毒猴肾)
OPV-mkc
常用疫苗组成成分

海藻糖、谷氨酸钠、精氨酸、抗坏血酸、低分子右旋糖苷、山梨醇、甘露醇
牛血清白蛋白、三氯甲烷、抗生素
灭菌注射用水
甲型肝炎灭活疫苗(人二倍体细胞)
灭活的甲型肝炎病毒
氢氧化铝、注射用氨基酸、磷酸二氢钾、聚山梨醇酯20、氯化钾、氯化钠
牛血清白蛋白、抗生素、甲醛
灭菌注射用水
A群脑膜炎球菌多糖疫苗
风疹减毒活疫苗(人二倍体细胞)
风疹减毒活病毒
明胶、蔗糖、人血白蛋白
牛血清白蛋白、抗生素
灭菌注射用水
风疹减毒活疫苗(兔肾细胞)
风疹减毒活病毒
明胶、蔗糖、人血白蛋白
牛血清白蛋白、抗生素
灭菌注射用水
麻疹腮腺炎联合减毒活疫苗
麻疹减毒活病毒和腮腺炎减毒活病毒
明胶、蔗糖、人血白蛋白、精氨酸、尿素、谷氨酸钠
牛血清白蛋白、抗生素
常用疫苗组成成分
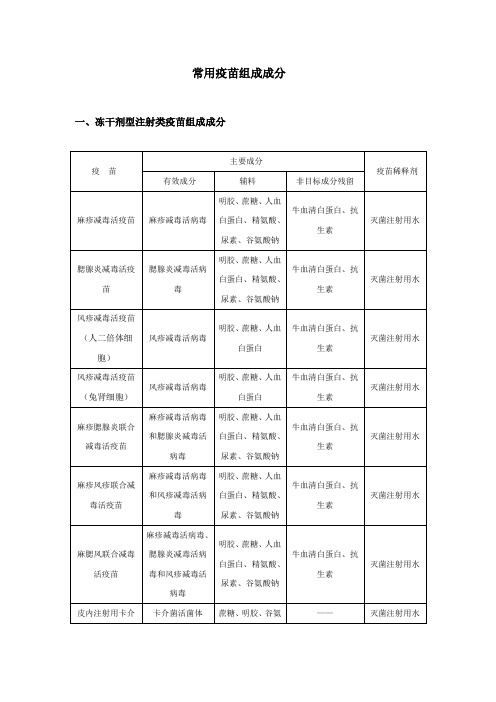
一、冻干剂型注射类疫苗组成成分
疫苗
主要成分
疫苗稀释剂
有效成分
辅料
非目标成分残留
麻疹减毒活疫苗
麻疹减毒活病毒
明胶、蔗糖、人血白蛋白、精氨酸、尿素、谷氨酸钠
牛血清白蛋白、抗生素
灭菌注射用水
腮腺炎减毒活疫苗
腮腺炎减毒活病毒
明胶、蔗糖、人血白蛋白、精氨酸、尿素、谷氨酸钠
牛血清白蛋白、抗生素
灭菌注射用水
灭活的I型和II型肾综合征出血热病毒源自氢氧化铝、硫柳汞、人白蛋白甲醛
双价肾综合征出血热灭活疫苗(沙鼠肾细胞)
灭活的I型和II型肾综合征出血热病毒
氢氧化铝、硫柳汞、人白蛋白
β-丙内酯
三、口服疫苗组成成分
疫苗
主要成分
有效成分
辅料
疫苗全称、简称、中英文对照表

卡介菌衍生物
BCG-PPD
锡克试验毒素
锡克毒素
STT
Welcome !!!
欢迎您的下载,
资料仅供参考!
疫苗全称、简称、中英文对照表
疫苗全称
疫苗中文简称
疫苗英文
简称
皮内注射用卡介苗
卡介苗
BCG
重组乙型肝炎疫苗(CHO细胞)
乙肝(CHO)
HepB-cho
重组乙型肝炎疫苗(酵母)
乙肝(酵母)
HepB-yst
脊髓灰质炎减毒活疫苗(人二倍体细胞)
脊灰(减毒二倍体)
OPV-hdc
脊髓灰质炎减毒活疫苗(猴肾细胞)
白喉(成人)
DV-a
吸附破伤风疫苗
破伤风
TT
麻疹减毒活疫苗
麻疹
MV
腮腺炎减毒活疫苗
腮腺炎
Mum
风疹减毒活疫苗(人二倍体细胞)
风疹(二倍体)
Rub-hdc
风疹减毒活疫苗(兔肾细胞)
风疹(兔肾)
Rub-rkc
麻疹腮腺炎风疹联合减毒活疫苗
麻腮风
MMR
麻疹腮腺炎联合减毒活疫苗
麻腮
MM
麻疹风疹联合减毒活疫苗
麻风
钩体
Lep
皮肤划痕用鼠疫活疫苗
鼠疫
Plag
皮肤划痕人用炭疽活疫苗
炭疽
Anth
皮肤划痕人用布氏菌活疫苗
布病
Bruc
霍乱疫苗
霍乱
Chol
乙型肝炎人免疫球蛋白
乙肝球蛋白
HepBIG
冻干乙型肝炎人免疫球蛋白
乙肝球蛋白(冻干)
HepBIG-fd
白喉抗毒素
白抗
DAT
疫苗全称
Lep
皮肤划痕用鼠疫活疫苗
鼠疫
Plag
皮肤划痕人用炭疽活疫苗
炭疽
Anth
皮肤划痕人用布氏菌活疫苗
布病
Bruc
霍乱疫苗
霍乱
Chol
乙型肝炎人免疫球蛋白
乙肝球蛋白
HepBIG
冻干乙型肝炎人免疫球蛋白
乙肝球蛋白(冻干)
HepBIG-fd
白喉抗毒素
白抗
DAT
冻干白喉抗毒素
白抗(冻干)
DAT-fd
破伤风抗毒素
HFⅠ
Ⅱ价肾综合征出血热灭活疫苗
出血热(Ⅱ价)
HFⅡ
双价肾综合征出血热灭活疫苗
出血热(双价)
HFⅠ+Ⅱ
伤寒疫苗
伤寒
Typh
伤寒Vi多糖疫苗
伤寒Vi
Typh-Vi
伤寒副伤寒甲联合疫苗
伤寒副伤寒甲
T-pTA
伤寒副伤寒甲乙联合疫苗
伤寒副伤寒甲乙
T-pTAB
口服福氏宋内痢疾双价活疫苗
痢疾
Dys
钩端螺旋体疫苗
Pneu23
气管炎疫苗
气管炎
Tra
兰菌净细菌溶解物
兰菌净
Lan
人用狂犬病疫苗(Vero细胞)
狂犬病(Vero)
Rab-Vero
冻干人用狂犬病疫苗(Vero细胞)
狂犬病(Vero冻干)
Rab-Vero-fd
人用狂犬病疫苗(地鼠肾细胞)
狂犬病(地鼠肾)
Rab-hkc
Ⅰ价肾综合征出血热灭活疫苗
出血热(Ⅰ价)
脊髓灰质炎灭活疫苗
脊灰(灭活)
IPV
吸附百白破联合疫苗
百白破
DPT
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
风疹减毒活疫苗(兔肾细胞)
Fengzhen Jiandu Huo Yimiao(Tushen Xibao)
Rubella V accine(Rabbit Kidney Cell), Live
本品系用风疹减毒株接种原代兔肾细胞,经培养、收获病毒液、加入适宜稳定剂后冻干制成,用于预防风疹。
1 基本要求
生产、检定用设施、原材料及辅料、水、器具、动物等应符合“凡例”有关要求。
2 制造
2.1生产用细胞
生产用细胞为原代兔肾细胞或连续传代不超过5代的兔肾细胞。
2.1.1 细胞管理及检定
应符合“生物制品生产和检定用细胞基质制备及检定规程”规定。
2.1.2细胞制备
选用25-30日龄的清洁级家兔,无菌取肾,用胰蛋白酶消化,分散细胞,置37℃或适宜温度培养。
来源于同一批家兔于、同一容器内消化制备的兔肾细胞为1个细胞消化批。
源自同一批家兔、于同一天制备的多个细胞消化批为1个细胞批。
2.2毒种
2.2.1名称及来源
生产用毒种为风疹病毒松叶株。
2.2.2种子批的建立
应符合“生物制品生产和检定用菌毒种管理规程”规定。
毒种用SPF级家兔的原代兔肾细胞传代,原始种子批传代应不超过第12代,主种子批应不超过第17代,工作种子批应不超过第18代,生产的疫苗代次应不超过第19代。
2.2.3种子批的检定
主种子批应进行以下全面检定,工作种子批应至少进行2.2.3.1-2.2.3.5项检定。
2.2.
3.1鉴别试验
将稀释至100-500CCID50/ml的病毒液与适当稀释的抗风疹病毒免疫血清等量混和后,置37℃水浴60分钟,接种RK-13细胞,置32℃培养14天判定结果,风疹病毒应完全被中和(无细胞病变),同时设血清和细胞对照,均应为阴性,病毒对照的滴度应不低于100 CCID50/ml。
2.2.
3.2 病毒滴定
取毒种作10倍系列稀释,每个稀释度病毒液接种RK-13细胞,置32℃培养,14天判定结果,病毒滴度应不低于4.8 Lg CCID50/ml。
同时应用病毒参考品进行
滴定。
2.2.
3.3 无菌检查
依法检查(附录XII A),应符合规定。
2.2.
3.4 支原体检查
依法检查(附录XII B),应符合规定。
2.2.
3.5 病毒外源因子检查
依法检查(附录XII C),应符合规定。
2.2.
3.6免疫原性检查
用主种子批毒种制备疫苗,按常规接种易感儿童至少30名,分别于免疫前及免疫后4~6周采血,测定风疹病毒抗体,抗体阳转率应不低于95%(HI法<1:8为阴性,≥1:8为阳性)。
2.2.
3.7猴体神经毒力试验
主种子批或工作种子批应进行猴体神经毒力试验,以证明无神经毒力。
每次至少用10只风疹抗体阴性的易感猴,每侧丘脑注射0.5ml(应不低于1个人用剂量的病毒量),观察17~21天,不应有麻痹及其他神经症状出现。
注射后48小时内猴死亡数不超过2只可以更换,如超过20%,即使是非特异性死亡,试验也不能成立,应重试。
观察期末,每只猴采血测风疹病毒抗体,阳转率应不低于80%,并处死解剖,对大脑和脊髓的适当部位病理组织学检查,应为阴性。
每次试验同时有2只易感猴作为对照,待试验猴处死后10天,第2次采血,对照猴风疹抗体应为阴性。
2.2.
3.8毒种保存
冻干毒种应置-20℃以下保存;液体毒种置-60℃以下保存。
2.3 原液
2.3.1细胞制备
同2.1.2项。
2.3.2培养液
培养液为含适量灭能新生牛血清的水解乳蛋白MEM培养液或其他适宜培养液。
新生牛血清的质量应符合规定(附录XIII D)。
2.3.3对照细胞外源因子检查
依法检查(附录XII C),应符合规定。
2.3.4病毒接种和培养
细胞在37℃长成单层后,毒种和细胞按??MOI接种,置30~32℃培养,当细胞出现一定程度病变时,倾去培养液,用不少于原倍培养液量的洗液洗涤细胞表面,换含人血白蛋白MEM、199或其他适宜的维持液。
2.3.5 病毒收获
当细胞病变达到相当程度时,收获病毒液。
根据细胞生长情况,可换以维持液,进行多次病毒收获。
同一细胞批的同一病毒收获液检定合格后可合并为单次病毒收获液。
2.3.6 单次病毒收获物检定
按3.1项进行。
2.3.7 单次病毒收获液保存
于于-20℃以下保存不超过30天。
2.3.8 单次病毒收获液合并
两个或多个单次病毒收获液检定合格后可合并为一批原液。
2.3.9原液检定
按3.2项进行。
2.3.10 原液保存
于2-8℃保存不超过30天。
2.4半成品
2.4.1 配制
用疫苗稀释液将原液按同一病毒滴度进行配制,并加入适量稳定剂,即为半成品。
多批检定合格的原液可制备成一批半成品。
2.4.2 半成品检定
按3.3项进行。
2.5成品
2.5.1分批
应符合“生物制品分批规程”规定。
2.5.2.分装及冻干
应符合“生物制品分装和冻干规程”规定。
分装过程中的半成品疫苗应于2-8℃放置
2.5.3规格
按标示量复溶后每瓶0.5ml、1.0ml。
每1次人用剂量为0.5ml,含风疹活病毒应不低于3.2 LgCCID50。
2.5.4.包装
应符合“生物制品包装规程”规定。
3 检定
3.1 单次病毒收获液检定
3.1.1 病毒滴定
按2.2.3.2项进行。
病毒滴度应不低于4.8LgCCID50/ml。
3.1.2 无菌检查
依法检查(附录XII A),应符合规定。
3.1.3 支原体检查
依法检查(附录XII B),应符合规定。
3.2 原液检定
3.2.1病毒滴定
按2.2.3.2项进行,病毒滴度应不低于4.8 LgCCID50/ml。
3.2.2无菌检查
依法检查(附录XII A),应符合规定。
3.2.3 支原体检查
依法检查(附录XII B),应符合规定。
3.3半成品检定
无菌检查
依法检查(附录XII A),应符合规定。
3.3成品检定
除水分测定外,应按制品标示量加入灭菌注射用水,复溶后进行其余各项检定。
3.3.1 鉴别试验
按2.2.3.1项进行。
3.3.2外观
应为乳酪色疏松体,复溶后为橘红色澄明液体,无异物。
3.3.3 水分
应不高于3.0%(附录VII D)。
3.3.4 病毒滴定
取疫苗3-5瓶混合滴定,按 2.2.3.2项进行,病毒滴度应不低于 3.5 LgCCID50/ml。
3.3.5 热稳定性试验
疫苗出厂前应进行热稳定性试验,应与病毒滴定同时进行。
于37℃放置7天后,按2.2.3.2项进行,病毒滴度应不低于3.5 LgCCID50/ml,病毒滴度下降应不高于1.0 Lg。
3.3.6 无菌检查
依法检查(附录XII A),应符合规定。
3.3.7异常毒性检查
依法检查(附录XII F),应符合规定。
3.3.8牛血清白蛋白残留量
应不高于50ng/剂(附录VIII F)。
3.3.9 抗生素残留量测定
细胞制备过程中加入抗生素的应进行该项检查,采用酶联免疫法,应不高于10ng/ml。
4 保存、运输与有效期
于2-8℃避光保存和运输,自生产之日起,有效期为18个月。
5 疫苗稀释剂
疫苗稀释剂为灭菌注射用水,应符合对疫苗稀释剂有关要求。
5.1疫苗稀释剂装量
5.2 疫苗稀释剂包装
5.3 疫苗稀释稀释剂有效期
5.4 疫苗稀释剂批准文号
5.5 疫苗稀释剂生产企业
6 说明书。
