锰纯度定值及其单元素溶液标准物质的研制
多用途的锰矿石成分分析标准物质候选物制备

*+
!"#$ %%
,)
,-%./ '. (
34"5)%
)$*$,- %% ,-%./
"&$ (
01**2
+$*$,- %%
67 &' (
,-%./ '. (
89:;<=>
?@ABCDAEF
3)细 碎、过 筛 和 混 匀:将 配 制 好 的 候 选 物 样 品 用盘磨机粉碎至全部通过 0.097mm振动筛;用双 锥混料机混合 120h;
中图分类号:P575 文献标识码:A doi:10.14101/j.cnki.issn.1002-4336.2018.05.039
锰矿 是 重 要 的 矿 产 资 源,它 广 泛 用 于 冶 金、建 材、化工、农业、能源和国防等国民经济的各个领域, 由于我国锰矿资源贫乏且消耗量大,每年都大量进 口锰矿,据文献介绍我国锰矿消耗企业对国外依存 度达 50%以上[12]。同时,由于成矿条件的变化,不 同产地锰矿在矿物构造、矿物组分,特别是有毒、有 害成分等方面存在明显差异[3],导致在工业设计和 生产中遇 到 麻 烦 甚 至 带 来 “灾 害 ”。 随 着 分 析 技 术 的提升、环保意识的加强和对进口锰矿监测的需要, 为《多用途的锰矿石成分分析标准物质研制》 提出 了需求。本文在《国家质量基础的共性技术研究与 应用》重点专项的支持下,开展了 3个矿区锰矿的 化学成分和矿物组分的研究与 2个标准物质候选物 制备,取得了一定效果。
主 要 仪 器 设 备:荷 兰 帕 纳 科 (PANalytical AxiosmAX) X 射 线 荧 光 光 谱 仪;荷 兰 帕 纳 科 (PANalyticalB.V.X’PertPRO MPD)X射 线 多 功 能粉末衍 射 仪;德 国 赛 多 利 斯 电 子 天 平 (BSA224S
锰标准溶液配制

锰标准溶液配制
锰标准溶液是重要的化学试剂,广泛应用于许多行业和领域中。
为了保证锰标准溶液的准确性和稳定性,制备锰标准溶液需要严格按照标准操作程序进行。
下面是锰标准溶液配制的步骤:
1. 准备所需材料,包括高纯度锰粉、硝酸、去离子水等。
2. 在清洁的烧杯中加入一定量的去离子水,加热至80℃左右。
3. 将一定量的锰粉加入烧杯中,搅拌均匀。
4. 缓慢加入硝酸,同时不断搅拌,直至完全溶解。
5. 将容量瓶加入一定量的去离子水,标记刻度线。
6. 将溶解好的锰溶液倒入容量瓶中,用去离子水冲洗烧杯,将冲洗液倒入容量瓶中,使溶液达到标记刻度线。
7. 用塞子密封容量瓶,摇匀,称取一定量的溶液,进行反应实验。
通过以上步骤,锰标准溶液便可制备完成。
在操作过程中需要注意使用高质量的试剂,避免污染溶液;操作时要严格按照程序进行,避免误差;在制备好的锰标准溶液中定期检测其准确性和稳定性,以确保其可靠性。
- 1 -。
高锰酸钾溶液标准物质的研制

高锰酸钾溶液标 准物质 的研 制 术
梁秀丽 , 张坤 , 王爱 萍 , 李本涛 , 王学琴 。 姚旭霞 , 刘 立君
( 中 国兵器 工 业 集 团第 五 三 研 究所 , 济南 2 5 0 0 3 1)
摘要
介 绍高猛酸钾溶液标 准物质的研制过程。 对研制的溶液标准物质进行 了均 匀性和稳定性考察。 结果表 明 ,
该标 准物 质 均 匀性 良好 , 定 值稳 定期 为 6 个月。 用 称 量 滴 定 法 定值 , 定值结果为 c ( 1 / 5K Mn O ) = O . 1 0 0 7 mo l / k g( 2 ) 。
该标 准溶 液满足二级标 准物质的技术要求 , 已被批 准为国家级二级标 准物质。 关键词 高锰酸钾 ; 标准物质 ; 均 匀性 ; 稳定性 中图分类 号 : 06 5 6 文献标识码 : A 文章 编号 : 1 0 0 8 - 6 1 4 5 ( 2 0 1 3 ) 0 1 — 0 0 0 7 - 0 3
Pr e pa r a ion t o f t he Ce r t i ie f d Re f e r e n c e Ma t e r i a l o f Pot as s i um Pe r ma nga na t e S o l u t i o n
L i a n g Xi u l i , Z h a n g K u n , Wa n g Ai p i n g , L i B e n t a o , Wa n g X u e q i n , Y a o Xu x i a , L i u L i j u n
8
第2 2卷, 第 1 期
2 0 1 3年 1 月
化学 分析 计量
CHE MI CAL ANAL YS I S AND ME TERAGE
标准物质研制报告

标准物质研制报告1. 引言标准物质是指具有一定特定性质、确定的组分和浓度,并通过国家或国际标准化组织审查通过的物质。
标准物质在各行各业的质量控制、检测和测量中起着重要的作用。
本报告旨在介绍一种标准物质的研制过程,包括研制目的、方法和实施结果等内容。
2. 研制目的制定本标准物质的目的主要有以下几点:•提供质量控制中的参照物质,确保测量结果的准确性和可靠性;•满足特定行业或领域中对特定物质的需求;•为科学研究提供标准参照物。
3. 研制方法3.1 选择原材料选择适当的原材料是成功研制标准物质的首要步骤。
原材料的选择应基于以下几个方面的考虑:•对应特定目标物质的化学纯度和物质组成的要求;•准确测量目标物质浓度的技术可行性;•原材料的可获得性和成本。
3.2 物质制备根据选定的原材料,进行物质的制备。
制备过程通常包括:•原材料的称量和混合;•物质的纯化和分离;•通过适当的方法生成目标物质。
制备过程中需要严格控制各个环节,确保目标物质的纯度和组分达到预期要求。
3.3 浓度测定浓度测定是标准物质研制过程中的关键步骤之一。
浓度测定方法应该选择准确、可重复性好的方法。
常见的浓度测定方法包括:滴定法、光谱法、色谱法等。
在浓度测定过程中,还需要通过与已知浓度的参考物质进行比对,验证测定结果的准确性。
3.4 验证与认证在标准物质研制完成后,需要对其进行验证与认证,确保其符合相关标准和要求。
验证与认证的内容可以包括:•目标物质的纯度和组分分析;•浓度测定结果的准确性验证;•与已有标准物质进行比对。
4. 实施结果经过严格的研制过程,我们成功制备了一种符合要求的标准物质。
以下是关键结果的总结:•目标物质的纯度达到了预期要求;•目标物质的组分分析结果表明其与预期组分一致;•通过浓度测定方法测定的浓度结果符合准确性要求;•与已有标准物质进行比对,结果显示本标准物质与已有标准物质具有一致的特性。
5. 结论本报告详细介绍了一种标准物质的研制过程,包括研制目的、方法和实施结果。
标准物质的制备、定值及数据处理_图文(精)

标准物质的制备、定值及数据处理上海市计量测试技术研究院王根荣・标准物质的制备标准物质重新制备的管理是根据国家级标准物质技术的要求,对用于化学成分、物理化学特性和工程技术特性等国家级标准物质的研制,标准物质的候选物、制备、均匀性检验、稳定性检验、定值、测量值、测量方法、统计处理、标准值与不确定度、贮存与包装等,可以参照如下技术规范执行。
1国家级标准物质如何选择候选物与制备 1.1候选物(1候选物的选择应满足适用性、代表性以及容易复制的原则。
(2候选物的基体应和使用的要求相一致或尽可能接近。
(3候选物的均匀性、稳定性及待定特性量的量值范围应适合该标准物质的用途。
(4系列化标准物质特性量的量值分布梯度应满足使用要求,以较少品种复盖预期的范围。
(5候选物应有足够的数量,以满足在有效期间的需要。
1.2制备(1根据候选物的性质,选择合理的制备程序、工艺,并防止污染及待定特性量的量值变化。
(2对待定特性量不易均匀的候选物,在制备过程中,除采取必要的均匀性措施外,还应进行均匀性初检工作。
(3候选物的待定特性量有不易稳定趋向时,在加工过程中注意研究影响稳定性的因素,采取必要的措施改善其稳定性,如辐照灭菌、添加稳定剂等, 选择合适的贮存环境。
(4当候选物制备量大,为便于保存可采取分级分装。
最小包装单元应以适当方式编号,并注明制备日期。
(5最小包装单元中标准物质的实际质量或体积与标称的质量或体积应符合规定的要求。
2国家级标准物质如何进行均匀性检验 2.1不论制备过程中是否经过均匀性初检,凡成批制备并分装成最小包装单元的标准物质必须进行均匀性检验。
对于分级分装的标准物质,凡由大包装分装成最小包装单元时,都需要进行均匀性检验。
2.2抽取单元数抽取单元数对样品总体要有足够的代表性。
抽取单元数取决于总体样品的单元数和对样品的均匀程度的了解。
当总体样品的单元数较多时,抽取单元也应相应增多。
当已知总体样品均匀性良好时, 抽取样品单元数可适当减少。
电解金属锰质量控制过程及成份标准

电解金属锰质量控制过程及成份标准2.Ⅰ为片状,Ⅱ粉状。
3.DJMnA表示电解锰A级。
外观质量电解金属锰允许呈浅棕色,但不允许发黑,产品中不允许有外来夹杂物。
一出槽工注意事项:1出槽工必须提前15分钟到岗,穿戴好防护用品,做好出槽准备工作。
2处理液操作指标:1%水玻璃浓度(含3°硅酸钠溶液pH11-13),3%钝化液浓度(K2Cr2O7水溶液)3极板要求平直:无毛板、无余锰、无污物、光亮4将擦好的阴极板放入水玻璃容器池中浸泡1~2分钟,然后取出用极板车推至电解槽边整齐摆放待用。
5配制好产品钝化液,在取板过程中,并始终确保其PH值在5~6范围内。
6出槽工应听从调仓主操班长指挥,待取板槽内各项指挥调整好后,方可开始取插板。
7出槽取插极时,应取一插一,如此循环操作,注意轻取轻放,不能损坏槽体设施,阴极板及隔膜框袋。
插板前,应对阴极板与导电母排接触点用纱布或钢丝刷擦亮,保证接触点接触良好,进新板时,阴极板必须居中摆放,与母排接触导电好,确保不断路,不短路。
取出的板面应在槽上停留10秒左右,待锰板上槽液大体滤干后方可下槽进入钝化桶钝化,钝化时间为5-7分钟。
8严禁在锰板上堆放锰板,严禁锰板、阴极板在地上拖行。
9钝化后的板面应用清水冲净板面上残留钝化液,及硫铵结晶块,推至烘烤箱交剥离人员烘烤。
出槽工作全部完毕后,及时回收钝化桶、热水桶及地面上脱落产品,冲洗干净交剥离人员烘烤。
二对剥离人员的品质要求剥离前把现场打扫干净,检查剥离工具,领包装物穿戴好防护用品。
1将钝化好的锰板取出,滴干钝化液,用自来水冲洗干净。
2将清洗好的锰板装车推入烘烤箱进行烘烤。
控制烘烤温度在60-110℃间,保证产品不因温度过高而造成发黑变色。
3烘烤产品必须烤干、冷透后,方能剥离,严禁剥离未烘干产品,严禁选板剥离。
4用木棰或塑料锤剥离,应轻拿轻放,轻轻敲打。
严禁乱击乱碰,用力过猛,损坏极板。
5剥离时应轻拿轻放,应尽力将产品剥离干净,不要将产品打出成品台外,个别剥离不掉的要单独堆放,特殊处理。
锰矿中锰含量的测定

锰矿中锰含量的测定作者:赵丽敏来源:《赤峰学院学报·自然科学版》 2011年第4期赵丽敏(赤峰学院化学系,内蒙古赤峰 024000)摘要:本实验主要目的是探索一种测定锰矿中锰含量的一种方法.这种方法主要是甲基百里香酚兰做络合剂做指示剂,用EDTA滴定锰,从而测定出锰的含量.首先用稀硫酸溶解试样,使用pH计调pH值,加入指示剂,滴定至终点.但是这种方法很难确定终点,通过探索加入另一种物质来改变这种状况,在探索中证实了钴有这种能力,pH值必须控制在5.8到6.5左右.加入钴之后终点很好确定,还有另外两种方法可测定锰的含量,以铬黑T为指示剂用CaCO3进行返滴定和以钙指示剂为指示剂用CaCO3进行返滴定.通过比较用甲基百里香酚兰络合剂做指示剂用EDTA滴定锰的含量的方法的准确度较高.关键词:锰;甲基百里香酚兰络合剂;EDTA络合滴定;Co2+-EDTA中图分类号:P575 文献标识码:A 文章编号:1673-260X(2011)04-0029-031 关于锰的介绍锰是自然界分布较广的一种元素,约占地壳重量的0.085%,它主要以氧化物形式存在.锰是银灰色金属,元素符号Mn,原子序数25,原子量54.94,比重7.4g/cm3,熔点1250摄氏度,是一种难熔的重金属.在自然界中锰有Ⅱ、Ⅲ、Ⅳ及Ⅶ价态,其中以Ⅱ和Ⅳ价态最为常见.锰在空气中非常容易氧化.在加热条件下,粉状的锰与氯、溴、磷、硫、硅及碳元素都可以化合.锰在地球岩石圈中以及硅酸盐相的陨石中表现有强烈的亲石性质,但在岩石圈上部则有强烈的亲氧性质,锰与铁在岩石圈中以及陨石中虽有许多相似的化学性质,但锰并不亲铁.2 实验原理锰矿的主要成分是二氧化锰,其主要杂质是铁.因此在测锰的含量时主要考虑铁的影响.在溶解试样时,先进行酸洗,但是考虑到二价锰的损失,加入少许过氧化氢,抑制二价锰的溶解损失.洗完之后加入还原剂草酸钠,再加稀硫酸,加热溶解.测定时,首先制备EDTA溶液,用碳酸钙标定EDTA溶液,EDTA溶液应当保存在聚氯乙烯瓶或硬质玻璃瓶中,若贮存于软质玻璃瓶中,会不断溶解玻璃瓶中的Ca2+形成CaY2-使EDTA浓度不断降低.用CaCO3标定EDTA时,通常使用钙指示剂指示终点,用NaOH控制溶液pH为12~13,其变色原理为:滴定前 Ca+In(蓝色)=CaIn(红色)滴定中 Ca+Y=CaY终点时 CaIn(红色)+Y=CaY+In(蓝色)然后以甲基百里香酚兰络合剂做指示剂在pH=5.9~6.5之间用EDTA标准溶液滴定Mn2+.具体做法是:取一定体积的试样溶液于锥形瓶中,加入2~3滴指示剂,2滴Co2+-EDTA溶液,用六亚甲基四胺溶液调pH=5.9~6.5,以EDTA标准溶液滴定.其变色原理为:滴定前 Mn2++CoEDTA=MnEDTA+Co2+Co+In(黄色)=CoIn(蓝色)滴定中 Mn+Y=MnY终点时 EDTA+CoIn(蓝色)=CoEDTA+In(黄色)以钙指示剂为指示剂进行返滴定的原理,首先取一定体积的试样溶液于锥形瓶中,然后加入过量的EDTA标准溶液,用六亚甲基四胺溶液调pH=5.9~6.5,静置一会儿等过量的EDTA标准溶液与锰进行反应,反应为:Mn+Y= MnY.再用NaOH溶液控制pH值在12~13之间,将剩余的EDTA标准溶液用CaCO3返滴定.其变色原理为:滴定前滴定前指示剂在溶液中呈游离状态,溶液颜色为指示剂颜色,蓝色.滴定中 Ca+Y=CaY终点时 Ca+In(蓝色)=CaIn(红色)以EBT为指示剂进行返滴定的原理,首先取一定体积的试样溶液于锥形瓶中,然后加入过量的EDTA标准溶液,用六亚甲基四胺溶液调PH=5.9~6.5,静置一会儿等过量的EDTA标准溶液与锰进行反应,反应为:Mn+Y=MnY.然后用氨水将溶液的PH值调制9~10左右,然后加入一定体积的NH3·H2O-NH4Cl冲溶液,剩余的EDTA标准溶液用CaCO3返滴定,其变色原理为:滴定前滴定前指示剂在溶液中呈游离状态,溶液颜色为指示剂颜色,蓝色.滴定中 Ca+Y=CaY终点时 Ca+In(蓝色)=CaIn(红色)3 实验试剂及仪器试剂:甲基百里香酚兰络合剂[6],乙二胺四乙酸二钠,HCl溶液1:1,钙指示剂,1g钙指示剂与100gNaCl混合磨匀,NaOH溶液40g·L-1,六亚甲基四胺溶液200g·L-1,六亚甲基四胺缓冲溶液,分析纯MnO2,化学纯MnO2,Na2C2O4(s)分析纯;H2SO4溶液3mol·L-1,软锰矿试样,CaCO3固体,NH3·H2O-NH4CI缓冲溶液;邻二氮菲溶液,30%H2O2溶液,MnSO4固体,NaAc-HAc缓冲溶液,NaAc固体.仪器:PH酸度计,50mL,100mL,250mL,500mL的容量瓶,500mL的试剂瓶;500mL的烧杯;250mL锥形瓶;表面皿;电热套;聚乙烯瓶.4 实验步骤4.1 溶液的配制4.1.1 0.020mol·L-1EDTA溶液的配制[2]称取4.0g乙二胺四乙酸二钠(Na2H2Y.2H2O)于500mL的烧杯中,加200mL水,温热使其溶解完全,转入至聚乙烯瓶中,用水稀释至500mL,摇匀,备用.4.1.2 1:1 HCl溶液的配制用10mL量筒量取5mL浓HCl,慢慢加入蒸馏水至10mL,静置一段时间备用.4.1.3 0.020mol·L-1钙标准溶液的配制准确称取110℃干燥过的CaCO3 0.50-0.55g,置于250mL烧杯中,用少量水润湿,盖上表面皿,慢慢滴加1:1 HCl溶液5mL使其溶解,加少量水稀释,定量转移至250mL容量瓶中,用水稀释至刻度,摇匀,计算其准确浓度.4.1.4 40g·L-1 NaOH溶液的配制称取2g NaOH固体于100mL烧杯中,加少量水溶解,然后加水稀释至50mL备用.4.1.5 3mol·L-1 H2SO4溶液的配制将167mL的18mol·L-1 H2SO4溶液慢慢加到含835mL蒸馏水的容量瓶中.4.1.6 试样的溶液的配制准确称取0.9~1g化学纯MnO2,置于250mL锥形瓶中.根据MnO2的含量称取含量较理论值计量多一点的Na2C2O4,置于上述锥形瓶中,再加入30mL3mol·L-1 H2SO4溶液30mL和水20mL.在锥形瓶上盖上表面皿,在电热套上控温加热,直至不在放出二氧化碳气体为止,且无黑色颗粒残渣为止.以水稀释锥形瓶内壁及表面皿,将溶液转入容量瓶中稀释至250mL.备用.4.1.7 由分析纯MnO2制备Mn2+溶液准确称取0.9~1g分析纯MnO2,置于250mL锥形瓶中.根据MnO2的含量称取含量较理论值计量多一点的Na2C2O4,置于上述锥形瓶中,再加入30mL3mol·L-1 H2SO4溶液30mL和水20mL.在锥形瓶上盖上表面皿,在电热套上控温加热,直至不在放出二氧化碳气体为止,且无黑色颗粒残渣为止.以水稀释锥形瓶内壁及表面皿,将溶液转入容量瓶中稀释至250mL.备用.4.1.8 200g·L-1六亚甲基四胺溶液的配制准确称取100g六亚甲基四胺溶液与250mL烧杯中,加200mL蒸馏水溶解,然后转移到500mL的试剂瓶中,加蒸馏水至刻度,摇匀,备用.4.1.9 NH3·H2O-NH4CI缓冲溶液的配制准确称取NH4CI 27g置于250mL烧杯,加100mL蒸馏水溶解,然后加浓氨水31.5mL,然后转移到500mL的试剂瓶中,加蒸馏水至刻度,摇匀,备用.4.1.10 NaAc-HAc缓冲溶液的配制准确称取NaAc 41.5g至于250烧杯,加100mL蒸馏水溶解,然后加冰醋酸60mL,然后转移到500mL的试剂瓶中,加蒸馏水至刻度,摇匀,备用.4.2 CaCO3为基准物标定EDTA溶液的浓度移取20.00mL钙标准溶液于250mL锥形瓶中,加5mL 40g·L-1 NaOH溶液及少量钙指示剂,摇匀后,用EDTA溶液滴定至由酒红色恰变为纯蓝色,即为终点.平行做三份,计算EDTA标准溶液的浓度.4.3 分析纯试样中的Mn的含量的测定4.3.1 用甲基百里香酚兰络合剂做指示剂进行滴定用10mL移液管准确移取10mLMn2+溶液,加入200g·L-1六亚甲基四胺溶液调制pH=5.9—6.4左右,然后加入甲基百里香酚兰络合剂,滴入一滴Co2+-EDTA溶液,用EDTA标准溶液滴定至颜色由蓝色恰变为黄色为止,即为终点.平行测定三份,计算出锰的含量.4.3.2 用EBT做指示剂返滴定首先用10mL移液管准确移取10mLMn2+溶液,加入200g·L-1六亚甲基四胺溶液调制PH=5.9~6.4左右,然后加入10mLEDTA标准溶液,摇匀,静置一会儿,加入5mL浓NH3·H2O,再加入10mLNH3·H2O-NH4CI缓冲溶液,控制PH值在9~10左右滴入一滴EBT溶液,用CaCO3溶液滴定至溶液由蓝色恰变为酒红色为止,即为终点.平行测定三份,计算出锰的含量.4.3.3 用钙指示剂做指示剂返滴定首先用10mL移液管准确移取10mL Mn2+溶液,加入200g·L-1六亚甲基四胺溶液调制PH=5.9~6.4左右,然后加入10mLEDTA标准溶液,摇匀,静置一会儿,加入5mL 40g·L-1 NaOH溶液,加入钙指示剂,用CaCO3溶液滴定至溶液由蓝色恰变为紫红色为止,即为终点.平行测定三份,计算出锰的含量.4.4 试样的Mn的含量的测定用10mL移液管准确移取10mL Mn2+溶液,加入200g·L-1六亚甲基四胺溶液调制pH=5.9~6.4左右,然后加入甲基百里香酚兰络合剂,滴入一滴Co2+-EDTA溶液,用EDTA标准溶液滴定至颜色由蓝色恰变为黄色为止,即为终点.平行测定三份,计算出锰的含量.5 实验数据记录与处理5.1 CaCO3为基准物标定EDTA溶液的浓度的数据处理5.2分析纯MnO2中的Mn的含量的测定数据处理.5.2.1甲基百里香酚兰络合剂做指示剂5.2.2用钙指示剂做指示剂返滴定数据处理5.2.3 用EBT做指示剂返滴定数据处理5.3试样的Mn的含量的测定数据处理6 方法的讨论与分析6.1 实验方法的选择根据本次试验中测定分析纯二氧化锰中锰的含量所运用的三种方法来看,用甲基百里香酚兰络合剂做指示剂的方法灵敏度和准确度比较高.但是在用甲基百里香酚兰络合剂做指示剂时,必须加入Co2+-EDTA溶液否则终点很难确定,变色不灵敏.当加入Co2+-EDTA溶液时终点变色非常灵敏.此法比返滴定法的终点都好确定,但是具体的原因尚未确定,有怠于进一步探索.6.2 实验条件的选择溶液的pH值在5.9和6.5之间时测定效果最好,pH值太大锰会沉淀,太小指示剂不稳定.调pH值时最好用六亚甲基四胺溶液,试样溶液是强酸性溶液,但是当加入强碱性溶液时,在酸碱中和的过程中还伴随着Mn的氧化,会将二价的锰氧化成二氧化锰,给最终的测定带来误差.NaAc是弱碱,它也可以用来调PH值,但是因为NaAc-HAc缓冲溶液的缓冲在PH值在4.4左右[3],实验前后溶液的PH值变化差大,而且小于5.9使终点提前,带来实验误差.参考文献:〔1〕林顺增,叶子斌,苏世花,朱明慧,陈樟几,张启卫.Journal of Sanming College.三明高等专科学校学报.〔2〕〔4〕华中师范大学,东北师范大学,陕西师范大学,北京师范大学.分析化学实验.高等教育出版社出版,2006.〔3〕武汉大学.分析化学.高等教育出版社出版,2006.〔5〕吉林冶金研究所.金属与矿物原料分析手册.吉林人民出版社出版,1978.〔6〕广东省冶金地质实验研究所.矿石分析与常用仪器.1973.。
原子吸收分光光度法单元素标准系列溶液的配制
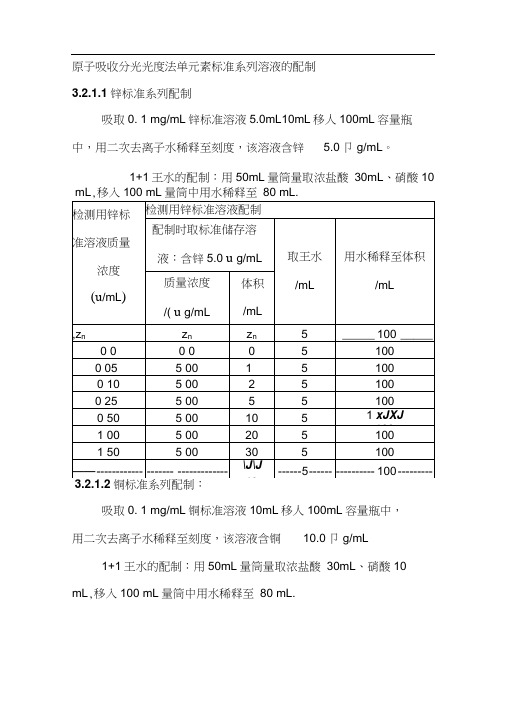
原子吸收分光光度法单元素标准系列溶液的配制3.2.1.1锌标准系列配制吸取0. 1 mg/mL锌标准溶液5.0mL10mL移人100mL容量瓶中,用二次去离子水稀释至刻度,该溶液含锌 5.0卩g/mL。
1+1王水的配制:用50mL量筒量取浓盐酸30mL、硝酸10 mL,移入100 mL量筒中用水稀释至80 mL.吸取0. 1 mg/mL铜标准溶液10mL移人100mL容量瓶中,用二次去离子水稀释至刻度,该溶液含铜10.0卩g/mL1+1王水的配制:用50mL量筒量取浓盐酸30mL、硝酸10 mL,移入100 mL量筒中用水稀释至80 mL.1+1王水的配制:用50mL量筒量取浓盐酸30mL、硝酸10检测用铅标准溶液配制mL,移入100 mL量筒中用水稀释至80 mL.。
吸取0. 1 mg/mL银标准溶液5.0mL10mL移人100mL容量瓶中,用二次去离子水稀释至刻度,该溶液含银 5.0卩g/mL1+1王水的配制:用100mL量筒量取浓盐酸60mL、硝酸20 mL,移入200 mL量筒中用水稀释至160 mL.吸取锰标准溶液10mL移人100mL容量瓶中,用二次去离1+1王水的配制:用100mL量筒量取浓盐酸60mL、硝酸20mL ,移入200 mL量筒中用水稀释至160 mL吸取0. 1 mg/mL钻标准溶液20.0mL标准溶液20mL移人100mL容量瓶中,用二次去离子水稀释至刻度,该溶液含钻20.0 卩g/mL1+1王水的配制:用50mL量筒量取浓盐酸30mL、硝酸10 mL,移入100 mL量筒中用水稀释至80 mL。
吸取0. 1 mg/mL镍标准溶液20.0mL标准溶液移人100mL容量瓶中,用二次去离子水稀释至刻度,该溶液含镍20.0卩g/mL 1+1王水的配制:用50mL量筒量取浓盐酸30mL、硝酸10 mL,移入100 mL量筒中用水稀释至80 mL3.2.1.8金标准系列配制:吸取0. 1 mg/mL金标准溶液2.50mL标准溶液移人100mL 容量瓶中,加入浓盐酸18mL用二次去离子水稀释至刻度,该溶液含金2.50卩g/mL。
锰矿石中锰含量测定方法确认与应用

2.1 样品分解使用的介质选择 试样的分解介质可选择磷酸、盐酸—磷酸—硝
酸、硫酸—磷酸—硝酸。以图标为依据开展了样品 分解介质和条件的确认实验[6],由于锰矿试样中含 有有机物、硫化物及其他还原物质,因此,本法选择 盐酸—磷酸—硝酸介质分解试样。 2.2 样品分解冒烟时间的影响
按样品分析步骤对有证标准物质(GBW07264) 进行分解,加热至冒 SO3浓白烟时开始计时,再加热 不同时间后取下,后续按分析步骤进行锰含量测定, 结果见图 1。
52
中 国 锰 业
第 39卷
T1 =C[(NH4)2Fe(SO4)2·6H2O]×0.05494
(2)
式(1)~(2)中:C[(NH4)2Fe(SO4)2·6H2O] 为硫酸亚铁铵溶液的浓度,mol/L;C(1/6K2Cr2O7) 为重铬酸钾标准溶液的浓度,mol/L;V为移取重铬
酸钾标准溶液的体积,mL;V1 为标定消耗硫酸亚铁 铵溶液的体积,mL;V0 为空白标定 消耗硫 酸亚 铁 铵 溶液的体积,mL;T1 为硫酸亚铁铵溶液对锰的滴定 度,g/mL;0.05494为 锰 的 毫 摩 尔 质 量,g/(m·
由图 1可 知:在 实 验 条 件 下 样 品 分 解 冒 烟 时 间对锰测定 结 果 有 影 响,主 要 是 时 间 过 长 容 易 析
(,+)
(*+5 $%$ $%& '%$ '%& (%) (%& *+$ *%& ,%$ ,%& !"#
图 3 加入不同量的高氯酸的对锰测定结果影响
由图 3可知:高氯酸量超过 1.0mL后结果偏
54
中 国 锰 业
第 39卷
与科研相伴 与时代同行——记中国计量科学研究院化学计量技术应用研究室主任周涛

66 科学中国人 2020年12月创新之路Way of Innovation与科研相伴 与时代同行——记中国计量科学研究院化学计量技术应用研究室主任周涛 王静娟科学技术是第一生产力,科学界的各大领域从理论研究到实际应用大抵都需要经历科学—技术—生产力的过程,这是科研成果转化的规律。
社会的发展进步呼唤科学技术的进步,科研成果的价值取决于对时代发展贡献的大小,这是对科学研究的方向性指引。
中国计量科学研究院化学计量技术应用研究室主任周涛用实际行动做出了对科研的诠释。
多年来,他致力于关于无机质谱的应用研究,在高纯金属纯度计量、同位素丰度与原子量测量和同位素稀释质谱法领域做出了突出贡献。
“我们的科研成果不能悬在空中,应该让它落地为社会做出更多贡献。
”他如此说道。
潜心科研,追求卓越周涛的研究生涯始于中国原子能科学研究院。
24年前,刚刚从北京大学化学系本科毕业的周涛来到中国原子能科学研究院继续深造,开启他在同位素丰度和原子量测量方面的科研探索。
一直以来,元素同位素都因其特有的性质被广泛应用于地质科学、核科学等领域,周涛的硕士论文就是关于锂同位素标准物质的研究。
在此期间,他接触到了同位素质谱和标准物质,“标准物质在测量物质或材料特性、评价分析测量方法等方面起着不可或缺的作用,一个测量实验室的水平高低只要看它使用和存放标准物质的数量就可知晓。
”科研前辈这样向周涛解释标准物质的重要性。
在攻读博士期间,周涛在中国计量科学研究院赵墨田研究员的指导下开展钕原子量测量新技术的研究。
“在化学学科中,原子量作为基本常数,一切化学反应、分析等都要用原子量进行计算,而原子量则是通过测量元素同位素丰度得到的。
”周涛向记者介绍道。
现代的原子量测量通常采用沿用了数十年的热电离质谱绝对测量法,其优点是理论研究成熟,系统偏差小,但也存在测量周期长,多个样品测量重复性的控制技术难度大的缺点。
而作为2000年后才发展起来的多接收电感耦合等离子体质谱仪(MC-ICP-MS),虽然也具备了高精密度同位素测量能力,但由于系统偏差相比热电离质谱有量级上的差别,国内外质谱界普遍认为其只能用于相对测量,无法用于原子量测量和同位素标准物质研制等具有高准确度需求的研究。
锰矿石成分分析标准物质研制

2022年3月March2022岩 矿 测 试ROCKANDMINERALANALYSISVol.41,No.2314-323收稿日期:2021-04-08;修回日期:2021-08-04;接受日期:2021-09-21基金项目:“国家质量基础的共性技术研究与应用”重点专项“多用途的锰矿石成分分析标准物质研制”(2016YFF020110307);中央引导地方科技发展专项资金项目(2018KT5001)第一作者:王干珍,研究员级高级工程师,从事地质实验测试工作。
E-mail:1345817528@qq.com。
通信作者:彭君,博士,高级工程师,从事地质实验测试工作。
E-mail:pengjun6539@126.com。
王干珍,彭君,李力,等.锰矿石成分分析标准物质研制[J].岩矿测试,2022,41(2):314-323.WANGGanzhen,PENGJun,LILi,etal.PreparationofStandardMaterialforCompositionAnalysisofManganeseOre[J].RockandMineralAnalysis,2022,41(2):314-323.【DOI:10.15898/j.cnki.11-2131/td.202104080051】锰矿石成分分析标准物质研制王干珍1,彭君1,李力2,秦毅1,曹健1,田宗平1(1.湖南省地质测试研究院,湖南长沙410007;2.湖南省有色地质勘查局二四五队,湖南吉首416007)摘要:锰矿中有毒有害元素对锰提纯工艺、生产环境和产品质量的影响,一直是困扰锰行业发展的技术难题,也是实验测试亟需解决的质量基础共性技术问题。
目前,国内外现有的锰矿石成分分析标准物质共有10个,定值成分有Mn、Fe、Al2O3和SiO2等17种,均缺乏Cl、F、Pb、Cd、Co、Cr、Hg和As等有害成分的定值,从而无法满足锰提纯工艺研发、环境监测评估、锰矿进口监督、检测方法评价等需要。
环境监测用6 种金属离子混合溶液标准物质的研制

引用格式:施力予, 王晓文, 杨扬仲夫, 等. 环境监测用6种金属离子混合溶液标准物质的研制[J]. 中国测试,2022, 48(8): 73-79.SHI Liyu, WANG Xiaowen, YANG Yangzhongfu, et al. Preparation of 6 kinds of metal ions solution reference materials for environmental monitoring[J]. China Measurement & Test, 2022, 48(8): 73-79. DOI: 10.11857/j.issn.1674-5124.2022050210环境监测用6种金属离子混合溶液标准物质的研制施力予1, 王晓文2, 杨扬仲夫2, 罗婷婷3, 韩 爽3, 张鹏辉3, 杨嘉伟4(1. 甘肃省计量研究院,甘肃 兰州 730070; 2. 中国计量测试学会,北京 100020;3. 四川中测标物科技有限公司,四川 成都 610052;4. 中国测试技术研究院,四川 成都 610021)摘 要: 详细介绍水中锰、铜、钡、锌、镍、铬6种重金属离子溶液标准物质的研制。
采用经准确校准后的仪器设备,主要包括电感耦合等离子体光谱仪和质谱仪、离子色谱仪等对6种金属原料的杂质进行分析,同时对原料间相互包含的干扰杂质分析测定,最后结合质量平衡法对6种原料进行纯度定值。
根据F 检验和t 检验结果表明,采用重量-容量法制备的水中锰、铜、钡、锌、镍、铬离子混合溶液标准物质具有良好的均匀性和稳定性,定值结果为100 μg/mL ,相对扩展不确定度为U = 2% (k = 2)。
该标准物质可用于分析仪器的检定校准,环境等领域中多元素分析方法确认与质量控制。
关键词: 金属离子; 标准物质; 杂质扣除法; 多元素分析中图分类号: TB9文献标志码: A文章编号: 1674–5124(2022)08–0073–07Preparation of 6 kinds of metal ions solution referencematerials for environmental monitoringSHI Liyu 1, WANG Xiaowen 2, YANG Yangzhongfu 2, LUO Tingting 3,HAN Shuang 3, ZHANG Penghui 3, YANG Jiawei 4(1. Gansu Provincial Research Institute of Measurement, Lanzhou 730070, China; 2. Chinese Society for Measurement,Beijing 100020, China; 3. Sichuan ZhongzhiBiao Technology Co., Ltd., Chengdu 610052, China; 4. NationalInstitute of Measurement and Testing Technology, Chengdu 610021, China)Abstract : This paper introduced the developed process of 6 kinds of metal ions mixed solution reference material. Based on deduction impurity method, the purity of 6 kinds raw materials were precisely detected by the analysis of inductively coupled plasma mass spectrometry (ICP-MS), inductively coupled plasma optical emission spectrometry (ICP-OES) and ion chromatograph (IC). These ions as impurity existed in each other were determined quantitatively. According to F and t examinations, the solution prepared by weighting-volumetric method was good in homogeneity and stability. The characteristic value of this mixed reference material was 100 μg/mL with the relative expanded uncertainty of 2% (k = 2) in 12 months. This reference material was used for the calibration of instrument, the evaluation of multi-element analytic procedure and quality control in environmental and other fields.tal and other fields.Keywords : metal ions; reference material; deduction impurity method; multi-element analysis收稿日期: 2022-05-28;收到修改稿日期: 2022-06-23作者简介: 施力予(1970-),女,甘肃兰州市人,高级工程师,硕士,主要从事标准物质及化学计量技术研究工作。
单元素标准溶液

单元素标准溶液单元素标准溶液是化学实验室中常用的一种溶液,它具有一定浓度和纯度的特点,可以用于标定和校准实验中所需的其他溶液。
在化学分析和实验中,单元素标准溶液扮演着至关重要的角色,因此我们有必要对其特点、制备方法和应用进行深入了解。
首先,单元素标准溶液的特点是具有已知浓度和纯度。
这是通过精密的实验操作和仪器设备测定得出的,因此可以作为化学实验中其他溶液的标准参照物。
其次,单元素标准溶液的制备方法是通过称量一定量的纯物质,溶解于溶剂中并配制成所需浓度的溶液。
在制备过程中需要严格控制溶质的质量和称量精度,以确保溶液的准确性和可靠性。
在实际应用中,单元素标准溶液有着广泛的用途。
首先,它可以用于标定和校准分析仪器,如PH计、离子色谱仪等,以确保仪器测定结果的准确性和可靠性。
其次,单元素标准溶液还可以用于质量控制和质量保证,例如在药品生产中对原料药和成品药的含量进行检测和控制。
此外,单元素标准溶液还可以用于科研实验和教学实验中,作为化学试剂和标准物质使用。
在制备单元素标准溶液时,需要注意一些关键问题。
首先,选择纯度高、稳定性好的原料物质,以确保溶液的准确性和可靠性。
其次,需要严格控制称量和溶解过程中的误差,避免对溶液浓度和纯度造成影响。
最后,在使用过程中需要注意溶液的保存和保管,避免受到外界环境的污染和影响。
综上所述,单元素标准溶液在化学实验中具有重要的地位和作用,它的准确性和可靠性对实验结果和分析数据具有至关重要的影响。
因此,我们在制备和使用单元素标准溶液时,需要严格遵循操作规程,确保溶液的质量和准确性,以提高实验结果的可靠性和科学性。
同时,我们也要不断加强对单元素标准溶液的研究和应用,促进其在化学领域的进一步发展和应用。
高锰酸钾标准溶液的配制及标定方法

实验十二(0.02mol/L)KMnO4标准溶液的配制与标定1、实验原理市售的KMnO4试剂中常含有少量的MnO2和其它杂质,高锰酸钾在制备和贮存过程中,常混入少量的杂质,蒸馏水中常含有微量还原性的物质,它们可与MnO4-反应而析出MnO(OH)2沉淀,这些生成物以及光、热、酸、碱等外界条件的改变均会促进KMnO4的分解,因此KMnO4标准溶液不能直接配制。
为了配制较稳定的KMnO4溶液,常采用下列措施:(1)称取稍多于理论量的KMnO4溶液,溶解在规定体积的蒸馏水中。
(2)将配制好的KMnO4溶液加热至沸,并保持微沸1h,然后放置2~3天,使溶液中可能存在的还原性的物质完全氧化。
(3)用微孔玻璃漏斗过滤,除去析出的沉淀。
(4)将过滤后的KMnO4溶液贮存于棕色试剂瓶中,并寸放在暗处,以待标定。
如需要浓度较稀的KMnO4溶液,可用蒸馏水将KMnO4稀释和标定后使用,但不宜长期贮存。
标定KMnO4标准溶液的基准物很多,在H2SO4溶液中,MnO4-与C2O4-的反应如下:2 MnO4- + 5 C2O4- +16H+ < xmlnamespace prefix ="v" /> 2Mn2+ +10CO2↑+ 8H2O为了使这个反应能够定量地较快地进行,应注意下列滴定条件:(1)温度:在室温下,这个反应的速率缓慢,因此常将溶液加热至70~85℃时进行滴定。
但温度过高,若高于90℃,会使部分H2C2O4发生分解:H2C2O4→CO2 + CO + H2O(2)酸度:酸度过低,KMnO4易分解为MnO2;酸度过高,会促使H2C2O4分解,一般滴定开始时的酸度应控制在0.5~1mol/L。
(3)滴定速度:开始滴定时的速度不宜太快,否则加入的KMnO4溶液来不及与C2O4-反应,即在热的酸性溶液中发生分解反应。
(4)催化剂:开始加入的几滴KMnO4溶液褪色较慢,随着滴定产物Mn2+的生成,反应速率逐渐加快。
锰纯度定值及其单元素溶液标准物质的研制

锰纯度定值及其单元素溶液标准物质的研制孙倩芸;李锋丽;杨焕蝶;陈蕾蕾;高捷;郭波;张喆【摘要】以高纯锰为原料研制锰单元素溶液标准物质.采用电感耦合等离子体质谱法、电感耦合等离子体发射光谱法以及元素分析仪3种方法测定高纯锰中杂质元素的含量,并通过杂质扣除法确定了高纯锰的纯度为(99.95±0.04)%(k=2).采用重量-容量法制备了锰单元素溶液标准物质,以配制值作为锰单元素溶液标准物质的标准值.对溶液标准物质的均匀性和稳定性进行了检验,其均匀性与稳定性良好.对标准物质的不确定度进行了评定.锰单元素溶液标准物质的浓度值为100μg/mL,相对扩展不确定度为0.8%(k=2).该标准物质的量值准确,可用于锰元素的分析检测、检测方法评价与仪器校准.【期刊名称】《化学分析计量》【年(卷),期】2019(028)005【总页数】5页(P1-5)【关键词】ICP-MS;ICP-OES;锰溶液标准物质【作者】孙倩芸;李锋丽;杨焕蝶;陈蕾蕾;高捷;郭波;张喆【作者单位】山东省计量科学研究院,济南 250014;山东省计量科学研究院,济南250014;山东省农业科学院农产品研究所,济南 250100;山东省农业科学院农产品研究所,济南 250100;山东省计量科学研究院,济南 250014;山东省计量科学研究院,济南 250014;山东省计量科学研究院,济南 250014【正文语种】中文【中图分类】O656金属溶液标准物质是无机标准物质重要的组成部分,其广泛应用于环境监察、食品药品安全检测、化工合成、冶金工业和材料生产过程控制等行业和领域[1–3]。
金属单元素溶液标准物质一般以高纯金属为原料,在对原料纯度进行测定的基础上,采用重量–容量法进行制备[4–6]。
因此高纯金属纯度分析成为金属单元素溶液标准物质定值的关键点。
对于纯度达到99.99%以上的金属,很难进行直接的主体含量测量,而通常采用杂质扣除的方法,即测量其中的杂质含量经扣除计算得到纯度量值。
标准物质的制备和定值

标准物质的制备和定值固体标准物质的制备⼤致可以分为采样、粉碎、混匀和分装等⼏步。
固体标准物质通常是直接采⽤环境样品制备的。
已被选作标准物质的环境样品有飞灰、河流沉积物、⼟壤、煤;植物的叶、根、径、种籽;动物的内脏、肌⾁、⾎、尿、⽑发、⾻骼等。
多数环境的液体和⽓体样品很不稳定,组成的动态变化⼤,所以液体和⽓体的标准物质是⽤⼈⼯模拟天然样品的组成制备的。
均匀是标准物质第⼀位和最根本的要求,是保证标准物质具有空间⼀致性的前提,对固体样品尤其如此。
均匀性是⼀个相对的概念。
⾸先,绝对的均匀是不可能实现的。
若样品的不均匀度远远⼩于分析中的误差,就可以认为样品是均匀的。
样品的均匀性⼜是有针对性的,因为不同组分在样品中的分布是很不同的。
有些组分很难达到均匀,例固体样品,对这类组分的均匀性检查是检验⼯作的重点。
取量的⼤⼩也是与均匀度有关的因素。
为保证样品的均匀,标准物质证书中通常要规定最⼩取样量。
因为当取样量减少到⼀定限度以下时,样品的不均匀度将急剧增加。
均匀性的检验可以分为分装前的检验和分装后的检验。
分装前的检验⼜包括混匀过程中的检查和混匀后的检查。
稳定性是标准物质的另⼀重要性质,是使标准物质具有时间⼀致性的前提。
与固体标准物质相⽐,液体和⽓体物质的均匀性容易实现,但保持稳定则困难得多。
标准物质的稳定性受温度、湿度、光照等环境条件的影响。
微⽣物的活动也会导致样品组成的改变,因此很多标准物质封装后都要采⽤辐射灭菌或⾼温灭菌措施。
选择适当的储存容器,加⼊适当的稳定剂,都可能⼤⼤改善标准物质的稳定性。
稳定性检验采⽤跟踪检验的办法。
制备后定期检查组分是否随时间的推移⽽改变,以及变化的程度能否满⾜标准物质不确定度允许限的要求。
均匀性和稳定性的检验通常采⽤⾼精密度的测定⽅法,以便发现标准物质在时间、空间分布中的微⼩差异。
⽬前,环境标准物质的定值多采⽤多种分析⽅法,由多个实验室的协作试验来完成。
制备环境标准物质是⼀项技术性很强,准确度要求很⾼,⼯作环境和⼈员操作技能都要有较⾼的⽔平,⼯作量⼤,制备成本很⾼的⼯作。
锰标准溶液 介质

锰标准溶液介质锰标准溶液是一种常用的化学试剂,用于分析和检测锰元素的含量。
在化学实验室和工业生产中,锰标准溶液被广泛应用于定量分析、质量控制和校准仪器等方面。
下面我将详细介绍锰标准溶液的相关内容。
一、锰标准溶液的制备锰标准溶液通常采用重量法或体积法制备。
在重量法中,首先需要称取一定量的锰盐(如硫酸锰)溶解于适量的溶剂中,再进行稀释,得到一系列不同浓度的锰标准溶液。
在体积法中,则是通过向一定体积的溶剂中加入适量的锰盐来制备。
二、锰标准溶液的浓度锰标准溶液的浓度一般以摩尔浓度(mol/L)或质量浓度(g/L)表示。
具体的浓度可以根据实验需求和分析要求来确定。
常见的锰标准溶液浓度有0.1mol/L、0.01mol/L等。
三、锰标准溶液的保存为了确保锰标准溶液的稳定性和准确性,需要注意以下几点:1.保存条件:锰标准溶液应存放在干燥、阴凉、避光的地方,远离火源和易燃物。
2.密封保存:使用后应及时封好瓶盖,避免空气中的水分和杂质对溶液产生影响。
3.防止污染:在取用锰标准溶液时,应使用洁净的容器和工具,并避免与其他化学试剂接触。
四、锰标准溶液的应用锰标准溶液在许多领域有着广泛的应用,包括但不限于以下几个方面:1.定量分析:锰标准溶液可作为定量分析的参比试剂,用于测定样品中锰元素的含量。
通过与待测溶液进行滴定反应,可以确定样品中锰的浓度。
2.质量控制:在工业生产中,锰标准溶液可用于质量控制,用来检验产品中锰元素的含量是否符合要求,以保证产品质量的稳定性和一致性。
3.仪器校准:锰标准溶液可以用于校准分析仪器,如原子吸收光谱仪、荧光光度计等。
通过与仪器测得的信号进行比对,可以检验和修正仪器的准确性和灵敏度。
五、注意事项在使用锰标准溶液时,需要注意以下几点:1.操作规范:严格按照实验操作规程进行操作,避免误差和污染。
2.溶解度:不同的锰盐具有不同的溶解度,因此在制备锰标准溶液时需选择适合的溶剂,并控制溶解温度和时间。
标准溶液配制标定操作规程

1范围本规程适用于标准溶液的配制与标定2规范性引用文件下列标准中的条款通过本标准的引用而成为本标准的条款。
GB/T603化学试剂试验方法中所用制剂及制品的制备GB/T6682分析实验室用水规格和试验方法GB/T9725化学试剂电位滴定法通则3一般规定3.1除另有规定外,本规程所用试剂的级别应在分析纯(含分析纯)以上,所用制剂及制品,应按GB/T603的规定制备,实验用水应符合GB/T6682中三级水的规格。
3.2本规程制备标准滴定溶液的浓度,除高氯酸标准滴定溶液、盐酸-乙醇标准滴定溶液、)=0.5mol/L]外,均指20℃时的浓度;在标准滴定溶液标亚硝酸钠标准滴定溶液[c(NaNO2定、直接制备和使用时若温度不为20℃时,应对标准滴定溶液体积进行补正。
规定“临用前标定”的标准滴定溶液,若标定和使用时的温度差异不大时,可以不进行补正。
标准滴定溶液标定、直接制备和使用时所用分析天平、滴定管、单标线容量瓶、单标线吸管等按相关检定规程定期进行检定或校准。
3.3在标定和使用标准滴定溶液时,滴定速度一般应保持在6-8mL/min。
3.4称量工作基准试剂的质量小于或等于0.5g时,按精确至0.01mg称量;大于0.5g时,按精确至0.1mg称量。
3.5制备标准滴定溶液的浓度应在规定浓度的±5%范围以内。
3.6除另有规定外,标定标准滴定溶液的浓度时,需两人进行实验,分别做四平行,每人四平行标定结果相对极差不得大于相对重复性临界极差[CR(4)r=0.15%],两人共八平行标0.95(8)r=0.18%]。
在运算过程中保留5位定结果相对极差不得大于相对重复性临界极差[CR0.95有效数字,取两人八平行标定结果的平均值为标定结果,报出结果取4位有效数字。
3.7本规程中标准滴定溶液浓度的相对扩展不确定度不大于0.2%(k=2)。
3.8本规程使用工作基准试剂标定标准滴定溶液的浓度;当对标准滴定溶液浓度的准确度有更高要求时,可使用标准物质(扩展不确定度应小于0.05%)代替工作基准试剂进行标定或直接制备,并在计算标准滴定溶液浓度时,将其质量分数代入计算式中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金属纯度定值中,国内对高纯金属中部分金属杂质 元素的含量研究较多,而氧、氮、氢等非金属元素的 含量则被忽略了,这样将使高纯金属实际的化学纯 度出现偏差,从而对化学成分测量结果产生严重影 响。因此从化学计量学的角度出发,对高纯金属纯 度的分析应尽可能多地得到其中杂质元素的信息, 以确保纯度量值的可靠性[7–10]。电感耦合等离子体 质谱(ICP–MS)仪可实现多元素同时快速分析,灵 敏度高、精密度好、抗基体干扰能力强、动态线性范 围宽,该仪器不仅可以进行准确的定量分析,还可以
可用于锰元素的分析检测、检测方法评价与仪器校准。
关键词 ICP–MS ;ICP–OES ;锰溶液标准物质
中图分类号:O656
Байду номын сангаас
文献标识码:A
文章编号:1008–6145(2019)05–0001–05
Certification of the purity of Mn and preparation of Mn solution reference material
(99.95±0.04)%(k=2)。采用重量 – 容量法制备了锰单元素溶液标准物质,以配制值作为锰单元素溶液标准物质的
标准值。对溶液标准物质的均匀性和稳定性进行了检验,其均匀性与稳定性良好。对标准物质的不确定度进行了评
定。锰单元素溶液标准物质的浓度值为 100 μg/mL,相对扩展不确定度为 0.8%(k=2)。该标准物质的量值准确,
第 28 卷,第 5 期 2019 年 9 月
化学分析计量
CHEMICAL ANALYSIS AND METERAGE
doi :10.3969/j.issn.1008–6145.2019.05.001
Vol. 28,No. 5
1
Sept. 2019
锰纯度定值及其单元素溶液标准物质的研制
孙倩芸 1,李锋丽 1,杨焕蝶 2,陈蕾蕾 2,高捷 1,郭波 1,张喆 1
Keywords ICP–MS; ICP–OES; Mn solution reference material
金属溶液标准物质是无机标准物质重要的组成 部分,其广泛应用于环境监察、食品药品安全检测、 化工合成、冶金工业和材料生产过程控制等行业和 领域[1–3]。金属单元素溶液标准物质一般以高纯金 属为原料,在对原料纯度进行测定的基础上,采用重 量 – 容量法进行制备[4–6]。因此高纯金属纯度分析 成为金属单元素溶液标准物质定值的关键点。对于 纯度达到 99.99% 以上的金属,很难进行直接的主 体含量测量,而通常采用杂质扣除的方法,即测量其 中的杂质含量经扣除计算得到纯度量值。在高纯
Abstract Mn solution reference materials was prepared by using high purity Mn as raw material. The impurity element in high purity Mn was determined by using inductively coupled plasma mass spectrometry,inductively coupled plasma emission spectrometry and elemental analyzer,the purity of Mn was (99.95±0.04)%(k=2) determined by the impurity deduction method. Mn solution reference material was prepared by weight –volume method with the formulating concentration as certified value. The uniformity and stability of standard solution were tested,which were considered to be good. The uncertainty of reference material was evaluated. The certified value of Mn single element solution reference material was 100 μg/mL with the relative extended uncertainty of 0.8%(k=2). The results revealed that the value of the reference material is accurate. The method can be used for analysis of manganese element, evaluation of detection method and instrument calibration.
(1. 山东省计量科学研究院,济南 250014 ; 2. 山东省农业科学院农产品研究所,济南 250100)
摘要 以高纯锰为原料研制锰单元素溶液标准物质。采用电感耦合等离子体质谱法、电感耦合等离子体发
射光谱法以及元素分析仪 3 种方法测定高纯锰中杂质元素的含量,并通过杂质扣除法确定了高纯锰的纯度为
SUN Qianyun1,LI Fengli1,YANG Huandie2,CHEN Leilei2,GAO Jie1,GUO Bo1,ZHANG Zhe1
(1. Shandong Institute of Metrology,Jinan 200014, china; 2. Institute of Agro-Food Sciences and Technology, Shandong Academy of Agricultural Sciences, Jinan 250100, china)
通讯作者 孙倩芸,高级工程师,硕士,主要从事标准物质的研制工作,E-mail: qianyun5751@ ;收稿日期 2019–06–12 引用格式 孙倩芸,李锋丽,杨焕蝶,等 . 锰纯度定值及其单元素溶液标准物质的研制[J]. 化学分析计量,2019,28(5): 1–5.
