高考总复习 化学 (鲁科版)--第2章 第3讲--(附解析及答案)
高三鲁科版化学一轮复习题库 3-2 氮的循环 含解析

第二讲氮的循环一、选择题1.中新网沈阳4月18日电,沈阳市公安局查获掺入非食品添加剂的毒豆芽二十余吨.经检测,毒豆芽中含有亚硝酸钠(NaNO2)等有害物质,过量或长期食用含亚硝酸钠的食品会致癌。
亚硝酸钠是一种防腐剂和增色剂,其在酸性条件下会产生NO和NO2。
下列有关说法错误的是()A.NaNO2既具有氧化性又具有还原性B.亚硝酸钠属于离子化合物C.NaNO2与胃酸作用的离子方程式为:2NO-2+2H+===NO↑+NO2↑+H2OD.1 mol NaNO2在酸性条件下完全反应生成NO和NO2,转移电子的物质的量为1 mol解析NaNO2中的氮元素的化合价为+3价,既能升高又能降低,A正确;NaNO2是离子化合物,B正确;胃酸属于强酸,NaNO2是易溶于水的强电解质,C正确;根据C中离子方程式分析可知:1 mol NaNO2在酸性条件下完全反应生成NO和NO2,转移电子的物质的量应为0。
5 mol,D不正确。
答案D2.将22.4 L某气态氮氧化合物与足量的的灼热铜粉完全反应后,气体体积变为11。
2 L(体积均在相同条件下测定),则该氮氧化合物的化学式为( )A.NO2B.N2O3C.N2O D.N2O4解析相同条件下,气体的体积比即为物质的量之比,由题知气态氮氧化合物和生成的N2物质的量之比为2∶1,可知1 mol该氮的氧化物中含有1 mol 氮原子,故设该氮氧化合物的化学式为NO x.NO x+x Cu错误!x CuO+错误!N2,可知x=1或2均可(根据原子守恒,观察可得出)。
答案A3.无色的混合气体甲,可能含有NO、CO2、NO2、NH3、N2中的几种,将100 mL甲气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )A.NH3、NO2、N2B.NH3、NO、CO2 C.NH3、NO2、CO2D.NO、CO2、N2解析由题意,无色混合气体中一定无NO2,100 mL气体通入浓H2SO4后,体积变为80 mL,一定有NH3,经Na2O2后变为红棕色,则含有CO2和NO,最后无气体剩余,则不含N2.答案B4.下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是()物a b c质选项A Al AlCl3Al (OH)3B HNO3NO NO2C Si SiO2H2SiO3D CH2===CH2CH3CH2OHCH3CHO解析A项,Al(OH)3变为Al不可能一步实现;B项正确;C 项,SiO2变为H2SiO3、H2SiO3变为Si都不可能一步实现;D项,CH3CHO不可能一步变为CH2===CH2。
2021新高考化学鲁科版一轮复习学案:第2章第3讲 氧化还原反应 Word版含解析

祝学长学业有成,取得好成绩Evaluation Only. Created with Aspose.Words. Copyright 2003-2016 Aspose Pty Ltd.第3讲氧化还原反应【2021·备考】最新考纲素养落地1。
通过实验事实了解氧化还原反应的本质是电子的转移。
2.了解常见的氧化剂、还原剂和生产生活中常见的氧化还原反应。
微观与宏观相结合,多视角、多层次地认识氧化还原反应的特征、实质及规律;运用分析、推理等方法构建氧化还原计算、配平的思维模型,通过实验探究验证并加深对物质氧化性、还原性的理解.错误!『知识梳理』一、氧化还原反应1.氧化还原反应本质和特征2。
基本概念及相互关系概括为“升失氧、降得还,剂性一致、其他相反”例如,反应Cu+2H2SO4(浓)错误!CuSO4+SO2↑+2H2O中,氧化剂是浓H2SO4,还原剂是Cu,氧化产物是CuSO4。
生成1 mol SO2时转移电子数目为2N A,被还原的H2SO4的物质的量是1__mol,浓硫酸表现的性质是酸性和强氧化性。
名师提示你(1)元素由化合态变为游离态,该元素不一定被还原。
(2)在氧化还原反应中,一种元素被氧化,不一定有另一种元素被还原,也可能是同一元素既被氧化又被还原。
3。
氧化还原反应电子转移的表示方法(1)双线桥法:①标变价,②画箭头,③算数目,④说变化。
实例:用双线桥法标出铜和浓硝酸反应电子转移的方向和数目.(2)单线桥法:箭头由失电子原子指向得电子原子,线桥上只标电子转移的数目,不标“得到"、“失去”字样。
实例:用单线桥法标出铜和稀硝酸反应电子转移的方向和数目。
4.氧化还原反应与四种基本反应类型的关系祝学长学业有成,取得好成绩二、常见的氧化剂和还原剂1.常见氧化剂常见氧化剂包括某些非金属单质、含有高价态元素的化合物、过氧化物等。
如:2。
常见还原剂常见还原剂包括活泼的金属单质、非金属离子及低价态化合物、低价金属阳离子、非金属单质及其氢化物等。
鲁科版高考化学一轮总复习课后习题 第二单元 化学物质及其变化 第3节 氧化还原反应

微点拨 氧化还原反应的相关概念可以通过“升失氧,降得还”记忆:反应物
所含元素化合价升高,失去电子,发生氧化反应,对应氧化产物;反应物所含
元素化合价降低,得到电子,发生还原反应,对应还原产物。
2.相关概念之间的关系
(1)氧化还原反应相关概念之间的关系。
微点拨 理解氧化还原反应相关概念的“三大误区”
(3)若产生标准状况下22.4 L Cl2,则转移电子的物质的量为
。
mol。
(4)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污
水中含CN-a mg·L-1,用ClO2将CN-氧化只生成两种气体,该反应的离子方程
式为
mol ClO2。
,处理100 m3这种污水,至少需要
(1)该反应的氧化剂为
还原产物为
,还原剂为
。
(2)用双线桥标出反应中转移电子的方向和数目:
答案 (1)O2F2
(2)
,氧化产物为
H2S
SF6
O2
。
关键能力 考向突破
考向1
氧化还原反应相关概念的辨析
【典例1】 (2021山东卷改编)实验室中利用固体KMnO4进行如图实验,下
列说法错误的是(
)
A.G与H均为氧化产物
性的强弱。
微点拨 (1)常见物质的氧化性、还原性强弱顺序。
氧化性:MnO-4 >Cl2>Br2>Fe3+>I2;
2+
还原性:S2->SO2(或
H
SO
)>I
>Fe
>Br
>Cl
。
2
3
3
新高考化学(鲁科版)一轮复习题库:第二章第三讲氧化还原反应(含答案解析)

第三讲氧化复原反响一、选择题1.以下各组离子因发生氧化复原反响而不可以大批共存的是() A. H+、Fe2+、 Cr 2O27-、 SO24-B. Ca ++、SO42--2、 H、HCO3C. Na +、 Ca2+、Cl -、 S2-D. Fe3+、 K +、 SCN -、 Cl -分析 A 项酸性条件下, Fe2+能被 Cr2O27-氧化为 Fe3+; B 项 H+和 HCO -3反响放出 CO2而不可以共存; C 项 Cu2+和 S2-生成 CuS 积淀而不可以共存; D 项 Fe3+与 SCN-发生络合反应而不可以共存。
答案A2.亚硝酸钠是一种防腐剂和添色剂,但在食品中过度时会对人体产生危害。
其在酸性条件下会产生NO 和 NO 2。
以下相关说法错误的选项是()A. NaNO 2既拥有氧化性又拥有复原性B.食用“醋溜豆芽”可能会减少亚硝酸钠对人体的危害C. NaNO 2和胃酸作用的离子方程式为:2NO2-+ 2H+===NO↑+ NO2↑+H 2OD .1 mol NaNO 2在酸性条件下完整反响生成NO 和 NO 2,转移电子的物质的量为 1 mol分析 NaNO 2中的氮元素的化合价为+ 3 价,既能高升又能降低, A 正确;食醋中含有乙酸,可与亚硝酸钠作用而使其消耗, B 正确;胃酸属于强酸, NaNO 2是易溶于水的强电解质, C 正确;依据 C 中离子方程式剖析可知: 1 mol NaNO 2在酸性条件下完整反响生成 NO 和 NO2,转移电子的物质的量应为 0.5 mol , D 不正确。
答案 D3.必定条件下硝酸铵分解的化学方程式为5NH 4NO 3===2HNO 3+ 4N 2↑+ 9H 2O,在反响中被氧化与被复原的氮原子的物质的量之比为()。
A. 5∶3B.5∶4C.1∶1D.3∶5分析反响中铵离子中的氮元素化合价由- 3 价到 0 价 (失掉电子被氧化),硝酸根离子中氮元素化合价由+ 5 价到 0 价 (获得电子被复原),依据氧化复原反响中得失电子守恒可知,被氧化与被复原的氮原子的物质的量之比为5∶ 3。
2018版高考化学(鲁科版)一轮总复习(课件):第2章 元素与物质世界 第3节 氧化剂和还原剂

。
②某些活泼的非金属单质:如H2,一般被氧化为 H2O 。 CO2 ③元素处于低价态的物质:如CO,一般被氧化为 。
上一页 返回首页 下一页
高三一轮总复习
[应用体验] 1.指出四种基本反应类型与氧化还原反应的关系。
[提示] 置换 复分解 分解
上一页 返回首页 下一页
高三一轮总复习
△ 2.对于反应:MnO2+4HCl(浓)=====MnCl2+Cl2↑+2H2O,请填空。 (1)氧化剂是________,发生________反应,还原产物是________。 (2)还原剂是________,发生________反应,氧化产物是________。 (3)生成1 mol Cl2,被氧化的HCl为________mol,转移电子数为________。 (4)在此反应中,表现氧化性的物质是________。
上一页
返回首页
下一页
高三一轮总复习
3.(2017· 湛江模拟)实验室利用以下反应制取少量氮气,NaNO2+ NH4Cl===NaCl+N2↑+2H2O,下列关于该反应的说法正确的是( )
【导学号:99682063】 A.NaNO2发生氧化反应 B.NH4Cl中的氮元素被还原 C.N2既是氧化产物,又是还原产物 D.每生成1 mol N2转移电子的物质的量为6 mol
上一页
返回首页
下一页
高三一轮总复习
上一页
返回首页
下一页
高三一轮总复习
(1)熟记常见元素的化合价:一价氢、钾、钠、氟、氯、溴、碘、银;二价 氧、钙、钡、镁、锌;三铝、四硅、五价磷;说变价也不难,二三铁、二四碳、 二四六硫都齐全;铜汞二价最常见。 (2)明确一些特殊物质中元素的化合价: CuFeS2:Cu、Fe、 S ;K2FeO4:Fe;Li2NH、LiNH2、AlN: N ;Na2S2O3:
鲁科版化学高考试题与参考答案(2024年)

2024年鲁科版化学高考复习试题(答案在后面)一、单项选择题(本大题有16小题,每小题3分,共48分)1、下列物质中,不属于同分异构体的是:A、C2H4O 和 C2H2O2B、C4H10 和 C5H12C、C6H6 和 C6H5OHD、C2H5OH 和 CH3OCH32、下列关于化学反应速率的描述正确的是:A、反应速率越大,反应时间就越短B、所有反应的速率都与反应物浓度成正比C、温度越高,反应速率越快D、反应速率与催化剂的种类无关3、下列物质中,不属于电解质的是()A. 氯化钠(NaCl)B. 硫酸(H2SO4)C. 氢氧化钠(NaOH)D. 氢气(H2)4、下列关于物质的叙述,正确的是:A、所有金属单质在常温下都呈现银白色固体状态。
B、氢气燃烧生成的产物是水,因此氢气是清洁能源。
C、二氧化碳在常温下是液体,能溶解于水形成碳酸。
D、氯化钠在水中溶解时,溶解过程中放出热量。
5、下列关于化学反应速率的叙述正确的是()A、反应速率越大,反应时间越短B、反应速率越大,反应物浓度越大C、温度越高,反应速率越快D、压强越高,反应速率越快6、下列物质中,不属于有机高分子化合物的是()A. 聚乙烯B. 聚氯乙烯C. 聚苯乙烯D. 水玻璃7、下列关于化学反应速率的说法正确的是()A. 化学反应速率越大,反应所需时间越短B. 反应物的浓度越高,化学反应速率越快C. 反应物的状态对化学反应速率有影响,气态反应物的速率通常比固态反应物的速率快D. 温度越高,化学反应速率越快,但温度过高会导致反应失控8、下列关于物质的描述正确的是:A. 氯化钠溶液在加热时,水的电离程度增大。
B. 铁与稀硫酸反应,生成硫酸亚铁和氢气。
C. 氯化铝溶液中,铝离子和氢氧根离子反应生成氢氧化铝沉淀。
D. 铁与铜在空气中加热,形成氧化铁和氧化铜。
9、下列物质中,属于有机高分子化合物的是()A. 乙醇(C2H5OH)B. 氯化钠(NaCl)C. 聚乙烯(PE)D. 碳酸钙(CaCO3)10、下列关于化学反应速率的说法中,正确的是()A. 反应速率与反应物的浓度成正比,与温度无关。
高中化学鲁科版必修2习题:第2章第3节第2课时化学反应为人类提供能量习题2含解析

1.下边是四个化学反响,你以为理论上不行用于设计原电池的是()A . 2Al + 2NaOH +6H O===2Na[Al(OH)4]+3H ↑22点燃222B .2H + O =====2H OC .Mg 3N 2+ 6H 2O===3Mg(OH) 2+ 2NH 3↑点燃D . CH 4+ 2O 2 =====CO 2+ 2H 2O分析: 选 C 。
理论上只有开释能量的自觉的氧化复原反响才可用于设计原电池。
2. 以下说法中正确的选项是()A .原电池是把电能转变为化学能的装置B .原电池中电子流出的一极是正极,发生氧化反响C .原电池两极均发生氧化反响和复原反响D .原电池内部的阳离子向正极挪动分析:选 D 。
原电池是把化学能转变为电能的装置,A 项错误; 电子流出的一极是负极 ,B 项错误;负极发生氧化反响,正极发生复原反响 , C 项错误。
3.某原电池的电池反响为Fe + 2Fe 3+===3Fe 2 +,与此电池反响不切合的原电池是()A .铜片、铁片、 FeCl 3 溶液构成的原电池B .石墨、铁片、 Fe(NO 3)3 溶液构成的原电池C .铁片、铅片、 Fe (SO ) 溶液构成的原电池24 3D .银片、铁片、 Fe(NO 3)2 溶液构成的原电池分析: 选 D 。
依据原电池的电池反响为Fe + 2Fe3+===3Fe2+可知 , Fe 为负极 ,比 Fe 不开朗的金属或非金属导体作正极,含 Fe3+的溶液为电解质溶液。
4.①②③④四种金属片两两相连浸入稀硫酸中都可构成原电池。
①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③ 的质量减少。
据此判断这四种金属活动性由大到小的次序是()A .①③②④B .①③④②C .③④②①D .③①②④分析: 选 B 。
此题重点点在于理清原电池的正、负极资料与金属性强弱的关系,第一要能正确判断电极 ,金属性:负极>正极。
高中化学鲁科版必修2习题:第2章第3节第2课时化学反应为人类提供能量习题含解析

[ 基础达标 ]1.以下图的装置中, a 的金属性比氢强, b 为碳棒,对于此装置的各样表达不正确的是()+A .碳棒上有气体放出,溶液中c(H )变小B.a 是正极, b 为负极C.导线中有电子流动,电子从 a 极到 b 极D. a 极上发生氧化反响分析:选 B。
因为 a 的金属性比氢强,b为碳棒,故原电池中,a金属做负极,失掉电子发生氧化反响,b碳棒做正极,正极上H+得电子发生复原反响。
所以,原电池中电子流向是负极 (a 金属 )→外电路 (导线 )→正极 (b 碳棒 ),溶液中 c(H +)变小。
故 B 项错误。
2.如图属于原电池装置的是()分析:选 D 。
由原电池的构成条件知,A中未形成闭合回路; B 中酒精为非电解质;C 中两电极开朗性同样; D 中切合原电池的构成条件。
3.如图是Zn 和 Cu 形成的原电池,某实验兴趣小组做完实验后,记录以下:① Zn 为正极, Cu 为负极2+③电子从 Zn 经外电路流向 Cu ④Cu ② Cu 向负极挪动极上有 Cu 产生⑤如有 1 mol 电子流过导线,则产生Cu 为 0.5 mol ⑥正极的电极反响式为 Zn- 2e- ===Zn2+描绘合理的是 ()A .①②③B .③④⑤C.④⑤⑥ D .②③④分析:选 B。
在该原电池中,Zn 比 Cu 开朗,故 Zn 做负极, Cu 做正极,电子由 Zn 流出经导线流向 Cu,负极反响为Zn- 2e-===Zn2+,正极反响为 Cu 2++ 2e- ===Cu,故每转移11 mol 电子时,产生 Cu 0.5 mol ,在溶液中Cu 2+向正极挪动,SO24-向负极挪动,故①②⑥错误,③④⑤ 正确。
4.以下对于能量转变的认识不正确的选项是()A.绿色植物的光合作用是将光能转变为化学能B.煤焚烧时化学能转变为热能和光能C.原电池工作时,化学能转变为电能D.白炽灯工作时,电能所有转变为光能分析:选 D 。
白炽灯工作时,还有热能放出。
高三化学复习《化学必修2》 第2章 第3节鲁教版知识精讲

高三化学复习《化学必修2》 第2章 第3节鲁教版【本讲教育信息】 一. 教学内容:高考第一轮复习:《化学必修2》 第2章 化学键 化学反应与能量 第3节 化学反应的利用 1. 利用化学反应制备新物质 2. 氯气的制法3. 化学反应为人类提供能源4. 原电池原理 二. 教学目的1. 认识利用化学反应造福人类2. 掌握氯气的制备方法和原理3. 了解化学反应提供能源有哪些应用4. 了解原电池的工作原理5. 预计考查新分子的合成 三. 教学重点、难点1. 如何利用化学反应新物质,氯气的实验室制法。
2. 怎样将化学能转化为电能,原电池的工作原理。
四. 考点分析本节内容在高考中主要考查点是:1. 实验室制备氯气的反应原理和尾气处理方法,制备装置及收集方法。
2. 原电池工作原理,原电池中的电极反应,电极的判断和原电池的应用。
五. 知识要点人类利用化学反应,不但要利用化学反应产生的新物质,还要充分利用化学反应过程中产生的能量。
在化学反应中,能量以不同的形式表现出来,通常有热能、电能等。
(一)氯气的制法1. 氯气的实验室制法(1)反应原理:()O H 2Cl MnCl HCl 4MnO 2222+↑+∆+浓 (2)实验装置如图装置中所盛试剂及其作用:C 饱和食盐水,除去氯气中的氯化氢气体;D 浓硫酸,除去氯气中的水蒸气(或干燥氯气);F 氢氧化钠溶液,吸收尾气中的氯气。
(3)验满方法如果采用排空气法收集氯气,可在瓶口用湿润的淀粉碘化钾试纸(变蓝)来检验,也可以用湿润的有色布条(褪色)来检验。
(4)实验步骤①组装仪器使之构成成套装置:I. 组装仪器的顺序是:“先左后右、先下后上”;II. 气体在洗气瓶中的走向是长管进气,短管出气。
②检验装置的气密性:检验装置的气密性一定要在装入药品之前进行。
应把制备装置、净化装置、收集装置作为一个整体来检验气密性。
检验方法是:关闭分液漏斗的活塞,将最末端的导气管插入盛水的烧杯中,用手捂热圆底烧瓶(或点燃酒精灯,对圆底烧瓶微微加热),若导气管的末端有气泡冒出,且松手后(或拿开酒精灯后)导气管内有一段水柱,则装置的气密性良好。
高中化学鲁科版必修2练习:第2章系统总结Word版含解析
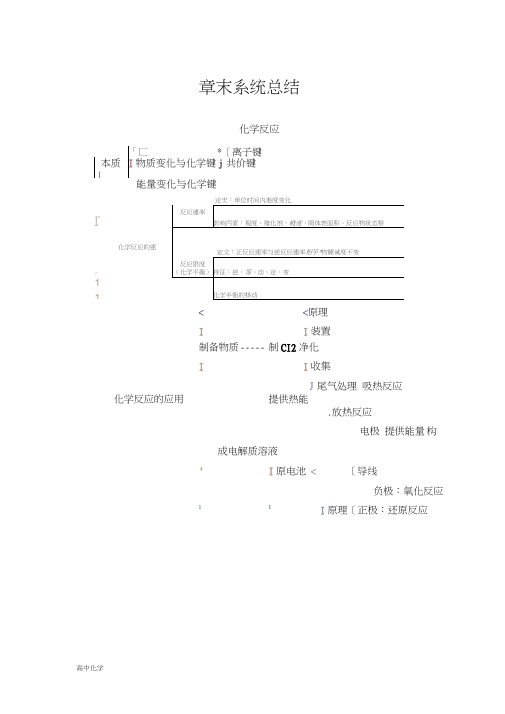
化学反应
「匚*〔离子键
本质丿
I物质变化与化学键j共价键
能量变化与化学键
定史:单位时间内淞度变化r化学反ຫໍສະໝຸດ 的速举和限1童反应連率
影响丙索:观度、雉化剂,戦度、間体表面积、反应物状态帑
定文:正反应速率与逆反应連率相竽*物睡诫度不变
T"
反应限度
(化学平衞)
持征:逆、等、动、定、变
1
1
化学半衙的移动
<<原理
II装置
制备物质制CI2净化
II收集
J尾气处理 吸热反应
化学反应的应用提供热能
.放热反应
电极 提供能量构成电解质溶液
'I原电池<〔导线
负极:氧化反应
11I原理〔正极:还原反应
2014高考化学一轮复习(鲁科版)专项训练 第2章第3节(含解析).pdf

一、选择题 1.下列反应中,不属于氧化还原反应的是( ) ①3Cl2+6KOH===5KCl+KClO3+3H2O ②2NO2+2NaOH===NaNO3+NaNO2+H2O ③SnCl4+2H2O===SnO2+4HCl ④3CCl4+K2Cr2O7===2CrO2Cl2+3COCl2+2KCl A.①② B.①③ C.③④ D.②④ 解析:选C。
①中Cl元素由0价变为-1、+5价;②中N元素由+4价变为+3、+5价;③④元素化合价无变化。
故选C。
2.化合反应、分解反应、置换反应和复分解反应是四种基本化学反应类型。
下列变化属于氧化还原反应,但是不属于四种基本反应类型的是( ) A.CO+CuOCu+CO2 B.2Al+Fe2O3Al2O3+2Fe C.2O33O2 D.Cl2+2FeCl2===2FeCl3 解析:选A。
B属于置换反应,C属于非氧化还原反应,D属于化合反应。
3.下列各组离子中,因发生氧化还原反应而不能大量共存的是( ) A.Fe3+、H+、SO、ClO- B.Fe3+、Fe2+、SO、NO C.Al3+、Na+、SO、CO D.K+、H+、Br-、MnO 解析:选D。
A项H+与ClO-能结合成HClO,是复分解反应;B项可以大量共存;C项Al3+和CO可以发生双水解反应而不能大量共存,并无化合价的变化,不属于氧化还原反应;D项因酸性KMnO4的氧化性很强,会把Br-氧化为Br2,故选D项。
4.将氯水分别滴入下列溶液中,由实验现象得出的结论正确的是( ) 选项氯水滴入下列溶液中实验现象结论A滴有KSCN的FeCl2溶液变红Cl2具有还原性B滴有酚酞的NaOH溶液退色 氯水具有酸性C紫色石蕊溶液先变红后退色Cl2具有漂白性D淀粉-KI溶液变蓝色Cl2具有氧化性解析:选D。
A项,Cl2将Fe2+氧化成Fe3+,Fe3+与SCN-发生反应生成红色物质,表现Cl2的氧化性,A项不正确;B项也可能表现HClO的漂白性;C项表现盐酸的酸性和HClO的漂白性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第3讲氧化还原反应基础
【2020·备考】
最新考纲:1.了解氧化还原反应的本质是电子的转移。
2.了解常见的氧化还原反应。
核心素养:1.证据推理与模型认知:建立氧化还原的观点,通过分析、推理等方法认识氧化还原反应的特征和实质,建立氧化还原反应计算、配平的思维模型。
2.科学探究与创新意识:认识科学探究是进行科学解释和发现、创造和应用的科学实践活动;能从氧化还原反应的角度,设计探究方案,进行实验探究,加深对物质氧化性、还原性的理解。
考点一氧化还原反应的相关概念及表示方法
(频数:★☆☆难度:★☆☆)
名师课堂导语氧化还原反应的有关概念属于基础理论知识,双线桥法是串联各概念的有效途径,是后面方程式配平和计算的基础。
1.氧化还原反应本质和特征
有化合价变化的反应一定是氧化还原反应,但有单质参与的反应不一定属于氧化还原反应,如O 2和O 3的转化。
2.相关概念及其关系
示例:在Fe 2O 3+3CO=====高温2Fe +3CO 2的反应中Fe 2O 3
是氧化剂,CO 是还原剂;C 元素被氧化,Fe 元素被还原;Fe 2O 3具有氧化性,CO 具有还原性;CO 2是氧化产物,Fe 是还原产物。
氧化还原反应概念的“三大误区”(学生举出反例)
误区1.某元素由化合态变为游离态时,该元素一定被还原。
误区2.在氧化还原反应中,非金属单质一定只作氧化剂。
误区3.在氧化还原反应中,若有一种元素被氧化,则一定有另一种元素被还原。
3.氧化还原反应电子转移的表示方法
(1)双线桥法:①标变价,②画箭头,③算数目,④说变化。
实例:用双线桥法标出铜和浓硝酸反应电子转移的方向和数目。
(2)单线桥法:箭头由失电子原子指向得电子原子,线桥上只标电子转移的数目,不标“得到”、“失去”字样。
实例:用单线桥法标出铜和稀硝酸反应电子转移的方向和数目。
4.氧化还原反应与四种基本反应类型间的关系图示
总结:①一定属于氧化还原反应的基本反应类型是置换反应。
②一定不属于氧化还原反应的基本反应类型是复分解反应。
