四川大学有机化学学习指导4
四川大学有机化学习题库

四川⼤学有机化学习题库四川⼤学有机化学试卷班级姓名分数⼀、选择题( 共32题64分)1. 2 分(0037)0037CH3CH2CH2CH2+(I),CH3CH+CH2CH3(II),(CH3)3C+(Ⅲ)三种碳正离⼦稳定性顺序如何?(A) I>II>III (B) III>II>I (C) II>I>III (D) II>III>I2. 2 分(0038)0038HBr与3,3-⼆甲基-1-丁烯加成⽣成2,3-⼆甲基-2-溴丁烷的反应机理是什么? (A)碳正离⼦重排(B) ⾃由基反应(C) 碳负离⼦重排(D) 1,3-迁移3. 2 分(0039)0039环⼰烯加氢变为环⼰烷的热效应如何?(A) 吸热反应(B) 放热反应(C) 热效应很⼩(D) 不可能发⽣4. 2 分(0040)0040下列化合物中哪些可能有E,Z异构体?(A)2-甲基-2-丁烯(B) 2,3-⼆甲基-2-丁烯(C) 2-甲基-1-丁烯(D) 2-戊烯5. 2 分(0041)0041下列化合物中哪些可能有顺反异构体?(A) CHCl=CHCl (B) CH2=CCl2(C) 1-戊烯(D) 2-甲基-2-丁烯6. 2 分(0042)0042烯烃加I2的反应不能进⾏,原因是:(A) I─I太牢固不易断裂(B) C─I不易⽣成(C) I+不易⽣成(D) 加成过程中C─C键易断裂7. 2 分(0043)(A)亲电加成反应(B) ⾃由基加成(C) 协同反应(D) 亲电取代反应8. 2 分(0044)0044测定油脂的不饱和度常⽤碘值来表⽰,测定时所⽤试剂为:(A) I2(B) I2 + Cl2(C) ICl (D) KI9. 2 分(0045)0045烯烃与卤素在⾼温或光照下进⾏反应,卤素进攻的主要位置是:(A)双键C原⼦(B) 双键的α-C原⼦(C) 双键的β-C原⼦(D) 叔C原⼦*. 2 分(0046)0046实验室制备丙烯最好的⽅法是:(A)⽯油⽓裂解(B) 丙醇脱⽔(C) 氯丙烷脱卤化氢(D) Wittig反应11. 2 分(0049)0049CH3CH=CH2 + Cl2 + H2O 主要产物为:(A) CH3CHClCH2Cl + CH3CHClCH2OH (B) CH3CHOHCH2Cl + CH3CHClCH2Cl (C) CH3CHClCH3 + CH3CHClCH2OH(D) CH3CHClCH2Cl12. 2 分(0052)0052某烯烃经臭氧化和还原⽔解后只得CH3COCH3,该烯烃为:(A) (CH3)2C=CHCH3(B) CH3CH=CH2(C) (CH3)2C=C(CH3)2(D) (CH3)2C=CH213. 2 分(0053)0053CH3CH=CHCH2CH=CHCF3 + Br2 (1 mol) 主要产物为:(A) CH3CHBrCHBrCH2CH=CHCF3(B) CH3CH=CHCH2CHBrCHBrCF3 (C) CH3CHBrCH=CHCH2CHBrCF3(D)CH3CHBrCH=CHCHBrCH2CF314. 2 分(0054)0054CH2=CHCOOCH=CH2 + Br2 (1 mol) 主要产物为:ROCH=CH2 + HI 主要产物为:(A) ROCH2CH2I (B) ROCHICH3(C) ROH + CH2=CH2(D) RCH=CH2 +HOI16. 2 分(0056)0056CF3CH=CHCl + HI 主要产物为:(A) CF3CH2CHClI (B) CF3CHICH2Cl(C) CF3I + CH2=CHCl (D) CF3Cl + CH2=CHI17. 2 分(0057)0057(CH3)2C=CCl2 +HI 主要产物为:(A) (CH3)2CH―CCl2I (B) (CH3)2CI―CHCl2(C) CH3CH=CCl2 + CH3I (D) (CH3)2C=CClI + HCl18. 2 分(0061)0061分⼦式为C7H14的化合物G与⾼锰酸钾溶液反应⽣成4-甲基戊酸,并有⼀种⽓体逸出, G 的结构式是: (A) (CH3)2CHCH2CH2CH=CH2(B) (CH3)3CCH=CHCH3(C) (CH3)2CHCH=C(CH3)2(D) CH3CH2CH=CHCH(CH3)219. 2 分(0066)00661-甲基环⼰烯+ HBr 反应的主要产物是:(A) 1-甲基-1-溴代环⼰烷(B) 顺-2-甲基溴代环⼰烷(C) 反-2-甲基溴代环⼰烷(D) 1-甲基-3-溴环⼰烷20. 2 分(0068)0068由CH3CH2CH2Br CH3CHBrCH3,应采取的⽅法是:(A) ①KOH,醇;②HBr,过氧化物(B) ①HOH,H+;②HBr(C) ①HOH,H+;②HBr,过氧化物(D) ①KOH,醇;②HBr21. 2 分(0071)00713-甲基-1-丁烯与HBr反应的主要产物是什么?(A) 2-甲基-3-溴丁烷与2-甲基-2-溴丁烷(B) 3-甲基-2-溴丁烷与3-甲基-1-溴丁烷烃C6H12能使溴溶液褪⾊,能溶于浓硫酸,催化氢化得正⼰烷,⽤酸性KMnO4氧化得⼆种羧酸,则该烃是: (A) CH3CH2CH=CHCH2CH3(B) (CH3)2CHCH=CHCH3(C) CH3CH2CH2CH=CHCH3(D) CH3CH2CH2CH2CH=CH223. 2 分(0077)0077在碳烯(carbene)与烯烃的加成反应中,三线态⽐单线态的⽴体定向性差的原因是什么?(A) 三线态能量⾼,易发⽣副反应(B) 三线态能量低,不易起反应(C) 三线态易转化为单线态(D) 三线态的双价⾃由基分步进⾏加成24. 2 分(0078)0078下列哪种化合物进⾏催化氢化后不能得到丁烷?(A) 1-丁烯(B) (Z)-2-丁烯(C) (E)-2-丁烯(D) 2-甲基-2-丁烯25. 2 分(0079)0079卤化氢HCl(I),HBr(II),HI(III)与烯烃加成时,其活性顺序为:(A)I>II>III (B) III>II>I(C) II>I>III (D) II>III>I26. 2 分(0080)00802-甲基-2-丁烯与HI加成的主要产物是:(A) (CH3)2CICH2CH3(B) (CH3)2CHCHICH3(C) (CH3)2CHCH2CH2I (D) (CH3)2CHCH=CH227. 2 分(0081)00811-戊烯与HBr加成的主要产物是:(A) CH3CH2CH2CH2CH2Br (B) CH3CH2CH=CHCH3(C) CH3CH2CH2CHBrCH3(D) CH3CH2CHBrCH2CH328. 2 分(0082)0082丙烯与HBr加成,有过氧化物存在时,其主要产物是:(A)CH3CH2CH2Br (B) CH3CH2BrCH3⽤下列哪种⽅法可由1-烯烃制得伯醇?(A)H2O (B) 浓H2SO4,⽔解(C) ①B2H6;②H2O2,OH-(D) 冷、稀KMnO430. 2 分(0085)0085某烯烃经酸性KMnO4氧化,得到CH3COCH3和(CH3)2CHCOOH,则该烯烃结构是: (A) (CH3)2C=C(CH3)2(B) (CH3)2C=CHCH(CH3)2(C) (CH3)2CHCH=CH2(D) (CH3)2CHCH=CHCH(CH3)231. 2 分(0086)0086某烯烃经臭氧化和⽔解后⽣成等物质的量的丙酮和⼄醛,则该化合物是: (A) (CH3)2C=C(CH3)2(B) CH3CH=CHCH3(C) (CH3)2C=CHCH3(D) (CH3)2C=C=CH232. 2 分 (0177) 0177CH 3CH =CHCH 3与CH 3CH 2CH =CH 2是什么异构体? (A) 碳架异构 (B) 位置异构(C) 官能团异构 (D) 互变异构⼆、填空题 ( 共18题 36分 ) 33. 2 分 (1413) 1413化合物(E )-3,4-⼆甲基-2-戊烯的结构式是:34. 2 分 (1414) 1414化合物(E)-4,4-⼆甲基-2-戊烯的结构式是:35. 2 分 (1415) 1415化合物(Z )-3-甲基-4-异丙基-3-庚烯的结构式是:36. 2 分 (1342) 1342写出下列反应的主要有机产物或所需之原料和试剂(如有⽴体化学问题请注明)。
四川大学生物化学课件 第4章糖代谢

Part II. Metabolism
物质代谢(metabolism of substrates)
biosynthesis & degradation of macromolecules: carbohydrates、lipids、proteins(amino acids)、 nucleic acids(nucleotides) 能量代谢(energy metabolism) generation & storage of metabolic energy (bioenergetics): citric acid cycle、oxidative phosphorylation
CH2OPO3 2―
O
C-O PO3 2―
CHOH CH2OPO3 2―
+ ADP
phosphoglycerate kinase
C-O ―
CHOH CH2OPO3 2― + ATP
3-磷酸甘油醛(3-PG)的氧化及磷酸化均由3-磷酸甘油醛脱氢 酶(glyceraldehyde 3-phosphate dehydrogenase)催化 第一个底物水平磷酸化(substrate phosphorylation)
Reaction Glucose glucose 6-phosphate fructose 1,6-diphosphate 2 3-phosphoglycerate 2 pyruvate 2 H2O + 2 NAD+ ATP change per glucose -1 -1 +2 +2 +5 or +3 +5
1. 葡萄糖 丙酮酸:见前糖酵解途径 2. 丙酮酸乙酰CoA 乙酰CoA(acetyl coenzyme A, acetyl CoA) 是物质代谢中最重要的中间产物
四川大学有机化学ppt

重点与难点: 重点与难点: 重点:烯烃的结构, 键的特征,烯烃的化学性质及应用, 重点:烯烃的结构,π键的特征,烯烃的化学性质及应用, 亲电加成反应的历程,马氏规则的应用。 亲电加成反应的历程,马氏规则的应用。 难点是:烯烃的结构, 键的特征, 难点是:烯烃的结构,π键的特征,亲电加成反应的历 烯烃的结构对亲电加成反应速率和取向的影响。 程,烯烃的结构对亲电加成反应速率和取向的影响。
126.6 kJ.mol-1 E
119.5 kJ.mol-1
115.3 kJ.mol-1
126.6 kJ.mol-1 E
119.1 kJ.mol-1
112.4 kJ.mol-1
(1) 烯烃顺反异构体的稳定性是:反式 > 顺式(二者 烯烃顺反异构体的稳定性是: 顺式( 能差为 4.2kJ.mol-1)。 V 子序数 最大
(3)取代基为不饱和基团, (3)取代基为不饱和基团,可分解为连有两个或三个相同 取代基为不饱和基团 的原子。 的原子。
2
CH =CH2
1
2
相当于
CH2 CH C
1
C C1( C , C , H ) ; C2( C , H , H )
C =CH
1
2
相当于
C C 2 C CH C C
CH3 C H CH2 CH3 C H CH3CH2
C H3
C
H C CH2CH3
顺 -2- 戊烯
-3反 -3- 甲基 己烯
顺反命名法有局限性,即在两个双键碳上所连接的两个基团彼 顺反命名法有局限性, 局限性 应有一个是相同的 彼此无相同基团时,则无法命名其顺反。 此应有一个是相同的,彼此无相同基团时,则无法命名其顺反。
CH3 CH3 CH3 CH3
四川大学有机化学

•The region of space
defined by this
combination of orbitals is
LIYING
2021/4/3
the molecular orbital.
LIYING
2021/4/3
–The method of overlapping orbitals is known as the Linear Combination of Atomic Orbitals (LCAO) method.
There are three important types of molecular orbitals
– sigma (s) symmetry: 键轴 – pi (p) symmetry: 节面、节点 –n
Each of these types of orbitals will be discussed as follows
LIYING
2021/4/3
20世纪-- 以量子力学为基础的现代结 构理论的建立、现代物理测试方法、复 杂天然物的合成,有机合成工业。 结构理论:共价键理论、分子轨道 理论对称守恒原理 不对称合成、复杂天然物的合成、 生物系统的模拟如叶绿素、血红素、胆 固醇、VB12、牛胰岛素的全合成(中国、 1965年)
LIYING
2021/4/3
p*-Antibonding Orbital
LIYING
2021/4/3
LIYING
2021/4/3
LIYING
2021/4/3
3. 杂化轨道理论
LIYING
2021/4/3
LIYING
2021/4/3
LIYING
2021/4/3
四川大学有机化学ppt

3ROH + PX3(P + X2)
3R-X + P(OH)3 X = Br 、 ( 制备溴代或碘代烃) I
ROH + PCl5 ROH + SOCl2
R-Cl + POCl3 + HCl R-Cl + SO2 + HCl
制氯代烃
产物不重排 醇与PX 作用生成卤代烃的反应,通常是按S 历程进行的。 醇与PX3作用生成卤代烃的反应,通常是按SN2历程进行的。 反应的立体化学特征:构型反转。 反应的立体化学特征:构型反转。
3°
液态醇的酸性强弱顺序: 1o醇 > 2o醇 > 3o醇 液态醇的酸性强弱顺序: [解释 烷氧负离子的稳定性 解释] 解释 Na与醇的反应比与水的反应缓慢的多, Na与醇的反应比与水的反应缓慢的多,反应所生成的 与醇的反应比与水的反应缓慢的多 热量不足以使氢气自燃,故常利用醇与Na的反应销毁 利用醇与Na 热量不足以使氢气自燃,故常利用醇与Na的反应销毁 残余的金属钠,而不发生燃烧和爆炸。 残余的金属钠,而不发生燃烧和爆炸。 CH3CH2O- 的碱性比-OH强,所以醇钠极易水解。 OH强 所以醇钠极易水解。
3.醇的命名 1)俗名 如乙醇俗称酒精,丙三醇称为甘油等。 如乙醇俗称酒精,丙三醇称为甘油等。
2)简单的一元醇用普通命名法命名。 简单的一元醇用普通命名法命名。
CH3 CH CH2OH 异丁醇 CH3 CH3 C OH CH3 叔丁醇 环己醇
CH3
OH 苄醇
CH2OH
3)系统命名法 结构比较复杂的醇,采用系统命名法。选择含有羟基碳的 结构比较复杂的醇,采用系统命名法。 最长碳链为主链,以羟基的位置最小编号, 称为某醇。 最长碳链为主链,以羟基的位置最小编号,……称为某醇。 称为某醇
四川大学 考研 890有机化学 内部课堂习题 第四章 习 题 有答案

第四章 习 题4-1 指出下列名称就是否有错,错在哪里?写出每个化合物的结构式。
a 、 3,4-二甲基-顺-2-戊烯 e 、 反-1-丁烯b 、 (E )-3-乙基-3-戊烯 f 、 (Z )-2溴-2-戊烯c 、 2-甲基环戊烯 g 、 2,3-二甲基环戊烷d 、(E )-3-甲基-2-己烯4-2 已烯有13种异构体(不包括立体异构),其中有3种在臭氧分解时只产生含C 3(三个碳)的产物(即不产生含C 1、C 2、C 4、C 5的产物),写出这三种异构体及其反应方程式。
4-3 计算丙烯与硫酸加成反应前后每个碳原子的氧化数,并计算反应前后氧化数的总变化。
4-4 排列下面烯烃与氢卤酸反应的速度次序。
(1) a 、 R 2C =CH 2 b 、 RCH =CH 2 c 、 CH 2=CH 2,(2) a 、 HF b 、 HCl c 、 HBr d 、 HI 4-5 如何实现由2-甲基-1-丁烯转变为下列产物?写出反应方程式。
a 、 (CH 3)2C(OH)CH 2CH 3; b 、 CH 3CH 2CH(CH 3)CH 2OH 4-6 写出下列反应机理:a 、b 、4-7 从能量上说明,氯化氢与碘化氢一般不与烯烃发生游离基型反应。
(注:有关键的键能(kJ/mol ) π键=260、4,C -Cl =338、6,C -I =213、2,C -H =412、6,H -Cl =431、4, H -I =298、5)4-8 三种C 5H 10的异构体A 、B 、C 。
A 与B 能使溴的四氯化碳溶液褪色,C 不能;A 与C 与臭氧与与稀高锰酸钾溶液均难反应;B 则能迅速与臭氧在二氯甲烷溶液中反应,生成的臭氧化物在碱性过氧化氢作用下分解得到丙酮与一个水溶性的羧酸。
推则A 、B 、C 的结构,写出各步反应。
4-9 用简单化学方法区分下列各对化合物:a 、 戊烷与1-戊烯;b 、 2-戊烯与乙基环丙烷;c 、 乙基环丙烷与戊烷 4-10 写出下列反应产物及必要构型。
2019年四川大学化学学院拟录取名单公示
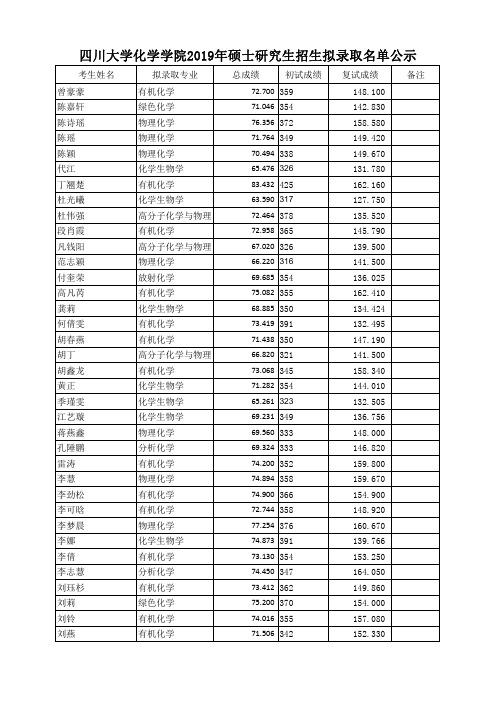
四川大学化学学院2019年硕士研究生招生拟录取名单公示考生姓名拟录取专业总成绩初试成绩复试成绩备注曾豪豪有机化学72.700359148.100陈嘉轩绿色化学71.046354142.830陈诗瑶物理化学76.356372158.580陈瑶物理化学71.764349149.420陈颖物理化学70.494338149.670代江化学生物学65.476326131.780丁翘楚有机化学83.432425162.160杜光曦化学生物学63.590317127.750杜伟强高分子化学与物理72.464378135.520段肖霞有机化学72.958365145.790凡钱阳高分子化学与物理67.020326139.500范志颖物理化学66.220316141.500付奎荣放射化学69.685354136.025高凡芮有机化学75.082355162.410龚莉化学生物学68.885350134.424何倩雯有机化学73.419391132.495胡春燕有机化学71.438350147.190胡丁高分子化学与物理66.820321141.500胡鑫龙有机化学73.068345158.340黄正化学生物学71.282354144.010季瑾雯化学生物学65.261323132.505江艺璇化学生物学69.231349136.756蒋燕鑫物理化学69.560333148.000孔陲鹏分析化学69.324333146.820雷涛有机化学74.200352159.800李慧物理化学74.894358159.670李劲松有机化学74.900366154.900李可晗有机化学72.744358148.920李梦晨物理化学77.254376160.670李娜化学生物学74.873391139.766李倩有机化学73.130354153.250李志慧分析化学74.450347164.050刘珏杉有机化学73.412362149.860刘莉绿色化学75.200370154.000刘铃有机化学74.016355157.080刘燕有机化学71.506342152.330龙洪汉放射化学65.369318136.046鲁锴化学生物学67.749327142.543陆玮璠化学生物学66.880317144.200罗贵银有机化学72.626356149.530罗进文有机化学71.576347149.680罗莉华有机化学73.360363149.000吕川无机化学73.374373143.069吕辞丹绿色化学71.534350147.670吕文迪分析化学71.932333159.860马秋亭分析化学75.670374153.950莫宇浩有机化学78.918382165.390聂泓宇分析化学74.470349162.950彭杨物理化学69.870341144.750蒲思锐分析化学69.662350138.310蒲小路高分子化学与物理70.388354139.540申婧怡物理化学67.664334137.920沈鑫有机化学71.202353144.210谭亚梅有机化学72.380357147.700陶绍坤绿色化学77.490377161.250涂辰琳有机化学76.996370162.980涂义民有机化学72.560349153.400王蕾无机化学69.900328152.700王琳华有机化学74.632357158.960王梅无机化学72.640357149.000王薇物理化学69.576333148.080伍星红分析化学71.336357142.482夏学欢高分子化学与物理75.700363160.700项文翔有机化学75.918382150.390肖翔心高分子化学与物理79.060377169.100徐皓威放射化学69.100315156.500徐健祥有机化学79.180400155.900严诚露分析化学76.074371157.770杨成勇有机化学74.154361154.170杨良坤有机化学79.500393161.700杨沐凡化学生物学65.384315137.920杨晓花物理化学68.946344138.330余莎有机化学72.060349150.900余文旺物理化学71.186346148.330湛堂余有机化学76.094364162.070张冬梅有机化学71.292334156.060张俊峰无机化学72.920342159.400张琳高分子化学与物理69.653346140.663张巧物理化学78.290387159.250张琴高分子化学与物理77.140374161.300张文瑜物理化学76.960368164.000张晓宇有机化学74.300355158.500赵玲有机化学76.074373156.570赵鹏伟放射化学71.380353145.100钟汶君分析化学70.064325155.320周德红有机化学76.000379152.600周锦林化学生物学72.840349154.800周炜兰物理化学68.364319150.420周肖元放射化学68.140334140.300周鑫物理化学77.156372162.580周雪连高分子化学与物理73.000356151.400。
四川大学有机化学公开课一等奖优质课大赛微课获奖课件
H+ H2O
OH CH3CH2CCOOH
CH3
H+ CH3CHCOOH
OH
第18页
HO R
HO R
OH2RCH2CHO
RCH2CHCHCHO Ag2O
RCH2CHCHCOOH
HOCH2CH2Cl NaCN
HOCH2CH2CN
NaOH H2O
HOCH2CH2COOH
Reformatsky反应
1) Zn
LIYING
CH3CH2OCH2COOH -乙氧基醋酸
/10/10
第1页
CH3 CH3 C CH=CHCOOH
COOH
COOH
4-甲基-4-苯基-2-戊烯酸
(1R, 3R)-1,3-环己烷二羧酸
O H C CH2COOH
丙醛酸 (3-氧代丙酸或3-羰基丙酸)
O
CH3 C CH2COOH
3-丁酮酸 (3-氧代丁酸或乙酰乙酸)
第十章 羧酸 及其衍生物
(Carboxylic acid and its Derivatives)
(CH3)2CHCH2
布洛芬
CHCOOH CH3
酰基 O 羧基 R C OH
COOH
OCOCH3
阿司匹林
一.命名、物性和波谱特性
HOOCCH-CHCOOH
H
H
C=C
OH OH
HOOC
COOH
酒石酸
马来酸
1)酯化 酸催化
O R C OH + H O* R'
H+
LIYING
/10/10
O R C O* R' + H2O
第9页
四川大学化学考研高分复习经验和考研资料大赠送

四川大学分析化学考研高分复习经验和考研资料大赠送写在前面的话本资料是和四川大学化学化工学院无机化学、分析化学、有机化学、物理化学等专业硕士专业考研试题配套的资料,适合于2015年考研的学子,吾经历了考研的过程,深知考研路途的艰辛,面对各种考研机构的专业课资料的纷繁复杂,对什么内容的资料适合考生,对考研的重点,也做了认真的分析,我经历了考研,也花了很多的时间,认真的收集和整理了这一份资料,和群里面的同学分享它,希望对你们能够为你减轻专业课上的负担和压力,希望为你带来有很大的帮助,凡是在群里面的同学,如果需要,和我联系,向我索要者,都是价格自己定,出点邮费为你提供服务,而且特别是资料的答案部分,均是自己的劳动成果,均不发送电子版,为了增加考研的竞争力度和提高你的成功率,我仅仅送二十套资料,送完为止。
无机化学试题精解解答部分,该答案是我花了很多的时间,认真分析考研试题的难度和重要的知识点,总结编写完成的,且深知考研过程中,如有老师或者同学指点,这对于我们复习专业课是非常轻松的,我对各种常考而且容易出错的题型、以及非常疑难的题目作出了详细的精解,提供了详细的考查知识点,为你复习无机化学各知识点提供了重点复习线索。
郑重申明:本试题的答案部分仅供你做考研专业课真题的过程中作参考,有些答案不是唯一的,比如计算题等,只要方法正确,即为正确的答案。
我真诚的希望本试题答案能对莘莘的考研学子有所帮助,但由于我的水平有限,考虑不周,书中定有不当或者错误之处,敬请你们批评指正为谢!这个时节,春风浪漫,欣喜若狂,朝气蓬勃,正如这个时候的你,开始踏上了考研的征程,从这里开始,让我们一起,放下包袱,充满自信地探究一个又一个谜底,春天来了,花开还会远吗?祝你:考研成功金榜题名四川大学在向你召唤!编者:Chen MingEmail:562104983@2014.3.25于四川大学一、明确所考化学课程和分数比例我考的专业是分析化学,但是对于考本院的其它专业的考研学子来说,也是考一样的专业课,所以对你们还是有一定复习指导和参考经验的,希望对你们有所帮助。
四川大学有机化学ppt

O
+ (CH 3CO2O) AlC3l
COC3 H + CH3COOH
=
=
=
=
O
+
O AlC3l
O
O
C CH=CHCOOH
3、F-C烷基化与F-C酰基化反应的异同点:
相同点: a. 反应所用cat. 相同;反应历程相似。 b. 当芳环上有强吸电子基(如:-NO2、-COR、-
CN等)时,既不发生 F-C 烷基化反应,也不发生 F-C
NO2 NO2+
6%
NO2 +
NO2 1%
NO2 NO2
93%
3. 磺化:
浓H2SO4 , 或发烟H2SO4
25 。 C , 45 。 C
SO3H 发烟H2SO4 , 90。C
SO3H SO3H
例: CH3
浓H2SO4 回流
CH3 SO3H +
CH3
反应温度 ,有利于 对位产物的生成。
SO3H
SO3H
与脂肪烃和脂环烃相比,芳香烃这种比较容易进行取 代,而不容易进行加成和氧化的化学特性,称为芳香性。
单环芳烃 苯
CH 2CH 3
CHCH 3 CH 3
乙苯
异丙苯
CH=CH 2 苯乙烯
苯系芳烃
联苯 联苯
对三联苯
多环芳烃 稠环芳烃
萘
蒽
非苯芳烃
多苯代脂烃
CH 2 二苯甲烷
环戊二烯 环庚三烯
薁
负离子 正离子
Z―基团可分为两类: 1.第一类定位基(即邻对位定位基)
R R''
R
R
R' R''
四川大学有机化学习题库

四川大学有机化学试卷班级姓名分数一、选择题( 共32题64分)1. 2 分(0037)0037CH3CH2CH2CH2+(I),CH3CH+CH2CH3(II),(CH3)3C+(Ⅲ)三种碳正离子稳定性顺序如何?(A) I>II>III (B) III>II>I (C) II>I>III (D) II>III>I2. 2 分(0038)0038HBr与3,3-二甲基-1-丁烯加成生成2,3-二甲基-2-溴丁烷的反应机理是什么? (A)碳正离子重排(B) 自由基反应(C) 碳负离子重排(D) 1,3-迁移3. 2 分(0039)0039环己烯加氢变为环己烷的热效应如何?(A) 吸热反应(B) 放热反应(C) 热效应很小(D) 不可能发生4. 2 分(0040)0040下列化合物中哪些可能有E,Z异构体?(A)2-甲基-2-丁烯(B) 2,3-二甲基-2-丁烯(C) 2-甲基-1-丁烯(D) 2-戊烯5. 2 分(0041)0041下列化合物中哪些可能有顺反异构体?(A) CHCl=CHCl (B) CH2=CCl2(C) 1-戊烯(D) 2-甲基-2-丁烯6. 2 分(0042)0042烯烃加I2的反应不能进行,原因是:(A) I─I太牢固不易断裂(B) C─I不易生成(C) I+不易生成(D) 加成过程中C─C键易断裂7. 2 分(0043)0043实验室中常用Br2的CCl4溶液鉴定烯键,其反应历程是:(A)亲电加成反应(B) 自由基加成(C) 协同反应(D) 亲电取代反应8. 2 分(0044)0044测定油脂的不饱和度常用碘值来表示,测定时所用试剂为:(A) I2(B) I2 + Cl2(C) ICl (D) KI9. 2 分(0045)0045烯烃与卤素在高温或光照下进行反应,卤素进攻的主要位置是:(A)双键C原子(B) 双键的α-C原子(C) 双键的β-C原子(D) 叔C原子*. 2 分(0046)0046实验室制备丙烯最好的方法是:(A)石油气裂解(B) 丙醇脱水(C) 氯丙烷脱卤化氢(D) Wittig反应11. 2 分(0049)0049CH3CH=CH2 + Cl2 + H2O 主要产物为:(A) CH3CHClCH2Cl + CH3CHClCH2OH (B) CH3CHOHCH2Cl + CH3CHClCH2Cl (C) CH3CHClCH3 + CH3CHClCH2OH (D) CH3CHClCH2Cl12. 2 分(0052)0052某烯烃经臭氧化和还原水解后只得CH3COCH3,该烯烃为:(A) (CH3)2C=CHCH3(B) CH3CH=CH2(C) (CH3)2C=C(CH3)2(D) (CH3)2C=CH213. 2 分(0053)0053CH3CH=CHCH2CH=CHCF3 + Br2 (1 mol) 主要产物为:(A) CH3CHBrCHBrCH2CH=CHCF3(B) CH3CH=CHCH2CHBrCHBrCF3 (C) CH3CHBrCH=CHCH2CHBrCF3(D) CH3CHBrCH=CHCHBrCH2CF314. 2 分(0054)0054CH2=CHCOOCH=CH2 + Br2 (1 mol) 主要产物为:(A) CH2BrCHBrCOOCH=CH2(B) CH2=CHCOOCHBrCH2Br (C) CH2BrCOOCH=CHCH2Br (D) CH2BrCH=CHCOOCH2Br15. 2 分(0055)0055ROCH=CH2 + HI 主要产物为:(A) ROCH2CH2I (B) ROCHICH3(C) ROH + CH2=CH2(D) RCH=CH2 +HOI16. 2 分(0056)0056CF3CH=CHCl + HI 主要产物为:(A) CF3CH2CHClI (B) CF3CHICH2Cl(C) CF3I + CH2=CHCl (D) CF3Cl + CH2=CHI17. 2 分(0057)0057(CH3)2C=CCl2 +HI 主要产物为:(A) (CH3)2CH―CCl2I (B) (CH3)2CI―CHCl2(C) CH3CH=CCl2 + CH3I (D) (CH3)2C=CClI + HCl18. 2 分(0061)0061分子式为C7H14的化合物G与高锰酸钾溶液反应生成4-甲基戊酸,并有一种气体逸出, G 的结构式是:(A) (CH3)2CHCH2CH2CH=CH2(B) (CH3)3CCH=CHCH3(C) (CH3)2CHCH=C(CH3)2(D) CH3CH2CH=CHCH(CH3)219. 2 分(0066)00661-甲基环己烯+ HBr 反应的主要产物是:(A) 1-甲基-1-溴代环己烷(B) 顺-2-甲基溴代环己烷(C) 反-2-甲基溴代环己烷(D) 1-甲基-3-溴环己烷20. 2 分(0068)0068由CH3CH2CH2Br CH3CHBrCH3,应采取的方法是:(A) ①KOH,醇;②HBr,过氧化物(B) ①HOH,H+;②HBr(C) ①HOH,H+;②HBr,过氧化物(D) ①KOH,醇;②HBr21. 2 分(0071)00713-甲基-1-丁烯与HBr反应的主要产物是什么?(A) 2-甲基-3-溴丁烷与2-甲基-2-溴丁烷(B) 3-甲基-2-溴丁烷与3-甲基-1-溴丁烷(C) 3-甲基-1-溴丁烷(D) 3-甲基-2-溴丁烷22. 2 分(0076)0076烃C6H12能使溴溶液褪色,能溶于浓硫酸,催化氢化得正己烷,用酸性KMnO4氧化得二种羧酸,则该烃是:(A) CH3CH2CH=CHCH2CH3(B) (CH3)2CHCH=CHCH3(C) CH3CH2CH2CH=CHCH3(D) CH3CH2CH2CH2CH=CH223. 2 分(0077)0077在碳烯(carbene)与烯烃的加成反应中,三线态比单线态的立体定向性差的原因是什么?(A) 三线态能量高,易发生副反应(B) 三线态能量低,不易起反应(C) 三线态易转化为单线态(D) 三线态的双价自由基分步进行加成24. 2 分(0078)0078下列哪种化合物进行催化氢化后不能得到丁烷?(A) 1-丁烯(B) (Z)-2-丁烯(C) (E)-2-丁烯(D) 2-甲基-2-丁烯25. 2 分(0079)0079卤化氢HCl(I),HBr(II),HI(III)与烯烃加成时,其活性顺序为:(A)I>II>III (B) III>II>I(C) II>I>III (D) II>III>I26. 2 分(0080)00802-甲基-2-丁烯与HI加成的主要产物是:(A) (CH3)2CICH2CH3(B) (CH3)2CHCHICH3(C) (CH3)2CHCH2CH2I (D) (CH3)2CHCH=CH227. 2 分(0081)00811-戊烯与HBr加成的主要产物是:(A) CH3CH2CH2CH2CH2Br (B) CH3CH2CH=CHCH3(C) CH3CH2CH2CHBrCH3(D) CH3CH2CHBrCH2CH328. 2 分(0082)0082丙烯与HBr加成,有过氧化物存在时,其主要产物是:(A)CH3CH2CH2Br (B) CH3CH2BrCH3(C) CH2BrCH=CH2(D)( B), (C) 各一半29. 2 分(0084)0084用下列哪种方法可由1-烯烃制得伯醇?(A)H2O (B) 浓H2SO4,水解(C) ①B2H6;②H2O2,OH-(D) 冷、稀KMnO430. 2 分(0085)0085某烯烃经酸性KMnO4氧化,得到CH3COCH3和(CH3)2CHCOOH,则该烯烃结构是: (A) (CH3)2C=C(CH3)2(B) (CH3)2C=CHCH(CH3)2(C) (CH3)2CHCH=CH2(D) (CH3)2CHCH=CHCH(CH3)231. 2 分(0086)0086某烯烃经臭氧化和水解后生成等物质的量的丙酮和乙醛,则该化合物是: (A) (CH3)2C=C(CH3)2(B) CH3CH=CHCH3(C) (CH3)2C=CHCH3(D) (CH3)2C=C=CH232. 2 分 (0177) 0177CH 3CH =CHCH 3与CH 3CH 2CH =CH 2是什么异构体? (A) 碳架异构 (B) 位置异构(C) 官能团异构 (D) 互变异构二、填空题 ( 共18题 36分 ) 33. 2 分 (1413) 1413化合物(E )-3,4-二甲基-2-戊烯的结构式是:34. 2 分 (1414) 1414化合物(E)-4,4-二甲基-2-戊烯的结构式是:35. 2 分 (1415) 1415化合物(Z )-3-甲基-4-异丙基-3-庚烯的结构式是:36. 2 分 (1342) 1342写出下列反应的主要有机产物或所需之原料和试剂(如有立体化学问题请注明)。
四川大学有机化学实验

基本原理——沸点
定义:沸点是液体化合物的蒸气压与外界大气压力相等时 的温度。 液体化合物均具有其蒸气压,且蒸气压只与外界温 度有关。温度越高,蒸气压越大,当蒸气压增大到与外界 压力相同时,液体内部会有大量气泡逸出,即沸腾。 若大气压力有变化,那么令液体化合物的蒸气压达 到一定大气压力时的温度也发生变化。即沸点随大气压力 变化而变化。
实验报告的撰写
关于讨论: 对于同一个实验,由于每位同学对理论知识及 实验操作掌握程度的不同,同时每人对实验的理解也 存在差异。因此每位同学的实验现象都是不完全相同 的,都会出现一些独有的现象,这需要在实验报告中 进行总结。 讨论的重要性在于:通过对自己实验过程的回 顾,可以发现自己在实验中的不足之处,防止以后出 现相同的错误。同时可以加深对实验相关理论知识及 实践操作的认识,巩固学习成果。
仪器的领取与维护
每人在第一次上课时在准备室领取一套玻璃仪器,领取 后应按清单点数并洗净,不够需到准备室补齐。 实验过程中应小心使用玻璃仪器,若发生仪器损坏,应 及时到准备室报告并领取新仪器,同时承担部分费用。 每次实验后应将自己的所有玻璃仪器收好保存在柜中。 所有课程结束后,清点仪器交还回准备室,缺损的需补 齐,并承担相应费用。
实验室安全须知
灼伤处理:
如被灼热的玻璃或铁器烫伤,轻者立即用冷自来水 冲伤口数分钟或用冰块敷伤口至痛感减轻;较重者可 在患处涂以正红花油,然后擦一些些烫伤软膏。 除金属钠外的任何药品溅入眼内,都要立即用大量 水冲洗。冲洗后,如果眼睛未恢复正常,应马上送医 院就医。
实验室安全须知
中毒预防:
化学药品大多具有不同程度的毒性,产生中毒 的主要原因是皮肤或呼吸道接触有毒药品所引起的。 在实验中,要防止中毒,切实做到以下几点: 药品不要沾在皮肤上,尤其是极毒的药品。实验完 毕后应立即洗手。称量任何药品都应使用工具,不得 用手直接接触。
四川大学有机化学pptPPT资料全面版

❖ 20世纪30年代建立了量子化学理论:化学键的 微观本质 诱导效应 、共轭效应、及共振论
❖ 20世纪60年代将现代物理方法用到测定分子结 构上,确定了许多复杂有机化合物的结构:糖、蛋 白质、氨基酸、胆甾醇、血红素、叶绿素等
N4O HCN (N 3)2C HO
Wohler给瑞典化学家J.Berzelius的信中这样写到:
我应当告诉您的是:我制造出尿素,而且不求助于肾或动物— —无论是人或犬。
1845年,柯尔伯(H.kolber) 制得醋酸;用碳、硫磺、氯 气和水为原料。实现了从单质到有机物的完全合成
生命力学说逐渐被抛弃 1854年柏赛罗(M.berthelot) 合成了油脂、1861年布特列洛 夫合成了糖类。 有机元素分析方法 有机化合物均含有:碳和氢
❖ 在有机分析和合成发展的同时,有机结构理论得到 了迅速的发展和完善。
❖ 1857年凯库勒和库帕各自独立提出——有机化合物中碳原子都是四价的, 相互结合成碳链
❖ 1861年布特列洛夫提出了化学结构,结构决定性质,性质可推出结构
❖ 1865年凯库勒提出了苯的构造式。
❖ 1874年范特霍夫和勒贝尔分别提出了碳的四面体结构,建立了分子的立 体概念,说明了旋光异构现象。
2. 有机化合物构造式的表示方法。 3. 共价键的形成——价键法(sp3、sp2 sp杂化、σ键与π 键)和分子轨道法。
4. 共价键的基本属性及诱导效应。
5. 共价键的断键方式及有机反应中间体。 6. 有机化合物的酸碱概念。
§有机化合物与有机化学
1、有机化合物:烃及其衍生物(烃:碳氢化合物) 2、有机化学:研究有机化合物来源、制备、结构、性能、应用 及其变化规律的科学。 3.有机化合物的研究对象 有机化学是从分子水平上研究物质世界最丰富多彩的部分 —— 有机化合物。 简单有机小分子化合物(组成、价键、结构、性质、鉴定、反应、 合成)——复杂有机化合物(结构、鉴定、合成) ——大分子 化合物( 结构、鉴定、合成、相互作用) —— 超分子(分子识别、 分子组装、功能) 三项内容:分离、结构、反应和合成
四川大学华西药学院《有机化学(II)-1,2》教学大纲

《有机化学(II)-1,2》(药物化学专业)教学大纲一、课程基本信息课程名称( 中、英文): 有机化学Ⅱ-1[Organic Chemistry Ⅱ-1]有机化学Ⅱ-2[Organic Chemistry Ⅱ-2]课程号( 代码) :,课程类别: 类级平台课程,必修课学时:64+48学分:4+3先修课程:《无机化学》、《分析化学》基本面向:药物化学专业二、教学目的及要求有机化学与药学渊源深厚。
该课程要求药物化学专业的学生系统地、扎实地掌握有机化学的基本理论和基本规律,为后续课程的学习以及继续深造,为将来利用有机化学,服务药学奠定坚实的基础。
通过有机化学的教学,把有机化学与药学紧密结合起来,进一步加强对学生解决问题、分析问题和提出问题的能力培养。
在学习该课程时学生要着重掌握各类有机化合物的结构、命名、物理性质、光谱性质、常用制备方法和用途。
紧紧抓住结构与性能的关系,深入理解各类有机化合物的典型反应的规律,机理,立体化学。
三、教学内容1 前言(4学时)基本要求:一、了解有机化学的发展史、主要任务和学习方法;二、了解有机化合物的基本特点、分类和反应类型;三、了解共价健的本质,掌握共价健的属性,熟悉利用键能数据推算反应的焓变;四、掌握下述名词术语:有机化学;同分异构现象;分子间作用力;Van der walls 力;官能团1-1 有机化学的由来和发展1-2 有机化合物的特点:分子结构和组成(同分异构现象,结构的表示方法);理化性质1-3 共价键的键参数:键能、键长、键角;键的极性与诱导效应;键的可极化性1-4 共价键的断裂方式与有机反应的类型1-5 有机化合物的分类1-6 学习有机化学的目的和学习方法2 烷烃和环烷烃(6学时)基本要求:一、了解烷烃的物理性质,掌握烷烃的命名规则。
二、掌握构象的表示方法和典型的构象ap, sp, sc, ac 的稳定性分析;三、了解饱和碳原子的sp 3 杂化轨道与烷基自由基的sp 2 杂化轨道的形成与构型;四、着重掌握烷烃的自由基取代反应(卤代反应)的基本规律(区域选择性)和反应机理(自由基反应),五、弄清下列概念:同系列与同分异构;构造异构与链异构;T.S 与活泼中间体;扭转张力与Van der Walls 张力;Newman 投影式与透视式;活性与选择性;Baeyer 张力;船式与椅式构象2-1 烷烃的同系列与同分异构现象(键异构)2-2 烷烃和命名:习惯命名;系统命名(采用1980 年中国化学会有机化学命名原则)衍生物命名与俗名2-3 烷烃的结构:CH 4 的正四面体结构与sp 3 杂化轨道;烷烃的构象2-4 烷烃的物理性质2-5 烷烃的反应:烷烃的卤代反应(CH 4 的氯代反应及自由基反应历程);卤代反应中卤素的活性与选择性;氧化反应(燃烧与部分氧化);热裂反应2-6 烷烃自由基的立体化学(sp 2 杂化)2-7 环烷烃的分类、异构与命名2-8 环烷烃的物理性质2-9 环烷烃的化学反应2-10 拜尔张力学说与近代观点2-11 环烷烃的构象(环丙烷、环己烷及其衍生物、十氢萘)3 立体化学- 对映异构(6学时)基本要求:一、掌握对称因素与手性的关系;二、掌握Fischer 投影式的书写规则,并能熟练地掌握R/S 的命名法,正确地判断手性中心的构型;三、弄清下列概念:对映异构体和非对映异构体;手性和旋光性;旋光度与比旋光度;内消旋体和外消旋体;手性与对称因素,手性中心与手性分子;赤式与苏式;外消旋化与内消旋化3-1 手性现象3-2 平面偏振光与物质的光活性:平面偏振光;物质的光活性;旋光度与比旋光度3-3 手性与对称因素(对称面、心、轴,更迭对称轴)3-4 手性分子构型表示方法与命名结构表示法(透视式与投影式)命名(R 、S ,赤式与苏式,次序规则)3-5 含两个手性碳原子的化合物3-6 含三个手性碳原子的化合物3-7 其它手性分子4 卤代烃(8学时)基本要求:一、重点掌握卤代烃的三类反应:亲核取代、消去反应与活泼金属的反应以及前两类反应的极端历程的描述和特征(动力学特征、立体化学特征等);二、掌握影响S N 1 ,S N 2 ,E1 ,E2 历程的影响因素及其规律(判断反应的历程);三、熟练掌握消去反应的规律——Saytzev 烯和Hofman 烯;四、熟练掌握Grignard 试剂的制备和应用,了解RLi ,R 2 CuLi ,RNa 等的形成与应用;五、掌握下述概念:亲核剂;溶剂解;氢解;Walden 转化;两可离子;邻基参与与邻位促进4-1 卤代烃的分类、异构与命名4-2 卤代烃的化学反应一.亲核取代反应:碳亲核剂的反应;氧亲核剂的反应;氯亲核剂的反应硫亲核剂的反应;卤亲核剂的反应二.卤代烷SN 反应的历程和立体化学(S N 1 、S N 2 )三.影响SN 反应的因素:R 的结构;L 离去基团;Nu 的亲核性;溶剂四.芳卤的SN 反应(Meisenheimer 络合物,苯炔历程)五.卤代烃的消去反应:β- 消去的历程(E1 ,E2 ,E1cb )影响因素;定向规律六.卤代烷与金属的反应:格氏试剂及其反应;类格氏试剂及其反应七.卤代烃的还原八.多卤代烃与α- 消去反应九.分子内的SN 反应与邻基参与5 烯烃(10学时)基本要求:一、掌握烯烃和环烷烃的顺反异构现象和E/Z 命名法;二、掌握烯烃的各类反应,重点掌握其反应规律及离子型亲电加成反应的历程;三、了解环烷烃的性质和构象,掌握环丙烷和环已烷的构象及其理论解释;四、掌握下述概念:Markovnikov 规则与过氧化物效应;立体选择性反应与立体与一性反应;亲电剂;亲电反应;氢化热与燃烧热;5-1 烯的结构5-2 烯烃的异构与命名:烯烃的异构(位置、顺反异构);命名(Z 、E 命名法)5-3 烯烃的物理性质5-4 烯烃的化学反应;烯烃与卤素的加成反应与亲电加成反应的历程[ 立体选择性] 与立体专一性;烯烃与无机酸的亲电加成反应(Markovnikov 规则);烯烃与H 2 O 的反应;烯烃与HOX 的反应;烯烃的聚合反应;硼氢化一氧化反应;溶剂汞化一去汞化反应;烯烃的还原与氧化反应;烯烃的自由基加成反应;烯烃的α-H 反应5-5 烯烃的制备;醇脱水(Saytzev 规律)和卤代烃脱HX (Hofmann 规律)6 炔烃与二烯烃(6学时)基本要求:一、掌握炔烃的亲电加成反应、氧化还原和炔氢的反应,了解亲核加成、聚合反应等;二、掌握共轭二烯的亲电加成反应规律和共轭二烯的Diels-Alder 反应;三、掌握下述概念:共轭效应与诱导效应;双烯组分与亲双烯组分;乙烯基化反应与乙炔基化反应;速度控制与平衡控制;1 ,2- 加成与共轭加成6-1 炔烃的结构、异构和命名6-2 炔烃的化学反应:加成反应(亲电加成);炔烃与含活泼氢化物反应(亲核加成、乙烯基化);氧化与还原反应(Lindlar 催化剂);炔氢的反应(酸性、亲核取代、乙炔基化反应);乙炔的聚合反应6-3 炔烃的制备6-4 二烯烃的分类与多烯烃的命名6-5 共轭二烯烃的结构与π、π共轭效应6-6 其它类型的共轭效应(P- π、P-P 、σ- π、σ-P )6-7 共轭二烯烃的反应:与H 2 和HX 的反应(动力学和热力学控制反应)加H 2 ;游离基加成反应;Diels-Alder 反应;聚合反应6-8 共轭二烯烃的制备7 芳烃(8学时)基本要求:一、掌握苯系芳烃的亲电取代反应类型(卤代;硝化;磺化;付一克烷化与酰化)、历程和定位规则,能充分利用电子效应和共振论来解释其规律;二、掌握侧链上的氧化与卤代反应规律,了解芳环被催化氢化,催化氧化,Birch 还原的规律;三、掌握萘及一取代萘的亲电取代反应和蒽、菲的特性;四、掌握Huckel 规律与芳香性判断;五、掌握下述概念和人名反应:共振论和Kekule 结构;活化基与钝化基;邻对位定位基与间位定位基;同位素效应;空间效应;Friedel-Crafts 烷化和酰化;Clemensen 还原;Haworth 合成法7-1 芳烃的分类和命名7-2 苯的结构:苯的特性与Kekule 结构;苯结构的描述(MO 和共振论)7-3 苯系芳烃的亲电取代反应的反应历程:卤代;硝化;磺化;付一克烷化与酰化7-4 芳环上的亲电取代反应的定位规则及其应用:定位规律及理论解释;苯二元取代物再取代的定位规律;定位规律的应用7-5 氧化(苯环上氧化,侧链氧化)7-6 游离基反应(环的加成,侧链卤代)7-7 萘的结构与衍生物的命名7-8 萘的化学反应;亲电取代(定位规则);氧化与还原7-9 蒽、菲的特性7-10 致癌烃7-11 非苯芳烃:芳香性的条件(Huckel 规则);几个典型碳环非苯芳香族化合物(环丙烯正离子,环戊二烯负离子,环庚三烯正离子,篮烃,杯烯、轮烯)8 醇、醚(6学时)基本要求:一、了解醇、醚的结构的共性、命名与物理性质及一些主要合成法;二、掌握醇的亲核取代反应和消去反应的规律,了解醇氧化和掌握邻二醇的特性;三、掌握不对称醚的醚键断裂规律和酸碱作用下的环醚开环规律;四、弄清下述试剂与反应的体质:Lucas 试剂;Sarett 试剂;Oppenmer 氧化法;Williamenson 醚合成;Pinacol 重排;Wagner-meerwein 重排;Fries 重排8-1 醇的分类和命名8-2 醇的结构与物理性质8-3 醇的化学性质:酸性、碱性、亲核性(与R-X 反应,与ROH 反应,与RCOOH 反应,与TsCl 和无机酰卤反应,与CS 2 反应)与无机酸反应;消去反应;醇的氧化8-4 邻二醇的特性(氧化与重排)8-5 醇的制备8-7 醚(分类,命名,反应,制备)8-8 硫醇和硫醚:命名;物理性质;化学性质9 醛、酮(8学时)基本要求:一、重点掌握羧基上的各种亲核加成反应的规律及历程,注意Cram 规则的立体化学问题;二、掌握醛、酮的α-H 的反应历程;三、了解插烯原理,掌握α、β- 不饱和醛酮的共轭加成规律及意义;四、搞清下列名称反应:Aldol 反应;Claisen-Schmidt 缩合;Mamich 反应;Wittig 反应;Baeyer-Villiger 反应;Wolff-Kisher- 黄鸣龙反应;Michael 反应;Robinson 反应;Cannizzaro 反应9-1 醛酮的分类与命名9-2 醛酮羰基上的亲核加成反应——加HCN 、NaHSO 3 ,有机金属化合物,H 2 O ,LiAlH 4 ,NaBH 4 ,PCl 5 等和立体化学;与氨及氨衍生物的反应(肟、腙、缩氨脲),与醇的加成缩合反应——半缩醛(酮)、缩醛(酮)的生成,醛(酮)的Wittig 反应、Mannich 反应、安息香缩合;9-3 醛酮α-H 的反应:酮- 烯醇互变,卤代与卤仿反应,aldol 反应;9-4 醛酮的氧化与还原:醛酮的一般氧化,Baeyer-Villiger 氧化和Riley 氧化;Cannizzaro反应;还原成醇(催化氢化和金属氢化物和金属还原);还原成烃基(Clemensen 还原,Wolff-Kisher- 黄鸣龙还原)9-5 醛、酮、的制备9-6 不饱和醛、酮(插烯原理与共轭加成)10 酚、醌(4学时)基本要求:一、掌握酚的结构、反应和制备方法;二、掌握醌的结构特征和对体醌的基本反应;三、弄清Reimer-Tiemann 反应;Kolbe 反应;10-1 酚的结构和命名10-2 酚的化学反应(酸性,氧上的烷化与酰化,显色反应,芳环上的反氧化与还原,10-3 酚的制备(磺化法、氯苯水解法、异丙苯法等)10-4 醌的分类与命名10-5 对苯醌的反应10-6 醌的制备11 羧酸及取代羧酸(6学时)基本要求:一、重点掌握羧酸羰基碳上的亲核取代反应,熟悉取代羧酸的特性;二、了解羧酸的结构对酸性的影响,羧酸的脱酸与还原反应,羧酸的α-H 的反应;三、适当的掌握卤代酸、酚酸、醇酸的特有反应。
[理学]四川大学近代化学基础有机总复习
![[理学]四川大学近代化学基础有机总复习](https://img.taocdn.com/s3/m/b40ff1d99ec3d5bbfd0a742c.png)
可极化度
中心原子相同的试剂:
亲核性与碱性一致
例:
a Ob Oc Sd COO-
亲核性: c > b > a > d 碱性
4、中间体的稳定性
C+ , C- ,C.
主要影响因素:
带电体系电荷分散则稳定
电子效应 氢键
有芳香性 (Huckel 规则)
5、反 应 活 性
CH2CH2Br
<
CH2Br
<
CHCH3 Br
芳香
亲核取代
芳卤的取代
X
重氮盐的取代
苯基正离子 (消除-加成)
NO2(CN) (o,p)
X Nu NO2(CN)
合成
加成-消除
酰基
亲核取代
RCOOH , RCOL 主要历程: 加成-消除 反应特点: 四面体中间体 有利因素: 酰基C+ 好离去基
NaCN
CCCN
(4)
CH2 - CH - CH2 - CH3 Br
KOH ,ROH
CH2 - CH=CH - CH3
例:比较在KOH醇溶液中消除HX的反应速度
(1)a.5-溴-1,3-环己二烯 b.3-溴环己烯 c.环己基溴
a. Br b. Br c. Br
根据产物稳定性 (2)
CH3 Br
HI
3、路线设计方法—— 倒推法 由产物找前体
由原料找与产物的关系
例1:用简单的酯合成下列化合物
PhCOCHCOOEt Ph
EtOOC O COOEt O
EtOOC + EtOOC - COOEt COOEt
PhCOOEt + PhCH2COOEt
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
、n→σ *、π →π *和 n→π *,这四种跃迁中,π →π *和 n→π *跃迁所需要的
能量较低,可在近紫外和可见区产生吸收,因此紫外光谱适用于分析具有π 键的不饱和化合物,特别是具有共轭体系的化合物。 化合物的紫外光谱通常有一个或几个吸收峰,最大吸收峰处的波长λ
max
和对应的摩尔吸收系数max 为化合物的紫外特征数值,是鉴定化合物结构的主 要依据。紫外光谱主要用于共轭体系的判断、化合物的纯度测定等。 红外光谱是由于分子振动能级的跃迁所产生的吸收光谱。分子的振动是通 过键合原子的化学键而引起的,可分为伸缩振动和弯曲振动。分子振动能级是 量子化的,当发生能级跃迁时就吸收相应波长的红外光,而产生红外吸收峰。 红外吸收峰在图谱中的位置取决于各化学键的振动频率,而化学键的振动频率 与组成化学键原子的质量和键本身性质有关。红外吸收峰的强度主要取决于化 合物的结构的特征和样品的浓度,如果在吸收红外光后分子振动过程中引起偶 极矩的变化较大,则吸收峰较强。此外,吸收峰也随跃迁几率的增加而增强。 根据 IR 谱中吸收峰的位置(波数)和峰的强度能判断分子中可能含有的官能团。 正确认识和判断特征吸收峰、相关峰和指纹区是解析 IR 谱的基础。 特征吸收峰能用于鉴定官能团的吸收峰, 这类峰出现在 IR 谱的 4000cm-1~
首 09 羧酸及 10 胺与生 11 有机波 12 杂环 13 糖 14 脂 15 氨基酸多 上一 页 其衍生物„ 物碱 谱学基础 化合物 类 类 肽蛋白质 页
第十章 胺和生物碱
一、基本要求
1. 掌握:胺的分类和命名,能区分脂肪胺与芳香胺及伯胺、仲胺、叔胺与 季铵; 胺的结构, 理解脂肪胺和芳香胺在结构上的差别; 重氮盐的化学性质, 能利用重氮盐的反应合成苯的衍生物及偶氮化合物。 了解: 胺的物理性质; 掌握胺的化学性质,能用化学方法区别不同类型的胺。
的质子数目成正比。将峰面积积分,可得到阶梯积分曲线。峰面积与积分曲线 高度成正比,即积分曲线高度之比等于相应质子数目之比,只要知道分子的总 质子数目就能求出各各吸收峰相应的质子数。现在的大多数核磁共振谱仪器与 计算机联用,各质子峰的强度直接由计算机输出。 (3)峰的裂分和偶合常数(J): 峰的裂分是由两组氢核之间自旋偶合引起的。 裂分峰中各小峰之间的距离称为耦合常数(J, 单位 Hz), 值的大小反映了核间 J 自旋偶合的有效程度。相互偶合的两组氢核信号应具有相同的 J 值。当相互偶 合的两组质子的化学位移与偶合常之比大于 6 时,峰的裂分规律为:如邻接碳 原子上氢核数目为 n, 则裂分的峰数为 n+1; 各裂分峰强度之比等于二项式(a+b)n 展开项的各项系数。 3、图谱的解析 解析核磁共振谱,应主要从其中寻找信号的位置、数目、强度及裂分情况 的信息。从信号的数目可知分子中有多少种不同类型的质子;从化学位移δ 值 可知质子的类型;从积分曲线高度可知各类质子的相对数目;从信号的裂分情 况可知邻近基团结构关系。 综合上述各参数提供的结构信息, 再结合其他波谱, 可推断化合物的结构。 三、重点和难点 重点:吸收光谱、紫外光谱、红外光谱、核磁共振谱的概念和基本原理; 紫外吸收与化合物共轭体系及官能团之间的关系;红外光谱中常见官能团的特 征红外吸收峰;核磁共振谱的主要参数;用紫外光谱、红外光谱、核磁共振谱 鉴定简单有机化合物结构的基本方法。 难点:吸收光谱的一般原理和紫外光谱、红外光谱、核磁共振谱的基本原 理以及对图谱的识别。
吡咯、呋喃和噻吩都是一个平面的五元环结构,即成环的四个碳原子和一 个杂原子都是 sp2 杂化。环上每个碳原子的 p 轨道有一个电子,杂原子 p 轨道 上有两个电子,p 轨道都垂直于 sp2 杂化轨道所在的平面,互相侧面重叠而形成 一个五原子六电子组成的富电子闭合共轭体系, 符合 Hückel 规则, 具有芳香性。 由于电负性的原因,杂环上的电子云密度不像苯那样均匀,芳香性都比苯差。 环上的电子云密度比苯环上的大,因此发生亲电取代反应时比苯活泼,取代基 主要进入-位。吡咯氮上的氢具有弱酸性。吡咯的重要衍生物有:卟吩、血红 素、叶绿素等。 3.稠杂环化合物 杂环与杂环稠合或苯环与杂环稠合而成的化合物总称为稠杂环化合物。由 嘧啶和咪唑在 4、5 位稠合而成的结构称为嘌呤。嘌呤能与酸或碱成盐。嘌呤的 重要衍生物有:腺嘌呤、鸟嘌呤、次黄嘌呤、黄嘌呤和尿酸等。尿酸具有酮式 和烯醇式两种互变异构体。
二、总 结
1. 胺 胺可看作是氨分子中的氢原子被烃基取代后的产物。根据直接连在 N 原子 上的烃基种类不同可分为脂肪胺和芳香胺,根据烃基数目的不同可分为伯胺、 仲胺和叔胺。要注意胺的伯仲叔分类与醇或卤代烃不同,后者是根据羟基或卤 素所连接的碳原子的类型不同来分类的。铵根离子(NH4+)中 4 个 H 原子都被烃 基取代后的化合物称为季铵化合物,包括季铵盐和季铵碱。 简单胺的命名一般以胺为母体,把连于 N 上烃基的数目和名称按“优先者 置后”的原则写在“胺”字的前面;若芳香胺的 N 连有脂肪烃基,命名时常以 芳香胺为母体,在脂肪烃基名称前标上“N” ,表示此烃基直接连接在 N 上。季 铵盐、季铵碱和胺的盐类的命名类似无机铵类化合物。 胺分子中的氮原子为不等性 sp3 杂化, 个杂化轨道中的 3 个分别与碳或氢 4
香胺也有差异。脂肪伯胺与亚硝酸反应,定量放出 N2,并生成醇、烯及卤烃等 混合物。此反应可用作伯氨基的定量分析。芳香伯胺与亚硝酸在低温下反应生 成芳香重氮盐, 芳香重氮盐在低温水溶液中较稳定, 当温度较高时会逐渐分解, 放出 N2。
仲胺与亚硝酸反应,都是在 N 上进行亚硝化,生成难溶于水的黄色 N-亚 硝基胺。 脂肪叔胺与亚硝酸作用生成不稳定、易水解的弱酸弱碱盐。芳香叔胺与亚 硝酸作用,芳环上对位的氢被亚硝基取代,生成有颜色的 C-亚硝基化合物;若 对位被占据,则亚硝基取代在邻位。 (6) 芳香胺的亲电取代反应 氨基的供电子共轭效应使芳环上的电子密度
1300cm-1 区段(特征谱带区)。 IR 谱中 1300cm-1~650cm-1 区段称为指纹区。这一区域对分子的结构十分敏 感,分子结构有细微变化,就会引起吸收峰的位置和强度明显改变。每一化合 物在指纹区都有它自己的特征光谱,这为分子结构的鉴定可提供重要信息。 IR 谱解析的一般顺序是: 首选根据官能团区域中特征吸收锋的位置判别可 能存在的官能团,然后找出相关峰,以确证分子中存在的官能团,最后观察指 纹区的吸收峰,并与标准图谱对照。 核磁共振是由处于强磁场中的自旋核受电磁波照射、引起核从低能级自旋 状态向高能级自旋状态跃迁所产生的吸收光谱。 1H 核产生的核磁共振称为 1H 由 NMR 或 pmr。 1、屏蔽作用 化合物分子处在外加磁场中,氢核外围电子在外加磁场垂直的平面内做循 环运动,产生电子环流,如果电子的环流产生一个与外加磁场方向相反的局部 磁场,使氢核实际受到的磁场强度稍有降低,核外电子对核的这种作用称为屏 蔽作用。在某些情况下,感应磁场与外加磁场方向一致,则作用于质子的磁场 强度比 H0 稍高一些,即质子受到了去屏蔽作用。由于核外电子的屏蔽作用,氢 核必须在外加磁场稍加大的情况下才能发生共振, 即共振吸收出现在较高磁场; 反之,质子受到去屏蔽作用,共振吸收出现在较低磁场。 2、NMR 谱的主要参数 (1)化学位移(δ 值):不同化学环境的氢核,因受到不同的屏蔽作用,将在 不同磁场区域产生共振吸收, 通常采用一参考物质(TMS), 以它的共振信号位置 作为标准,将其他氢核共振信号的位置与标准比较,二者的相对距离即为化学 位移的相对值,用δ 表示。各类氢核的δ 值与化合物的结构密切相关,且都有 一定的范围,是解析图谱、推断结构的主要依据。 (2)峰面积(积分高度):在 1H NMR 谱中,吸收峰占有的面积与产生核信号
原子形成σ 键,另一个 sp3 杂化轨道被一孤对电子所占用,整个分子呈三棱锥 形结构。苯胺中的氮原子仍为不等性 sp3 杂化,但孤对电子所占据的轨道含有 更多 p 轨道的成分。尽管苯胺不是一个平面型分子,但氮原子上孤对电子所占 据的轨道仍能与苯环的大π 键形成共轭体系,从而使 N 上的电子密度降低,芳 环上电子密度增高。芳香胺与脂肪胺的这种差异明显地表现在化学性质上。 (1) 碱性 胺分子中 N 上的孤对电子能接受质子而呈碱性。胺在水溶液中
的碱性强弱与 N 上电子密度有关,也受到空间效应和溶剂化效应的影响,故胺 的碱性强弱是电子效应、立体效应和溶剂化效应共同综合作用的结果。各类胺 在水溶液中的碱性强弱大致表现出如下顺序:
脂肪仲胺 > 脂肪 伯胺 叔胺 > 芳香伯胺 > 芳香仲胺 > 芳香叔胺
季铵类化合物的碱性由与季铵正离子相伴出现的负离子来决定,季铵碱的 碱性就表现为 OH-的碱性,故为强碱。 (2) 烃基化反应 胺和氨一样可作为亲核试剂与卤代烃发生 SN2 反应,产
升高,芳环上的氢原子容易被亲电试剂所取代。一些反应通常很难控制在一元 取代阶段,如苯胺与溴水在常温下立即定量生成 2,4,6-三溴苯胺。 2. 重氮盐和偶氮化合物 重氮盐分子中含有重氮基(-N+≡N)结构, 偶氮化合物分子中则含有偶氮基 (-N=N-)结构。 重氮盐很活泼, 可以发生多种化学反应, 主要有放氮反应 (重 氮基被取代的反应)和留氮反应(偶联反应)两类。 (1) 取代反应 在不同条件下,重氮基可以被羟基、卤素、氰基、氢原子等
三、重点和难点
重点:胺的命名、结构与化学性质;重氮盐的化学性质 难点:脂肪胺与芳香胺在结构上的特点及其与性质的关系;胺类的碱性比 较
第十一章 有机波谱学基础
一、基本要求 掌握:用紫外光谱、红外光谱、核磁共振谱鉴定简单有机化合物结构的基 本方法。 熟悉: 一些常见官能团的特征红外吸收峰的波数范围以及一些常见质 子的化学位移值范围。 了解:吸收光谱的一般原理和紫外光谱、红外光谱、核 磁共振谱的基本原理 二、总 结 紫外光谱是由价电子跃迁所产生的吸收光谱。电子跃迁类型主要有σ →σ
物是高一级的胺,最终生成季铵盐。 (3) 酰化反应 伯胺和仲胺仍象氨一样能与酰卤、酸酐甚至酯等酰化剂作
用生成酰胺。叔胺氮上没有可以被取代的氢原子,不能起酰化反应。 (4) 磺酰化反应 伯胺和仲胺可与苯磺酰酰胺氮上的氢受磺酰基影响呈弱酸性,可与碱 成盐而溶于水;仲胺形成的磺酰胺氮上无氢,不与碱成盐而呈固体析出;叔胺 不被磺酰化。常利用此反应鉴别三类胺(称 Hinsberg 试验法)。 (5) 与亚硝酸的反应 伯、仲、叔胺与亚硝酸反应各不相同,脂肪胺和芳
