中国药典》2010年版二部概况
中国药典2010年版二部解析

附录V 附录 D 高效液相色谱法
适当改变:色谱柱内径、长度、载体粒度、流动 相流速、混合流动相各组分的比例、柱温、进样 量、检测器的灵敏度 调整流动相组分比例:以组分比例较低者(小于 或等于50%)相对改变量不超过±30%且相对于 总量的改变量不超过±10%为限,如30%相对改 变量的数值超过10%时,则改变量以总量的 ±10%为限 色谱柱理论板数计算公式为n=16(tR/W)2 或 n=5.54(tR/Wh/2)2
附录I 附录 B 注射剂
注射剂所用原辅料应从来源及工艺等生产环节进行严格 控制并应符合注射用的质量要求 供注射用的非水性溶剂,应严格限制其用量,并应在品 种项下进行相应的检查 除另有规定外,容器应足够透明,以便内容物的检视{性 状、可见异物检查法} 注射剂必要时应进行相应的安全性检查,如异常毒性、 过敏反应、溶血与凝聚、降压物质、热原或细菌内毒素 等,均应符合规定 注射剂所用辅料,在标签或说明书中应标明其名称
附录I 附录 A 片剂
分散均匀性(取供试品6片,置250ml烧杯中,加 15-25℃的水100ml,振摇3分钟,应全部崩解并通 过二号筛)【原:取供试品2片,置20℃±1℃的水 100ml中,振摇3分钟,应全部崩解并通过二号筛】 {明确操作细则,放宽不必要的温度控制,与实际情 况接近} 控释片是指在规定介质中缓慢地恒速释放药物的片 剂【原:在水中或规定介质中缓慢地恒速或接近恒 速释放】{严格要求} 删除“必要时,薄膜包衣片应检查残留溶剂”{实质 上是必须检}
《中国药典2010年版(二部) 概况

凡例的增修订情况
正 文
• 八、正文系根据药物自身的理化与生物学特性,按照批准的处方来源、 生产工艺、贮藏条件等所制定的、用以检测药品质量是否达到用药要求 并衡量其质量是否稳定均一的技术规定。
附 录
• 十、附录主要收载制剂通则、通用检测方法和指导原则。制剂通则系按 照药物剂型分类,针对剂型特点所规定的基本技术要求;通用检测方法 系各正文品种进行相同检查项目的检测时所应采用的统一的设备、程序、 方法及限度;指导原则系为执行药典、考察药品质量、起草与复核药品 标准等所制定的指导性规定。
应在后续的生产环节予以有效去除。除正文已明确列
有“残留溶剂”检查的品种必须依法进行该项检查外,
其他未在“残留溶剂”项下明确列出的有机溶剂与未 在正文中列有此项检查的品种,如生产过程中引入或 产品中残留有机溶剂,均应按本版药典附录“残留溶 剂测定法”检查并应符合相应溶剂的限度规定。
药典标准—体现高质量药品
合国家有关的管理规定。 (3)来源于动物组织提取的药品,其所用动物种属要明确,所用脏 器均应来自经检疫的健康动物,涉及牛源的应取自无牛海绵状脑病地区
的健康牛群;来源于人尿提取的药品,均应取自健康人群。上述药品均
应有明确的病毒灭活工艺要求以及质量管理要求。
凡例的增修订情况
项目与要求
• 十七、(第二段)对于生产过程中引入的有机溶剂,
各论的增修订情况(1):名称与性状
药品通用名称 (制剂)
规范并真正反映药品的组成和剂型特点,明确了剂型的亚类,与制剂 通则一致。 将胶丸统一修改为软胶囊 硫糖铝片改硫糖铝咀嚼片。 替硝唑注射液(均为大容量规格)改名为替硝唑氯化钠注射液 把甲硝唑注射液中大容量规格改名为甲硝唑氯化钠注射液
2010年版中华人民共和国药典第二部化学药

2010年版中华人民共和国药典第二部化学药作者:中华人民共和国药典编委会出版社:中国医药科技出版社出版日期:2010年1月出版开本:16开精装册数:全一册光盘数:0定价:650元优惠价:598元进入20世纪,书籍已成为传播知识、科学技术和保存文化的主要工具。
随着科学技术日新月异地发展,传播知识信息手段,除了书籍、报刊外,其他工具也逐渐产生和发展起来。
但书籍的作用,是其他传播工具或手段所不能代替的。
在当代, 无论是中国,还是其他国家,书籍仍然是促进社会政治、经济、文化发展必不可少的重要传播工具。
详细介绍:《中国药典》是我国药品标准体系的核心,是药品研究、生产、经营、使用和监管的法定依据。
本版《中国药典》为新中国成立以来的第九版药典将分为中药、化学药、生物制品三部出版。
新版药典收载药品品种达到4615个,形成了中药材、中药饮片、中成药等各类齐全的药品标准体系,基本覆盖国家基本药物目录品种的需要。
2010年版《中国药典》分为三部出版,一部为中药,二部为化学药,三部为生物制品。
各部内容主要包括凡例、标准正文和附录三部分,其中附录由制剂通则、通用检测方法、指导原则及索引等内容构成。
药典二部收载化学药品、抗生素、生化药品、放射性药品以及药用辅料等。
药典三部收载生物制品。
新版药典在凡例、品种的标准要求、附录的制剂通则和检验方法等方面均有较大的改进和发展,特别是对药品的安全性、有效性和质量可控性方面尤为重视。
新版药典在继承前版药典的基础上,做了大量发展和创新性的工作。
本版药典具有以下几个特点:新增与淘汰并举,收载品种有较大幅度的增加;二是药品检测项目和检测方法增加,标准提高;三是中药标准有突破和创新;四是新版药典在凡例、品种的标准要求、附录的制剂通则等方面均有较大的变化和进步;五是力求覆盖国家基本药物目录品种和社会医疗保险报销药品目录品种;六是顶尖专家扛鼎之作。
本版药典聘请全国医药行业323位一流专家学者、投入巨额资金、历时两年编制而成,集中体现了当前我国药品标准工作的最新发展成果。
《中国药典XXXX年版(二部)概况

标准中有较大变化的部分制剂品种(3)
• 尼美舒利片,尼索地平片,对乙酰氨基酚 片、胶囊、注射液,地高辛片,地西泮片, 达那唑胶囊,异烟肼片、粉针,地塞米松 磷酸钠注射液,西米替丁氯化钠注射液, 达非唑胶囊,曲安奈德注射液,肌苷葡萄 糖注射液,注射用肌苷,米非司酮片,安 乃近片,异戊巴比妥片,异烟肼片,芬布 芬片、胶囊,克霉唑乳膏、药膜、栓,呋 喃妥因肠溶片,
10年版与05年 1、片剂:崩解时限(溶出度)、分散均匀 性(分散片)
• 2、注射剂:有关物质、可见异物、颜色与 澄清度。
• 3、栓剂:融变时限 • 4、胶囊剂:崩解时限(溶出度)、水分(
某些制剂) • 5、软膏剂:粒度(混悬型)、微生物限度
• 6、滴眼剂:粒度、沉降体积比(混悬型) 、渗透压
• 盐酸多沙普仑注射液,盐酸安他唑林片, 盐酸利多卡因注射液,盐酸环丙沙星片、 胶囊、滴眼液,盐酸帕罗西汀片,盐酸美 西律注射液,盐酸莫雷西嗪片,盐酸普罗 帕酮注射液,氧氟沙星片、胶囊、滴眼液, 氨甲环酸片、注射液,烟酸占替诺注射液, 酒石酸美托洛米片、注射液、胶囊,
标准中有较大变化的部分制剂品种(11)
标准中有较大变化的部分制剂品种(8)
• 盐酸罗通定片,盐酸哌唑嗪片,盐酸哌替 啶片、注射液,盐酸氟奋乃近片、注射液, 盐酸美沙酮片、注射液,盐酸倍他司汀片, 盐酸胺碘酮片、注射液、胶囊,盐酸麻黄 碱注射液、滴鼻液,盐酸维拉帕米缓释片, 盐酸氯西那林片,盐酸氯米帕明片,盐酸 氯胺酮注射液,盐酸普鲁卡因注射液,
标准中有较大变化的部分制剂品种(4)
• 呋噻米注射液,吡哌酸胶囊、片,吲哚美 辛肠溶片、乳膏,利福平注射液,谷氨酸 钾注射液,泛酸钙片,阿司匹林肠溶片, 阿普唑仑片,环扁桃酯胶囊,苯巴比妥钠 片,注射用苯妥英钠,非诺贝特片、胶囊, 罗通定片,洛莫司汀胶囊,辛伐他汀片、 胶囊,非诺贝特胶囊,
2010年版中国药典

(一)2010版品种
• 2010年版《中国药典》收载品种4567种 (2165+2271+131),基本覆盖基本药物目录(307 种——补遗是下一步重点)。 • 新增——1386种 • 中药(新增1019种,即药材种、饮片439种、植 物油与提取物种、中成药种)特别是饮片标准的 大幅增加,主要解决饮片标准较少、各地炮制规 范不统一等问题。对于提高中药饮片质量,保证 中医临床用药的安全有效,推动中药饮片产业健 康发展,将起到积极作用。 • 化药新增330种、生物制品新增37种,均为临床常 用、标准完善、成熟稳定的品种;
二、中国药典2010年版的凡例总则
◊ 6.首次明确附录的法律约束力。
《中国药典》2000年版规定“附录中收载的指导原则,是 为执行药典、考察药品质量所指定的指导性规定,不作为 法定标准。” 《中国药典》2005年版规定“附录中收载的指导原则,是 为执行药典、考察药品质量所制定的指导性规定。” 新版药典虽然也有类似规定,但结合凡例总则之二明确药 典收载的“凡例、附录对药典以外的其他国家药品标准具 同等效力”的规定,附录是具有法律约束力的指导性规定。 以上4、5、6使药典收载的凡例约束力得以扩大、附录 法律地位及其约束力得以确立,由此,《中国药典》作为 国家要品标准的核心地位得以确立。
(二)2010版附录
(对所有药品标准具有法定约束力——同品种同时废止)
• 中药 新增 个附录 新增14个附录 个附录(如:黄曲霉素测定法、异常毒性、 微量多元素同时分析等),修订 个 修订47个 修订 • 化药 新增 个附录 新增14个附录 个附录(如:溶血与凝聚、注射剂安全性检 测指导原则、离子色谱、电导率、NMR、拉曼光谱等); 修订69个 渗透压/明确正常血液渗透压285修订 个(如:渗透压 渗透压 310mOsmol/kg,静脉注射液、滴眼液必检;可见异物/深 于7号比色液宜选用色差计测定,明显异物/2mm以上/不 得检出,细微异物复试;过敏反应/坚毛、发抖、干呕、 连喷3声现象之二、或二便失禁、步态不稳或倒地、抽搐、 休克、死亡之一则不合规定) • 生物制品 新增 个附录 新增18个附录 个附录(如:残留溶剂、牛血清白蛋 白残留量测定),修订 个 修订39个 修订
2010版中国人民共和国药典第二部

2010年版《中华人民共和国药典》(全套三部)【著作者】国家药典委员会【出版社】中国医药科技出版社【I S B N 】9787502565264【出版日期】2010-1-1【定价】1498 元【三部优惠价】999元◇简介2010年版《中华人民共和国药典》(全套三部)•药品监督管理的法定技术标准•323位顶级药学专家历时两年编纂完成•集中体现我国药品标准工作的最新发展成果•是药品监督、生产、经营、研发等部门和企业必备工具书价格1498元第一部648元,第二部650元,第三部200元2010年版《中国药典》分为三部出版,一部为中药,二部为化学药,三部为生物制品。
各部内容主要包括凡例、标准正文和附录三部分,其中附录由制剂通则、通用检测方法、指导原则及索引等内容构成。
药典二部收载化学药品、抗生素、生化药品、放射性药品以及药用辅料等。
药典三部收载生物制品。
新版药典在凡例、品种的标准要求、附录的制剂通则和检验方法等方面均有较大的改进和发展,特别是对药品的安全性、有效性和质量可控性方面尤为重视。
新版药典在继承前版药典的基础上,做了大量发展和创新性的工作。
本版药典具有以下几个特点:新增与淘汰并举,收载品种有较大幅度的增加;二是药品检测项目和检测方法增加,标准提高;三是中药标准有突破和创新;四是新版药典在凡例、品种的标准要求、附录的制剂通则等方面均有较大的变化和进步;五是力求覆盖国家基本药物目录品种和社会医疗保险报销药品目录品种;六是顶尖专家扛鼎之作。
本版药典聘请全国医药行业323位一流专家学者、投入巨额资金、历时两年编制而成,集中体现了当前我国药品标准工作的最新发展成果。
新增与淘汰并举提高药品标准就意味着优胜劣汰。
2010年版《中国药典》在2005年版的基础上,做了大幅度的增修订和新增品种的工作。
本版药典共收载品种4598种,新增1462种。
其中:一部收载品种2136种,其中新增990种、修订612种;二部收载品种2220种,其中新增341种、修订1549种;三部收载品种131种,其中新增27种、修订104种。
中国药典版二部色谱法概况

右)”
显色与检视
V B 薄层色谱法
系统适用性试验
检测灵敏度 ( 系指杂质检查时,供试品溶液中被测物
能被检出的最低量。)
比移值(Rf ) (除另有规定外,比移值(Rf )应在0.2~0.8
之间。 )
分离效能 (鉴别时,在对照品与结构相似药物的对照
D 高效液相色谱法
E 气相色谱法
F 电泳法(1990)
G 毛细管电泳法(2000)
H 分子排阻色谱法(2000)
J 离子色谱法(2010)
V A 纸色谱法
系以纸为载体,纸上所含水分或其他物质
为固定相,用展开剂进行展开的分配色谱。
鉴别
纯度检查
含量测定
V B 薄层色谱法
系将供试品溶液点样于薄层板上,经展开、
检视后所得的色谱图,与适宜的对照物按同
法所得的色谱图作对比,用于药品的鉴别或
杂质检查的方法。
V B 薄层色谱法
仪器与材料
薄层板(增 “高效薄层板的粒径一般为5~7µm”)
点样器
展开容器
显色剂(“碘蒸气中显色”修改为“适宜试剂的蒸气中
熏蒸显色”)
显色装置
检视装置
V B 薄层色谱法
(当采用顶空进样时,由于供试品和对照品处于不完全
相同的基质中,故可采用标准溶液加入法以消除基质效
应的影响;当标准溶液加入法与其他定量方法结果不一
致时,应以标准加入法结果为准。)
V E 气相色谱法
对于生产过程中引入的有机溶剂,应在后续的生产环
节予以有效去除。除正文已明确列有“残留溶剂”检查的
中国药典2010年版二部及菌种使用说明书

中国药典2010年版二部及菌种使用说明书依据: 中国药典2010年版二部及菌种使用说明书1.标准菌的来源标准菌株由中国药品生物制品检定所医学菌种保藏中心(China Medical culture collection , CMCC)提供的冷冻干燥菌种(0代)或由上级药检部门已接种好的菌种斜面(3代)。
黑曲霉的0代菌种为保存于含15%甘油的0.9%无菌氯化钠溶液中的孢子悬液冷存管。
中国药品生物制品检定所医学微生物菌种保藏管理中心提供的冷冻干燥菌种的标签CMCC(B)代表细菌(bacteria),CMCC(F)代表真菌(fungi)每种菌具有固定的代号。
2.标准菌的验收从菌种保藏中心购买的原始菌种管是玻璃安瓿装的冻干菌,接收同时应检查是否有随菌种附有的相关资料。
接收菌种时应检查安瓿的数量和名称,和每一支安瓿的完整性。
在相应的菌种接收记录上记上所有的关于菌种的信息,如名称、数量和接收日期等。
在菌种安瓿及菌种管上粘贴标签,内容包括:菌种名称、菌种代号、代次、接收日期、接收人、贮存条件、有效期至。
新购入的0代原始菌种储存于-20℃,有效期为三年。
从上级药检部门购买的已接种好的菌种斜面(3代)应检查菌种管是否完好。
储存于2~8 ℃,有效期为3个月。
3. 标准菌的复苏、复壮及标准储备菌株的制备3.1物品及试剂:接种针、酒精灯、移液管、75%酒精及75%酒精棉球3.2培养基改良马丁琼脂培养基:用于黑曲霉复苏、复壮.液体硫乙醇酸盐培养基:用于生孢梭菌复苏、复壮.营养肉汤培养基:用于金黄色葡萄球菌、枯草芽孢杆菌、大肠埃希菌、乙型副伤寒沙门菌、短小芽孢杆菌、铜绿假单胞菌复苏、复壮。
改良马丁培养基:用于白色念珠菌复苏、复壮.3.3操作步骤:a.打开洁净工作台。
b.在安瓿的外表面用75%的酒精擦拭并让其自然风干。
c.用一小砂轮在安瓿的上部划一条线,用手轻轻将安瓿掰开(开启安瓿时必须小心,因为安瓿遇热时可能会破裂)。
d.以无菌方法用一无菌吸管从已准备好的上述液体培养基中移取0.5~0.8 ml 到安瓿中。
中国药典2010年版二部及菌种使用说明书

依据: 中国药典2010年版二部及菌种使用说明书1.标准菌的来源标准菌株由中国药品生物制品检定所医学菌种保藏中心(China Medical culture collection , CMCC)提供的冷冻干燥菌种(0代)或由上级药检部门已接种好的菌种斜面(3代)。
黑曲霉的0代菌种为保存于含15%甘油的0.9%无菌氯化钠溶液中的孢子悬液冷存管。
中国药品生物制品检定所医学微生物菌种保藏管理中心提供的冷冻干燥菌种的标签CMCC(B)代表细菌(bacteria),CMCC(F)代表真菌(fungi)每种菌具有固定的代号。
2.标准菌的验收从菌种保藏中心购买的原始菌种管是玻璃安瓿装的冻干菌,接收同时应检查是否有随菌种附有的相关资料。
接收菌种时应检查安瓿的数量和名称,和每一支安瓿的完整性。
在相应的菌种接收记录上记上所有的关于菌种的信息,如名称、数量和接收日期等。
在菌种安瓿及菌种管上粘贴标签,内容包括:菌种名称、菌种代号、代次、接收日期、接收人、贮存条件、有效期至。
新购入的0代原始菌种储存于-20℃,有效期为三年。
从上级药检部门购买的已接种好的菌种斜面(3代)应检查菌种管是否完好。
储存于2~8 ℃,有效期为3个月。
3. 标准菌的复苏、复壮及标准储备菌株的制备3.1物品及试剂:接种针、酒精灯、移液管、75%酒精及75%酒精棉球3.2培养基改良马丁琼脂培养基:用于黑曲霉复苏、复壮.液体硫乙醇酸盐培养基:用于生孢梭菌复苏、复壮.营养肉汤培养基:用于金黄色葡萄球菌、枯草芽孢杆菌、大肠埃希菌、乙型副伤寒沙门菌、短小芽孢杆菌、铜绿假单胞菌复苏、复壮。
改良马丁培养基:用于白色念珠菌复苏、复壮.3.3操作步骤:a.打开洁净工作台。
b.在安瓿的外表面用75%的酒精擦拭并让其自然风干。
c.用一小砂轮在安瓿的上部划一条线,用手轻轻将安瓿掰开(开启安瓿时必须小心,因为安瓿遇热时可能会破裂)。
d.以无菌方法用一无菌吸管从已准备好的上述液体培养基中移取0.5~0.8 ml到安瓿中。
《中华人民共和国药典》2010版简介

《中华人民共和国药典》2010年版简介《中华人民共和国药典》(简称《中国药典》)2010年版,按照第九届药典委员会成立大会暨全体委员大会审议通过的《中国药典》2010年版编制大纲所确立的指导思想、基本原则、任务目标及具体要求,在全体委员和常设机构工作人员的不懈努力及有关部门和参与单位的大力支持下编制完成。
经第九届药典委员会执行委员会审议通过,为中华人民共和国第九版药典。
本版药典分一部、二部和三部,收载品种总计4567种,其中新增1386种。
药典一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等,品种共计2165种,其中新增1019种(包括439个饮片标准)、修订634种;药典二部收载化学药品、抗生素、生化药品、放射性药品以及药用辅料等,品种共计2271种,其中新增330种、修订1500种;药典三部收载生物制品,品种共计131种,其中新增37种、修订94种。
本版药典收载的附录亦有变化,其中药典一部新增14个、修订47个;药典二部新增15个、修订69个;药典三部新增18个、修订39个。
一、二、三部共同采用的附录分别在各部中予以收载,并尽可能做到统一协调、求同存异。
本版药典的变化主要体现在:收载品种有较大幅度的增加。
本版药典积极扩大了收载品种范围,基本覆盖了国家基本药物目录品种范围。
此次收载品种的新增幅度和修订幅度均为历版最高。
对于部分标准不完善、多年无生产、临床不良反应多的药品,也加大调整力度,2005年版收载而本版药典未收载的品种共计36种。
现代分析技术得到进一步扩大应用。
除在附录中扩大收载成熟的新技术方法外,品种正文中进一步扩大了对新技术的应用。
如附录中新增离子色谱法、核磁共振波谱法、拉曼光谱法指导原则等。
中药品种中采用了液相色谱质谱联用、DNA分子鉴定、薄层生物自显影技术等方法,以提高分析灵敏度和专属性,解决常规分析方法无法解决的问题。
化药品种中采用了分离效能更高的离子色谱法和毛细管电泳法;总有机碳测定法和电导率测定法被用于纯化水、注射用水等标准中。
2010中国药典第二部附录

2010中国药典第二部附录
2010年版中国药典第二部附录是中国药典的一个重要组成部分。
中国药典是我国药品质量标准的权威性文件,对于保障药品的质量
和安全具有重要意义。
第二部附录是中国药典中的一个附属部分,
主要包含了一些与药品相关的辅助性信息。
在2010年版中国药典第二部附录中,我们可以找到以下内容:
1. 药品的命名规范,该部分规定了药品的命名规范,包括通用名、商品名、化学名等。
2. 药品的分类和编码,该部分对药品进行了分类和编码,以便
于管理和使用。
3. 药品的质量标准,该部分列举了各类药品的质量标准,包括
药品的理化性质、含量测定、微生物限度等。
4. 药品的生产工艺和质量控制,该部分详细介绍了药品的生产
工艺和质量控制方法,包括原料药的提取、制备、检验等。
5. 药品的储存和运输,该部分指导了药品的储存和运输条件,
以确保药品在储存和运输过程中的质量和安全。
6. 药品的不合格处理,该部分规定了药品在质量检验中出现不
合格情况时的处理方法,包括退货、重新检验等。
此外,2010年版中国药典第二部附录还包含了一些其他与药品
相关的信息,如药品的毒理学评价、药品的药理学作用等。
总的来说,2010年版中国药典第二部附录是一个重要的参考资料,它为药品的命名、分类、质量标准、生产工艺、质量控制、储
存和运输等方面提供了规范和指导,有助于确保药品的质量和安全。
2010版中国药典知识
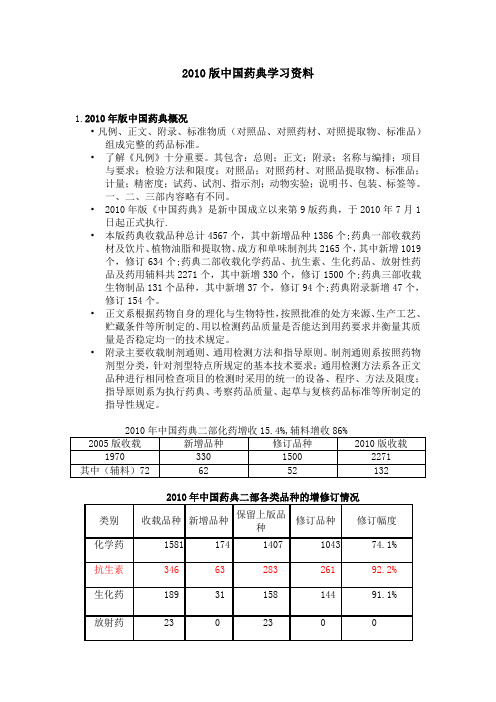
2010版中国药典学习资料1.2010年版中国药典概况•凡例、正文、附录、标准物质(对照品、对照药材、对照提取物、标准品)组成完整的药品标准。
•了解《凡例》十分重要。
其包含:总则;正文;附录;名称与编排;项目与要求;检验方法和限度;对照品;对照药材、对照品提取物、标准品;计量;精密度;试药、试剂、指示剂;动物实验;说明书、包装、标签等。
一、二、三部内容略有不同。
•2010年版《中国药典》是新中国成立以来第9版药典,于2010年7月1日起正式执行.•本版药典收载品种总计4567个,其中新增品种1386个;药典一部收载药材及饮片、植物油脂和提取物、成方和单味制剂共2165个,其中新增1019个,修订634个;药典二部收载化学药品、抗生素、生化药品、放射性药品及药用辅料共2271个,其中新增330个,修订1500个;药典三部收载生物制品131个品种,其中新增37个,修订94个;药典附录新增47个,修订154个。
•正文系根据药物自身的理化与生物特性,按照批准的处方来源、生产工艺、贮藏条件等所制定的、用以检测药品质量是否能达到用药要求并衡量其质量是否稳定均一的技术规定。
•附录主要收载制剂通则、通用检测方法和指导原则。
制剂通则系按照药物剂型分类,针对剂型特点所规定的基本技术要求;通用检测方法系各正文品种进行相同检查项目的检测时采用的统一的设备、程序、方法及限度;指导原则系为执行药典、考察药品质量、起草与复核药品标准等所制定的指导性规定。
凡例的增修订情况•新版药典凡例进行了重大修订:•1)、首次在凡例中设置总则一节。
增加了“总则”一节,将中国药典中最重要、最原则、最通用、最基础的内容集中阐明,并且做到一、二、三部之凡例的体例、结构的一致性。
内容在保留特点的基础上也基本一致。
•2)、首次明确药典制定颁布依据。
新版药典凡例总则之一明确“《中华人民共和国药典》简称《中国药典》。
《中国药典》依据《中国人民共和国药品管理法》组织制定和颁布实施”。
中国药典2010年版二部及菌种使用说明书

依据: 中国药典2010年版二部及菌种使用说明书1.标准菌的来源标准菌株由中国药品生物制品检定所医学菌种保藏中心(China Medical culture collection , CMCC)提供的冷冻干燥菌种(0代)或由上级药检部门已接种好的菌种斜面(3代)。
黑曲霉的0代菌种为保存于含15%甘油的0.9%无菌氯化钠溶液中的孢子悬液冷存管。
中国药品生物制品检定所医学微生物菌种保藏管理中心提供的冷冻干燥菌种的标签CMCC(B)代表细菌(bacteria),CMCC(F)代表真菌(fungi)每种菌具有固定的代号。
2.标准菌的验收从菌种保藏中心购买的原始菌种管是玻璃安瓿装的冻干菌,接收同时应检查是否有随菌种附有的相关资料。
接收菌种时应检查安瓿的数量和名称,和每一支安瓿的完整性。
在相应的菌种接收记录上记上所有的关于菌种的信息,如名称、数量和接收日期等。
在菌种安瓿及菌种管上粘贴标签,内容包括:菌种名称、菌种代号、代次、接收日期、接收人、贮存条件、有效期至。
新购入的0代原始菌种储存于-20℃,有效期为三年。
从上级药检部门购买的已接种好的菌种斜面(3代)应检查菌种管是否完好。
储存于2~8 ℃,有效期为3个月。
3. 标准菌的复苏、复壮及标准储备菌株的制备3.1物品及试剂:接种针、酒精灯、移液管、75%酒精及75%酒精棉球3.2培养基改良马丁琼脂培养基:用于黑曲霉复苏、复壮.液体硫乙醇酸盐培养基:用于生孢梭菌复苏、复壮.营养肉汤培养基:用于金黄色葡萄球菌、枯草芽孢杆菌、大肠埃希菌、乙型副伤寒沙门菌、短小芽孢杆菌、铜绿假单胞菌复苏、复壮。
改良马丁培养基:用于白色念珠菌复苏、复壮.3.3操作步骤:a.打开洁净工作台。
b.在安瓿的外表面用75%的酒精擦拭并让其自然风干。
c.用一小砂轮在安瓿的上部划一条线,用手轻轻将安瓿掰开(开启安瓿时必须小心,因为安瓿遇热时可能会破裂)。
d.以无菌方法用一无菌吸管从已准备好的上述液体培养基中移取0.5~0.8 ml 到安瓿中。
《中国药典》2010年版(二部)

283
158 23 1871
261 / 15
144 / 24 0 1448
92.2%
91.1% 0 77.4%
化学药中由于未找到样品而未修订的品种有306个,占保留上版品种21.8%
2010年版与2005年版药典主要项目收载情况比对表
增修订项目 红外光谱鉴别 有关物质 残留溶剂 渗透压摩尔浓度 溶出度或释放度 含量均匀度 无菌检查方法 细菌内毒素 含量测定 HPLC法 原料 制剂 HPLC方法 2005年版 530 2 142 24 4 315 165 107 216 359 2010年版 580 73 707 97 45 414 219 132 372 694
依法进行该项检查外,其他未在“残留溶剂”项下明确列出的有机溶
剂与未在正文中列有此项检查的品种,如生产过程中引入或产品中残 留有机溶剂,均应按本版药典附录“残留溶剂测定法”检查并应符合
相应溶剂的限度规定。
主要内容
1 3 2 3 4 5 3 二部特点及品种收载情况
凡例的增修订情况
各论的增修订情况 现代分析技术的应用
脏器均应来自经检疫的健康动物,涉及牛源的应取自无牛海绵状脑病
地区的健康牛群;来源于人尿提取的药品,均应取自健康人群。上述 药品均应有明确的病毒灭活工艺要求以及质量管理要求。
凡例的增修订情况
项目与要求
• 十七、(第二段)对于生产过程中引入的有机溶剂,应在后续的生产 环节予以有效去除。除正文已明确列有“残留溶剂”检查的品种必须
Байду номын сангаас
应关注晶型和药效的关系。如确需利用熔点作为控制晶型的手段,则 标准中应收入。
各论的增修订情况(1):名称与性状
比旋度(原料药)
《中国药典》2010版二部生化药品增修订概况与解读--梁翠荣

合成多肽中的醋酸测定法
为合成多肽中的醋酸检查,提供统一的方法。
色谱条件与系统适用性试验:C18柱 210nm检测
流动相A: 0.07%磷酸溶液(pH3.0) 流动相B:甲醇
理论板数按醋酸峰计算不低于2000
梯度洗脱 1.2ml/mlin
时间(min) 0~5 5~10 10~20 20~22 22~30
甲氧基苯胺值
测定原理 油脂中的不饱和脂肪酸,被氧化成过氧化物,过氧化物进一步分解生
注射剂(小针、输液、粉针)胶囊剂、乳膏剂、滴眼液、滴鼻液、颗粒 剂及口服溶液剂。 项目
检查:溶液的澄清度与颜色 有关物质 TLC法和HPLC法 残留溶剂、 炽灼残渣等 输液、滴眼液品种增订渗透压摩尔浓度 复方葡萄糖输液增订5-羟甲基糠醛(HPLC法) 部分品种热原修订为细菌内毒素
含量测定:UV及HPLC 法。
胰岛素
ChP2010版依据USP33、EP6.0标准,参照2005版分别对来源、性状、鉴别 、 检查项下含量测定项、活性检查作了修订和补充 (该品种江苏所起草,中检所复 核)
1.鉴别:由HPLC法改为肽图分析,经V8酶水解胰岛素,对其分子碎片 中的肽图进行分析,该法能确定不同种属的胰岛素,专属性强。
计算公式:
100 (C /W )(rt / Frs )
限度:尿嘧啶、尿苷均不得过0.1%;阿糖尿苷不得过0.3%;其他单个杂质不得过 0.1%;所有杂质总和不得过0.3%。
酶与辅酶
品种与剂型 收载品种(14个),剂型有片剂(片、 肠溶片)、注射剂(小针、粉针)、
胶囊剂(软胶囊、胶囊) 、颗粒剂。
19(6)
3(1)
20.0%(20%)
脂 总数
2(1)
4(2)
第一章药典概况

17 .5696 17 .5693 100 % 0.03 % 1.0124
符合规定
16.5572
1.0124
[含量测定]
碘液0.1026mol/L 9.8425 9.6347 0.2078 滴定:0.00 → 22.95ml
称取样品
22.95 0.008806 0.1026 100% 99.8% 0.2078 0.1
3、检验方法和限度 药典收载的原料药及制剂应按规定的方
法 检验
4、标准品和对照品
标准品与对照品是指用于鉴定、检查、含量
测定的标准物质,是由国务院药品监督管理部
门指定的单位制备、标定和供应。
标准品是指用于生物检定、抗生素或生化药 品中含量或效价测定的标准物质,按效价单位 (或μ g)计,以国际标准品进行标定;
例
检验报告书(省略上半页)
检验项目 检验标准 [性状] 应白色粉末 [检查] 检验结果 白色粉末 检验结论 符合规定 符合规定
[鉴别] 应生成黑色↓ 生成↓黑
溶液颜色 A440≤0.07
A440 =0.02 A440
A440 符合规定
炽灼残渣 ≤0.1% 0.03% 符合规定 [含量] ≥99.0% 99.8% 符合规定 结论 本品经检验符合(中国药典2000年版)规定 负责人 罗红 复核人 罗红 检验人 张杰
涂改方式:划两条细线,在右上角写正确数 字,并签名
例
9.6543 -8.1270 1.52723
例
2 0.1031
张杰
张杰
例
05 消耗22.31ml
张杰
记录完成后,需复核。复核后的记录,属内容和 计算错误的,由复核人负责;属检验操作错误的,由
2010年中国药典制剂通则

(二)无菌与灭菌制剂 无菌与灭菌制剂 与灭菌
基本定义: 基本定义:系指直接注射于体内或直接用于创伤面、
粘膜等的一大类制剂。
灭菌制剂:系指采用物理、化学方法杀灭或除去所
有活的微生物繁殖体和芽孢的一类制剂。
无菌制剂:系指采用无菌操作方法或制备技术的不
含任何活的微生物繁殖体和芽孢的一类制剂。
基本分类:注射制剂(注射剂、粉针等)、眼用
注射用浓溶液
附录ⅠB注射剂增修概况介绍( 附录ⅠB注射剂增修概况介绍(二) ⅠB注射剂增修概况介绍
注射剂在生产与贮藏期间(一般要求) 注射剂在生产与贮藏期间(一般要求)
第一点: 除另有规定外 混悬型注射液中药物粒度应控制在15μm 除另有规定外, 第一点:…除另有规定外,混悬型注射液中药物粒度应控制在15μm 以下, 15~20μm(间有个别20 50μm) 20~ 不应超过10 10% 。 以下,含15~20μm(间有个别20~50μm)者,不应超过10%…。混 悬型注射液不得用于静脉注射或椎管注射 乳状液型注射液应稳定, 不得用于静脉注射或椎管注射; 悬型注射液不得用于静脉注射或椎管注射;乳状液型注射液应稳定, 不得有相分离现象,不得用于椎管注射。静脉用乳状液型注射液中乳 不得有相分离现象,不得用于椎管注射。静脉用乳状液型注射液中乳 分散相球粒)的粒度90%应在1μm以下,不得有大于5μm 90%应在1μm以下 5μm的 滴(分散相球粒)的粒度90%应在1μm以下,不得有大于5μm的乳滴 球粒) 除另有规定外,静脉输液应尽可能与血液等渗。 (球粒)。除另有规定外,静脉输液应尽可能与血液等渗。 第二点: 第二点:注射剂所用的原辅料应从来源及工艺等生产环节进行严格控 制并应符合注射用的质量要求。注射剂所用溶剂必须安全无害, 制并应符合注射用的质量要求。注射剂所用溶剂必须安全无害,并不 得影响疗效和质量。一般分为水性溶剂和非水性溶剂。 得影响疗效和质量。一般分为水性溶剂和非水性溶剂。 非水性溶剂:常用的为植物油, 等溶剂 等溶剂。 (2)非水性溶剂:常用的为植物油,…等溶剂。供注射用的非水性 溶剂,应严格限制其用量,并应在品种项下进行相应的检查。 溶剂,应严格限制其用量,并应在品种项下进行相应的检查。
2010版中国药典

(二)中药品种分别增加和完善了 安全性质控指标
• 二是在中药正文标准中增加或完善安全性检查 项目。 • 如对易霉变的桃仁、杏仁等新增黄曲霉素检测, 方法和限度与国际一致;在正文标准中全面禁 用苯作为溶剂;对工艺中使用有机溶剂的均检 查有机溶剂残留;对川乌、草乌、马钱子等剧 毒性饮片,采用高效液相色谱法(HPLC)等更 先进、更精确的方法加以限量检查。
• 2010年版《中国药典》的一个主要特点 就是,大幅增加了中药饮片标准的收载 数量,初步解决了长期困扰中药饮片产 业发展的国家标准较少、地方炮制规范 不统一等问题。对于提高中药饮片质量, 保证中医临床用药的安全有效,推动中 药饮片产业健康发展,将起到积极的作 用。
(四)大幅增加符合中药特点的专 属性鉴定
(一)中药收取物标准大幅提升,一举改 变和扭转长期以来收载品种少、基础差, 尤其是中药饮片缺乏标准的局面。在中 药资源保护及其相关标准技术创新得到 跨越式发展。
(二)中药品种分别增加和完善了 安全性质控指标
• 一是在中药附录中加强安全性检查总体要求。 • 如在附录制剂通则中,口服酊剂增订甲醇限量 检查,橡胶膏剂首次提出不得检出致病菌检查 要求等;在附录检测方法中,新增二氧化硫残 留量测定法、黄曲霉毒素测定法、渗透压摩尔 浓度测定法、异常毒性检查法、降压物质检查 法、过敏反应检查法、溶血与凝聚检查法等。
附录
新增 一部 二部 三部 14 15 18 修订 47 69 39
主要特点: 主要特点:
• 一、药品安全性得到进一步保障 • 二、中药标准整体水平全面提升
• (一)中药收载品种数量大幅度提高 • (二)中药品种分别增加和完善了安全性质控指标。 • (三)解决了中药饮片标准的问题。 • (四)大幅增加符合中药特点的专属性鉴定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
度米芬滴丸,盐酸马普替林片,盐酸布比卡因注射液,注射用盐酸甲氯芬酯, 盐酸尼卡地平片,盐酸地芬尼多片,盐酸多巴胺注射液,盐酸多巴芬丁胺注 射液,盐酸多塞平片,盐酸异丙肾上腺素注射液,盐酸异丙嗪片、注射液, 盐酸利多卡因胶浆,盐酸妥拉唑林片、注射液,盐酸阿米替林片,盐酸苯乙 双胍片,盐酸苯海索片,盐酸奈福泮片、注射液,
标准中有较大变化的部分制剂品种(3)
尼美舒利片,尼索地平片,对乙酰氨基酚片、胶囊、注射液,地高辛片,地 西泮片,达那唑胶囊,异烟肼片、粉针,地塞米松磷酸钠注射液,西米替丁 氯化钠注射液,达非唑胶囊,曲安奈德注射液,肌苷葡萄糖注射液,注射用 肌苷,米非司酮片,安乃近片,异戊巴比妥片,异烟肼片,芬布芬片、胶囊, 克霉唑乳膏、药膜、栓,呋喃妥因肠溶片,
标准中有较大变化的部分制剂品种(9)
盐酸雷尼替丁注射液,盐酸溴己新片,格列齐特片(Ⅱ),核黄素磷酸钠注 射液,盐酸丁丙诺啡注射液,盐酸己氟拉嗪片,盐酸去氯羟嗪片,盐酸左氧 氟沙星片、胶囊,盐酸布桂嗪片、注射液,盐酸甲氧明注射液,盐酸甲氯芬 酯胶囊,盐酸曲吗多胶囊,盐酸伐昔洛韦片、胶囊,
标准中有较大变化的部分制剂品种(10)
标准中有较大变化的部分制剂品种(6)
胆苯硷片,美洛昔康片、分散片、胶囊,洛莫司汀胶囊,盐酸乙胺丁醇片, 枸橼酸喷托维林片,氢化可的松注射液,氢氟噻嗪片,氢溴酸东莨菪硷片、 注射液, 水仙硷片,复方甘草片,复方卡托普利片,复方甲苯咪唑片,复 方克霉唑乳膏,复方莪术油栓,复方铝酸铋胶囊、片,
标准中有较大变化的部分制剂品种(7)
盐酸多沙普仑注射液,盐酸安他唑林片,盐酸利多卡因注射液,盐酸环丙沙 星片、胶囊、滴眼液,盐酸帕罗西汀片,盐酸美西律注射液,盐酸莫雷西嗪 片,盐酸普罗帕酮注射液,ቤተ መጻሕፍቲ ባይዱ氟沙星片、胶囊、滴眼液,氨甲环酸片、注射 液,烟酸占替诺注射液,酒石酸美托洛米片、注射液、胶囊,
标准中有较大变化的部分制剂品种(11)
放射药 23
0
23
总数 2139
268
1871
1043 261 144
0 1448
74.1% 92.2% 91.1%
0 77.4%
标准中有较大变化的部分制剂品种(1) (主要是有关物质、含量测定项目)
乙酰半胱氨酸颗粒,乙酰唑胺片,二羟丙茶硷片、注射液,己烯雌酚注射液, 己酮可可硷注射液,马来酸氯苯那敏注射液、片、滴丸,五氟利多片,贝诺 酯片,牛磺酸颗粒,双氯芬酸钠肠溶片,双嘧达莫片、注射液,丙戊酸钠片, 甘露醇注射液,左氧氟沙星片,布美他尼注射液、片,丙谷氨片、胶囊,布 洛芬片、胶囊,扑米酮片,
《中国药典》 2010年版(二部) 概况
河北省药品检验所 2010年11月 石家庄
主要内容
31 总体情况 2 凡例的增修订情况 3 各论的增修订情况举例 4 附录增修订情况 35 对药典(药品标准)一点个人体会
10年版与05年版二部增修订情况比较表
药典
收载品种 新增品种
保留上 版品种
修订品种 修订幅度
硝酸甘油片、注射液,硝酸异山梨酯乳膏,硝酸益康唑乳膏、栓、喷雾剂、 乳膏,奥沙西泮片,酮洛芬肠溶胶囊,酮康唑片、乳膏、胶囊,
标准中有较大变化的部分制剂品种(13)
澳丙胺太林片,熊去氯胆酸片,醋酸甲羟孕酮片,醋酸地塞米松片,醋酸曲 安奈德注射液,磺胺嘧啶片、混悬液,磷酸川芎嗪片、胶囊、注射液,磷酸 可待因片,磷酸苯丙哌林颗粒、片、胶囊,磷酸氯喹片、注射液,螺内酯片、 胶囊。
10年版与05年版药典主要项目收载情况比对表
增修订项目
红外光谱鉴 原料
别
制剂
有关物质
HPLC方 法
残留溶剂
渗透压摩尔浓度
溶出度或释放度
含量均匀度
无菌检查方法
细菌内毒素
含量测定 HPLC法
2005年版 530 1
142
24 4 315 165 107 216 359
2010年版 580 73
标准中有较大变化的部分制剂品种(8)
盐酸罗通定片,盐酸哌唑嗪片,盐酸哌替啶片、注射液,盐酸氟奋乃近片、 注射液,盐酸美沙酮片、注射液,盐酸倍他司汀片,盐酸胺碘酮片、注射液、 胶囊,盐酸麻黄碱注射液、滴鼻液,盐酸维拉帕米缓释片,盐酸氯西那林片, 盐酸氯米帕明片,盐酸氯胺酮注射液,盐酸普鲁卡因注射液,
标准中有较大变化的部分制剂品种(2)
卡马西平片、胶囊,卡托普利片,卡维地洛片、胶囊,甲芬那酸片、胶囊, 甲氧氯普胺片,盐酸甲氧氯普胺注射液,甲氧苄啶注射液,甲硝唑片、泡腾 片、栓、胶囊、注射液,甲磺酸培氟沙星片、胶囊,甲磺酸酚妥拉明注射液, 司坦唑醇片,尼莫地平片、分散片、胶囊,尼可刹米注射液,
盐酸消旋山莨菪硷注射液,诺氟沙星软膏、滴眼剂,萘普生片、栓、胶囊、 颗粒,酚咖片,羟基脲片,维A酸片,维生素B1片、注射液,维生素C注射液 (草酸检查),维生素E软胶囊,维生素K1注射液,联磺甲氧苄啶片,葡萄 糖酸亚铁片、胶囊、糖浆,硝西泮片,硝苯地平片、胶囊,
标准中有较大变化的部分制剂品种(12)
2005年版 1967个
327个 1640个
522个
31.8%
2010年版 2271个
330个 1941个 1500个
76.1%
10版二部各类品种的增修订情况
类别
收载品种 新增品种
保留上 版品种
修订品种/无样品 修订幅度
化学药 1581
174
1407
抗生素 346
63
283
生化药 189
31
158
标准中有较大变化的部分制剂品种(4)
呋噻米注射液,吡哌酸胶囊、片,吲哚美辛肠溶片、乳膏,利福平注射液, 谷氨酸钾注射液,泛酸钙片,阿司匹林肠溶片,阿普唑仑片,环扁桃酯胶囊, 苯巴比妥钠片,注射用苯妥英钠,非诺贝特片、胶囊,罗通定片,洛莫司汀 胶囊,辛伐他汀片、胶囊,非诺贝特胶囊,
标准中有较大变化的部分制剂品种(5)
