中国药典2010年版
2010版中国药典知识
2010版中国药典学习资料1.2010年版中国药典概况•凡例、正文、附录、标准物质(对照品、对照药材、对照提取物、标准品)组成完整的药品标准。
•了解《凡例》十分重要。
其包含:总则;正文;附录;名称与编排;项目与要求;检验方法和限度;对照品;对照药材、对照品提取物、标准品;计量;精密度;试药、试剂、指示剂;动物实验;说明书、包装、标签等。
一、二、三部内容略有不同。
•2010年版《中国药典》是新中国成立以来第9版药典,于2010年7月1日起正式执行.•本版药典收载品种总计4567个,其中新增品种1386个;药典一部收载药材及饮片、植物油脂和提取物、成方和单味制剂共2165个,其中新增1019个,修订634个;药典二部收载化学药品、抗生素、生化药品、放射性药品及药用辅料共2271个,其中新增330个,修订1500个;药典三部收载生物制品131个品种,其中新增37个,修订94个;药典附录新增47个,修订154个。
•正文系根据药物自身的理化与生物特性,按照批准的处方来源、生产工艺、贮藏条件等所制定的、用以检测药品质量是否能达到用药要求并衡量其质量是否稳定均一的技术规定。
•附录主要收载制剂通则、通用检测方法和指导原则。
制剂通则系按照药物剂型分类,针对剂型特点所规定的基本技术要求;通用检测方法系各正文品种进行相同检查项目的检测时采用的统一的设备、程序、方法及限度;指导原则系为执行药典、考察药品质量、起草与复核药品标准等所制定的指导性规定。
凡例的增修订情况•新版药典凡例进行了重大修订:•1)、首次在凡例中设置总则一节。
增加了“总则”一节,将中国药典中最重要、最原则、最通用、最基础的内容集中阐明,并且做到一、二、三部之凡例的体例、结构的一致性。
内容在保留特点的基础上也基本一致。
•2)、首次明确药典制定颁布依据。
新版药典凡例总则之一明确“《中华人民共和国药典》简称《中国药典》。
《中国药典》依据《中国人民共和国药品管理法》组织制定和颁布实施”。
中国药典 2010 年版一部附录

中国药典2010 年版一部附录附录Ⅰ A 丸剂丸剂系指饮片细粉或提取物加适宜的黏合剂或其他辅料制成的球形或类球形制剂,分为蜜丸、水蜜丸、水丸、糊丸、蜡丸和浓缩丸等类型。
蜜丸系指饮片细粉以蜂蜜为黏合剂制成的丸剂。
其中每丸重量在0.5g(含0.5g)以上的称大蜜丸,每丸重量在0.5g 以下的称小蜜丸。
水蜜丸系指饮片细粉以蜂蜜和水为黏合剂制成的丸剂。
水丸系指饮片细粉以水(或根据制法用黄酒、醋、稀药汁、糖液等)为黏合剂制成的丸剂。
糊丸系指饮片细粉以米粉、米糊或面糊等为黏合剂制成的丸剂。
蜡丸系指饮片细粉以蜂蜡为黏合剂制成的丸剂。
浓缩丸系指饮片或部分饮片提取浓缩后,与适宜的辅料或其余饮片细粉,以水、蜂蜜或蜂蜜和水为勤合剂制成的丸剂。
根据所用黏合剂的不同,分为浓缩水丸、浓缩蜜丸和浓缩水蜜丸。
丸剂在生产与贮藏期间应符合下列有关规定。
一、除另有规定外,供制丸剂用的药粉应为细粉或最细粉。
二、蜜丸所用蜂蜜须经炼制后使用,按炼蜜程度分为嫩蜜、中蜜和老蜜,制备蜜丸时可根据品种、气像等具体情况选用。
除另有规定外,用塑制法制备蜜丸时,炼蜜应雄热加入药粉中,混合均匀;处方中有树脂类、胶类及含挥发性成分的药味时,炼蜜应在60℃左右加入;用泛制法制备水蜜丸时,炼蜜应用沸水稀释后使用。
三、浓缩丸所用提取物应按制法规定,采用一定的方法提取浓缩制成。
四、除另有规定外,水蜜丸、水丸、浓缩水蜜丸和浓缩水丸均应在80℃以下干燥;含挥发性成分或淀粉较多的丸剂(包括糊丸)应在60℃以下干燥;不宜加热干燥的应采用其他适宜的方法干燥。
五、制备蜡丸所用的蜂蜡应符合本版药典该饮片项下的规定。
制备时,将蜂蜡加热熔化,待冷却至60℃左右按比例加入药粉,棍合均匀,趁热按塑制法制丸,并注意保温。
六、凡需包衣和打光的丸剂,应使用各品种制法项下规定的包衣材料进行包衣和打光。
七、丸剂外观应圆整均匀、色泽一致。
蜜丸应细腻滋润,软硬适中。
蜡丸表面应光滑无裂纹,丸内不得有蜡点和颗粒。
中国药典2010年版

2010版中国药典中国药典2010年版名称:《中华人民共和国药典》中国药典2010版作者:国家药典委员会出版社:中国医药科技出版社2010年10月出版开本:16开精装册数:全三卷定价:1498 元优惠价:980 元读者服务部→发行部:,内容简介:2010年版药典的鲜明特色:更新与淘汰并举、收载品种大幅增加。
药品检测项目和检测方法增加、标准提高,因而在药品安全性和质量可控性方面有更高、更多、更大提升。
二部中采用高效液相色谱法进行含量测定或用于有关物质检查的品种有近千个,系统适用性要求也更为合理,个别品种采用了分离效能更高的离子色谱法,检测器使用种类也更加多样。
中药标准有突破和创新,尤其在过去比较薄弱的中药材和中药饮片标准的新增和修订方面,如本版《中国药典》一部中动物药蛇类、植物药川贝母等,都采用了PCR检测方法。
新版药典在凡例、品种的标准要求、附录的制剂通则等方面均有较大的变化和进步。
在广泛吸取国内外先进技术和实验方法的基础上,附录内容与目前国际对药品质量控制的方法和技术力求一致,进一步发挥《中国药典》的国际影响力。
新版药典在坚持科学、实用、规范、药品安全性、质量可控性和标准先进性的原则下,力求覆盖国家基本药物目录品种和社会医疗保险报销药品目录品种。
顶尖专家扛鼎之作。
本版《中国药典》是在第九届药典委员会的精心组织下,聘请全国医药行业323位一流专家、投入巨额资金、历时两年编制而成,集中体现了当前我国药品标准工作的最新发展成果。
《中国药典》是国家监督管理药品质量的法定技术标准。
2010年版《中国药典》分为三部出版,一部为中药,二部为化学药,三部为生物制品。
各部内容主要包括凡例、标准正文和附录三部分,其中附录由制剂通则、通用检测方法、指导原则及索引等内容构成。
药典二部收载化学药品、抗生素、生化药品、放射性药品以及药用辅料等。
药典三部收载生物制品。
新版药典在凡例、品种的标准要求、附录的制剂通则和检验方法等方面均有较大的改进和发展,特别是对药品的安全性、有效性和质量可控性方面尤为重视。
中国药典2010年版

影响吸收的因素:
1. 眼睑缝隙损失(7~30μl,1滴药液约50~70μl) 2. pH和pKa值(分子型>离子型药物,双亲性药物更易吸收) 3. 刺激性、表面张力、粘度等 4. 外周血管消除(结膜→外周→消除)
2013-7-30
Page 19
附录ⅠG 眼用制剂增修概况与解读(一)
滴眼剂 系指由药物与适宜辅料制成的供滴入眼内的无菌液体制
3. 给药途径多(胃肠道、腔道、皮肤、粘膜等)
4. 可降低某些药物的刺激性(如碘或溴化物等) 5. 可提高某些药物AUC 6. 但不稳定(物理、化学与生物学)、携带和运输不便、可能含防腐剂等
2013-7-30
Page 22
附录ⅠC 酊剂增修概况与解读
酊剂
系指将药物用规定浓度的乙醇浸出或溶解而制成的澄清液 体制剂,也可用流浸膏稀释制成。供口服或外用。
2013-7-30
Page 20
附录ⅠG 眼用制剂增修概况与解读(二)
除另有规定外,眼用制剂应进行以下相应检查 (必检项目)
【渗透压摩尔浓度】 除另有规定外,水溶液型滴眼剂、洗眼剂和 眼内注射溶液按各品种项下的规定,照渗透压摩尔浓度测定法(附 录Ⅸ G)检查,应符合规定。 【无菌】 (眼内注射溶液、眼内插入剂及供手术、伤口、角膜穿通伤用的眼用 制剂,)照无菌检查法(附录Ⅺ H(J))检查,应符合规定。 删除【微生物限度】检查
2013-7
定义:丸剂系指药物与适宜的辅料以适当方法制成的球状或类球状
固体制剂。
基本分类:滴丸、糖丸、小丸等。
滴丸 系指固体或液体药物与适宜的基质加热熔融后溶解、乳化或混 悬于基质中,再滴入不相混溶、互不作用的冷凝(液)介质中,…。 糖丸 系指以适宜大小的糖粒或基丸为核心,用糖粉和其他辅料的混 合物作为(撒粉)材料,…。 生产与贮藏期间(一般要求): 第四点:…供口服的滴丸或小丸可包糖衣或薄膜衣。必要时,薄膜包 衣丸应检查残留溶剂(与片剂要求一致)
中国药典2010年版附录

化学药品质量控制按剂型分ⅠA片剂ⅠB注射剂ⅠC酊剂ⅠD栓剂ⅠE胶囊剂ⅠF软膏剂乳膏剂糊剂ⅠG眼用制剂ⅠH丸剂ⅠJ植入剂(增订)ⅠK糖浆剂ⅠL气雾剂粉雾剂喷雾剂ⅠM膜剂ⅠN颗粒剂ⅠO口服溶液剂口服混悬剂口服乳剂ⅠP散剂ⅠQ耳用制剂ⅠR鼻用制剂ⅠS洗剂冲洗剂灌肠剂ⅠT搽剂涂剂涂膜剂ⅠU凝胶剂ⅠV贴剂片剂系指药物与适宜的辅料混匀压制而成的圆片状或异形片状的固体制剂。
片剂以口服普通片为主,另有含片、舌下片、口腔贴片、咀嚼片、分散片、可溶片、泡腾片、阴道片、阴道泡腾片、缓释片、控释片与肠溶片等。
含片系指含于口腔中,药物缓慢溶解产生持久局部作用的片剂。
含片中的药物应是易溶性的,主要起局部消炎、杀菌、收敛、止痛或局部麻醉作用。
含片应进行释放度检查。
舌下片系指置于舌下能迅速溶化,药物经舌下黏膜吸收发挥全身作用的片剂。
舌下片中的药物与辅料应是易溶性的,主要适用于急症的治疗。
口腔贴片系指粘贴于口腔,经黏膜吸收后起局部或全身作用的片剂。
口腔贴片应进行溶出度或释放度检查。
咀嚼片系指于口腔中咀嚼或吮服使片剂溶化后吞服,在胃肠道中发挥作用或经胃肠道吸收发挥全身作用的片剂。
咀嚼片口感、外观均应良好,一般应选择甘露醇、山梨醇、蔗糖等水溶性辅料作填充剂和黏合剂。
咀嚼片的硬度应适宜。
分散片系指在水中能迅速崩解并均匀分散的片剂。
分散片中的药物应是难溶性的。
分散片可加水分散后口服,也可将分散片含于口中吮服或吞服。
分散片应进行溶出度检查。
可溶片系指临用前能溶解于水的非包衣片或薄膜包衣片剂。
可溶片应溶解于水中,溶液可呈轻微乳光。
可供外用、含漱等用。
泡腾片系指含有碳酸氢钠和有机酸,遇水可产生气体而呈泡腾状的片剂。
泡腾片中的药物应是易溶性的,加水产生气泡后应能溶解。
有机酸一般用枸橼酸、酒石酸、富马酸等。
阴道片与阴道泡腾片系指置于阴道内应用的片剂。
阴道片和阴道泡腾片的形状应易置于阴道内,可借助器具将阴道片送入阴道。
阴道片为普通片,在阴道内应易融化、崩解并释放药物,主要起局部消炎杀菌作用,也可给予性激素类药物。
2010版中国药典

1019
634
2165
1146
《中国药典》发展与展望
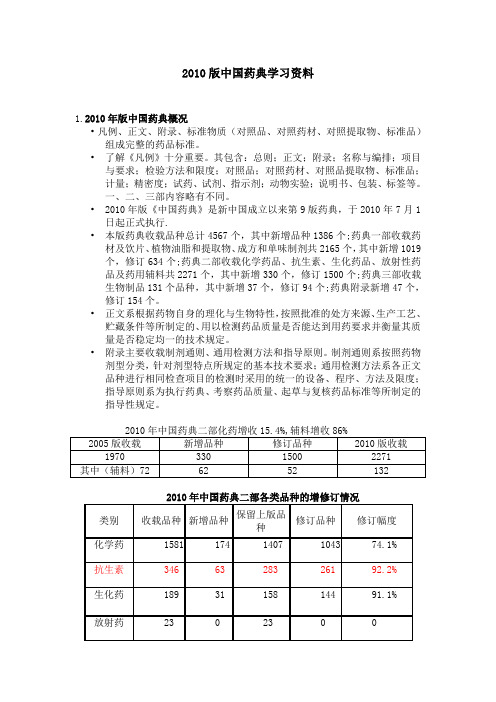
2010版药药典二部化药增收15.4%,辅料增收86%
2005版收载 1970
新增品种 修订品种 2010版收载
330
1500
2271
其中(辅料) 72
62
52
132
《中国药典》发展与展望
2010版药药典三部(生物制品)增收29.7%
类别
收载总数
140
新增 14 15 18
修订
2010版 收载
47
112
69
152
39
149
《中国药典》发展与展望
中国药典2010版概况
管理创新 强化系统性、规范性、基础性工作
标准验证和复核;一般检查项目的增补和完善;中药材拉丁名词序 变更;规范功能与主治等。
注重体现中药 特色,表达中药特点
重视中药材与中药材饮片标准,注重质量控制的专属性,一测多 评技术,多指标成分定量;特征和指纹图谱技术的应用。
2010版中国药典概述来自010版中国药典一、 《中国药典》发展与展望 二、 《中国药典》2010年版通用检测方法和指导原则 三、 2010年版中国药典凡例附录简介 四、 《中国药典》 2010年版一部增修订情况简介 五、 《中国药典》2010年版药用辅料概述 六、 《中国药典》2010年版无菌检查和微生物限度检查部分增修订内容
新增品种
修订品种
未收载 2010版收载
3217
1386(43%) 2237(70%) 36
4567
《中国药典》发展与展望
2010版药药典品种收载情况
内容
新增
修订 2010年版 2005年版
中国药典(2010版)

4附录XIX C 原料药与药物制剂稳定性试验指导原则稳定性试验的目的是考察原料药或药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。
稳定性试验的基本要求是:(1)稳定性试验包括影响因素试验、加速试验与长期试验。
影响因素试验用1批原料药或1批制剂进行。
加速试验与长期试验要求用3批供试品进行。
(2)原料药供试品应是一定规模生产的,供试品量相当于制剂稳定性试验所要求的批量,原料合成工艺路线、方法、步骤应与大生产一致。
药物制剂供试品应是放大试验的产品,其处方与工艺应与大生产一致。
药物制剂如片剂、胶囊剂,每批放大试验的规模,片剂至少应为10000片,胶囊剂至少应为10000粒。
大体积包装的制剂如静脉输液等,每批放大规模的数量至少应为各项试验所需总量的10倍。
特殊品种、特殊剂型所需数量,根据情况另定。
(3)供试品的质量标准应与临床前研究及临床试验和规模生产所使用的供试品质量标准一致。
(4)加速试验与长期试验所用供试品的包装应与上市产品一致。
(5)研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法与有关物质(含降解产物及其他变化所生成的产物)的检查方法,并对方法进行验证,以保证药物稳定性试验结果的可靠性。
在稳定性试验中,应重视降解产物的检查。
(6)由于放大试验比规模生产的数量要小,故申报者应承诺在获得批准后,从放大试验转入规模生产时,对最初通过生产验证的3批规模生产的产品仍需进行加速试验与长期稳定性试验。
本指导原则分两部分,第一部分为原料药,第二部分为药物制剂。
4.1一、原料药原料药要进行以下试验。
4.1.1(一)影响因素试验此项试验是在比加速试验更激烈的条件下进行。
其目的是探讨药物的固有稳定性、了解影响其稳定性的因素及可能的降解途径与降解产物,为制剂生产工艺、包装、贮存条件和建立降解产物分析方法提供科学依据。
供试品可以用1批原料药进行,将供试品置适宜的开口容器中(如称量瓶或培养皿),摊成≤5mm厚的薄层,疏松原料药摊成≤1 0mm厚的薄层,进行以下试验。
中国药典2010年版
年版截图:中国药典20102010版中国药典word版pdf版exe版电子书2010版中国药典word版pdf版exe版电子书中国药典2010年版一部正文一枝黄花(p3)YizhihuanghuaSOLIDAGINIS HERBA本品为菊科植物一枝黄花Solidago decurrens Lour.的干燥全草。
秋季花果期采挖,除去泥沙,晒干。
【性状】本品长30~lOOcm。
根茎短粗,簇生淡黄色细根。
茎圆柱形,直径0.2~0.5cm;表面黄绿色、灰棕色或暗紫红色,有棱线,上部被毛;质脆,易折断,断面纤维性,有髓。
单叶互生,多皱缩、破碎,完整叶片展平后呈卵形或披针形,长1~9cm,宽0.3~1.5cm;先端稍尖或钝,全缘或有不规则的疏锯齿,基部下延成柄。
头状花序直径约0.7cm,排成总状,偶有黄色舌状花残留,多皱缩扭曲,苞片3层,卵状披针形。
瘦果细小,冠毛黄白色。
气微香,味微苦辛。
【鉴别】 (1)叶表面观:上表皮细胞多角形,垂周壁略呈念珠状增厚。
下表皮细胞垂周壁波状弯曲,气孔不定式,略下陷。
非腺毛有两类:表皮非腺毛由3个细胞组成,壁薄,顶端1个细胞常萎缩成鼠尾状,较小;叶缘非腺毛睫毛状由3~7个细胞组成,壁稍厚,长180~500μm。
(2)取本品粉末2g,加石油醚(60~90℃)50ml,超声处理30分钟,放冷,滤过,弃去石油醚液,药渣挥干溶剂,加70%乙醇30ml,加热回流1小时,放冷,滤过,滤液蒸干,残渣加甲醇1ml使溶解,作为供试品溶液。
另取一枝黄花对照药材2 g,同法制成对照药材溶液。
再取芦丁对照品,加甲醇制成每1ml含0.5mg的溶液,作为对照品溶液。
照薄层色谱法(附录ⅥB)试验,吸取供试品溶液5~10μl、对照药材溶液和对照品溶液各5μl,分别点于同一以含4%磷酸氢二钠溶液制备的硅胶G薄层板上,以乙酸乙酯-甲醇-甲酸-水(8:1:2010版中国药典word版pdf版exe版电子书1:1)为展示剂,展开,取出,晾干,喷以3%三氯化铝乙醇溶液,晾干,置紫外光灯(365nm)下检视,供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的荧光斑点。
中国药典2010版[1]
![中国药典2010版[1]](https://img.taocdn.com/s3/m/2eed273de2bd960590c67714.png)
计量---计量单位
长度:米,分米,厘米,毫米,微米,纳米
体积:升,毫升,微升 质量:千克,克,毫克,微克,纳克 压力:兆帕,千帕,帕 密度:千克每立方米,克每立方厘米
波数:负一次方厘米
动力粘度:帕秒
试药、试液、指示剂
试药:除另有规定外,选用不同等级并符合 国家有关行政主管部门规定的试剂标准
编排
乙酰唑胺
Acetazolamide
《中国药品通用名称》
按WHO编订的国际非专利 药品名称命名
C4H6N4O3S2,222.25
N-[5-(氨磺酰基)-1,3,4噻二唑-2-基]乙酰胺。 中国化学会《有机化学命名
原则》IUPAC
项目与要求
溶解度
极易溶解 :系指溶质1g(ml)能在溶剂不到1ml 易溶:系指溶质1g(ml)能在溶剂1~不到10ml 溶解:系指溶质1g(ml)能在溶剂10~不到30ml 略溶:系指溶质1g(ml)能在溶剂30~不到100ml 微溶:系指溶质 1g(ml) 能在溶剂 100 ~ 不到 1000ml 中溶 解; 极 微 溶 解 : 系 指 溶 质 1g(ml) 能 在 溶 剂 1000~ 不 到 10000ml 几乎不溶或不溶:系指溶质1g(ml)在溶剂10000ml中不能 完全溶解
主要国外药典标准
(四)《日本药局方》(日本薬局方)
Japanese Pharmacopoeia(简称JP)。
1、目前为第16版。
2、由一部和二部组成,共一册。第一部主要收载原 料药及其基础制剂。第二部主要收集生药、家庭药制 剂和制剂原料。
3、日本厚生省专门出版一本关于抗生素质量标准的 法典《日本抗生物质基准解说》, 简称“日抗基”。
《中国药典》2010年版(三部)凡例、通则

附件:《中国药典》2010年版(三部)凡例、通则及附录定稿会会议纪要按照2010年版《中国药典》编制的统一安排,我委于2009年3月18-20日在京召开了2010年版《中国药典》三部凡例、通则及附录的定稿会。
来自病毒制品、细菌制品、血液制品、生物技术产品以及微生物专业委员会的相关委员、中检所和参与批签发的7个地方药检所的有关专家、我委生物制品标准处、业务综合处相关人员以及部分生物制品生产企业代表共约40人参加了会议。
会议对2010年版《中国药典》三部凡例、9个通则及16个通用性附录的增修订进行了审定,确认了下列增修订意见,会议主要内容纪要如下:一、凡例(一)、名称及编排项下,增订微生态活菌制品总论及体外诊断试剂的收载。
(二)、设施与生产质量管理项下第(2),修订为:人血液制品应使用专用设备并在专用设施内进行生产,不得与其他异种蛋白制品混用。
(三)“制造”项修订为“基本要求”,修订内容为:1、设施与生产质量管理项下增订:(4)涉及感染性材料的操作应符合国家生物安全的相关规定。
2、辅料及原料项下将“原料”修订为“原材料”,质量要求增订应符合现行《中国药典》三部的规定,“本版药典未收载者,必须制定符合药用要求的标准”修订为“本药典未收载者,必须制定符合产品生产和质量控制要求的标准”。
3、增订“七、生产过程中防腐剂使用的相关要求”项,增订内容为:1、抗生素的使用生产过程中抗生素的使用应符合以下原则:(1)除另有规定外,不得使用青霉素或其他β-内酰胺类抗生素。
(2)成品中不得使用抗生素作为防腐剂。
(3)生产过程中,应尽可能避免使用抗生素,必须使用时,应选择安全性风险相对较低的抗生素,且产品的后续纯化工艺应保证可有效去除制品中的抗生素,去除工艺应经验证;如后续工艺不能有效去除抗生素,则不得添加。
病毒性疫苗生产中应仅限于在细胞制备、细胞增殖过程中使用抗生素。
(4)生产过程中使用抗生素时,成品检定中应检测抗生素残留量,并规定残留量限值。
中国药典2010

片剂片剂:片剂是指提取物、提取物加片剂细粉或饮片细粉与十一的辅料混匀压制或用其他适宜方法制成的圆片装或异形片状的制剂、有浸膏剂、半浸膏剂片和全粉片等。
片剂以,口服普通片为主另外有含片、咀嚼片、泡腾片、阴道片、阴道泡腾片和肠溶片等。
口含片指含于口腔内缓慢溶解的压制片,能对口腔及咽部产生持久的药效,用于局部的消炎、消毒等,如草珊瑚含片。
咀嚼片是指于口腔中咀嚼后吞服的片剂。
泡腾片是指含有碳酸氢钠和有机酸遇水可产生气体而呈泡腾状的片剂。
阴道片与阴道泡腾片是指于阴道内是用的片剂。
肠溶片是指肠溶性包衣材料进行包衣的片剂。
片剂在生产与贮藏期间应符合下列有关规定。
(1)用于偏激的要分与辅料应混合均匀。
含药量小的或者有毒性的片剂,应根据药物的性质用适宜的方法使药物分散均匀。
(2)凡属于挥发性或遇热不稳定的药物,在制片过程中应避免受热损失。
(3)压片前的颗粒应控制水分,以适应制片工艺的需要,并防止成品在贮藏期间发霉、变质。
(4)片剂根据需要,可加入娇味剂、芳香剂和着色剂等附加剂。
(5)为增加稳定性、掩盖药物不良臭味或该散片剂万贯等。
可对制成的药片包衣或薄膜衣,对一些遇胃液易破坏刺激胃黏膜或需要在肠道内释放的口服药片,可包肠溶衣,必要时,薄膜衣片剂应检查残留溶剂。
(6)偏激外观应完整光洁、色泽均匀,有适宜的硬度,以避免在包装、贮运过程中发生磨损或破碎。
(7)除另有规定外,片剂应蜜蜂储藏除另有规定外,偏激应进行一下检查。
【重量差异】片剂照下列方法检查,应符合规定。
检查法取供试品20片,精密称定总重量,求得平均片重量后,在分别精密称定每片重量,每片重量应与标识片重量相比较,按规定,超出重量差异的限度不得超过2片,并不得有一片超过限量的1倍。
糖衣片的片芯应质量检查差异符合规定,包糖衣后不在检查重量差异。
除另有规定外,其他包衣应在包衣后检查重量差异病应符合规定。
【崩解时限】除另有规定外,照崩解时限检查法检查,应符合检查。
阴道片照融变时限检查法检查,并应符合规定。
《中国药典》2010年版(一部)

行气止痛,活血 散瘀。用于胃 痛,风湿痹痛; (未改动) 外治牙痛,跌扑 肿痛,虫蛇咬伤 。 理气止痛,温中 助阳。用于胃寒 (未改动) 胀痛,肝胃气 痛,肾虚阳痿, 腰膝酸痛。 原功效中“消 炎”属于西医 术语,原“主 治”中的“支 气管炎,肺炎 ……晚期血吸 虫病腹水”属 于西医病名, 故而删除。参 考《广东地标 》规范为中医 习惯用病证名 。
三叉苦
苦,寒。
原标准中归 经阙如。根 据《广东地 增加“归肺 苦,寒。归肺 标》记载及 、心、肝经 、心、肝经。 功效主治特 ”。 点,补充归 经“肺、肝 ”。
三分三
苦、辛, 温;有大毒 。
苦、辛, 苦、辛,温, 温,有大毒 据《中华本 有大毒。归肝 。归肝、肾 草》主治病 、肾、脾、胃 、脾、胃、 症修订 、大肠经。 大肠经。
《中国药典》2010版中药材及饮片临床标准修订表 中国药典》2010版中药材及饮片临床标准修订表
性味归经原 性味归经修订 性味归经修 性味归经修 后 标准 订的部分 订的理由 原标准中没 将“平”性 有归经,根 改为“凉” 据《中华本 性;“微苦 微苦、辛, 辛、苦,凉。 草》及其功 ”改为“苦 平。 归肺、肝经。 效、主治特 ”。增加归 点,补充归 经“肺、肝 经内容,并 ”。 修改性味。 辛、温;有 小毒。归肝 、脾、胃经 。 辛、温;有小 毒。归肝、脾 未改动 、胃经。 功能主治修订 功能主治修订 用法用量 用法用量 用法用量修订 功能主治原标 功能主治修订后 准 的部分 的理由 原标准 修订后 的部分 疏风清热,抗 菌消炎。用于 感冒,急性咽 喉炎,扁桃体 炎,疮疖肿毒 。 祛风除湿,消 肿止痛。用于 风湿痹痛,半 身不遂,跌扑 肿痛。 温中降逆,补 肾助阳。用于 脾胃虚寒,呃 逆呕吐,食少 吐泻,心腹冷 痛,肾虚阳痿 开窍化痰,醒 脾安神。用于 热病神昏,癫 痫,神经官能 症,耳鸣耳 聋,胸闷腹 胀,食欲不 清热解毒,疏散 风热。用于喉 痹,乳蛾,咽喉 肿痛,疮疖肿 毒,风热感冒。 功效按中医术 语规范。主治 增加“喉痹, 乳蛾”,删去 西医病名 。 规范功能主治 表述,删去西 医病名,突出 9~15g。 本品外解内清 的药用特点。
2010版中国药典-中国药典2010年版

2010版中国药典中国药典2010年版名称:《中华人民共和国药典》中国药典2010版作者:国家药典委员会出版社:中国医药科技出版社2010年10月出版开本:16开精装册数:全三卷定价:1498 元优惠价:980 元读者服务部→发行部:,内容简介:2010年版药典的鲜明特色:更新与淘汰并举、收载品种大幅增加。
药品检测项目和检测方法增加、标准提高,因而在药品安全性和质量可控性方面有更高、更多、更大提升。
二部中采用高效液相色谱法进行含量测定或用于有关物质检查的品种有近千个,系统适用性要求也更为合理,个别品种采用了分离效能更高的离子色谱法,检测器使用种类也更加多样。
中药标准有突破和创新,尤其在过去比较薄弱的中药材和中药饮片标准的新增和修订方面,如本版《中国药典》一部中动物药蛇类、植物药川贝母等,都采用了PCR检测方法。
新版药典在凡例、品种的标准要求、附录的制剂通则等方面均有较大的变化和进步。
在广泛吸取国内外先进技术和实验方法的基础上,附录内容与目前国际对药品质量控制的方法和技术力求一致,进一步发挥《中国药典》的国际影响力。
新版药典在坚持科学、实用、规范、药品安全性、质量可控性和标准先进性的原则下,力求覆盖国家基本药物目录品种和社会医疗保险报销药品目录品种。
顶尖专家扛鼎之作。
本版《中国药典》是在第九届药典委员会的精心组织下,聘请全国医药行业323位一流专家、投入巨额资金、历时两年编制而成,集中体现了当前我国药品标准工作的最新发展成果。
《中国药典》是国家监督管理药品质量的法定技术标准。
2010年版《中国药典》分为三部出版,一部为中药,二部为化学药,三部为生物制品。
各部内容主要包括凡例、标准正文和附录三部分,其中附录由制剂通则、通用检测方法、指导原则及索引等内容构成。
药典二部收载化学药品、抗生素、生化药品、放射性药品以及药用辅料等。
药典三部收载生物制品。
新版药典在凡例、品种的标准要求、附录的制剂通则和检验方法等方面均有较大的改进和发展,特别是对药品的安全性、有效性和质量可控性方面尤为重视。
中国药典2010年版(三部)药材及饮片用量

中华人民共和国药典2010版/中国药典2010版作者:国家药典委员会丛书名:中华人民共和国药典-2010年版【ISBN】:9787506744379出版社:中国医药科技出版社出版日期:2010年1月1日包装:大16开精装3卷总定价:1498.00优惠价:980元内容简介:2010年版药典的鲜明特色:更新与淘汰并举、收载品种大幅增加。
药品检测项目和检测方法增加、标准提高,因而在药品安全性和质量可控性方面有更高、更多、更大提升。
二部中采用高效液相色谱法进行含量测定或用于有关物质检查的品种有近千个,系统适用性要求也更为合理,个别品种采用了分离效能更高的离子色谱法,检测器使用种类也更加多样。
中药标准有突破和创新,尤其在过去比较薄弱的中药材和中药饮片标准的新增和修订方面,如本版《中国药典》一部中动物药蛇类、植物药川贝母等,都采用了PCR检测方法。
新版药典在凡例、品种的标准要求、附录的制剂通则等方面均有较大的变化和进步。
在广泛吸取国内外先进技术和实验方法的基础上,附录内容与目前国际对药品质量控制的方法和技术力求一致,进一步发挥《中国药典》的国际影响力。
新版药典在坚持科学、实用、规范、药品安全性、质量可控性和标准先进性的原则下,力求覆盖国家基本药物目录品种和社会医疗保险报销药品目录品种。
顶尖专家扛鼎之作。
本版《中国药典》是在第九届药典委员会的精心组织下,聘请全国医药行业323位一流专家、投入巨额资金、历时两年编制而成,集中体现了当前我国药品标准工作的最新发展成果。
《中国药典》是国家监督管理药品质量的法定技术标准。
2010年版《中国药典》分为三部出版,一部为中药,二部为化学药,三部为生物制品。
各部内容主要包括凡例、标准正文和附录三部分,其中附录由制剂通则、通用检测方法、指导原则及索引等内容构成。
药典二部收载化学药品、抗生素、生化药品、放射性药品以及药用辅料等。
药典三部收载生物制品。
新版药典在凡例、品种的标准要求、附录的制剂通则和检验方法等方面均有较大的改进和发展,特别是对药品的安全性、有效性和质量可控性方面尤为重视。
中国药典2010年版中药标准

(三)药品安全性得到进一步保障
对规定使用天然牛黄或体外培育牛 黄投料的制剂增加了猪去氧胆酸的 检查,保证了投料准确。(如安宫 牛黄丸、散)
(四)新方法、新技术应用
1、聚合酶链式反应法鉴别 饮片:乌梢蛇、蕲蛇
2、薄层-生物自显影技术法鉴别 地黄、熟地黄(检测成分:毛蕊花糖苷;显
原子 吸收
氮测 定法
挥发 油测 定法
滴定
鞣 质
重量 法
品种 数 850 51 17 29 2 11 4 27 1 3
新增 709 24 8 12 1 9 1 9 1 0
2005版与2010版含量测定项目比较
HPLC GC 2005年版 564 31
UV
TLC-S
原子 吸收
滴定
26 38 1 38
2010年版 1265 70 41 33 2 53
药材:黄芪、枸杞子、金银花、阿胶、西洋参、 白芍、甘草、丹参、山楂
饮片:黄芪、枸杞子、金银花、阿胶、 西洋参 、甘草、山楂
(三)药品安全性得到进一步保障
中成药:
树脂残留物检查(复脉定胶囊) 铅镉砷铜检查(紫血散) 重金属、砷盐检查(黄连上清片等7个品种) 乌头碱限量(固肾定喘丸等32个品种) 三氧化二砷检查(六应丸等10个品种)
5、含量测定增加了较多的新对照品 独一味:山栀苷甲酯和8-o-山栀苷甲酯 知母:芒果苷、知母皂苷BⅡ 青叶胆片:獐牙苦苷 金莲花润喉片:荭草苷
(三)药品安全性得到进一步保障
增加剂型安全性要求: 眼用制剂按无菌制剂要求;
(公告:中国药典关于眼用制剂无菌要求的 具体执行时间将根据《药品生产质量管理 规范》实施的要求另行规定。)
2010版中国药典

2010版中国药典凡例总则一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药品管理法》组织制定和颁布实施。
《中国药典》一经颁布实施,其同品种的上版标准或其原国家标准即同时停止使用。
《中国药典》由一部、二部、三部及其增补本组成,内容分别包括凡例、正文和附录。
除特别注明版次外,《中国药典》均指现行版《中国药典》。
本部为《中国药典》二部。
二、国家药品标准由凡例与正文及其引用的附录共同构成。
本部药典收载的凡例、附录对药典以外的其他中药国家标准具同等效力。
三、凡例是为正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》正文、附录及与质量检定有关的共性问题的统一规定。
四、凡例和附录中采用的“除另有规定外”这一用语,表示存在与凡例或附录有关规定不一致的情况时,则在正文中另作规定,并按此规定执行。
五、正文中引用的药品系指本版药典收载的品种,其质量应符合相应的规定。
六、正文所设各项规定是针对符合《药品生产质量管理规范》(Good Manufacturing Practices, GMP)的产品而言。
任何违反GMP 或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。
七、《中国药典》的英文名称为Pharmacopoeia of The People’s Republic of China, 英文简称Chinese Pharmacopoeia;英文缩写为Ch.P.。
正文八、正文系根据药物自身的理化与生物学特性,按照批准的处方来源、生产工艺、贮藏运输条件等所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。
九、正文项下根据品种和剂型不同,按顺序可分别列有:(1)品名(包括中文名称、汉语拼音与英文名);(2)有机药物的结构式;(3)分子式与分子量;(4)来源或有机药物的化学名称;(5)含量或效价规定;(6)处方;(7)制法;(8)性状;(9)鉴别;(10)检查;(11)含量或效价测定;(12)类别;(13)规格;(14)贮藏;(15)制剂等。
《中国药典》2010年版(二部)

283
158 23 1871
261 / 15
144 / 24 0 1448
92.2%
91.1% 0 77.4%
化学药中由于未找到样品而未修订的品种有306个,占保留上版品种21.8%
2010年版与2005年版药典主要项目收载情况比对表
增修订项目 红外光谱鉴别 有关物质 残留溶剂 渗透压摩尔浓度 溶出度或释放度 含量均匀度 无菌检查方法 细菌内毒素 含量测定 HPLC法 原料 制剂 HPLC方法 2005年版 530 2 142 24 4 315 165 107 216 359 2010年版 580 73 707 97 45 414 219 132 372 694
依法进行该项检查外,其他未在“残留溶剂”项下明确列出的有机溶
剂与未在正文中列有此项检查的品种,如生产过程中引入或产品中残 留有机溶剂,均应按本版药典附录“残留溶剂测定法”检查并应符合
相应溶剂的限度规定。
主要内容
1 3 2 3 4 5 3 二部特点及品种收载情况
凡例的增修订情况
各论的增修订情况 现代分析技术的应用
脏器均应来自经检疫的健康动物,涉及牛源的应取自无牛海绵状脑病
地区的健康牛群;来源于人尿提取的药品,均应取自健康人群。上述 药品均应有明确的病毒灭活工艺要求以及质量管理要求。
凡例的增修订情况
项目与要求
• 十七、(第二段)对于生产过程中引入的有机溶剂,应在后续的生产 环节予以有效去除。除正文已明确列有“残留溶剂”检查的品种必须
Байду номын сангаас
应关注晶型和药效的关系。如确需利用熔点作为控制晶型的手段,则 标准中应收入。
各论的增修订情况(1):名称与性状
比旋度(原料药)
2010年版中华人民共和国药典第一部中药.套

2010年版中华人民共和国药典第一部中药.作:中华人民共和国药典编委会中国医药科技出版社2010年1月出版16开精装全一册光盘:0定价:648元优惠:596元..详细:.......................................... ...................................................... ............《中国药典》是我国药品标准体系的核心,是药品研究、生产、经营、使用和监管的法定依据。
本版《中国药典》为新中国成立以来的第九版药典将分为中药、化学药、生物制品三部出版。
新版药典收载药品品种达到4615个,形成了中药材、中药饮片、中成药等各类齐全的药品标准体系,基本覆盖国家基本药物目录品种的需要。
2010年版《中国药典》分为三部出版,一部为中药,二部为化学药,三部为生物制品。
各部内容主要包括凡例、标准正文和附录三部分,其中附录由制剂通则、通用检测方法、指导原则及索引等内容构成。
药典二部收载化学药品、抗生素、生化药品、放射性药品以及药用辅料等。
药典三部收载生物制品。
新版药典在凡例、品种的标准要求、附录的制剂通则和检验方法等方面均有较大的改进和发展,特别是对药品的安全性、有效性和质量可控性方面尤为重视。
新版药典在继承前版药典的基础上,做了大量发展和创新性的工作。
本版药典具有以下几个特点:新增与淘汰并举,收载品种有较大幅度的增加;二是药品检测项目和检测方法增加,标准提高;三是中药标准有突破和创新;四是新版药典在凡例、品种的标准要求、附录的制剂通则等方面均有较大的变化和进步;五是力求覆盖国家基本药物目录品种和社会医疗保险报销药品目录品种;六是顶尖专家扛鼎之作。
本版药典聘请全国医药行业323位一流专家学者、投入巨额资金、历时两年编制而成,集中体现了当前我国药品标准工作的最新发展成果。
2010年版《中国药典》在2005年版的基础上,做了大幅度的增修订和新增品种的工作。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020/5/25
Page 10
附录ⅠH 丸剂增修概况与解读
定义:丸剂系指药物与适宜的辅料以适当方法制成的球状或类球状
固体制剂。
基本分类:滴丸、糖丸、小丸等。
滴丸 系指固体或液体药物与适宜的基质加热熔融后溶解、乳化或混 悬于基质中,再滴入不相混溶、互不作用的冷凝(液)介质中,…。
糖丸 系指以适宜大小的糖粒或基丸为核心,用糖粉和其他辅料的混 合物作为(撒粉)材料,…。
附录ⅠB注射剂增修概况与解读(三)
3. 第三点: …。所用附加剂应不影响药物疗效,避免对检验产生干扰, 使用浓度不得引起毒性或明显(过度)的刺激。常用的抗氧剂有亚硫 酸钠、亚硫酸氢钠和焦亚硫酸钠等,…。
4. 第四点: …。容器用胶塞特别是多剂量包装注射液用的胶塞要有足 够的弹性和稳定性,其质量应符合有关国家标准规定。除另有规定 外,容器应足够透明,以便内容物的检视。
2020/5/25
Page 22
附录ⅠC 酊剂增修概况与解读
酊剂 系指将药物用规定浓度的乙醇浸出或溶解而制成的澄清液
体制剂,也可用流浸膏稀释制成。供口服或外用。
一般要求:
四、酊剂应检查乙醇量。(增加第四点,其他点相应后移)
必检项目:
【甲醇量】 口服酊剂照甲醇量检查法(一部附录Ⅸ T)检查,应 符合规定。(增加相应检查项目)
2020/5/25
Page 6
附录ⅠA 片剂增修概况与解读(一)
含片 1.定义:系指含于口腔中,药物,药物缓慢溶化(解)产生(持久)
局部或全身作用的片剂 2.含片的溶化性照崩解时限检查法(附录Ⅹ A)检查,除另有规定 外,10分钟内不应全部崩解或溶化(30分钟内应全部崩解)
咀嚼片 定义:系指于口腔中咀嚼(或吮服使片剂溶化)后吞服(,在胃肠道中发挥
2020/5/25
Page 8
附录ⅠA 片剂增修概况与解读(三)
片剂在生产与贮藏期间应符合下列规定(属于一 般要求)
1. 第五点:为增加稳定性、掩盖药物不良臭味、改善片剂外观等,可 对片剂进行包衣。必要时,薄膜包衣片剂应检查残留溶剂。(把第 七点部分内容归类)
2. 第六点:片剂外观应完整光洁,色泽均匀,有适宜的硬度和耐磨性, 以免包装、运输过程中发生磨损或破碎,除另有规定外,对于非包 衣片,应符合片剂脆碎度检查法的要求(防止包装、运输过程中发生磨损 或破碎)(内容前移,叙述更合理)
基本分类:注射液、注射用无菌粉末与注射用浓溶液。
主要特点
1. 作用迅速、疗效可靠(抢救危重病症等); 2. 适用于不易口服患者(昏迷、抽搐、惊厥等); 3. 适用于不宜口服药物(胃肠道不稳定、不吸收、刺激性等); 4. 发挥局部定位作用(介入疗法、局麻等) 5. 使用不便、注射疼痛、成本高、风险大。
除另有规定外,眼用制剂应进行以下相应检查 (必检项目)
【渗透压摩尔浓度】 除另有规定外,水溶液型滴眼剂、洗眼剂和 眼内注射溶液按各品种项下的规定,照渗透压摩尔浓度测定法(附 录Ⅸ G)检查,应符合规定。
【无菌】 (眼内注射溶液、眼内插入剂及供手术、伤口、角膜穿通伤用的眼用 制剂,)照无菌检查法(附录Ⅺ H(J))检查,应符合规定。
一、制剂通则(二部)增修订概况
修订总数:10种制剂通则
具体内容
固体制剂:片剂、丸剂、颗粒剂 灭菌与无菌制剂:注射剂、眼用制剂 液体制剂:搽剂涂剂涂膜剂、糖浆剂、酊剂 其他制剂:气雾剂粉雾剂喷雾剂、凝胶剂
2020/5/25
Page 4
(一)固体制剂
固体制剂定义:新药研发中的首选剂型,在所有药物剂型中占
定义:眼用制剂系指直接用于眼部发挥治疗作用的无菌制剂。
(局部作用为主,亦有全身作用报道)
基本分类:眼用液体制剂(滴眼剂、洗眼剂、眼内注射溶液)、
眼用半固体制剂(眼膏剂、眼用乳膏剂、眼用凝胶剂)、眼用固体 制剂(眼膜剂、眼丸剂、眼内插入剂)等。眼用液体制剂也可以固 态形式包装,另备溶剂,在临用前配成溶液或混悬液。
2020/5/25
Page 9
附录ⅠA 片剂增修概况与解读(四)
除另有规定外,片剂应进行以下相应检查(必检 项目)
【分散均匀性】 分散片照下述方法检查,应符合规定。
检查法 取供试品6片,置250ml烧杯中,加15~25℃的水100ml,振 摇3分钟,应全部崩解并通过二号筛。
原方法(检查法 取供试品2片,置20℃±1℃的100ml水中,振摇3 分钟,应全部崩解并通过二号筛。)
2020/5/25
Page 23
附录ⅠK 糖浆剂增修概况与解读
糖浆剂 系指含有药物的浓蔗糖水溶液。供口服用。
影响吸收的因素:
1. 眼睑缝隙损失(7~30μl,1滴药液约50~70μl) 2. pH和pKa值(分子型>离子型药物,双亲性药物更易吸收) 3. 刺激性、表面张力、粘度等 4. 外周血管消除(结膜→外周→消除)
2020/5/25
Page 19
附录ⅠG 眼用制剂增修概况与解读(一)
滴眼剂 系指由药物与适宜辅料制成的供滴入眼内的无菌液体制
2020/5/25
Page 14
附录ⅠB注射剂增修概况与解读(一)
注射液 包括(系指药物制成的供注射入体内用的无菌)溶液型(注射液)、
乳状液型(注射液)或混悬型注射液。可用于肌内注射、静脉注射、 静脉滴注等。其中,供静脉滴注用的大体积(除另有规定外,一般 不小于100ml)注射液也称静脉输液。
注射用浓溶液 系指药物制成的供临用前稀释(供)后静脉滴
【溶化性】 泡腾颗粒 因一般装量较大,测定数由6袋修订为3袋
2020/5/25
Page 12
(二)无菌与灭菌制剂
基本定义:系指直接注射于体内或直接用于创伤面、粘膜等的一
大类制剂。
灭菌制剂:系指采用物理、化学方法杀灭或除去所有活的微生物
繁殖体和芽孢的一类制剂。
无菌制剂:系指采用无菌操作方法或制备技术的不含任何活的微
5. 第五点: …。注射剂必要时应进行相应的安全性检查,如异常毒 性、过敏反应、溶血与凝聚、降压物质、热原或细菌内毒素等,均 应符合要求。(与现有法规要求一致)
6. 第九点:注射剂所用辅料,在标签或说明书中应标明其名称,抑菌 剂还应标明浓度;注射用无菌粉末,应标明注射用(所用)溶剂。
修订内容较多,特别关注!
有率高达70%以上,其主要优势: 1. 物理、化学、生物学性质稳定; 2. 生产成本低,储存、携带方便; 3. 制造过程前处理操作单元相同; 4. 各固体剂型间质量控制关系密切等。
基本分类:散剂、颗粒剂、丸剂、胶囊剂和片剂等
2020/5/25
Page 5
(一)固体制剂(附录ⅠA 片剂)
定义:片剂系指药物与适宜的辅料混匀压制而成的圆片状或异形
2. 第二点:注射剂所用的原辅料应从来源及工艺等生产环节进行严格 控制并应符合注射用的质量要求。注射剂所用溶剂必须安全无害, 并不得影响疗效和质量。一般分为水性溶剂和非水性溶剂。
(2)非水性溶剂:…。供注射用的非水性溶剂,应严格限制其用量, 并应在品种项下进行相应的检查。
0/5/25
Page 16
片状的固体制剂。
基本分类:口服普通片为主,另有含片、舌下片、口腔贴片、咀
嚼片、分散片、可溶片、泡腾片、阴道片、阴道泡腾片、缓释片、 控释片与肠溶片等(亚剂型)
片剂作为最常用口服剂型,其种类较多、发展较快,各国药典收载 的制剂中以片剂为最多。但易出现溶出、释放、生物利用度问题; 特殊人群不易吞服;挥发性组分不易保存等。
2020/5/25
Page 17
附录ⅠB注射剂增修概况与解读(四)
除另有规定外,注射剂应进行以下相应检查(必 检项目)
1. 【装量】 注射液及注射用浓溶液照下述方法检查,应符合规定。 检查法 …,将内容物分别用相应体积的干燥注射器及注射针头抽 尽,然后注入经标化的(量具)量入式量筒内((量具)量筒的大小应 使待测体积至少占其额定体积的40%)…。
《中国药典》2010年版 制剂通则增修订概况与解读
1
制剂通则增修订总体原则
注重一个“严”字 新立项较多 增修订慎重 定稿时稳重
☆ 加快追赶国际先进水平的步伐
2020/5/25
Page 2
内容提要
➢一、制剂通则(二部) ➢二、制剂通则(一部) ➢三、制药用水和指导原则
2020/5/25
Page 3
删除【微生物限度】检查
2020/5/25
Page 21
(三)液体制剂
基本定义:液体制剂系指药物分散在适宜的分散介质中制成的可
供内服或外用的液体形态的制剂
基本分类:均相(溶液剂、高分子溶液剂等)和非均相(溶胶剂、
乳剂、混悬剂等)
主要特点:
1. 分散度大、吸收快、药效迅速(与固体制剂比较) 2. 易于分剂量、服用方便,特别适合婴幼儿和老人 3. 给药途径多(胃肠道、腔道、皮肤、粘膜等) 4. 可降低某些药物的刺激性(如碘或溴化物等) 5. 可提高某些药物AUC 6. 但不稳定(物理、化学与生物学)、携带和运输不便、可能含防腐剂等
2. 【渗透压摩尔浓度】 除另有规定外,静脉输液及椎管注射用注射 液按各品种项下的规定,照渗透压摩尔浓度测定法(附录Ⅸ G)检 查,应符合规定。(新增检查项目,通过总体控制复杂处方组分每批次
加入量,从另一角度检测产品质量的重现性、可控性等)
2020/5/25
Page 18
附录ⅠG 眼用制剂增修概况与解读
剂。可分为水性或油性(澄明)溶液、混悬液或乳状液(,供滴入的眼
用液体制剂,也可将药物以粉末、颗粒、块状或片状形式包装,另备溶剂,在临用
前配成澄明溶液或混悬液)。
眼用制剂在生产与贮藏期间(一般要求)
1. 装量:除半固体制剂增加除另有规定外,其他均为文字统一的修改 2. 第三点:洗眼剂属用量较大的眼用制剂,应(基本)尽可能与泪液等
