基于定量PCR技术探讨紫杉醇生物合成的限速步骤
工厂化生产紫杉醇的流程

工厂化生产紫杉醇的流程英文回答:The process of industrial production of paclitaxel, also known as Taxol, involves several steps. Paclitaxel is a natural compound found in the bark of the Pacific yew tree (Taxus brevifolia), but its extraction from the treeis not a sustainable option due to the slow growth rate and limited availability of the tree. Therefore, scientists have developed a synthetic process to produce paclitaxel in large quantities.The first step in the production of paclitaxel is the isolation of the precursor compound, 10-deacetylbaccatin III, from renewable plant sources such as the needles of the European yew tree (Taxus baccata) or the leaves of the English yew tree (Taxus baccata). This compound is then converted into paclitaxel through a series of chemical reactions.One of the key reactions in the synthesis of paclitaxel is the acylation of 10-deacetylbaccatin III with acetic anhydride. This reaction is catalyzed by an enzyme called acetyltransferase, which is isolated from a fungus called Aspergillus aculeatus. The acetylation reaction converts10-deacetylbaccatin III into paclitaxel, which is then purified through various techniques such as chromatography and crystallization.Another important step in the production of paclitaxel is the modification of the side chain of the molecule. This is achieved through a series of chemical reactions that involve the introduction of various functional groups. For example, the hydroxyl group on the molecule can be converted into a carbamate group, which enhances the stability and solubility of paclitaxel.Once the synthesis and purification steps are complete, the paclitaxel is formulated into a suitable dosage formfor administration. This can be in the form of aninjectable solution or a solid dosage form such as a tablet or a capsule. The formulation process involves the additionof excipients such as solvents, stabilizers, and preservatives to ensure the stability and efficacy of the final product.The industrial production of paclitaxel requires a combination of organic chemistry, enzymology, andformulation science. It involves the use of various raw materials, reagents, and equipment such as reactors, centrifuges, and chromatography columns. The process is carefully controlled to ensure the quality, purity, and consistency of the final product.中文回答:工厂化生产紫杉醇的过程涉及几个步骤。
紫杉醇的生物合成

紫杉醇的生物合成吴雪琼田朝霞梅兴国(华中理工大学生物系,武汉430074关键词紫杉醇生物合成1.引言紫杉醇(Paclitaxel,商品名为T axo l,是从紫杉树皮中分离提取到的一种天然抗肿瘤物质。
1992年,美国FDA已批准将其用于治疗难治的卵巢癌和转移性乳腺癌。
紫杉醇独特的抗癌活性机制在于它属于有丝分裂抑制剂或纺锤体毒素,不但能抑制细胞的有丝分裂、纺锤体和纺锤丝的形成,从而阻止癌细胞的繁殖,而且能通过诱导和促进微管蛋白的聚合和装配,阻止微管发生解聚,使微管稳定,因而对于许多耐常规化疗药物的肿瘤有活性,应用前景十分广阔。
现在,随着紫杉醇应用范围的不断扩大,该药的需求量远远大于供应量,药源短缺这一矛盾不断深化。
为解决这一矛盾,国内外正积极发展相关技术以期开发紫杉醇的新来源,如化学全合成法、半合成法、人工栽培繁殖法、组织细胞培养法等等。
其中,生物合成紫杉醇或利用生物转化方法对其结构进行修饰与改造以获取“第二代紫杉醇类抗癌药”将是最有希望的一条解决途径。
对细胞培养中紫杉醇生物合成途径的研究,特别是对其中限速步骤的确定和调控,将大大提高细胞培养中紫杉醇的产量,使细胞培养的产业化成为可能,同时,对紫杉醇进行生物转化,以获得更高效、低毒的第二代紫杉醇类抗癌药也是十分必要的。
2.紫杉醇的生物合成2.1母核的形成在90年代以前,人们对紫杉醇的生物合成途径起始阶段几乎一无所知。
只是到近年来,科学家们才逐步揭开其神秘的面纱。
1991年N edea等通过(3R[2214C]和(3R S(5R S[523H]甲羟戊酸在T. canad ensis 植物体内的标记实验揭示了紫杉醇的母核是甲羟戊酸途径的产物[1、2]。
1995年,华盛顿州立大学C ro teau及其同事们终于确定了紫杉醇生物合成起始的一步,即紫杉醇A、B、C三环结构的形成[3]。
反应是紫杉醇前体双牛基焦磷酸的环化,形成紫杉24(5,11(122二烯(图1。
紫杉醇生物合成途径及合成生物学研究进展

紫杉醇生物合成途径及合成生物学研究进展作者:匡雪君 王彩霞 邹丽秋李滢孙超来源:《中国中药杂志》2016年第22期[摘要] 紫杉醇是一种从红豆杉植物中提取的具有显著抗癌效果的萜类次生代谢产物。
作为有效的抗癌药物,目前生产主要依赖于红豆杉,供求矛盾十分突出。
近年来,利用合成生物学技术建立新的紫杉醇来源途径已成为研究热点。
目前,紫杉醇合成途径基本框架已经确定;参与紫杉醇合成相关酶基因大部分已被克隆和鉴定;已经在大肠杆菌和酿酒酵母中异源合成了紫杉醇的前体物质紫杉烯和5α羟基紫杉烯。
该研究对紫杉醇生物合成途径及紫杉醇药物中间体在大肠杆菌和酿酒酵母工程细胞中的合成进展进行了综述,以期为生物合成紫杉醇进一步研究提供参考。
[关键词] 紫杉醇;合成途径;合成生物学Recent advances in biosynthetic pathway and synthetic biology of taxolKUANG Xuejun1, WANG Caixia2, ZOU Liqiu1, LI Ying1, SUN Chao1*(1. Institute of Medicinal Plant Development, China Academy of Medical Sciences and Peking Union Medical College,Beijing 100193, China;2. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences,Beijing 100700, China)[Abstract] Taxol, a kind of terpenoid secondary metabolite produced by Taxus brevifolia, is an effective anticancer drug that manufacture relies mainly on the extraction form plants. In order to solve the resource shortage, a lot of work has been done to develop the alternative method. Recently, using synthetic biology to realize heterologous biosynthesis of the precursors of taxol has become a hotspot. Now, the basic framework of taxol biosynthetic pathways has been confirmed,and most enzyme genes involved in taxol biosynthesis have been cloned and identified. The two taxol precursors, taxa4(5),11(12)diene and taxa4(20),11(12)dien5αol, have been synthesized in Escherichia coli and Saccharomyces cerevisiae. Here this paper reviewed the recent advances in the biosynthetic pathway of taxol and the latest developments of synthetic biology,which aims to provide a guidance for the heterologous biosynthesis of taxol.[Key words] taxol; biosynthetic pathway; synthetic biologydoi:10.4268/cjcmm20162210紫杉醇是一种复杂的四环二萜类化合物,1971年首次由Wani等从短叶红豆杉Taxus brevifolia Nutt.树皮中提取出来并确定其结构[1]。
紫杉醇微生物合成途径相关酶基因的克隆与表达

紫杉醇微生物合成途径相关酶基因的克隆与表达紫杉醇是一种从红豆杉树中发现的具有抗肿瘤作用的二萜类化合物,目前已广泛的在临床上应用于卵巢癌、宫颈癌、乳腺癌等多种癌症的治疗,且疗效明显。
紫杉醇的生产方法主要有红豆杉栽培法、化学合成法、细胞培养法、微生物发酵法等。
药源不足是长期以来制约紫杉醇在临床中广泛应用的瓶颈问题,也成为研究的热点。
利用基因工程技术构建紫杉醇高产菌株有望在较短的时间内显著提高紫杉醇产量,然而目前有关产紫杉醇微生物的遗传背景尚不清楚,对于微生物合成紫杉醇的代谢途径及相关酶的研究也未见报导,因此对于微生物合成紫杉醇的代谢途径及相关酶的研究及阐明十分必要。
本试验研究以从东北红豆杉中分离的产紫杉醇内生真菌选育获得的工程菌株HDF-68为出发菌株,根据GenBank中紫杉醇生物合成途径相关酶基因序列设计引物,利用RT-PCR技术克隆菌株HDF-68生物合成紫杉醇的相关酶基因。
结果表明,本试验成功克隆得到了 GGPP合成酶、紫杉二烯5α-羟化酶、紫杉二烯5α-醇-乙酰基转运酶以及紫杉烷10β-羟化酶4种相关酶基因的cDNA全长;同时,通过Blast分析表明,得到的4种酶基因基因序列与GenBank中已经提交的相对应基因同源性达到99%-100%。
将获得的酶基因片段双酶切后连接到具有相同双酶切位点的表达载体pET28a上,转化E.coli BL21(DE3)进行原核表达验证;用0.05mmol/LIPPTG诱导重组子进行表达培养,试验中研究了各自最佳诱导时间。
SDS-PAGE电泳结果分析表明,克隆得到的酶基因片段中,GGPP合成酶基因、紫杉二烯5α-羟化酶基因以及紫杉二烯5α-醇-乙酰基转运酶基因均在E.coli BL21(ED3)中实现了高效表达。
试验中同时对重组菌株蛋白表达形式进行了分析,结果表明,GGPP合成酶基因、紫杉二烯5α-羟化酶基因表达出了可溶性蛋白;另外,本试验对表达蛋白的基本性质及结构进行了生物信息学预测,为后续的进一步研究奠定了理论基础。
紫杉醇的合成

2.重组菌的构建及影响
图1.在下游途径恒定的情况下改变上游途径的强度对紫杉二烯积累的影响
图2.在恒定的上游途径下依赖于下游途径的紫杉二烯的变化
图3.在两个不同的下游途径表达(31和61个任意单位)及菌株1724的上游途径高度过表达时紫杉二烯的变化;
图4.通过增强启动子使两个不同的下游途径表达(31和61个任 意单位)来调整上游途径基因的整合
补料分批式培养的基因工程菌在1l发酵罐中的发酵情况?通过跨膜转运工程tm和cyp450酶类嵌合体的产生使某些植物的cyp450和细胞色素还原酶cpr已可在大肠杆菌中表达为生物合成的功能性分子构建了嵌合体酶at24t5aohttcpr使第一步氧化反应能高效地进行导致至少98的紫杉二烯转化为紫杉二烯5醇并有少量环己烷产生嵌合体酶at24t5aohttcpr产生紫杉二烯5醇的能力提高了两倍以上达到了21mgl嵌合体酶的的表达功能可变如可构建为at8t5aohttcprat24t5aohttcpr及at42t5aohttcpr导致出现了复杂的结构重排使紫杉二烯被环醚化
E.重组大肠杆菌K12MG1655 DrecADendA;EDE3-重组大肠杆 菌K12MG1655 DrecADendA在 RNA聚合酶的作用下将DE3 T7启 动子结合;MEP, dxs-idi-ispDF 启 动子; GT, GPPS-TS 启动子; TG, TS-GPPS启动子; Ch1,染色体1个拷 贝; Trc, Trc启动子; T5, T5启动子; T7, T7 启动子; p5, pSC101 质粒; p10, p15A 质粒; p20, pBR322 质粒
Author: Parayil Kumaran Ajikumar, Wen-Hai Xiao, Keith E. J. Tyo, et al
紫杉醇真菌发酵试验方案

紫杉醇真菌发酵试验方案1、培养基种子培养基:马铃薯200 g (去皮煮汁,过滤取液),蔗糖20 g,水1 L。
配制方法是马铃薯去皮切条,水煮30 min,4 层纱布过滤,溶入蔗糖,然后加水定容,121℃灭菌30 min,在超净工作台内倒平板。
发酵培养基:葡萄糖5 g /L,蔗糖15 g /L,蛋白胨1 g /L,醋酸钠1 g /L,MgSO4 2. 5 mg /L,C a (NO3) 2 10 mg /L,CuSO4 10 mg /L,ZnSO4 5 mg /L,M nCl2 2. 5 mg /L,FeCl3 2 mg /L,KH2 PO4 100mg /L,维生素B1 5 mg /L,维生素B6 5 mg /L,甲醇10mL /L,油酸5mL /L。
2、菌株活化在冰箱中保存的平板菌种上取10m m×10 mm大小的菌块接种,转接于种子培养基中,200 r/m in摇床上28 ℃黑暗培养3 d。
3、液体培养(1)摇瓶培养实验将内生真菌菌株接种到发酵培养基中,培养3 d后取6 m l接入250 m l三角瓶中,28℃、220 r/min,每瓶60m l培养7 d。
(2)发酵罐培养实验将内生真菌菌株接种到发酵培养基中,培养3 d后取6 0m l接入2500 m l发酵罐中,28℃、220 r/min,培养7 d。
4、紫杉醇粗提将发酵液4 000 r/m in离心,取上清液于60 ℃下旋转蒸发至1 /10体积后,加入等体积乙酸乙酯在超声波下萃取1 h,收集乙酸乙酯层,沉淀的菌体用组织捣碎仪处理后,经低温冻融2次,加入一定量乙酸乙酯用超声波细胞破碎仪破碎细胞。
加入等体积乙酸乙酯超声波提取1 h,收集乙酸乙酯层。
菌体沉淀和上清液再加入等体积的乙酸乙酯超声波提取2次。
合并乙酸乙酯层,并于50 ℃下旋转蒸发至干,加入适量甲醇溶解洗涤固体,再加入体积比为1:1的二氯甲烷-水混合液萃取后,将二氯甲烷层45 ℃旋转蒸发至干,用少量甲醇溶解过滤。
紫杉醇的合成路线及作用机理

进一步的研究还发现紫杉醇还可调节体内的免疫功能,通过 作用于巨噬细胞,导致癌坏死因子TNF-α受体(TNFR)的 减少以及TNF-α的释放,还可以促进白细胞介质IL-1等及干 扰素IFN-α、IFB-β的释放,对癌细胞起杀伤或抑制作用。 血清中出现的一种能使多种肿瘤发生出血性坏死的物质,命 名为肿瘤坏死因子(TNF)。 1985年Shalaby把巨噬细胞产生的TNF命名为TNF-α。 可溶性TNFR:TNF结合蛋白(TNF-BP)是TNFR的可溶形式。 TNF-BP可与YNF特异结合,抑制TNF活性。HIV感染、肾功 能不全及患肿瘤时可升高。
偶合
六、 Mukaiyama全合成路线(1998)
以开链化合物48为起始反应物,通过加人适合 的保护基团等反应可得到构象非常合适的线型化合 物49、50,再通过醇醛缩合进行环化得到立体化学 非常明确的含有B环的化合物51、52,然后通过Mi— chael加成得到化合物53,再通过分子内的醇醛缩合 完成C环与B环的构建(化合物54)。通过在化合物54上 C一1引入烯丙基和分子内的Pinacol反应完成了ABC 环的结构(化合物55、56、57),再通过溴代入臭氧化 等反应引入D环。最后再完成侧链的加入,从而最终 得到了目标产物紫杉醇
verhenon
五、 Kuwajima全合成路线(1998)
由炔丙醇(propargyl alco—ho1)为起始物经过 16步反应制备了含A环体系的化合物39,再与含 c环结构的化合物4O偶合得到含AC环的化合物4l、 42,化合物42通过一个新颖的环化反应完成八元 B环的构建从而得到含ABC环骨架的化合物43, 进一步反应可得到化合物44、45,通过环丙烷中 问体在化合物45中引人C一8位甲基得到化合物 46,在通过一系列引人保护基团完成c一1O位乙 酰化得到化合物47,再通过臭氧化等反应完成含 氧D环的合成。最终制备出baccatin III(2)和紫杉 醇(1)(图8)。 化合物4O是由2一溴.2.环已烯酮经八步反 应制得。
紫杉醇的生物合成

L/O/G/O
Thank You!
工艺过程
• 细胞悬浮培养:培养基为含1ppm的2,4-D、 0.05ppm的KT及10%椰乳的B-5培养基
• 红豆杉细胞大量培养:培养基与悬浮细胞培养基相 同。在反应器中加入培养液,灭菌后冷却至室温, 接种已经培养30天的悬浮培养细胞,接种量按干细 胞1到2克每升,在25摄氏度下,培养30天,待收获 细胞。
提取。
从红豆杉中提取
• 紫杉醇在植物体内的含量相当低,目前公认含量最 高的短叶红豆杉树皮中也仅含0.069%
• 资源很匮乏 • 红豆杉生长缓慢, 树皮剥去后不能再生, 树木将死亡
红豆杉怀璧获罪
由于美国、加拿大等国家对红豆杉立法保护,药源地转向了中国等 国家。在 中国,80%的红豆杉集中在云南,而且云南红豆杉的紫杉醇含量 最高。
2
愈伤组织的代培养
3
悬浮细胞培养
4
细胞大量培养
工艺过程
• 红豆杉外植体的处理:用自来水充分洗净,再用 70%乙醇冲洗表面后切成小块,在70%乙醇中浸泡2 分钟,再转移至0.1%升汞溶液中浸泡20分钟,然后 用无菌水冲洗4到5次,备用。
• 愈伤组织诱导及培养:将上述无菌红豆杉嫩茎小块 组织接种于含2ppm的2,4-D、0.5ppm的KT及10% 椰乳的MS培养基中,于25摄氏度的二氧化碳培养箱 中培养40天,PH5.8,即可形成小的愈伤组织块,然 后每隔30天进行一次移植继代培养。每次移植继代 培养均取一块愈伤组织,不另其混杂,如此多次移 植继代培养即可获得多个愈伤组织无性系。
1993年,民营企业云南汉德公司成立,其主要业务是从红豆杉中提 取紫 杉醇。1995年,汉德公司依靠中科院昆明植物研究所的技术,建成 了中 国最大的年生产能力50公斤的紫杉醇及其系列产品生产线。1999 年2 月,该厂的产品还通过了美国FDA认证,“顺利扫清了通向美国市场 的障 碍”。
紫杉醇的生产技术分析

cP450羟基化限制,可能需要与其同源的cP450还原酶共同表达 才能发挥作用。用微生物宿主来合成紫杉醇仅停留在实验室水 平,微生物代谢的通路和原理复杂,给紫杉醇的批量生产制造 了障碍,较于化学合成固定的途径,微生物可以在未来被基因 工程等方式改造来达到紫杉醇生产的商业化,前景较为广。
1.4 紫杉醇的植物组织培养 利用植物组织培养批量生产紫杉醇被认为是一种可行的 方法。植物组织培养不受地域和季节变化限制,摆脱了多变的 自然条件,人为控制可以连续的提供品质均一的紫杉醇;同时 不产生毒副产物,环境友好,还可根据不同部位的营养需求精 确设置营养条件,使植株生长较快,周期短。植物组织培养生 产紫杉醇的首个专利在1991年提交[4],产量达1~3mg/L。EunKyong Lee等利用先天未分化的形成层分生组织细胞(CMC) 进行培养,此类细胞的生长变异性低,聚集体较小,对剪应 力不敏感。使得其紫杉醇的产量远远大于传统的去分化细胞 (DDC),为可持续生产提供经济高效且环保的平台。徐志荣 以南方红豆杉一年生枝条诱导愈伤组织,建立了细胞悬浮培养 体系[3],发现适合紫杉醇合成的理化条件。此类研究为紫杉醇 未来的扩大生产提供参考。
代中药,2016,18(1):126-130. 作者简介 李旭恒(2000-),男,山西运城人;现就读学校:西华大学食
品与生物工程学院,专业:酿酒工程,本科。
128 科学与信息化2021年4月中
2 展望 全合成途径的复杂与成本昂贵,此方法生产大批量的紫杉
醇难以实现。当前可行的方案有半合成方法和植物组织培养。 目前商业上所使用的多为半合成法,植物组织培养配合于控制 技术的完善,具有大规模生产的潜力。目前,在大规模的生产 器中保证细胞或植株的活性与产量是一大问题;随代谢工程进 入人们的视野,可以改善紫杉醇的生物合成路线使产物在细胞 中高效表达从而达到大规模的生产。总之,紫杉醇的大规模生 产仍需要多学科的交汇,将此“癌症杀手”进一步扩大生产达 到社会的需求仍是科学研究的一大目标。
紫杉醇生物体内合成过程

紫杉醇生物体内合成过程
紫杉醇是一种天然产物,最初是从紫杉树(Taxus brevifolia)中提取的。
紫杉醇的生物体内合成过程涉及植物细胞中的多个生物
化学途径和酶的作用。
以下是紫杉醇在植物体内合成的一般过程:
1. 起始物质,紫杉醇的生物合成起始物质是丙酮和葡萄糖。
这
些起始物质通过植物体内的代谢途径被转化为更复杂的中间体。
2. 萘乙酰辅酶A的合成,在生物体内,丙酮和葡萄糖首先被转
化为萘乙酰辅酶A,这是紫杉醇合成途径的第一步。
3. 萘前体的合成,萘乙酰辅酶A接下来被转化为一系列的中间体,最终形成萘类化合物。
4. 萘类化合物的重排和环化,这些萘类化合物经过一系列酶催
化的反应,发生重排和环化反应,形成紫杉醇的前体物质。
5. 紫杉醇的合成,紫杉醇的前体物质最终被转化为紫杉醇,这
是通过多个酶催化的复杂反应完成的。
需要指出的是,紫杉醇的生物合成过程是一个复杂的生物化学过程,涉及多个酶的作用和多个中间产物的转化。
这个过程在植物细胞内进行,受到细胞内环境和调控因素的影响。
此外,紫杉醇的生物合成过程也是植物生物技术研究的热点之一,对其生物合成途径的研究有助于开发紫杉醇的生物合成技术,以满足医药和工业上对紫杉醇的需求。
紫杉醇制备工艺原理及流程

紫杉醇制备工艺原理及流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!紫杉醇是一种重要的抗肿瘤药物,其主要来源于太平洋红豆杉树的皮和木材。
紫杉醇生物合成
酶催化紫杉醇生物合成研究进展摘要:目前紫杉醇的全合成与半合成都远远难以满足市场的需要,酶催化紫杉醇生物合成有望成为解决该问题的可行途径。
本文综述了酶催化紫杉醇生物合成研究进展。
关键词:紫杉醇酶生物合成1前言紫杉醇(paclitaxel ,商品名Taxol) 是从红豆杉属植物树皮中提取分离出来的一种具有显著抗癌作用的紫杉烷二萜类化合物,现已成为临床上治疗肿瘤的重要药物。
但其资源十分匮乏,单纯从含量极低的天然红豆杉植物中提取紫杉醇无法满足临床用药需求,紫杉醇的药源问题引起人们的极大关注。
十多年来,科学家一直在研究解决紫杉醇药源的途径,如化学合成紫杉醇、培育高产量红豆杉栽培品种、筛选生产紫杉醇的微生物、利用红豆杉细胞工程生产紫杉醇等,并取得了一定的进展。
但紫杉醇的化学全合成(或半合成) 步骤复杂、成本高,还无商业应用价值,利用内生真菌培养及红豆杉植物愈伤组织、细胞与原生质离体培养体生产紫杉醇不仅产量不高,而且稳定性也比较差,尚难以实现工业化生产。
为此各国科学家在筛选高产量红豆杉栽培品种、化学合成、生物技术及微生物生产等方面做了大量的研究工作[1]。
随着紫杉醇生物合成途径的逐步阐明及越来越多的关键酶和相关酶的基因的克隆和功能重组表达, 利用基因工程方法对红豆杉从基因水平上进行改造或对产紫杉醇的内生真菌菌种进行改造有可能成为解决紫杉醇资源短缺的有效途径。
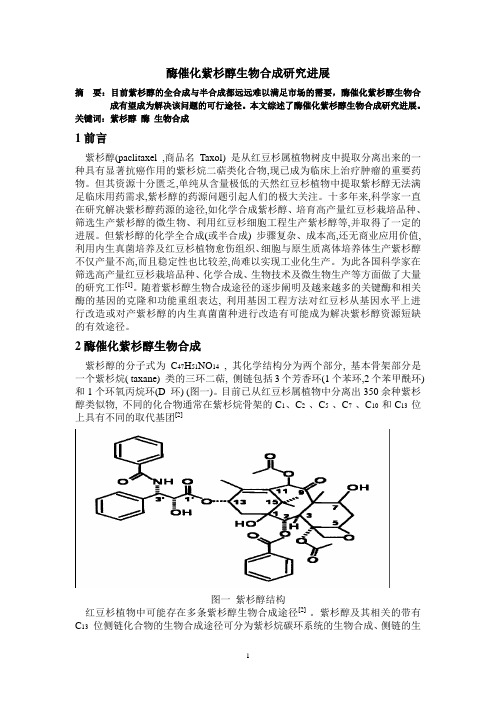
2酶催化紫杉醇生物合成紫杉醇的分子式为C47H51NO14, 其化学结构分为两个部分, 基本骨架部分是一个紫杉烷( taxane) 类的三环二萜, 侧链包括3个芳香环(1个苯环,2个苯甲酰环) 和1个环氧丙烷环(D 环) (图一)。
目前已从红豆杉属植物中分离出350余种紫杉醇类似物, 不同的化合物通常在紫杉烷骨架的C1、C2 、C5 、C7 、C10 和C13 位上具有不同的取代基团[2]图一紫杉醇结构红豆杉植物中可能存在多条紫杉醇生物合成途径[2] 。
紫杉醇及其相关的带有C13位侧链化合物的生物合成途径可分为紫杉烷碳环系统的生物合成、侧链的生物合成、紫杉烷系统和侧链的酯化反应, 形成完整的紫杉醇分子三个主要阶段。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
西北植物学报,2005,25(11):2213—2218Acta Bot.Boreal.-Occident.Sin.文章编号:1000-4025(2005)11-2213-06基于定量PCR技术探讨紫杉醇生物合成的限速步骤a刘 智,余龙江*,赵春芳,向 福,杨 秦(华中科技大学生命科学与技术学院,武汉430074)摘 要:次生代谢产物生物合成受到发育和诱导的调控,本实验研究了组织分化和诱导处理对紫杉醇生物合成的影响,并采用定量PCR技术分析了紫杉醇生物合成不同阶段关键酶基因的动态表达特征.结果表明,紫杉醇主要分布在中国红豆杉(T ax us chinensis)树皮和根皮组织中,针叶内含量很少,催化紫杉醇功能官能团连接的关键酶基因也主要定位在树皮和根皮组织中;茉莉酸甲酯(M J)和真菌诱导子F5分别提高了中国红豆杉悬浮培养细胞HG-1紫杉醇得率8倍和10倍,同时有效诱导紫杉醇生物合成基因的表达,发现催化紫杉醇侧链连接的基因与紫杉醇生物合成呈正相关.结果表明,紫杉醇生物合成的限速步骤是催化功能官能团连接的步骤.关键词:紫杉醇;生物合成;定量PCR;中国红豆杉;限速步骤中图分类号:Q946-33 文献标识码:AExploration of the Speed-limiting Process for TaxolBiosynthesis Resorting to Quantitative PCRLIU Zhi,YU Long-jiang*,ZHAO Chun-fang,XIANG Fu,YANG Qin(College of L ife S cience and Tech nology,Huazhong University of Science and T echnolog y,Wuh an430074,China)Abstract:Secondary metabolite biosynthesis is regulated by development and inducem ent o n and then this study explored the effects of tissue differentiation and induction o n taxol synthesis in T ax us chinensis and resor ted to quantitative PCR to analyze the dynam ic gene expressions of the key enzym es at different stag es of taxo l biosy nthesis.T he results sho wed that tax ol m ainly distr ibuted in bar k and ro ot-bark tissues of Tax us chinensis and appeared in the needle leaves in a very low content,and the genes of the key enzy mes co nnected w ith the functional gro ups cataly zing taxol functions w er e also mainly lo cated in the bark and roo t-bark tissues;M ethyl jasm onate(M J)and the fung al induction factor F5increased the taxo l rates in eig ht and ten folds in the suspension culture of HG-1cells of Tax us chinensis,respectively,and effectively induced the ex pression of the genes of taxo l bio synthesis;The study fo und that the g enes catalyzing the linkage of the lateral chains of tax ol positively co rrelated w ith tax ol biosynthesis.T he r esults of the study revealed that the speed-lim iting pr ocess o f tax ol bio sy nthesis was the process of cataly zing the connection of the functional g roups.Key words:tax ol;biosynthesis;quantitative PCR;T ax us chinensis;speed-limiting process 紫杉醇是红豆杉(T ax us spp.)中的一种具有显著抗癌功效的二萜类生物碱,被广泛应用于乳腺癌、卵巢癌等治疗中[1].但紫杉醇的自然来源匮乏,对其应用和研究造成了严重的影响.通过生物技术方法,a 收稿日期:2004-09-26;修改稿收到日期:2005-09-27基金项目:国家高技术863项目(102-C06-01-02);国家博士后基金(2003034490)资助作者简介:刘 智(1975-),男(汉族),博士后,主要从事次生代谢分子生物学研究.*通讯联系人.C or res pondence to:YU L on g-jian g.E-mail:yulj@利用红豆杉悬浮培养细胞或红豆杉植株生产紫杉醇被认为是解决紫杉醇来源问题的最有前景的工作[2],因此必须对紫杉醇的生物合成机理进行详尽的研究,包括代谢途径、参与生物合成的酶、编码这些关键酶的基因,以及它们的调控方式.最为直观和有效的方法是寻找紫杉醇生物合成过程中的限速步骤,克隆和高效表达其基因,然后通过转基因的方法获得紫杉醇高产细胞系和基因工程菌株,实现紫杉醇的高效、稳定生产.目前,有关紫杉醇的生物合成途径已经基本阐明,前体萜类代谢通用前体异戊烯焦磷酸(IPP)可能通过甲羟戊酸途径(M VA )和非甲羟戊酸途径(non-M VA)合成,3-羟基-3-甲基戊二酰辅酶A 还原酶(HM GR )和5-磷酸脱氧木酮糖还原异构酶(DXR)分别是这两条途径的关键酶[3,4],然后至少还包括20步酶学反应[5],IPP 在二萜代谢途径分支点的酶 牛儿基 牛儿基焦磷酸合成酶(GGPPS )的催化下形成 牛儿基 牛儿基焦磷酸(GGPP );进一步在紫杉二烯合成酶(T S)作用下形成紫杉醇碳骨架;还将经过至少9种羟化酶催化[6],使紫杉醇及相关紫杉烷更具有活性,更易于发挥作用[7];以及在酰基转移酶的作用下,连接上与紫杉醇药效相关的侧链基团等[8](图1).但有关紫杉醇生物合成的分子调控机理方面的研究很少报道.图1 紫杉醇生物合成代谢途径F ig.1 Pathw ay o f tax ol bio sy nthesis 实时荧光定量PCR 技术(real time PCR )是1996年美国Applied Biosystems 公司发展起来对模板DNA 片段进行定量研究的方法,是目前为止最精确和可靠的技术,被广泛应用在研究基因表达、基因转移评价以及病原体检测等方面[9].本研究通过比较组织分化和诱导处理对紫杉醇的合成影响,结合定量PCR 技术监测上述情况下紫杉醇合成关键酶基因的表达变化,推断紫杉醇生物合成和关键酶基因表达之间的关系,试图寻找决定紫杉醇生物合成的关键步骤,为代谢工程在紫杉醇生产中的应用奠定基础.1 材料与方法1.1 植株样品采集 2003年5月采集树龄超过1000年的中国红豆杉(Tax us chinensis )古树(树干半径121cm ,高28m )的当年生针叶、主干树皮、枝干树皮和树根,流水冲洗至无附着土粒,晾干后带回室内分析.1.2 细胞株及培养条件中国红豆杉细胞株HG-1,来源于1000年左右2214西 北 植 物 学 报25卷生中国红豆杉胚芽经愈伤组织诱导和驯化培养获得的悬浮培养细胞系,本实验室保存.继代基本培养基为改良的M S 培养基,添加3%(W/V )蔗糖和10L mol ・L -1NAA,(25±1)℃,120r /min 暗室培养.紫杉醇生物合成发酵培养基为改良的B 5培养基[10],每250mL 三角瓶装75mL 培养基,鲜细胞接种量为100g ・L -1.1.3 红豆杉细胞诱导处理诱导处理中,接种第10天添加50mg /L 真菌诱导子F 5或100L mo l ・L -1茉莉酸甲酯(M J ),定时取样分析紫杉醇含量和基因表达水平.M J(Sig ma)溶于双蒸水,加入1%(W/V )的吐温-20助溶,真菌诱导子制备方法参照文献[11],加入培养基前用0.22L m 滤膜过滤除菌.1.4 紫杉醇测定参照文献[10]的方法.1.5 定量PC R根据已经克隆得到的基因序列5-磷酸脱氧木酮糖还原异构酶(DXR ),3-羟基-3-甲基戊二酰辅酶A 还原酶HM GR(AY544991),GGPPS(AY5449-94),TS(A Y544995),细胞色素P450紫杉烷10B 羟化酶(C 10B 羟化酶)(AY 544992),10-脱乙酰巴卡亭III-10-O-乙酰转移酶(DBAT )(AY544993),18S r DNA (AY679156),采用primer premier 5设计定量PCR 引物(表1).其中18S r DNA 作为外标.表1 定量PCR 引物设计T able 1 Pr imer desig ns of the quantitativ e PCR酶类E nzymes 正义引物Sense prim er反义引物Antisen se prim erHM GR 5′-CT AAGGGCAT CACAGACC-3′5′-AGACCT CAGCCT GC TAACT -3′DXR 5′-T GGAGAAACT GAAGGAGGTA -3′5′-CT T ATT GAACAGGGT GGC -3′GGPPS 5′-GCCCAC AAATCAC AAGGT -3′5′-T TC AGGT CCACAT TAGCA-3′T S 5′-AT CT TT GTCGGT AGCAC G-3′5′-GT CCCAAT CAATAAC TT CCT C-3′DBAT 5′-GGGAGGGTGCT CT GT T TG-3′5′-GT TACCT GAACCACCAGAGG-3′C 10B -OH 5′-T CCT CCAGAAT GACT ACAACA-3′5′-T AACAACGCCCT CCAT CC-3′18S rDNA5′-T GGAGAAACT GAAGGAGGTA -3′5′-CT T ATT GAACAGGGT GGC -3′ 采用改良的一步异硫氰酸胍法提取细胞中的总RNA [12],关键酶基因定量PCR 以1L L 总RNA 为模板,外标基因18S r DNA 定量以100倍稀释的1L L 总RNA 为模板.定量PCR 仪为Roter-Gene3000(Corbett ,Austr alia ),反应体系20L L ,添加0.2L L Sy br Green I 荧光染料(M olecular Probes ,USA )监测PCR 反应进程.PCR 反应条件:95℃预变性5m in;94℃变性25s,48℃退火25s,72℃延伸25s,40循环.每个反应3个平行,同一反应(36孔)中包含样品和标准曲线.标准曲线包含5个梯度,每个反应含1000、100、10、1和0.1fem tomol cDNA.2 结果与分析2.1 6种关键酶的定量PCR 设计 紫杉醇生物合成是由一系列酶的共同作用下完成的,其合成代谢途径可以分为4个步骤:(1)代谢前体物质的合成;(2)紫杉醇碳骨架形成;(3)碳骨架的修饰和功能官能团的连接(图1).以中国红豆杉18S rDNA 作为外标,选取中国红豆杉中与紫杉醇生物合成相关的6种酶进行定量PCR 评价,其中HM GR 、DXR 代表紫杉醇前体物质形成,GGPPS 、TS 代表紫杉醇碳骨架形成,C 10B 代表紫杉醇碳骨架修饰,DBAT 代表功能官能团连接.定量PCR 的产物长度控制在100~200bp 之间,以悬浮细胞培养的红豆杉总RNA 为模板,定量PCR 产物电泳结果见图2,表明6种关键酶基因和作为外标的18S r DNA 基因片段特异性很强,符合定量PCR 的要求.以梯度稀释的含各种不同基因的质粒为模板,构建绝对定量标准曲线,结果见表2.图2 红豆杉总RN A 定量P CR 产物电泳图谱F ig.2 Electr ophor etog r am of the pro ducts in the quantitativ e PCR o f the to tal RN A o f T ax us chinensis1.DL2000DNA marker (T AKARA);2.hmgr ;3.dx r ;4.g gpp s ;5.ts ;6.C 10B ;7.d bat ;8.18S rDNAPCR 产物电泳图(图2)表明,PCR 特异性很强,符合定量PCR 分析要求.进一步通过测定标准模板含量的荧光吸收,建立各种不同基因的定量PCR 标准曲线,结果如表2所示,所有曲线的相关221511期刘 智,等:基于定量P CR 技术探讨紫杉醇生物合成的限速步骤系数都在90%以上,表明笔者建立了成功的基因含量检测体系.表2 6种关键酶基因与18S rDNA的标准曲线T able2 L inear equatio ns o f18S rD NA and thegenes enco ding the6key enzy mes基因Genes线性方程Linear equation相关系数(r)Correlationcoefficienthmg r Conc=10(-0.136*CT+1.518)0.9965d xr Conc=10(-0.134*CT+1.403)0.9999g gp ps Conc=10(-0.382*CT+12.905)0.9995ts Conc=10(-0.242*CT+1.548)0.9912C10B Conc=10(-0.109*CT+1.596)0.9933d bat Conc=10(-0.842*CT+18.321)0.911318S rDNA Conc=10(-0.136*CT+2.446)0.9975 *CT:阈值线和扩增曲线交点处的循环数.Note:CT means the cycle numb er at the intersection p oin t of the threshold value line and amplication curve.2.2 紫杉醇在中国红豆杉不同组织中的分布通过HPLC,对紫杉醇在千年红豆杉根皮、树皮和当年生针叶中的分布进行了检测,结果见图3.中国红豆杉不同组织中,紫杉醇含量存在明显的差异,根皮和树皮中紫杉醇含量较高,而针叶中含量很少,暗示组织分化极大影响着紫杉醇的生物合成,因此评价紫杉醇生物合成基因在不同组织之间的表达情况有助于阐明紫杉醇生物合成的分子机理.图3 中国红豆杉不同组织中紫杉醇的分布Fig.3 T axo l co nt ent s in differ ent tissuesof T ax us chinensis2.3 6种关键酶基因在中国红豆杉不同组织中的表达分别提取千年中国红豆杉根皮和树皮的形成层组织以及当年生针叶细胞中的总RNA,通过定量PCR检测这些组织中6种关键酶基因相对于外标18S rDNA的表达水平,结果见表3.表3 6种关键酶基因在千年中国红豆杉不同组织中的表达T a ble3 Ex pressio ns o f the genes enco ding the six key enzymes in different t issues o f1000-year-o ld T.chinensis t rees 组织Tissue HMGR DXR GGPPS TS C10B DBAT针叶Need leleaves9.0×10-2±5.8×10-3 5.4×10-2±7.5×10-3 6.0×100±3.5×10-1 5.4×10-3±1.7×10-4 2.1×10-1±1.2×10-2-树皮Bark 3.8×10-3±1.7×10-4 1.0×10-2±1.2×10-3 2.1×10-3±2.3×10-4 5.23×10-5±2.3×10-6 3.6×10-2±2.9×10-3 3.9×10-3±1.2×10-4根皮Root bar k2.5×10-2±2.9×10-3 2.5×10-3±2.3×10-4 2.0×103±5.8×101 1.05×10-4±1.3×10-5 1.3×10-2±2.7×10-3 2.7×10-2±1.2×10-3T-Test针叶/树皮Need leleaves/Bar k15.392 6.92817.30330.47020.092-针叶/根皮N eedle leaves/Root bar k22.517 6.65734.74628.51113.772-树皮/根皮Bar k/Rootbar k7.813 5.41334.641 5.704 3.95418.187 注:-没有检出荧光信号.Note:-Means that no fluorescence signal was detected. 不同组织中,6种关键酶基因的表达水平差异很大,在95%的置信范围内,T统计检验结果都大于t0.95(3)=2.3534.比较针叶和树皮组织,发现编码前体合成的酶类HMGR、DXR,紫杉醇骨架形成的酶类GGPPS、TS和紫杉醇骨架修饰的酶类C10B 的表达水平在针叶中分布较高,它们在针叶中的表达水平是树皮中的5倍以上;而编码紫杉醇功能官能团连接的DBAT转录表达水平在针叶中未检测到,在根皮中含量较高,达2.7×10-2,表明组织分化对紫杉醇生物合成酶的调控作用不同.而在红豆杉根皮组织中,这6种酶的含量都相对较高,这也与根皮中紫杉醇含量最高一致.比较针叶和树皮组织,发现编码前体合成、紫杉醇骨架形成和修饰的酶类HM GR、DXR、GGPPS、TS和C10B的表达水平在针叶中分布较高,而编码紫杉醇功能官能团连接的DBAT转录表达水平在根皮中含量较高,表明组织2216西 北 植 物 学 报25卷分化对紫杉醇生物合成酶的调控作用不同.而在红豆杉根皮组织中,这6种酶的含量都相对较高,这也与根皮中紫杉醇含量最高一致.由于紫杉醇主要分布在树皮和根皮组织中,针叶组织中含量很少(图3),上述结果也暗示DBAT代表的紫杉醇功能官能团连接的步骤可能是紫杉醇形成的关键步骤.2.4 诱导处理对紫杉醇生物合成的影响次生代谢产物的合成还受到外界环境诱导的调控,因此考察了不同诱导剂对紫杉醇生物合成的作用.M J是目前应用广泛的紫杉醇生物合成促进剂,真菌诱导子F5是千年中国红豆杉树皮中生长的内生真菌(A sp erg illus niger)的多糖提取物,两者对红豆杉悬浮培养细胞产生紫杉醇的诱导作用如图4所示.结果表明,2种诱导剂都能有效提高红豆杉悬浮细胞培养体系中的紫杉醇得率,与对照相比,真菌诱导子提高产量约8倍,M J提高产量10倍左右.而且,M J诱导处理中,紫杉醇产量最高峰发生在添加诱导剂的第3天,F5处理中最高峰在第6天,表明在诱导红豆杉细胞合成紫杉醇的效率方面,M J优于F5.图4 诱导处理对中国红豆杉悬浮培养细胞HG-1紫杉醇生物合成的影响Fig.4 Effect o f the inducement on tax ol bio sy nthesis in the suspension culture o f HG-1cells of T ax us chinensis表4 诱导处理对6种关键酶基因表达的影响T able4 Effect of the inducement o n the expr essio n of the g enes encoding t he six key enzy mes诱导剂In ducer时间T ime(d)HM GR DXR GGPPS T S C10B DBAT对照Control 3 1.1×10-1 2.8×10-3 6.4×10-1---6 1.1×10-1 4.4×10-37.1×10-1---10 1.0×10-1 3.9×10-3 6.8×10-1---Fungal elicitor F53 6.0×10-1 1.39.5×1049.4×10-3 3.9 1.1×10-9 68.0×10-17.0×10-1 1.1×104 1.5×10-1 5.7 5.0×102 10 2.6×10-39.4×10-3 3.7×102 2.6×10-68.4×10-3-M J 3 2.3×10-1 5.9×10-19.1×103 1.2×10-5 1.5×10-1 1.9×105 6 2.7×10-1 3.8×10-1 1.2×1037.4×10-4 1.5×10-19.2×104 10 2.3×10-1 2.7×10-1 1.4×102 6.0×10-79.3×10-28.0×104 注:-没有检出荧光信号.Note:-M eans that no fluorescence signal w as detected.2.5 诱导处理对6种关键酶基因表达的影响进一步考察不同诱导处理中紫杉醇合成关键酶基因表达水平的变化,结果见表4.诱导处理能有效激发各种关键酶基因的表达,但不同基因应答诱导的特点不一样.HM GR、DXR、GGPPS在对照处理中仍然有一定的表达量,HM-GR和DXR负责所有萜类代谢前体IPP的合成, GGPPS是二萜代谢前体GGPP合成的关键酶,表明红豆杉细胞中合成萜类代谢次生产物前体的基因表达水平背景较高.同时这些基因应答诱导处理非常敏感,在添加F5诱导子第3天,HM GR、DXR、GGPPS的表达水平分别是对照的5.45×105、464. 29×105、1.48×105倍,在添加MJ诱导子第3天, HM GR、DXR、GGPPS的表达水平分别是对照的2.09×104、210.71×104、1.42×104倍,暗示这些基因的表达不大可能造成紫杉醇代谢的限制.TS、C10和DBA T是紫杉醇代谢过程中专有的酶系,其在对照处理中没有检测到基因的表达,暗示这些基因可能是紫杉醇生物合成调控的关键.比较MJ和真菌诱导子F5诱导基因表达的效率,发现在诱导3d和6d时,M J诱导其它基因的表达水平都低于F5处理,但DBAT的表达水平却大大提高;在诱导10d 时,M J诱导GGPPS、T S的表达水平低于F5处理,而HMGR、DXR、C10B的表达水平高于F5处理,同时DBAT的表达水平很高.如前分析HMGR、DXR 基因的表达不大可能造成紫杉醇代谢的限制,而M J诱导紫杉醇生物合成的能力高于真菌诱导子F5 (图4),通过比较基因表达水平,暗示DBAT代表的紫杉醇功能官能团连接的步骤可能是其合成代谢调控的关键.221711期刘 智,等:基于定量P CR技术探讨紫杉醇生物合成的限速步骤3 讨 论实时荧光定量PCR技术是目前为止检测基因表达最精确的方法,外标的选择对于研究特异基因在不同环境条件下的表达非常重要.T homas等研究了4种常用看家基因,包括B-肌动蛋白、B-2-微球蛋白、3-磷酸甘油醛脱氢酶(GAPDH)和18S rDN A,对外界刺激的应答反应,发现在外界环境刺激下B-肌动蛋白和GAPDH m RNA量分别增加9倍和3倍,而B-2-微球蛋白和18S rDNA增加不大,因此后两者可作为合适的定量PCR外标使用[13].而且由于rRNA占总RNA的80%,其含量变化受外界环境影响很小[14],本实验选择红豆杉细胞的18S rDNA作为外标.植物次生代谢产物的合成同时受到遗传物质和外界环境的影响.本研究表明,组织分化和环境诱导对紫杉醇的生物合成具有很大的影响,在红豆杉植株中,紫杉醇主要分布在树皮和树根皮部分(图3),中国红豆杉悬浮培养细胞HG-1中,MJ和真菌诱导子F5能分别提高紫杉醇得率10倍和8倍(图4).比较不同紫杉醇产生条件下,6种代表紫杉醇生物合成不同阶段的关键酶基因的表达特征(表3、4),发现催化紫杉醇功能侧链连接的DBAT与紫杉醇高产相关.MJ是诱导红豆杉细胞合成紫杉醇最常用的诱导剂,元英进等[15]研究发现其主要激发从巴卡亭Ⅲ到10-脱乙酰紫杉醇的步骤,这些步骤主要是紫杉醇侧链连接的过程.本研究结果也暗示,催化紫杉醇功能官能团连接的步骤可能是决定紫杉醇生物合成的关键步骤.但值得注意的是,在诱导处理和组织分化过程中,紫杉醇生物合成关键酶基因的转录表达水平可以成指数等级提高,但紫杉醇含量最高只能提高10倍左右,两者之间没有比例关系,暗示基因转录后的调控过程,包括翻译调控和翻译后加工可能是控制紫杉醇生物合成的关键调控机制.参考文献:[1] GELM ON K.T he taxoids:paclitaxel an d docetaxel[J].L ancet,1994,344:1267-1272.[2] JAZIRI M,ZHIRI A,GUO Y W,et al.T axus sp.cell,tiss ue and org an cu ltures as alternative s ources for taxoids production:a literaturesurvey[J].P lant Cell T issue and Org an Cultur e,1996,46:59-75.[3] CHAPPELL J,W OL F F,PROUL X J,et al.Is the reaction catalyzed by3-hydroxy-3-methylglutaryl coenzyme A r eductas e a rate-limitingstep for isoprenoid bios ynthesis in plants[J].P lant Physiology,1995,109:1337-1343.[4] T AKAHASHI S,KUZUYAM A T,WAL ANABE H,et al.A1-deoxy-D-xylulos e5-phosphate reductoismeras e catalyzin g the form ation of2-C-methyl-D-erythritol4-phosph ate in an alternative nonmevalon ate pathw ay for terpeonid biosynthesis[J].P roc.N atl.A cad.Sci.USA.,1998,95:9879-9884.[5] JENNEW EIN S,LONG R M,W ILLIAM S R M,et al.C ytochrome P450tax adiene5A-h ydroxylase,a mechan istically unus ual monooxyge-nas e catalyzing th e first ox ygenation s tep of tax ol b iosynthesis[J].Chemistry and B iology,2004,11:379-387.[6] CHAU M,J ENNEW EIN S,WAL KE R K,et al.T ax ol biosynthesis:molecular cloning and ch aracterization of a cytochrome P450taxoid7B-hyd rox ylase[J].Chemistry and B iology,2004,11:663-672.[7] KINGST ON D G I,J AGT OP P G,YU AN H,et al.The ch emis try of taxol and related taxoids[J].F ortsc hritte d er Che mie Or ganische rN atursto f f e,2002,84:53-225.[8] KINGS TON D G I.T axol,a molecule for all seas ons[J].C hemical Communication,2001,10:867-880.[9] SHUA I X R(帅小蓉),XIA Q Y(夏庆友),ZHU Y(朱 勇).Progress and application of qu antitative PC R[J].N ew sletter of S er iculturalS cience(蚕学通讯),2002,22:20-27(in Chinese).[10] ZHANG C H,M EI X G,LIU L,et al.Enh anced paclitaxel produ ction induced by the combination of elicitors in cell s uspension cu lturesof T axus chinensis[J].B iotechnology L e tter s,2000,20:1561-1564.[11] LAN W ZH(兰文智),YU L J(余龙江),LI W(李 为),et al.Selecting preparation methods and is olationg components of fun gal elicitorto enhance taxol biosynthesis[J].J ournal o f W uhan Botanical Researc h(武汉植物研究),2002,20(1):66-70(in Chinese).[12] ZHEN G Q P(郑清平),YU L J(余龙江),LIU ZH(刘 智),et al.Cloning and analys is of cDNA encod ing key enzyme gene(dx r)of thenon-M VA path w ay in Tax us chinensis cells[J].Chinese J our nal of Biotechnology(生物工程学报),2004,20:548-553(in C hinese). [13] THOM AS D S,BRAIN A Z.Effect of exper imental treatment on h ousekeeping gene ex pres sion:validation by real-time,quantitative RT-PCR[J].J.B ioc hem.Bio p hys.M ethods,2000,46:69-81.[14] GOIDIN D,M AM ES SIER A,S TAGU ET M J,et al.Ribosomal18S RNA pr evails over glyceraldehyde-3-phosph ate dehydrogenase andB-actin genes as internal standard for quantitative comparis on of mRNA levels in invas ive and noninvasive human melanoma cell s ubpop-ulation s[J].A nalytical Biochemistry,2001,295:17-21.[15] M IAO Z Q,YU AN Y J,RE N D F,et al.Acting point in taxol bios ynthes is path way of elicitor in sus pen sion cultu res of T axus chinensisvar.mairei[J].A cta Botanic a S inica,2004,46(6):730-737.2218西 北 植 物 学 报25卷。
