工程热力学第四章理想气体热力过程教案
工程热力学教案

《工程热力学》教案能源与动力工程学院邓巧林2010年2月一、课程基本描述课程名称:工程热力学英文译名:Engineering Thermodynamics总学时数:40 讲课学时:40 实验学时:0授课对象:热能与动力工程专业、建筑环境与设备工程专业本科生课程要求:必修分类:专业(学科)基础课开课时间:第四学期先修课:高等数学、大学物理、理论力学、材料力学、工程流体力学二、课程教学定位1. 本课程在专业课程体系中的定位工程热力学是研究物质的热力性质、热能与其它能量之间相互转换的一门工程基础理论学科,其内涵丰富、概念抽象、公式数量多、联系工程实际范围广,是热能与动力工程和建筑环境与设备工程专业四年制本科的一门重要的专业基础课。
热能与动力工程专业所研究的问题:如燃料燃烧、能量转换、火力发电、内燃机动力装置、燃气轮机装置等,建筑环境与设备工程专业所研究解决的问题:如采暖、空调,热源、冷源,以及建筑物的温度、湿度等问题的调节与控制,都要以热力学物理模型研究为基础。
因此学生掌握工程热力学课程基本理论,直接影响其专业水平,对今后从事科学研究、工程应用及管理工作都非常重要。
工程热力学作为有百年历史的老学科,早已自成体系,目前全国约有30多个专业开设该课程,同型专业开设工程热力学课程的目的是一致的:即应用热力学的基本概念、基本定律和工质的热力性质,对各种类型热工设备或热力系统的热工过程进行分析计算,以寻求提高热能利用率和节能的有效途径。
所不同的是,能源动力类专业的研究对象主要是热能与机械能的转换,它是后续汽轮机原理、热力发电厂、锅炉原理、燃气轮机原理、燃气蒸汽联合循环发电技术、燃烧理论与技术、火电厂节能原理与技术、核能发电技术等课程的基础;而建筑环境与设备专业,其研究对象主要是热能的直接利用,一方面集中供热、供暖的热源,常取自热电联产,空调的冷源来自制冷装置,这些要涉及热与功的转换;而另一方面湿空气、燃气、制冷剂、溶液等的热力性质,是后续供热、供燃气、通风与空调工程课程必须要用到的。
华中科技大学工程热力学-第4章-气体热力过程PPT课件

定容过程的条件为dv = 0,由此,有过程方程 v = 常数 V = 常数 (CM)
2020/11/10
3
⑵ 定容过程中的参数关系
Pv RgT P Rg 常数 Tv
定容过程中,气体的压力与其温度成正比
对理想气体,不仅定容过程,任何过程均有
du cvdT dh cPdT u cv T h cP T
2020/11/10
2
无论是对于控制质量(CM)或控制容积(CV) ,如果所 发生的热力过程外部条件相同,譬如同为定温过程或绝 热过程等,工质的状态变化规律是一样的,不同的只是 系统与外界的能量交换情况。
本章基本上针对CM中的可逆过程进行讨论,个别情 况下也对CV的过程作附加说明
§4.2 定容过程
可逆的绝热过程为定熵过程
由
dscP
dv v
cv
dP P
定比热容时,对定熵过程可导得
Pvk conts
k cp cv
热容比,亦称为绝热指数
2020/11/10
13
⑵ 绝热过程中的参数关系
由
Pvk conts
Pv = RgT
P2 ( v1 )k P1 v2 T2 ( v1 )k1 T1 v2
(定比热容理想气体可逆绝热过程)
或
wk Rg T 1 1(1T T1 2)k Rg T 1 11(P P 1 2)kk 1
2020/11/10
15
由热力学第一定律第二表达式
qhwt
知绝热过程的技术功 wt h (任何工质) 对定比热容理想气体的绝热过程有技术功
2
qh1 cpdT
qcp(T2T1) (比热容为定值)
2020/11/10
《工程热力学》课程教案

《工程热力学》课程教案*** 本课程教材及主要参考书目教材:沈维道、蒋智敏、童钧耕编,工程热力学(第三版),高等教育出版社,2001.6手册:严家騄、余晓福著,水和水蒸气热力性质图表,高等教育出版社,1995.5 实验指导书:华北电力大学动力系编,热力实验指导书,2001参考书:曾丹苓、敖越、张新铭、刘朝编,工程热力学(第三版),高等教育出版社,2002.12王加璇等编著,工程热力学,华北电力大学,1992年。
朱明善、刘颖、林兆庄、彭晓峰合编,工程热力学,清华大学出版,1995年。
曾丹苓等编著,工程热力学(第一版),高教出版社,2002年全美经典学习指导系列,[美]M.C. 波特尔、C.W. 萨默顿著郭航、孙嗣莹等译,工程热力学,科学出版社,2002年。
何雅玲编,工程热力学精要分析及典型题精解,西安交通大学出版社,2000.4概论(2学时)1. 教学目标及基本要求从人类用能的历史和能量转换装置的实例中认识理解:热能利用的广泛性和特殊性;工程热力学的研究内容和研究方法;本课程在专业学习中的地位;本课程与后续专业课程乃至专业培养目标的关系。
2. 各节教学内容及学时分配0-1 热能及其利用(0.5学时)0-2 热力学及其发展简史(0.5学时)0-3 能量转换装置的工作过程(0.2学时)0-4 工程热力学研究的对象及主要内容(0.8学时)3. 重点难点工程热力学的主要研究内容;研究内容与本课程四大部分(特别是前三大部分)之联系;工程热力学的研究方法4. 教学内容的深化和拓宽热力学基本定律的建立;热力学各分支;本课程与传热学、流体力学等课程各自的任务及联系;有关工程热力学及其应用的网上资源。
5. 教学方式讲授,讨论,视频片段6. 教学过程中应注意的问题特别注意:本课程作为热能与动力工程专业学生进入专业学习的第一门课程(专业基础课),要引导学生的学习兴趣和热情。
另,用例应尽量采用较新的事实和数据。
7. 思考题和习题思考题:工程热力学的宏观研究方法与微观方法的比较作业: (短文,一、二页即可)网络文献综述——能源利用与工程热力学8. 师生互动设计讲授中提问并启发讨论:从本课程教材的四大部分的标题看,对于工程热力学的研究内容有没有一个初步的认识(可以“猜想”)?知道热力学第一、第二定律吗?第三、第零定律呢?请举例并比较:宏观研究方法和微观研究方法。
工程热力学第三版电子教案教学计划6
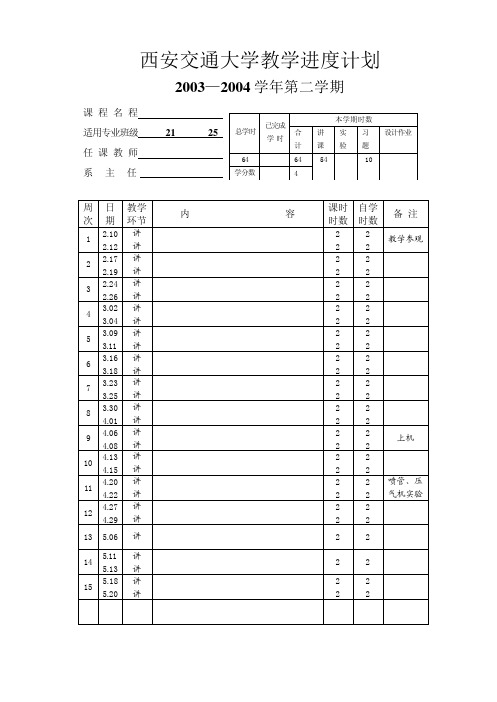
工程热力学 能动 26、2 7、28 赵小明 傅秦生
李国君
总学 已完
本学期学时
课外学时
合计 讲课 实验 机时 讨论 实验
64
64 54
10
学分 4
数
周日
教 学
次期
环 节
1 2.10 讲 2.12 讲
2 2.17 讲 2.19 讲
3 2.24 讲 2.26 讲
4 3.2 讲 3.4 讲
5 3.9 讲 3.11 讲
课课
内外
备
学学
注
时时
2 2 电教片 2 2 参观
22
23
24
22
22
22
22
23
24
22
22
22
22
22
22
14 5. 11 讲
气体与蒸气的流动
2 4 喷管实
5. 14 讲
第九章 压气机的热力过程
22 验
15 5. 18 讲
压气机的热力过程
22
5. 21 讲
第十章 气体动力循环
22
16 5. 25 讲
6 3.16 讲 3.18 讲
7 3.23 讲 3.25 讲
8 3.30 讲 4.1 讲
9
4. 6 4. 8
讲 讲
10
4. 13 4. 15
讲 讲
11 4. 20 讲 4. 22 讲
12 4. 27 讲 4. 29 讲
13 5. 6 讲
14 5. 11 讲 5. 13 讲
内
容
绪论 第一章 基本概念 第二章 热力学第一定律
15 5.18 5.20
讲 讲
第十三章 湿空气 复习 机动 考试
工程热力学第四章理想气体热力过程

03
CHAPTER
等容过程
等容过程是指气体在变化的整个过程中,其容积保持不变的过程。
定义
特点
适用场景
气体在等容过程中,气体温度和压力会发生变化,但容积保持不变。
等容过程常用于高压、高温或低温等极端条件下的气体处理。
03
02
01
等容过程定义
在等容过程中,气体吸收的热量等于气体所做的功和气体温度升高所吸收的热量之和。
多变过程的具体形式取决于气体所经历的压力和温度的变化规律。
多变过程定义热力学第一定律 Nhomakorabea热力学第二定律
理想气体状态方程
热效率
多变过程的热力学计算
01
02
03
04
能量守恒定律,用于计算多变过程中气体吸收或释放的热量。
熵增原理,用于分析多变过程中气体熵的变化。
描述气体压力、体积和温度之间的关系,可用于多变过程的计算。
衡量多变过程能量转换效率的指标,通过比较输入和输出的热量来计算。
提高热效率的方法
优化多变过程参数,如压力和温度的变化规律,以减少不可逆损失和提高能量转换效率。
热效率与熵增的关系
根据熵增原理,不可逆过程会导致熵的增加,从而降低热效率。因此,减少不可逆损失是提高多变过程热效率的关键。
热效率计算公式
$eta = frac{Q_{out}}{Q_{in}}$,其中$Q_{out}$为输出热量,$Q_{in}$为输入热量。
计算公式
通过优化气体的初态和终态,以及选择合适的加热和冷却方式,可以提高等容过程的热效率。同时,也可以通过改进设备结构和操作方式来提高热效率。
提高热效率的方法
等容过程的热效率
04
CHAPTER
工程热力学4理想气体热力过程及气体压缩g

• 二、过程初,终状态参数间的关系p65
气态方程:
pv RT
过程方程 p1v1 p2v2 p1v1v1 1 p2v2v2 1
T1v1 1 T2v2 1
T1
p 1 1
T2
p2
1
p2 ( v1 )k (4-5) p1 v2
T2 ( v1 )k 1 4-6 T1 v2
研究热力学过程的依据
1) 第一定律: q du w dh wt
稳流:
q
h
1 2
c2
gz
ws
2) 理想气体: pv RT cp cv R u f (T ) h f (T )
k cp cv
3)可逆过程:
w pdv
wt vdp
2) ds δq T
s12
2
ds
1
2 δq ? 0
1T
上述两种结论哪一个对?为什么? 既然 δq 0 q 0 为什么熵会增加?(不可逆)
结论: 1)
ds δq TR
必须可逆
2)熵是状态参数,故用可逆方法推出的熵变 △s 公式也可用于不可逆过程。
3)不可逆绝热过程的熵变大于零。
pv RgT
p T
Rg v
2
s 1 ds
2
1 cV
dT T
Rg
ln
v2 v1
2
1 cp
dT T
Rg
ln
p2 p1
2
1 cp
dv v
2
1 cV
dp p
第4章-理想气体的热力性质和热力过程

m
pRgVT1w
1
Ts
0.098MPa36m3 0.28[7kJ/(kgK)]
2
1 73K
1 308K
5.117kg
9
第二节 理想气体的比热容
10
• 热容:指工质温度升高1K所需的热量。
C Q dT
• 比热容:1kg(单位质量)工质温度升高1K所
k
nn1n2n3 ni nk ni i 1
• 第 i 种组元气体的摩尔分数 (mole fraction of a mixture):
xi
ni n
(433)
xi nni nni 1
各组元摩 尔分数之
和为1
37
换算关系
mnM
mi niMi
• 根据热力学第一定律,任意准静态过程:
q d u p d v d h v d p
u是状态参数: uf(T,v)
du(T u)vdT(uv)Tdv
q( T u)vdT[p( u v)T]dv
单位物量的物质 在定容过程中温 度变化1K时热 力学能的变化值
q u
• 定容: dv0 cv (dT)v (T)v 12
3
第一节 理想气体及其状态方程
4
• 理想气体 ideal gas定义:
– 遵循克拉贝龙(Clapeyron)状态方程的气体,
即基本状态参数 p、v、T 满足方程
pv 常数 T 的气体称为理想气体。
理想气体的基本假设:
• 分子为不占体积的弹性质点 uu(T)
• 除碰撞外分子间无作用力
理想气体是实际气体在低压高温时的抽象
工程热力学第4章

29
4-7 理想气体过程综述
一、各种过程在p-v图和T-s图上的相对位置
定容、定压、定温和定熵(可逆绝热)四个典型过 程都可以理解为多变过程的特例。其在p-v图上和T-s图 上的斜率如下:
( n 0)
0 p v
T cp 0 T cV
30
p p n v v n
Tc Tb
考虑过程等压 c
hc hb
a
q p ha hc 面积amnca
ha hb 面积amnca
38
p-v,T-s图练习(1)
压缩、升温、放热的过程,终态在哪个区域?
p
T
v
39
s
p-v,T-s图练习(2)
膨胀、降温、放热的过程,终态在哪个区域?
p
T
v
40
s
p-v,T-s图练习(3)
1 2
wt vdp 0
1
2
q p h wt h c
T2 p T1
T2 T1 1 Tds
2
四、Δu、 Δh、Δs和c
u c
T2 V T1
T2 T1
h c
T2 p T1
T2 T1
11
s
2
1
T2 dT cp s c p ln T T1
三、 定容过程的功量和热量
因为dv = 0,所以膨胀功为零,即
2
w pdv 0
1
注意和p-v 图对应
技术功: t vdp v( p1 p2 ) Rg (T1 T2 ) w
1
2
热量:
q Tds cV dT
工程热力学第三版电子教案教学大纲 (3)

教学大纲课程名称:工程热力学英文译名:Engineering Therodynamics (Architecture type)总学时数:54讲课学时:50(含习题课4)实验学时:8授课对象:建筑环境与设备专业、建材专业本科生课程要求:必修分类:技术基础课开课时间:第三学期主要先修课:高等数学、大学物理、理论力学、材料力学选用教材及参考书教材:采用由我校廉乐明主编,李力能、谭羽非参编的全国建筑暖通专业统编教材、全国高等学校教材《工程热力学》。
本书自1979年出版至今,历经第一版、第二版、第三版和第四版共四次修订,计十二次印刷,在全国发行量达12万余册。
本书曾获国家级教学成果奖教材二等奖、建设部部优教材奖。
主要参考教材:1、清华大学主编、高教出版社出版的《工程热力学》2、西安交通大学主编、高教出版社出版的《工程热力学》3、 Krle C.Potter Craig W .Somerton《Engineering Therodynamics》(1998年版)一、本课程的性质、教学目的及其在教学计划中的地位与作用本课程是研究物质的热力性质、热能与其他能量之间相互转换的一门工程基础理论学科,是建筑环境与设备专业的主要技术基础课之一。
本课程为专业基础课,主要用于提高学生热工基础理论水平,培养学生具备分析和处理热工问题的抽象能力和逻辑思维能力。
为学生今后的专业学习储备必要的基础知识,同时训练学生在实际工程中的理论联系实际的能力。
通过对本课程的学习,使学生掌握有关物质热力性质、热能有效利用以及热能与其它能量转换的基本规律,并能正确运用这些规律进行各种热工过程和热力循环的分析计算。
此外本课程在有关计算技能和实践技能方面也使学生得到一定的训练。
因此本课程不仅是学习后续课程,包括《供热工程》、《空调工程》、《锅炉及锅炉房设备》等主要专业的理论基础外,而且能广泛服务于机械工程、动力工程、冶金、石油、电力工程等各个研究领域。
工程热力学4

方法 1) 抽象分类
p vT s n
基本过程
2) 可逆过程 (不可逆再修正)
研究热力学过程的依据
1) 热力学第一定律 q du w dh wt
稳定流动能量方程
q
h
1 2
c2
gz
ws
cn cv
v
理想气体基本过程的p-v,T-s图
pT s v
T2
(
p2
)
k 1 k
T1 p1
T
sv
n0
p
n0 T
n 1
n 1 p
nk
n
n
v
nk s
u在p-v,T-s图上的变化趋势
u =T
u cvdT
pv RT
p u>0
T
u>0
n0 n 1
n0 n 1
nk
n
v
n
nk s
h在p-v,T-s图上的变化趋势
p
T
n0
n0
n
n 1 nk
v
n
n 1
nk s
p-v,T-s图练习(2)
膨胀、降温、放热的过程,终态在哪个区域?
p
T
n0
n0
n
n 1 nk
v
n
n 1
nk s
p-v,T-s图练习(3)
膨胀、升温、吸热的过程,终态在哪个区域?
p
T
n0
n0
n
n 1 nk
v
n
n 1
nk s
理想气体基本过程的计算
《工程热力学》教学课件第4-5章

工程热力学 Thermodynamics 二、摩尔气体常数及其他形式
由阿伏伽德罗定律知:在同温同压下任何气体的摩尔
体积都相等。
pVm 常数 R T
pVm RT
摩尔气体常数R,与气体种类和气体状态无关。
R 8.31431J/(mol K)
其他形式还有 pV mRgT 或 pV nRT
Rg
c t2
c
t2 0C
t2
c
t1 0C
t1
t1
t2 t1
工程热力学 Thermodynamics
(3)平均比热容的直线关系式:
c t2 t1
a bt
a b(t2
t1)
(4)定值比热容:
定值比热容表
工程热力学 Thermodynamics
三、理想气体的热力学能和焓及熵
du cVdT
;u
T2 T1
cV
dT
dh cpdT ;h
T2 T1
c
p
dT
真实比热容 平均比热容
u
T2 T1
cV
dT
u
cV
t2 t1
(t2
t1)
平均比热容(表)
u
cV
t2 0C
t2
cV
t1 0C
t1
定值比热容
u cV T cV t
h
T2 T1
c
p dThcpt2 t1(t2
t1 )
工程热力学 Thermodynamics
第四章 理想气体的热力性质
第一节 理想气体及其状态方程式 一、概述 二、状态方程:
pv RgT 称为克拉珀龙状态方程。
理想气体定义:凡是遵循克拉贝珀状态方程的气体
工程热力学第三版课后习题答案沈维道(第四章)

第四章 理想气体的热力过程
4—1 有 2.3 千克的 CO, 初态 T1 = 477K,p1 = 0.32MPa , 经可逆定容加热, 终温 T2 = 600K , 设 CO 为理想气体,求 ∆U 、 ∆H 、 ∆S ,过程功及过程热量。 (1)设比热容为定值; (2)变 值比热容,按气体性质表。 解: (1)定值比热容
4—3 试由 w = 算式。 解: 可逆过程的过程功 w =
2 2
∫
1
pdv,wt = − ∫ vdp 导出理想气体进行可逆绝热过程时过程功和技术功的计
1
∫
2
1
pdv ,由绝热过程方式可知 p1v1κ = pvκ , p =
p1v1κ vκ
所以
w = p1v1κ ∫
v2
v1
dv 1 1 = ( p1v1 − p2 v2 ) = Rg (T − T ) κ v κ −1 κ −1 1 2
60.08K = 13546.39J/mol 100K
1 ( H m,1 − H m,2 ) M 1 (9123.608 − 13546.39)J/(mol ⋅ K) = −138.21× 103 J/kg = −3 32.0 × 10 kg/mol
4—6 3kg 空气, p1 = 1MPa,T1 = 900K ,绝热膨胀到 p2 = 0.1MPa 。设比热容为定
Rg =
R 8.3145J/(mol ⋅ K) = = 0.260J/(kg ⋅ K) T1 = t1 + 273 = 40 + 273 = 313K M 32.0 × 10−3 kg/mol
p1 0.1MPa = 0.260J/(kg ⋅ K) × 313K ln = −112.82J/kg p2 4MPa
工程热力学第4章 气体与蒸汽的热力过程

分析热力过程的一般步骤
➢ 确定过程方程 p = f ( v )
➢ 确定初态、终态参数的关系及热力学 能、焓、熵的变化量
➢ 确定过程中系统与外界交换的能量
➢ 在p-v图和T-s图画出过程曲线,直观地 表达过程中工质状态参数的变化规律及 能量转换
§4-1 理想气体的热力过程
例4:将理想气体在可逆绝热过程中所作技术功的 大小,表示在T-s图上。
[分析]:
绝热过程技术功:
wt cp(T1T2)
cp(T1T2)
1 T
2' 2
q12
=面积1ba2’1
a
bS
五、多变过程
❖ 工程实际中有些热力过程,p、v、T有明显变化, 且系统与外界交换的Q不可忽略。则不能用上述4种 基本热力过程来描述。
u cV (T2 T1 )
h c p (T2 T1 )
s
c
p
ln
T2 T1
Rg ln
p2 p1
3. 能量转换
w 2 1
pdv
p1v1n
2 1
dv vn
n
1 1(
p1v1
p2v2 )
R n
1(T1
T2 )
wt nw
nRT111
p2 p1
(n1)/n
q
u
w
cV
(T2
T1)
R n
1(T1
ucV(T2 T1)
hcp(T2 T1)
sv
cV
lnT2 T1
Rg
l
nv2 v1
cV
l
nT2 T1
cV
l
np2 p1
工程热力学课件第4章

κ=
cp cv
pv κ = 常数
∴κ > 1
Qc p > cv
2、初、终状态参数关系 、
p 2 v1 = p1 v 2
κ
pvκ = 常数
pv = RT
T2 v1 = T1 v2 κ −1 T2 p2 κ = T1 p1
1 1
2
2
κ
dp
1
=κ
R (T1 − T2 ) = κw κ −1
pκ
κ ( p1v1 − p 2 v 2 ) = κ −1
2)热量 )
q=0
∆s = 0
∆u + w = 0 或 ∆u = − w ∆ h + wt = 0 或 ∆ h = − wt
4-3 多变过程的综合 分析
多变过程
1、 过程方程: pv n 、 过程方程:
pc dT pc dp sc − sb = ∫ cp − ∫ R = −R ln T T pb p pb
T
Qsc > sb
∴pc < pb
sb sc
s
定压线向左水平移动, 定压线向左水平移量转换 、 1)过程功 dp= 0 ∴wt = −∫1 vdp = 0 ) 2)热量 )
2
2
v
4
3
wT = wt ,T
2)热量 )
T
∆h = c p (t2 − t1) = 0
2’ 1 2
∆u = cv (t2 − t1) = 0
v2 p1 p1 q = w = wt = RT ln = RT ln = p1v1 ln v1 p2 p2
s
4
工程热力学第4章

工程热力学第4章第4章理想气体热力过程及气体压缩4.1 本章基本要求熟练掌握定容、定压、定温、绝热、多变过程中状态参数p、v、T、?u、?h、?s的计算,过程量Q、W的计算,以及上述过程在p-v 、T-s图上的表示。
4.2 本章重点结合热力学第一定律,计算四个基本热力过程、多变过程中的状态参数和过程参数及在p-v 、T-s图上表示。
本章的学习应以多做练习题为主,并一定注意要在求出结果后,在p-v 、T-s图上进行检验。
4.3 例题例1.2kg空气分别经过定温膨胀和绝热膨胀的可逆过程,如图4.1,从初态p1=9.807bar,t1=300?C膨胀到终态容积为初态容积的5倍,试计算不同过程中空气的终态参数,对外所做的功和交换的热量以及过程中内能、焓、熵的变化量。
图4.1 解:将空气取作闭口系对可逆定温过程1-2,由过程中的参数关系,得p2?p1v11?9.807??1.961bar v25RT1=0.1677m3/kg p1按理想气体状态方程,得v1?—30—v2?5v1=0.8385m3/kgT2?T1=573K t2=300?C气体对外作的膨胀功及交换的热量为WT?QT?p1V1lnV2=529.4kJ V1过程中内能、焓、熵的变化量为?U12=0 ?H12=0 ?S12=或?S12=mRlnQT=0.9239kJ /K T1V2=0.9238kJ /K V1对可逆绝热过程1-2′, 由可逆绝热过程参数间关系可得'p2?p1(v1k) 其中v2'?v2=0.8385m3/kg v21故p2'?9.807()1.4=1.03bar 5T2'?p2'v2'R=301K t2'=28?C气体对外所做的功及交换的热量为Ws?11(p1V1?p2V2)?mR(T1?T2')=390.3kJ k?1k?1Qs'?0过程中内能、焓、熵的变化量为?U12'?mcv(T2'?T1)??390.1kJ或?U12'??W2??390.3kJ?H12'?mcp(T2'?T1)??546.2kJ ?S12'=0例2. 1kg空气多变过程中吸取41.87kJ的热量时,将使其容积增大10倍,压力降低8倍,求:过程中空气的内能变化量,空气对外所做的膨胀功及技术功。
工程热力学(理想气体的热力性质)

mi , m
wi
mi m
;
wi 1;
xi
ni n
;
i
Vi V
换 算 关 系 :i xi ;
wi
xi M i ; xi M i
xi
wi / M i wi / M i
工程热力学 Thermodynamics
2、折合摩尔质量和折合气体常数 :
M eq
m n
xi M i
Rg,eq
R M eq
工程热力学 Thermodynamics
第四章 理想气体的热力性质
第一节 理想气体及其状态方程式 一、概述 二、状态方程:
pv RgT 称为克拉珀龙状态方程。
理想气体定义:凡是遵循克拉贝珀状态方程的气体
称为理想气体。
从微观上讲,凡符合下述假设的气体称为理想气体: 1. 气体分子是不占据体积的弹性质点; 2. 气体分子相互之间没有任何作用力。
工程热力学 Thermodynamics
1、真实比热容
c
c c(t) c c(T )
c a0 a1T a2T 2 a3T 3
c b0 b1t b2t2 b3t3
1
2、平均比热容(表)
o
t1
定义式:
c t2
q
t2 cdt t1
t1 t2 t1 t2 t1
计算:
c t2
三 理想气体比热容
理想气体 :
u u(T )
cV
du dT
f (T )
cV
u T
v
cp
h T
p
h u pv u(T ) RgT h(T )
cp
dh dT
(T )
迈耶尔公式:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章 理想气体的热力过程概 述热能⇔机械能的相互转化是靠工质在热力设备中吸热、膨胀、压缩等状态变化的过程来实现的,这个状态变化的过程就是热力过程,那么,在前面第一章研究的平衡状态,第二章研究理想气体的性质以及第三章研究分析开、闭口系热力状态变化的工具——热力学第一定律都是为这一章打基础。
前面第三章已提到过相同的工质在相同的温度下,不同的热力过程,能量转化的状况是不同的。
P V q q >,00v p w w ==膨技,,因此工程上实际过程多种多样、复杂、多变,不是可逆过程,据传递能量的工质不一不可能一一加以研究,何况逐个研究不总结规律性的知识用途也不大。
因此,我们仍采用热力学常用的方法,对复杂多样的热力过程进行合理化的假设。
认为是理想气体的可逆过程,这就是我们下面要研究的理想气体○V ○P ○T ○S 。
○P :例如各种环热设备,工质一面流动一面被加热,流动中克服阻力的压力降与其压力相比小很多,故认为压力不变。
○V :汽油机工作时,火花塞一点火,气缸内已被压缩的可燃混合气即燃烧,在一瞬间烧完,这期间气缸与外界无质量交换,活塞移动极微,可近似定容过程。
○T :如往复式压气机,气体在气缸中被压缩时温度升高,为了省功气缸周围有冷却水套,若冷却效果好,气缸中温度几乎不变,可近似定温过程。
○S :例气缸中燃烧产物在气缸中膨胀对外作功过程,由于工质与外界交换的热量很少可略去不计,认为是定熵过程。
上述过程实际上是略去次要因素后的一个等同特征,就是过程中有一个状态参数不变,对理想气体()u f t = ()h f t =这研究起来就方便很多,而且只有实际意义。
4—1 研究热力过程的目的及方法一. 目的1.实现预期的能量转化,合理安排热力过程,从而来提高功力装置的热经济性。
2.对确定的过程,也可预计热→功之多少。
二.解决的问题1.根据过程特点,寻找过程方程式 2.分析状态参数在过程中的变化规律3.确定热功转化的数量关系,及过程中,,u h s ∆∆∆的变化 4.在P —V ,T —S 图上直观地表示。
三.方法——依据1.热力学第一定律解析式可逆过程q du pdvq dh vdpδδ=+=+2.理想气体性质热⇒功靠工质膨 胀实现,但即使 工质膨胀能力很 大,如不给外界 条件,也难以实 现热⇒功。
而且 外界条件不同, 热→功能力也不 同,例前面 内容p v c c <。
状态方程式 理气比热从这两个依据出发,所要解决的问题就是上述要达到的目的。
4—2 定容过程1.定义:气体在状态变化过程中容积保持不变的过程。
2.过程方程式0v v ==定 d 3.确定初终状态参数之间的关系v =定值"1""2"- 121212v v vP P RT T v=====常数 pv RT =说明:定容过程中工质的绝对压力与绝对温度成正比,已知1122,,P T P T 或中任一个即可求得另一个终态的参数。
4.求过程中的,,u h s ∆∆∆在第三章的四、五节我们讨论了理想气体不论经过哪一种势力过程2211()t v v vmt u u q c t t ∆=∆==-任意2()121t h h q c t t p p pm t ∆=∆==- 任意s s s ∆=∆∆任意任一个可逆过程几个可逆过程和 or22222111112222211111222222111111ln ln ln ln ln ln ln ln t vm t t pm t t pm vm t v T v dT cvR c R T v T v p T p dTcpR c R T p T p v p dv dp cpcv c c v p v p =+=+=-=-=+=+⎰⎰⎰⎰对于定容过程0dv = 2211ln t vmt T Sv c T ∆= 或者工质膨胀时,对工质可不加热、不吸热○S 或者 加热实限制外界条件○V ○P ○T ∴外界条件不同 热力过程不同热状况也不同,因 此分析目的是。
注意:P T绝对21()cv T T -21()cp T T -在相同初终态条 件下2211ln t vm t pc p =5.求过程中的,q w根据特力学第一定律解析式 闭口、可逆 q du pdv δ=+∵21000dv pdv w pdv =⇒=⇒==⎰吸∴q du δ=21()q u cv T T =∆=- 开口、可逆 q dh vdp δ=+ 2121()t w vdp v P P =-=-⎰12()q h v P P =∆+-12()u pv v P P u=∆+∆+-=∆6.热力过程在P —V 图,T —S 图上表示121 2.0T P S T u -↑→↑-∆>↑∆↑加热, 吸热, q>0 12'-↓→↓放热,T P 120S T u '-∆<↓∆↓ 方热, q<04—3 定压过程1. 定义:工质在状态变化过程中压力保持不变的过程。
2. 过程方程式 P =定值 3. 初终态参数之间的关系21lnT cv T 21lnP cv P在定容过程中, 加热工质的热全 部变为工质的内 能。
从而可知定 容过程并没有热 变功的转变反有 热量的传递,因 而定容过程实质 是热变功的准备 过程。
P =定值 "1""2"- 121212P Pv Pv v RT T P=====定值 Pv RT =说明:定压过程中工质的v T 与成正比 4.求过程中的,,u h s ∆∆∆ 2211()v vm u u c T T ∆=∆=- 2211()p pm h h c T T ∆=∆=-2211ln P dTS cpR Y P ∆=-⎰2211ln T cpm T = 5.求过程中的q ,wq du pdv δ=+ 21q u pdv =∆+⎰21()q u p v v =∆+- 21h h h=-=∆q dh vdp δ=- 21q h vdp =∆-⎰h =∆2121t w vdp w pv pv =-=+-⎰膨0= 2112()()p v v p v v =-+- 21w pdv =⎰膨说明:定压过程 中,加给工质的 热量一部分用于 增加工质的内能,分用于工质对外 作膨胀功,也说 明定压过程,加 给工质的热量 等于焓增。
2121()()p v v R T T =-=- 理想 6.热力过程在P —V 图,T —S 图上的表示。
12v -↑→↑∆膨胀T 1-2吸热s>0 0p q < 12v ''-↓→↓∆压缩T 1-2放热s<0 0p q <21()w P v v =- Tds q δ= 定容:21lnT s cv T ∆= 定压:21ln T s cp T ∆= ∴曲线是对数曲线※从上图可知,定容过程与定压过程在T —S 图上都是一条对数曲线,但定压线的斜率小,更为平坦。
证明:∵ vq ds T=定容过程 q du pdv δ=+ du = ∴ du ds T=dT cvT= ∴ ()v T T S cv∂=∂ 而定压过程P q dh c dT δ==∴ P dTds c T= ∴ ()P PT T S c ∂=∂∵P v P VT T c c c c <⇒< ()()lg lg P V P V T T S S K K p v∂∂⇒<∂∂⇒<⇒∂<∂ ∴ 从同一点出发的定压线较平坦 12()1t kw R T T k =-- 112212111211()11111K K K Kp v p v K p KRT K p V KRT K V --=--⎡⎤⎛⎫⎢⎥=- ⎪⎢⎥-⎝⎭⎢⎥⎣⎦⎡⎤⎛⎫⎢⎥=- ⎪-⎢⎥⎝⎭⎣⎦显然t w kw =膨4—4 定温过程1.定义:工质在状态变化过程中温度保持不变。
2.过程方程式T PV ==定值定值3.初终状态参数之间的关系。
∵T PV ==定值定值⇒1212T T pv pv ==说明:理想气体温度不变时,压力和比容互成反比。
4.过程中 : ∴,,u h s ∆∆∆2211()0v vm u u c T T ∆=∆=-= 2211()0p pm h h c T T ∆=∆=-=2221112211122211V P P V T V VS C In RIn RIn T V V T P P C InRIn RIn T P P V P C InC In V P ∆=+==-==+ 5.过程中的q .w2221111122t t dq du pdv pdv w V p p RT RT q dV RTIn RTIn q dp w RTIn V V p P p w w =+==⎡⎤∴====-==⎢⎥⎣⎦=⎰⎰膨膨 可见:定温过程加给工质的热量全部用于对外做功,气体被压缩时,外界加给的功全部转化为热能。
6.热力过程在P-V 图、T-S 图上的表示1-2. 膨胀 W>0 P ↓ V ↑ 1-2 吸热 △S>0 1-2’ 压缩 W<0 P ↑ V ↓ 1-2’ 吸热 △S<0稳定流动的开口系统,若其工质的流动动能和重力位能的变化可以忽略不计,,定温过程中系统所作的 轴功为:4—5 绝热过程1.定义:状态变化任何一段微元过程中工质与外界都不发生热量交换的过程。
即:0q δ= 2.过程方程式kpv =常数 式中1cpk cp cv k cv=>⇒>绝热指数这个过程的方程式可根据过程的特点,借助理气状态方程式由热力学第一定律导出。
根据 0q q cvdT pdv pv RTδδ==+= 0cvdT pdv ⇒+=又 ∵ pv T R= ∴()0()0()0()0000vv v v v pvcv d pdv Rc d pv pdv Rc pdv vdp Rpdv c R pdv c vdp cp pdv c vdp cppdv vdp cvkpdv vdp +=+=++=++=+=+=+=同除 pv 则 0dv dp kv p+= ln ln ln k dv dpkv p k v p pv +=+==⎰⎰定值定值定值∴ kpv =定值3.初终态参数之间的关系∵ kpv =定值 ∴1122k k p v p v =2112kp v p v ⎛⎫= ⎪⎝⎭又∵ pv RT =1211212211k k kT v T v T p T p --⎛⎫= ⎪⎝⎭⎛⎫= ⎪⎝⎭4.过程中的 ,,u h s ∆∆∆22112211()()0v p k u u Cvm T T h h Cpm T T q s T δ∆=∆=-∆=∆=-∆== 5.绝热过程中的技术功12t q dh vdpw h h h δ=-=-∆=- 说明工质在绝热过程中所做的技术工等于焓降对于理想气2121()t w h Cpm T T =-∆=-定比热 1212()()t w cp t t cp T T =-=-将 1k Cp R k-=代入上式4—6 多变过程上节我们讨论了四种典型的热力过程,它是实际过程忽略一些次要因素后有一个共同的特征。
