微生物大小与数量的测定实验报告
微生物大小的测定及显微镜直接计数法

微⽣物⼤⼩的测定及显微镜直接计数法微⽣物学实验报告姓名年级班级组别⼀组同组者科⽬微⽣物题⽬微⽣物⼤⼩和数量的测定仪器编号⼀、⽬的要求1.学习并掌握使⽤显微镜测微尺测定微⽣物⼤⼩的⽅法。
2.了解⾎球计数板的构造、明确其计数原理。
3.学习并掌握使⽤⾎球计数板测定微⽣物细胞或孢⼦数量的⽅法。
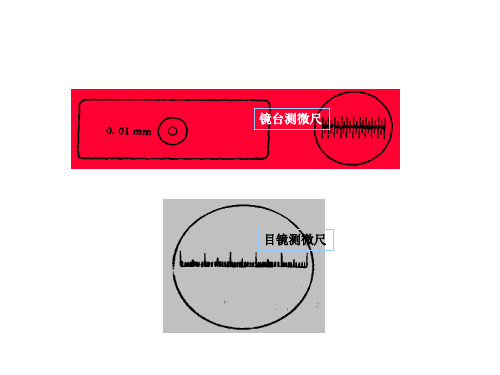
⼆、基本原理l.显微测微尺可⽤于测量微⽣物细胞或孢⼦的⼤⼩,包括镜台测微尺和⽬镜测微尺两个部件。
镜台测微尺全长1mm,等分为100格,每格0.01mm。
⽤于校正⽬镜测微尺没⼩哥的长度.⽬镜测微尺其中央刻有50等分或100等分的⼩格.测量前应预先⽤镜台测微尺来校正并计算出在某⼀放⼤镜下,⽬镜测微尺每⼩格所代表的实际长度,再以后作为测量微⽣物细胞的长度.⽬镜测微尺每格长度(µm)=(两重合线间镜台测微尺格数x10)/两重合线间⽬镜测微尺格数2.球菌⽤直径表⽰⼤⼩;杆菌⽤宽和长来表⽰µm图⼀:测微尺的校正3.显微直接计数法:将⼩量待测样品悬浮液置于计菌器上,于显微镜下直接计数的⼀种简便、快速、直观的⽅法。
显微计数法适⽤于各种含单细胞菌体的纯培养悬浮液,如酵母、细菌、霉菌孢⼦等。
菌体较⼤的酵母菌或霉菌孢⼦可采⽤⾎球计数板,⼀般细菌则采⽤彼得罗夫·霍泽(Petrof Hausser)细菌计数板或Hawksley计数板。
三种计数板的原理和部件相同,只是细菌计数板较薄,可以使⽤油镜观察。
⽽⾎球计数板较厚,不能使⽤油镜,计数板下部的细菌不易看清。
⾎球计数板是⼀块特制的厚型载玻⽚,载玻⽚上有4条槽⽽构成3个平台。
中间较宽的平台,被⼀短横槽分隔成两半,每个半边上⾯各有⼀个计数区。
计数区的刻度有两种:⼀种是计数区(⼤⽅格)分为16个中⽅格,⽽每个中⽅格⼜分成25个⼩⽅格;另⼀种是⼀个计数区分成25个中⽅格,⽽每个中⽅格⼜分成16个⼩⽅格。
计数区由400个⼩⽅格组成。
每个⼤⽅格边长为1mm,其⾯积为lmm2,盖上盖玻⽚后,盖载玻⽚间的⾼度为0.1mm,所以每个计数区的体积为0.1mm3。
微生物大小测定及计数

2、在不改变目镜和目镜测微尺,而改用不同放大倍数的物镜来测定同一菌体大小时,其测定结果是否相同,为什么?
答:测定结果不相同。因为在不同倍数的目镜下,细菌大小发生变化,而目镜测微尺每格大小不变,所以测定结果不同。
四、仪器和其他用品:载玻片、盖玻片、显微镜、镊子、接种环、血球计数板、显微测微尺、滴管、酒精灯
五、操作步骤:
1、微生物大小的测定
(1)取下显微镜右目镜,将目镜测微尺放在目镜镜筒内的隔板上,然后放上目镜透镜,将目镜装回镜筒。
(2)校正目镜测微尺:在低倍镜下调节焦距,当清晰看到镜台测微尺的刻度后,用推进器移动镜台测微尺,使两尺在某一区域内两线完全重合,然后分别输出两重合线之间镜台测微尺和目镜测微尺所占的格数。
(2)将血球计数板盖上盖玻片,用无菌毛细管吸取少量摇匀的酿酒酵母菌液,滴在盖玻片的一个顶点,待菌液从盖玻片另一对角流出为满。
(3)先在低倍镜下找到计数室,再用高倍镜计数。每小格内的菌数不能超过8个为宜。当每小格内的菌数过多时,适当稀释。
(4)任选5个中格计数(5个中格不可以挨着;酵母菌出芽计1个菌体;计数时,位于边线上的细胞,记上不记下,计左不计右)
(3)用同样的方法在高倍镜下和油镜下进行校正。并计算目镜测微尺每小格所代表的实际长度。
(4)制酵母菌玻片:用接种环取菌在蒸馏水中涂抹,加热干燥,用美兰染色1’30”,流水脱色,自然干燥。
(5)先在低倍镜和高倍镜下找到菌株,再在油镜下测出酵母菌的长度和宽度。重复3次并记下平均值。
2、酵母菌的显微计数
(1)将血球计数板洗净,再用95%乙醇棉球擦洗,自然干燥。
sdu
微生物大小及数量测定
一、实验目的:
实验报告(8)

微生物大小及数量测定姓名:张弛学号:201100140157 班级:生院2011级生物基地生北周一第六组同组者:关事成、钱丹丹、喻心仪、刘婷婷、钟天白一、实验目的1、学习并掌握测微尺的使用和计算方法,完成对酿酒酵母的大小测量2、了解血球计数板的构造、明确其计数原理3、掌握使用血球计数板显微镜下直接进行微生物计数的方法二、实验原理1、测微尺测量大小(1)测微尺的构造:显微镜测微尺是由目镜测微尺和镜台接物测微尺组成目镜测微尺是一块圆形玻璃片,其中有精确的等分刻度,在5mm 刻尺上分50 份。
目镜测微尺每格实际代表的长度随使用接目镜和接物镜的放大倍数而改变,因此在使用前必须用镜台测微尺进行标定。
镜台测微尺为一专用的载玻片,中央有精确等分线将长为1mm 的直线等分成100 个小格,每格长10μm,专用于校正目镜测微尺。
两重合线间镜台测微尺格数X10目镜测微尺每格长度(μm)=————————————————两重合线间目镜测微尺格数(2)球菌用直径表示大小;杆菌用宽和长来表示2、血球计数法血球计数板是一块特制的厚型载玻片,载玻片上有4条槽而构成3个平台。
中间较宽的平台,被一短横槽分隔成两半,每个半边上面各有一个计数区。
计数区的刻度有两种:一种是计数区(大方格)分为16个中方格,而每个中方格又分成25个小方格;另一种是一个计数区分成25个中方格,而每个中方格又分成16个小方格。
计数区由400个小方格组成。
每个大方格边长为1mm,其面积为lmm2,盖上盖玻片后,盖载玻片间的高度为0.1mm,所以每个计数区的体积为0.1mm3。
使用血球计数板计数时,通常测定五个中方格的微生物数量,求其平均值,再乘以25或16,就得到一个大方格的总菌数,然后再换算成1毫升菌液中微生物的数量。
因此:每ml菌悬液中含有细胞数= 5x104AxB(25个中格)或=3.2x104AxB(16个中格)三、实验器材1、菌种:酿酒酵母2、仪器、材料:(1)测量大小:显微镜、目镜测微尺、镜台测微尺、擦镜纸、香柏油、二甲苯(2)菌种计数:显微镜、血球计数板、盖玻片、吸水纸、计数器、无菌滴管、擦镜纸等。
微生物的大小及数量的测定

微生物试验报告
内沿盖玻片的右上角滴入一小滴(不宜过多), 使菌液沿两玻片间自行渗入计数室, 勿使产生气泡,并用吸水纸吸去沟槽中流出的多余菌液。 (3)先在低倍镜下找到计数室后,再转换高倍镜观察计数。 (4)计数时用 16 中格的计数板,要按对角线方位,取左上、左下、右上、右下的 4 个中格(即 100 小格)的酵母菌数。如果是 25 中格计数板。除数上述四格外, 还需数中央 1 中格的酵母菌数(即 80 小格)。由于菌体在计数室中处于不同的空 间位置,要在不同的焦距下才能看到,因而观察时必须不断调节微调螺旋,方能 数到全部菌体, 防止遗漏。 如菌体位于中格的双线上, 计数时则数上线不数下线, 数左线不数右线,以减少误差。 (5)凡酵母菌的芽体达到母细胞大小一半时,即可作为两个菌体计算。每个样品 重复分数 2-3 次(每次数值不应招差过大,否则应重新操作),取其平均值,按下 述 公 式 计 算 出 每 毫 升 菌 液 所 含 酵 母 菌 细 胞 数 ( 25 中 格 )。
关键词
目镜测微尺 物镜测微尺 血球计数板
前言
微生物细胞的大小, 是微生物重要的形态特征之一,也是分类鉴定的依据之 一, 也让我们对微生物的实际大小有了一个感性的认识。微生物数量的测定在微 生物生长曲线中运用非常重要, 我们从微生物的数量上了解其生长状况,这也能 指导我们的生产工业。
一、 实验目的
1. 了解显微镜测定微生物大小与血球计数板测定微生物数量的原理。 2. 学习并掌握显微镜下测定微生物细胞大小的技术,包括目镜测微尺、镜台测 微尺的校正技术与测定细胞大小的技术。 3. 了解血球计数板的结构,学习并掌握血球计数板计数微生物数量的技术,包 括样品的点样、菌数计数的方法与计算。
1
微生物(2) 镜台测微尺(图 2)
微生物大小的测定报告

微生物大小的测定报告微生物大小的测定报告微生物是生物界中一类非宏观、非个体、非生物和非细胞的微小生物的总称。
它们具有体积小、数量大、分布广、种类多、生命力旺盛等特点,与人类的生产、生活密切相关。
微生物大小的测定是微生物学研究中的一项基本技术,对于了解微生物的种类、生长和繁殖等方面具有重要意义。
本文将详细介绍微生物大小的测定方法、测定步骤以及结果分析等方面的内容。
一、测定方法微生物大小的测定方法有很多,如显微测量法、压滤法、离心法等。
其中,显微测量法是最常用的一种方法,其原理是利用显微镜对微生物的大小进行直接测量。
具体步骤如下:1.准备显微镜、血球计数板、盖玻片、吸管等实验器材。
2.用吸管吸取一定量的微生物培养液,轻轻滴在血球计数板上,然后盖上盖玻片。
3.在显微镜下观察并计数,记录每个视野中的微生物数量和大小。
4.重复以上步骤多次,求平均值,即可得到微生物的平均大小。
二、测定步骤1.准备试剂和器材(1)试剂:无菌水、生理盐水、无菌玻璃珠、无菌平皿等。
(2)器材:移液器、无菌吸管、无菌涂布器、无菌镊子、电子天平等。
2.制备菌悬液(1)用电子天平称取适量的细菌干粉,加入无菌生理盐水,摇匀。
(2)用移液器吸取上述菌悬液,加入无菌平皿中,加入无菌玻璃珠,摇匀。
(3)用无菌涂布器将上述菌悬液涂布到平皿表面,静置片刻,让细菌贴壁生长。
3.测定菌落大小(1)在上述平皿中加入无菌水,让水面覆盖平皿表面。
(2)用无菌镊子将平皿翻转,让细菌接种到无菌水表面,涂布均匀。
(3)静置约30分钟,让细菌形成单个菌落。
(4)用游标卡尺测量每个菌落的大小,记录数据。
4.数据处理和分析(1)对每个平皿中的菌落数量和大小进行统计,求出平均值。
(2)将平均值与对照组进行比较,判断细菌的生长情况。
三、结果分析通过上述测定步骤,我们得到了微生物的大小数据。
根据数据可以得出以下结论:1.同一时间内,不同微生物的大小有差异。
例如,细菌和原生动物的大小相差很大,这与它们的生物学特性有关。
微生物大小与菌群数量的测定实验 史倩

微生物大小与菌群数量的测定实验一、实验目的1.学习并掌握微生物大小及菌落数量的测量方法2.了解血细胞计数板和显微镜测微尺的使用二、实验原理酵母菌(yeast)是一群单细胞的真核微生物。
这个词语为无分类学意义的普通名称,通常用于以裂殖或芽殖来进行无性繁殖的单细胞真菌,以与霉菌分开。
大多数酵母菌为单细胞,在光学显微镜下,一般呈卵圆形、圆形、圆柱形或柠檬形。
大小约为(1-5)μm╳(5-30)μm,最大可达100μm。
各种酵母菌有其一定的大小和形态,但也随菌龄和环境条件而异。
枯草芽孢杆菌(Bacillus subtilis)是芽孢杆菌属的一种。
单个细胞0.7~0.8×2~3μm,着色均匀。
无荚膜,周生鞭毛,能运动。
革兰氏阳性菌,芽孢0.6~0.9×1.0~1.5μm,椭圆到柱状,位于菌体中央或稍偏,芽孢形成后菌体不膨大。
显微测微尺包括镜台测微尺和目镜测微尺两部分。
镜台测微尺是中央部分刻有精确等分线的载玻片,一般将1mm等分为100格,每格长l0μm(即0.0lmm),是专门用来校正目镜测微尺的。
校正时,将镜台测微尺放在载物台上,由于镜台测微尺与细胞标本是处于同一位置,都要经过物镜和目镜的两次放大成象进入视野,因此从镜台测微尺上得到的读数就是细胞的真实大小,所以可求出目镜测微尺每格所代表的长度,然后移去镜台测微尺,换上待测标本片,用校正好的目镜测微尺在同样放大倍数下测量微生物大小。
目镜测微尺是一块可放在接目镜内的隔板上的圆形小玻片,其中央刻有精确的刻度,等分成100小格两种,每5小格间有一长线相隔。
由于所用接目镜放大倍数和接物镜放大倍数的不同,目镜测微尺每小格所代表的实际长度也就不同,因此,目镜测微尺不能直接用来测量微生物的大小,在使用前必须用镜台测微尺进行校正,以求得在一定放大倍数的接目镜和接物镜下该目镜测微尺每小格的相对值,然后才可用来测量微生物的大小。
镜台测微尺是一个特制载玻片中央封固的标准刻尺,其尺度总长为1mm,精确分为10个大格,每个大格又分为10个小格,共100个小格,每一个小格长度为0.01mm,即10μm。
微生物大小与数量的测定实验报告

微生物大小与数量的测定实验报告一、实验目的本次实验旨在掌握使用显微镜测量微生物大小的方法,以及学会运用血球计数板对微生物数量进行测定。
通过实验操作和数据处理,深入了解微生物的形态特征和种群密度,为后续的微生物学研究打下基础。
二、实验原理(一)微生物大小的测定微生物细胞的大小是微生物的基本特征之一。
使用显微镜测微尺可以较为准确地测量微生物细胞的长度、宽度和直径等参数。
显微镜测微尺包括目镜测微尺和镜台测微尺。
目镜测微尺是一块可放在目镜内的圆形小玻片,上面刻有刻度;镜台测微尺是一块特制的载玻片,中央有精确的刻度,用于校正目镜测微尺。
(二)微生物数量的测定血球计数板是一种专门用于计算较大单细胞微生物数量的工具。
它由一块特制的厚玻璃片制成,玻片上有四个槽构成三个平台。
中间的平台又被一短横槽隔成两半,每半边上面各刻有一个方格网。
方格网上刻有 9 个大方格,其中只有中间的一个大方格为计数室。
计数室的刻度一般有两种规格,一种是一个大方格分成 16 个中方格,而每个中方格又分成 25 个小方格;另一种是一个大方格分成 25 个中方格,而每个中方格又分成 16 个小方格。
但无论哪种规格,每个大方格的边长均为 1 毫米,盖上盖玻片后,计数室的容积是一定的。
因此,在一定体积的菌液中,通过计算微生物在计数室中的数量,就可以换算出菌液中微生物的数量。
三、实验材料与仪器(一)材料枯草芽孢杆菌、酿酒酵母的菌悬液。
(二)仪器显微镜、目镜测微尺、镜台测微尺、血球计数板、盖玻片、滴管、擦镜纸、吸水纸等。
四、实验步骤(一)微生物大小的测定1、安装目镜测微尺将目镜测微尺装入目镜的隔板上,注意有刻度的一面朝下。
2、校正目镜测微尺(1)将镜台测微尺置于载物台上,先用低倍镜观察,找到镜台测微尺的刻度线。
(2)移动镜台测微尺,使镜台测微尺与目镜测微尺的刻度线平行,并使两者的“0”刻度线重合。
(3)换用高倍镜观察,找出两尺再次重合的刻度线。
分别记录目镜测微尺和镜台测微尺在重合线段内各自的格数。
微生物大小与数量的测定实验报告

微⽣物⼤⼩与数量的测定实验报告微⽣物⼤⼩与数量的测定实验报告Company number:【0089WT-8898YT-W8CCB-BUUT-202108】⼭东⼤学实验报告2017年11⽉27⽇ _________________________________________________________________科⽬:微⽣物学实验题⽬:微⽣物⼤⼩与数量的测定姓名:丁志康⼀、⽬的要求1.学习并掌握⽤测微尺测定微⽣物⼤⼩的⽅法。
2.增强微⽣物细胞⼤⼩的感性认识。
3. 明确⾎细胞计数板计数的原理。
4. 掌握使⽤⾎细胞计数板进⾏微⽣物计数的⽅法。
⼆、基本原理⼀)微⽣物⼤⼩的测定1.微⽣物细胞的⼤⼩是微⽣物基本的形态特征,也是分类鉴定的依据之⼀。
微⽣物⼤⼩的测定,需要在显微镜下,借助于特殊的测量⼯具——测微尺,包括⽬镜测微尺和镜台测微尺。
2.镜台测微尺是中央部分可有精确等分线的载玻⽚,⼀般是将1mm等分为100格每格长(即10µm)。
镜台测微尺并不直接⽤来测量细胞的⼤⼩,⽽是⽤于矫正⽬镜测微尺每格的相对长度。
3.⽬镜测微尺是⼀块可放⼊接⽬镜内的圆形⼩玻⽚,其中央有精确的等分刻度,有等分为50⼩格和100⼩格两种。
测量时,需将其放在接⽬镜中的隔板上,⽤以测量经显微镜放⼤后的细胞物象。
由于不同显微镜或不同的⽬镜和物镜组合放⼤倍数不同,⽬镜测微尺每⼩格所代表的实际长度也不⼀样。
因此,⽤⽬镜测微尺测量微⽣物⼤⼩时,必须先⽤镜台测微尺进⾏校正,以求出该显微镜在⼀定⼤放⼤倍数的⽬镜和物镜下,⽬镜测微尺每⼩格所代表的相对长度。
然后根据微⽣物细胞相当于⽬镜测微尺的格数,即可计算出细胞的实际⼤⼩。
4.球菌⽤直径来表⽰其⼤⼩;杆菌则⽤宽和长的范围来表⽰。
如⾦黄⾊葡萄球菌直径约为µm,枯草芽孢杆菌⼤⼩为~×2~3µm。
⼆)微⽣物数量的测定1.微⽣物数量的测定有多种⽅法,本次试验中使⽤显微镜直接计数法。
微生物大小的测定实验报告

微生物大小的测定实验报告实验室报告微生物大小的测定实验报告实验目的:本实验旨在通过显微镜观察和测量不同大小微生物的大小,以便更好地了解它们的特殊特征以及对它们的分类。
实验方法:1. 准备照相显微镜和放大物体;2. 将待观测微生物置于干净的载玻片上;3. 加入少量染料并将其涂匀覆盖;4. 将载玻片移至显微镜下,红外线光源下控制光线的亮度,将微生物的图像放大至目标大小;5. 使用图像处理软件对目标大小进行计算,并记录下其测量结果;实验结果:使用上述实验方法,共分别对霉菌、酵母菌和细菌进行大小测量,并得到如下的实验结果:表1. 不同菌株微生物大小测量结果菌株 | 菌丝长度(μm) | 菌孢长度(μm) | 细菌长度(μm)-----------------------------------------------A | 50-60 | | |B | 30-40 | 5-6 | |C | 20-25 | 2-3 | 1.2-1.5 |D | | | 3.5-4.5 |以上数据表显示了不同微生物的大小范围。
其中,实验发现,霉菌的菌丝长度最大,而酵母菌和细菌则相对较小。
小结:本实验给出了微生物大小的基本测量数据,并且证明了不同微生物的大小是有区别的。
这对于更深入地了解微生物的特征起到了极为重要的作用。
本实验也为生物学的研究提供了重要原始数据。
参考文献:[1] 桑巴斯瓦央蒂, 金钱龙. 显微镜下的电荷力显微镜图像微生物大小特征研究[J]. 桑巴氏微生物学报, 2015, 15(2): 56-63.[2] 李森, 许嘉宜. 微生物的分类[J]. 生物学知识, 2013, 18(4): 1-3.。
微生物大小和数量的测定
第6页
微生物大小和数量的测定
第7页
血球计数板计数
微生物大小和数量的测定
第8页
计数时,通常数五个中格总菌数,然后求得每 个中格平均值,然后再换算成lml菌液中总菌数。
假如是25个中方格计数板, 1mL菌液中总菌数=A/5×25×104×B=50000A·B(个 ) A为五个中方格中总菌数,B为菌液稀释倍数.
镜测微尺轻轻放在目镜隔板上,使有刻度一面朝下。将 镜台测微尺放在显微镜载物台上,使有刻度一面朝上。 先用低倍镜观察,调焦距,待看清镜台测微尺刻度后, 转动目镜,使目镜测微尺刻度与镜台测微尺刻度相平行 ,并使两尺左边一条线重合,向右寻找另外一条两尺相 重合直线。
2.标定公式: 计算两刻度间目镜测微尺格数和镜台测微尺格数。因 为镜台测微尺刻度每格长10µm,所以可得:
微生物大小和数量的测定
第10页
假如是16个中方格计数板, 1mL菌液中总菌数=A/5×16×104×B=3A·B(个)
微生物大小和数量的测定
第9页
(三)器材 1.菌种 酿酒酵母 2.仪器或其它用具 血球计数板,显微镜,盖玻片,无
菌毛细滴管。 (四)操作步骤 l.菌悬液制备 以无菌生理盐水将酿酒酵母制成浓度适当菌悬液。 2.镜检计数室 在加样前,先对计数室进行镜检。若有污物,则需清洗, 吹干后才能进行计数。 3.加样品 将清洁干燥血细胞计数板盖上盖玻片,再用无菌毛细 滴管将摇匀酿酒酵母菌悬液由盖玻片边缘凹槽滴加,菌 液沿缝隙靠毛细渗透作用自动进入计数室,普通计数室均 能充满菌液。 取样时先要摇匀菌液;加样时计数室不可有气泡产生。
镜台测微尺玻片很薄,如需标定油镜头时, 要格外注意,以免压碎镜台测微尺或损坏镜头。
思索题 为何不一样放大倍数目镜和物镜必须分别进行标 定?
实验五微生物数量和大小测定霉菌的观察

生长条件
霉菌可以在多种环境条 件下生长,如湿度、温
度、pH等。
分布广泛
霉菌在自然界中分布广 泛,可在土壤、空气、
水体等环境中生长。
03 实验步骤
样品采集与制备
样品采集
选择具有代表性的样品,如食品、土壤、水等,采集时要避免污染和交叉感染。
样品制备
将采集的样品进行适当处理,如破碎、稀释、过滤等,以便后续的实验操作。
实验五:微生物数量和大小测定霉菌的观察
目 录
• 实验目的 • 实验原理 • 实验步骤 • 实验结果与分析 • 结论与讨论 • 参考文献
01 实验目的
了解微生物数量和大小的测定方法
01
02
03
显微镜计数法
通过显微镜观察并计数样 品中的微生物数量,根据 视野范围和放大倍数计算 出微生物的数量。
平板计数法
将样品稀释后涂布在培养 基上,培养后统计菌落数 量,计算出样品中的微生 物数量。
流式细胞术
利用流式细胞仪对微生物 进行计数和大小测量,具 有快速、准确和高通量的 特点。
学习观察霉菌的方法和技巧
Hale Waihona Puke 010203
04
培养基制备
选择适合霉菌生长的培养基, 如PDA培养基,按照配方配
制培养基并灭菌。
接种与培养
参考文献
霉菌的形态特征
霉菌在显微镜下呈现丝状或分支状结构,通常为白色或灰色。
观察培养基
选择适合霉菌生长的培养基,如孟加拉红培养基或察氏培养基,以 促进霉菌的生长和观察。
计数方法
采用菌落计数法,通过在显微镜下观察培养基表面上的霉菌菌落数 量,计算出每克或每毫升样品中的霉菌数量。
THANKS FOR WATCHING
实验二:微生物细胞大小与数量的测定

实验二:微生物细胞大小与数量的测定一、实验目的与要求:(1)了解显微镜测定微生物大小与血球计数板测定微生物数量的原理。
(2)学习并掌握显微镜下测定微生物细胞大小的技术,包括目镜测微尺、物镜测微尺的校正技术与测定细胞大小的技术。
(3)了解血球计数板的结构,学习并掌握血球计数板计数微生物数量的技术,包括样品的点样、菌数计数的方法与计算。
二、实验原理1.微生物大小测定原理微生物细胞的大小,是微生物重要的形态特征之一,也是分类鉴定的依据之一。
由于菌体很小、只能在显微镜下来测量。
用于测量微生物细胞大小的工具有目镜测微尺和镜台测微尺。
目镜测微尺(图20-1)是一块圆形玻片,在玻片中央把5mm长度刻成50等分,或把10 mm长度刻成100等分。
测量时,将其放在接目镜中的隔板上(此处正好与物镜放大的中间像重叠)来测量经显微镜放大后的细胞物象。
由于不同目镜、物镜组合的放大倍数不相同,目镜测微尺每格实际表示的长度也不一样,因此目镜测微尺测量微生物大小时须先用置于镜台上的镜台测微尺校正,以求出在一定放大倍数下,目镜测微尺每小格所代表的相对长度。
镜台测微尺(图20-2)是中央部分刻有精确等分线的载玻片,一般将lmm等分为100格,每格长l0μm(即0.0lmm),是专门用来校正目镜测微尺的。
校正时,将镜台测微尺放在载物台上,图 20-1目镜测微尺由于镜台测微尺与细胞标本是处于同一位置,都要经过物镜和目镜的两次放大成象进入视野,即镜台测微尺随着显微镜总放大倍数的放大而放大,因此从镜台测微尺上得到的读数就是细胞的真实大小,所以用镜台测微尺的已知长度在一定放大倍数下校正目镜测微尺,即可求出目镜测微尺每格所代表的长度,然后移去镜台测微尺,换上待测标本片,用校正好的目镜测微尺在同样放大倍数下测量微生物大小。
2.血球计数板测定微生物数量的原理镜检计数法适用于各种含单细胞菌体的纯培养悬浮液,如有杂菌或杂质常不易分辨。
菌体较大的酵母菌或霉菌泡子可采用血球计数板;一般细菌则采用彼得罗夫·霍泽(Petroff Hausser)细菌计数板。
实验五微生物大小的测定

实验五微生物大小的测定实验五微生物大小的测定一、实验目的1. 学会测微尺的使用和计算方法。
2. 学习用测微尺对细菌和酵母菌的测量方法。
二、实验内容:1.认识测微尺,学习目镜测微尺的标定。
2.测定细菌和酵母菌菌体的大小。
三、实验材料和用具金黄色葡萄球菌、大肠杆菌和酵母菌的菌种斜面。
香柏油、擦镜液。
显微镜、目镜测微尺、镜台测微尺、擦镜纸。
四、操作步骤l.测微尺的构造显微镜测微尺是由目镜测微尺和镜台接物测微尺组成,目镜测微尺是一块圆形玻璃片,其中有精确的等分刻度,在5mm刻尺上分50份。
目镜测微尺每格实际代表的长度随使用接目镜和接物镜的放大倍数而改变,因此在使用前必须用镜台测微尺进行标定。
镜台测微尺为一专用中央有精确等分线的载玻片,一般将长为1mm的直线等分成100个小格每格长0.0lmm即10μm,是专用于校正目镜测微尺每格长度的。
2.目镜测微尺的标定把目镜的上透镜旋开,将目镜测微尺轻轻放在目镜的隔板上,使有刻度的一面朝下。
将镜台测微尺放在显微镜的载物台上,使有刻度的一面朝上。
先用低倍镜观察,调焦距,待看清镜台测微尺的刻度后,转动目镜,使目镜测微尺的刻度与镜台测微尺的刻度相平行,并使两尺左边的一条线重合,向右寻找另外一条两尺相重合的直线。
3.计算方法标定公式:目镜测微尺每格长度(μm)=两条重合线间镜台测微尺的格数×10/两条重合线间目镜测微尺的格数例如,目镜测微尺20个小格等于镜台测微尺3小格,已知镜台测微尺每格为10μm,则3小格的长度为3×10=30μm,那么相应地在目镜测微尺上每小格长度为3×10÷20=1.5μm。
用以上计算方法分别校正低倍镜、高倍镜及油镜下目镜测微尺每格实际长度。
4.菌体大小的测定将镜台测微尺取下,分别换上大肠杆菌及金黄色葡萄球菌玻片标本,先在低倍镜和高倍镜下找到目的物,然后在油镜下用目镜测微尺测量菌体的大小。
先量出菌体的长和宽占目镜测微尺的格数,再以目镜测微尺每格的长度计算出菌体的长和宽。
微生物大小的测定及数量的测定

微生物的大小测定与数量的测定一、实验目的1.学习了解测微尺的结构,掌握测定微生物大小的方法。
2.观察酵母菌的形态,掌握鉴别死活酵母菌的方法。
3.学习了解血球计数板的结构,掌握微生物数量测定的方法。
二、实验内容1.在低倍镜和高倍镜下求出目镜测微尺的校正值。
(1)目镜测微尺和镜台测微尺目镜测微尺是一块圆形玻片,在玻片的中央刻有一小尺,它是在 5 毫米内作50 等分刻制的,每一等份为0.1 毫米。
另一规格是 5 毫米作100 等分,每等分为0.05毫米。
镜台测微尺是刻在载玻片中央的小尺,它是在1 毫米内作100 等分刻成的,每等分10 微米。
(2)目镜测微尺校正的方法将镜台测微尺上面的透镜片取下,把目镜测微尺放在光阑上,刻度朝下。
把镜台测微尺置于载物台上,用低倍物镜检视,使测微尺位于视野中央。
注意区分视野内两把尺哪个是目镜测微尺,哪个是镜台测微尺。
利用推进器或转动目镜使两尺的第一条线(0 线)互相重合,然后找出另一条重合线。
如重合线较多选取距0 线最远的重合线。
记下两条重合线之间两尺的刻度,依公式算出目镜测微尺的校正值。
目镜测微尺校正值(每刻度微米数)= 两重叠刻度间镜台测微尺格数×10两重叠刻度间目镜测微尺格数2.用美兰水浸片法观察酿酒酵母(saccharomyces cerevisiac)的形态,注意出芽繁殖和死活酵母菌的染色形态,并测量大小。
3.用血球板计算黑曲霉孢子的数量。
(1)血球计数板3.用血球板计算黑曲霉孢子的数量。
(1)血球计数板利用血球计数板在显微镜下直接计数是一种常见的微生物计总数的方法。
因为计数板载片和盖片间的容积一定,所以可以根据显微镜下观察到的微生物数目来计算单位体积内微生物总数。
血球计数板是一只特制载玻片。
载片上有两个方格网,每一方格网共分九个大方格,其中间的一个大方格用来做微生物计数,所以又称为计数室。
计数室的刻度一般有两种,一种是每个大方格分成16 个中方格,每中方格又分成25个小方格。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
山东大学实验报告2017年11月27日________________________________________ _________________________科目:微生物学实验题目:微生物大小与数量的测定姓名:丁志康一、目的要求1.学习并掌握用测微尺测定微生物大小的方法。
2.增强微生物细胞大小的感性认识。
3. 明确血细胞计数板计数的原理。
4. 掌握使用血细胞计数板进行微生物计数的方法。
二、基本原理一)微生物大小的测定1.微生物细胞的大小是微生物基本的形态特征,也是分类鉴定的依据之一。
微生物大小的测定,需要在显微镜下,借助于特殊的测量工具——测微尺,包括目镜测微尺和镜台测微尺。
2.镜台测微尺是中央部分可有精确等分线的载玻片,一般是将1mm等分为100格每格长0.01mm(即10μm)。
镜台测微尺并不直接用来测量细胞的大小,而是用于矫正目镜测微尺每格的相对长度。
3.目镜测微尺是一块可放入接目镜内的圆形小玻片,其中央有精确的等分刻度,有等分为50小格和100小格两种。
测量时,需将其放在接目镜中的隔板上,用以测量经显微镜放大后的细胞物象。
由于不同显微镜或不同的目镜和物镜组合放大倍数不同,目镜测微尺每小格所代表的实际长度也不一样。
因此,用目镜测微尺测量微生物大小时,必须先用镜台测微尺进行校正,以求出该显微镜在一定大放大倍数的目镜和物镜下,目镜测微尺每小格所代表的相对长度。
然后根据微生物细胞相当于目镜测微尺的格数,即可计算出细胞的实际大小。
4.球菌用直径来表示其大小;杆菌则用宽和长的范围来表示。
如金黄色葡萄球菌直径约为0.8μm,枯草芽孢杆菌大小为0.7~0.8×2~3μm。
二)微生物数量的测定1.微生物数量的测定有多种方法,本次试验中使用显微镜直接计数法。
显微镜直接计数法是将少量待测样品的悬浮液置于一种特别的具有确定面积和容积的载玻片上(又称计菌器),于显微镜下直接计数的一种简便、快速、直观的方法。
目前国内外常用的计菌器有:血细胞计数板、Peteroff-Hauser计菌器以及Hawksley计菌器等,它们都可用于酵母、细菌、霉菌孢子等悬液的计数,基本原理相同。
后两种计菌器由于盖上盖玻片后,总容积为0.02mm3,而且盖玻片和载波片之间的距离只有0.02mm,因此可用油浸物镜对细菌等较小的细胞进行观察和计数。
(除了用这些计菌器外,还有在显微镜下直接观察涂片面积与视野面积之比的估算法,此法一般用于牛乳的细菌学检查。
)显微镜直接计数法的优点是直观、快速、操作简单。
但此法的缺点是所测得的结果通常是死菌体和活菌体的总和。
目前已有一些方法可以克服这一缺点,如结合活菌染色微室培养(短时间)以及加细胞分裂抑制剂等方法来达到只计数活菌体的目的。
本实验以血球计数板为例进行显微镜直接计数。
2.用血细胞计数板在显微镜下直接计数是一种常用的微生物计数方法。
该计数板是一块特制的载玻片,其上由四条槽构成三个平台;中间较宽的平台又被一短横槽隔成两半,每一边的平台上3.各列有一个方格网,每个方格网共分为九个大方格,中间的大方格即为计数室。
计数室的刻度一般有两种规格,一种是一个大方格分成25个中方格,而每个中方格又分成16个小方格;另一种是一个大方格分成16个中方格,而每个中方格又分成25个小方格,但无论是哪一种规格的计数板,每一个大方格中的小方格都是400个。
每一个大方格边长为lmm,则每一个大方格的面积为lmm2,盖上盖玻片后,盖玻片与载玻片之间的高度为0.lmm,所以计数室的容积为0.lmm3(万分之一毫升)。
(本次试验所用血球计数板为25个中方格)4.计数时,通常数随机五个不相邻中方格的总菌数,然后求得每个中方格的平均值,再乘上25,就得出一个大方格中的总菌数,然后再换算成lml菌液中的总菌数。
5.设五个中方格中的总菌数为A,菌液稀释倍数为B,所以对于25个中方格的计数板,1mL菌液中的总菌数n=A/5×25×10^4×B=50000A·B(个)。
血球计数板三、器材1.菌种:大肠杆菌7d鞋面培养物,酿酒酵母24h液体合成培养基培养物。
2.仪器或其他用具:目镜测微尺,镜台测微尺,载玻片,盖玻片,显微镜,移液枪,血球计数板等。
四、操作步骤一)微生物大小的测定1.装目镜测微尺取出右目镜,把目镜上的透镜片旋下,将目镜测微尺刻度朝下放在目镜镜筒内的隔板上,然后旋上目镜透镜,再将目镜插入镜筒内。
2.校正目镜测微尺(1)放镜台测微尺将镜台测微尺刻度面朝上放在显微镜载物台上。
(2)校正先用低倍镜观察,将镜面测微尺有刻度的部分移至视野中央,调节焦距,当清晰的看到镜台测微尺的刻度后,转动目镜使目镜测微尺的刻度与镜台测微尺的刻度平行。
利用移动器移动镜台测微尺,使两尺在某一区域内两线完全重合,然后分别数出两重合线之间镜台微尺和目镜微尺所占的格数。
(3)计算由于已知镜台测微尺每格长10μm,根据下列公式即可分别计算处在不同放大倍数下,目镜测微尺每格所代表的长度。
目镜测微尺每格长度(μm)=用上述方法分别对低倍镜、高背景和油镜进行校正,分别测出在低倍镜、高倍镜和油镜下,两重合线之间两尺分别所占的格数,并用上述公式计算出不同倍镜下目镜测微尺每格所代表的长度。
(观察时光线不宜过强,否则难以找到镜台微尺的刻度;换高倍镜和油镜校正时,务必十分细心,防止接物镜压坏镜台微尺和损坏镜头。
)3.菌体大小的测定目镜测微尺校正完毕后,取下镜台测微尺,换上细菌染色制片。
先用低倍镜和高倍镜找到菌体后,换油镜测定大肠杆菌的宽度和长度。
测定时,通过转动目镜微尺和移动载玻片,测出大肠杆菌宽和长所占目镜测微尺的格数。
最后将所测得的格数乘以目镜测微尺(用油镜时)每格所代表的长度,即为该菌的实际大小。
测定酵母菌时,先将酵母菌培养物制成水浸片,然后用高倍镜测出宽和长各占目镜微尺的格数,最后,将测得的格数乘上目镜微尺(用高倍镜时)每格所代表的长度,即为酵母菌的实际大小。
通常测定对数生长期菌体来代表该菌的大小;可选择有代表性的3~5个细胞进行测定;细菌的大小需用油镜测定,以减少误差。
4.测定完毕取出目镜测微尺后将接目镜放回镜筒,再将目镜测微尺和镜台测微尺分别用擦镜纸擦拭干净,放回盒内保存。
二)微生物数量的测定1. 菌悬液制备以无菌生理盐水将酿酒酵母制成浓度适当的菌悬液。
2.镜检计数室在加样前,先对计数板的计数室进行镜检。
若有污物,则需清洗,吹干后才能进行计数。
3.加样品将清洁干燥的血细胞计数板盖上盖玻片,再用换上新枪头的移液枪移取少量摇匀的酿酒酵母菌悬液,之后由盖玻片边缘缓缓注入一小滴,让菌液沿缝隙靠毛细渗透作用自动进入计数室,一般计数室均能充满菌液。
(取样时先要摇匀菌液;加样时计数室不可有气泡产生。
)4.显微镜计数加样后静止5min,然后将血细胞计数板置于显微镜载物台上,先用低倍镜找到计数室所在位置,然后换成高倍镜进行计数。
调节显微镜光线的强弱适当,对于用反光镜采光的显微镜还要注意光线不要偏向一边,否则视野中不易看清楚计数室方格线,或只见竖线或只见横线。
5.清洗血细胞计数板使用完毕后,将血细胞计数板在水龙头用水冲洗干净,切勿用硬物洗刷,洗完后自行晾干或用吹风机吹干。
之后镜检,观察每小格内是否有残留菌体或其他沉淀物。
若不干净,则必须重复洗涤至干净为止。
在计数前若发现菌液太浓或太稀,需重新调节稀释度后再计数。
一般样品稀释度要求细菌每小格内约有5~10个菌体为宜,酵母菌每小格内约有2~6个菌体为宜。
每个计数室选5个中格(可选4个角和中央的一个中格)中的菌体进行计数。
位于格线上的菌体一般只数上方和右边线上的。
如遇酵母出芽,可按照各人习惯记或者不记芽体,但要在结果中注明芽体数目是否算入。
五、实验结果六、思考题(1)为什么更换不同放大倍数的目镜或物镜时,必须用镜台微尺重新对目镜测微尺进行校正?答:因为目镜测微尺每一组的长度都是对应一个特定的放大倍数,在更换不同放大倍数的目镜或物镜之后,整个显微镜所观测到物体的整体放大倍数发生了改变,那么原来的目镜测微尺的标度就不再适用了,需要进行重新标定。
(2)在不改变目镜和物镜测微尺,而改用不同放大倍数的物镜来测定同一株细菌的大小时,其测定结果是否相同?为什么?答:基本相同。
因为细菌的大小是由其本身确定的,若使用不同的放大倍数测定同一株细菌,只要目镜测微尺的标定长度是正确的,那么所测得的结果就是大体相同的,不过因为不同放大倍数下读数的精确度不同以及读数时本身所存在的误差,可能会导致两次不同放大倍数下的测量结果和精确度有一定的差别。
(3)根据你的体会,说明用血细胞计数板计数的误差主要来自哪些方面?应如何尽量减少误差、力求准确?误差来源:①刻度不清晰导致读数不准;②浓度安排不合理导致过浓菌体有重叠或者过稀数据不准确;③菌液中混有杂质或气泡导致视野受阻;④视野中菌体分布不均匀,读数差别大,不准确等等。
解决方案:①使用之前用水洗净并镜检确定没有污物;②滴加菌液时从盖玻片边缘滴加让其缓缓渗入;③滴加完菌液之后将血球计数板静置5min使菌体沉淀;④清理血球计数板时不可使用毛刷或者吸水纸,用冲洗后自然晾干;⑤读数时若发现菌体密度过稀或过浓应及时调整稀释倍数重新测量,以菌体数每小方格2-6个为宜(针对酵母菌来说)。
(4)某单位要求知道一种干酵母粉中的活菌存活率,请设计1~2种可行的检测方法。
方案一:取适量酵母粉加入清水制成悬液,活化12h,加入美蓝染色10分钟,之后取少量菌液用血球计数板计数,分别记下总菌数以及活菌数(菌体呈无色),从而求得活菌成活率。
方案二:同样取适量酵母粉制成悬液,先是用光电比浊法测得菌液中总菌数,之后阶梯稀释成不同浓度的菌液,分别涂布在麦芽琼脂平皿上,28℃培养3天,根据出现的菌落数和对应菌液的稀释倍数算出活菌数,两组数据结合求得该酵母粉中的活菌存活率。
