AOAC50.1.04维生素E的检测
维生素e的测定方法

维生素e的测定方法
维生素E是一种重要的营养素,具有抗氧化作用,能够保护细胞膜不受自由基的伤害。
因此,测定维生素E的含量对于保持人体健康至关重要。
目前,测定维生素E的方法主要有高效液相色谱法、气相色谱法、荧光法、紫外分光光度法、电化学法等。
其中,高效液相色谱法和气相色谱法具有测定精度高、灵敏度高、分析速度快等优点,已经成为测定维生素E含量的主要方法。
在测定维生素E含量时,需要注意样品的制备和处理,以及仪器的校准和标准品的选取。
同时,还需要控制实验条件,避免干扰因素对测定结果的影响。
总之,维生素E的测定方法在保护人类健康方面具有重要作用,需要不断完善和提高。
- 1 -。
维生素e的四种鉴别方法

维生素E的四种鉴别方法如下:
与硝酸反应:取本品内容物适量(约相当于维生素E 10mg),加无水乙醇10ml溶解后,加硝酸2ml,摇匀,在70℃加热15分钟,溶液显橙红色。
该鉴别方法主要利用维生素E的硝化反应进行鉴别。
与三氯化铁反应:取“与硝酸反应”项下的溶液,冷却后加过量氨试液,摇匀,加三氯化铁试液1ml,摇匀,溶液显黄绿色。
该鉴别方法主要利用维生素E与三氯化铁的反应进行鉴别。
检查生育酚:照气相色谱法测定,检查生育酚的含量。
该鉴别方法主要利用气相色谱法进行鉴别。
紫外光谱法:取本品内容物适量(约相当于维生素E 10mg),加无水乙醇10ml溶解后,溶液在284nm与291nm的波长处有最大吸收。
该鉴别方法主要利用紫外光谱法进行鉴别。
另外,比色法、光谱法、电化学法也可用于鉴别维生素E。
其中,光谱法可分为紫外光谱法、红外光谱法和荧光法。
紫外光谱法只适用于高纯度、成分单一、干扰少的样品中维生素E 的测定;红外及近红外光谱法主要适用于植物油中部分生育酚的测定,具有一定的限制性;荧光法只能测定样品中总生育酚的含量,不适用于各异构体含量的分析。
以上信息仅供参考,如需了解更多信息,请查阅有关维生素E鉴别方法的文献或咨询相关专家。
维生素e的含量测定方法

维生素e的含量测定方法维生素E的含量测定方法维生素E是一种重要的脂溶性维生素,对人体的正常生理功能发挥着重要作用。
因此,了解维生素E的含量十分重要。
以下将介绍维生素E含量测定的一般步骤和方法。
1. 原理测定维生素E的含量一般采用紫外-可见分光光度法或高效液相色谱法。
紫外-可见分光光度法利用维生素E在特定波长下的吸光度来测定其含量。
高效液相色谱法则是通过将样品在色谱柱上分离,再利用检测器检测峰面积或峰高来确定维生素E的含量。
2. 实验步骤以下是测定维生素E含量的一般步骤:步骤一:样品的制备首先,将待测样品如食品、保健品等进行充分打碎或细磨,以确保样品中的维生素E能充分释放。
然后,取一定量的样品并溶解或提取维生素E。
步骤二:预处理如果样品中存在其他干扰物质,需要进行预处理。
预处理的方法包括提取、分离、净化等。
例如,可以采用萃取方法将样品中的维生素E提取至有机溶剂中,以去除其他干扰物质。
步骤三:测定方法选择根据实验条件和要求,选择合适的测定方法。
常用的方法有紫外-可见分光光度法和高效液相色谱法。
这两种方法各有优缺点,需要根据实际情况进行选择。
步骤四:仪器准备和参数设置根据选择的测定方法,准备好相应的仪器设备,如紫外-可见分光光度计或高效液相色谱仪,并进行相关参数的设置。
步骤五:标准曲线的绘制为了准确测定维生素E的含量,需要首先绘制标准曲线。
标准曲线可以通过制备一系列维生素E浓度逐渐升高的标准溶液,并测定其吸光度或峰面积/峰高,然后绘制曲线。
步骤六:测定样品取一定量的样品溶液,按照所选择的测定方法进行测定。
根据标准曲线,通过测定吸光度或峰面积/峰高,计算出样品中维生素E的含量。
步骤七:数据分析根据测定结果,可以计算出样品中维生素E的含量。
同时,还可以进行结果的统计分析,如平均值、标准差等。
步骤八:结果的解释及验证对于测定结果,需要进行合理解释,并与其他数据进行对比,以验证结果的准确性和可靠性。
3. 结论通过上述步骤,可以测定出样品中维生素E的含量。
维生素的检测方法

《维生素的检测》一、维生素E取样品0.18g,置于100mL的量瓶中,加无水乙醇稀释到刻度,摇30s,用干滤纸滤过,弃取初滤液,吸取50mL,置于回流瓶中,加硫酸3mL,摇匀,加热回流3小时放冷,移至于100mL量瓶中,用无水乙醇洗条容器,洗液并加入量瓶中,再加入无水乙醇稀释至刻度,摇匀,吸取25mL/L,加乙醇(95%)20mL,水10mL/L,二苯胺硫酸溶液2滴(10g/L),用0.01mol/L 硫酸铈标准液滴定结果用空白试验校正。
计算公式:(试样滴定数—空白滴定数)×标准液浓度×0.002364×8÷质量÷维生素E的标示量<如:50/100 33/100 25/100 20/100 等>×100二、维生素K3(亚硫酸氢钠甲苯酯含量测定)标准溶液配制:取甲萘醌对照品约0.05g,置于250mL的量瓶中,用三氯甲烷溶解,并稀释到刻度,摇匀。
吸取2mL置于100mL量瓶中,用无水乙醇稀释到刻度,摇匀。
样品溶液的配制:取样品1.3g,置于250mL量瓶中,用水稀释到刻度,摇匀。
吸取25mL 至于分液漏斗中,加三氯甲烷40mL/L,碳酸钠溶液5mL(1/100),剧烈振摇30s,静止分层,分出的三氯甲烷层通过预先用三氯甲烷湿润的棉花过滤到250mL的量瓶中,再加三氯甲烷40mL迅速洗条滤器,洗液并加入量瓶中,水层用三氯甲烷萃取2次,每次约20mL,萃取液过滤,并用三氯甲烷20mL洗条滤器,洗液和全部滤并到量瓶中,用三氯甲烷稀释到刻度,摇匀.吸取2mL至于100mL量瓶中,用无水乙醇稀释到刻度,摇匀.(用分光光度计在250nm波长处平行测定吸收度,用2%三氯甲烷的无水乙醇溶液做空白).计算公式:样品溶液的吸光度×标准溶液的吸光度÷标准溶液的吸光度÷样品溶液的浓度×191.82三、维生素B1 (硝酸硫胺含量的测定)取样0.1g,加水50mL溶解后,加盐酸2mL,煮沸,立即滴加硅钨酸溶液10mL,继续煮沸2nim,用在80℃干燥至恒重有4号垂溶坩埚滤过,沉淀先用煮沸的盐酸溶液洗条2次,每次10mL,再用水10mL洗条一次,最后用丙酮洗条2次,每次5mL,沉淀物在80℃干燥至恒重.计算公式:干燥后沉淀的重量×0.1882÷样品重量÷(1-样品干燥失重,重量百分数)×100四、烟酸取样0.3g,加新沸过的冷水50mL溶解,加酚酞指示剂3滴(1g/L),用0.1monl/L氢氧化钠标准液滴定至粉红色.计算公式:滴定数×标准液的浓度×0.01231÷质量×100五、维生素B6取样0.15g,加冰乙酸20mL与乙酸贡溶液(5g乙酸贡研细加温热的冰乙酸溶解为100mL)5mL,温热溶解,放冷,加(5g/L)结晶紫指示剂1滴,用0.1monl/L高氯酸标准液滴定,至溶液显蓝紫色,并将滴定结果用空白实验校正.计算公式:(样品滴定数-空白滴定数)×高氯酸标准液的浓度×0.02056÷质量×100六、维生素B12(氰钴胺)粉剂外观及颜色:浅红色至棕色细微粒粉末状,具有吸潮性.取样品维生素B12 0.002克,置于100毫升的量瓶中.加水80毫升,充分振摇混合后稀释至刻度,摇匀,用干滤纸过滤(必要时离心),弃去初滤液作为样品测量溶液.取维生素B12(氰钴胺)对照品(干燥品)0.2克,置于1000毫升的量瓶中用水稀释至刻度,摇匀,作为对照品测定液,用水做空白对照,于1cm比色皿内,用分光光度计于361nm波长处测定样品溶液和标准液的吸收度。
维生素E(VE)生育酚检测

维生素E(VE)/生育酚检测
维生素E(Vitamin E, VE)是一种脂溶性维生素,是最主要的抗氧化剂之一,能保护人体内不饱和脂肪酸免受自由基的破坏。
维生素E包括生育酚和三烯生育酚两类共8种化合物,即α、β、γ、δ生育酚和α、β、γ、δ三烯生育酚,其中,α-生育酚是自然界中分布最广泛含量最丰富活性最高的维生素E形式。
迪信泰检测平台采用高效液相色谱(HPLC)、液质联用(LC-MS)、生化法,可高效、精准的检测维生素E的含量变化。
此外,我们还提供其他维生素检测服务以及维生素检测试剂盒产品,以满足您的不同需求。
样品制备
1)称取粉末样品20 mg;
2)加入10 mL盐酸溶液,震荡摇匀;
3)加入10 mL水,震荡摇匀;
4)将溶液定容到200 mL;
5)用0.45 μm的微孔滤膜过滤;
6)用HPLC检测。
HPLC和LC-MS测定维生素E样本要求:
1. 请确保样本量大于0.2g或者0.2mL。
周期:2~3周
项目结束后迪信泰检测平台将会提供详细中英文双语技术报告,报告包括:
1. 实验步骤(中英文)
2. 相关质谱参数(中英文)
3. 质谱图片
4. 原始数据
5. 维生素E含量信息。
维生素e实验报告

维生素e实验报告维生素E实验报告维生素E是一种重要的脂溶性维生素,对人体的健康具有重要的影响。
为了深入了解维生素E的作用和效果,我们进行了一项实验,旨在探究维生素E对人体的益处以及适宜的摄入量。
实验方法:我们选取了40名参与者,将其分为两组,每组20人。
第一组作为对照组,不进行任何干预;第二组则每天补充200毫克的维生素E。
实验周期为8周,每两周进行一次检测。
实验结果:在实验结束后,我们对两组参与者进行了各项指标的比较和分析。
1. 抗氧化能力:维生素E作为一种有效的抗氧化剂,可以帮助人体清除自由基,减少氧化损伤。
实验结果显示,补充维生素E的第二组参与者的抗氧化能力明显提高,与对照组相比,其血液中的抗氧化指标明显升高。
2. 心血管健康:维生素E对心血管健康的影响备受关注。
实验结果显示,补充维生素E的参与者的血液循环状况明显改善,血液中的胆固醇水平下降,血管的弹性增加。
这些指标的改善表明维生素E的摄入有助于维持心血管系统的健康。
3. 免疫功能:维生素E对免疫系统的调节作用也是实验的重点之一。
实验结果显示,补充维生素E的参与者的免疫功能明显增强,白细胞计数和免疫球蛋白水平均有所上升。
这表明维生素E的摄入可以提高人体的免疫力,增强抵抗力。
4. 眼睛健康:维生素E对眼睛健康的影响也备受关注。
实验结果显示,补充维生素E的参与者的眼睛健康状况明显改善,眼睛疲劳感减轻,视力明显提高。
这表明维生素E的摄入对于保护眼睛健康具有积极的作用。
综合分析:通过对实验结果的综合分析,我们可以得出以下结论:1. 维生素E的摄入可以提高人体的抗氧化能力,减少氧化损伤。
2. 维生素E对心血管健康有积极的影响,可以改善血液循环和降低胆固醇水平。
3. 维生素E的摄入可以增强人体的免疫功能,提高抵抗力。
4. 维生素E有助于保护眼睛健康,减少眼睛疲劳感和改善视力。
适宜摄入量:根据实验结果以及相关研究,我们推荐成年人每天摄入15毫克的维生素E。
维生素E含量测定方法

高效液相色谱法对维生素E粉、E油含量的测定色谱条件色谱柱:采用C18柱(长150 mm,内径4.6mm,粒径4-5μm)流动相:甲醇(色谱醇)+水(去离子水) 比例:(98 + 2 )流速:1.2 ml/min检测波长:285 nm柱温: 25±2 ℃进样量:20 μL溶液制备标准溶液的制备:本实验室的标准品为液体油状物,因此用注射器抽取直接滴加到容量瓶中称量,把容量瓶放在分析天平托盘上然后滴加,称取维生素E标准品约0.1g(准确至0.0002),置50mL棕色量瓶中,加甲醇适量溶解并稀释至刻度,摇匀。
绘制标准曲线把制成2.008 mg/mL的溶液作为贮备液。
分别准确移取0.5、1.25、2.5、3.75、5mL 至10mL 的棕色量瓶中,加甲醇稀释至刻度,摇匀;得到浓度分别为0.1004、0.251、0.502、0.753、1.004mg/ml的五种溶液,分别经0.45μm 滤膜滤过,滤液作为标准溶液。
用100μL的进样针分别从制备的不同浓度的标准溶液抽取60μL溶液,注意不能带有气泡,注入液相色谱仪,按色谱条件操作,从0.1004——1.004mg/ml依次进样,记色谱峰面积以标准品溶液浓度(C)为纵坐标,峰面积(A)为横坐标,按照外标法过5点绘制标准曲线。
样品溶液的制备:维生素E粉样品溶液的制备制备步骤为:研磨→称量→水浴溶解→定容→过滤1.研磨把试样E粉倒入研钵中适量,用研磨棒轻度研磨至颜色有变化为止。
2.称量把称量纸放到分析天平上然后置零,把研磨好的试样用药匙转移到称量纸上,称取维生素E 粉约1g(约相当于维生素E 0.5g,准确至0.0002g),置50mL棕色量瓶中。
3.水浴溶解加甲醇适量,置超声波水浴器中助溶20 min。
4.移取定容冷却至室温,用甲醇稀释至刻度,充分摇匀,从制备好的溶液中移取1mL到10mL的容量瓶中,用甲醇稀释至刻度,充分摇匀;再从制备好的10mL容量瓶中的溶液中移取2.5mL放置到10mL容量瓶中,用甲醇稀释至刻度,充分摇匀。
维生素E验收标准及检验方法规程

将样品倒入白瓷盘内,在明亮的自然光处观察.2.含量2.1试剂1)四氢呋喃-丙酮溶液:四氢呋喃:丙酮溶液=1:12)α-生育酚醋酸酯标准品3)无水乙醇:不得含有醛类物质3.1)检查方法:取2ml银氨溶液于试管中,加入用量乙醇,摇匀,再加入10%氢氧化钠溶液,加热,放置冷却后,若有银镜反应则表示乙醇中有醛。
3。
2)取2g硝酸银溶于水中。
取4g氢氧化钠溶于温乙醇中。
将两者倾入1L乙醇中,振摇后,放置暗入两天(不时摇动,促进反应),经过滤,置蒸馏瓶中蒸馏,弃去初蒸出的50ml。
当乙醇中含醛较多时,硝酸银用量适当增加。
2.2仪器1)超声波振荡器;2)高效液相色谱仪带紫外检测器;3)紫外分光光度计;4)100ml容量瓶;5)高速离心机;2.3测定步骤1)标准溶液的配制:一100ml溶量瓶中,并定容.将最终稀释液用作标准溶液.1。
2)标准溶液的标定:于紫外分光光度计中按下面条件测定标准溶液的吸光度:维生素E标准溶液测定条件:波长:285nm且E错误!=442。
4样品的处理:1)准确称取20.0mg维生素E样品于一100ml容量瓶中,加水约10ml,于65℃超声水浴10min,冷却至室温。
2)加四氢呋喃:丙酮溶液约75ml,常温下超声水浴20min,冷却后,用四氢呋喃:丙酮溶液定容至刻度,离心后取上清液于液相色谱中测定。
2.5高效液相色谱分析2.5.1色谱条件1)分析柱:ultrasphere ODS 5μm,4。
6mm×25cm;2)甲醇:色谱纯;3)紫外检测器波长:285nm;4)进样量:20μL;5)流速:1.5ml/min;6)灵敏度:0。
5。
2。
5。
2样品分析1)把前标准溶液按上述色谱条件进样3~4次,根据色谱图,计算标准溶液的平均峰面积。
2)将样品溶液按上述色谱条件进样,根据色谱图,计算样品溶液的峰面积. 3)计算A样某种维生素含量(mg/g)= ————-—×C×100÷1000A标×W样式中:A样—-样品溶液的峰面积;A标——标准溶液的峰面积;W样——样品的质量,g;C——标准溶液的浓度,ug/100g。
维生素E检验标准操作规程

取本品0.10g,加无水乙醇5ml溶解后,加二苯硫酸铈滴定液(0.01mol/L)不得过1.0ml为符合规定。
3.3.3微生物限度
取本品10g加至含溶化的(温度不超过45℃)5g司盘80,3g 单硬脂酸甘油酯,10g聚山梨酯80的无菌混合物的烧杯中,用无菌玻棒搅拌成团后,加入45℃的pH7.0的无菌氯化钠-蛋白胨缓冲液至100ml,混匀使充分乳化,作为1:10的供试液。取适量供试液,照微生物限度检查平皿法(《中国药典》2005版二部附录Ⅺ J)检查,细菌数、霉菌和酵母菌数分别不得过100个/g,金黄色葡萄球菌、铜绿假单胞菌不得检出为符合规定。
4.4计算
4.4.1理论板数
n——理论板数t′R——组分保留时间
Wh/2——半高峰宽
4.4.2分离度
R——分离度tR1、tR2——1、2组分的保留时间
Wb1、Wb2——1、2组分的色谱峰峰宽
4.4.3校正因子
f——校正因子
CR——对照品的浓度
CS——内标物质的浓度
AR——对照品的峰面积或峰高
As——内标物质的峰面积或峰高
量筒碱式滴定管分析天平
3.2试药与试液
乙醇乙醚无水乙醇二甲基甲酰胺正己烷
酚酞指示液
二苯胺试液
氢氧化钠滴定液(0.1mol/L)
硫酸铈滴定液(0.01mol/L)
3.3检查项目与操作方法
3.3.1酸度
取乙醇与乙醚各15ml,置锥形瓶中,加酚酞指示液0.5ml,滴加氢氧化钠滴定液(0.1mol/L)至微显粉红色,加本品1.0g,溶解后,用氢氧化钠滴定液(0.1mol/L)滴定,消耗的氢氧化钠滴定液(0.1mol/L)不得过0.5ml为符合规定。
4.[含量测定]
维生素E检测方法研究

维生素E检测方法研究液相色谱法检测的生育酚方法报告一、生育酚简介又称维生素E,是一种脂溶性维生素,是最主要的抗氧化剂之一。
溶于脂肪和乙醇等有机溶剂中,不溶于水,对热、酸稳定,对碱不稳定,对氧敏感,对热不敏感。
维生素E为微带粘性的淡黄色油状物,在无氧条件下较为稳定,甚至加热至200?以上也不被破坏。
但在空气中维生素E极易被氧化,颜色变深。
维生素E易于氧化,故能保护其他易被氧化的物质(如维生素A及不饱和脂肪酸等)不被破坏。
维生素E的化学名称为(1)-2、5、7、8-四甲基 2-(-4、8、12-三甲基十三烷基)-6-苯并二氢吡喃醇醋酸酯,分子式为CHO,结构式为: 31523根据其化学结构可分为生育酚及生育三烯酚两类。
生育酚主要有四种衍生物,按甲基位置分为α、β、γ和δ四种。
其中,α-生育酚:R,R=CH;β-生育酚:R=H,R=CH;γ-123123生育酚:R=CH,R=H;δ-生育酚:R,R=H。
维生素E以α-生育酚生理活性最高,β-13212及γ-生育酚仅为α-生育酚的40%和8%。
二、色谱方法的选择现行标准中维生素E的检测仅有两个标准——《食品中维生素A和维生素E的测定》(GB/T 5009.82-2003)和《食用植物油中维生素E组分和含量的测定高效液相色谱法》(NY/T 1598-2008),其中前者介绍了液相色谱法和比色法两种方法。
[1]目前有的文献中指出,气相色谱法虽能正确定量维生素E,但是对不同型分离困难,为了使α-维生素E与β-维生素E及γ-维生素E分离,预先要将试样进行三甲基硅烷化或酯化,同时胆同醇等硬脂类对测定有干扰。
另外,如果前期样品处理不好,很容易对毛细管柱造成污染。
故建议使用液相色谱法。
三、内标法和外标法的选择1、两种方法的区别:内标法外标法内标物与待测物相似,且均出峰不需要标准曲线需要,可两点需要,需多点优点定量准确操作简便缺点不容易选择内标物;操作精度高与标准品严格相同的操作条件 2、在《食品中维生素A和维生素E的测定》中采用了内标法,内标物为苯并[a]芘,另外文献中也有使用正三十二烷及十六酸十六醇酯等。
高效液相色谱法分析(维生素E)原始记录
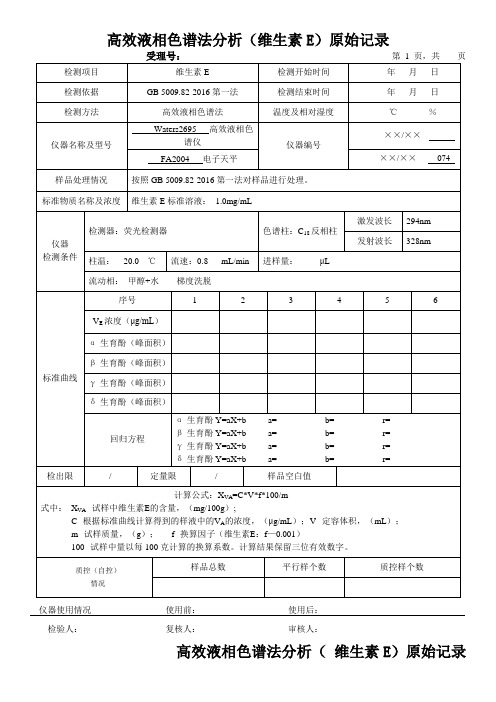
受理号:第1页,共页
检测项目
维生素E
检测开始时间
年月日
检测依据
GB 5009.82-2016第一法
检测结束时间
年月日
检测方法
高效液相色谱法
温度及相对湿度
℃%
仪器名称及型号
Waters2695高效液相色谱仪
仪器编号
××/××-
FA2004电子天平
××/××-074
式中:XVA--试样中维生பைடு நூலகம்E的含量,(mg/100g);
C--根据标准曲线计算得到的样液中的VA的浓度,(μg/mL);V--定容体积,(mL);
m--试样质量,(g);f--换算因子(维生素E:f—0.001)
100--试样中量以每100克计算的换算系数。计算结果保留三位有效数字。
质控(自控)
情况
4
5
6
VE浓度(μg/mL)
α-生育酚(峰面积)
β-生育酚(峰面积)
γ-生育酚(峰面积)
δ-生育酚(峰面积)
回归方程
α-生育酚Y=aX+b a=b=r=
β-生育酚Y=aX+b a=b=r=
γ-生育酚Y=aX+b a=b=r=
δ-生育酚Y=aX+b a=b=r=
检出限
/
定量限
/
样品空白值
计算公式:XVA=C*V*f*100/m
样品总数
平行样个数
质控样个数
仪器使用情况使用前:使用后:
检验人:复核人:审核人:
高效液相色谱法分析( 维生素E)原始记录第页,共页
样品编号
试样质量
(g)
定容体积
实验九气相色谱法测定维生素E的含量

实验九气相色谱法测定维生素E的含量
一、实验目的
熟悉气相色谱法的操作方法
掌握气相色谱法测定维生素E的色谱条件的选择
掌握基于校正因子的内标一点法的含量测定
二、溶液的制备(预试情况)
内标物溶液的配制:精密称取内标物正三十二烷48mg,置50ml容量瓶中,加正己烷溶解并稀释至刻度,得到浓度为49.6mg/ml的内标物溶液。
对照品溶液的制备:精密称取维生素E对照品20.76mg,精密加入内标物溶液10ml,溶解,得到浓度为2.076mg/ml的对照品溶液。
供试品溶液的制备:精密称取样品30.4mg,精密加入内标物溶液10ml,溶解,即得。
三、色谱条件
流动相:氮气
载气流速: 30ml/min ,空气流速:300ml/min,氢气流速:30ml/min
检测器:氢焰离子化检测器
进样量:2微升
进样口温度:300度
柱温:265度
检测器温度:300度
四、数据处理及结果()
校正因子的测定:精密吸取对照品2μl,注入气相色谱仪,计算相对校正因子(new calibration建立新的校正曲线,需要输入内标和维生素E的浓度或量,仪器自动给出绝对校正因子,RF显示项下全为NO,ISTD项下内标物选择YES,对照品选择NO,然后点击OK,即可)
样品的测定:精密吸取样品2μl,注入气相色谱仪,计算样品含量。
含量测定方法选择ISTD法,只需要打开样品图谱,即可得到含量。
中国药典2020版维生素e含量

我国药典2020版维生素E含量1. 维生素E的重要性维生素E,又称生育酚,是一种重要的脂溶性维生素,对人体健康起着重要作用。
它不仅是一种强效的抗氧化剂,能够保护细胞膜、维护血管弹性,还对促进生育、延缓衰老、改善皮肤等具有重要意义。
2. 我国药典对维生素E含量的规定根据我国药典2020版的规定,维生素E含量应该在合理的范围内,以确保食品或药品中的维生素E含量符合健康需求,同时不会产生过量摄入的危害。
对于不同类型的食品和药品,我国药典都有相应的标准来规定其维生素E含量,以保障用户的健康和权益。
3. 维生素E含量的测定方法在我国药典中,维生素E的检测需要遵循一定的测定方法。
常用的测定方法包括高效液相色谱法、紫外分光光度法等。
这些方法能够准确、快速地测定维生素E的含量,为产品质量的监管提供了技术支持。
4. 维生素E含量的食品和药品维生素E广泛存在于各种食品和药品中,包括植物油、坚果、谷物等食品,以及各种维生素E片剂、软胶囊等药品。
我国药典规定了不同类型产品中维生素E的含量标准,有助于用户正确选择并使用产品。
5. 个人观点和理解作为文章写手,我认为维生素E的含量标准是保障用户健康的重要举措。
合理的维生素E含量能够确保产品的营养价值,同时避免因摄入过量维生素E而导致的健康风险。
我国药典对维生素E含量的规定是科学的、合理的,符合国家对产品质量和用户健康的要求。
总结我国药典2020版对维生素E含量的规定,重要性不言而喻。
它的出台,为维护用户的权益、促进产品质量监管提供了有力的技术支持。
作为用户,我们也应该关注并认真遵守我国药典规定的维生素E含量标准,以确保自己的健康和权益。
希望以上对我国药典2020版维生素E含量的详细探讨,能够为你提供有价值的信息和启发。
维生素E是一种脂溶性维生素,它有助于维持健康的皮肤和眼睛,并对免疫系统具有益处。
维生素E在体内的重要作用包括抗氧化作用、维护细胞膜的完整性、保护DNA和其他细胞结构免受氧化损伤。
高效液相色谱法分析(维生素E)原始记录1
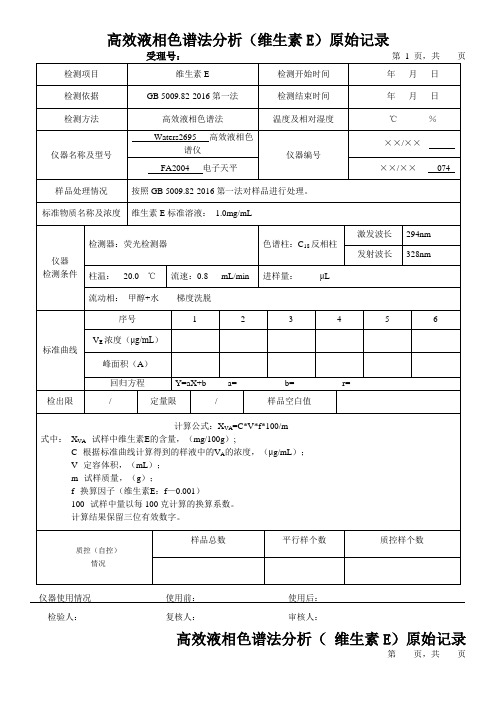
结果
(mg/100g)
平均值
(mg/100g)
相对偏差
(%)
备注
试验允差要求:≤10%
仪器使用情况使用前:使用后:检验人:复核人:审核人:
高效液相色谱法分析(维生素E)原始记录
受理号:第1页,共页
检测项目
维生素E
检测开始时间
年月日
检测依据
GB 5009.82-2016第一法
检测结束时间
年月日
检测方法
高效液相色谱法
温度及相对湿度
℃%
仪器名称及型号
Waters2695高效液相色谱仪
仪器编号
××/××-
FA2004电子天平
××/××-074
f--换算因子(维生素E:f—0.001)
100--试样中量以每100克计算的换算系数。
计算结果保留三位有效数字。
质控(自控)
情况
样品总数
平行样个数
质控样个数
仪器使用情况使用前:使用后:
检验人:复核人:审核人:
高效液相色谱法分析( 维生素E)原始记录第页,共页
样品编号
试样质量
(g)
定容体积
(ml)
样品浓度
样品处理情况
按照GB 5009.82-2016第一法对样品进行处理。
标准物质名称及浓度
维生素E标准溶液:1.0mg/mL
仪器
检测条件
检测器:荧光检测器
色谱柱:C18反相柱
激发波长
294nm
发射波长
328nm
柱温:20.0℃
流速:0.8mL/min
进样量:μL
流动相:甲醇+水梯度洗脱
标准曲线
维生素E测定方法2

MM_FS_CNG_0792饲料添加剂维生素E(原料) 检验规程滴定法分光光度法MM_FS_CNG_0792饲料添加剂维生素E(原料)1.适用范围本方法适于由三四基氢与异植物醇为原料,经化学合成制得的维生素E。
在饲料工业中作为饲料添加剂的原料,也可作为抗氧剂。
2. 分子式、分子量分子式:C31H52O3分子量:472.75(按1983年国际原子量)3.技术要求3.1.外观和性状本品为微绿黄色或黄色的粘稠液体,遇光色渐变深。
本品在无水乙醇、丙酮、乙醚或石油醚中易溶,在水中不溶。
4.4.1.主要试剂无水乙醇;乙醚;硝酸;2,2-联吡啶:0.5%乙醇溶液。
三氯化铁:0.2%乙醇溶液;氢氧化钾:0.5mol/L乙醇溶液(按中国药典1985年版二部附录128页制备);95%乙醇;硫酸:12%(V/V)乙醇溶液;硫酸铈;二苯胺:1%硫酸溶液;硫酸铈标准液:0.01mol/L。
按中国药内1985年版二部附录134页制备和标定。
4.2.仪器一般实验仪器设备和折光仪、紫外分光光度计。
4.3.鉴别试验4.3.1.称取样品约30mg,加无水乙醇10mL溶解后,加硝酸2mL,摇匀,在75℃加热约15min,溶解显橙红色。
4.3.2.称取样品约10mg ,加0.5mol/L 乙醇制氢氧化钾溶液2mL ,煮沸5min ,放冷,加水4mL 及乙醚10mL ,振摇,静止使分层,取乙醚液2mL 和0.5%2,2-联吡啶乙醇溶液数滴,0.2%三氯化铁乙醇溶液数滴混合,应显血红色。
4.4.维生素E 含量测定4.4.1.测定方法称取样品0.2g(准确至0.0002g),置具塞棕色锥形瓶中,加无水乙醇25mL 溶解,加12硫酸乙醇溶液25mL ,加热回流3h ,放冷,移置100mL 棕色量瓶中,用少量无水乙醇洗涤容器,洗液并入量瓶中,加无水乙醇稀至刻度,摇匀,准确量取25mL ,置于三角瓶中,加95%乙醇20mL ,水10mL ,1%二苯胺硫酸试液2滴,用0.01mol /L 硫酸铈标准溶液滴定,滴定速度以每10s25滴为宜,至溶液由亮黄色转变为灰紫色,持续10s 即为终点,并将滴定结果用空白试验校正。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
50.1.04AOAC Official Method992.03Vitamin E Activity(All-rac-a-Tocopherol)in Milk-Based Infant FormulaLiquid Chromatographic MethodFirst Action1992Final Action1996Codex-Adopted–AOAC Method* (Applicable to determination of vitamin E activity in milk-based in-fant formula.)Results of the interlaboratory study supporting the acceptance of the method(milk-based liquid,ready-to-feed):Mean recovery=24.14IU vitamin E/L infant formulas r=2.04;s R=2.82;RSD r=8.46%;RSD R=11.69%A.PrincipleVitamin E activity in test portions of infant formula is determined by saponification of all-rac-α-tocopherol,partitioning with organic solvent,separation from product matrix,and quantification by liquid chromatography.B.Apparatus(a)Liquid chromatograph(LC).—Capable of pressures up to 3000psi with injector capable of100µL injections.Operating con-ditions:eluent flow rate2.0±0.2mL/min;temperature ambient.(b)Detector.—Capable of measuring absorbance at280nm,with sensitivity0.02AUFS.(c)Precolumn.—2mm id×2cm stainless steel,packed with 40µm pellicular reversed-phase C18(Alltech28551is suitable). (d)Column.—4.6mm id×25cm stainless steel,packed with 5µm silica(Hypersil Silica is suitable).(e)Shaking water bath.—Capable of maintaining70±2°C,with vari-able speed capable of60oscillations/min,ca11×14in.(28×36cm)test sample area(Precision Scientific Model25is suitable).(f)Glassware.—(1)125mL separatory funnels.(2)5mL volu-metric flasks.(3)100mL low-actinic volumetric flasks.C.Reagents(a)Mobile phase solution.—Hexane–isopropyl alcohol(99.92+0.08,v/v),HPLC grade solvents.Degas2–5min under vacuum.(b)Wash solution.—H2O–absolute ethanol(3+2,v/v).(c)Extraction solution.—Hexane–methylene chloride(3+1, v/v),HPLC grade solvents.(d)Saponification solution.—10.5M potassium hydroxide (KOH).Dissolve673g KOH in1L H2O.(e)Antioxidant solution.—1%pyrogallol.Dissolve5.0g pyrogallol(1,3,5-trihydroxybenzene,98%;Aldrich is suitable source)in500mL absolute ethanol.(f)Standard solutions.—(1)Stock standard solu-tion.—0.5mg/mL all-rac-α-tocopheryl acetate in hexane.Accu-rately weigh ca50mg all-rac-α-tocopheryl acetate(USP Reference Standard)into100mL low-actinic volumetric flask and dilute to volume with hexane(HPLC grade).Shake well to dissolve.Make fresh every3weeks.Store at–20°C in explosion-proof freezer when not in use.(2)Working standard solution.—10µg/mL all-rac-α-tocopheryl acetate.Pipet2mL stock standard solution,(1),into100mL low-actinic volumetric flask.Evaporate to dryness under nitrogen. Dissolve residue in antioxidant solution,C(e),and dilute to volume. Prepare fresh daily.(g)Suitability test solution.—Approximately15µg/mL all-rac-α-tocopherol(USP Reference Standard)and all-rac-α-tocopheryl acetate(USP Reference Standard)in hexane (HPLC grade).D.Extraction of Standard and Test PortionsPipet10.0mL working standard solution,C(f)(2),or test portion containing ca0.095IU vitamin E activity(10mL for ready-to-feed formulas)into150mL centrifuge tube.Bring test solution volume to 10mL with H2O,if necessary.To standard tubes,add10mL H2O, 20mL antioxidant solution,C(e),and5mL saponification solution, C(d).To sample tubes,add30mL antioxidant solution and5mL saponification solution.Cap tubes and swirl briefly to mix.Place tubes in70°C shaking H2O bath(ca60oscillations/min)for25min. Remove tubes and place in ice5min,or until contents cool to room temperature.Quantitatively transfer contents to separate125mL separatory funnels.Wash remaining test portion solution or standard from tube into funnel with30mL H2O.Pipet30.0mL extraction sol-vent,C(c),into funnel and shake ca2min.When layers separate, discard aqueous(lower)layer.Add30mL wash solution,C(b),to funnel and shake very gently30s,venting frequently.Let phases separate and discard aqueous layer.Repeat wash step3×.Pipet 20.0mL portion from funnel into50mL tube and evaporate to dryness under nitrogen.Transfer residues quantitatively to sepa-rate5mL volumetric flasks and dilute to volume with mobile phase solution,C(a).Inject100µL standard or sample into LC.E.System Suitability TestInject100µL suitability test solution,C(g),into LC.Typical peak retention times for tocopherol and tocopheryl acetate are6.0and 5.0min,respectively.Calculate resolution(R)factor between tocopherol and tocopheryl acetate as follows:R=22112()t tW W−+where t1and t2=retention time measured from injection time to elu-tion time of peak maximum of tocopherol and tocopheryl acetate,re-spectively,and W1and W2=width of peak measured by extrapolating relatively straight sides to baseline of alcohol and ace-tate,respectively.If R factor is>1.0,proceed with test portion analysis;if R factor is<1.0,decrease amount of isopropyl alcohol added per liter[mo-bile phase solution,C(a)]by ca0.01%.Inject working standard solution,C(f)(2),5×.Calculate reproducibility of replicate injec-tions in terms of standard deviations(per USP),which should be ≤2%.Typical relative standard deviation values for peak height are±1.5%.F.Liquid ChromatographyInject100µL standard or test solution into LC.G.CalculationsMeasure peak heights or peak areas of all-rac-α-tocopherol in test solution and standard chromatograms.Calculate IU per reconsti-tuted quart of vitamin E activity(A)as follows:A=H sam/H std×C std×0.001IU/µg×946.33mL/quart where H sam=peak height of test portion solution;H std=peak height of standard;C std=concentration of standard,µg/mL. Reference:J.AOAC Int.76,398(1993).CAS-59-02-9(α-tocopherol)CAS-7695-91-2(α-tocopheryl acetate)Revised:March1997*Adopted as a Codex Reference Method(Type II)for liquid chromatogra-phy of vitamin E(milk based infant formula)in special foods.。
