四种重金属离子对明亮发光杆菌急性和亚急性毒性的比较研究
重金属对微生物毒性效应研究

武汉工业学院毕业论文论文题目:重金属对微生物毒性效应研究姓名学号院系化学与环境工程学院专业环境工程指导教师2010年5月15日目录中文摘要 (Ⅰ)英文摘要 (Ⅱ)1.前言 (1)1.1 重金属对微生物毒性研究现状 (1)1.2 本实验研究的目的和意义 (3)2.大肠杆菌、荧光假单胞菌和枯草芽孢杆菌的简介 (4)2.1 大肠杆菌的简介 (4)2.2 荧光假单胞菌的简介 (4)2.3 枯草芽孢杆菌的简介 (5)3.汞,铬,镉,铅对大肠杆菌,荧光假单胞菌,枯草芽孢杆菌毒性的实验研究 (7)3.1 细菌在重金属污染下存活数量 (7)3.1.1 实验材料和仪器 (7)3.1.2 实验步骤 (7)3.1.3 结果与分析 (7)3.2 细菌在受到重金属污染后在细胞水平上的研究 (9)3.2.1实验材料和仪器 (9)3.2.2 实验步骤 (9)3.2.3 结果与分析 (10)3.3 单细胞凝胶实验 (12)3.3.1 实验材料和仪器 (12)3.3.2 实验步骤 (12)3.3.3 结果与分析 (13)4.微生物和重金属相互作用的应用范围及发展前景 (15)4.1 微生物和重金属相互作用的应用范围 (15)4.1.1 重金属污染的微生物学评价 (15)4.1.2 微生物在环境保护中的应用 (15)4.2 重金属和微生物相互作用的发展前景....................16 谢辞 (17)参考文献 (18)摘要微生物不仅种类繁多,数量极大,分布广泛,而且具有繁殖迅速,个体微小,比表面积大,对环境适应能力强等特点,因而成为人类最宝贵、最具开发潜力的资源库之一。
作为分解者,微生物在地球生态系统的物质循环过程中起着“天然环境卫士”的作用。
众所周知,重金属不能被微生物降解并且对它们有毒害作用,本次实验是以四种常见的重金属离子+2H g、+6Cd、+2P b对大肠杆菌、荧光假单Cr、+2胞菌、枯草芽孢杆菌三种细菌生长过程的毒性研究。
3种金属离子对褶皱臂尾轮虫的急性毒性试验

照组 。各 种离 子 的浓度 分别 是 :
P b : 2 0、 1 0、 5 、 2 . 5、 1 . 2 5 、 0 . 6 2 5 m L
Cd 2 + : 1 2、 6、 3、 1 . 5、 0. 7 5、 0. 3 7 5 m L
养殖与饲料 2 0 1 7年 第 5 期
H g “ : 3 0 、 1 5 、 7 . 5 、 3 . 7 5 、 1 . 8 7 5 、 0 . 9 3 7 5 g e l
试验研 究 . 1 5.
表2 C d 对褶皱臂尾轮虫的急性毒性试验结果
3 试 验 结 果
按 上述 确 定 的 6个 浓 度 进行 试 验 , ( 2 5±1 )℃
L。
1 试 验 材 料
2 ) P h 、 c d z + 、 H g 2 + 急性 毒性 试 验 。 根 据 预试 验所
1 ) 试 验 动物 。褶 皱臂 尾轮 虫取 自日照 职业技 术 测得 的浓度范 围, 按倍 比稀 释 , 每种离子确定 6 个 学 院 饵料 实验 室 , 以扁 藻 为 饵 料 扩 大 培 养 , 试 验 所 浓 度梯 度 , 每 个 浓 度设 置 3个 平行 组 , 并设 1 个 对
态 毒 理 学 的 系统 研究 , 并 已经 应用 到 环 境毒 物 的检 度中各放 2 0个褶皱 臂尾轮虫 , ( 2 5± 1 )℃生化培 测 中 。1 9 9 9年 , 美 国环保 局把 褶皱 臂 尾轮 虫 作为 海 养箱培养 2 4 h , 测出轮虫全部死亡和全部存活的浓 水 测 试生 物列 人 国家测 试标 准 。本文 主要 研究 了 度 。经 过反 复 试验 : P b 、 c d 2 + 、 H 全部 存 活 的最 高 P b 、 c d 2 + 、 H 对 褶 皱 臂尾 轮 虫 的毒 性 影 响 , 对 海 洋 浓 度分 别 是 2 0 m g / L 、 1 2 m g / L、 3 0 g / L ; 全 部 死 亡 环境 的治 理有 一定 的参考 价值 。 的最低 浓 度分别 是 0 . 6 2 5 m g / L 、 0 . 3 7 5 m g / L 、 0 . 9 3 7 5
重金属离子对凡纳滨对虾肝胰脏、鳃丝和血液SOD活力的影响

重金属离子对凡纳滨对虾肝胰脏、鳃丝和血液SOD 活力的影响3吴众望 潘鲁青33 张红霞(中国海洋大学海水养殖教育部重点实验室,青岛266003)【摘要】 研究了3种重金属离子(Cu 2+、Zn 2+、Cd 2+)在96h 内对凡纳滨对虾(L itopenaeus vannamei )对肝胰脏、鳃丝和血液超氧化物歧化酶(SOD )活力的影响.结果表明,凡纳滨对虾SOD 活力在3种重金属离子作用下随取样时间变化显著(P <0105),Cu 2+在实验浓度范围内(011~1mg ・L -1),肝胰脏、鳃丝和血液的SOD 活力随时间延长呈一峰值变化,Zn 2+在10mg ・L -1时对肝胰脏表现为显著抑制作用,Cd 2+在015mg ・L -1时对肝胰脏和鳃丝起显著抑制作用,0125mg ・L -1对鳃丝SOD 活力无显著变化(P >0105),其他浓度Zn 2+(<10mg ・L -1)、Cd 2+(<0125mg ・L -1)对各组织器官SOD 活力的影响随时间延长均呈现先升高后下降的趋势.3种重金属离子对凡纳滨对虾肝胰脏、鳃丝、血液SOD 活力的影响呈现明显的剂量2时间效应关系.其SOD 活力大小顺序为肝胰脏>鳃丝>血液,3种重金属离子对凡纳滨对虾伤害大小顺序为Cd 2+>Cu 2+>Zn 2+.关键词 重金属离子 凡纳滨对虾 肝胰脏 鳃丝 血液 SOD 文章编号 1001-9332(2005)10-1962-05 中图分类号 X17115 文献标识码 AE ffects of heavy metal ions on SOD activity of L itopenaeus vannamei hepatopancreas ,gill and blood.WU Zhongwang ,PAN Luqing ,ZHAN G Hongxia (Key L aboratory of M ariculture ,Minist ry of Education ,Ocean U niversity of China ,Qingdao 266003,China ).2Chin.J.A ppl.Ecol .,2005,16(10):1962~1966.This paper studied the effects of Cu 2+,Zn 2+and Cd 2+on the superoxide dismutase (SOD )activity of L itope 2naeus vannamei hepatopancreas ,gill and blood.The results showed that the SOD activity changed significantly with prolonged exposure of these ions (P <0105).The SOD activity of all test objectives changed with a single peak under the exposure of 011~1mg Cu 2+・L -1,that of hepatopancreas and of hepatopancreas and gills was inhibited obviously under 10mg Zn 2+・L -1and 015mg Cd 2+・L -1,respectively ,while 0125mg Cd 2+・L -1had no significant effect on that of gill.The SOD activity of hepatopancreas ,gill and blood all increased first and then decreased under the prolonged exposure of <10mg Zn 2+・L -1and <0125mg Cd 2+・L -1.There was an obvious dose 2time response relationship between test metal ions and SOD activity.The SOD activity was decreased in or 2der of hepatopancreas >gill >blood ,while the toxicity of test metal ions was in order of Cd 2+>Cu 2+>Zn 2+.K ey w ords Heavy metal ions ,Itopenaeus vannamei ,Hepatopancreas ,G ill ,Blood ,SOD.3国家自然科学基金项目(30100140)和山东省科技兴海资助项目(20012326).33通讯联系人.2004-11-30收稿,2005-04-07接受.1 引 言近年来我国部分海域重金属污染日益加重,已成为养殖水环境的重要污染因子,对养殖动物造成了严重危害,目前国内外研究主要集中于重金属污染物对生物体的急性毒性[5,12,34,41]及在体内的积累吸收[18,19,22~24,26,29],并多以养殖动物的抗氧化酶来评价其毒害程度[4,8,14,25~27,30,31],而有关重金属离子对对虾抗氧化系统的研究尚未见报道.当污染物在体内进行生物转化时,机体通过氧化还原循环生成大量活性氧(reactive oxygen species ,ROS ),这些活性氧可引起机体的氧化应激反应如脂质过氧化、酶蛋白失活、DNA 损伤等[7,10,33,35,39],超氧化物歧化酶(superoxide dismutase ,SOD )是生物体内清除活性氧自由基、防御过氧化损害系统的关键酶之一[28],目前已证明SOD与生物抗污染胁迫密切相关,是一类敏感的分子生态毒理学指标[14,21,30,36,38].本文研究了3种重金属离子对凡纳滨对虾(L itopenaeus vannamei )肝胰脏、鳃丝和血液SOD 活力的影响,探讨了重金属离子对凡纳滨对虾的致毒机理,为对虾环境毒理学的研究积累资料.2 材料与方法211 实验材料实验所用凡纳滨对虾于2002年9月购自青岛市营海对虾养殖场,体色正常,健康活泼,生物体长810±015cm ,体重10±115g.采用青岛近海自然海水暂养8~10d ,海水盐应用生态学报 2005年10月 第16卷 第10期 CHIN ESE JOURNAL OF APPL IED ECOLO GY ,Oct.2005,16(10)∶1962~1966度为30,p H为812,温度为24±015℃,连续充气,日换水2次,换水量为1/3~1/2,并适量投喂对虾配合饲料.212 实验方法21211重金属离子梯度的设置 经检测实验用青岛沿海自然海水的Cu2+、Zn2+、Cd2+的含量分别为1115、4715、0146μg・L-1.实验重金属离子的种类和来源为:Cu2+(CuSO4・5H2O)、Zn2+(ZnSO4・7H2O)、Cd2+(CdCl2・215H2O),3种重金属离子分别按《中华人民共和国渔业水质标准》(Cu2+≤0101mg・L-1、Zn2+≤011mg・L-1、Cd2+≤01005mg・L-1)的10倍、20倍、50倍、100倍设置实验浓度梯度.Cu2+的实验浓度梯度为011、012、015、1mg・L-1;Zn2+的浓度梯度为1、2、5、10mg・L-1;Cd2+的浓度梯度为0105、011、0125、015 mg・L-1.所有实验浓度梯度均设3个平行组,并以不加重金属离子组为对照组.实验在50cm×40cm×30cm的塑料水槽内进行,各梯度分别放健康的凡纳滨对虾各20尾,实验期间养殖管理与暂养期间完全相同,换水时分别加入相应重金属离子浓度的养殖用水,实验期间对虾无死亡现象.实验开始后于0、6、12、24、48、72、96h取样,每个梯度各水槽随机选取2尾对虾,用纱布擦干对虾体表,将消毒的5号针头和1ml注射器由头胸甲后插入心脏取血,注射器中预先加入已消毒预冷抗凝剂,使血液与抗凝剂的最终比例为1∶1,将2尾对虾血液混和样品放入冰箱(0~4℃)中保存;然后将对虾置冰盘内解剖,取肝胰脏和鳃丝,去除多余的组织块,用预冷重蒸水洗净、滤纸吸干后,置于115ml塑料离心管中.所有样品均保存于-20℃的冰箱内待测.21212样品制备 取肝胰脏和鳃丝样品加入9倍体积预冷的匀浆液(0125mol・L-1蔗糖,011mol・L-1Tris2HCl p H816缓冲液),冰浴中10000r・min-1匀浆5min,然后在高速冷冻离心机中以0℃、14000r・min-1,离心10min,取上清液测定超氧化物歧化酶的活力.血液样品置于冰箱(4℃)中保存过夜,低速离心(3000r・min-1)20min,取上清液待测. 21213超氧化物歧化酶活力测定 采用改良邻苯三酚自氧化测定法[43].在25℃p H=815,50mmol・L-1的K2HPO42 KH2PO4的缓冲液415ml中,加入10μl50mmol・L-1的连苯三酚,迅速摇匀,在波长325nm处每隔半分钟测一次A 值,使自氧化速率△A325nm/分控制在01070OD・min-1左右. SOD活力的测定为在加入连苯三酚前加入011ml酶液,依次测定A1~A20各OD值,选择A n+2~A n的各OD值,取其平均值,SOD活力单位定义为25℃条件,每分钟抑制邻苯三酚自氧化率达50%时所需要的酶量(U・mg-1).酶液蛋白质含量测定以牛血清白蛋白为标准物,采用考马斯亮蓝法[2]测定.213 数据处理和分析所有数据均以3个平行组数据的平均值(Means)表示(n =6),并采用单因素方差分析(ANOVA)和Duncan检验法统计分析.3 结果与分析311 Cu2+对凡纳滨对虾肝胰脏、鳃丝和血液SOD 活力的影响由图1A可看出,015、1mg・L-1Cu2+在12h对凡纳滨对虾肝胰脏SOD活力有最大促进作用,011、012mg・L-1浓度组在24h表现出最大激活,随作用时间的延长,酶活力下降,呈现出一个峰值的变化,至96h全部表现为抑制(P<0105).Cu2+对凡纳滨对虾鳃丝SOD活力影响与肝胰脏的变化趋势相似,在12h内所有浓度均表现出促进作用,至24h时,除011mg・L-1浓度组表现出最大激活作用外,其他浓度组酶活力下降至与对照组差异不显著(P>0105),随着Cu2+对凡纳滨对虾作用时间延长,酶活力下降,72h全部浓度组均低于对照组,96h全部显著抑制(P<0105).Cu2+对凡纳滨对虾血液SOD活力在6h全部浓度组表现为最大的促进作用,随作用时间延长,酶活力下降,至72h全部低于对照组,96h显著抑制(P<0105).312 Zn2+对凡纳滨对虾肝胰脏、鳃丝和血液SOD 活力的影响图1B表明,1、2和5mg・L-1的Zn2+对凡纳滨对虾肝胰脏SOD活力在6h出现最高峰值,随作用时间延长酶活力下降,1、2mg・L-1的Zn2+在72h, 5mg・L-1的Zn2+在24h表现为抑制作用.10mg・L-1的Zn2+未表现出激活效应,随时间延长,酶活力下降,24h达显著水平(P<0105).1、2、5mg・L-1浓度组Zn2+在72h内,10mg・L-1浓度组在48h内对凡纳滨对虾鳃丝SOD活力均表现出促进作用,且分别在72h和48h达到最大促进作用.96h酶活力下降与对照组差异不显著(P>0105).Zn2+对凡纳滨对虾血液SOD活力在12h全部浓度组表现为最大促进作用,且随作用时间延长,酶活力下降,48h后与对照组差异不显著(P>0105). 313 Cd2+对凡纳滨对虾肝胰脏、鳃丝和血液SOD 活力的影响由图1C可知,0105mg・L-1Cd2+对凡纳滨对虾肝胰脏SOD活力在24h表现为最大促进作用,011和0125mg・L-1在12h有最大促进作用,24h下降至低于对照组但不显著,015mg・L-1在实验时间范围内一直处于抑制状态,随时间延长酶活力下降.Cd2+对凡纳滨对虾鳃丝SOD活力在6h0105369110期 吴众望等:重金属离子对凡纳滨对虾肝胰脏、鳃丝和血液SOD活力的影响 图1 Cu2+(A)、Zn2+(B)和Cd2+(C)对凡纳滨对虾组织SOD活力的影响Fig.1Effects of Cu2+(A),Zn2+(B)and Cd2+(C)on SOD activity in tissue of L itopenaeus vannamei.a)肝胰脏Hepatopancreas;b)鳃丝G ill;c)血液Blood.Ⅰ10mg・L-1;Ⅱ1011mg・L-1;Ⅲ1012mg・L-1;Ⅳ1015mg・L-1;Ⅴ11mg・L-1.mg・L-1和011mg・L-1浓度组在实验时间内均表现为促进作用,0125mg・L-1浓度组在实验时间内酶活力与对照组差异不显著(P>0105),015mg・L-1浓度组在6h即表现出显著抑制作用(P<0105),随时间延长,酶活力下降.Cd2+对凡纳滨对虾血液SOD活力在6h所有浓度组均表现出最大的促进作用,随作用时间延长,酶活力下降,48h后与对照组差异不显著(P> 0105).由图1可知,3种重金属离子对凡纳滨对虾3种组织器官SOD活力的影响显著(P<0105).在实验时间内,Cu2+各处理组SOD活力均呈峰值变化, Zn2+、Cd2+低浓度组均表现为先升高而后下降的趋势,高浓度Zn2+对凡纳滨对虾肝胰脏SOD活力和高浓度Cd2+对肝胰脏、鳃丝SOD活力均表现为抑制作用,且随时间延长抑制增强,表现出一定剂量、时间效应,而对照组在实验时间内无显著变化(P> 0105).凡纳滨对虾SOD活力大小为肝胰脏>鳃丝>血液.4 讨 论411 重金属离子对凡纳滨对虾不同器官SOD活力影响的时间剂量效应据Florence[8]报道,在Cu2+(015、215、25μg・L-1)作用(1、3、7、14、21、28d)下,蛤仔(R uditapes decussates)鳃丝细胞质中SOD活力3d时显著激活,25μg・L-1在3d时刺激鳃丝发生脂质过氧化,而015、215μg・L-1在28d时脂质过氧化才增加; Siraj[31]研究了暴露于5mg・L-1Cd2+(1、7、15d)时,莫桑比克罗非鱼(O reochrom is mossam bicus)肝脏、肾脏SOD活力均较对照组高且呈上升趋势,30 d酶活力有所下降,并认为抗氧化防御系统能保护动物不受自由基的伤害;侯丽萍等[11]研究表明,在Cd2+(11096、2119、41365mg・L-1)作用(6、12、24、72h)下,草鱼(Ctenopharyngodon i dell us)肝脏SOD 活力随Cd2+浓度的增加呈现先短暂升高,然后逐渐下降,同一浓度随处理时间的延长,SOD活力逐步下降的趋势.Stebbing[32]认为,毒物在低浓度下引起动物抗氧化酶出现增益现象,是其在无毒情况下的刺激反应,并把这一现象称为“毒物兴奋效应”.本研究表明,3种重金属离子对凡纳滨对虾各组织器官SOD活力的影响具有明显的时间、剂量效应关系,这与上述学者的研究结果类似.因此,以凡纳滨对虾各组织器官SOD活力为指标,对养殖水环境重金属离子污染监测是可行的.412 在重金属离子作用下凡纳滨对虾不同器官4691 应 用 生 态 学 报 16卷SOD活力大小杨丽华等[40]研究表明,Cd2+(0173、1146、2195 mg・L-1)作用(12、24、48、96、144h)下,丰产鲫(Carassi us aurat us(♀)×Cypri nus acuti dorsalis (♂))肝脏比鳃丝SOD活力高10倍左右,并认为鳃和肝SOD活力和敏感性不同,可能与它们的不同生理功能有关.本实验表明,凡纳滨对虾3种组织器官SOD活力影响的大小顺序为,肝胰脏>鳃丝>血液.重金属离子可通过鳃丝和消化道进入水产动物体内,通过血液循环到达各组织器官,高亲和力的重金属离子容易与蛋白质结合而被细胞吸收[15,29].刘发义等[18,19]研究了Cu2+、Zn2+在对虾体内的积累和分布,发现肝胰脏对重金属的积累能力最强,是对虾体内Cu2+的主要储存器官,随后以胃、肠、鳃、壳、肌肉顺序递减.可以认为,肝胰脏是重金属累积及解毒的主要器官,肝巨噬细胞具有活跃吞噬能力,3种重金属离子在肝脏内氧化、还原或水解过程中会产生大量的O-・2,从而使肝胰脏SOD活力被诱导升高,而鳃丝是呼吸器官,直接与水环境接触,表现了一定氧化应激反应,但鳃丝重金属累积能力相对较弱,解毒功能低,因此其SOD活力和敏感性比肝胰脏低.同时血淋巴是转运污染物和运输组织器官代谢产物的重要介质,血淋巴内仅存少量活性的抗氧化酶,表现出较低的SOD活力[17].413 3种重金属离子对凡纳滨对虾的伤害程度水产动物受到环境刺激后发生非特异性防御反应,引发一系列代谢变化,动员机体的代偿适应功能来抵抗和适应各种应激刺激,产生应激适应;若应激反应超过一定强度且机体不能适应时,对机体组织结构造成伤害,导致应激损伤[6].依据本实验3种重金属离子对凡纳滨对虾SOD活力的抑制和伤害程度,可得出3种重金属离子对凡纳滨对虾伤害大小顺序为Cd2+>Cu2+>Zn2+.这种差别可能是3种重金属离子对机体诱导SOD活力变化的能力、酶亚基结合的数量及重金属离子浓度、作用时间和致毒机理有关.戴习林等[5]研究发现,Cu2+、Cd2+对罗氏沼虾幼体的毒性为Cd2+>Cu2+,与上述研究结果一致.很多研究也证实,Cu2+的毒性比Zn2+大[4,12,16,41].Cd2+是非必需金属,对多种酶活力都有影响.Cd2+体外实验表明,镉可直接与膜作用产生脂质过氧化反应,导致膜功能障碍,膜脂质流动性降低,通透性增加,进而造成Ca2+内流,无法维持细胞内钙的稳定,导致细胞损伤甚至死亡[20],因此较低剂量就对生物有毒性的影响.Cu、Zn是生物体内的微量元素,且SOD主要包括MnSOD和CuZn2 SOD,其中CuZnSOD占总SOD活力的80%~95%[9],作为其重要结合因子的Cu2+、Zn2+也可能具有一定抗氧化功能[1,3,13],其中Zn2+通过结合到结构物上或通过抑制金属催化的脂质过氧化反应可使胞内原生质和内膜处于稳定状态[37],所以对机体的毒性较弱.而侯兰英等[12]研究Cu2+、Zn2+、Cd2+对梭鱼的急性致毒效应,结果表明Cu2+、Zn2+、Cd2+对梭鱼均有明显的毒性,其毒性大小顺序为Cu2+>Zn2+>Cd2+;杨丽华等[41]实验结果表明,3种重金属离子对丰产鲫幼鱼的急性毒性大小为Cu2+>Cd2+>Zn2+,这可能与实验动物的不同和生长阶段有关.有研究表明,在相同实验条件下,镉对甲壳动物和鱼类的急性毒性影响的一般规律为甲壳动物比鱼类更为敏感[42].值得注意的是,在Cu2+作用下短时间内凡纳滨对虾3种组织器官SOD活力的激活率高浓度组>低浓度组,而Cd2+、Zn2+与之相反,由于Cu2+是甲壳动物血液血蓝蛋白的重要组成部分,高浓度Cu2+更易诱导体内SOD活力的升高,且诱导程度更大,有关这方面的作用机理还需进一步研究.参考文献1 Bagchi D,Vuchetich PJ,Bagchi M,et al.1998.Protective effect of zinc salts on TPA2induced hepatic and brain lipid peroxidation,glu2 tathionedepletion,DNA damage and peritoneal macrophage activa2 tion in mice.General Pharmacol,30(1):43~502 Bradford MM.1976.A rapid and sensitive method for the quantita2 tion of microgram quantities of protein utilizing the principle of pro2 tein dye binding.A nal Biochem,72:248~2543 Buzad ic B,K orac B,Lazic T,et al.2002.Effect of supplementa2 tion with Cu and Zn on antioxidant enzyme activity in the rat tis2 sues.Food Res Inter,35:217~2204 Dai J2Y(戴家银),Zheng W2Y(郑微云),Wang S2H(王淑红).1998.Effects of copper and zinc ions on activities of enzymes in tis2 sues of red sea bream Pagrosom us major juvenile.Envi ron Sci(环境科学),19(5):60~62(in Chinese)5 Dai X2L(戴习林),Zang W2L(臧维玲),Yang H2S(杨鸿山),et al.2001.The toxic effects of Cu2+,Zn2+,Cd2+on giant freshwater prawn juvenile.J S hanghai Fish U niv(上海水产大学学报),10(4):295~302(in chinese)6 Fang Y2Z(方允中),Zheng R2L(郑荣梁).2002.Theory and Ap2 plication of Free Radical Biology.Beijing:Science Press.122~212 (in Chinese)7 Feng T(冯 涛),Zheng W2Y(郑微云),Hong W2S(洪万树),et al.2001.Effect of benzo(a)pyrene on antioxidant enzyme activities in Boleophthal m us pecti ni rost ris liver.Chi n J A ppl Ecol(应用生态学报),12(3):422~424(in Chinese)8 Florence G,Angela S,Luisa B,et al.2002.Response of antioxidant systems to copper in the gills of the clam R uditapes decussates.M ar Envi ron Res,54:413~4179 Fridovich I.1986.Biological effects of superoxide radical.A rch Biochem Biophys,247:1~1110 Halliwell B,Gutteridge J MC.1989.Free Radicals in Biology and Medicine.Oxford:Clarendon Press.54311 Hou L2P(侯丽萍),Ma G2Z(马广智).2003.Effects of Cd2+on ac2569110期 吴众望等:重金属离子对凡纳滨对虾肝胰脏、鳃丝和血液SOD活力的影响 tivities of SOD in liver tissue of Ctenopharyngodon i dell us.Res Fish(水利渔业),23(3):14~15(in Chinese)12 Hou L2Y(侯兰英),Zhao H2R(赵鸿儒),Wu Y2L(吴玉霖).1993.Acute intoxication of some heavy metals to mugil so2iuy and the avoidance reaction of mugil so2iuy.Oceanol L i m nol Si n(海洋与湖沼),24(5):507~510(in Chinese)13 Johnson MA,Fischer J G,Kays SE.1992.Is copper an antioxidant nutrient?Crit Rev Food Sci N ut r,32:1~3114 K ong F2X(孔繁翔).2000.Environmental Biology.Beijing:Higher Education Press.72~74(in Chinese)15 Lan W2G(蓝伟光),Wu Y2P(吴永沛),Yang S2K(杨孙楷).1990.Progress of research on toxicity of seawater pollutant to the prawn.Fujian Fish(福建水产),(1):41~45(in Chinese)16 Lan W2G(蓝伟光),Yang S2K(杨孙楷).1993.Studies on effects of heavy metals on phisiological and biochemical characters of red sea bream Pagrosom us.Acta Ocean Si n(海洋学报),15(1):92~97(in Chinese)17 Li Y2P(李毅平),G ong H(龚 和).1998.Progress in research on insect antioxidant system.Chi n B ull L if e Sci(生命科学),10(5): 240~243(in Chinese)18 Liang D2H(梁德海),Liu F2Y(刘发义).1990.Effects of dietary copper on the prawn,Penaeus orientalis.Oceanol L i m nol Si n(海洋与湖沼),21(5):404~410(in Chinese)19 Liang D2H(梁德海),Liu F2Y(刘发义),Sun F(孙 凤),et al.1989.Effects of dietary zine on the prawn,Penaeus orientalis.M ar Sci(海洋科学),5:49~52(in Chinese)20 Liao L(廖 琳),Hu X2R(胡晓荣),Li H(李 晖),et al.2002.Research progress in Cd toxicity mechanisms and the antagonistic mechanisms of Se to Cd.Sichuan Envi ron(四川环境),21(2):21~24(in Chinese)21 Livingstone DR.1993.Biotechnology and pollution monitoring:Use of molecular biomarkers in the aquatic environment.J Chem Tech2 nol Biotechnol,57:195~21122 Liu C2F(刘长发),Tao S(陶 澍),Cao J(曹 军),et al.2000.Uptake of particulate lead via gills of gold fish.Chi n J A ppl Ecol (应用生态学报),11(2):283~286(in Chinese)23 Liu C2F(刘长发),Tao S(陶 澍),Long A2M(龙爱民),et al.2001.Interactions of lead and cadmium on uptake and accumulation by gold fish,Carassi us aurat us.Acta Ecol Si n(生态学报),21(11):1863~1868(in Chinese)24 Long A2M(龙爱民),Pan B(潘 波),Xu F2L(徐福留),et al.2002.Uptake of copper adsorbed on Kaolin of various size by fish (Cypri nus carpio)gills at various p H levels.Acta Ecol Si n(生态学报),22(10):1640~1644(in Chinese)25 Lu S2Q(鲁双庆),Liu S2J(刘少军),Liu H2Y(刘红玉),et al.2002.Effects of Cu2+on activities of protecting enzymes SOD,CAT and GSH2PX in liver tissue of Monopterus albus.J Fish Sci Chi na (中国水产科学),9(2):138~141(in Chinese)26 Lu X2J(陆星家),Xi Y2L(席贻龙),Liu G2Y(刘桂云).2004.Ac2 cumulation and distribution of lead in M acrobrachi um nipponense.Chi n J A ppl Ecol(应用生态学报),15(1):131~135(in Chinese) 27 Pan L2Q(潘鲁青),Ren J2Y(任加云),Wu Z2W(吴众望).2004.Effects of heavy metal ions on SOD,CAT activities of hepatopan2 creas and gill on the crab Eriochei r si nensis.J Ocean U niv Chi na(中国海洋大学学报),34(2):189~194(in Chinese)28 Parke VD.1987.Role of enzymes in protection against lipid peroxi2 dation.Regul Toxicol Pharmacol,7:222~23529 Rainbow PS.1992.The heavy metal accumulation and its meaning in marine organisms.M ar Envi ron Sci(海洋环境科学),11(1):44~51(in Chinese)30 Roche H,BogéG.1996.Fish Blood Parameters as a Potential Tool for Identification of Stress Caused by Environmental Factors and Chemical Intoxication.M ar Envi ron Res,41(1):27~4331 Siraj BP,Usha RA.2003.Cadmium2induced antioxidant defense mechanism in freshwater teleost Oreochromis mossambicus(Tilapi2a).Ecotoxicol Envi ron S af ety,56:218~22132 Stebbing ARD.1982.Hormesis the stimulation of growth by low levels of inhibition.Sci Tol Envi ron,22(1):213~23433 Stern A.1985.Red cell oxidative damage.In:Sites H.ed.Oxidative Stress.New Y ork:Academic Press.331~34934 Wang S2B(王寿兵),Guo R(郭 锐),Qu Y2F(屈云芳),et al.1998.Acute toxicity of Cu2+to Rana chensi nensis tadpole.Chi n JA ppl Ecol(应用生态学报),9(3):309~312(in Chinese)35 Winston GW.1991.Oxidants and antioxidants in aquatic animals.Com p Biochem Physiol,100C(1/2):173~17636 Wiston GW,Di G iulio T.1991.Prooxidant and antioxidant mecha2 nisms in aquatic organisms.A quat Toxicol,19:137~16137 Wu J(吴 坚).1992.Biochemical effects of trace metals on marine animals.M ar Envi ron Sci(海洋环境科学),10(2):58~64(in Chinese)38 Xu L2H(徐立红),Zhang Y2Y(张甬元),Chen Y2Y(陈宜瑜).1995.The advances of molecular ecotoxicology and its significance in water environment protection.Acta Hydrobiol Si n(水生生物学报),19(2):171~185(in Chinese)39 Xu L,Zheng G J,Lam PKS,et al.1999.Relationship between tis2 sue concentrations of polycyclic aromatic hydrocarbons and DNA adducts in green2lipped mussels(Perna vi ri dis).Ecotoxicology,8: 73~8240 Yang L2H(杨丽华),Fang Z2Q(方展强),Zheng W2B(郑文彪),et al.2003.Experiment with effect of cadmium on activity of super2 oxide dismutase in gill and liver tissue of crucian.J S af ety Envi ron (安全与环境学报),3(3):13~16(in Chinese)41 Yang L2H(杨丽华),Fang Z2Q(方展强),Zheng W2B(郑文彪).2003.Safety assessment and acute toxicity of heavy metals to cru2 cian Carassi us aurat us.J South Chi na Normal U niv(Nat Sci)(华南师范大学学报・自然科学版),(2):101~106(in Chinese)42 Zhao H2X(赵红霞),Zhan Y(詹 勇),Xu Z2R(许梓荣).2003.Progress in studying the toxic effects of heavy metals on aqutic ani2 mals.Inland A quatic Product(内陆水产),28(1):38~40(in Chi2 nese)43 Z ou G2L(邹国林),Hu W2Y(胡文玉),Qiu T(邱 涛),et al.1997.Studies on the sensitivity of some methods for activity assay of superoxide dismutase.J W uhan U niv(Nat Sci)(武汉大学学报・自然科学版),43(2):233~237(in Chinese)作者简介 吴众望,男,1980年生,硕士.从事养殖环境毒理学研究,发表论文多篇.E2mail:phy@6691 应 用 生 态 学 报 16卷。
金属离子鱼类急性毒性研究及对环境标准修订的启示意义

i i fe t o e fu t o s o x e i n a s o l e o s r e b i u l ct e cs ft rmea in n e p rme t l h c u d b b e v d o v o sy,L m o r c y a i ei n o c l ei u v h o l i f C fB a h d n o r r a d P e i a r t — o i c
摘
要: 以斑马鱼和孔雀鱼为 实验动物 , 进行 了 c “ 、 d 、n u c 2 z “和 c6 r 的鱼类急性毒性试验。结果表 明, 四 这
种金属 离子对受试鱼的毒性影响比较 明显 , 对斑马鱼、 孔雀鱼 9 6h半致死 浓度分别为 0 5 s L 1 .9m#L .7m / ,2 5 ,
关键词 : 金属 离子; u , d , I ,C6 鱼类急性毒性 ; c “ C 2 zl 2 r ; 标准修订 中图分类号 :5 3 2 X 0 . 文献标识码 : A
Fih Ac t x ct fM ea o sa d isI s iain s u e To ii o tlin n t n p rto y frEn io me tlSa d r sRe iin o vr n n a tn ad v so
第3 5卷第 4期 21 0 0年 4月
环境科学与管理
E VⅡl 0N 呕 NTAI S ENCE . CI AND ANAGEMENT M
V0 5 N仉 4 L3
Ap .2 0 r 01
文章 编号 :64— 19 2 1 }4— 0 8—0 17 6 3 (00 0 0 3 5
Absr c : u e tx c t fCu t a t Ac t o i i o 。 y
镉、锰、镍、铅对嗜酸氧化亚铁硫杆菌活性的影响
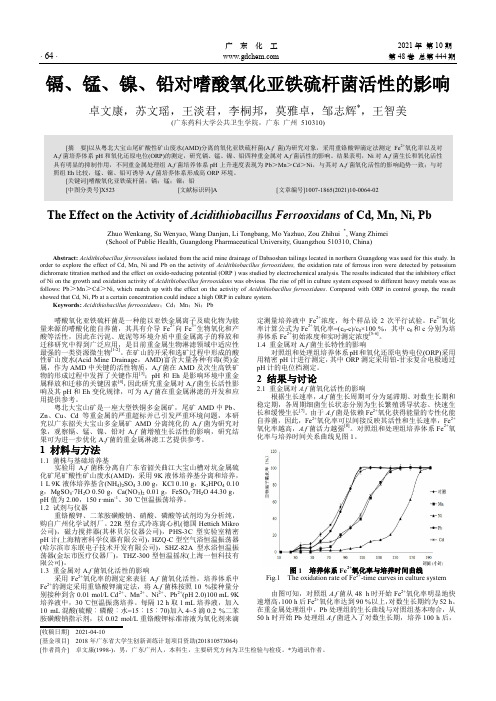
广东化工2021年第10期· 64· 第48卷总第444期镉、锰、镍、铅对嗜酸氧化亚铁硫杆菌活性的影响卓文康,苏文瑶,王淡君,李桐邦,莫雅卓,邹志辉*,王智美(广东药科大学公共卫生学院,广东广州510310)[摘要]以从粤北大宝山尾矿酸性矿山废水(AMD)分离的氧化亚铁硫杆菌(A.f菌)为研究对象,采用重铬酸钾滴定法测定Fe2+氧化率以及对A.f菌培养体系pH和氧化还原电位(ORP)的测定,研究镉、锰、镍、铅四种重金属对A.f菌活性的影响。
结果表明,Ni对A.f菌生长和氧化活性具有明显的抑制作用,不同重金属处理组A.f菌培养体系pH上升速度表现为Pb>Mn>Cd>Ni,与其对A.f菌氧化活性的影响趋势一致;与对照组Eh比较,锰、镍、铅可诱导A.f菌培养体系形成高ORP环境。
[关键词]嗜酸氧化亚铁硫杆菌;镉;锰;镍;铅[中图分类号]X523 [文献标识码]A[文章编号]1007-1865(2021)10-0064-02The Effect on the Activity of Acidithiobacillus Ferrooxidans of Cd, Mn, Ni, Pb Zhuo Wenkang, Su Wenyao, Wang Danjun, Li Tongbang, Mo Yazhuo, Zou Zhihui*, Wang Zhimei(School of Public Health, Guangdong Pharmaceutical University, Guangzhou 510310, China) Abstract: Acidithiobacillus ferrooxidans isolated from the acid mine drainage of Dabaoshan tailings located in northern Guangdong was used for this study. In order to explore the effect of Cd, Mn, Ni and Pb on the activity of Acidithiobacillus ferrooxidans, the oxidation rate of ferrous iron were detected by potassium dichromate titration method and the effect on oxido-reducing potential (ORP) was studied by electrochemical analysis. The results indicated that the inhibitory effect of Ni on the growth and oxidation activity of Acidithiobacillus ferrooxidans was obvious. The rise of pH in culture system exposed to different heavy metals was as follows: Pb>Mn>Cd>Ni, which match up with the effect on the activity of Acidithiobacillus ferrooxidans. Compared with ORP in control group, the result showed that Cd, Ni, Pb at a certain concentration could induce a high ORP in culture system.Keywords: Acidithiobacillus ferrooxidans;Cd;Mn;Ni;Pb嗜酸氧化亚铁硫杆菌是一种能以亚铁金属离子及硫化物为能量来源的嗜酸化能自养菌,其具有介导Fe2+向Fe3+生物氧化和产酸等活性,因此在污泥、底泥等环境介质中重金属离子的释放和迁移研究中得到广泛应用,是目前重金属生物淋滤领域中适应性最强的一类资源微生物[1-2]。
大学环境毒理学 环境中重金属的毒性

大学环境毒理学环境中重金属的毒性4.1 重金属概述4.2 汞(Hg)4.3 铅(Pb)4.4 镉(Cd)4.5 铬(Cr)4.6 砷(As)重金属的界定指比重在5.0以上的45种金属元素,包括金、银、铜、铅、锌、镍、钴、镉、铬和汞等。
由于砷和硒的毒性和某些性质与重金属相似,所以将砷、硒等类金属也列入重金属的讨论范围内。
目前人们关注的有毒重金属有(17种):汞、镉、铅、铬、锌、铜、锰、钴、镍、锡、钡、锑、铍、锂、铝、砷、硒。
环境毒理学的重点研究对象主要是:汞Hg、镉Cd、铅Pb、铬Cr、砷As、硒Se;其次还有锌Zn、锰Mn 等。
环境中的重金属为什么会损害人类健康?生物和环境是统一的,生物体的物质组成和环境的物质组成也是统一的;各生物元素在体内的绝对含量及相对比值是生物演化过程中形成的,只容许在一定范围内变化,只有如此才能维持人体的健康;环境元素与生物元素不断交流以保持动态平衡关系,生物体为这种内外元素的交流提供了通畅的途径;对于那些非必需的、甚至有毒的重金属元素如汞、镉、铅等,由于它们在环境中含量很低,在生命起源和生物演化早期阶段未被选择利用,生物体对它们的适应能力很差;当环境污染使局部地区的重金属元素浓度过高时,当地居民与环境之间的元素交换即会出现不平衡现象,即人体从环境中摄入的某些金属元素的量超过人体所适应的变动范围,体内不同元素之间的固有比例破坏了,这时就对人体健康产生危害,引起疾病,发生金属中毒,甚至死亡。
环境中重金属污染的来源对环境造成严重的重金属元素污染的主要来源是人类的生产活动。
工业:采矿、冶炼、使用重金属的工业生产过程(主要是含重金属的废水和残渣以及生活中的干电池)。
农业:施用农药(包括Pb、Hg、Cd、As等)。
化石燃料:煤、石油等燃料燃烧(排放出Pb、V、Ni等金属)等。
迁移:重金属主要是通过水在环境中迁移转运,同时也可以通过复杂的食物链(网)进行转移(逐级浓集放大)。
重金属在水体中不能被微生物降解,主要通过食物链在生物体中逐步蓄积,或者被水中悬浮粒子吸附而沉入水底淤泥中,从水体自净方面看,这似乎是好的一面,但实际上大量聚集于排水口附近底泥中的重金属,可能成为长期的二次污染源。
部分重金属与酚类混合物对淡水发光菌的毒性研究

部分重金属与酚类混合物对淡水发光菌的毒性研究摘要:应用微板毒性分析方法,分别测定了CdCl2·2.5H2O、CoSO4·5H2O、Cu(NO3)2·3H2O、Fe(NO3)3·3H2O、ZnSO4·7H2O、Ni(NO3)2·6H2O 6种重金属化合物和苯酚、邻甲基苯酚、间甲基苯酚、邻硝基苯酚及间硝基苯酚5种酚类化合物对淡水发光菌——青海弧菌Q67的抑制毒性,设计了EE-50(等EC50)、EE-10(等EC10)、EE-05(等EC05)3个等效应浓度比混合物,应用剂量加和(DA)与独立作用(IA)原理分析混合物的毒性。
关键词:青海弧菌Q67 重金属酚类混合物剂量-效应曲线联合毒性随着工业生产的不断发展,重金属对人类赖以生存的水源污染日益严重。
在美国环保署( EPA) 公布的水环境中存在的129 种优先污染物中,重金属类化合物就占12种。
另一方面, 含酚废水危害大、污染范围广。
在许多工业领域诸如冶金、机械制造、玻璃、石油化工、化学有机合成工业、塑料、医药、农药、油漆等工业排出的废水中均含有酚(陈延君等)。
人们对重金属和酚的毒性展开了广泛的研究,然而现实环境中,生物往往更多地、也更普遍地暴露在多种组分污染物存在的复杂混合体系中,因此,研究两者的联合毒性有着非常重要的意义。
1 材料与方法1.1 菌种及主要仪器、试剂青海弧菌Q67 (Vibrio-qinghaiensis sp.─Q67),华东师范大学提供,培养基配方及培养方法参见文献(莫凌云等,2006)。
Veritas?微板光度计(美国Turner Biosystems 公司);LS-B50L型立式压力蒸汽灭菌器(上海医用核子仪器厂);Pipetman?型移液器(P型移液器,P20,2~20μL;P100,20~100μL;PUM 12×300,20~300μL)(法国吉尔森公司);LRH-150Z型恒温振荡培养箱(广东医疗器械厂)。
4种重金属对发光菌的急性毒性和联合毒性研究[开题报告]
![4种重金属对发光菌的急性毒性和联合毒性研究[开题报告]](https://img.taocdn.com/s3/m/384151684afe04a1b071de97.png)
毕业论文开题报告环境工程4种重金属对发光菌的急性毒性和联合毒性研究一、选题的背景、意义随着工业农业的发展,大量污染物进入环境。
而重金属对环境的影响是巨大的,会对生态系统和人类健康产生潜在的长远的危害[1],当然对重金属进行研究与毒性的测定也是刻不容缓的事。
并且,有环境危险因素对生态系统和人类健康的有害效应并不是单一污染物作用的结果,而是各种污染物混合作用的结果。
待测生物暴露在混合污染物中时,由于混合物中各组分相互影响,会产生联合毒性[2]作用,表现为加和作用、协同作用和拮抗作用[3-4]。
(一)首先,要保护环境,其中第一步就是正确监测环境污染的情况。
目前主要是用物理仪器和化学分析相结合的方法。
这类方法的优点是能准确定性和定量,但是其仪器设备往往价格昂贵,技术要求和使用成本很高,只能在实验室里使用,即使不考虑这些仪器的昂贵价格及其他不便因素,仍然有一个重要问题:这样的毒物泄露到底对人类的健康有多大危害?尤其是中,远期危害,上述检验是无法直接回答这个问题的。
要回答对人群健康的影响,即对生物毒性大小的判断,必须用生物医学的方法对污染的生物毒性进行分析。
目前较常用的是检测污染物毒性的方法是从医学物理学的方法引用过来的小鼠,鱼,或藻类毒性实验,但其有不可克服的缺点,如时间长,要有专门的人员操作,成本大,个体存在差异等。
而应用发光细菌来检测污染物毒性则能克服这些缺点,具有方便、灵敏、高效进行等优点而被广泛应用[5-6],化合物对发光菌的毒性与对其它生物的毒性数据有一定的相关性[7]在有毒物质的筛选和环境污染物的生态风险评价等方面具有重要意义[8]。
而淡水发光菌-青海弧菌[9],和海洋型发光菌不同,具有更优越的性质,其不要Na存在有能生长发光良好,并且,新鲜培养的青海弧菌能在蒸馏水里能良好发光,且稳定发光课持续30min以上,因此,在淡水样品的检测中可以用蒸馏水做空白对照。
而淡水样品也不需要做任何额外添加物,直接将青海弧菌加进去就行了。
4种重金属离子对秀丽小杆线虫急性毒性研究

第43卷 增 刊2004年8月厦门大学学报(自然科学版)Journal of Xiamen University(Natural Science)Vol.43 Sup.Aug.2004文章编号:043820479(2004)S21332034种重金属离子对秀丽小杆线虫急性毒性研究收稿日期:2004205213作者简介:柯翎(1979-),男,硕士研究生.柯 翎(厦门大学生命科学学院,福建厦门361005)摘要:研究了Cu2+,Cd2+,Pb2+,Zn2+4种重金属离子对秀丽小杆线虫(Caenorhabditis elegans)的急性毒性影响.结果表明:4种重金属对秀丽小杆线虫的毒性大小依次是Cu2+>Pb2+>Cd2+>Zn+对 C.elegans的24h的L C50分别为6.04、17.20、71.70、145.33mg/L,Cu2+、Pb2+、Cd2+、Zn2+对 C.elegans的48h的L C50分别为3.46,10.07, 54.56,81.21mg/L.关键词:线虫;重金属;毒性中图分类号:X833;R135文献标识码:A 对于环境中重金属毒性的最直接测试方法是在生物体上的试验,即用鱼类或贝类等做试验,通过其的存活时间或繁殖量等指标直接判断毒性大小.而采用线虫作为生物试验对象的文献较少看到.秀丽小杆线虫(Caenorhabditis elegans),具有个体小,培养周期短,生长速度快,分布广泛,采集方便,容易在人工控制条件下生长繁殖等特点.本实验所用线虫自然条件下在土壤中生存,但在淡水或者培养液条件下也可以生存,因此也可以作为水生毒理学、水体污染方面的研究.国内外对 C.elegans 形态、分子、细胞转导等方面的研究报道较多,在发育生物学、细胞生物学等方面它已经成为目前在各方面了解得最清楚的后生动物,但少有对其作为污染物的生物指标种的研究报道.目前重金属污染方面的研究常用水生生物,如本文4种重金属离子对C.elegans的急性毒性试验,以了解重金属离子对其生长的影响.通过本试验,为重金属对C.elegans 的毒理学研究提供实践依据,并探索以线虫作为重金属污染检测指标的方法.1 材料与方法1.1 试验药剂CuSO4・5H2O(A.R.),CdCl2(A.R.),Pb(NO3)2(A.R.),ZnSO4(A.R.)用蒸馏水分别配成质量浓度为63.5、344.2、207.0、650.4mg/L的母液,再根据需要稀释成各质量浓度.1.2 试验线虫试验线虫来自South Dakota State University, Biological&Microbiological Department试验室人工纯种培养.接种所用的器皿等经过严格消毒.按K. Wah Chu[1]的方法进行培养和繁殖.1.3 试验方法试验于2004年2月~4月进行.为确定质量浓度的大致范围,先作预备试验,估算各重金属的7个质量浓度值,在每个浓度的培养皿中放入线虫40条,置于25℃下染毒.24h后在显微镜下观察,找出各重金属离子的100%致死浓度和最大耐受浓度.根据预备试验结果按等比级数设6个质量浓度组(各设3个平行组)及1个对照组,对照组均不加入重金属母液.将培养好的线虫洗脱下来,稀释到约300~500条/mL,在每个培养皿中加入500μL的线虫稀释液,并计数培养皿中的线虫数量.24h后,轻轻摇晃培养皿,使活动较少但没有死亡的线虫活动起来.显微镜下观察并记录线虫的死亡线虫数和活线虫数(当线虫完全不动并对针尖刺激不再起反应就认为线虫已死),统计死亡率,死亡率以死亡线虫数/(死亡线虫数+活线虫数)表示.计算平均死亡率,转换成概率单位,求出概率单位,与试验液质量浓度对数的回归方程.求出各种重金属离子的半数致死质量浓度L C50及各自的95%置信区间.48h后按以上方法再次计数线虫死亡率.表1 4种重金属离子对 C.elegans的急性毒性试验统计Tab.1 Statistical table for acute toxicity test of four heavy metals to C.elegans金属质量浓度/(mg/L)浓度对数试验动物数24h死亡率/%48h死亡率/%Cu2+0.00196 6.2±0.98.50±1.93.200.505122117.2±2.742.00±3.54.800.681219030.6±4.670.30±4.07.200.857316063.5±3.382.60±5.110.80 1.033423876.3±3.495.27±4.716.20 1.209527888.6±3.297.43±4.024.3 1.3856204100100Cd2+0.002217.4±2.59.63±3.534.00 1.531521214.4±2.627.73±1.851.00 1.707620123.3±2.737.10±1.176.50 1.883721454.9±4.669.00±3.6114.75 2.059819077.0±3.788.63±2.6172.13 2.235920888.7±1.497.07±2.3258.20 2.4119206100100Pb2+0.001857.5±1.68.10±2.010.30 1.012821127.0±5.948.57±2.815.50 1.190319946.1±4.881.33±4.223.30 1.367423767.3±6.395.03±4.434.81 1.541817877.0±3.699.50±0.952.30 1.718520787.4±2.510078.45 1.8945225100100Zn2+0.00209 6.5±2.27.07±1.240.00 1.602123013.0±2.123.10±2.560.00 1.778220320.1±1.834.97±1.890.00 1.954219031.3±4.556.33±2.7135.00 2.130322746.1±2.469.57±2.1202.50 2.306418664.1±6.288.93±2.5303.75 2.48251781001002 结 果Cu2+、Cd2+、Pb2+、Zn2+对 C.elegans的急性毒性结果见表1,2.不同浓度重金属离子的毒性有所不同,浓度越高,毒性越强,线虫死亡率越高.在高浓度组中线虫的中毒反应较迅速,短期内就出现死亡;而在低浓度组,中毒反应较缓慢,经较长时间才出现死亡.对照组相对其他各组,存活时间最长.各浓度组的 C.elegans中毒症状相似,首先是线虫受刺激,摆动比对照组强烈.12h后线虫逐渐麻痹,对外界刺激不敏感,虫体僵直,从雌虫的生殖孔开始逐渐溃疡,最后死亡并开始降解,直至虫体消失不见.而对照组的线虫表现正常. 通过回归方程估算出Cu2+、Cd2+、Pb2+、Zn2+4种重金属离子对C.elegans的L C50值,结果如表2.从试验结果可以看出,4种重金属离子对线虫的毒性影响不一.Cu2+的毒性最大,Zn2+的毒性最小.4种离子在24h和48h条件下的毒性顺序均为Cu2+ >Pb2+>Cd2+>Zn2+.总体来看,Cu2+和Pb2+对C.elegans的毒性是相近的,而Cd2+和Zn2+对 C. elegans的毒性较小.3 讨 论一般重金属可以分为必需金属(Cu2+、Zn2+)与非必需金属(Cd2+、Pb2+等)两类.重金属分布于土壤中,有多种络合态,金属离子通常只占可溶金属的一部分是唯一能与细胞膜载体蛋白结合的部分具有生物活性.试验中选用的4种重金属在水中均以二・431・厦门大学学报(自然科学版) 2004年表2 4种重金属离子 C.elegans 急性毒性试验结果Tab.2 Acute toxicity test results of four heavy metals to C.elegans元 素受试时间/h 浓度对数-几率单位曲线L C 50/(mg/L )L C 5095%置信区间X 2X 0.052Cu 2+24Y =3.117x +2.5071R 2=0.9905 6.04 6.49~5.627.7111.0748Y =2.993x +3.388R 2=0.9777 3.46 3.75~3.19 5.4111.07Cd 2+24Y =3.4697x -1.4838R 2=0.984971.70 77.28~66.52 4.6711.0748Y =3.6799x -1.3916R 2=0.9854.56 58.62~50.787.5911.07Pb 2+24Y =2.4514x +1.971R 2=0.988917.20 18.83~15.71 2.4811.0748Y =4.446x +0.5227R 2=0.996410.07 10.80~9.39 1.159.49Zn 2+24Y =2.1239x +0.4074R 2=0.9918145.33 161.56~130.730.9611.0748Y =2.5271x +0.1754R 2=0.995881.21 88.36~74.644.6111.07价阳离子为主要形式存在.因此用溶液Cu 2+、Cd 2+、Pb 2+、Zn 2+具有一定的可行性和可比性.金属对生物体毒性大小,除与金属本身的毒性和其浓度相关外,还与不同生长期的动物对重金属的耐受性有关[3].本试验采用处于相同生长期的线虫,作为染毒对象.试验采用的K 培养基能使线虫的生长处于L1幼虫期,只有极少数的线虫能够发育到成虫期.如果将线虫加入重金属溶液时发现成虫存在,要将成虫挑出,避免成虫产出的幼虫对试验结果造成影响.处于L1期的幼虫要经过3~5d 3次蜕皮发育成成虫后,才有可能怀孕并且产卵,因此本试验可排除成虫对试验动物数量的影响.本文着重对4种重金属对 C.elegans 的单一毒性作用进行初步研究,用 C.elegans 作为污染指标物,还需要对 C.elegans 在自然条件下对不同金属的敏感性以及重金属离子对C.elegans 的联合毒性作进一步研究.相对鱼类以及贝类等较高等水生动物,实验室人工培养的 C.elegans 的个体差异较小,对其进行的毒性实验具有更高的可靠性,且易于培养、保存.国外有研究表明经过转基因的 C.elegans 可以在短时间内被一定浓度的重金属诱导发出荧光[1],从而大大缩短污染物的检测时间.因此将 C.elegans 作为重金属污染检测的生物指标具有可行性.本文采用致死率作为毒理学的评价指标.今后还可以考虑用繁殖力等其它指标,这还需要更多试验来摸索其它的评价指标.参考文献:[1] Chu K Wah ,K ing L Chow.Syergistic toxicity of multipleheavy metals is revealed by a biological assay using a ne 2matode and its transgenic derivative[J ].Aquatic Toxicol 2ogy ,2002,61:53-64.[2] 徐镜波.环境毒理学[M ].长春:东北师范大学出版社,2000.[3] 赵钱举.重金属毒性的影响因素分析[J ].新疆环境保护,2002,24(4):38-40.The Acute Toxicity of Four Heavy Metals to Caenorhbditis elegansKE Ling(School of Life Sciences ,Xiamen University ,Xiamen 361005,China )Abstract :This study dealed with the acute toxicity of Cu 2+,Cd 2+,Pb 2+,Zn 2+to Caenorhabditis elegans .Themedian lethal concentrations of the four heavy metals of 24hours to C.elegans were determined to be 6.04,17.20,71.70,145.33mg/L ,respectively.The median lethal concentrations of the four heavy metals of 48hours toC.elegans were determinde to be 3.46,10.07,54.56,81.21mg/L ,respectively.The order of the toxicity toC.elegans of these heavy metals was obtained as follow :Cu 2+>Pb 2+>Cd 2+>Zn 2+.K ey w ords :Caenorhabditis elegans ;heavy metal ;toxicity・531・增 刊 柯 翎:4种重金属离子对秀丽小杆线虫急性毒性研究。
利用96微孔板进行水质发光菌急性毒性的快速检验

第2期 收稿日期:2020-10-27作者简介:唐哲兵(1963—),工程师,现就职于陕西省环境监测中心站质控中心,主要从事化学试剂危化品的安全管理。
利用96微孔板进行水质发光菌急性毒性的快速检验唐哲兵,张会强(陕西省环境监测中心站,陕西西安, 710054)摘要:选用淡水型青海弧菌Q67为测试菌种,以96微孔板为样品测试载体,用高灵敏度的微孔板式发光检测仪进行检测,建立了一种全自动,高灵敏度,高通量的水质发光菌急性毒性测试方法。
用该方法分别测试了汞,甲苯,三氯甲烷的水质发光菌急性毒性,用excel拟合了被测物质浓度(mg/L)与青海弧菌Q67相对发光强度(%)的线性方程,分别计算得出了汞,甲苯,三氯甲烷的半数效应浓度EC50值,利用96微孔板法进行水质发光菌急性毒性测试具有自动快速、高通量、数据准确等显著优势。
关键词:水质急性毒性;青海弧菌Q67;96微孔板中图分类号:X835;X502 文献标识码:A 文章编号:1008-021X(2020)02-0111-02RapidDetectionofAcuteToxicityofLuminescentBacteriainWaterby96MicroporePlateTangZhebing,ZhangHuiqiang(ShaanxiEnvironmentalMonitoringCenterStation,Xi'an 710054,China)Abstract:UsingfreshwaterVibrioqinghaiensisQ67astheteststrainand96microporeplateasthesampletestcarrier,ahighlysensitiveandhigh-throughputtestmethodforacutetoxicityofwaterluminescentbacteriawasestablished.Theacutetoxicityofmercury,tolueneandtrichloromethanewastestedbythismethod.Thelinearequationbetweentheconcentrationofthetestedsubstance(mg/L)andtherelativeluminousintensity(%)ofVibrioqinghaiensisQ67wasfittedbyExcel.TheEC50valuesofhalfeffectiveconcentrationofmercury,tolueneandtrichloromethanewerecalculatedrespectively.Theacutetoxicitytestofluminescentbacteriainwaterby96microporeplatemethodwasautomaticandrapid,highthroughputandaccuratedata.Keywords:acutetoxicityofwaterquality;vibrioqinghaiensisQ67;96microplate 细菌是在生态系统中存在最广泛的一类低等生物,利用污染物对细菌的毒性效应对评价生态风险具有重要意义[1]。
Hg(Ⅱ)和Pb(Ⅱ)对海洋单细胞藻的急性毒性效应

Hg(Ⅱ)和Pb(Ⅱ)对海洋单细胞藻的急性毒性效应战玉杰;杨茹君;王修林;张莹莹;王世荣【摘要】近年来,海洋重金属污染日益严重,为考察重金属对海洋藻类的生物毒性效应,进而评估其对海洋生态环境的影响,本研究采用一次性培养的实验方法,测定了2种重金属Hg(Ⅱ)和Pb(Ⅱ)对8种海洋单细胞藻的急性毒性效应,包括赤潮异弯藻(Heterosigma akashiwo Hada)、旋链角毛藻(Chaetoceros curvisetus Cleve)、海洋原甲藻(Prorocentrum micans Ehrenberg)、裸甲藻(Gymnodinium sp.)、中肋骨条藻(Skeletonema costatum( Greville) Cleve)、三角褐指藻(Phaeodactylum tricornutum Bohlin)、青岛大扁藻(Platymonas helgolanidica)和亚心型扁藻(Platymonas subcordiformis),测定出Hg(Ⅱ)对8种海洋藻的96 h-EC5o分别为16、42、24、37、31、12、385和161 μg·L-1,而Pb(Ⅱ)对赤潮异弯藻、旋链角毛藻、海洋原甲藻和裸甲藻的96 h-EC5o分别为9 516、8 373、12 002和10 128 μg·L-1.在本研究的培养条件下,Hg(Ⅱ)对受试海洋藻的毒性效应明显大于Pb(Ⅱ),Pb(Ⅱ)对赤潮异弯藻、旋链角毛藻、海洋原甲藻和裸甲藻的96 h-EC50与Hg(Ⅱ)对这4种藻的96 h-EC50的比值分别为594.75、199.36、500.08和273.73,而中肋骨条藻、三角褐指藻、青岛大扁藻和亚心型扁藻在有效浓度范围内未能检测到Pb(Ⅱ)对其相应的96 h-EC50,说明Pb(Ⅱ)对这4种藻的生物毒性作用比较小;比较重金属对各种藻作用的96 h-EC50,可知饵料藻对重金属的耐受性高于赤潮藻.同时发现,低浓度的Pb(Ⅱ)对藻类生长有一定的促进作用;在f/2营养液的培养条件下,重金属对海洋单细胞藻96 h-EC50值高于自然海水条件下相应的值.%Heavy metal pollution is becoming more and more serious in marine environment recently. In order to evalu ate the impact of heavy metals on marine eco-environment, the biotoxicity of heavy metals tomarine algae was investi gated. Using batch culture method, acute toxicity of Hg( II) and Pb( II) to 8 species of marine unicellular algae, Het erosigma cfcashhvo Hada, Chaetoceros curvisetus Cleve, Prorocentrum micans Ehrenberg, Gymnodinium sp., Skeletone ma costatum (Greville) Cleve, Phaeodactylum tricornutum Bohlin, Platymonas helgolanidica and Platymonas subcordi formis, was measured. The results showed that the 96 h-EC50 of Hg( II) for the tested algal species were 16, 42, 24, 37, 31, 12, 385 and 161 μg·L-1, respectively; and the 96 h-EC50 of Pb( H ) for Heterosigma ckashiwo, Chaetoceros curvisetus, Prorocentrum micans and Gymnodinium sp. Were 9 516, 8 373, 12 002 and 10 128 μg·L-1, respectively. The toxiciry of Hg( II) was significantly higher than that ofPb( II) under the f/2 culture condition; the ratios of 96 h-EC50 values of Pb( II) to Hg( II) for Heterosigma ckashiwo, Chaetoceros curvisetus, Prorocentrum micons and Gymnodinium sp. Were 594.75, 199.36, 500.08 and 273.73, respectively. However, the 96 h-EC50 of Pb( II) for Skele tonema costatum, Phaeodactyhim tricornutum, Platymonas helgolanidica and Platymonas subcordiformis could not be detected accurately in the effective concentration range under the f/2 culture condition, which suggested that the toxicity of Pb( II) to these four algae was very low. Based on the value of 96 h-ECS0, the tolerance of feed algae to heavy met als was estimated to be higher than that of harmful bloom algae. Moreover, it is found that Pb( II) could stimulate the growth of algae at relatively lower concentration, and the tolerance of algae to heavy metalwas higher under the f/2 culture condition than that in natural environment.【期刊名称】《生态毒理学报》【年(卷),期】2011(006)005【总页数】9页(P523-531)【关键词】急性毒性;EC50;Hg(Ⅱ);Pb(Ⅱ);海洋单细胞藻【作者】战玉杰;杨茹君;王修林;张莹莹;王世荣【作者单位】中国海洋大学化学化工学院,青岛266003;中国海洋大学海洋化学理论与工程技术教育部重点实验室,青岛266003;中国海洋大学图书馆,青岛266003;中国海洋大学化学化工学院,青岛266003;中国海洋大学海洋化学理论与工程技术教育部重点实验室,青岛266003;中国海洋大学化学化工学院,青岛266003;中国海洋大学海洋化学理论与工程技术教育部重点实验室,青岛266003;盐城工学院化学与生物工程学院,盐城224000;中国海洋大学化学化工学院,青岛266003;中国海洋大学海洋化学理论与工程技术教育部重点实验室,青岛266003【正文语种】中文【中图分类】X171.5近年来,随着沿海地区经济和工业的迅速发展,海洋污染日益严重,海洋生态环境遭到严重破坏。
二元混合污染物对明亮发光杆菌的联合毒性

c n oi v fe tT ejittxct so h iay mie oltnst h u n se 'b ce i a t s ie efc. h on o ii e ft e3bn r x d p l a t ot elmiecn a tra p t i u t
变 种作 为 毒 性 测 试 物 种 , 究 了 甲氨 基 阿维 菌 素 +阿维 菌 素 、 +P 和 多菌 灵 +H 等 农 业 源 污 染 物 二 元 研 Hg b g
混 合 的联 合 毒性 作用 和 主 因 子 作 用 , 立 了 3个 相 应 的 数 学 模 型 。结 果 表 明 : 氨 基 阿 等 5种 农 业 污 染 物 对 明 亮 发 光 杆 菌 的毒 性 有 显 著 的正 效 应 。3个 二 元 污 染 混 合 物 对 发 光 细 菌 的 Hg b
sgn, nd t e or e p i a hr e c r s ondi a he a i ng m t m tc mod l r sa ihe The r s lss e s we e e t bls d. e u t howe ha h oxii d t tt e t c -
we e dif r nt a e r l s ak ng, he e w a m a nl a ii e a to b t e n Em a e tn an r f e e , nd g ne aly pe i t r s i y a dd tv c i n e w e m c i d
上海农业学报
2 1 , 7 3 :6—2 0 12 () 1 0
Ac a Ag i ulur e S an ha t rc t a h g i
文章 编 号 : 0 03 2 ( 0 1 0 - 1 — 5 1 0 - 9 4 2 1 ) 3 0 60
基因重组发光菌应用于环境样品毒性的测试

种植业化学品通过化学肥料、化学农药和农膜的使 用释放到环境中[2],导致环境中化学品污染及健康 风险问题日 渐 突 出.现 阶 段,化 学 分 析 可 以 获 得 环 境样品的种类和含量等信息,但不能准确反映样品 的毒性 以 及 评 估 这 些 化 学 品 暴 露 引 发 的 环 境 风 险[3],为此,本 文 采 用 生 物 毒 性 测 试 来 表 征 环 境 样
TheApplicationofGeneRecombinantLuminescent BacteriatoEnvironmentalSampleToxicityTest
FANGGuizhen,HULixin ,HUANGGuoyong,ZHAOJianliang,YINGGuangguo
(SchoolofEnvironment,SouthChinaNormalUniversity∥GuangdongProvincialKeyLaboratoryofChemicalPollutionandEnvironmentalSafety∥ MOEKeyLaboratoryofEnvironmentalTheoreticalChemistry,SouthChinaNormalUniversity,Guangzhou510006,China)
华南师范大学学报(自然科学版)
JournalofSouthChinaNormalUniversity(NaturalScienceEdition)
2020,52(2):60-67 doi:10.6054/j.jscnun.2020028
基因重组发光菌应用于环境样品毒性的测试
方贵桢,胡立新 ,黄国勇,赵建亮,应光国
(华南师范大学环境学院∥广东省化学品污染与环境安全重点实验室∥环境理论化学教育部重点实验室,广州 510006)
磺胺与金属氧化物纳米颗粒对发光菌的急性联合毒性及其机制初探

共存 带来 了更大的环境生态风险 。
关键 词 : 磺胺 ; 纳米颗粒 ; V i b r i o l i s c h v d; 急性联 合毒性
[ J ] . A s i a n J o u na r l o f E c o t o x i c o l o g y , 2 0 1 6 , 1 l ( 5 ) : 6 5 — 7 0( i n C h i n e s e )
磺 胺 与金 属 氧 化 物 纳 米 颗 粒 对 发 光 茵 的 急 性联 合 毒 性 及 其 机 制 初 探
. 1 6 7 3 . 5 8 9 7 - 2 01 6 0 5 2 6 0 0l
周虹, 王大力, 葛鸿铭, 等. 磺胺 与金属 氧化物纳米颗粒对发光菌的急性联合毒性及其机制初探【 J 】 . 生态毒理学报 , 2 0 1 6 , 1 1 ( 5 ) : 6 5 . 7 0
Z h o u H, Wa n gD L , G eH M, e t a 1 . Ac u t e j o i n t e f e c t s a n dme c h a n i s ms o f b i n a r yt o x i c i t y o f s u l f o n a mi d e s n dme a t a l o x i d e n a n o p a r t i c l e s t o V i b n of i s c h e r i
y,S t h a n g h a i 2 0 0 0 9 2 , Ch i n a
Re c e i v e d 26 Ma y 2 01 6
重金属与四环素类抗生素对发光菌的毒性研究

银淑铮,刘刚,方俊.重金属与四环素类抗生素对发光菌的毒性研究[J].农业环境科学学报,2023,42(11):2422-2429.YIN S Z,LIU G,FANG J.Single and combined toxicity of heavy metals and tetracyclines to luminescent bacteria [J].Journal of Agro-Environment Science ,2023,42(11):2422-2429.重金属与四环素类抗生素对发光菌的毒性研究银淑铮,刘刚,方俊*(湖南农业大学生物科学技术学院,长沙410028)Single and combined toxicity of heavy metals and tetracyclines to luminescent bacteriaYIN Shuzheng,LIU Gang,FANG Jun *(College of Biological Science and Technology,Hunan Agricultural University,Changsha 410028,China )Abstract :In this study,the acute single toxicity and combined toxicity of five heavy metals and tetracycline antibiotics on luminescent bacteria were studied by a luminescent test.The toxicity unit method was used to characterize the combined toxicity,and the concentration addition model and independent action model were used to predict the combined acute toxicity of the binary mixed system to luminescentbacteria.The results showed that the toxicity was in the order of Pb (NO 3)2>ZnSO 4·7H 2O>CdCl 2·2H 2O>oxytetracycline hydrochloride>chlortetracycline hydrochloride>doxycycline hydrochloride>tetracycline hydrochloride>CuSO 4·5H 2O>K 2Cr 2O 7.The combined toxicity of heavy metals was mainly manifested as a synergistic effect.The combined toxicity of heavy metals and tetracycline antibiotics was mainlymanifested as an additive and antagonistic effect,and the combined toxicity of tetracycline antibiotics was mainly manifested as an antagonistic effect.When heavy metals coexist with tetracycline antibiotics,they had different toxic effects on luminescent bacteria.Therefore,the combined toxic effects should be considered during the evaluation of combined environmental pollution.Keywords :heavy metal;tetracycline antibiotics;toxicity unit method;concentration addition model;independent action model收稿日期:2023-06-28录用日期:2023-08-29作者简介:银淑铮(1998—),女,湖南邵阳人,硕士研究生,主要从事微生物研究。
《2024年不同环境因素作用下锑对大型溞的毒性效应以及风险评估》范文

《不同环境因素作用下锑对大型溞的毒性效应以及风险评估》篇一不同环境因素作用下锑对大型溞的毒性效应及风险评估一、引言锑是一种广泛使用的金属元素,其广泛的应用领域包括冶金、化工、电子和材料科学等。
然而,随着工业化的快速发展,锑的排放量逐渐增加,导致其在环境中的浓度不断上升。
作为水生生态系统中的重要组成部分,大型溞对环境中的污染物具有高度敏感性。
因此,研究不同环境因素作用下锑对大型溞的毒性效应及风险评估具有重要的科学意义和实践价值。
二、方法本研究采用大型溞作为实验对象,设置不同浓度的锑暴露组,并在不同环境因素(如温度、pH值、溶解氧等)下进行实验。
通过观察大型溞的生长、繁殖、存活等指标,评估锑对其的毒性效应。
三、不同环境因素作用下锑对大型溞的毒性效应1. 温度的影响在较低的温度下,锑对大型溞的毒性效应更为显著。
随着温度的升高,大型溞的抗逆性增强,但过高的温度也会对大型溞造成负面影响。
因此,温度是影响锑对大型溞毒性效应的重要因素之一。
2. pH值的影响pH值对锑在水中存在的形态有重要影响,从而影响其对大型溞的毒性效应。
在酸性条件下,锑更容易以有毒的形式存在,对大型溞的毒性效应更为显著。
而在碱性条件下,锑的毒性效应相对较弱。
3. 溶解氧的影响溶解氧是水生生态系统中的重要因素,对大型溞的生长和繁殖具有重要影响。
在低氧条件下,锑对大型溞的毒性效应更为显著,这可能是由于低氧条件下,锑更容易被大型溞吸收并积累在体内。
四、风险评估根据实验结果,我们可以对锑对大型溞的风险进行评估。
首先,我们需要确定锑的安全浓度,即不会对大型溞造成明显毒性效应的锑浓度。
然后,我们需要考虑不同环境因素对锑毒性效应的影响,以及这些环境因素在实际水体中的变化范围。
最后,我们可以根据这些信息评估锑对大型溞的风险,并据此提出相应的环境保护措施。
五、结论本研究表明,不同环境因素作用下,锑对大型溞的毒性效应具有显著差异。
温度、pH值和溶解氧等因素都会影响锑的毒性效应。
重金属毒理学研究中关键基因的识别与功能解析

重金属毒理学研究中关键基因的识别与功能解析重金属污染是当今世界环境保护面临的重要挑战之一。
重金属如铅、汞、镉等具有较高的毒性,会对人类健康和生态系统造成严重的威胁。
了解重金属毒性的分子机制对于发展有效的预防和治疗方案至关重要。
在重金属毒理学研究中,识别和解析关键基因的功能对于揭示毒性机制、筛选新的治疗靶点以及评估环境污染的风险具有重要意义。
一、重金属毒性的基本机制重金属以不可降解的形式进入环境中,被生物体摄取后会积累在组织和细胞中,引发一系列有害生理和形态学效应。
重金属通常通过以下机制对生物产生毒性作用:1. 直接损伤细胞膜和细胞器:重金属离子与细胞膜和细胞器膜中的脂质相互作用,引起膜的损伤,导致细胞的毒性反应。
2. 干扰生物体内的细胞信号传导:重金属物质可以与细胞内的信号传导通路发生相互作用,扰乱正常的细胞信号传递,导致各种异常生理效应。
3. 影响基因表达和蛋白质功能:重金属通过不同方式干扰细胞的基因表达和蛋白质功能,从而引发细胞功能紊乱和毒性反应。
二、重金属毒性相关的关键基因为了识别和解析与重金属毒性相关的关键基因,研究人员采用了多种方法,包括转录组学、蛋白质组学、基因敲除和基因表达分析等。
通过这些方法,研究人员已经鉴定出了许多与重金属毒性相关的关键基因。
1. 金属离子转运基因:包括铅、镉、汞等重金属离子的转运蛋白基因。
这些基因参与了重金属的摄取、转运和积累过程。
例如,人类铅转运蛋白hPbT1基因参与了人体内铅的吸收和分布。
2. 氧化还原基因:包括谷胱甘肽过氧化物酶系统和超氧化物歧化酶等氧化还原相关基因。
这些基因参与了细胞内重金属离子的还原和解毒过程,起到保护细胞的作用。
3. 基因转录因子:包括转录因子家族,如金属响应元件结合蛋白(MTFs)、核因子E2相关因子(NRFs)等。
这些转录因子通过与DNA结合来激活或抑制与重金属响应相关的基因。
4. 细胞凋亡相关基因:包括凋亡抑制因子和凋亡相关激酶等。
三种重金属离子对卤虫的急性毒性研究

三种重金属离子对卤虫的急性毒性研究ZHANG Yong-gang;ZHANG Wen-xiang【摘要】以卤虫无节幼体(36 h)和成虫(16 d)为例,在温度为15+3℃、盐度为30的条件下,通过单因子静态急性毒性试验方法,分别研究了Cu2+、Mn2+和Zn2+对卤虫的无节幼体和成虫的单一毒性效应;在此基础上,以卤虫卤虫无节幼体(36 h)为例,在相同试验条件下,通过等毒性溶液法,研究了Cu2+、Mn2+和Zn2+对卤虫的联合毒性效应.试验结果表明:卤虫无节幼体对三种金属离子的耐受能力均高于成虫,CU2+、Mn2+和Zn2+的48 h LC50分别是4.0、27.19和115.95 mg/L,而成虫Cu2+、Mn2+和Zn2+的48 h LC50仅为1.31、6.86和34.23 mg/L;且对两个时期的卤虫,三种金属离子毒性由强至弱均为Cu2+> Mn2+>Zn2+;三种重金属对卤虫无节幼体和成虫的安全浓度(SC)分别是0.4、2.72、11.6、0.13、0.69和3.42 mg/L.联合毒性试验结果表明Cu-Mn、Cu-Zn和Mn-Zn均对卤虫无节幼体表现为拮抗作用.%Studies on acute toxicity of Cu2+,Mn2+ and Zn2+ to Artemianauplii (36h) and adults were carried out at 15 ± 3 ℃ in the natural seawater where salinity is 30 using single-factor acute toxicity;on this basis,equi-toxicity test was used to evaluate the effect of joint toxicity of Cu2+,Mn2+ and Zn2+ to Artemia nauplii (36 h) in the same conditions.Results show that Artemia has different tolerances for the three heavy metal ions when it is in different growth period,and the interaction of heavy metal ions varied with growth period,adults are more sensitive of the three heavy metals;The 48 h LC50 of these three heavy metal to the Artemia nauplii is 4.0,27.19 and 115.95 mg/L,and to the adults is 1.31,6.86 and 34.23 mg/L;the order of toxicity of cuprum,manganese and zinc forArtemia nauplii and adults was Cu2+ >Mn2+ >Zn2+;the safe concentration of the three heavy metal ions (Cu2+,Mn2+ and Zn2+) to Artemia nauplii (36 h) and adults were 0.4,2.72,11.6,0.13,0.69 and 3.42mg/L.The results of combined toxicity test showed that Cu-Mn,Cu-Zn and Mn-Zn were all antagonistic to the Artemia naupli.【期刊名称】《海洋通报(英文版)》【年(卷),期】2018(020)002【总页数】10页(P71-80)【关键词】卤虫;重金属离子;单一和联合毒性;急性毒性【作者】ZHANG Yong-gang;ZHANG Wen-xiang【作者单位】Key Laboratory of Mariculture& Stock Enhancement in North China's Sea,Ministry of Agriculture,Dalian Ocean University, Dalian 116023, China;Key Laboratory of Preventive Veterinary Medicine in Hebei Province, Hebei Normal University of Science and Technology, Qinhuangdao 066600, China【正文语种】中文1 IntroductionArtemia,belong to theArthropoda,Branchiata,Cr-ustacea,Branchiopoda,Anostraca,Branchinectid-ae,Artemia,living in saltwater lakes and salt fields with high salinity[1].Distribution in salt fieldsand inland high salt waters of China's coastal provinces[2].Because of its wide distribution,strong environmental adaptability,fast reproduction,nutrient rich,convenient source,resting eggs can be stored for a long time and other advantages,Artemiabecome the most widely used live bait in aquatic animal breeding.Artemia,because of its resting eggs and nauplii,is easy to obtain and to be cultivated.It has become an important material for the toxicity test.At present,there are many experimental study on toxicity of heavy metal ions on the domestic section on Artemia,forexample:Guo[3],Xiu[4],Han[5],Xu[6]and others have doneCu2+,Hg2+,Se2+,Zn2+,Pb2+,Ni2+,Cd2+toxicity and other heavy metals onArtemianauplii.However,because of the environmental conditions used in the experiment and the difference in the origin of the Artemia,the result of the test is very different.Zhang[7]have shown the antagonistic effect of Pb2+-Mn2+on Russian Artemia by uniform design tablemethod;Li[8]concluded that the Pb2+-Mn2+showed synergistic effect by using the same toxicity solution method for the Artemiaspecies of Ebinur Lake in Xinjiang.This may be related to the strain,hatching condition and design ofArtemia.TheArtemianauplite and adult are very important biological bait forfish,shrimp,and crabs.This paper selects the fish breeding common resting eggs and more suitable for the water environment ofArtemiagrowth,studied the acute toxicity of copper,manganese and zinc onArtemianauplii and adults and larvae to three kinds of heavy metal ionson the joint toxicity of nauplii.Through the study of the acute toxicity effect of Cu2+,Mn2+and Zn2+onArtemia,improve the survival rate ofArtemianauplii and adults as well as quality,can reduce the cost in the process of aquaculture,so as to improve the economic benefit;on the other hand,using the sensitivity ofArtemiato heavy metals to monitor water is contaminated,especially the polluted water does not necessarily contain a heavy metal ions,has very important practical significance for the joint toxicity of various heavy metals onArtemiaas test,can put the environment biological indicators.2 Materials and Methods2.1 Material2.1.1 ArtemiaThe resting eggs produced by a company in Tianjin were incubated in a full temperature oscillation incuba tor at 28.5℃,1 500 lx,hatching for 36 h.Nauplii at 15±3℃,salinity 30,and feeding on algae feed for 16 days in an aerobic environment.2.1.2 Test drugs and equipmentCuSO4·5H2O(AR),ZnCl2(AR),MnCl4·4H2O(AR),Full temperature oscillating incubator(HZQ-F160)2.2 experiment design2.2.1 Design of single factor test for heavy metalsThe preparation of three kinds of heavy metals Cu2+,Mn2+and Zn2+in solution with distilled water solution on the basis of the test results:copper sulfate concentration(as Cu2+)in the seawater salinity is 30 to 10-15 mg/Lbegan to appear cloudy,after static precipitation.Testpreparation ofcopper,manganese and zinc in motherliquor concentration (with heavy metal ionsmeter)are 1 g/L,5 g/L and 20 g/L.The concentration of heavy metals is determined by pre-test,which is shown in Table 1.Tab.1 The concentration of metal ions in a single acute toxicity testNote:Ⅰ-nauplius,Ⅱ-imago?Take 100ml small beaker astest container,adding proper amount of water for each beaker,then according to the data of heavy metals solution pre-test results were added,each beaker into 40Artemianauplii or 20 adults,set a total of 7 concentration gradient and 1 control groups,each with three parallel,concentration setup is shown in Table 1.The test temperature was about 15±3℃.During the experiment,no bait was used and pH was kept in the optimum range.The death rate of artemia parasites in 24 hours and 48 hours was recorded.The 48 h LC50of each heavy metal onArtemiawas obtained by using EXCEL software to analyze and process the test data. 2.2.2 Experimental design of combined toxicity of heavy metalsThe joint toxicity test of nauplii was carried out by the method of equal toxicity solution[8].The toxicity of each group was one toxic unit(48 hLC50of a certain test heavy metal ion to Artemia nauplius).The 48 h LC50ofA andB heavy metal ions were multiplied by 0.8,0.6,0.5,0.4 and0.2,respectively,and then the two combinations,as shown in Table 2.The test conditions were the same as the single factor toxicity test,and the mortality of 48 h was recorded in each group.Tab.2 Combined toxicity test concentration combinationTest combinationA+B 1 2 3 4 5 0.8+0.2 0.6+0.4 0.5+0.5 0.4+0.6 0.2+0.8 Cu-Mn0.8Cu+0.2Mn 0.6Cu+0.4Mn 0.5Cu+0.5Mn 0.4Cu+0.6Mn 0.2Cu+0.8Mn Cu-Zn 0.8Cu+0.2Zn 0.6Cu+0.4Zn 0.5Cu+0.5Zn 0.4Cu+0.6Zn 0.2Cu+0.8Zn Mn-Zn 0.8Mn+0.2Zn 0.6Mn+0.4Zn 0.5Mn+0.5Zn 0.4Mn+0.6Zn 0.2Mn+0.8Zn 2.3 Manipulation dataAfter the data were recorded,the experimental data were analyzed and processed by EXCEL software.According to the experimental results,the concentration-mortality curves were made,and the types of interaction between heavy metal ions were analyzed and determined.3 Results and Analysis3.1 Single factor toxicity test of three kinds of heavy metal ions onArtemia 3.1.1 Toxicity of Cu2+to nauplii and adult ofArtemiaAs can be seen from Fig.1 the toxicity of Cu2+toArtemianauplius and adults increased with the increase of Cu2+concentration.The mortality of adultArtemiawas 90mg/L when the concentration of Cu2+was 4.0mg/L.The mortality rate of adultArtemia increased more.The results of above showed that there was no significant difference betweenthem(P>0.05).But Figure 1 shows that when the concentration ofCu2+reaches 4 mg/L,the mortality of nauplii is only about 60%,while the adult mortality is higher than 90%.Fig.1 Acute toxicity of Cu2+to Artemia nauplii and adults3.1.2 Toxicity of manganese toArtemianaupli and adultsAs can be seen from Fig.2,with the increase of the concentration ofMn2+,the toxicity of theArtemianaupli and the adult increased,and the death rate of theArtemiain the same concentration was higher than that of the adult.When the concentration of Mn2+is higher than 20 mg/L,which changes each unit,Artemiaadult mortality changes more.The variance analysis of the test results found that the difference ofArtemiatoxic effects of Mn2+on the two period was significant(0.01<P<0.05 Mn2+).The results showed that Mn2+had a certain toxic effect on the growth and development ofArtemia.The toxicity of Mn2+to the adult ofArtemiawas greater,and the toxicity of Mn2+to the adult ofArtemia was linear.3.1.3 Toxicity of Zinc toArtemisnauplii and adultsFig.2 Acute toxicity of Mn2+toArtemianauplii and adultsAs can be seen from Fig.3,with the increase of Zn2+concentration,the toxicity to Artemiain two periods increased.When Zn2+>20 mg/L,its toxicity toArtemiaadults was greater than that of nauplii.When the concentration of Zn2+increased by one unit,the adultArtemiavariance are more toxic.Analysis of the two stages ofArtemiamortality were not significant different in mortality in two cases (P>0.05),but can be seen from Figure 3 when the concentration of Zn2+reached 50 mg/L,nauplius mortality rate was only about 40%,and the adult mortality rate was as high as 90%.Fig.3 Acute toxicity of Zn2+to Artemianaupli and adults3.1.4 Comparison of Acute toxicity of three heavy MetalIons toArtemisnaupliand adultsAs can be seen from Fig.4,theArtemianauplii of Cu2+,Mn2+andZn2+tolerance of the three kinds of heavy metals in 48 h LC50were 3.03,20 and 125 mg/L.The 48 h LC50of three heavy metals of Cu2+,Mn2+andZn2+ofArtemiaadults were 1.5,6.63 and 32.5 mg/L,respectively.From these two groups of data,it can be seen that the toxicity of the three heavy metal ions to adultArtemiais higher,and the toxicity of Cu2+is greater than that of Zn2+.The order of toxicity was Cu2+>Mn2+>Zn2+.Fig.4 Comparison of the 48 h semi lethal concentration of three heavy metals to the two stages ofArtemia3.1.5 The safe concentration of heavy metals to nauplii and adults ofArtemiaThe safety concentration of various heavy metal ions onArtemianauplii and adults is shown in table 3.Tab.3 Safe concentrations of various heavy metal ions for Artemia nauplii and adults Various heavy metal ionsVarious heavy metal ions Safety concentration ofArtemianauplii and adult Artemianaupli Adult Cu 00.40 0.13 Mn 02.72 0.68 Zn 11.60 3.423.2 Combined toxicity test of heavy metals to nauplii ofArtemiaFig.5 Combined toxicity test of three kinds of heavy metal ionsAs shown in Fig.5,Cu-Mn,Cu-Zn and Mn-Zn ofArtemianauplii showed antagonistic effect.Three cases were mortality and theoretical analysis of variance results:There was a significant difference between the mortality rate and the theoretical mortality rate in the three conditions(P<0.01).The combination of Cu-Mn,Cu-Zn and Mn-Zn reduced the toxicity ofArtemianaupli.The mortality analysis of the three cases showedthat:mortality difference was not significant(P>0.05),that the antagonistic between each combination has no significant difference.4 DiscussionCopper,zinc and manganese are essential trace elements in animal body.Their toxicity to organisms is not only dependent on the chemical nature and form of metal,but also affected by the environmental factors and the physiological conditions of the individual animals.There are certain limits of essential elements in organisms,which can promote the growth and development of organisms in the range of physiological concentration.Too much will have a toxic effect on biology[8].4.1 Toxicity of single heavy metals to Artemis nauplii and adultsThe acute toxicity test of the three kinds of heavy metal ions onArtemianauplii and adults was tested in this experiment.The toxicity of different heavy metal ions is different from that ofArtemiaduring the same period.ForArtemianauplii,Cu2+showed greater toxicity,about 40 times of Zn2+,while for adults,the toxicity of Cu2+was about 20 times of Zn2+.The differences of the three kinds of heavy metals on the acute toxicity test on Artemia,may be due to the chemical structure of three kinds of heavy metal ions of different toxicological mechanism of different causes;may also be due to various heavy metal ions invade the body in different ways,together with the different absorption rate of Artemiaon different causes;there may be three kinds of trace elements in the body of the function.Copper is the active center of enzyme composition and variety of enzymes,content of medium can promote the growth ofbody[8];manganese activator of many enzymes,excess into the body it will produce toxic effects on the nervous system,and also can inhibit the activity of related enzymes[8];zinc is involved in the composition of more than 300 enzymes and functional proteins in animals,affecting many metabolic functions of the body.When the content is moderate,it can promote the growth of organism,and excessive will do harm to the organism[9].The metal tolerance ofArtemiawas different in different developmental stages.The tolerance concentration of theArtemianauplii to heavy metals was higher,and the acute toxicity of heavy metal ions on the adultArtemiawas enhanced.At present,the results of acute toxicity test of heavy metal ions toArtemiaare still different.Xu[6]experiments showed that the 48 h LC50of Cu2+and Mn2+for the naupli ofArtemiawere 2.10 mg/L and 12.15 mg/L.Xiu[4]experiments showed that the 48 h LC50of acute toxicity of Zn2+to stageⅡ-Ⅲ Artemia was 19.1 mg/L.It is different from this test,which may be related to the strain,hatching and experimentalconditions of theArtemia(salinity,temperature,DO,light,pH and so on).4.2 Combined toxicity test of a variety of heavy metals onArtemianauplii The joint toxicity test of the three heavy metal ions toArtemiawas carried out in this experiment.The results showed that Cu-Mn,Cu-Zn and Mn-Zn showed antagonistic effects onArtemianauplii,but the antagonism between each group was not significant.The joint toxicity of Cu-Mn onArtemianauplii showed antagonistic action,the reason may bethatcopper is the active center of the composition and enzymes in organism,manganese is the activator of many enzymes in aquatic organisms,when the mass enters the body,may cause certain effects on the nervous system,while suppressing the activity of the enzyme.Therefore,the combined action of the two metal ions may prevent each other,thus reducing the toxicity of the twoArtemianauplii[8].Cu-Zn showed the reason of antagonism.It may be because copper thiophil belongs to heavy metals,and some biological tissue enzyme thiol has a great affinity[8].Zinc is part of many biological active site cofactor,zinc ion and copper ion compete in living organisms,because the active site metal into the cells of the body is limited,when zinc ion is far greater than the concentration of copper ion at the active site of these cells which mostly occupied byZn2+,the toxicity Cu2+cannot enter the cell[10],so the two are showing antagonism.Mn-Zn showed antagonistic effect,may be due to zinc is part of many coenzyme,manganese activator of many enzymes in aquatic organisms,may increaseArtemianauplii activity of two kinds of metal ions when combined,thereby reducing its toxicity,so the two are showing antagonism.Chen[10]and others studied the combined action ofZn2+,Cu2+,Hg2+,Cd2+and Pb2+on Hydra.The experiment showed that the four cases showed an antagonistic effect on the mortality of Hydra,and the mortality of Hydra in four cases was not significant.The results of this paper are similar.On one hand,it is possible that one of the metal ions is more easily absorbed by the body and occupies the active sites ofrelatively more biological cells in advance because of the effect of heavy metals.Because of the limited activity site of cells,the damage of other heavy metals to the body is very small.There may be no significant difference in the number of active sites occupied by several kinds of heavy metals,so the antagonistic effect is also not significant.On the other hand,it may be that the experimental conditions are limited,and the toxicity test method is not perfect,so the difference between the test results is not significant.Therefore,we need to constantly combine the knowledge of biometrics and constantly improve the test methods.It will be seen from this that the toxicity of two kinds of heavy metal ions onArtemiamay be weakened or enhanced.After the study of toxicity to organisms,we can take into account the possible interactions between different compounds.It can be seen from this experiment that the toxicity test of single heavy metal to Artemiacan only depend on its physical and chemical properties and absorption speed.The joint toxicity of many heavy metal ions may also depend on the interaction between two heavy metal ions.In this experiment,the effect of the death ofArtemiawas used as a standard to detect the effect of heavy metals on theArtemia.Only a combination of different heavy metal ions between the joint toxicity was tested.Result analysis is just a list of the line graph,and no equation was written because of the complex effects of heavy metals on Artemiacan not rely on a simple equation to express its ing mathematical statistics related knowledge to increase the number of treatment,improve the analysis of design and test software,joint toxicity analysis of multi factors is animportant research direction in the future.5 ConclusionThe acute toxic effects of Cu2+,Mn2+and Zn2+on the nauplii and adult ofArtemiawere studied in this experiment.Based on these,the joint toxicity tests of three heavy metal ions againstArtemianauplii were carried out.The test results showed thatArtemianauplii tolerance of the three kinds of metal ions were higher than that of adults,Cu2+,Mn2+and Zn2+48 hLC50were 4.0、27.19 and 115.95 mg/L,Cu2+,Mn2+and Zn2+and the adult 48 h LC50 is only 1.31,6.86 and 34.23 mg/L.The results of combined toxicity test showed that Cu-Mn,Cu-Zn and Mn-Zn were all antagonistic to theArtemianauplii.Reference【相关文献】[1] Chen Y M.Biological bait culture[M].China Agriculture Press.2002,113-118.[2] Lin X C.The utilization and development prospect of Artemia in aquaculture[J].Fisheries Science&Technology Information,2000,(3):121-123,127.[3] Guo Q,Zheng J,Xu YX,et al.Acute toxicity offour toxicants to Artemialarvae[J].EcologicalScience,1992(2):67-69.[4] Xiu R Q,Dave G.Experimental study on toxicity of selenium and six heavy metal ions on Artemia[J].Journal of Hygiene Research,1992(3):298-300.[5] Han X F,Wang J P,Liu C Q.The actuate toxicitive effects of lanthanumand cerium on Brine Shrimp[J].Journal of HebeiUniversity(Natural Science Edition),1998,8(1):68-71. [6] Xu Z C,Hong LQ,Zheng B D.Toxic effects of heavy metals on severalmarine bivalve and crustacean.[J].Journal of Applied Oceanography,1994,12,13(4):381-387.[7] Zhang Q T,Hu G K.Studies on joint toxicity of five heavy metal ions to Artemia [J].Journal of Tianjin University of Science&Technology,2010,4(2)25:26-29.[8] Li N,Shi Y X,Qi S T,et al.Toxicity effects of main heavy metal pollutant ofthe Bohai Sea on Artemia Nauplius[J].Hebei Fisheries,2006(2):14-16.[9] Yi Z H.The mechanism of high zinc and its application in the diet of piglets [J].Jiangxi Feed,2003(6):8-10.[10]Chen N,Hao J S,Wang Y,et al.Single and binary-combined acute toxicity of heavy metal ion Hg2+,Cu2+,Cd2+,Ag2+,Zn2+and Pb2+to Hydra[J].Journal ofBiology,2007,6,24(3):35-37.。
基于发光细菌法的农产品中主要重金属的联合毒性评价

基于发光细菌法的农产品中主要重金属的联合毒性评价刘霞;何早;胡雨欣;郑舒;罗芳【期刊名称】《食品与机械》【年(卷),期】2016(032)003【摘要】通过细菌发光抑制试验,研究pb2+、Cd2+和Hg2+的单一毒性,以及pb2+ +Cd2+、Cd2+ +Hg2+、pb2++ Hg2+、pb2++Cd2++ Hg2+的混合毒性,分别采用等毒性单位法与加和指数法,对其混合物的联合毒性进行评价.结果表明,3种重金属的毒性大小为Hg2+> Pb2+ >Cd2+.对于混合体系,两种评价方法结果一致,即pb2++ Cd2+为协同作用;Cd2++Hg2+、pb2++ Hg2+和pb2+ +Cd2++ Hg2+均为拮抗作用.【总页数】5页(P60-64)【作者】刘霞;何早;胡雨欣;郑舒;罗芳【作者单位】湖南农业大学食品科技学院,湖南长沙410128;食品科学与生物技术湖南省重点实验室,湖南长沙410128;湖南农业大学食品科技学院,湖南长沙410128;食品科学与生物技术湖南省重点实验室,湖南长沙410128;湖南农业大学食品科技学院,湖南长沙410128;食品科学与生物技术湖南省重点实验室,湖南长沙410128;湖南农业大学食品科技学院,湖南长沙410128;食品科学与生物技术湖南省重点实验室,湖南长沙410128;湖南农业大学食品科技学院,湖南长沙410128;食品科学与生物技术湖南省重点实验室,湖南长沙410128【正文语种】中文【相关文献】1.发光细菌法检测大米中的重金属 [J], 何早;吴卫国;胡雨欣;刘霞2.甲醛与重金属二元混合体系对发光细菌的联合毒性 [J], 钱骁;刘瑞志;王静;李捷;雷坤;李艺红3.二元含Hg(Ⅱ)重金属混合物对发光细菌的联合毒性 [J], 吴淑杭;周德平;徐亚同;姜震方4.用于环境污染物遗传毒性评价的重组发光细菌载体的构建 [J], 黄新新;何苗;施汉昌;蔡强5.发光细菌法在煤化工废污水急性毒性评价中的应用 [J], 宋张杨;韦昊;魏玥;孙晓懿;孙照东;焦瑞峰因版权原因,仅展示原文概要,查看原文内容请购买。
