第十章 醚和环氧化合物
第十章 醚和环氧化合物

例如:合成
(CH3)2CH O CH2Ph
X
(CH3)2CHCl + NaO CH2
(CH3)2CHONa + Cl CH2
(CH3)2CHOH Na
(CH3)2CHONa
CH3
Cl2 hν
CH2Cl
(CH3)2CHONa
(CH3)2CH O CH2Ph
10
◆ 芳香醚的合成:
O ONa + CH3OSOCH3 O
R
+
.. O ..
R' + HCl
R
O
+
R' + Cl
pKb≈ 17.5
H
醚还可以与缺电子的Lewis酸形成络合物:
R
.. O .. .. O ..
R' + BF3
R R'
O
R R' O
BF3
X Mg R" O R R'
16
R
R' + R"MgX
2. 醚键的断裂 醚在HI或HBr的作用下,C–O键断裂,生成醇与卤代烷等
第十章 醚和环氧化合物
1
1 结构和命名
通式为R—O—R,两个烃基相同时称为简单醚,不相
同时称为混合醚。
烃基可以是芳香烃基,也可以是脂肪烃基,两个烃基 可以彼此相连形成环醚。 醚和碳原子数目相同的醇互为同分异构体。 CH3OCH3 CH3CH2OH
2
H O H
R O R'
醚
CH3CH2OCH2CH3
R ONa + R' L
用于混醚、环醚、芳香醚的合成
第十章 醚和环氧化合物

H2C O
CH2
+ H3O+
H2O
H2C O H
CH2 + H2O
H2C O H
CH2
HO CH2
CH2 OH2
H2O
HO CH2
CH2
OH + H3O+
工业上制备乙二醇的方法
不对称的环氧化合物在酸催化下, 不对称的环氧化合物在酸催化下,发生 SN2反应,Nu:优先进攻取代较多的 原子: 反应, 优先进攻取代较多的C原子 反应 优先进攻取代较多的 原子:
Mg 纯醚 H2SO4
△
CH2
H2SO4 D2O
BrCH2CH2CH2OC(CH3)3 DCH2CH2CH2OC(CH3)3
BrMgCH2CH2CH2OC(CH3)3
CH3 DCH2CH2CH2OH + CH3 C CH2
在碱的催化下, 在碱的催化下,醇与炔烃发生亲核加成 反应,生成烯基醚: 反应,生成烯基醚:
CH3OCH2CH2OCH2CH2OCH3
CH2 CH O CH2CH3
O CH3
乙基乙烯基醚
CH3CHCH2CH2CH3 OCH3
CH3CH2O
CH3
β , β′ –二甲氧基乙醚 二甲氧基乙醚 二甘醇二甲醚 (diglyme)
环
CH3 CH CH2
CH3OCH2CH3
CH3OCH3
O
CH3OC(CH3)3
苯甲醚 茴香醚 (anisole) 对于结构复杂的醚: 对于结构复杂的醚: 较大的烃基作为母体, 较大的烃基作为母体,烃氧基作为取代基 。 1–乙氧基 甲苯 乙氧基–4–甲苯 乙氧基 2–甲氧基戊烷 (1-ethoxy-4-methylbenzene) 甲氧基戊烷 (2-methoxypentane)
醚和环氧化合物
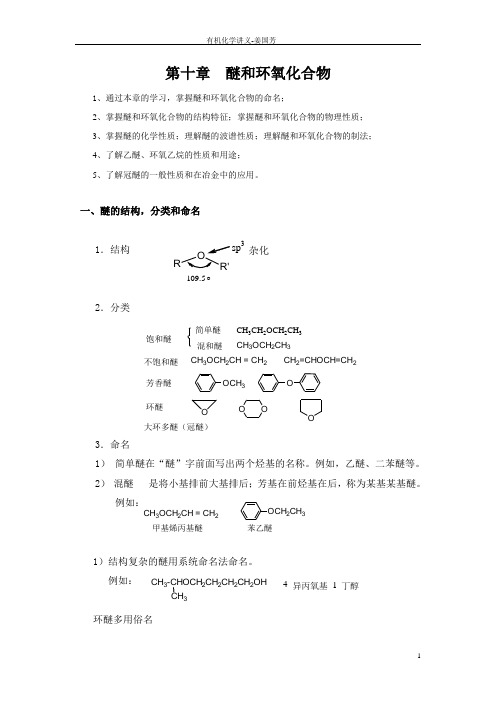
第十章 醚和环氧化合物1、通过本章的学习,掌握醚和环氧化合物的命名;2、掌握醚和环氧化合物的结构特征;掌握醚和环氧化合物的物理性质;3、掌握醚的化学性质;理解醚的波谱性质;理解醚和环氧化合物的制法;4、了解乙醚、环氧乙烷的性质和用途;5、了解冠醚的一般性质和在冶金中的应用。
一、醚的结构,分类和命名1.结构 2.分类3.命名1) 简单醚在“醚”字前面写出两个烃基的名称。
例如,乙醚、二苯醚等。
2) 混醚 是将小基排前大基排后;芳基在前烃基在后,称为某基某基醚。
例如:1)结构复杂的醚用系统命名法命名。
例如:环醚多用俗名饱和醚简单醚混和醚不饱和醚芳香醚环醚大环多醚(冠醚)CH 3CH 2OCH 2CH 3CH 3OCH 2CH 3CH 3OCH 2CH = CH 2CH 2=CHOCH=CH 2OCH 3O O OOOCH 3OCH 2CH = CH 2OCH 2CH 3甲基烯丙基醚苯乙醚CH 3-CHOCH 2CH 2CH 2CH 2OHCH 3异丙氧基丁醇4 --1-ROR'°109.5sp 3杂化二、醚的物理性质常温下,大多数醚为易挥发、易燃烧、有香味的液体。
醚分子中因无羟基而不能在分子间生成氢键,因此醚的沸点比相应的醇低得多,与分子量相近的烷烃相当。
常温下,甲醚、甲乙醚、环氧乙烷等为气体,大多数醚为液体。
醚分子中的碳氧键是极性键,氧原子采用sp 3杂化,其上有两对未共用电子对,两个碳氧键之间形成一定角度,故醚的偶极矩不为零,易于与水形成氢键,所以醚在水中的溶解度与相应的醇相当。
甲醚、1,4-二氧六环、四氢呋喃等都可与水互溶,乙醚在水中的溶解度为每100g 水溶解约7克,其它低分子量的醚微溶于水,大多数醚不溶于水。
二、乙醚能溶于许多有机溶剂,本身也是一种良好的溶剂。
乙醚有麻醉作用,极易着火,与空气混合到一定比例能爆炸,所以使用乙醚时要十分小心。
三、醚的化学性质醚是一类不活泼的化合物,对碱、氧化剂、还原剂都十分稳定。
第十章 醚和环氧化合物(修改)

O
O
4.命名
普通命名法: 甲醚 ; 甲乙醚; 乙醚; 烯丙基乙炔基醚.
O
O
O
O
系统命名法
1-甲氧基丁烷; 乙氧基乙烯 1,4-环氧丁烷
O
O
O
二.一般制法
(1)一般用于制备对称醚 产率10>20>30 (30易脱水成烯) (2)可用于制备伯烷基叔烷基醚
OH
+
OH
con.H2SO4 O
叔烷基醚还可以这样制备:
1.乙醚 乙醚通常用于从水中萃取有机物的原因: ① 乙醚微溶于水; ② 乙醚能溶解大多数有机物; ③ 沸点低.
环氧乙烷及其它1,2-环氧化物
制备 ① 烯烃氧化
C C
+
RCO3H Ag
C C O
(过过过过过)
CH2 CH2
+
O2
250℃
CH2 O
CH2
(催过过过)
② β-卤代醇与碱作用
C C X OH
+
CH3 C O C CH3
H
+
CH3 CH3 C CH3
H O
+
CH3 C CH3 CH3
(CH3)3COH CH3 CH3 C CH2
CH3 _ H+
CH3 CH3 C O CH3 CH3
H
+
CH3 CH3 C CH3
H O
+
CH3 CH3 CH3 C+
+
CH3OH CH3 CH3 C CH2
CH3 _ H+
OH
+
H2SO4 O
2. Williamson醚合成法 醚合成法 特点:a.可制混合醚; b.不能用20RX、30RX。
第十章醚和环氧化合物

H 2O CH2 CH2 + C2H5OH O HBr
H+
CH2 OH
CH2 +OH 2
+
-H +
HOCH2CH2OH
乙二醇
CH2 CH2 -H+ OH HOC2H5 HOCH2CH2Br
2- 溴乙醇
HOCH2CH2OC2H5
乙二醇单乙醚
例2:
CH2 CH2 + H2O O
OH -
HOCH2CH2OH
乙二醇
OH -
O
HOCH2CH2OCH2CH2OH
二乙二醇 O O O O O O
n
O
OH -
HOCH2CH2O(CH2CH2O)n CH2CH2OH
聚乙二醇
O
例3:
CH2 CH2 + NH3 O O
OH OH -
HOCH2CH2NH2
乙醇胺
O
OH -
HOCH2CH2NHCH2CH2OH
分离与提纯醚
10.4.2 酸催化碳–氧键断裂
醚在HI或HBr的作用下,C–O键断裂, 生成醇与卤代烷等:
H CH3CH2CH2OCH3 + HI CH3CH2CH2O CH3
首先生成 盐
CH3CH2CH2O
–
CH3 I H
CH3I + CH3CH2CH2OH
I 与 盐发生SN2反应
•醚键的断裂——醚和浓酸(常用HI)共热
反应具有SN1 的性质
O H (CH3)2C
CH2OH
反式开环
OCH3
10.4.3 碱催化碳–氧键断裂
第十章-醚和环氧化合物

检查过氧化物的方法:使湿的淀粉/KI试纸变蓝或使FeSO4 /KSCN显红色。 除去过氧化物的方法:用FeSO4洗涤(还原破坏)
四、克莱森(Claisen)重排
烯丙基芳基醚在高温下可以重排为邻烯丙基酚或对烯丙基酚, 称为克莱森重排。
OC* H2CH=CH2 200oC
OH CH2CH=C* H2
若邻位已被占领,烯丙基经两次连续重排迁移到对位。
CH3
OCH2CH=C* H2 CH3
CH3
OH CH3
CH2CH=C* H2
αβγ
O CH2CH=CHCH3
CH3
CH3
重排机理:经历环状过渡态
CH3
OH CH3
CH2CH=CHCH3
α βγ
* O
* O
O
OH
H CH2CH=C*H2 互变异构
CH2CH=C* H2
如何制备?
OH
CHCH2CH3 C6H5 CH3
KOH 160 ~180oC
CH2=CH O C2H5
汞盐催化下醇对炔烃的亲电加成反应
CH3C CH + HOR Hg2+
CH2C=CH2 OR
第四节 醚的化学性质
醚是一类不活泼的化合物,对稀酸、碱、金属钠、催化氢 化、氧化剂、还原剂等都很稳定,与强酸可以发生反应。
一 烊盐的形成 二 醚键的断裂 三 生成过氧化物 四 克莱森重排
OR C
OR
H3O+
C O + ROH
ROH
H3O+
H+
O
O OR
四氢吡喃醚
+ ROH
O OH
常用于保护羟基
4* 含芳基的混合醚,醚键总是优先在脂肪烃基一边断裂。
第十章 醚和环氧化合物

sp3杂化
2. 环氧化合物的结构
10.3 醚和环氧化合物的制法 1. 醚和环氧化合物的工业合成
乙醇Байду номын сангаас硫酸催化下,加热脱水生成乙醚。
乙烯催化氧化得环氧乙烷。
浓 H2SO4
2 CH3CH2OH
CH3CH2OCH2CH3 Ag
H2C CH2
+
1/2 O2
oC 280~300
1~2MPa
H2C CH2 O
R
OH
+
H3C
C
CH2
CH3
用于醇的保护和脱保护
• 烯基醚
R' C R" CH OR R"
H2O/ H+
R' CH CH O + HOR
醛(或酮) 总是在烯基醚键处开裂
醇
3. 环氧化合物的酸性开环——亲核取代反应SN1机理
环氧化合物的碱性开环——SN2机理
O O + NH3 HOCH2CH2NH2 一乙醇胺 O HOCH2CH2NHCH2CH2OH 二乙醇胺 HOCH2CH2 HOCH2CH2 HOCH2CH2 三乙醇胺 N
第十章
醚和环氧化合物
主要学习内容
掌握醚的分类及其命名法。 掌握氢键对沸点、水溶性等物理性质的影响。 理解醚的结构特点。 掌握醚和环氧化合物的化学性质 理解醚和环氧化合物的制备方法
一.醚(Ether)和环氧化合物的分类及命名
分类
O O O O O
O R R'
R
O
R'
(CH2)n O
• 叔烷基醚按SN1 机理
CH3 CH3 CH3 I H O C CH3 CH3 CH3 O H CH3 C CH3 I CH3 I C CH3 CH3 I OH + CH3 C CH3
第十章 醚及环氧化合物.

Boiling Points of Ethers and the Isomeric 1-Alkanols
Ether CH3OCH3 CH3OCH2CH3 (CH3CH2)2O Name Methoxymethane (Dimethyl ether) b.p. (oC) -23.0 1-Alkanol CH3CH2OH CH3CH2CH2OH CH3(CH2)3OH CH3(CH2)7OH b.p. (oC) 78.5 82.4 117.3 194.5
反应的动力:亲核试剂强的亲核性,开环后张力减小 2 碱性开环方向
SN2:从位阻小的方向进攻
31
3 碱性开环的立体化学
SN2:从离去基团的背面进攻
32
Summary
环氧化合物在酸性与碱性条件下都可以开环: (1) 酸性开环,为SN2机理,但具有部分SN1的性质, 不对称的 环氧化合物开环时, 开环反应的比较复杂。 (2) 碱性下开环,同样为SN2机理,但不对称的环氧化合物开 环时,开环方向由空间效应所决定,亲核试剂加在取代 少的环碳上。 (3) 无论酸性或是碱性开环,亲核试剂从氧桥的反面进攻中 心碳原子,符合SN2反应的立体化学特征。
§5 冠醚(Crown ether)
高度稀释
18-Crown-6
23
选择性识别
相转移催化-PTC(Phase Transfer Catalysis)
24
§6 环氧化合物的反应
分子内部存在张力,易开环
一、酸性开环
25
1 酸性开环机理:一般SN2
削弱C-O键
2 酸性开环方向
SN2机理但具有部分SN1的性质
Why?
10
二、Williamson Ether Synthesis
10-醚和环氧化合物
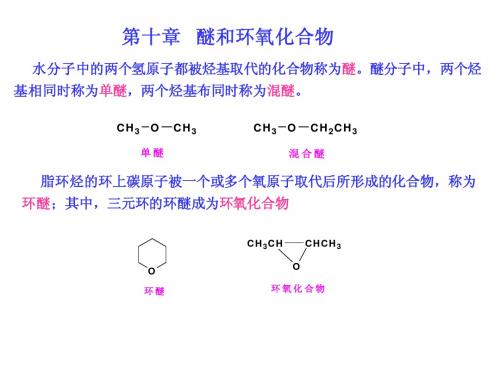
脂环烃的环上碳原子被一个或多个氧原子取代后所形成的化合物,称为 脂环烃的环上碳原子被一个或多个氧原子取代后所形成的化合物, 环醚;其中,三元环的环醚成为环氧化合物 环醚;其中,三元环的环醚成为环氧化合物
CH3CH O 环醚 O 环氧化合物 CHCH3
一,醚和环氧化合物的命名
简单醚的命名: 集团在前 芳基在 简单醚的命名:小集团在前,芳基在前 的命名
MgBr + CH3CH O CH2
n-C6H13 CH2CH2OH
纯醚 H2O, H+ CH2CHCH3 OH
优先在取代基少的碳原子上发生反应, 优先在取代基少的碳原子上发生反应,SN2 机理
5. Claisen 重排
苯基烯丙基醚及其类似物在加热的条件下,发生分子内重排生成邻烯丙 苯基烯丙基醚及其类似物在加热的条件下,发生分子内重排生成邻烯丙 及其类似物在加热的条件下 重排生成 基苯酚的反应 称为Claisen 重排. 的反应, 重排. 基苯酚的反应,称为
O O H
H3C H2C O CH CH3
CH3CH2O CH O O CH3 H + (n-1) C2H5OH
n
蒸馏提纯这种乙醚时,残留液易发生爆炸! 在蒸馏提纯这种乙醚前, 蒸馏提纯这种乙醚时,残留液易发生爆炸! 在蒸馏提纯这种乙醚前,必 须检验过氧化物的存在, 须检验过氧化物的存在,以防意外
七,冠醚
醚分子极性小,分子间作用力小,沸点低.但醚可与水形成氢键,故醚 醚分子极性小,分子间作用力小,沸点低.但醚可与水形成氢键, 极性小 氢键 微溶于水. 微溶于水.
五,醚的波谱性质
IR: C-O 伸缩振动吸收峰在 1200-1050 cm-1
1H
NMR:
有机化学-第十章 醚与环氧化合物-文档资料

17
10.5.2 酸催化醚键断裂
例如: (1) 对称醚键的断裂: 两侧醚键断裂均等
18
(2) 甲基伯烷基醚:醚键断裂在甲基一侧
(3) 叔烷基醚:醚键断裂在叔丁基一侧
(4) 芳基醚:醚键断裂在烷基一侧
19
醚键开裂机理
甲基伯烷基醚:SN2机理(主要考虑位阻影响为主)
叔烷基醚:SN1机理(主要考虑碳正离子稳定性)
11
(3) 立体专一性反应——邻基参与作用
12
10.3.3 不饱和烃与醇的反应
该反应是可逆反应,可利用异丁烯与醇反应生成的叔 丁基醚保护醇羟基。
13
10.4 醚的物理性质和波谱性质
IR:
C–O
Байду номын сангаас
1200 ~ 1050cm-1
14
10.4 醚的物理性质和波谱性质
δ 3.4 ~ 4.0
1H
NMR:
20
两类较易水解的醚类化合物
• 叔丁基醚
用于醇的保护和脱保护
• 烯基醚
21
烯基醚的水解机理
22
10.5.3 环氧化合物的开环反应
稀酸介质 HX溶液
23
反应机理
不对称环氧化物的酸性下开环
反应取向:在取代基多的一端开环,具有SN1性质。
立体化学: 反式开环。
酸的醇溶液
碱性条件下的环氧化物开环
2
。
10.1 醚和环氧化合物的分类
单醚:
乙醚 甲基叔丁醚
醚
混醚: 环醚:
四氢呋喃(THF)
1,4-二氧六环
环氧化合物:
环氧乙烷
3
10.1 醚和环氧化合物的命名 1. 单醚: “二”+“烃基 + 醚”
有机化学(高鸿宾第四版)第十章醚和环氧化合物

根据生成碘化银的量,计算出甲氧基含量。此反 应用于天然的复杂有机化合物分子中甲氧基的测定。
当混醚中的一个烃基是芳基时,由于p、π-共轭效应的影响, 芳环与氧原子相连的键比较牢固,与氢碘酸反应时,发生烷氧 键(R-O)断裂,生成碘代烷和酚。
O C H 25H + I S N 2
O H C + H C 3 H 2 I
C H 3 O C H 3
甲醚
O
二苯醚
H 2 C H C O C H C H 2
二乙烯基醚
(2) 混醚:“烃基”+“烃基”+ “醚”,较
优基团
置后,但芳基置前:
C H 3O C 2H 5
O C H 3
甲乙醚
苯甲醚
methyl ethyl ether (茴香醚)
(3)对于结构复杂的醚: 较大的烃基作为母体,烃氧基作为取代基 。
① 乙 醚
M g B r+H 2 C O C HC H 3② H 3 O +
C H 2 C HC H 3 O H
(60%)
例:
C H 2 = C H 2 C H 3 C H 2 C H 2 C H 2 O H
CH3CH2-MgCl +
O
-Mg(OH)Cl H2O
C H 3 C H 2 C H 2 C H 2 O M g C l
但可以和水分子形成氢键, 小分子醚有一定水溶性。
易燃易爆 使用小分子醚时,应避免明火。
乙醚,它遇到火星就有发生燃烧爆炸的危险。其蒸气能 从远处将明火引来起火。
醚长期放置受热或碰撞可发生爆炸。
三、醚的化学性质
{稳定,不和除酸之外的试剂反应。
在空气中会慢慢氧化成过氧化物。
有机化学-第十章醚和环氧化合物

H H3CH2C O C O O n H
CH3
+ (n-1) CH3CH2OH
有机化学 第十章 醚和环氧化合物
31
本章的重点和难点
醚和环氧化合物的结构; 醚和环氧化合物的制备方法; 环氧化合物在酸、碱催化下醚键的断裂反应;
有机化学 第十章 醚和环氧化合物
32
作业
P375 习题(一); P376 习题(二)(1-4);习题(四)单
R O Na + R' L R O R' + Na L L: Br, I, OSO2R'' 或 OSO2OR''等
反应特点: SN2; 反应原料最好使用RCH2X
有机化学 第十章 醚和环氧化合物
11
(2) 芳香醚的合成
O ONa + CH3OSOCH3
O
O
OCH3 + NaOSOCH3
(75%)
O
6
(5) 冠醚
m-冠-n m: 碳、氧原子总数 n: 氧原子数
O
O
OO
12-冠-4
O O
O O
O
苯并-15-冠-5
有机化学 第十章 醚和环氧化合物
7
2. 结构
1) 醚
O
0.142 nm
CH3 112° CH3
O: sp3 杂化
2) 环氧化合物
0.147 nm
CH2
CH2
59.2°
0.144 nm
剧毒
OH
O
+ H3CO C OCH3
OCH3 + CH3OH + H2O
无毒无害,
绿色化学。 有机化学 第十章 醚和环氧化合物
第十章 醚及环氧化合物

-CH3COOH
(CH3)3CCHCH2HgOOCCH3 OC2H5
NaBH4 OH-
(CH3)3CCHCH3 + Hg + -OOCCH3 OC2H5
反应遵循马氏规则:氢加在含氢较多的碳上,烷氧 基加在含氢较少的碳上。 优点:反应快,操作方便,产率高,一般不发生重排和消除。 如果用叔醇和烯烃制备相应的醚,由于空间位阻, 用Hg(OOCCF3)2来代替Hg(OOCCH3)2,效果较好。
α O H3C
α β γ H C 3 CH3 β O γ CH3 H3C O CH3 γ β α
OH H3C CH3 H3C H
O CH3 β α γ
α
β γ
在有机合成上可用于制备邻位带有某些烃基的酚类化合物。
脂肪乙烯基烯丙醚的重排:
1O 2 HC CH2 3 CH2 1 CH 2 CH2 3 O1 HC 2 CH2 3 1 CH2 2 CH CH2 3
-Cl-
O
二、 醇分子间失水---制备简单醚
CH3CH2OH
H+
CH3CH2OH + CH3CH2—OH2
+
+
-H2O
SN2
-H+
CH3CH2OCH2CH3 H
CH3CH2OCH2CH
3
醇在浓H2SO4作用下可以制得对称的醚。 1oROH制醚产率好。
三、 烯烃的烷氧汞化-脱汞法
(CH3)3CCH=CH2 + Hg(OOCCH3)2 + C2H5OH
(CH3)3C
+ O CH3 + H
(CH3)3C
O CH3 H
SN1
(CH3)3C+ + CH3OH I(CH3)3CI
10 第十章_醚和环氧化合物

醚的分类
醚 (Ether)
单醚:
乙醚
环醚:
四氢呋喃(THF)
水
醇
混醚:
叔丁基甲基醚
环氧化合物:
环氧乙烷
1,4-二氧六环
10.1 醚和环氧化合物的命名
单醚: “二”+“烃基” + “醚” “二”字和“基”字有时可省略,但不饱和醚习 惯上保留“二”字。
(二)乙(基)醚 乙醚
diethyl ether
1,2–二甲氧基乙烷 (乙二醇二甲醚)
1,2-dimethoxyethane
环醚的命名
环醚: 按杂环化合物命名为“氧杂环某烷”, 三元环醚习惯称为“环氧某烷”。
环氧乙烷 (氧杂环丙烷)
1,2-epoxyethane (oxirane)
2–(氯甲基)氧杂环丙烷 (环氧氯丙烷)
2-(chloromethyl)oxirane (1,2-epoxy-3-chloropropane)
有机化学 Organic Chemistry
第十章 醚和环氧 化合物
第十章 醚和环氧化合物
水分子中的两个氢原子都被烃基取代的化合物称为醚 。脂环烃的环上碳原子被一个或多个氧原子取代后所形 成的化合物,称为环醚;其中三元环醚称为环氧化合物 。
醚和环氧化合物的分类、命名、制法 醚和环氧化合物的物理性质和波谱性质 醚键的断裂 环氧化合物的开环反应 环氧化合物与 Grignard 试剂的反应 Claisen 重排 冠醚
醚键开裂机理:
SN2机理
位阻影响
SN1机理
中间体稳定性
10.5.3 环氧化合物的开环反应
环氧乙烷酸性条件下开环:
不对称环氧化合物酸性条件下开环
反应取向: 亲核试剂优先进攻取代较多的碳原子, 类SN1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十章醚和环氧化合物
授课对象:应用化学、化工分析、化学工程、制药工程、药学
学时安排:2-4h
教材:普通高等教育“十五”国家级规划教材《有机化学》第四版高鸿宾主编2005年5月
一、教学目的与要求
1、掌握醚和环氧化合物的命名、结构;
2、掌握醚和环氧化合物的化学性质:质子化成盐、环氧乙烷与Grignard试剂的反应、Claisen重排、过氧化物的生成;
3、熟悉醚的波谱性质;
4、熟悉环氧化合物的结构和命名,三元环氧化物的开环(酸催化和碱催化)加成反应;
5、熟悉醚和环氧化合物的制备方法(Williamson制醚的方法);
6、了解环氧化物的开环机理;冠醚的结构与应用。
二、教学重点
1、醚的中、英文命名法;
2、醚的化学性质:质子化成盐、环氧乙烷与Grignard试剂的反应、Claisen重排、过氧化物的生成;
3、三元环氧化物的开环(酸催化和碱催化)加成反应;
4、醚的结构和命名;
5、醚与HX作用;
6、三元环氧化物的开环(酸催化和碱催化)加成反应。
三、教学难点
1、Claisen重排的机理;
2、环氧化物的开环反应机理。
四、教学方法
讲授法。
酸催化和碱催化下三元环氧化物的开环加成反应是本章的难点,又是重点,通过多做练习题加以巩固。
五、教具
电脑、幻灯投影仪、powerpoint课件、红外线指示笔。
六、教学步骤及时间分配
导言:
1、引导学生回顾醚和环氧化合物的通式、来源或制备方法;
2、已经学过了的醚有哪些主要的性质?
4、从生活中的实例引入醚类化合物的重要性,引入本章内容。
一、醚的结构、分类和命名
1、醚的结构和分类
给出脂肪醚和芳香醚的通式,认识醚键。
以甲醚为例,分析键角和中心氧原子的杂化状态。
两大类:直链醚(单醚和混醚、脂肪醚和芳香醚)、环醚
分别举例说明(由powerpoint课件给出结构式)
2、命名
(1)单醚
以烃基的名称命名,如(二)甲(基)醚、二乙烯基醚、(二)苯(基)醚。
由上面分类的例子,让学生来命名。
(2)混醚
两个烃基的表达按先小后大的次序,如:甲乙醚、甲(基)烯丙(基)醚。
由芳香烃基和脂肪烃基构成的混醚,习惯上先表达芳香烃基。
如苯甲醚(又叫茴香醚)。
(3)结构复杂的醚(不能直接称为“某基某基醚”时),常把烃氧基(R-O-)作为取代基,其他部分作为母体。
如:2,3-二甲基-2-甲氧基戊烷4-甲氧基甲苯2-乙氧基乙醇1-甲氧基-1-丁烯
(4)环醚通常称为“环氧某烷”,或按杂环化合物命名。
例如:1,4-环氧丁烷(四氢呋喃)1,4-二氧六烷(二恶烷)
英文名称
烃基名+ether (烃基按第一个字母先后顺序给出)举例说明。
烃氧基的名称:甲氧基methoxy 乙氧基ethoxy
二、物理性质(5分钟)
简单介绍醚的状态、沸点、水中溶解度(与分子量相近的其它类型有机化合物比较)。
三、化学性质(35分钟)
1、氧原子上未共用电子对的反应
-R
13
2
2、醚键的断裂
3、α-氢原子的反应
醚是一类比较不活泼的化合物。
但分子中的氧原子能与强酸成盐,醚键也可发生断裂。
主要反应部位如上图所示。
(一)与浓酸成盐
醚中氧原子上有未共用电子对,可与强质子酸(浓盐酸、浓硫酸等)和缺电子的路易斯酸(如BF3、AlCl3等)作用生成盐。
(投影仪给出反应式)
应用:鉴别和分离醚。
(二)醚键的断裂
醚成盐后,在强烈条件下,发生醚键断裂。
醚与氢碘酸共热,生成碘代烷和醇。
(powerpoint课件给出分步反应过程)
氢碘酸过量,醇继续反应生成碘代烷。
应用:蔡塞尔(Zeisel)甲氧基定量测定法。
测定天然的复杂有机化合物分子中甲氧基(或乙氧基)。
反应活性:不同HX反应活性HI > HBr > HCl (需高温下反应)
若两个烃基均为芳香烃基时,由于p-π共轭效应的影响,芳环与氧原子连接的键比较牢固,不易反应。
反应机理:S N2 投影仪给出反应过程并举例。
叔丁基醚主要发生消除反应,得到烯烃。
完成反应式时注意区别。
(三)过氧化物的生成和检查
在光照下或在空中久置,醚被氧化生成过氧化物。
过氧化物不稳定,受热易发生爆炸。
检查过氧化物的存在:取少量醚、碘化钾溶液和几滴淀粉溶液一起摇荡,若呈兰色,表示有过氧化物存在。
除去过氧化物:用硫酸亚铁和硫酸的稀水溶液洗涤。
补充:各类醚的制备方法,强调Williamson法合成混醚及其应用。
四、环醚(Epoxides)
1、命名
研究范围:含有三元环的醚(环氧乙烷)及其衍生物。
命名:
(1)以环氧乙烷为母体,环中氧原子编号为1号。
例:2,3-二甲基环氧乙烷
(2)称“环氧某烷”,并标明与氧原子成环的碳原子的位置。
上例又名:2,3-环氧丁烷
2、开环反应
三元环张力大,不稳定,易开环发生加成反应。
主要与含有活泼氢的化合物(水、醇、胺等)和格氏试剂反应。
以环氧乙烷为例给出反应通式。
两种开环方式:
(1)酸催化开环
以环氧乙烷和1,2-环氧丙烷为例,详细分析开环机理。
S N2机制,中间体(部分碳正离子)稳定性决定反应取向。
(2)碱催化开环
例子同上,反应条件改变。
S N2机制,空间位阻决定反应取向。
应用:有机合成中注意选择反应条件。
注意:质子化的环氧化合物能与水、醇等溶剂反应开环,合成是注意避免用这些试剂作溶剂。
练习:选择合适的条件完成反应式。
练习题见多媒体课件。
五、大环多元醚和超分子化学
学生自学、课堂提问
最后用10分钟时间总结回顾本章主要内容。
powerpoint课件以表格的形式列出本章的重点反应式。
(powerpoint课件给出《各类化合物的主要反应》)
点做习题:教材P375-377 (二)、(四)(1)-(4)、(六)、(七)(1)、(2)、(八)
参考资料:
1、高鸿宾主编,《有机化学简明教程》,天津大学出版社,2005。
2、Carey F A。
Orhanic Chemistry. 4th ed. New York: McGraw- Hill Companies, Inc, 2000。
