醚和环氧化合物(3)
第十章_醚和环氧化合物

H2SO4 170 C
2 CH 2=CH 2 + 2H2O
2CH3CH2OH
H2SO4 140 C
CH3CH2-O-CH2CH3 + H2O
反应特点: 分子间脱水的温度低于分子内脱水; 反应特点:1) 分子间脱水的温度低于分子内脱水; 2) 此法伯醇收率高(SN2机理)。 机理)。 此法伯醇收率高( 机理
环醚一般称为环氧某烃,或氧杂环某烷 环醚一般称为环氧某烃,或氧杂环某烷:
CH2 CH2 CH3 CH CH2 O O
环氧乙烷 1,2-环氧丙烷
CH2 CH CH2 O Cl
3-氯-1,2-环氧丙烷
和环氧化合物的结构 二. 醚和环氧化合物的结构
醚的结构
R-O-R(R’);Ar-O-R或Ar-O-Ar(Ar’) - - ; - - 或 - - ( )
3
CH3OH Protecting group C H
C BrCH2CH2CH2O C H
3
C H
BrCH2CH2CH2OH + CH3 C M g D O
2
2
H 2 S O
4
C H C H
3
3
E t h e r
C C H
3
C H
DCH2CH2CH2O
3
H2 S O
4
C H
3
C H
DCH2CH2CH2OH + CH3-C
冷浓H2SO4
乙醚溶解,呈一相 戊烷不溶解,分层
盐用冰水稀释,则又分解而析出醚。
2、醚中碳氧键的断裂 、
CH3CH2CH2OCH3 HI H CH3CH2CH2OCH3
I
[理学]第八章 醚和环氧化合物讲解学习
![[理学]第八章 醚和环氧化合物讲解学习](https://img.taocdn.com/s3/m/78163a936aec0975f46527d3240c844769eaa00a.png)
CH3- CH C2H Nu O
Nu CH3 CH C2H (似SN 2)
O-
空间障碍C1: < C2 , Nu更容易从背面进 1 攻C
例如:
H H 3 3 C CCO C HC H 3C H 3 O N C aH , 3 C O H -3 O HH 3 CO C C H 3O C H C H C H 33C H 3 O HH 3 CO C C H H 3O C H C H C H 33
OC H3+ H I
O H+ C H3 I
返回
8.3 醚的化学性质
(3)过氧化物的生成
醚对氧化剂较稳定,但长期与空气接触可被空气中 的氧氧化为有机过氧化物。氧化过程比较复杂,可能 是先生成α-氢过氧化物,然后再转变为更复杂的过 氧化物。
+ H3 CC HOC HC H2 O2
C H3 C H3
OO H H3 C COC HC H3
C H3 C H3
过氧化物
返回
过氧化物的检验:酸性碘化钾淀粉试纸
除去过氧化物的方法: 5%FeSO4、5%NaHSO3、5%NaI均可洗去过氧化物。
防止过氧化物的生成: ① 将乙醚贮存于棕色瓶中; ② 在乙醚中加入铁丝(还原剂)。
8.3 醚的化学性质
(4) 环氧乙烷的化学性质
环氧乙烷又叫氧化乙烯,是重要的环醚。它是无
例如chchchch4甲氧基2己烯chchchchohoc醚的命名返回环氧乙烷环氧某烷或从杂环化合物名称衍生12环氧丙烷3氯12环氧丙烷环氧氯丙烷14环氧丁烷四氢呋喃thf多元醚多元醇的烃衍生物命名时首先写出多元醇的名称再写出烃基的数目和名称最后写上醚字
[理学]第八章 醚和环氧化 合物
8.1 醚(Ethers)
醚和环氧化合物化学反应方程式反应路径
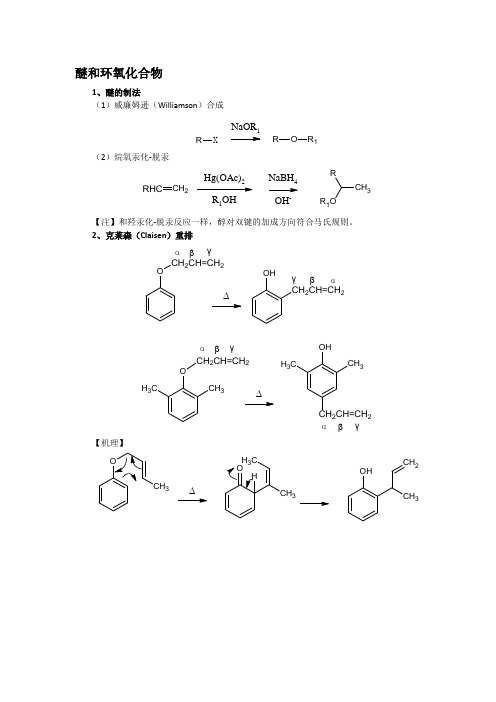
醚和环氧化合物1、醚的制法(1)威廉姆逊(Williamson )合成RXNaOR 1OR 1R(2)烷氧汞化-脱汞RHCCH 2Hg(OAc)2R 1OHNaBH 4OH -CH 3RR 1O【注】和羟汞化-脱汞反应一样,醇对双键的加成方向符合马氏规则。
2、克莱森(Claisen )重排OCH 2CH=CH 2OHCH 2CH=CH 2OCH 2CH=CH 2CH 3CH 3αβγ∆∆OHCH 3CH 3CH 2CH=CH 2αβγαβγαβγ【机理】33∆OHCH 3CH 2CH 3CH 3OCH 2CH=CHC H3α∆OCH 3CHCH =C HC3CH 3OCH 3C3HCHCHCH 2CH2H33αCH 3CH 3OHCH 2CH=CHC H3ααα【注】类似的构型也可发生重排 【例】∆CH 2OOC H 2CH 3CH 3CH 3∆OC3CH 3CH 3OCH 3CH 2∆CH 3O3、冠醚ClOOClOOHOOH+KOH∆OOOOOOOClClOClClOH OHOHOHKOH∆OOOOOO18-冠-6二苯并18-冠-6【特点】冠醚性质最突出就是他有很多醚键,分子中有一定的空穴,金属例子可以钻到空穴中与醚键络合。
OOOOOOK+冠醚分子内圈氧可以与水形成氢键,故有亲水性。
它的外围都是CH2结构,又具有亲油性,因此冠醚能将水相中的试剂包在内圈带到有机相中,从而加速反应,故称冠醚为相转移催化剂。
这种加速非均相有机反应称为相转移催化。
4、环氧化合物(1)开环①酸性开环O CC H+-CCNuOHOCC+【注】不对称环氧化合物的酸性开环方向是亲核试剂优先与取代较多的碳原子结合。
【例】O CH3H +H 3HH 3δ+OH CH 3δ+δ+HOR RO CH 3OH-H +②碱性开环OC2H 5CC OC 2H 5O-HOC 2H 5CC OC 2H 5OH【注】碱性开环,亲核试剂总是先进攻空间位阻较小的,空间效应。
醚和环氧化合物

2-甲氧基- 2-丙醇 - -
上述开环反应可总结为: 上述开环反应可总结为:
R
酸开环
O
碱开环
形成的过氧化物容易爆炸, 形成的过氧化物容易爆炸,所 以储存时间长的醚在使用前必须加 入锌粉还原
3、醚键的断裂 、
醚与氢碘酸共热,则发生 键断裂, 醚与氢碘酸共热,则发生R-O键断裂,生成 键断裂 一分子碘代烷和一分子醇。例如: 一分子碘代烷和一分子醇。例如:
当使用过量的氢碘酸时, 当使用过量的氢碘酸时,则醇也与氢碘酸作 生成碘代烷, 用,生成碘代烷,即
4、环氧化合物的开环反应 、 酸催化开环: 酸催化开环:
亲核试剂进攻取代基比较多的环 碳原子.例如: 碳原子.例如:
O H3C HC CH2 Cl HCl CH3CHCH2OH
碱催化开环: 碱催化开环:
亲核试剂进攻取代基较少的环氧碳原子
O H3C HC OH NaOCH3 CH2 CH3OH CH3CH CH2 OCH3
氢溴酸和盐酸虽然也能进行醚键的断裂反 但其活性差。所以, 应,但其活性差。所以,常采用氢碘酸来使 醚键断裂。 醚键断的断裂,往往是从含碳原子较少的烷 基断裂下来与碘结合。 基断裂下来与碘结合。
当混醚中的一个烃基是芳基时, 当混醚中的一个烃基是芳基时,由于 p、π-共轭效应的影响,芳环与氧原子相 共轭效应的影响, 、 共轭效应的影响 连的键比较牢固,与氢碘酸反应时, 连的键比较牢固,与氢碘酸反应时,发 生烷氧键( 生烷氧键(R-O)断裂,生成碘代烷和 )断裂, 酚。例如:
醚与强酸形成的烊盐溶于冷的浓酸中, 醚与强酸形成的烊盐溶于冷的浓酸中,它 烊盐溶于冷的浓酸中 不稳定,遇水分解成原来的醚, 不稳定,遇水分解成原来的醚,因此利用此 性质可以鉴别和分离 鉴别和分离醚 性质可以鉴别和分离醚。
醚和环氧化合物

SN1历程的特点:(1) 反应分两步进行 (2) 有正碳离子生成 (3) 为一级反应 (4) 构型外消旋化
13
醚键断裂反应属于亲核取代反应。通常,伯烃基 醚易按SN2机制进行。
H O C H-I
H δ++ H δOC
Nu
CC
H+
CC
Nu
CC
O
OH+
OH
32
主要受电子效应控制。
O CH2CH3 + HCl
HOCH2CHCH2CH3 Cl
HO H
H O H
CH3CH2
CH3CH2 C l
H CH3CH2
OH Cl
33
2. 碱催化开环反应机制
SN2机制
在强碱或强亲核试剂条件下,亲核试剂直接进
攻环氧化合物中取代基较少的环氧碳原子。
O O H
乙醚
过氧化乙醚
过氧化醚受热易分解爆炸,蒸馏醚时应避免蒸干 过氧化醚的检验:酸性碘化钾-淀粉试纸 过氧化醚的除去:还原剂硫酸亚铁或亚硫酸钠
18
四、冠醚 (crown ether)
冠醚 是分子中含有多个 —OCH2CH2— 结构单 元的大环多醚, 因其立体结构像王冠, 故称冠醚。
OO
O
O
O
OO
2-甲基环氧乙烷
2-氯-1-丙醇 1-氯-2-丙醇
27
(二) 碱催化开环反应
在强碱条件下,三元环被打开,生成相应 的加成产物。
OH , H2O H2C CH2 OHOH
乙二醇
NH3
H2C CH2 2-氨基乙醇
醚和环氧化合物

(三)、过氧化物的生成
CH3CH2OCH2CH3 O2 CH3CH O O O H CH2CH3
乙醚
过氧乙醚
除去过氧化物的方法是往醚中加入少量的硫酸 亚铁、亚硫酸钠或碘化钾等还原剂。
五 制备 (一)在浓硫酸作用下,由醇分子间脱水可制备对称 醚:
ROH
浓 H2SO4
ROR
+
H2O
C2H5OH
浓H2SO4 140 C
第四节 硫醚
醚分子中的氧原子被硫置换后的化合物称为硫醚, 通式:R-S-R’ 一 命名 硫醚的命名与醚类似,只需在醚字前加一个 “硫”即可
二.性质 1.硫盐的生成 硫醚与卤代烃可发生亲核取代反应生成锍 盐.
.. RSR + .. .. R`X R .. S R` CH3 例如: :S: CH3 CH3 + CH3I S+ .. CH3 CH3 IR X-
CH3CH2OCH2CH3 乙醚 diethyl ether
+
HI
CH3CH2I
+ HOCH2CH3
HI CH3CH2I
碘乙烷 iodoethane
醚键断裂机制:
CH3CH2-O-CH2CH3 CH3 I H CH2 O + CH2CH3 SN2过渡态 H
+
H+ CH3CH2-O-CH2CH3
I
-
O sp 3 杂化
o CH3
110
图9-1 甲醚的结构
环醚的结构:
O
O
O 1,4-二氧六环 (1,4-dioxane)
四氢呋喃 (tetrahydrofuran)
(二)醚的命名 简单醚:先写出烃基的名称,再加上“醚” 可。 混醚:在两个烃基的名称后加上“醚”既可。 芳香醚:两个烃基至少有一个芳基的醚。
第八章 醚和环氧化合物

+
C C O
H CH3CH2 O
C C O+ H
H δ CH3CH2 O H
Nu
Nu C C OH
OH H CH3CH2 Cl
H
2. 碱催化开环反应机制
碱催化的开环反应, 碱催化的开环反应 是亲核试剂直接进攻环氧 化合物本身, 而不是先生成质子化环氧化合物, 化合物本身 而不是先生成质子化环氧化合物 因 此开环需要在强碱条件下或强亲核试剂。 此开环需要在强碱条件下或强亲核试剂。
2
OH NH
2
R-C-CH-R 1 R3
O CH3CH CH2 + CH3NH-H O CH3CH CH2 + H-CN O CH3 CH3 + CH3OH
CH3ONa
? ?
?
二、环氧化合物开环反应机制
1. 酸催化开环反应机制
环氧化合物的开环反应属于亲核取代反应。酸性条件下 环氧化合物的开环反应属于亲核取代反应。酸性条件下, 首 先生成质子化环氧化合物(protonated epoxide), 然后亲核试剂进 先生成质子化环氧化合物 攻质子化环氧化合物, 质子化环氧化合物迅速开环生成产物。 攻质子化环氧化合物 质子化环氧化合物迅速开环生成产物。
CH3I + C2H5OH HI 过过 C2H5I + H2O
反应机制: 反应机制:
H+
CH3CH2 O C2H5
CH3CH2 O C2H5
质 质 质质
H+
I
-
I
H+
[ CH3CH2 O C2H5 ] SN2 过 过 过 CH3CH2I + CH3CH2OH
伯烷基混醚: 伯烷基混醚:
有机化学PPT08ether第八章 醚和环氧化合物课件

4
南京医科大学康达学院 博学至精 明德醚较稳定,其稳定性仅次于烷烃。醚不能与
强碱、稀酸、氧化剂、还原剂或活泼金属反应。 在一定条件下可发生反应,反应与醚氧原子上的 孤电子对有关。
(锌一锌)样醚样锌锌酮的样酮样银质锌酮铜银子酮样银化铜酮银铜洋:银洋铜锌洋铜 盐样的形酮成 银 铜
C H 3O C H 3+H I
C H 3I + C H 3O H H I C H 3 I + H 2 O
较小的烃基生成卤代烃,较大的烃基生成醇(芳基则生成酚);
O C H 3 + H I O H + C H 3 I
南京医科大学康达学院化学教研室 有机化学
7
南京医科大学康达学院 博学至精 明德至善
1
O
H 3C H C C H C H 3
32
2,3-二甲基 环氧乙烷
1
O
2-乙基环
H2C CHCH2CH3 氧乙烷
32
南京医科大学康达学院化学教研室 有机化学
11
南京医科大学康达学院 博学至精 明德至善
二、环氧化合物的开环反应
(一) 酸催化开环反应
在稀酸条件下,环氧化合物的环 被打开,生成相应的加成产物。
甲乙醚 苯甲醚 南京医科大学康达学院化学教研室 有机化学
2
南京医科大学康达学院 博学至精 明德至善
b、复杂:用系统命名法,将醚键所连接的2个烃基 中碳链较长的烃基作母体,称“某烃氧基某烃”。
C H 3C H 2C H 2C H C H 3 OCH3
HOCH2CH2 OC2H5
2-甲氧基戊烷
2-乙氧基乙醇
醚键断裂反应属于亲核取代反应, 通常伯烷基醚 易按SN2机制进行, 叔烷基醚易按SN1机制进行。
有机化学-第十章 醚与环氧化合物-文档资料

17
10.5.2 酸催化醚键断裂
例如: (1) 对称醚键的断裂: 两侧醚键断裂均等
18
(2) 甲基伯烷基醚:醚键断裂在甲基一侧
(3) 叔烷基醚:醚键断裂在叔丁基一侧
(4) 芳基醚:醚键断裂在烷基一侧
19
醚键开裂机理
甲基伯烷基醚:SN2机理(主要考虑位阻影响为主)
叔烷基醚:SN1机理(主要考虑碳正离子稳定性)
11
(3) 立体专一性反应——邻基参与作用
12
10.3.3 不饱和烃与醇的反应
该反应是可逆反应,可利用异丁烯与醇反应生成的叔 丁基醚保护醇羟基。
13
10.4 醚的物理性质和波谱性质
IR:
C–O
Байду номын сангаас
1200 ~ 1050cm-1
14
10.4 醚的物理性质和波谱性质
δ 3.4 ~ 4.0
1H
NMR:
20
两类较易水解的醚类化合物
• 叔丁基醚
用于醇的保护和脱保护
• 烯基醚
21
烯基醚的水解机理
22
10.5.3 环氧化合物的开环反应
稀酸介质 HX溶液
23
反应机理
不对称环氧化物的酸性下开环
反应取向:在取代基多的一端开环,具有SN1性质。
立体化学: 反式开环。
酸的醇溶液
碱性条件下的环氧化物开环
2
。
10.1 醚和环氧化合物的分类
单醚:
乙醚 甲基叔丁醚
醚
混醚: 环醚:
四氢呋喃(THF)
1,4-二氧六环
环氧化合物:
环氧乙烷
3
10.1 醚和环氧化合物的命名 1. 单醚: “二”+“烃基 + 醚”
醚和环氧化合物

2、醚的过氧化作用
CH3CH2 O CH2CH3 O2 CH3CH2 O CHCH3 使淀粉试剂 显蓝色 KI I2 H O O H 过氧化物
形成的过氧化物容易爆炸,所 以储存时间长的醚在使用前必须加 入锌粉还原
3、醚键的断裂
醚与氢碘酸共热,则发生R-O键断裂,生成 一分子碘代烷和一分子醇。例如:
醚和环氧化合物
醚是醇或酚羟基中氢原 子被烃基取代后所得的化合 物。醚常用R-O-R`表示。
1、分类
醚分子中的两个烃基可以相同也可以不同。 两个烃基相同时,称为单醚;两个烃基不同时, 称为混醚。组成环的原子除碳原子外还有氧原 子的环状化合物,称之为环醚或者是环氧化合 物。例如:
醚与强酸形成的烊盐溶于冷的浓酸中,它 不稳定,遇水分解成原来的醚,因此利用此 性质可以鉴别和分离醚。
当使用过量的氢碘酸时,则醇也与氢碘酸作 用,生成碘代烷,即
氢溴酸和盐酸虽然也能进行醚键的断裂反 应,但其活性差。所以,常采用氢碘酸来使 醚键断裂。
醚键的断裂,往往是从含碳原子较少的烷 基断裂下来与碘结合。
当混醚中的一个烃基是芳基时,由于 p、π-共轭效应的影响,芳环与氧原子相 连的键比较牢固,与氢碘酸反应时,发 生烷氧键(R-O)断裂,生成碘代烷和 酚。例如:
4、环氧化合物的开环反应 酸催化开环:
亲核试剂进攻取代基比较多的环 碳原子.例如:
O H3C HC CH2 Cl HCl CH3CHCH2OH
碱催化开环:
亲核试剂进攻取代基较少的环氧碳原子
O H3C HC OH NaOCH3 CH2 CH3OH CH3CH CH2 OCH3
2-甲氧基- 2-丙醇
上述开环反应可总结为:
Rபைடு நூலகம்
酸开环
O
碱开环
大学有机化学醚和环氧化合物PPT课件

• 有机化学醚的介绍 • 环氧化合物的介绍 • 醚和环氧化合物的比较 • 有机化学醚和环氧化合物的实际应用 • 有机化学醚和环氧化合物的未来发展
01
有机化学醚的介绍
醚的定义和结构
醚的定义
醚是一类由醇或酚与卤素或硫酸反 应生成的化合物,其结构通式为RO-R',其中R和R'为烃基。
醚和环氧化合物的应用比较
醚的应用
醚在工业上主要用于溶剂、麻醉剂、农药等。
环氧化合物的应用
环氧化合物主要用于合成树脂、聚合物、涂料等高分子材料。
应用比较
醚和环氧化合物的应用领域不同,醚主要用于化学试剂、农药等; 而环氧化合物主要用于高分子材料合成。
04
有机化学醚和环氧化合物的实际应用
醚在医药领域的应用
THANKS
感谢观看
一些醚类化合物具有杀虫、杀 菌或除草活性,可以直接用作 农药,如杀螨醚、苯氧威等。
醚类化合物还可以作为农药的 增效剂,与其他农药混合使用, 以提高防治效果并减少农药的 使用量。
环氧化合物在材料科学领域的应用
环氧化合物可以通过聚合反应制备高 分子材料,如环氧树脂、环氧橡胶等, 这些材料具有优异的力学性能、电绝 缘性能和耐腐蚀性能。
醚和环氧化合物的性质比较
醚的性质
醚是较为稳定的化合物,对酸、 碱都有较好的稳定性。醚的沸点 较低,容易挥发。
环氧化合物的性质
环氧化合物对酸、碱都敏感,容 易发生开环反应。环氧化合物的 沸点较高,不易挥发。
性质比较
醚和环氧化合物的性质差异较大, 醚较为稳定,沸点低;而环氧化 合物对酸、碱敏感,沸点较高。
详细描述
环氧化合物具有多种化学性质,包括亲核性、亲电性、开环反应等。在一定条件下,环氧化合物可以 与多种试剂发生反应,如醇、酚、胺等。其中,开环反应是环氧化合物最重要的反应类型之一,可以 通过与氢离子、金属离子等反应打开环氧环。
有机化学(高鸿宾第四版)第十章醚和环氧化合物

根据生成碘化银的量,计算出甲氧基含量。此反 应用于天然的复杂有机化合物分子中甲氧基的测定。
当混醚中的一个烃基是芳基时,由于p、π-共轭效应的影响, 芳环与氧原子相连的键比较牢固,与氢碘酸反应时,发生烷氧 键(R-O)断裂,生成碘代烷和酚。
O C H 25H + I S N 2
O H C + H C 3 H 2 I
C H 3 O C H 3
甲醚
O
二苯醚
H 2 C H C O C H C H 2
二乙烯基醚
(2) 混醚:“烃基”+“烃基”+ “醚”,较
优基团
置后,但芳基置前:
C H 3O C 2H 5
O C H 3
甲乙醚
苯甲醚
methyl ethyl ether (茴香醚)
(3)对于结构复杂的醚: 较大的烃基作为母体,烃氧基作为取代基 。
① 乙 醚
M g B r+H 2 C O C HC H 3② H 3 O +
C H 2 C HC H 3 O H
(60%)
例:
C H 2 = C H 2 C H 3 C H 2 C H 2 C H 2 O H
CH3CH2-MgCl +
O
-Mg(OH)Cl H2O
C H 3 C H 2 C H 2 C H 2 O M g C l
但可以和水分子形成氢键, 小分子醚有一定水溶性。
易燃易爆 使用小分子醚时,应避免明火。
乙醚,它遇到火星就有发生燃烧爆炸的危险。其蒸气能 从远处将明火引来起火。
醚长期放置受热或碰撞可发生爆炸。
三、醚的化学性质
{稳定,不和除酸之外的试剂反应。
在空气中会慢慢氧化成过氧化物。
有机化学课件--醚和环氧化合物

3
第一节 醚的定义、分类、 结构特征和命名
一 醚的定义 H
R
醚?
O
O
H
R
二 醚的分类 (I)
醚的分类(II)
(取代基是否相同)
(取代基类型)
简单醚:ROR
混合醚:ROR’ 环醚
二烷基醚 二芳基醚 烷芳混合醚
乙烯醚 烯丙醚
2020/2/3
课件
4
三 醚的结构特征
1. 烷基醚分子中氧原子是sp3杂化, 整个分子成交叉构象。
(1)烯烃与过氧化物反应
O
C6H5C O OH
C6H5CH=CH2
CHCl3
O
C6H5CH
CH2
H
H
CH3CO3H, C6H6
H
O
CC
25℃
C6H5
C6H5
C6H5
H C6H5
2020/2/3
课件
33
注意:如果烯烃有顺反异构,用过氧酸氧化后,取 代基的相对位置不变,再如:
H C
C6H5
C6H5 C
CH3
141.0pm
O 111.7o
H H
H H
HH
H H
O
H H
H
O 105o
H
2. 芳基醚分子中氧原子采用sp2,氧原子中的一对 孤电子与苯环中的π电子存在p-π共轭。
136pm
CH3
H
O 108.9o
CH3
O
CH3
121o
2020/2/3
课件
5
四 醚的命名
R
1. 普通命名法:
O
写出两个烃基的名称,再加上“醚”字,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
整理课件
9
(1)铁羊盐的形成
醚链中氧原子上的孤电子对可作为一种路易斯 碱,接受强酸中的质子形成铁羊 盐而溶于强酸。
C 2 H 5 O 2 H 5 C 浓 H H 2 2 O S4O [C 2 H 5O H C 2 H 5] + H4 -SO
由于氧对孤电子对的吸引较强,因此醚的氧只 能与强酸的质子形成 铁羊盐,用水稀释,铁羊盐
O C 2H 5
HI △
OH + C 2H 5I
二苯基醚的醚键很稳定,通常不易与HX发 生醚键的断裂反应。
整理课件
13
(三) 醚的过氧化物的形成
醚对氧化剂是稳定的,但在空气中久置,会
慢慢发生自动氧化,α碳上的氢可被氧化生
成过氧化物。
CH3CH2OCH2CH3
O2 CH3CH-OCH2CH3 O OH
整理课件
19
第二节 环氧化物
一个氧原子与相邻的两个碳原子相连构成 的三元环醚,不稳定,性质特殊,在有机 化学中特称为环氧化物(epoxides)。
整理课件
20
一 环氧化合物的结构和命名
C
C
O
整理课件
21
普通命名法:根据相应的烯烃称为氧化 某烯。
O
O
O
C2HC2H C2HCH 3 CC H 2HC(3 )2 CH
(ethyl methyl ether)
O
(二)苯(基)醚 (phenyl ether)
O CH2CH3
苯乙醚 (ethyl phenyl ether)
整理课件
6
烃基结构比较复杂的醚,以烃为母体,烃氧基 为取代基来命名。
CH3CH2 CH CH3
CH3 CCH3 OCH3
2,3-二甲基-2-甲氧基戊烷
除去过氧化物的方法是用适量FeSO4或Na2SO3
水溶液洗涤,以破坏其中的过氧化物。
整理课件
14
三.冠醚
冠醚(crown ethers)是一类分子中具有重复单位 ( OCH2CH2 )n 的大环多醚,相当于乙二醇的大
环聚合物。由于它的形状像王冠,故称为冠醚。
整理课件
15
冠醚的命名习惯采用简单命名法。成环总 原子数(X)+ 冠+ 环中氧原子数(Y),称 为X-冠(醚)-Y。
O
O
O
O
O
18-冠(醚)-6(18-crown-6)
整理课件
16
冠醚分子的环内有一定的空穴,金属离子可 以钻到空穴中与醚键络合,这是冠醚氧原子 和金属离子之间形成偶极-离子吸引的结果。 这是冠醚最突出的性质。不同结构的冠醚, 分子中空穴大小不同,可以容纳的金属离子 不同,所以冠醚的络合作用具有较高的选择 性。利用上述性质,可以分离金属离子。
23
二. 环氧乙烷的开环反应 环氧乙烷是环氧化物中结构最简单、性质特 殊的环醚。由于分子中存在着具有张力结构 的三元环,易发生加成开环反应,极易与多 种含活泼氢的化合物以及某些亲核试剂反应, 生成多种不同类型的化合物,
整理课件
24
(一)酸催化开环反应
不对称环氧化合物开环反应若在酸性介质中
第八章 醚和环氧化合物
醚(ether)是两个烃基通过氧原子连结而成的 化合物,通式:R―O―R’。
整理课件
1
第一节 醚
醚(ether)可以看作是水分子的两个氢原子被 烃基取代所得的化合物,也相当于醇或酚分子 中羟基的氢原子被烃基取代的结果。醚分子中 C—O—C称醚键。
整理课件
2
一.醚的结构、分类和命名
又分解成原来的醚。
整理课件
10
(二) 醚键的断裂
在加热条件下,醚和 氢碘酸作用时,醚键发生断 裂,生成醇和碘代烷。浓的氢溴酸和盐酸与醚也 可发生上述反应,但需较高温度。
CH 3 O 3C +H HI
CH 3I + C3O HH HI
CH 3I + 2O H
整理课件
11
醚键的断裂反应属于亲核取代反应。通 常伯烷基醚易按SN2机制进行,叔烷基醚易 按SN1机制进行。
整理课件
4
醚的命名:只需在与氧原子相连的两个烃基的名 称后加上“醚”字即可。命名单醚时,常将二 字省掉;命名混醚时,两个烃基的名称按先小 后大的次序写;命名芳香醚时,一般将芳基放 在烷基的前面。
整理课件
5
CH3CH2OCH2CH3 (二)乙(基)醚 (ethyl ether)
CH3OCH2CH3 甲乙醚
整理课件
17
O
O
O
K+
O
O
O
整理课件
18
冠醚更重要的用途在有机合成领域。冠醚 分子内氧原子可以与水形成氢键,有亲水 性;它的外圈都是―CH2―结构,则具有 亲脂性。因此冠醚可将仅溶于水的盐类包 在内圈而转溶于有机相中,从而加速该试 剂和有机化合物之间的反应。这种加速非 均相有机反应的作用称为相转移催化,冠 醚为相转移试剂(phase-transfer)。
CH3O
CH3 4-甲氧基甲苯
整理课件
7
环醚命名时可看作是环氧化合物,根据 母体烃称为“环氧某烷”,也可用俗名。 某些环醚还可当作杂环化合物的衍生物
来命名。
CH2 CH2
CH3 CH CH2
O
O
O
O
环氧乙烷 1,2-环氧丙烷 1,4-二氧六环
整理课件
8
二、醚的化学性质
醚分子的极性较低,化学性质并不活泼,一 般情况下,醚既不与氧化剂、还原剂作用, 也不与稀酸、强碱反应,其稳定性仅次于烷 烃。但由于醚分子中氧上有孤电子对,使它 也能发生一些反应。
连有两个不同伯烷基的混醚与HX反应时, 易按SN2机制进行,一般是较小烷基生成卤 代烃,较大烃基生成醇。
芳基烷基醚发生醚键断裂时,键的断裂 发生在烷基与氧之间,产物为卤代烷和酚。
整理课件
12
混合醚断裂规律:
小基团生成卤代烃 大基团生成醇或酚
CH3 O
C 2H 5
57%HI △
C 2H 5O H + C H 3I
可以认为醚分子中的氧原子为sp3杂化, 两对孤电子对处在sp3杂化轨道中。
O CH3 H3C
整理课件
3
醚的通式为R—O—R’
当醚分子中与氧相连的两个烃基相同 (R= R’)时称单醚。
醚分子中的两个烃基不一样(R ≠R‘) 则称混醚。
两烃基中有一个或两个是芳香烃基的 称为芳香醚。
若氧原子与烃基连成环则称为环醚。
氧化乙烯
氧化丙烯
氧化异丁烯
整理课件
22
系统命名法:将母体命名为环氧乙烷, 三元环中氧原子编号为1。
1 O
1 O
1 O
C3 H 3CC 2HH 3CH C 32HC 2 H 2C C 3H H C 32HC 2 (3)C 2 H
2,3-二甲基 环氧乙烷
2-乙基环氧乙烷
2,2-二甲基 环氧乙烷
整理课件
