有机化学:第10章 醚和环氧化合物
第十章 醚和环氧化合物

H CH3 HO
OCH 3 H H
不对称的取代环氧乙烷,在碱性条件下,是按SN2机制进 行的。亲核试剂主要进攻含取代基较少(空间位阻小)的碳 原子。立体化学:反式开环。
H2O, H + CH3OH, H + OH
HO CH2 CH2 OH CH3O CH2 CH2 OH O CH2 CH2 OH
OH
200 C
o
14
OH
CH2CH=CH2
200oC
14
CH2CH=CH2
克莱森重排机理(P373)
• Claisen 重排是个协同反应,中间经过一个环状 过渡态,所以芳环上取代基的电子效应对重排无 影响。
• 邻位已被取代基占据,无法发生互变异构,接着 又发生一次[3,3]σ迁移到对位,然后经互变异构 得到对位烯丙基酚。
• (CH3)2COCH3 + O2
优先形成稳 定的自由基。
(CH3)2COCH3 OO •
(CH3)2COCH3 + (CH3)2CHOCH3 OO • • (CH3)2COCH3 + (CH3)2COCH3 OOH
关键中间体
第七节 冠醚 含有多个氧的大环醚
15 16 17 14 18 O 13 O1 2 O 12 11 O 10 9 O 8 7 6 O4 3 5
应用实例:
• Claisen 重排具有普遍性,在醚类化合物中,如 果存在烯丙氧基与碳碳双键相连的结构,就有可 能发生Claisen 重排。
四 自动氧化(过氧化物的生成)
1 定义:
化学物质和空气中的氧在常温下温和地进行氧化, 而不发生燃烧和爆炸,这种反应称为自动氧化。
第十章醚和环氧化合物

H 2O CH2 CH2 + C2H5OH O HBr
H+
CH2 OH
CH2 +OH 2
+
-H +
HOCH2CH2OH
乙二醇
CH2 CH2 -H+ OH HOC2H5 HOCH2CH2Br
2- 溴乙醇
HOCH2CH2OC2H5
乙二醇单乙醚
例2:
CH2 CH2 + H2O O
OH -
HOCH2CH2OH
乙二醇
OH -
O
HOCH2CH2OCH2CH2OH
二乙二醇 O O O O O O
n
O
OH -
HOCH2CH2O(CH2CH2O)n CH2CH2OH
聚乙二醇
O
例3:
CH2 CH2 + NH3 O O
OH OH -
HOCH2CH2NH2
乙醇胺
O
OH -
HOCH2CH2NHCH2CH2OH
分离与提纯醚
10.4.2 酸催化碳–氧键断裂
醚在HI或HBr的作用下,C–O键断裂, 生成醇与卤代烷等:
H CH3CH2CH2OCH3 + HI CH3CH2CH2O CH3
首先生成 盐
CH3CH2CH2O
–
CH3 I H
CH3I + CH3CH2CH2OH
I 与 盐发生SN2反应
•醚键的断裂——醚和浓酸(常用HI)共热
反应具有SN1 的性质
O H (CH3)2C
CH2OH
反式开环
OCH3
10.4.3 碱催化碳–氧键断裂
醚和环氧化合物

第7章 醚和环氧化合物本章重点介绍醚和环氧化合物的结构和化学性质;醚键断裂的机制;环氧乙烷开环反应的机制;取代环氧化合物在酸和碱催化下的开环取向;以及醚在医药学上的应用。
醚(ether)是含氧的有机物,可以看成是醇或酚分子中羟基的氢原子被烃基取代而成的化合物,醚的化学性质不活泼,是常用的有机溶剂。
环氧化合物(epoxide )是指含有三元环的醚及其衍生物。
它属于环醚,但性质与一般的醚不同,高度活泼,是合成反应重要的中间体。
学完本章后,你应该能够回答以下问题: 1. 醚的结构如何?它怎样分类和命名? 2. 醚键断裂有何规律?反应机制是什么? 3. 环氧化合物特指哪一类环醚?它如何命名? 4. 环氧乙烷开环反应的机制是什么?5. 取代环氧化合物在酸性和碱性条件下的开环取向是否一样?为什么? 6. 冠醚是什么样的化合物?有哪些重要用途?7.1 醚的结构、分类和命名温习提示:醇的结构,醇分子间脱水反应。
醚的结构通式为R-O-R 、Ar-O-R 或Ar-O-Ar ,分子中的C-O-C 键称为醚键,是醚的官能团。
甲醚分子中C-O-C 键角为111.7°,氧原子为sp 3不等性杂化,两对孤对电子位于sp 3杂化轨道。
H 3C3图7-1 甲醚的结构按醚键所连接的烃基不同,醚可以是饱和醚、不饱和醚和芳香醚等: 饱和醚: CH 3OCH 3 CH 3CH 2OCH 2CH 3 CH 3OCH 2CH 3 不饱和醚: CH 3CH 2OCH=CH 2 芳醚:两个烃基相同的为单醚,两个烃基不同的为混醚。
如果氧原子与烃基连成环则为环醚。
分子中含有多个氧原子的大环醚,因为结构象皇冠而被称为冠醚。
单醚命名时,如果是两个饱和烃基,在烃基名称后面加上醚字,通常“二”字可省略;CH 33如果是不饱和烃基或芳烃基,“二”字不可省略。
英文名称醚为ether ,例如:CH 3CH 2-O-CH 2CH 3 CH 2=CH-O-CH=CH 2(二)乙醚 二乙烯基醚 二苯醚diethyl ether diethenyl ether diphenyl ether混醚命名时,分别写出两个烃基的名称,加上醚字,如果是两个脂肪烃基,较优基因放在后面;如果有芳烃基,则芳烃基放在前面,英文命名醚中烃基按第一个字母顺序排列。
第10章 醚和环氧习题参考答案
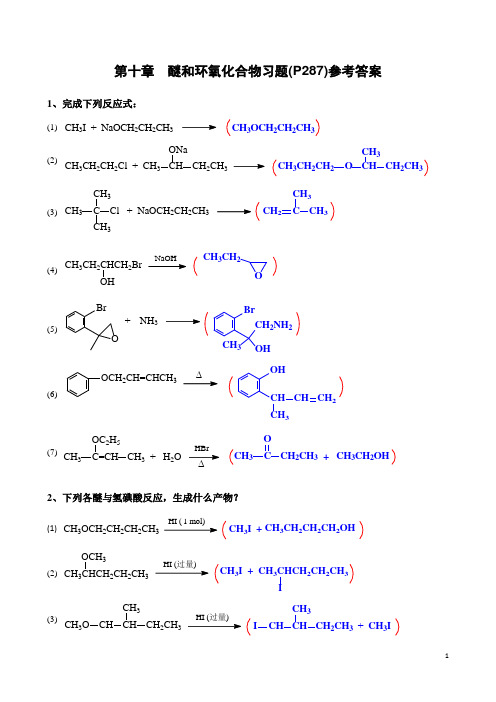
第十章 醚和环氧化合物习题(P287)参考答案1、完成下列反应式:(1) CH 3I + NaOCH 2CH 2CH 3CH 3OCH 2CH 2CH 3(2)CH 3CH 2CH 2Cl + CH 3CH CH 2CH 3ONaCH 3CH 2CH 2O CH CH 2CH 3CH 3(3) CH 3C CH 3CH 3Cl + NaOCH 2CH 2CH3CH 2C CH 3CH 3(4)CH 3CH 2CHCH 2BrOH OCH 3CH 2(5)BrONH 3+BrCH 3OHCH 2NH 2 (6)OCH 2CH=CHCH 3OHCH CH 3CH CH 2(7)CH 3C=CH CH 3 + H 2OOC 2H 5CH 3C OCH 2CH 3+CH 3CH 2OH ∆2、下列各醚与氢碘酸反应,生成什么产物?(1) CH 3I+CH3CH 2CH 2CH 2OHHI ( 1 mol)CH 3OCH 2CH 2CH 2CH 3(2) CH 3CHCH 2CH 2CH 3OCH 3CH 3I + CH 3CHCH 2CH 2CH 3I(3)CH 3O CH CH CH 2CH 3CH3CH CH CH 2CH 3CH 3I+CH 3I3、1,2-环氧丙烷分别与下列试剂反应,各生成什么产物?序号试剂反应产物(1) CH3OH,H+CH3CH CH2OHOCH3(2) CH3OH,CH3ONaCH3CH CH2OCH3OH(3) HBr HOCH2CHCH3Br(4) ①C2H5MgBr;②H+,H2O CH3CHCH2CH2CH3 OH(5) ①CH CNa;②H+,H2O CH3CHCH2COHCH4、乙二醇及其甲醚的沸点随相对分子质量的增加而降低,请解释之。
化合物(1) HOCH2CH2OH(2) HOCH2CH2OCH3(3) CH3OCH2CH2OCH3沸点/℃197 125 84解释两个羟基形成分子间氢键一个羟基形成分子间氢键无羟基,不能形成分子间氢键分子间氢键作用减弱,分子间力减弱,沸点降低5、在3,5-二氧杂环己醇OOOH的稳定椅式构象中,羟基处在a键的位置。
有机化学醚

3oROH不能制得醚,而只能得到烯烃。
二、 Williamson 合成法(混醚)
RONa ArONa
+ +
R'X RX
SN2
ROR' Ar-O-R
+ +
NaX NaX
12
SN2
例:
CH3CH2CH2CH2O—Na + I—CH2CH3 CH3CH2CH2CH2OC2H5 71%
(CH3)2CHO—Na + Cl—CH2-C6H5
(CH3)2CH—O—CH2-C6H5 84%
(CH3)2SO4 ONa +
或
O—CH3
CH3—I
13
由于该反应是SN2反应,为尽量减少E2消除,卤代 烷部分尽可能避免采用仲卤代烷和叔卤代烷。例:
CH3 CH3—C—ONa + BrCH2CH3 SN2 CH3 CH3 CH3—C—O—C2H5 CH3
R R O + BF3
气态 bp:-1010C
R O + RMgX R X
R R O BF3
溶液
R R O Mg O R
R 2 R
如:格氏试剂在金属镁的表面生成,与醚形成络合物 后脱离金属镁的表面进入溶液,使得格氏试剂的制备 得以进行。
16
二、醚键断裂的反应
醚与浓的HCl、HBr、HI作用,醚键可发生断裂。 HX的反应活性:HI > HBr > HCl 醚键断裂的顺序:30烷基>20烷基>10烷基>芳烃基 1、 若两个是10烷基则发生SN2,小烃基生成碘代烷, 大烃基生成醇。若氢碘酸过量则均生成碘代烷。
OCH2CH3
间乙氧基苯酚
4
《有机化学》(王积涛第二版_下册)学习笔记

+ CO 2
可见其酸性是大于水而小于碳酸的。 苯环上有吸电子基团时增强苯酚的酸性;间氯苯酚酸性大于对氯苯 酚,邻氯苯酚酸性较强,但是如果邻位有较大基团时影响溶剂化的作 用而使酸性减弱。
42
有机化学笔记
2Hale Waihona Puke 3、与 FeCl3 的显色反应 (具有烯醇式结构的都能发生显色反应) 。 醚的生成
由于酚氧键不易断裂,不能像醇那样发生分子间的脱水而成醚,但是 酚氧负离子可以作为亲核试剂与卤代烷反应,类似于醇解反应生成 醚。又由于苯酚是弱酸,即酚氧负离子为强碱,易于与卤代烷发生消 除反应,所以卤代烷只能是伯卤。
2-甲氧基戊烷
混合醚的命名将较小的烃或苯基写在前面。 多元醚首先写出多元醇的名称,在写出另一个部分烃基的名称。 CH3OCH2CH2OCH3 乙二醇二甲醚 CH3CH2OCH2CH2OH 乙二醇乙醚
醚无活泼氢,分子间不能形成氢键但能与水形成氢键。 醚的化学性质 醚是稳定的化合物,对碱、稀酸、金属钠、催化氢化、还原剂、氧化 剂等不反应。 1、 钅羊盐及络合物的形成 醚上有未公用电子对,是 Lewis 碱,与强酸作用形成钅羊盐,与 Lewis 酸作用络合
CH 3CH2OC H2 CH3 +
浓H 2SO 4
R BF3 R O
C H 3C H2OCH 2CH3 H BF3
+
HSO4
R
O
R
+
2、 醚键的断裂
46
有机化学笔记
与 HX 同热,醚键断裂。
R O R + HX R H O -X R Δ ROH + RX
醚键断裂的方向:
伯大 芳
O O
伯小 脂
伯
徐寿昌《有机化学》 课件 第十章 醇、醚

R CH CH R' OH OH
+
Pb(OAc)4
RCHO
+
R'CHO
+ Pb(OAc)2 +
HOAc
这个反应常定量完成,因此可用于乙二醇的定量测定,并可根 据氧化产物推断原醇的结构。 7、邻二醇的重排反应—频哪醇重排
CH3 CH 3 H3C C C CH3
H2SO4 (HCI)
△
CH3 H3C C O C CH3 CH3
M= b.p=
74 117.2
OH OH
频哪醇
频哪酮
CH3 CH3 H3C C C CH3
H2SO4
CH3 CH3 H3C C C CH3
+
OH OH CH3 CH 3 H3C C OH C
OH OH2
CH3 H3C C C CH3
-H
+
CH3 H3C C O C CH3 CH3
+CH3O Nhomakorabea CH3
第二节 醚(ethers)
325℃
5、与酸反应——酯化
醇可与有机酸、无机酸作用生成酯。
O H3C C OH + H
O
O CH2
H+ CH3
△
CH3 C O CH2 CH3
发生酯化反应时,羧酸的C – O键断裂,醇的O – H键断 裂。 CH3 – OH + H2SO4 (CH3)2SO4(硫酸二甲酯)
硫酸二甲酯剧毒,对皮肤的阀限值1ppm,空气中最 高限量5mg/m3。
CH3CH2Cl + H2O
通常用无水氯化锌与浓盐酸按1:1的比例配成溶液与醇反 应, 代替不易操作的氯化氢气体,这样的溶液称为卢卡斯 (Lucas)试剂。结构不同的醇与卢卡斯试剂反应的活性顺序 为:
有机化学第10章 醇、酚、醚

①醇可依分子中所含羟基数目分为一元醇、二元醇及三元醇等,二
元及二元以上的醇称为多元醇。例如:
CH3CH2OH CH2CH2 OH OH
乙醇(一元醇) 乙二醇(二元醇)
CH2CH CH2 OH OH OH
丙三醇(三元醇)
3
②醇也可依分子中烃基的不同而分为脂肪醇(包括饱和醇及不饱和 醇)、脂环醇和芳香醇。 例如:
C(CH3)2或 C(CH3)3
23
在醇的核磁共振谱图中,羟基质子(O—H)由于受
分子间氢键的影响,其化学位移(δ)出现在1~5.5范围 内,在核磁共振谱中产生一个单峰。由于氧的电负性 较大,羟基所连碳原子上的质子的化学位移一般在 3.4~4.0。
24
10.1.4 醇的化学性质
羟基是醇的官能团,作为反应中心羟基决定了醇的化学性质。
2,3-二甲基-3-戊醇
12
不饱和醇的命名,除应选择同时连有羟基和不饱和键的最长碳 链作为主链外,其它原则与饱和醇相同。
CH3CH2CH2CHCH2CH2CH2OH CH CH2
5 6
4
3
2
1
4-丙基-5-己烯-1-醇
CH CHCH3 CH3CH2CHCHCH2CHCH3 CH3 OH
4-甲基-5-乙基-6-辛烯-2-醇
32
醇和氢卤酸反应的速率与醇的结构的关系: 醇的活性顺序是:烯丙型醇、苄基型醇>叔醇>仲醇>伯醇。 例如:
33
利用不同醇与盐酸反应速率的不同,可以区分伯、仲、叔醇。无
水氯化锌与浓盐酸配制的溶液,叫做Lucas试剂。因为水溶性较好的
醇与Lucas试剂反应后,生成与水不互溶的氯代烃,形成乳状的混浊 溶液或分层,所以可利用Lucas试剂鉴别低碳(C6以下)一元伯、仲、叔 醇(C6以上的一元醇水溶性较差,难于用Lucas试剂鉴别)。例如:
第10章 醚

1
醚
一、结构和命名
通式为R—O—R, R—O—R 两个烃基相同时称为简单醚, 不相同时称为混合醚。 烃基可以是芳香烃基,也可以是脂肪烃基, 两个烃基可以彼此相连形成环醚。 醚的命名,常用衍生物命名法:
一般的醚的名称以与氧相连的烃基名称加上“醚” 字, 这不是系统名称;
CH3CH2OCH2CH3 乙醚
H+
C4H9–O–C4H9 正丁醚 R–O–R′ + NaX CH3 CH3–C–O–CH2CH3 CH3
(2)威廉姆森合成制备混醚 混醚 (注意原料的选择)
CH3 CH3CH2–X + CH3–C–ONa CH3
原因:叔卤代烷, 碱性条件下, 易发生消除反应 CH3 CH3 CH3CH2–ONa + CH3–C–X CH3–C=CH2 CH3
CH3OCH2CH3
甲乙醚
2
CH2CH2OCH2CH2 Cl Cl
二(2 (2-氯乙基)醚
烃基结构复杂的醚使用系统命名,将烷氧基 作为取代基命名。
CH3CHCH2CHCH3 OCH3 CH3
CH2 CH2 O O CH2CH3 CH3
2-甲基-4-甲氧基戊烷
CH3CH CH2
1-甲氧基-2-乙氧基乙烷
-H2O
CH3–I + C5H11I
C5H11OH + AgI↓ C–C–C–COOH =CH2
7
一芳基醚生成酚和卤代烷,二芳基醚则不易断裂。
O CH3
HI
OH
+ CH3I
–O–
+ HI
×
醚键上连有易生成碳正离子的烷基, 按SN1历程进行了解
(CH3)3C O H
有机化学-第十章 醚与环氧化合物-文档资料

17
10.5.2 酸催化醚键断裂
例如: (1) 对称醚键的断裂: 两侧醚键断裂均等
18
(2) 甲基伯烷基醚:醚键断裂在甲基一侧
(3) 叔烷基醚:醚键断裂在叔丁基一侧
(4) 芳基醚:醚键断裂在烷基一侧
19
醚键开裂机理
甲基伯烷基醚:SN2机理(主要考虑位阻影响为主)
叔烷基醚:SN1机理(主要考虑碳正离子稳定性)
11
(3) 立体专一性反应——邻基参与作用
12
10.3.3 不饱和烃与醇的反应
该反应是可逆反应,可利用异丁烯与醇反应生成的叔 丁基醚保护醇羟基。
13
10.4 醚的物理性质和波谱性质
IR:
C–O
Байду номын сангаас
1200 ~ 1050cm-1
14
10.4 醚的物理性质和波谱性质
δ 3.4 ~ 4.0
1H
NMR:
20
两类较易水解的醚类化合物
• 叔丁基醚
用于醇的保护和脱保护
• 烯基醚
21
烯基醚的水解机理
22
10.5.3 环氧化合物的开环反应
稀酸介质 HX溶液
23
反应机理
不对称环氧化物的酸性下开环
反应取向:在取代基多的一端开环,具有SN1性质。
立体化学: 反式开环。
酸的醇溶液
碱性条件下的环氧化物开环
2
。
10.1 醚和环氧化合物的分类
单醚:
乙醚 甲基叔丁醚
醚
混醚: 环醚:
四氢呋喃(THF)
1,4-二氧六环
环氧化合物:
环氧乙烷
3
10.1 醚和环氧化合物的命名 1. 单醚: “二”+“烃基 + 醚”
高四10章__醚和环氧

10.3 醚和环氧化合物的制法 醚和环氧化合物的制法
工业合成
10.3 醚和环氧化合物的制法 10. 10.3.1 醚和环氧化合物的工业合成
乙醚是重要的有机溶剂,在工业上, 乙醚是重要的有机溶剂,在工业上,可用醇脱水的方法制取: 浓H2SO4
2CH3CH2OH
∆
CH3CH2
O CH2CH3
环氧乙烷是重要的有机化工原料,是制备非离子表面活性剂的重要 原料。工业上,可由乙烯催化氧化制取环氧乙烷:
(1) 醇钠与卤烷的SN2反应 醇钠与卤烷的S
RONa + R'X R-O-R' + NaX
CH3 CH3CH2Br + CH3 C ONa CH3 CH3CH2 CH3 O C CH3 CH3 乙基叔丁基醚
例:
O Na
+ Br CH2CH3
OCH2CH3
注意:不能用叔卤烷做原料! 注意:不能用叔卤烷做原料!
CH3 O CH3 R=R' CH3 O 环醚 氧原子与二价 烃基两端相连 CH3 O CH2CH3 混(合)醚 R=R' CH CH CH3
单(纯)醚
O 环氧化合物 三元的环醚
10.1 10.1 醚和环氧化合物的命名
醚和环氧化合物的命名 醚和环氧化合物的命名
① 习惯命名法:(常用,适用于简单醚)
Ag 1 CH2=CH2 + O2 o 2 300 C , 1~2Mpa
CH2 O
CH2
该方法只适用于从乙烯制取环氧乙烷。
10.3 醚和环氧化合物的制法
Williamson 合成法
10.3.2 Williamson 合成法
此法特别适用于合成混合醚,也可用于制备单纯醚。 此法特别适用于合成混合醚,也可用于制备单纯醚。
大学有机化学醚和环氧化合物PPT课件

• 有机化学醚的介绍 • 环氧化合物的介绍 • 醚和环氧化合物的比较 • 有机化学醚和环氧化合物的实际应用 • 有机化学醚和环氧化合物的未来发展
01
有机化学醚的介绍
醚的定义和结构
醚的定义
醚是一类由醇或酚与卤素或硫酸反 应生成的化合物,其结构通式为RO-R',其中R和R'为烃基。
醚和环氧化合物的应用比较
醚的应用
醚在工业上主要用于溶剂、麻醉剂、农药等。
环氧化合物的应用
环氧化合物主要用于合成树脂、聚合物、涂料等高分子材料。
应用比较
醚和环氧化合物的应用领域不同,醚主要用于化学试剂、农药等; 而环氧化合物主要用于高分子材料合成。
04
有机化学醚和环氧化合物的实际应用
醚在医药领域的应用
THANKS
感谢观看
一些醚类化合物具有杀虫、杀 菌或除草活性,可以直接用作 农药,如杀螨醚、苯氧威等。
醚类化合物还可以作为农药的 增效剂,与其他农药混合使用, 以提高防治效果并减少农药的 使用量。
环氧化合物在材料科学领域的应用
环氧化合物可以通过聚合反应制备高 分子材料,如环氧树脂、环氧橡胶等, 这些材料具有优异的力学性能、电绝 缘性能和耐腐蚀性能。
醚和环氧化合物的性质比较
醚的性质
醚是较为稳定的化合物,对酸、 碱都有较好的稳定性。醚的沸点 较低,容易挥发。
环氧化合物的性质
环氧化合物对酸、碱都敏感,容 易发生开环反应。环氧化合物的 沸点较高,不易挥发。
性质比较
醚和环氧化合物的性质差异较大, 醚较为稳定,沸点低;而环氧化 合物对酸、碱敏感,沸点较高。
详细描述
环氧化合物具有多种化学性质,包括亲核性、亲电性、开环反应等。在一定条件下,环氧化合物可以 与多种试剂发生反应,如醇、酚、胺等。其中,开环反应是环氧化合物最重要的反应类型之一,可以 通过与氢离子、金属离子等反应打开环氧环。
第10章醚和环氧化物

2–甲氧基戊烷 (2-methoxypentane)
CH3CH2O
CH3
1–乙氧基–4–甲苯 (1-ethoxy-4-methylbenzene)
CH3OCH2CH2OCH2CH2OCH3
β , β′ –二甲氧基乙醚 二甘醇二甲醚 (diglyme)
OCH3
CH=CH CH3 对甲氧基丙烯基苯
结构特点分析
a碳有亲电性, 但难亲核取代
醚在中性、碱性和弱酸性 条件下稳定,常用作溶剂
a碳有亲电性,可 亲核取代
H+
R' C O R
H
C上连有氧, H易被氧化
氧有碱性, 可与酸结合
H R' C O R
H
较好的 离去基
1、 盐的生成
R O R' 一种Lewis碱 pKb≈ 17.5
与强酸作用生成 盐:
O
(CH2)n
X
CH2 X
(CH2)n+1O
反应速率与环的大小 相关:
≥
>
>≥
>
O
O
O
O
O
O
反应速率依次减小
影响反应的因素: • X与–OH的距离愈小,愈易反应; • 环张力愈小,愈易反应。
4)立体专一性反应——邻基参与作用
分子内的Williamson反应 SN2反应机理
Br
Br
H3C H H3C H
H2O
H+
HO
烯与过氧化物氧化形成环氧物:
RCOOOH
O
CC
常用的过氧化物有H2O2,过氧乙酸,间 (氯)过氧苯甲酸,过氧三氟乙酸。
乙烯基醚的合成
在碱的催化下,醇与炔烃发生亲核加成反应, 生成烯基醚:
有机化学(高鸿宾第四版)第十章醚和环氧化合物

根据生成碘化银的量,计算出甲氧基含量。此反 应用于天然的复杂有机化合物分子中甲氧基的测定。
当混醚中的一个烃基是芳基时,由于p、π-共轭效应的影响, 芳环与氧原子相连的键比较牢固,与氢碘酸反应时,发生烷氧 键(R-O)断裂,生成碘代烷和酚。
O C H 25H + I S N 2
O H C + H C 3 H 2 I
C H 3 O C H 3
甲醚
O
二苯醚
H 2 C H C O C H C H 2
二乙烯基醚
(2) 混醚:“烃基”+“烃基”+ “醚”,较
优基团
置后,但芳基置前:
C H 3O C 2H 5
O C H 3
甲乙醚
苯甲醚
methyl ethyl ether (茴香醚)
(3)对于结构复杂的醚: 较大的烃基作为母体,烃氧基作为取代基 。
① 乙 醚
M g B r+H 2 C O C HC H 3② H 3 O +
C H 2 C HC H 3 O H
(60%)
例:
C H 2 = C H 2 C H 3 C H 2 C H 2 C H 2 O H
CH3CH2-MgCl +
O
-Mg(OH)Cl H2O
C H 3 C H 2 C H 2 C H 2 O M g C l
但可以和水分子形成氢键, 小分子醚有一定水溶性。
易燃易爆 使用小分子醚时,应避免明火。
乙醚,它遇到火星就有发生燃烧爆炸的危险。其蒸气能 从远处将明火引来起火。
醚长期放置受热或碰撞可发生爆炸。
三、醚的化学性质
{稳定,不和除酸之外的试剂反应。
在空气中会慢慢氧化成过氧化物。
理工类专业有机化学教案10醚和环氧化合物

第十章醚和环氧化合物授课对象:应用化学、化工分析、化学工程、制药工程、药学学时安排:2-4h教材:普通高等教育“十五”国家级规划教材《有机化学》第四版高鸿宾主编2005年5月一、教学目的与要求1、掌握醚和环氧化合物的命名、结构;2、掌握醚和环氧化合物的化学性质:质子化成盐、环氧乙烷与Grignard试剂的反应、Claisen重排、过氧化物的生成;3、熟悉醚的波谱性质;4、熟悉环氧化合物的结构和命名,三元环氧化物的开环(酸催化和碱催化)加成反应;5、熟悉醚和环氧化合物的制备方法(Williamson制醚的方法);6、了解环氧化物的开环机理;冠醚的结构与应用。
二、教学重点1、醚的中、英文命名法;2、醚的化学性质:质子化成盐、环氧乙烷与Grignard试剂的反应、Claisen 重排、过氧化物的生成;3、三元环氧化物的开环(酸催化和碱催化)加成反应;4、醚的结构和命名;5、醚与HX作用;6、三元环氧化物的开环(酸催化和碱催化)加成反应。
三、教学难点1、Claisen重排的机理;2、环氧化物的开环反应机理。
四、教学方法讲授法。
酸催化和碱催化下三元环氧化物的开环加成反应是本章的难点,又是重点,通过多做练习题加以巩固。
五、教具电脑、幻灯投影仪、powerpoint课件、红外线指示笔。
六、教学步骤及时间分配1、引导学生回顾醚和环氧化合物的通式、来源或制备方法;2、已经学过了的醚有哪些主要的性质?4、从生活中的实例引入醚类化合物的重要性,引入本章内容。
一、醚的结构、分类和命名1、醚的结构和分类给出脂肪醚和芳香醚的通式,认识醚键。
以甲醚为例,分析键角和中心氧原子的杂化状态。
两大类:直链醚(单醚和混醚、脂肪醚和芳香醚)、环醚分别举例说明(由powerpoint课件给出结构式)2、命名(1)单醚以烃基的名称命名,如(二)甲(基)醚、二乙烯基醚、(二)苯(基)醚。
由上面分类的例子,让学生来命名。
(2)混醚两个烃基的表达按先小后大的次序,如:甲乙醚、甲(基)烯丙(基)醚。
有机化学醚

O (1)位阻较大
-
Nu
CH3CH CH2
O (2)
N u-:RO-、PhO-、RMgX
OH CH3CH
CH2 H2O Nu
反应特点:碱作为Nu-从氧环背后进攻,断键与成键同时进行, 为SN2反应。对于不对称环氧化合物,试剂选择进攻取代基较 少(即位阻较小)的环碳原子。
H 3C H 5C 2
( 主)
C CH 2 + -OCH3
O
CH3OH
H 3C H 5C 2
C CH 2OCH 3 OH
*立体化学:若被亲核试剂进攻的碳原子为手性碳原子,则构型 转化。
CH3
eg. H
R
R
O
H3C H
NH3.H2O
H3C H
OH H2N
SH
CH3
O
C2H5OH
OH H
-OC2H5
H OC2H5
H2C
CH2
O
H2O/H+ ROH/H+ HX HCN
CH3
CH3 C CH3 Br
C2H5ONa C H 3
CH3 C CH2
➢三 醇与烯烃的加成
1. 烯烃与醇反应制备叔烷基醚
R
HCl
C CH2 + HO R
R'
•合成上的应用:保护醇羟基
R R' C O R
CH3
例:完成转变 HO
Br
HO
合成路线
HO
Br
H3C
CH3 CO CH3
H2C
CH3 CH3
SO 3 H
ONa
Br2 Fe
Mg Br 乙醚
MgBr
H2C
有机化学课件--醚和环氧化合物

3
第一节 醚的定义、分类、 结构特征和命名
一 醚的定义 H
R
醚?
O
O
H
R
二 醚的分类 (I)
醚的分类(II)
(取代基是否相同)
(取代基类型)
简单醚:ROR
混合醚:ROR’ 环醚
二烷基醚 二芳基醚 烷芳混合醚
乙烯醚 烯丙醚
2020/2/3
课件
4
三 醚的结构特征
1. 烷基醚分子中氧原子是sp3杂化, 整个分子成交叉构象。
(1)烯烃与过氧化物反应
O
C6H5C O OH
C6H5CH=CH2
CHCl3
O
C6H5CH
CH2
H
H
CH3CO3H, C6H6
H
O
CC
25℃
C6H5
C6H5
C6H5
H C6H5
2020/2/3
课件
33
注意:如果烯烃有顺反异构,用过氧酸氧化后,取 代基的相对位置不变,再如:
H C
C6H5
C6H5 C
CH3
141.0pm
O 111.7o
H H
H H
HH
H H
O
H H
H
O 105o
H
2. 芳基醚分子中氧原子采用sp2,氧原子中的一对 孤电子与苯环中的π电子存在p-π共轭。
136pm
CH3
H
O 108.9o
CH3
O
CH3
121o
2020/2/3
课件
5
四 醚的命名
R
1. 普通命名法:
O
写出两个烃基的名称,再加上“醚”字,
《有机化学》徐寿昌 第二版 第10章 醇和醚

顺-1,2-环戊二醇 环戊二醇
10.2 醇的制法
10.2.1 烯烃水合 (1)烯烃直接水合: )烯烃直接水合: 用于一些简单的醇制备,符合马氏规律。 用于一些简单的醇制备,符合马氏规律。
H3PO4-硅藻土 硅藻土 CH2=CH2 + HOH CH3CH2-OH 280~300℃,8MPa ℃
CH3-CH=CH2 + HOH
Na/C2H5OH
R—CH2OH OH R—CH—R’ R—CH2OH
伯醇
仲醇
O 羧酸 R—C—OH O 羧酸酯R—C—OR’
伯醇
R—CH2OH + R’OH 伯醇
例如: 例如:
(CH3)3CCOOH O R—C—OC2H5
1. LiAlH4 2.乙醚,H2O 乙醚, 乙醚
(CH3)3CCH2OH
烯丙基氯(易从丙烯高温氯化得到) 烯丙基氯(易从丙烯高温氯化得到)
烯丙醇
苄氯(甲苯高温氯化) 苄氯(甲苯高温氯化)
苄醇
10.3 醇的物理性质
◆低级醇为无色透明液体;C12以上的直链醇为固体 低级醇为无色透明液体; 以上的直链醇为固体. 沸点:直链饱和一元醇的沸点比相应烷烃的沸点高. ◆沸点:直链饱和一元醇的沸点比相应烷烃的沸点高
10.2.3 从醛、酮、羧酸及其酯还原*** 从醛、 催化加氢( ◆催化加氢(Ni/H2;Pd/H2;Pt/H2) 用还原剂还原( ◆用还原剂还原(NaBH4、LiAlH4、Na/C2H5OH) ) 、 O 醛 R—C—H O 酮 R—C—R’
[H] NaBH4 [H] NaBH4 [H] LiAlH4 [H]
① 按-OH数 数 目分类: 目分类:
二元醇: 二元醇:
CH2—CH2 OH OH CH2—CH—CH2 OH OH OH
有机化学第十章醚和环氧化合物

第十章 醚和环氧化合物
1
第十章 醚和环氧化合物
醚和环氧化合物 —— 水分子中的两个氢原子都被烃基取代的化合物称为醚。
脂环烃的环上碳原子被一个或多个氧原子取代后所形成的化合物,称 为环醚;其中三元环醚称为环氧化合物 。
醚和环氧化合物的分类、命名、制法和物理性质 醚键的断裂 环氧化合物的开环
(1,4–二氧六环)
7
10.2 醚和环氧化合物的结构
10.2.1 醚的结构
10.2.2 环氧化合物的结构
O: sp3 杂化
O
R
R'
sp3杂化
8
10.3 醚和环氧化合物的制法
10.3.1 醚和环氧化合物的工业合成
9
10.3.2 Williamson合成法
(1) 醇钠与RX的SN2反应合成醚 剧毒 无毒
互变 异构
六员环过渡态
I
邻位产物
第二次 重排
互变 异构
I
六员环过渡态
对位产物
29
10.5.6 过氧化物的生成
醚的过氧化物受热易爆炸!
机理:
链引发
链增长
30
10.6 冠醚 相转移催化反应
10.6.1 冠醚
18-冠-6 冠醚的合成:
15-冠-5
二环己烷并-18-冠-6
31
10.6.1 冠醚
冠醚形状及性质:
2
10.1 醚和环氧化合物的命名
醚 (Ether)
单醚:
混醚:
环醚:
水
醇
乙醚
(diethyl ether)
甲基叔丁醚 (tert-butyl methyl ether)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
环氧化合物:三元环的环醚。
H2C CH2 O
环氧乙烷
10.1 醚和环氧化合物的命名
单醚:“二” + “烃基” + “醚”
饱和烃基可省去“二”字和 “基” 字,不饱 和烃基则否:
CH3CH2OCH2CH3
二乙基醚(乙醚)
CH2 CHOCH CH2
二乙烯基醚
结构简单的混醚:烃基 + 烃基 + “醚”
第十章 醚和环氧化合物
醚:水分子中两个氢原子都被烃基取代的化合物。
R O R'
单醚 : 两个烃基相同 CH3CH2OCH2CH3
乙醚
混醚: 两个烃基不同
CH3O
CH3 C CH3 CH3
甲基叔丁醚
环醚: 脂环烃的环上碳原子被一个或多个氧原子
取代后所形成的化合物。
O
四氢呋喃 (THF)
OO
1,4–二氧六环 二烷
OO
1,4–二氧六环 二烷
10.2 醚和环氧化合物的结构
10.2.1 醚的结构
醚键: C O C
O: sp3 杂化 甲醚:
O. .
0.142 nm
CH3 112° CH3
10.2.2 环氧化合物的结构
环氧乙烷:
0.147 nm
CH2
CH2
59.2°
O
0.144 nm 61.5°
三元环具有较大的环张力。
R ONa + R' X
R O R' + NaX
例如:
CH3CH2I NaOCH2CH2CH2CH3
CH3CH2 OCH2CH2CH2CH3 71%
•原料最好使用伯卤代烷RCH2X,用叔卤代烷 得到烯烃:
H3C
CH3 C ONa CH3
CH3CH2Br t BuOH
H3C
CH3 C OCH2CH3 CH3
10.3 醚和环氧化合物的制法
10.3.1 醚和环氧化合物的工业合成
乙醚:
2 CH3CH2OH
浓
H2SO4
△
CH3CH2OCH2CH3
醇在硫酸的作用下脱水生成醚 ——单醚的制备
环氧乙烷:
CH2
CH2
+
1 2
O2
Ag 280~300℃,1~2MPa
H2C CH2 O
10.3.2 Williamson 合成法 (1) 醇钠对RX的SN2反应。用于混醚、环醚、 芳香醚的合成。
>
O
OO
O
O
O
反应速率依次减小
10.3.3 不饱和烃与醇的反应
醇与烯烃在酸的催化下,发生亲电加成反应生成醚:
ROH + CH3
CH3 C CH2
浓H2SO4
CH3 RO C CH3
CH3
羟基的 保护基
例如: BrCH2CH2CH2OH
DCH2CH2CH2OH
CH3 BrCH2CH2CH2OH + CH3 C CH2 H2SO4 BrCH2CH2CH2OC(CH3)3
➢ 把在次序规则中“优先”的烃基放在后面 ➢ 如果其中一个是芳基,芳基放在前面
CH3OCH2CH3
甲乙醚
CH3OC(CH3)3
甲基叔丁基醚
CH2 CH O CH2CH3
乙基乙烯基醚
O CH3
苯甲醚(茴香醚)
结构复杂的醚: 较大的烃基作为母体,烃氧基作为取代基 。
CH3CHCH2CH2CH3 OCH3
2–甲氧基戊烷
CH3CH2O
乙氧基苯
CH3OCH2CH2OCH2CH2OCH3
β , β′ –二甲氧基乙醚 二甘醇二甲醚
环醚:环氧某烃,或按杂环化合物命名。
H2C CH2 O
环氧乙烷
CH3 CH CH2 O
CH2 CH CH2
Cl
O
1,2–环氧丙烷 3–氯–1,2–环氧丙烷 环氧氯丙烷
O
1,4-环氧丁烷 四氢呋喃 (THF)
(1)首先生成 盐:
CH3CH2CH2OCH3 + HI
(2)I - 与 盐发生SN2反应
H
CH3CH2CH2O CH3
CH3 I CH3CH2CH2O
H
CH3I + CH3CH2CH2OH
➢叔烷基醚在反应中能生成稳定的叔碳正离 子,因此按SN1机理反应:
CH3 CH3 C O
CH3 HBr
CH3 CH3 C O
与强酸作用生成 盐:
R O R' + HCl
H R O + Cl
R'
生成的 盐可溶于浓强酸中,用冷水稀释则重新析出 醚层,利用这一性质来分离与提纯醚。
醚还可以和lewis酸形成加合物或络合物:
R
O R
BF3
R O BF3
R
R
O R
R'MgX
R
R
R
O Mg O
R
X
R
10.6.2 酸催化碳氧键断裂
醚在HI或HBr的作用下,C–O键断裂,生成醇与 卤代烷等。 ➢伯烷基醚与氢碘酸作用时,碘负离子与 盐按SN2 机理进行,且优先得到碘甲烷:
H3C
CH3 C Br CH3
CH3CH2ONa CH3CH2OH
H3C
CH3 C CH2
可以用磺酸酯或硫酸酯类化合物代替卤代烷:
芳香醚的合成:
O ONa + CH3OSOCH3
O
剧毒
O
OCH3 + NaOSOCH3
(75%)
O
茴香醚
OH O
+ CH3OCOCH3
无毒
OCH3 + CH3Oห้องสมุดไป่ตู้ + CO2
(2) 合成环醚——生成环的大小与反应速率的关系
环醚可通过分子内的Williamson反应制备:
OH
(CH2)n
HO -H2O
CH2 X
O-
(CH2)n
-X
CH2 X
(CH2)n+1O
影响反应的因素: ➢ X与–OH的距离愈小,愈易反应; ➢ 环张力愈小,愈易反应。
环的大小与反应速率关系:
≥ > >≥
H
CH3
CH3 CH3
CH3 Br CH3 C Br
CH3
CH3
CH3 C CH3OH CH3
在酸催化下,环氧化合物发生亲核取代反应,开 环生成 2–取代乙醇:
H2C
CH2
HBr
10℃
BrCH2CH2OH
O
(~90%)
工业上制备乙二醇的方法:
H2C CH2 + H3O+ O
H2C CH2 + H2O O H
➢ 分子间不能形成氢键,沸点较低。
沸点
CH3OCH3 -23 oC
CH3CH2OH 78.5 oC
➢ 氧原子上有未共用电子对,可以作为氢键受体与 水分子形成氢键,因此有一定的水溶性。
➢ 化学惰性,常用作溶剂,医用麻醉剂。
10.6 醚和环氧化合物的化学性质 10.6.1 盐的生成
R O R' 一种Lewis碱 pKb≈ 17.5
Mg 纯醚
BrMgCH2CH2CH2OC(CH3)3 D2O
DCH2CH2CH2OC(CH3)3
CH3
H2SO4
△
DCH2CH2CH2OH + CH3 C
CH2
在碱的催化下,醇与炔烃发生亲核加成反应,生成 烯基醚:
RC CH + CH3CH2OH NaOH
RC CH2 OCH2CH3
10.4 醚的物理性质
H2C CH2 H2O O H
HO CH2 CH2 OH2
H2O HO CH2 CH2 OH + H3O+
