牛奶中蛋白质检测研究
牛奶中蛋白质含量的测定

牛奶中蛋白质含量的测定摘要:通过国标牛奶中蛋白质的测定找出它的不足之处,用新的方法进行蛋白质的测定。
关键词:蛋白质测定凯氏定氮法微波消解—凯式定氮法 Bradford法甲醛值滴定法牛奶是一种营养丰富而全面的理想食品,是人体所需蛋白质的重要来源,蛋白质是牛奶中的主要营养指标。
因此,牛奶中蛋白质的测定是一件非常重要的事,也是大家非常关注的事。
用凯氏定氮的方法检测蛋白质含量。
蛋白质测定的国标规定方法——凯氏定氮法介绍【GB/T 5009.5—1985】食品中蛋白质的测定方法本标准适用于各类食品中蛋白质的测定。
1 原理蛋白质是含氮的有机化合物。
食品与硫酸和催化剂一同加热消化,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。
然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
2 试剂所有试剂均用不含氨的蒸馏水配制。
2.1 硫酸铜。
2.2 硫酸钾。
2.3 硫酸。
2.4 2%硼酸溶液。
2.5 混合指示液:1份0.1%甲基红乙醇溶液与5份0.1%溴甲酚绿乙醇溶液临用时混合。
也可用2份0.1%甲基红乙醇溶液与1份0.1%次甲基蓝乙醇溶液临用时混合。
2.6 40%氢氧化钠溶液。
2.7 0.05N硫酸标准溶液或0.05N盐酸标准溶液。
3 仪器定氮蒸馏装置:如图所示。
(图略)4 操作方法4.1 样品处理:精密称取0.2~2.0g固体样品或2~5g半固体样品或吸取10~20ml液体样品(约相当氮30~40mg),移入干燥的 100ml或500ml定氮瓶中,加入0.2g硫酸铜,3g硫酸钾及20ml硫酸,稍摇匀后于瓶口放一小漏斗,将瓶以45°角斜支于有小孔的石棉网上。
小心加热,待内容物全部炭化,泡沫完全停止后,加强火力,并保持瓶内液体微沸,至液体呈蓝绿色澄清透明后,再继续加热0.5h。
取下放冷,小心加20ml 水。
放冷后,移入100ml容量瓶中,并用少量水洗定氮瓶,洗液并入容量瓶中,再加水至刻度,混匀备用。
考马斯亮蓝染色法测定牛奶中蛋白质含量

实验六考马斯亮蓝染色法测定牛奶中蛋白质含量一、目的要求学习考马斯亮蓝染色法测定牛奶中蛋白质含量的方法和原理,标准曲线的绘制和回归方程的使用,分光光度计的使用。
二、基本原理考马斯亮蓝所含疏水基团在酸性条件下与蛋白质的疏水微区具有亲和力。
通过疏水作用与蛋白质相结合,形成的蓝色蛋白质染料复合物,在595 am处有最大吸光度,在一定的蛋白质浓度范围内,蛋白质染料复合物在595 nm处的吸光度与蛋白质含量成正比,因此可用于蛋白质含量的测定。
分光光度法的原理:通过测定被测物质在特定波长处或一定波长范围内光的吸收度,对该物质进行定性和定量分析。
三、器材和试剂1.器材可见分光光度计,玻璃比色皿,试管2.试剂考马斯亮蓝G一250溶液:精确称取考马斯亮蓝G一250 100 mg,溶于50 mL 95%的乙醇,再加入100 mL 85%的磷酸,稀释定容至1 000 mL备用。
标准蛋白质溶液:精确称取牛血清白蛋白10 mg,加水溶解并定容至10 ml,冰冻,用时吸取上述溶液1 ml,用蒸馏水稀释至10 ml,即为100 μg/ml的标准蛋白质溶液。
样品的制作:准确吸取2 ml牛奶(市场上现买)加水至1000 ml制作样品。
四、操作1.工作曲线的确定在试管中分别精确移取牛血清白蛋白标准溶液0、0.1、0.2、0.4、0.6、0.8、1.0 mL,加蒸馏水至1.0 mL,然后在各支试管中分别加入4.0 mL考马斯亮蓝G-250溶液,摇匀,室温下反应5 min,在595 nm波长处测定吸光度,以牛血清白蛋白标准溶液浓度为横坐标,以吸光度为纵坐标,绘制标准曲线。
2. 样品的测定分别准确移取一定量的乳与乳制品样品于试管中,用蒸馏水定容至1.0 mL加入4.0 mL考马斯亮蓝G一250溶液,摇匀,在室温下反应5 min,以空白(不加乳制品)溶液作参比溶液,分光光度计595 nm波长处测定样品组的吸光度。
注意:比色应在1h内完成。
五、计算:根据牛血清白蛋白标准溶液标准曲线得出回归方程(可用EXCEL工具作图给出公式),以样品吸光度为X代入方程求得Y蛋白浓度。
牛奶中蛋白质测定实验方案-甲醛值滴定法

实验设计方案——12制药1班陈文照陈颖峰甲醛值滴定法快速测定牛奶中蛋白质含量一、实验原理:牛奶中蛋白质含量与游离氨基酸含量呈良好的正相关。
氨基酸为两性电解质,在接近中性的水溶液中,全部解离为双极离子。
当甲醛溶液加入后,与中性的游离氨基酸中非解离型氨基反应,生成单羟甲基和二羟甲基诱导体,使氨基酸失去氨基特性,游离的羧基(-COOH)可以用标准碱溶液滴定,根据碱溶液的消耗量得出游离氨基酸含量,乘以经验常数计算出蛋白质的含量。
二、实验仪器与试剂仪器碱式滴定装置,1个500ml细口瓶,1个250ml细口瓶,分析天平,3个250ml锥形瓶,1个1ml移液管,1个2ml移液管,1个10ml移液管,1个50ml量筒,1个胶头滴管。
样品纯牛奶40ml试剂饱和草酸钾溶液:330g/L;酚酞指示液:5g/L,用乙醇溶液配制; 质量分数为50%的NaOH 溶液(约19mol/L);中性甲醛水溶液。
三、实验测定方法1、0.1mol/l NaOH标准滴定溶液的配制:用洁净量筒取1.1ml质量分数为50%的NaOH 溶液(约19mol/L)于细口瓶中,加入蒸馏水200ml,盖好橡皮塞,摇匀;2、0.05mol/l NaOH标准滴定溶液的配制:用洁净量筒取1.1ml质量分数为50%的NaOH 溶液(约19mol/L)于细口瓶中,加入蒸馏水400ml,盖好橡皮塞,摇匀;3、NaOH溶液浓度的标定:称三份邻苯二甲酸氢钾KHP 0.4g至250ml锥形瓶中,加入30mL 无CO2水溶解,加入2滴酚酞→用待标的NaOH溶液来滴定至微红色,30s不褪色,即终点,记录用去NaOH溶液的体积,计算器准确浓度。
(平衡三份)4、定量滴定:实验时准确吸取奶样10.0 ml于编号分别为①、②、③三个三角瓶中,向三个三角瓶加入0.5 ml饱和草酸钾溶液[优点:1]和0.5 ml酚酞指示液,振荡均匀,约2 min后用0.1 mol L氢氧化钠标准溶液滴定至粉红色。
检验牛奶的实验报告(3篇)

第1篇一、实验目的通过对牛奶的物理性质、化学成分和微生物指标进行检测,评估牛奶的品质,确保消费者饮用的安全与卫生。
二、实验原理1. 物理性质检测:通过观察牛奶的颜色、透明度、黏度等,初步判断牛奶的品质。
2. 化学成分检测:通过检测牛奶中的蛋白质、脂肪、乳糖等成分,评估牛奶的营养价值。
3. 微生物指标检测:通过检测牛奶中的细菌总数、大肠菌群等指标,判断牛奶的卫生状况。
三、实验材料与仪器1. 实验材料:新鲜牛奶、无菌生理盐水、蛋白试剂、脂肪试剂、乳糖试剂、细菌培养箱、显微镜等。
2. 仪器:电子天平、烧杯、试管、移液器、比色计等。
四、实验方法1. 物理性质检测(1)观察牛奶的颜色、透明度和黏度,记录结果。
(2)将牛奶样品置于烧杯中,用电子天平称取一定量,记录质量。
2. 化学成分检测(1)蛋白质检测:按照蛋白试剂说明书进行操作,观察颜色变化,记录结果。
(2)脂肪检测:按照脂肪试剂说明书进行操作,观察颜色变化,记录结果。
(3)乳糖检测:按照乳糖试剂说明书进行操作,观察颜色变化,记录结果。
3. 微生物指标检测(1)细菌总数检测:按照细菌培养箱说明书进行操作,将牛奶样品稀释后,涂布于琼脂平板上,培养一定时间后,计数细菌总数。
(2)大肠菌群检测:按照大肠菌群试剂说明书进行操作,将牛奶样品稀释后,涂布于伊红美蓝琼脂平板上,培养一定时间后,观察菌落生长情况,记录结果。
五、实验结果与分析1. 物理性质检测结果(1)颜色:样品牛奶呈乳白色,无异味。
(2)透明度:样品牛奶透明度良好。
(3)黏度:样品牛奶黏度适中。
2. 化学成分检测结果(1)蛋白质:样品牛奶蛋白质含量为3.2%。
(2)脂肪:样品牛奶脂肪含量为3.8%。
(3)乳糖:样品牛奶乳糖含量为4.5%。
3. 微生物指标检测结果(1)细菌总数:样品牛奶细菌总数为5×10^5 CFU/mL。
(2)大肠菌群:样品牛奶大肠菌群为0。
六、实验结论根据实验结果,样品牛奶品质良好,符合国家标准。
检验牛奶的实验报告单

检验牛奶的实验报告单
实验目的:
本实验旨在检验牛奶的质量,通过分析牛奶中的营养成分、微生物指标和感官特征,评估牛奶的新鲜度和卫生状态。
实验步骤:
1. 样品准备:收集不同品牌和来源的牛奶样品。
2. 营养成分分析:使用化学分析方法,测定牛奶中的蛋白质、脂肪、碳水化合物和维生素等营养成分的含量。
3. 微生物检测:将牛奶样品接种在含有适宜培养基的琼脂平板上,培养并计数牛奶中的总菌落数、大肠杆菌和金黄色葡萄球菌等微生物。
4. 感官评价:将不同样品的牛奶进行无标记的盲测,评估其颜色、气味、味道和口感等感官特征。
实验结果与讨论:
1. 营养成分分析结果表明,不同牛奶样品中的蛋白质、脂肪、碳水化合物和维生素等营养物质含量存在一定的差异。
通过对比不同样品的营养成分含量,可以评估其质量和营养价值。
2. 微生物检测结果显示,牛奶中的总菌落数、大肠杆菌和金黄
色葡萄球菌等微生物的数量可以反映牛奶的卫生状况。
较高的微生物数量可能代表牛奶的污染或存储条件不当。
3. 感官评价方面,通过对不同样品的颜色、气味、味道和口感等特征的评估,可以了解牛奶的新鲜度和品质。
特别是气味和口感对于评估牛奶的质量具有重要的参考意义。
结论:
通过对牛奶的营养成分分析、微生物检测和感官评价,可以综合评估牛奶的质量和卫生状况。
这些评估结果对于消费者选择优质牛奶、保证食品安全至关重要。
因此,定期检验牛奶样品,确保其新鲜度和卫生状态是维护公众健康的必要措施之一。
牛奶中蛋白质的提取与鉴定

探索更为高效、环保的蛋白质提取方法,降低提取成本, 提高提取效率。
加强与其他学科的合作,如生物学、医学等,从多角度 探究牛奶中蛋白质的作用和价值。
感谢您的观看
THANKS
分离。
纯化原理
分子筛原理
利用不同大小的蛋白质分子在通过分子筛时受到不同程度的阻拦, 从而实现分离。
亲和层析法
利用蛋白质与配体之间的特异性亲和力,将目标蛋白质与其他蛋 白质分离。
离子交换层析法
利用不同蛋白质分子所带电荷性质的差异,通过离子交换剂进行 分离。
实验材料与设备
实验材料
牛奶、缓冲液、离子交换剂、亲和配 体等。
实验设备
离心机、电泳仪、层析柱、pH计、天 平等。
04 蛋白质的鉴定
鉴定方法
化学分析法
通过蛋白质的化学性质进行鉴定,如测定氮 含量、氨基酸组成等。
色谱技术
利用不同蛋白质在色谱柱上的吸附或洗脱性 质进行分离和鉴定。
免疫学方法
利用抗原-抗体反应原理,通过特异性抗体 对蛋白质进行检测。
质谱技术
通过蛋白质的质荷比进行分离和鉴定,常用 于蛋白质的序列分析和结构研究。
02 牛奶中蛋白质的提取
提取方法
01
02
03
离心法
利用高速离心机将牛奶中 的蛋白质与其他成分分离, 收集离心后的沉淀物即可 得到蛋白质。
沉淀法
通过加入适量的盐或有机 溶剂,使蛋白质沉淀,再 经过过滤和洗涤,得到纯 净的蛋白质。
膜过滤法
利用孔径大小不同的膜, 将牛奶中的蛋白质和其他 小分子物质分离,得到高 纯度的蛋白质。
提取原理
牛奶中蛋白质含量的测定---- 凯氏定氮法
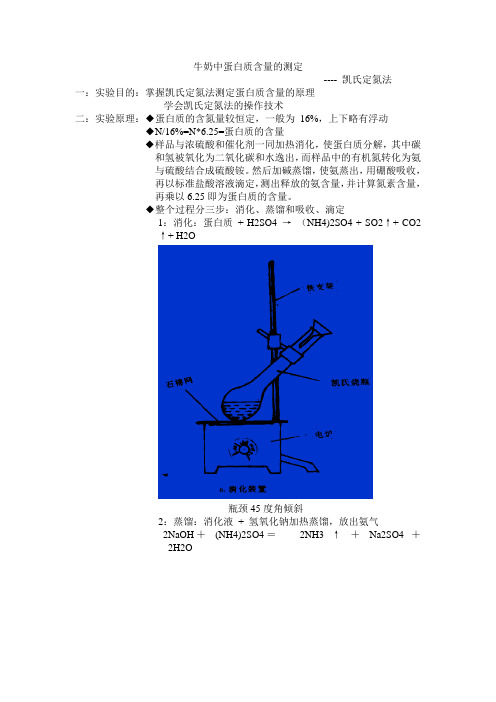
牛奶中蛋白质含量的测定---- 凯氏定氮法一:实验目的:掌握凯氏定氮法测定蛋白质含量的原理学会凯氏定氮法的操作技术二:实验原理:◆蛋白质的含氮量较恒定,一般为16%,上下略有浮动◆N/16%=N*6.25=蛋白质的含量◆样品与浓硫酸和催化剂一同加热消化,使蛋白质分解,其中碳和氢被氧化为二氧化碳和水逸出,而样品中的有机氮转化为氨与硫酸结合成硫酸铵。
然后加碱蒸馏,使氨蒸出,用硼酸吸收,再以标准盐酸溶液滴定,测出释放的氨含量,并计算氮素含量,再乘以6.25即为蛋白质的含量。
◆整个过程分三步:消化、蒸馏和吸收、滴定1:消化:蛋白质+ H2SO4 →(NH4)2SO4 + SO2↑+ CO2↑+ H2O瓶颈45度角倾斜2:蒸馏:消化液+ 氢氧化钠加热蒸馏,放出氨气2NaOH+(NH4)2SO4=2NH3 ↑+Na2SO4 +2H2O3:吸收与滴定(1)用4%硼酸吸收(2)用盐酸标准溶液滴定(3)混合指示剂(甲基红—溴甲基酚绿混合指示剂)指示剂:红色———→绿色———→红色(酸)吸收(碱)滴定(酸)3NH3 + H3BO3→(NH4)3BO3(NH4)3BO3+ 3HCl →3NH4Cl + H3BO3三:实验步骤1、消化:准确量取牛奶0.5mL,移入干燥的凯氏烧瓶中(勿粘附在瓶壁上),加入0.2g硫酸铜、0.3g硫酸钾、10mL浓硫酸,小心摇匀,于通风橱内消化(先小火,待炭化完全后,加大火力至溶液呈蓝绿色),冷却至室温,定容至25mL。
同时消化一份空白试剂为对照。
2、蒸馏、吸收◆取40mL硼酸溶液于锥形瓶中,加2d混合指示剂,置于冷凝管下端,为接受瓶。
◆量取5mL样品消化液由加料口加入反应室,用5mL蒸馏水冲洗加料口,再加入40%NaOH10mL(溶液呈蓝褐色),不要摇动,立即封口。
◆夹紧缓冲管下口,开始蒸馏,当接收瓶溶液颜色变化时,继续蒸馏3-5min,下降接收瓶,使硼酸液面离开冷凝管口,继续蒸馏1min,用蒸馏水淋洗浸入硼酸的管外壁,移出接收瓶,滴定。
ppt牛奶中蛋白质含量的检测

考核评价
自我评价(30%) 小组评价(30%) 教师评价(40%)
谢谢聆听!
敬请批评指正
八、小结
步骤 湿法消化
碱化蒸馏 硼酸吸收 盐酸滴定
反应前后颜色变化
凯氏烧瓶:样品无色(加硫酸前)→加硫 酸炭化黑色→消化后红棕色→ 棕褐色→消 化终点蓝绿色/墨绿色→淡蓝色(冷却后溶
液) 反应室:深蓝色或黑色沉淀
紫红色→绿色
甲基红和溴甲酚绿混合指示剂:绿色→灰色 甲基红和亚甲基蓝混合液:绿色→蓝紫色
硼酸溶液(20g/L)1L怎么配制?
氢氧化钠溶液(400g/L)1L怎么配制? 盐酸标准滴定溶液(0.0500mol/L)2L怎么配 制?(注意) 混合指示剂:甲基红1+溴甲酚绿5
四、实验准备
硼酸溶液(20g/L):称取20g硼酸,加水溶解后并 稀释至1000mL。
氢氧化钠溶液(400g/L):称取40g氢氧化钠加水 溶解后,放冷,并稀释至100mL。
任务1 牛奶中蛋白质含量的检测0102 Nhomakorabea03
04
检查学生的 出勤情况
工作服穿 戴情况
学习用具 是否齐全
本次任务的 安全培训
实验安全最重要, 操作规则记心上。 个人防护有意识, 职业素养即养成。 防电,防烫,防硫酸!!
一、实验目的 二、相关知识 三、实验仪器及试剂 四、实验准备
五、实验步骤
六、数据分析及处理 七、注意事项
五、实验步骤
1.样品消化处理
• (1)称取10~25g试样,移入干燥的消 化管中,加入0.2g 硫酸铜、6g硫酸钾及 20mL浓硫酸,置于控温消化炉上。
• (2)小心加热,待内容物全部炭化,泡 沫完全停止后,加强火力,并保持瓶内 液体微沸,至液体呈蓝绿色并澄清透明 后,再继续加热0.5~1h。取下冷却备用 。同时做空白试验
牛奶中蛋白质测定过程

测定牛奶中的蛋白质含量牛奶是日常生活中一种营养价值高的食物,其营养价值主要集中在蛋白质上。
蛋白质能促进人体心血管的健康,而且能改善睡眠状况,控制高血压,增强身体的免疫机能。
实验目的:测定牛奶中蛋白质含量实验试剂:鲜牛奶一袋、浓硫酸、NaOH(40%)、硫酸标定液(0.01mol/L)、H3BO3(2%)、混合指示液(甲基红、溴甲酚绿)K2SO4、CuSO4·5H2O作做催化剂实验主要仪器:消化管、锥形瓶、天平、凯氏微量定氮仪一套等实验方法:凯氏定氮法,样品经加硫酸消化使蛋白质分解,其中氮素与硫酸化合成硫酸铵。
然后在凯氏定氮器中加碱蒸馏使氨游离,用硼酸液吸收后,再用硫酸滴定,根据酸的消耗量,再乘以一定的数值(6.25)即为蛋白含量。
原理:蛋白质是含氮的有机化合物。
由于蛋白质含氮量比较恒定,约为16%,所以蛋白质含量=N/16%=N*6.25。
测出含氮量即能得出蛋白质含量。
实验步骤(过程记录):1、样品消化:将牛奶10mL置于消化管内,加入催化剂5g,并沿烧瓶壁缓缓加入20mL浓硫酸,使全部样品浸没于硫酸。
接着将消化管放在消化炉支架上,把支架连同装有试样的消化管一起移至电热炉上。
设定温度在420℃保持消化管中液体连续沸腾。
待溶液消煮至无微小碳粒、呈蓝绿色时,继续消煮一会。
同一方法做试剂空白实验。
消化结束,等其冷却至室温。
冷却过程中,防止废气泻出。
2、样品蒸馏:使自来水经过给水口进入冷凝管。
然后打开定氮仪总电源开关,启动仪器待蒸汽导出管放出蒸汽,按消除按钮停止加热。
在蒸馏导出管托架上,放上已经加入适量的15ml接受液(硼酸和混合指示剂)的锥形瓶。
抬起锥形瓶支架使蒸馏导出管的末端浸入接受液内。
再在消化完全冷却后的消化管内,逐个加入10mL左右蒸馏水稀释样品。
而后开始蒸馏,到时或到量时自动停止。
用洗瓶将蒸馏水冲洗接收,取下锥形瓶。
最后加碱:按下碱按钮,使NaOH溶液加至蒸馏液碱性颜色变黑为止。
3.加酸滴定:用标定后的硫酸溶液进行滴定,溶液由蓝绿色变为灰紫色为滴定终点。
牛奶中蛋白质的测定原理及其注意事项

牛奶中蛋白质的测定原理及其注意事项牛奶作为一种常见的饮品,其蛋白质含量是人们关注的重点。
蛋白质是构成生物体的重要组成成分,对于人体的生长发育、免疫系统和新陈代谢过程起着至关重要的作用。
因此,准确地测定牛奶中蛋白质的含量对于消费者和生产商来说都是非常重要的。
本文将介绍牛奶中蛋白质测定的原理及其注意事项。
测定原理:牛奶中的蛋白质主要包括酪蛋白和乳清蛋白,其中乳清蛋白的含量较低,而酪蛋白的含量较高。
因此,在进行蛋白质测定时,一般常用的方法是将牛奶中的乳清蛋白沉淀,然后通过物理或化学方法将其纯化,最后使用确定性的试剂来测定其含量。
常用的蛋白质测定方法有几种,包括比色法、电泳法、质谱法等。
其中,最广泛使用的是比色法,通过测量在特定条件下形成的复合物的吸收光谱来确定蛋白质的含量。
常见的比色试剂有布拉德福德试剂、二噁英红试剂等,它们与蛋白质中的游离氨基酸发生反应,产生具有一定吸收特性的化合物。
注意事项:1.样品的选择:在进行测定之前,应注意样品的选择和保存。
牛奶中的蛋白质含量会受到多种因素的影响,包括奶牛的饲料、乳品加工工艺等。
因此,在进行测定之前,应在样品代表性和存储条件上进行充分的考虑。
2.实验步骤的标准化:为了保证测定结果的准确性和可重复性,应按照标准的操作步骤进行实验。
在使用试剂和仪器时,应遵循标准操作程序,并严格控制各种可能导致误差的因素,如温度、pH值等。
3.实验装置的选择和校准:在进行蛋白质测定时,选择合适的实验装置也是至关重要的。
比色法的测定一般使用分光光度计进行,因此,在使用前需要进行校准和调试,以确保仪器的准确性。
此外,还需要注意光路的清洁和调整,以避免光路不正和杂质的干扰。
4.控制试剂的质量和用量:试剂的质量和用量直接影响到测定结果的准确性和稳定性。
因此,在实验中应选择质量可靠的试剂,并根据实验要求准确使用和配制。
5.数据处理和结果的判定:在蛋白质测定结束后,需要对实验数据进行处理和结果的判定。
专业实验凯氏定氮法测定牛奶中的蛋白质(修改后)

清澈的蓝绿色
牛奶中含氮量的测定
2、碱化蒸馏
用强碱高温水蒸气蒸出氨 气
(NH4)2SO4+2NaOH=2NH3+2H2O+Na2SO4
3、吸收 用硼酸吸收氨气
2NH3+4H3BO3=(NH4)2B4O7+5H2O
牛奶中含氮量的测定
4、滴定 用标准盐酸进行滴定
(NH4)2B4O7+2HCl+5H2O=2NH4Cl+4H3BO3 指示剂: 甲基红—溴甲基酚绿混合指示剂 红色————→ 蓝色 ———→红色 (酸) 吸收NH3(碱) 滴定 (酸)
(1)水蒸气发生器
水、适量浓硫酸、数滴甲基 红指示剂 保持水呈酸性
(2)反应室
10ml消化后样品定溶液 10ml蒸馏水 10mlNaOH 适量水密封
(2)反应室
同时吸取10.0mL试剂空白消 化液按上法蒸馏操作
(3)吸收装置
硼酸试剂20mL 混合指示剂2—3滴 用PH试纸检验是否蒸馏完全
吸收装置内颜色变化
凯氏定氮法测定牛奶中的蛋白质
一、实验目的
• 1、掌握凯氏定氮法的原理 • 2、熟悉利用凯氏定氮法测定牛奶中蛋白质含量的操作
方法
二、实验原理
• 1、绝大多数蛋白质的氮元素含量相当接近,只要测定出生物
样品中的含氮量,再乘以相应的蛋白质换算系数(乳制品为
6.38),就可以计算出样品中的蛋白质含量。
• 2、牛奶中含氮量测定
牛奶样品
(NH4)2SO4
NH3
(NH4)2B4O7
牛奶中含氮量的测定
1、消化 蛋白质的有机氮消化为无机氮
K2SO4和CuSO4的作用
K2SO4 1、提高沸点 硫酸沸点 338℃ 氮的临界分解温度 373℃ 2、不宜加太多 消化体系温度过高,引起已生 成的铵盐发生热分解
测定牛奶中蛋白质的等电点

三、实验的仪器和试剂 1、10mL试管、试管架、胶头滴管、pH计、 磁力搅拌器、电热炉、铝锅、50mL的烧杯、 100mL的容量瓶、玻璃棒、电子天平、10mL 量筒、试管刷 2、0.5mol/L的盐酸、20%的氢氧化钠、蒙牛 纯牛奶
四、操作步骤 1)取12支50mL的烧杯,按照下表加入试剂,配 制不同pH值的牛奶溶液(牛奶的原先pH为6.5)
完全凝固, 有少量颗 呈块状, 粒状沉淀 可以倒立,
试管编号 鲜牛奶 (mL)
8 30
11 30
12 30
12 30
溶液Ph
实验现象
7.5
没沉淀
8.0
没沉淀
8.5
没沉淀
9.0
没沉淀
9.5
没沉淀
10.0
没沉淀
通过实验现象的对比可以得出以下的结 论:
(1)蒙牛纯牛奶的PI约为:pH=5.5 (2)蒙牛纯牛奶对酸比较地敏感,在接近等电
探究牛奶凝固原因
——(pH对白质变性原理 2、掌握调节溶液pH值的方法
二、实验原理 1、蛋白质的结构:蛋白质由氨基酸按照 一定顺序排序卷曲组成,作用力:由氢键、 静电力、范德华力、二硫键等化学键铆钉 形成一定的固定结构。
2、一般的蛋白质疏水性氨基酸包裹 在内,亲水性氨基酸包裹在外,使 其具有稳定性和溶解度。长时间加 热可破坏蛋白质的三级结构,蛋白 质聚沉。 3、牛奶中含有约3.3%的蛋白质,其 中约82%是酪蛋白,酪蛋白主要分为 四种:α-s1型、 α-s2型、β型和κ型。 在牛奶中,酪蛋白大多是以结合成 一个一个的颗粒束的形式存在。
4、酪蛋白的性质:酪蛋白是一种含磷钙 的结合蛋白,对酸敏感,对碱不敏感,在 pH较低会发生沉淀,主要存在于哺乳动物 的奶中。
牛奶中蛋白质的检测方法

牛奶中蛋白质的检测方法
牛奶那可是咱生活中的好东西呀!可你知道怎么检测牛奶中的蛋白质不?嘿,其实有个超简单的办法!先取一点牛奶样品,然后加入特定的试剂,哇塞,就像变魔法一样,如果出现了某种颜色变化,那就说明有蛋白质存在呢!这过程超有趣,就像在玩一场神秘的实验游戏。
在检测过程中,安全性那是杠杠的!只要你按照正确的步骤来,根本不用担心会出啥问题。
稳定性也不错哦,每次的结果都比较靠谱呢。
那这检测方法能用在啥地方呢?比如说食品加工厂,他们得保证牛奶的质量呀!还有那些检测机构,也得靠这个方法来把关呢。
优势可多啦,简单快捷,成本也不高。
我给你讲个实际案例哈。
有个小工厂,以前不知道牛奶质量咋样,用了这个检测方法后,一下子就清楚了自己的产品情况。
哇,效果那叫一个好!可以及时调整生产,提高产品质量。
所以呀,牛奶中蛋白质的检测方法真的超棒!既安全又稳定,应用场景广泛,优势明显。
咱可得好好利用这个方法,让我们喝到更放心的牛奶。
牛奶蛋白质实验报告

一、实验目的1. 学习从牛奶中提取蛋白质的方法。
2. 了解蛋白质的等电点特性及其在提取过程中的应用。
3. 掌握蛋白质的鉴定方法,包括颜色反应和分子量测定。
二、实验原理牛奶是一种复杂的胶体溶液,其中含有多种蛋白质。
蛋白质是一种两性化合物,其溶解度受溶液pH值的影响。
当溶液pH值达到蛋白质的等电点时,蛋白质所带正、负电荷相等,呈电中性,此时蛋白质的溶解度最小,会以沉淀形式从溶液中析出。
根据这一原理,本实验采用调节牛奶pH值至蛋白质等电点的方法,从牛奶中提取蛋白质。
蛋白质的鉴定方法主要包括颜色反应和分子量测定。
颜色反应是通过蛋白质与特定试剂发生反应,产生特定颜色的化合物来鉴定蛋白质。
本实验中,我们采用了缩二脲反应、蛋白黄色反应和茚三酮反应来鉴定蛋白质。
分子量测定则采用SDS-聚丙烯酰胺凝胶垂直板电泳法,通过建立标准曲线,测定蛋白质的分子量。
三、实验材料与试剂1. 实验材料:新鲜牛奶、离心管、烧杯、移液器、pH计、电泳仪、凝胶成像系统等。
2. 实验试剂:0.2mol/L pH4.7醋酸-醋酸钠缓冲液、95%乙醇、无水乙醚、双缩脲试剂、硝酸、茚三酮试剂、SDS、丙烯酰胺、甲叉双丙烯酰胺、Tris、甘氨酸、十二烷基硫酸钠等。
四、实验步骤1. 调节牛奶pH值:取50mL新鲜牛奶于150mL烧杯中,用pH计测定牛奶pH值,逐渐加入0.2mol/L pH4.7醋酸-醋酸钠缓冲液,直至pH值达到4.7,观察蛋白质沉淀现象。
2. 离心分离:将混合物转入离心管中,于3000r/min离心15min,收集沉淀。
3. 洗涤沉淀:用去离子水洗涤沉淀2次,离心去除水分。
4. 酶解:将沉淀溶于适量95%乙醇中,加入蛋白酶,于37℃恒温酶解2h。
5. 蛋白质鉴定:取适量酶解液,分别加入双缩脲试剂、硝酸和茚三酮试剂,观察颜色变化。
6. 蛋白质分子量测定:配制SDS-聚丙烯酰胺凝胶,将酶解液加入凝胶孔中,进行SDS-聚丙烯酰胺凝胶垂直板电泳。
牛奶中的蛋白质种类分析与测定

牛奶中的蛋白质种类分析与测定牛奶是人类常用的营养食品之一。
它是良好的蛋白质来源,其中的蛋白质种类多种多样。
在医学和营养学研究中,对牛奶中蛋白质种类的测量和分析具有重要意义。
一、牛奶中的蛋白质种类牛奶中主要含有两类蛋白质:酪蛋白和乳清蛋白。
酪蛋白(casein)是牛奶中主要的蛋白质。
它约占牛奶中蛋白质总量的80%,并呈不溶性状态。
酪蛋白是由磷酸酪氨酸、酪氨酸、丝氨酸和脯氨酸等四种氨基酸组成的多肽,能够凝固形成乳凝。
乳清蛋白(whey protein)是另一类主要的牛奶蛋白质,约占牛奶中蛋白质总量的20%左右。
乳清蛋白分为α-乳清蛋白、β-乳清蛋白和结合乳铁蛋白。
其中,α-乳清蛋白和β-乳清蛋白易溶于水,而结合乳铁蛋白则不易溶。
此外,牛奶中还含有少量的免疫球蛋白、酪肽、β-胡萝卜素结合蛋白、乳糖结合蛋白等其他蛋白质。
二、测定牛奶中蛋白质种类的方法目前常用的测定牛奶中蛋白质种类的方法主要有两种:电泳和色谱。
电泳是一种基于蛋白质在电场中运动速度不同而分离的技术。
电泳可分为凝胶电泳和毛细管电泳两种。
凝胶电泳是将样品涂抹到凝胶板上,然后通电进行分离。
毛细管电泳是将样品注入毛细管中,然后进行电泳分离。
电泳法可以较为准确地分离出酪蛋白和乳清蛋白。
色谱是一种以分离为基础的技术。
常用的色谱有高效液相色谱、气相色谱和离子交换色谱等。
其中,高效液相色谱是常用来分离乳清蛋白的方法。
利用高效液相色谱,可以将α-乳清蛋白、β-乳清蛋白和结合乳铁蛋白等不同种类的蛋白质分离出来。
三、蛋白质测定的意义对牛奶中蛋白质种类的测量和分析具有重要意义。
首先,了解牛奶中蛋白质的种类和含量,有助于合理地选择和使用牛奶及其制品。
酪蛋白和乳清蛋白的营养成分和功能不同,不同的人群可以根据自己的需要选择哪种蛋白质更适合。
其次,对牛奶中蛋白质种类的分析,有利于研究奶制品的品质和安全性。
不同种类的奶制品,其蛋白质种类和含量有所不同,对于奶制品的生产和质量控制具有很大的参考价值。
牛奶蛋白实验报告

一、实验目的1. 学习从牛奶中提取蛋白质的方法;2. 掌握蛋白质的鉴定方法;3. 了解牛奶蛋白的成分和性质。
二、实验原理牛奶是一种含有多种营养成分的乳制品,其中蛋白质是重要的营养成分之一。
牛奶蛋白主要包括酪蛋白、乳清蛋白和乳球蛋白等。
本实验采用酸沉淀法从牛奶中提取蛋白质,并通过颜色反应、SDS-聚丙烯酰胺凝胶电泳等方法对提取的蛋白质进行鉴定。
三、实验材料与仪器1. 实验材料:新鲜牛奶、醋酸、氢氧化钠、硝酸、茚三酮、SDS、聚丙烯酰胺凝胶、凝胶成像系统等;2. 实验仪器:烧杯、玻璃棒、离心机、pH计、电子天平、电泳仪、凝胶成像系统等。
四、实验步骤1. 提取牛奶蛋白(1)称取10g新鲜牛奶,加入50mL烧杯中;(2)用玻璃棒搅拌,缓慢加入1mol/L的醋酸溶液,使pH值降至4.5;(3)继续搅拌,观察白色沉淀的形成;(4)将混合物转移至离心管中,于3000r/min离心10min;(5)弃去上清液,保留沉淀;(6)将沉淀用蒸馏水洗涤两次,去除杂质;(7)将沉淀转移至烧杯中,加入适量的蒸馏水,用玻璃棒搅拌溶解。
2. 鉴定牛奶蛋白(1)颜色反应鉴定① 取1mL提取的牛奶蛋白溶液,加入1mL 0.1mol/L的氢氧化钠溶液,观察颜色变化;② 取1mL提取的牛奶蛋白溶液,加入1mL 0.1mol/L的硝酸溶液,观察颜色变化;③ 取1mL提取的牛奶蛋白溶液,加入1mL茚三酮溶液,加热至50℃,观察颜色变化。
(2)SDS-聚丙烯酰胺凝胶电泳鉴定① 准备SDS-聚丙烯酰胺凝胶;② 将提取的牛奶蛋白溶液加入样品缓冲液,混匀;③ 加热样品至95℃,使蛋白质变性;④ 将样品加入凝胶孔中,进行电泳;⑤ 电泳结束后,用凝胶成像系统观察蛋白质条带。
五、实验结果与分析1. 颜色反应鉴定结果(1)加入氢氧化钠溶液后,牛奶蛋白溶液呈现红褐色;(2)加入硝酸溶液后,牛奶蛋白溶液呈现黄色;(3)加入茚三酮溶液后,加热至50℃,牛奶蛋白溶液呈现蓝紫色。
凯氏定氮法测定牛奶中蛋白质的含量

编号新疆农业职业技术学院半微量凯氏定氮法测定牛奶中蛋白质的含量开题报告分院名称园林科技学院专业食品营养与检测班级 2010 级食检 (4) 班学生姓名张倩茹指导教师张军老师2012年9 月25日论文题目:半微量凯氏定氮法测定牛奶中蛋白质的含量1.立论依据(包括课题的研究意义,国内外研究现状分析,附主要的参考文献)1.1研究意义2008年毒奶粉事件再次敲响了食品安全的警钟,不法分子为了提高掺水牛奶中蛋白质的含量,添加工业原料三聚氰胺,由于我国现行标准GB/T5009.5-2003食品中蛋白质的测定》中的2种方法“凯氏定氮法”和杜马斯(Dumas)燃烧法只能测出含氮量,然后根据氮元素与蛋白质换算系数计算蛋白质的含量,但并不能区分牛奶硝化后氮的来源,如果添加违规化学物质,就可以测出较高的“蛋白质含量”。
三聚氰胺并非惟一的替代添加物,只要含氮量大于牛奶中蛋白质的化学物质,且性状和价格具备条件,在理论上都存在被不法分子利用的可能性。
蛋白质(protein)是生命的物质基础,没有蛋白质就没有生命。
因此,它是与生命及与各种形式的生命活动紧密联系在一起的物质。
机体中的每一个细胞和所有重要组成部分都有蛋白质参与1.2国内外研究现状分析蛋白质是构成生物体细胞组织的重要成分。
食物中的蛋白质是人体中氮的惟一来源, 具有糖类和脂肪不可替代的作用。
蛋白质与营养代谢、细胞结构、酶、激素、病毒、免疫、物质运转和遗传等密切相关, 其分离与定性、定量分析是生物化学和其他生物学科、食品检验、临床检验、诊断疾病、生物药物分离提纯和质量检验中最重要的工作。
随着分析手段的不断进步, 对食品中蛋白质含量的测定方法也正向准确和快速的方向发展。
1.3参考文献1]黄梅兰、苏艳华、林会松凯氏定氮法消化装置的改进[期刊论文] -中国卫生检验杂志2001(06)[2]刘玉兰、李珊、刘坤食品中蛋白质含量测定方法的改进和应用[期刊论文] -青岛医学院学报1999(02)[3]试析食品中蛋白质含量的测定方法- 广西质量监督导报 - 2008(9)[4]浅谈食品中蛋白质含量的测定 - 计量与测试技术 - 2009, 36(9)[5]食品中蛋白质含量测定方法的改进和应用 - 青岛医学院学报 - 1999, 35(2)[6]一种蛋白质含量测定方法的改进研究 - 饲料工业 - 2005, 26(18)[7]食品中蛋白质测定方法的改进 - 现代食品科技 - 2010, 26(7)[8]路苹. 蛋白质测定方法评价[J] . 北京农学院学报, 2006( 21) : 65- 69.[9]宗留香. 半微量凯氏定氮法测定蛋白质工艺的改进[J] .食品工业科技, 2007, 5: 232- 234.[10]瞿鹏.、孔晓朵、蛋白质测定的研究进展[J] . 商丘师范学院学报, 2002, 18 ( 2) : 107- 110.2.研究方案2.1研究目标牛奶中蛋白质含量的测定2.2研究内容半微量凯氏定氮法测定干酵母片中蛋白质的含量2.3拟解决的关键问题凯氏定氮法并不能完全解决蛋白质的检测问题,因为所测定的氮可能不仅仅是由蛋白质转化来的。
牛奶提取蛋白质实验报告

一、实验目的1. 了解牛奶中蛋白质的组成和特性。
2. 掌握从牛奶中提取蛋白质的原理和方法。
3. 熟悉蛋白质的鉴定技术。
二、实验原理牛奶中的蛋白质主要分为乳清蛋白和酪蛋白,其中乳清蛋白含量约为18%,酪蛋白含量约为80%。
蛋白质是一类具有两性性质的有机化合物,由氨基酸通过肽键连接而成。
在特定条件下,蛋白质可以发生变性、沉淀、凝固等性质变化。
本实验采用等电点沉淀法从牛奶中提取蛋白质。
等电点是指蛋白质分子所带正、负电荷相等,呈电中性的pH值。
在此pH值下,蛋白质的溶解度最低,容易从溶液中析出。
通过调节牛奶的pH值至酪蛋白的等电点(pH 4.6-4.7),可以使酪蛋白沉淀出来,从而实现蛋白质的提取。
三、实验材料与试剂1. 实验材料:新鲜牛奶、蒸馏水、稀盐酸、氢氧化钠、醋酸、无水乙醇、乙醚、硫酸铜、硫酸锌、三氯乙酸、茚三酮等。
2. 试剂:0.1mol/L氢氧化钠溶液、0.1mol/L盐酸溶液、0.1mol/L醋酸溶液、0.1mol/L硫酸铜溶液、0.1mol/L硫酸锌溶液、0.1mol/L三氯乙酸溶液、0.1mol/L茚三酮溶液等。
四、实验步骤1. 准备实验器材:烧杯、玻璃棒、滴定管、pH计、离心机、离心管、抽滤装置等。
2. 将新鲜牛奶加热至40℃。
3. 在搅拌的同时,缓慢加入预热至40℃的0.1mol/L醋酸溶液,使牛奶的pH值调节至4.6-4.7。
4. 将混合液冷却至室温,观察酪蛋白沉淀的形成。
5. 将混合液转入离心管中,以3000r/min的转速离心15分钟。
6. 弃去上清液,保留沉淀物。
7. 将沉淀物用蒸馏水洗涤三次,弃去洗涤液。
8. 将沉淀物加入适量无水乙醇,搅拌,然后转移至布氏漏斗中抽滤。
9. 将抽滤后的沉淀物用乙醚洗涤两次,弃去洗涤液。
10. 将沉淀物风干,得到蛋白质提取物。
11. 将蛋白质提取物进行鉴定。
五、实验结果与分析1. 蛋白质鉴定(1)缩二脲反应:取少量蛋白质提取物,加入适量的0.1mol/L硫酸铜溶液,观察是否产生红紫色络合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Keywords: Dairy products; casein; beta-lactoglobulind; ELISA
目
录
摘Leabharlann 要 ............................................................................................................................................. I
第1章
1.1 引言
绪
论
随着人们生活水平的提高及对健 康生活概念的重视,在我 国,牛 奶的消费量 每年都在急速增长。与此同 时,由奶产业带 来的巨大经济效益 ,刺激了市场上奶 制品生产企业的大量产生,同时激起了剧烈的竞 争。以造假 、掺 假等方式来盈利 也成为了屡禁不止的盈利方式。 原料奶作为牛奶生产厂家的基本 原料, 其质量控制在质量管 理中 是至关重要 的一节。如果这个环节出现 问题,那么无论 后续的控制方法多么 先进、控制手段 多么严格,都只能是事倍功 半。目前奶行业 中通用的检测方法是 凯氏定氮法,其 通过检测样品中氮元素的含量来 间接计算蛋白质的含 量, 这种方 法因测定结果的 准确稳定且重复性强等方面的优 点而被国内外所广泛 采用和认可 , 但该方法存在 着操作繁琐、试剂消耗量大 、操作过程费水 、费电、费时等缺 点 , 在消化的同时 排放出来的二氧化硫以及硫化氢 等有害气体,还会造 成环境污染 , 危害人体健 康 [1] ;最重要的是 ,这种间接的检测技 术,为造假者 提供了生存 空间。因此,亟 待一种新型快速有效的牛奶质量 检测技术 的应用。
I
北京理工大学本科生毕业论文
melamine, cyanuric acid, urea and soybean meal was less than 15 % which was in line with the requirements of analysis of biological samples . Thus, this detection technology contains the advantages that high accuracy, data reliability and anti-interference ability. The application of this technology provides a new reliable method for the detection of protein.
II
北京理工大学本科生毕业论文
3.1 快速检测牛乳中蛋白质方法的精密度检测 ............................................................. 10 3.2 快速检测牛乳中蛋白质方法的准确度检测 ..............................................................11 3.3 抗干扰实验 ....................................................................................................................11 第 4 章 实验结果与讨论 ........................................................................................................... 12 4.1 快速检测牛乳中蛋白质方法的精密度检测 ............................................................. 12 4.2 快速检测牛乳中蛋白质方法的准确度检测 ............................................................. 14 4.3 抗干扰实验 ................................................................................................................... 18 第五章 总结................................................................................................................................ 21 致 谢 .......................................................................................................................................... 22
ABSTRACT ................................................................................................................................... I 目 录 ........................................................................................................................................... II 绪 论 ........................................................................................................................... 1
参考文献 ...................................................................................................................................... 23
III
北京理工大学本科生毕业论文
第1章
1.1 引言 ...................................................................................................................................... 1 1.2 奶制品蛋白质检测方法的研究进展 ................................................................................ 1 1.3 ELISA 技术简介 ............................................................................................................... 4 1.4 研究内容和意义 ................................................................................................................. 6 第 2 章 实验试剂与仪器 ............................................................................................................. 8 2.1 试剂列表 ....................................................................................................................... 8 2.2 实验仪器 ....................................................................................................................... 8 2.3 溶液的配制 ................................................................................................................... 9 第 3 章 实验方法与步骤 ........................................................................................................... 10
关键词:奶制品;酪蛋白; β - 乳球蛋白; ELISA
Abstract
This article first made a summary of the last decade of milk adulteration detection technology at home and abroad through aspects of physics, chemistry and biology. Then, based on ELISA technique, removed the lipid layer by centrifugal effect, optimized experimental conditions of consistence of antibody, reacting time, temperature etc. Designed an experiment to testing casein and lactoglobulin at the same time. Evaluated its precision and accuracy. Added melamine, cyanuric acid, urea and soybean meal to test the specific of the technology through interference. The results show that the cubicle error of dual protein through ELISA detection was 2.9 % and the rate of recovery was 97.98 % ± 6.4%. These results were better than others detections which precision were about 10 %. The max error coursed by
