豆制品中胰蛋白酶抑制剂活性测定方法研究
胰蛋白酶或抑制剂分离、纯化综合分析

实验胰蛋白酶或抑制剂分离、纯化在动物胰脏中,胰蛋白酶是以无活性的酶原状态存在的。
在生理条件下,胰蛋白酶原随胰液分泌至十二指肠后,在小肠上腔有Ca2+的环境中,为肠激酶或胰蛋白酶所激活,其肽链N -端的赖氨酸与异亮氨酸之间的一个肽键被水解,失去一个酸性6肽,其分子构象发生一定的改变后转变为具有催化蛋白质水解活性的胰蛋白酶。
胰蛋白酶原分子量约为24 000,其等电点为pH8.9;胰蛋白酶的分子量约为23 400,其等电点为pH 10.8。
胰蛋白酶在pH3.0时最稳定,其浓溶液可贮存于冰箱(0℃以下)数周而活性无显著丧失。
pH<3时,胰蛋白酶易变性。
PH>5时,胰蛋白酶易自溶。
胰蛋白酶催化活性的最适pH为7.6~7.8。
重金属离子、有机磷化合物和反应产物都能抑制胰蛋白酶的活性。
胰脏、卵清和大豆中也含有一些蛋白质对胰蛋白酶活性具有抑制作用。
实验(一)胰蛋白酶活性测定[原理]胰蛋白酶能催化蛋白质的水解,对于由碱性氨基酸(如精氨酸、赖氨酸)的羧基与其他氨基酸的氨基所形成的肽键具有高度的专一性。
此外,胰蛋白酶也能催化由碱性氨基酸的羧基所形成的酰胺键和酯键,有高度的专一性仍表现为对碱性氨基酸羧基一侧的选择对此等化学键的催化水解活性的敏感度为:酯键>酰胺键>肽键。
因此,可以利用含有这些化学键中任一种键型的底物来研究胰蛋白酶的专一催化活性。
本实验方法一采用N-苯甲酰-L-精氨酸乙酯[(BAEE),N-benzoyl-L-arginine ethyl ester]作为底物,水解反应如下:N-苯甲酰-L-精氨酸乙酯(BAEE)在波长253nm下的紫外光吸收远远弱于N-苯甲酰-L-精氨酸[(BA),benzoyl-L-arginine]的紫外光吸收。
在胰蛋白酶的催化下,BAEE随着酯键的水解,水解产物BA逐渐增多,反应体系的紫外光吸收亦随之相应增加,以△A253nm计算胰蛋白酶的活性。
胰蛋白酶的BAEE单位定义为:以BAEE为底物,在一定反应条件下,每分钟使△A253nm 增加0.001的酶量为一个BAEE单位。
碱性蛋白酶钝化胰蛋白酶抑制剂的研究

酶用量 底物浓 度 钝化率 ( L/ U g ) ( %) ( %)
1 5 0. 1 5 0. 4. 6 8 4. 6 8 4. 6 8 4. 6 8 1.4 6 1 1.4 6 1 1.4 6 1 1 .4 6 1 1 5 0. 0 1 5 0. 0 1 5 0. 0 1 5 0. 0 2 0 1 1 6 5. 2 16 .2 1 7 0. 5 1 7 0. 5 1 7 0. 5 1 7 0. 5 1 7 0. 5 1 7 0. 5 1 7 0. 5 1 7 0. 5 4 1 .2 4 1 .2 4 1 .2 4 1 .2 4 1 .2 4 1 .2 6 6 8. 5 9 .2 3 6 .4 5 5 0. 1 0 2. 5 7 7 4. 0 1 2 5. 8 5 3 4. 0 2 9 7. 5 7 21 5. 3 1 2. 9 7. 0 1 1 9 7. 0 1 8 5. 6 1 9 7. 8 1 2 8. 6
液 ,准 确 计 时 1mn 后 , 加 入 0i 0 5 3 %醋酸终止反应 ,40 m 比 .mL 0 1n
色。按同样方 法同时测定空白溶 液, 只是先加 入 3 %醋 酸 ,然 后加入牛 0 胰蛋白酶溶液。每一个待测样设 3 个
<油 工 食 机 > o 1 圆 粮 加 与 品 械z  ̄ 2 o z 期
维普资讯
糕
重复试验 ,结果取平均值。
④无糖豆粉溶液的水解。将无糖
豆粉 配制 成一 定 浓度 的 溶液 ,倒 入 水
・
开 发研 究 ・
式中 ,)为 . J
吸光度;z为浓 试验号
度。
大豆中的胰蛋白酶抑制剂及其提取方法解读

大豆中的胰蛋白酶抑制剂及其提取方法解读大豆中的胰蛋白酶抑制剂是一种重要的生物活性物质,它能够抑制胰蛋白酶的活性,从而保护大豆不受胰蛋白酶的分解。
这种抑制剂在食品、医药等领域都有广泛的应用。
为了提取大豆中的胰蛋白酶抑制剂,可以采用以下步骤:1. 制备大豆胰蛋白酶抑制剂初级上清液:将干大豆加水浸泡过夜后磨碎并充分混匀成浆液,然后搅拌后加溶液用3层以上的纱布过滤,得到滤液和豆渣。
接着以2-5:1.5的比例添加柠檬酸钠和磷酸三钠,直至滤液ph值达到4.5~6.0,对添加柠檬酸钠和磷酸三钠后的滤液进行浸提并水浴,水浴后离心去除杂蛋白,得到初级上清液。
2. 制备大豆胰蛋白酶抑制剂粗提物:将初级上清液加热,并在上清液中添加硫酸铵,直至硫酸铵浓度30%,搅拌后得到次级搅拌液。
将次级搅拌液用滤纸过滤去脂,并将滤液静置过夜,即可得到粗提上清液。
在粗提上清液中加入硫酸铵,直至硫酸铵浓度50%,搅拌沉淀后得到大豆胰蛋白酶抑制剂粗提物。
以上步骤完成后,就可以提取到大豆中的胰蛋白酶抑制剂。
这种抑制剂的应用可以保护大豆不受胰蛋白酶的分解,同时也可以应用到食品、医药等领域中。
在提取过程中,需要严格控制各个步骤中的条件和操作,以保证提取的质量和效率。
除了作为食品和医药领域的原料,大豆胰蛋白酶抑制剂还可以用于研究胰蛋白酶的活性及其作用机制。
通过进一步纯化大豆胰蛋白酶抑制剂,可以获得更高纯度的抑制剂,从而更好地了解其结构和功能。
此外,大豆胰蛋白酶抑制剂的研究还可以与人工智能技术相结合,开发出更加智能化的方法来提取和纯化这种抑制剂。
例如,可以利用人工智能算法预测大豆胰蛋白酶抑制剂的活性,优化提取和纯化过程,提高抑制剂的产量和质量。
此外,大豆胰蛋白酶抑制剂的活性研究还可以与营养学、生理学等领域相结合,研究其在人体内的生理作用和营养价值。
例如,可以研究大豆胰蛋白酶抑制剂对人体肠道健康的影响,以及其在预防和治疗某些疾病方面的应用。
同时,大豆胰蛋白酶抑制剂的研究还可以与农业领域相结合,开发出更加环保和高效的农业生产方式。
大豆制品中脲酶活性的测定

制作人:刘力、李亚杰
背景
大豆制品中含有大量抗营养因子,影响到动物的正常生长 发育。其中最主要的是胰蛋白酶抑制因子,不耐热,但在 点击添加标题 生产加工过程中,过度的加热在灭活抗营养因子的同时, 导致蛋白质变性,特别是赖氨酸、精氨酸和胱氨酸等严重 点击添加标题 变性,大大降低了大豆制品的消化率和生物学价值。抗胰 蛋白酶活性是直接反映大豆制品中抗营养因子水平及加热 程度的可靠指标,但由于该法费时、所用试剂昂贵,在生 点击添加标题 产上不适用。而脲酶活性与抗胰蛋白酶活性呈高度正相关, 方法较简便、快速、经济,国内外常用脲酶活性作为检验 点击添加标题 大豆制品加热程度和抗营养因子水平的判断指标。
注意事项
若样品粗脂肪含量高于 点击添加标题 10%,则应先进行不 加热的脱脂处理后,在测定脲酶活性; 点击添加标题 称量样品时,一定要将样品混合均匀,否则 会造成试验误差; 点击添加标题 试样和空白试验同时操作,过程要迅速,防 止时间影响。 点击添加标题
问题
反应时间(30min )对脲酶活性是否有影响? 点击添加标题
仪器设备
粉碎机:粉碎时应不生强热,如球 点击添加标题 磨机。
点击添加标题 点击添加标题
点击添加标题
测定步骤
样品中脲酶活性的测定:称取0.2 g(准确至0.0001 g)样品(如果活性很
高,可称取0.05 g试样)玻璃试管中,加10 mL尿素缓冲液,立即盖好试管 盖剧烈振摇后,马上置于30±0.5 ℃水浴锅内,准确计30 min±10 s。取下 点击添加标题 后立即加入10 mL盐酸(0.1 mol/L),振摇后迅速冷却至20℃,将试管内容 物全部转入50 mL烧杯中,用20 mL蒸馏水冲洗数次,以0.1 mL的氢氧化钠 标准滴定溶液用酸度计滴定至 pH 4.70。记录氢氧化钠标准滴定溶液消耗量。 点击添加标题 如果选用指示剂,试管中内容物全部移入250 mL锥形瓶中,滴加8~10滴混 合指示剂,以0.1 mol/L氢氧化钠标准滴定溶液滴定至蓝绿色,记录氢氧化 点击添加标题 钠滴定溶液消耗量。 空白测定:称取样品后立即加入10 mL盐酸溶液,之后不加。
大豆制品中胰蛋白酶抑制剂失活方法的研究进展

因而在加工 中一般以 S T I 的残 留活性来衡量大豆制品抗营养因子的残 留活性 。H a c k l e r 等的研究认为,当 S T I 的活性损失 9 0 %以上,大豆制品才能达到其最高的营养价值 ,即最大的蛋白质效率 比值,方可认为该
制品 是安全 的 ቤተ መጻሕፍቲ ባይዱ
2大 豆胰蛋 白酶 抑制剂的结 构
大豆制品 中胰蛋 白酶抑制剂失活方法的研究进展
陈 婉
( 福建 中检 华 日食品安全检测有限公司,福建 福州 3 5 0 0 0 2 ) 摘 要 :大 豆胰 蛋 白酶抑 制剂是大 豆 中主要 的抗 营养因子,降低 了大 豆制品的营养 质量和食 用安全性,在大豆制 品加
工过程 中必须 使其失活 。介绍 了通过 热处理 、微 波技术 、压力处理 、超 声波处理 、高压 脉冲 电场 、化学还原 、酚类化合物 络合 、酶法水 解 、微生物发酵及 亲和色谱分离 等钝化 大豆胰 蛋 白酶抑制剂的方法 。 关键词 :大豆;胰蛋 白酶抑 制剂;失活 中图分类号:Q 5 0 3 文献标识码 : A 文章编号 :1 6 7 3 - 1 4 1 7( 2 0 1 3 )0 2 ・ 0 0 2 4 - 0 6
3 失活方法
3 . 1物理方法失活
3 . 1 . 1热 处理
收稿 日期:2 0 1 3 — 0 1 — 2 O 作者简介:陈 婉 ( 1 9 8 2 一) ,女,福建漳州人,助理工程师,本科。主要研究方向:食品检测与加工・
第 2期
陈 婉 :大豆制品中胰蛋白酶抑制剂失活方法的研究进展
豆 奶 中热 处理对 S T I 活性 的 影 响,结 果 发 现热 处理 导致 豆奶 中蛋 白质 巯 基 的变 化 从而 引起 蛋 白质组 分的 变
豆制品中胰蛋白酶抑制剂的研究

·食品科技·豆制品中胰蛋白酶抑制剂的研究杨丽杰吴非霍贵成孙占海(东北农业大学)【摘要】对豆制品中胰蛋白酶抑制剂活性进行了调查,发现水解蛋白、乳用蛋白、组织蛋白、水豆腐、干豆腐中胰蛋白酶抑制剂活性均被钝化了以上;对腐乳、豆酱中胰蛋白酶抑制剂活性进行检测,结果未检出。
无糖豆粉、豆粉、豆浆以及内酯豆腐中胰蛋白酶抑制剂钝化率低于。
比较了种热处理方式对胰蛋白酶抑制剂的钝化效果,得到巴氏杀菌可钝化胰蛋白酶抑制剂;高压杀菌可钝化,超高温灭菌可钝化。
【关键词】豆制品;胰蛋白酶抑制剂;热处理中图分类号:文献标识码:文章编号:()大豆营养价值高,是人和动物的主要蛋白质来源,但其中含有胰蛋白酶抑制剂,有碍营养素的吸收,导致食用后身体不适或豆制食品感官上的缺陷,严重时会造成人或动物的死亡。
豆制品中胰蛋白酶抑制剂的存在还没有引起人们足够的重视。
目前失活胰蛋白酶抑制剂主要采用热处理,为达到彻底钝化而采用的过度加热可使大豆中的蛋白质溶解度降低,营养物质遭到破坏。
而且,胰蛋白酶抑制剂比较耐热,热处理的效果也很有限。
本研究对市场上多种豆制品中胰蛋白酶抑制剂活性进行了测定调查,比较了常用热处理方式对胰蛋白酶抑制剂的钝化效果,有利于人们对豆制品安全性的认识,为更彻底地失活胰蛋白酶抑制剂提供依据。
材料与方法材料与设备腐乳、干豆腐、内酯豆腐、豆浆、水豆腐、豆酱、豆粉为市售;无糖豆粉、水解蛋白、乳用蛋白、组织蛋白为大豆蛋白食品公司提供;生豆粉为实验室自备;所用化学试剂为分析纯或生化试剂。
牛胰蛋白酶、、均由美国公司生产。
仪器设备:振荡培养箱(上海医用仪表厂)、离心机(北京医用离心机厂)、型凯氏定氮仪(北京宜兴科教仪器研究所)、多功能恒温水浴锅型(沈阳市医疗器械厂)、紫外可见分光光度计型(日本岛津公司)、高压灭菌器(上海医用核子仪器厂)。
试验方法豆制品中常规营养成分测定d水分含量测定:常压干燥法。
i粗蛋白测定:微量凯式定氮法。
发酵豆粕脲酶活性、胰蛋白酶抑制因子、凝集素和大豆抗原的测定研(精)

发酵豆粕脲酶活性、胰蛋白酶抑制因子、凝集素和大豆抗原的测定研究彭辉才1粱明振1’张宏福2(1广西大学动物科技学院,广西南宁530005;2北京畜牧兽医研究所营养学国家重点实验室, 北京海淀区100094摘要:豆粕中最主要的抗营养因子是胰蛋白酶抑制因子、凝集素和大豆抗原;本试验对8种发酵豆粕进行测定,前两者含量极低未检出。
用SDS-PAGE凝胶电泳定性检测大豆抗原中的B一伴大豆球蛋白(B--Conglycinin和大豆球蛋白(Glycinin,6种条带模糊,抗原消失,结果表明,生物发酵是一种有效的钝化抗营养因子的方法。
关健词:胰蛋白酶抑制因子凝集素13一伴大豆球蛋白大豆球蛋白测定发酵豆粕指是通过现代生物发酵技术对原料豆粕进行发酵处理后的产物。
发酵过程中可产生蛋白酶、非淀粉多糖酶和植酸酶等多种酶活,其目的就是消除抗营养因子,把大分子量的大豆蛋白质分解为多肽、寡肽、小肽,从而增加水溶性,提高消化率,利于动物消化吸收。
这些酶把纤维类物质分解为糖,部分糖被转化为乳酸,并产生大量有益微生物,使豆粕转化成高营养价值的功能性饲料。
发酵豆柏可替代日粮中血浆蛋白粉、鱼粉、肠膜蛋白和乳清粉等动物性饲料原料,可替代日粮中控制腹泻的预防性抗生素,大大降低生产成本,减少畜禽养殖对动物性饲料原料的依赖,杜绝动物性饲料原料所带来的疾病传播,提高养殖业的安全与效益。
大豆的抗营养因子有蛋白酶抑制因子(protease inhibitors,大豆凝集素(SBA、大豆抗原、非淀粉多糖(NSP、植酸(phytic acid、单宁、大豆寡糖、脲酶、.大豆异黄酮、大豆皂甙、致甲状腺肿因子、生氰糖甙等。
这些抗营养因子会导致人和动物胰腺肿大、过敏反应、生长缓慢、日粮养分利用率下降以及其他一些不良生理反应。
本试验测定起主要抗营养作用的胰蛋白酶抑制因子、凝集素及大豆抗原中的大豆球蛋白和B一伴大豆球蛋白。
1材料与方法1.1腮酶的测定脲酶活性测定参照国标GB8622--88执行。
酶法钝化大豆胰蛋白酶抑制剂研究

2结果与讨论
21蛋 白酶活 力 .
21 标 准 曲 线 制 作 .1 .
收稿 日期 : 02-5-5 20-0-0 - -
维普资讯
1 0
粮套 与油脂
S 0
20 第 6期 02年
表 2 酪氨酶溶液浓度 ( 与吸光值 ( 关系 c) A)
时1 0分钟 后, 加入 05 升 3 % 醋 酸终 止反应 , 1 m 比 毫 0 4 0n 色。按 同样方法同时测定空白溶 液, 只是先加入 3 % 醋酸 , 0
0前言
大豆 是优质植物蛋 白源 , 需氨基酸丰 富平衡, 必 但其中
含 有的 胰蛋 白酶 抑制 剂会苊 害人体 健康 , 造成营 养价值 下 降。胰 蛋 白酶 抑制剂对人 的危害主要 是抑制人体分泌 胰蛋 白酶 , 因此食用 未完全去 陈胰蛋 白酶抑制 剂的豆 制 品时 , 不 仅抑制人体对蛋 白质吸收 , 同时还可能会 引起胰腺肿大等 中 毒症状… [ 。本 文 目的就在于 从几种常用 酶 中筛选 出能 够 水解胰蛋 白酶抑制剂的最佳酶, 从而 为食品领域钝化豆制品
一
邑6 0
耋4 0
啻 2 0
吸 光值 A 为纵 坐 标 , 氨 酸浓 度 C p / )为横 坐 酪 (gm1
标, 绘制标准 曲线 , 如图 1
1材料与方法
11材料 . 低温 脱脂豆 粕 由黑龙 江三江 食 品公司提 供 : 中性蛋 白 酶、 碱性 蛋 白酶、 酸性 蛋 白酶和 木瓜蛋 白酶 均 由广东江 门酶
制剂公司提供。 试剂 :睫蛋 白酶 (ima公司) B P Sg 、 A NA(ima公司) Sg 、 福林试 剂 ( 京鼎 国生物 技术发 展 中心 )T i( 北 r 上海 华舜生 s
胰蛋白酶抑制因子的测定方法

胰蛋白酶抑制因子的测定方法:称取1g 样品( 液体也以质量称取), 每1g 样品用50ml 0.01 mol/L 的氢氧化钠溶液提取3h( 搅拌),样品的最大用量约为1g 。
分别吸取0 、0 . 6 、1 . 0 、1 . 4 、1 . 8 、2 . 0ml 的上层提取液注入2 组试管中, 并加水稀释至2ml. 分别加入2ml 胰蛋白酶溶液于每支试管中, 混匀。
在加入5ml 预热至37 ℃的BAPNA溶液,并严格地于10min 后加入1ml 醋酸溶液并混匀,已停止反应。
将内容物过滤, 并于410nm 出测定光密度值。
对于空白对照管, 是取2ml 样本提取液加5ml BAPNA试剂并保温在37 ℃10min , 然后加入1ml 醋酸溶液及2ml 胰蛋白酶溶液.活力的表示方法:一个胰蛋白酶单位(AU), 是10ml 反映溶液在本文叙述的条件下,于410nm 处测得反映前后所增加0.01光密度为1 单位( Absorbance Unit),胰蛋白酶抑制剂活力用胰蛋白酶抑制剂单位( TLU) 表示。
结果计算:用TLU ml 对分析所用提取液体积( ml)做标准曲线,并外推到零。
每克样品的TLU 值=延伸值×稀释倍数, 当用分析的提取液的TLU ml 对分析液体积做图并不是直线关系时,则计算出每单位体积提取液中TLU 平均值, 则TLU g 样品=平均值×稀释倍数。
试剂:0 . 05mol/ L tris - CaCl2 溶液( 三羟甲基氨基甲烷缓冲溶液) pH: 8 . 2 溶解6 . 05g 三羟甲基氨基甲烷及2 . 94gCaCl2 . H2O 于约900ml 蒸馏水中, 调节至pH 为8 . 2 ,并用蒸馏水稀释成1L.底物溶液:称取40mg BAPNA溶于1ml 二甲基亚砜中,并用已预热到37 ℃的tris-CaCl2 溶液稀释成100ml 。
胰蛋白酶溶液:称取4mg 胰蛋白酶(不含盐) 溶于200ml 0.001mol/L的HCl 中。
不同方法测定大豆脲酶活性的比较研究

不同方法测定大豆脲酶活性的比较研究杨奇慧舒璐钟剑锋摘要:用滴定法和增值法测定大豆粉在85℃和140℃下分别热处理0、45、90、135、180min的脲酶活性,并用0.2%KOH溶解法测定大豆粉在不同热处理下的蛋白质溶解度。
结果表明:在85℃条件下,处理0~180min 大豆粉的脲酶活性和蛋白质溶解度随着时间延长无明显变化;而在140℃条件下,大豆粉的脲酶活性和蛋白质溶解度随着处理时间的延长显著降低。
通过测定结果可见,同一样品用滴定法和增值法测得的脲酶活性在数值上不相等,不能互用,但蛋白质溶解度更能反映大豆粉受热过度的程度。
关键词:大豆粉;脲酶活性;蛋白质溶解度;pH增值法;滴定法众所周知,大豆含有较丰富的蛋白质、脂肪、碳水化合物等,是饲料生产中主要的植物蛋白质源之一,具有较高营养价值。
但是,大豆中含有多种抗营养因子,如蛋白酶抑制因子、植物凝集素、胃肠胀气因子、抗维生素因子、抗原蛋白等,这些抗营养因子阻碍营养物质在动物体内的利用,尤其是胰蛋白酶抑制因子的存在不仅会降低饲料营养成分的消化率和适口性,而且也会影响动物对蛋白质的消化吸收,对动物生长发育也产生不良的影响。
但是,胰蛋白酶抑制因子的测定较困难,而豆粕中脲酶活性与胰蛋白酶抑制因子活性呈正相关,所以通常通过测定脲酶活性来反映蛋白酶抑制因子的活性。
目前,脲酶活性的测定方法有滴定法(国标法)、pH增值法等,目前,对脲酶活性不同测定方法差异性的研究较少,本文拟对两种方法进行研究,以比较不同方法对测定结果的影响,为实际生产和理论研究提供依据和参考。
1 材料和方法1.1 实验材料大豆粉:将生大豆粉碎,过60目标准筛。
在85℃和140℃下分别处理0、45、90、135和180min冷却后装入封口袋保存备用。
1.2 化学试剂本实验所用试剂均为分析纯(AR),实验用水为蒸馏水。
1.3 测定方法1.3.1 pH增值法实验原理:将研细的试样与尿素缓冲液混合,尿素在尿素酶作用下水解产生氨,使溶液pH 值改变,改变的程度与脲酶活性大小相关,因此可以用其与空白溶液的差值表示脲酶活性高低,单位为△pH值。
大豆中的抗营养因子及处理方法

大豆中的抗营养因子及处理方法
大豆胰蛋白酶抑制因子
大豆中的主要抗营养因子是大豆胰蛋白酶抑制因子(STI)。
生大豆中主要有两种胰蛋白酶抑制因子,一种是库尼兹胰蛋白抑制因子,另一种是鲍曼-贝尔克胰蛋白酶抑制因子。
大豆胰蛋白酶抑制因子可与动物小肠液中的胰蛋白酶结合,降低胰蛋白酶的活性,导致蛋白质消化利用率下降,并能引起动物生长抑制作用,如引起老鼠、小鸡的胰腺肿大和增生等。
因此,钝化大豆胰蛋白酶抑制因子对改善和提高大豆食品与饲料的营养价值和食用安全有重要意义。
胰蛋白酶抑制因子的检测方法
常用来检测大豆胰蛋白酶抑制因子的方法是脲酶检测法和氢氧化钾检测法。
生大豆中的脲酶与胰蛋白酶抑制因子的含量相近,变性失活的程度也与胰蛋白酶抑制因子相似,故可用脲酶活性作为大豆加工适宜程度的检测指标。
而氢氧化钾检测法是用来评估大豆加工过度和加工不足的最佳方法。
但是这两种方法并不能直接测出蛋白酶抑制因子的含量。
胰蛋白酶抑制因子失活方法
近十年来国内外对于大豆胰蛋白酶抑制因子失活方法与技术的研究,主要在物理失活、化学失活、生物学失活等几个方面获得明显的进展。
其中,物理方法包括热失活法、超声波失活法和其他失活法。
到目前为止,热处理仍是消除大豆中胰蛋白酶抑制因子的主要方法。
其
原理是通过加热,破坏饲料中对热不稳定的抗营养因子。
通常在120℃条件下加热10分钟,大豆中的抗营养因子可以失活,并且较好地保存大豆的营养价值。
胰蛋白酶研究及其在食品加工中的应用

胰蛋白酶研究及其在食品加工中的应用胰蛋白酶是一种生物酶,主要存在于胰腺中,可以分解蛋白质和肽类。
近年来,随着生物技术的不断发展和食品加工行业的迅速发展,胰蛋白酶的研究也越来越受到重视,成为了食品加工领域中不可或缺的酶类。
胰蛋白酶的研究历程可以追溯到19世纪,当时人们就已经开始研究胰蛋白酶的结构和功能。
经过几十年的努力,科学家们最终成功地分离出了胰蛋白酶,确认了其结构和功能,并对胰蛋白酶进行了一系列的研究。
随着科学技术的发展,现代生物技术提供了更加先进的研究方法,从而使得胰蛋白酶的研究更加深入、全面。
尤其是在最近的几年里,在研究胰蛋白酶的基本功能和结构的基础上,又进一步扩展了胰蛋白酶在食品加工中的应用领域,并且开发出了各种新型的胰蛋白酶,提高了其应用的效率和安全性。
胰蛋白酶在食品加工中的应用主要包括:蛋白水解、乳化和改良酶。
首先,蛋白水解是胰蛋白酶在食品加工中最常见的应用领域,其主要作用是将蛋白质分解成更小的肽类和氨基酸,使得蛋白质的味道更加丰富,易于消化吸收。
在加工肉制品、酱油、豆制品及饮料等各种食品时,常常需要使用蛋白酶进行蛋白水解,以提高食品的口感和营养价值。
其次,乳化是另一种重要的胰蛋白酶应用。
在食品加工过程中,常常需要将油和水乳化,以形成更加稳定和均匀的乳液。
而这一过程需要的就是特定的酶类,其中胰蛋白酶就是较为常见的一种。
胰蛋白酶可以将脂肪酸分离成甘油和脂肪酸,从而使油水混合物更加稳定,方便加工。
最后,改良酶是胰蛋白酶在食品加工中的另一种重要应用,其主要作用是改善食品的质感和口感,同时增加其保质期。
在制作各种膨化食品、饼干、饮料等食品时,常常需要使用改良酶来帮助食品更好地保持形态和口感。
不过,我们也需要注意到,虽然胰蛋白酶在食品加工领域中的应用既重要又广泛,但是必须依据食品工业的安全标准来使用,并确保胰蛋白酶的质量和纯度。
比如,需要遵循正确的使用方法和浓度,避免蛋白酶过量,以免引起食品变质和毒性反应,从而危害人体健康。
豆粕中胰蛋白酶抑制剂间接竞争酶联免疫吸附检测方法的研究

邢春芳等 : 中胰蛋白酶抑制剂 间 竞争酶联免 疫吸附检型 豆粕 接
一
。
LS 过程 无法进行 , 检测不 能完 成 。 了解 决这一 问题 , 为 本 右对应 的包 被抗原 和 一抗 、二抗 的浓 度为 E IA 反 文建立 了间接 竞争 E IA检测方 法。 LS 应 的理想 工作浓度 。
1 材 料 与 方 法
爨
1 . 抗原最佳 包被时 间的选择 .2 3
邢春 芳 , 中农 业大 学生命科 学技 术 学院 ,3 0 0 湖北 华 4 07 ,
武 汉 洪 山 区狮 子 山。
间。
1 . 抗原 和抗 体体积 比及竞争 时间的选择 .4 3
葛向阳, 单位及通讯地址 同第一作者 。
收稿 日期 :01 — 2 0 2 00—8
以抗 原 和 抗 体 体 积 比 7 3 、0: 0 5 5 、 0: 0 6 4 、0: 0
最低检 出限 I 为 2n/l c g 。选择 0 5M、H值 8 r — C 缓 冲液为样品浸提 液 , 0 、.、. g l m . p 0 .Ti H 1 2 s 以 .1 2 8 6 4 ̄/ m 的浓度添加 到豆粕 中时 , 回收率 为 9.%~0 . 变异 系数 为 2 %一 . 其 37 149 %, . 51 8 %。本研 究成功 建立原 的最佳包被工作浓度 , 3 按 7℃ 释 度 进 行 E IA 测 定 ,测 0 选 择 最 佳 包 被 时 LS D
间。
主要 仪器 :6 酶标 板 (E 加 拿 大制造 )酶标 1 2 3 4 5h和 4℃过夜进 行包被 ,以最佳 抗血清稀 9孔 J T, ; 、 、 、 、
怎样去除大豆中胰蛋白酶抑制剂

怎样去除大 豆中胰蛋白酶抑制剂
物 生 长 产 生 抑 制 作 用 ,一 般 认 为 有 以
下 丽方 面 的原 因 : ( 1 ) 胰 蛋 白酶 抑 制 较 好
3 . 2 化 学 处 理 法
一
剂 失 活 。 此 外 ,挤 压 膨 化 的 效 果 也 比
国 内外 对 大 豆 r r i 基因 ( 不 含 胰 蛋
白 酶 抑 制 剂 的 隐性 基 因 ) 及 其 遗 传 规 律 的 研 究 ,为 通 过 作 物 育 种 手 段 降 低
大 豆 胰 蛋 白酶 抑 制 剂 的 活 性 提 供 了 依 据 。H y mo w i t z 于 1 9 8 6年 已成 功 地 培 养 m 了低 胰 蛋 白酶 抑 制 剂 的 大 豆 新 品 种 , 其 胰蛋 F = 1 酶 抑 制 剂 的活 性 比一 般 大 豆 低 5 O %。
2 大 豆 中胰 蛋 白酶 抑 制剂 的毒 理
热 ( 烘 烤 、红 外 辐 射 等 ) 。 通 常 采 用 常
胰 蛋 白 酶 抑 制 剂 对 动 物 的 有 害 作 用 主 要 是 引 起 生 长抑 制 和 使 某 些 动 物
引 起 胰 腺 肥 大 。 胰 蛋 白 酶 抑 制 剂 对 动
蒸汽 加热 3 0 mi n或 9 8 K p a压 力 的 蒸
酸 钠 处 理 生 大 豆 一 周 以 上 ,可 使 胰 蛋 白酶 抑 制 剂 降低 5 9 . 8 3 % 。 张 建 立 等 ( 1 9 9 9 ) 报 道 ,用 5 %尿 素+ 2 0 %水 处 理 生大豆 3 0 d ,使 胰 蛋 白酶 抑 制 剂 是失 活 牢达到 7 8 . 5 5 %。
酶法钝化大豆胰蛋白酶抑制剂的研究
3 讨 论
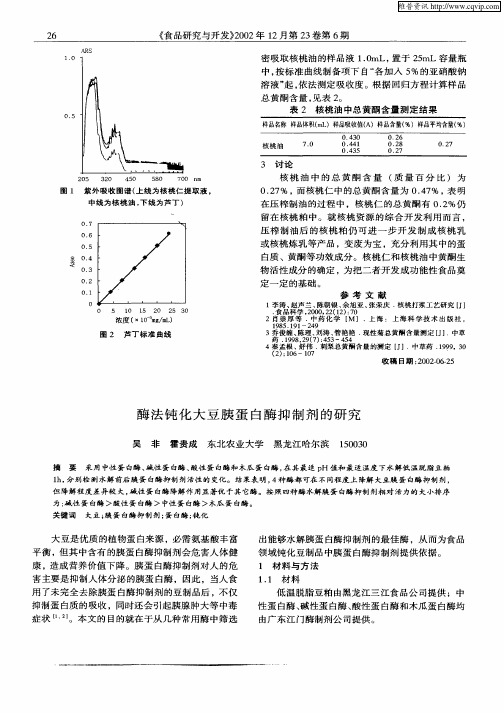
20 5 32 0 4 0 5 5 80 7 0 n 0 m
核 桃 油 中 的 总 黄 酮 含 量 ( 量 百 分 比 ) 为 质 0 2 % , 核 桃 仁 中 的总 黄 酮 含 量 为 0.7 , 明 .7 而 4% 表 在 压 榨 制 油 的过 程 中 ,核 桃 仁 的 总 黄 酮 有 0 2 .%仍 留 在 核 桃 粕 中 。就 核 桃 资 源 的 综 合 开 发 利 用 而 言 ,
维普资讯
《 品研究与开发) 0 2 1 月第 2 卷第 6 食 ) 0年 2 2 3 期
试 剂 胰 蛋 白 酶 ( ima公 司 ) B NA Sg 、 AP
2 白酶 相 当 的 酶 活 %
力。 2 结 果 与讨 论 2. 蛋 白酶 活力 1 2. . 标 准 曲线 的制 作 11 表 1 酪 氨 酸 溶 液 浓 度 ( 与 吸 光 值 ( 的 关 系 C) A)
维普资讯
2 6
《 食品研 究与开发) 0 2 1 ) 0 年 2月第 2 卷第 6 2 3 期
密 吸取 核 桃 油 的 样 品 液 1 0 .mL, 于 2 mL容 量 瓶 置 5
O O O
7
6
5
中, 按标 准 曲线制备项下 自“ 加入 5 各 %的亚硝酸钠 溶 液 ” , 法 测定 吸 收 度 。根 据 回归 方 程 计 算 样 品 起 依
图 1 紫 外 吸 收 图谱 ( 线 为 核 桃 仁 提 取 液 。 上 中线 为核 桃油 , 线为 芦丁 ) 下
压榨 制油 后 的核桃 粕仍 可进 一 步开 发 制 成核 桃乳
或 核 桃 炼 乳 等 产 品 ,变废 为 宝 ,充 分 利 用 其 中 的蛋 白质 、黄酮 等 功 效 成 分 。 核 桃 仁 和 核 桃 油 中黄 酮 生 物 活 性 成 分 的 确 定 ,为 把 二 者 开 发 成 功 能 性 食 品奠
一种胰蛋白酶抑制剂活性的检测方法[发明专利]
![一种胰蛋白酶抑制剂活性的检测方法[发明专利]](https://img.taocdn.com/s3/m/b68b0811bdd126fff705cc1755270722192e5966.png)
[19]中华人民共和国国家知识产权局[12]发明专利申请公布说明书[11]公开号CN 101191142A [43]公开日2008年6月4日[21]申请号200710159112.1[22]申请日2007.12.21[21]申请号200710159112.1[71]申请人中国科学院沈阳应用生态研究所地址110016辽宁省沈阳市沈河区文化路72号[72]发明人徐慧 李启平 张忠泽 张颖 李慧 史荣久 韩斯琴 杨伟超 [74]专利代理机构沈阳科苑专利商标代理有限公司代理人许宗富 周秀梅[51]Int.CI.C12Q 1/37 (2006.01)权利要求书 1 页 说明书 4 页 附图 1 页[54]发明名称一种胰蛋白酶抑制剂活性的检测方法[57]摘要本发明涉及酶催化/酶抑制生物技术领域,具体为一种胰蛋白酶抑制剂活性的检测方法。
检测具体过程主要为在胰蛋白酶反应体系中分别加入胰蛋白酶抑制剂提取物和胰蛋白酶作用底物,待反应10-15分钟后,加入反应终止液,而后测定反应终溶液在410nm波长下的吸光度值,根据抑制剂的加入量与吸光度值绘制出曲线,确定胰蛋白酶抑制剂的活性;其中胰蛋白酶作用底物为BAPNA溶液,加入量为每毫升胰蛋白酶反应体系中0.5-1.0ml。
本发明使用仪器简单、操作方便、反应灵敏度高,适用于各类胰蛋白酶抑制剂活性的测定。
200710159112.1权 利 要 求 书第1/1页 1.一种胰蛋白酶抑制剂活性的检测方法,其特征在于:胰蛋白酶反应体系中分别加入胰蛋白酶抑制剂提取物和胰蛋白酶作用底物,待反应10-15分钟后,加入反应终止液,而后测定反应终溶液在410nm波长下的吸光度值,根据抑制剂的加入量与吸光度值绘制出曲线,确定胰蛋白酶抑制剂的活性;其中胰蛋白酶作用底物为BAPNA溶液,加入量为每毫升胰蛋白酶反应体系中0.5-1.0ml。
2.按权利要求1所述的胰蛋白酶抑制剂活性的检测方法,其特征在于:所述反应温度为36-38℃。
实验六 胰蛋白酶的结晶及活力测定

实验一胰蛋白酶的结晶及活力测定原理胰蛋白酶(trypsin,EC.3.4.21.4)通常是以无活性的胰蛋白酶原(trypsinogen)形式存在于动物的胰脏中。
在生理条件下,胰蛋白酶原随胰液分泌到十二指肠后,在小肠上腔有钙离子的环境中被肠激酶(enterokinase)或胰蛋白酶所激活,其肽链N端的赖氨酸与异亮氨酸之间的一个肽键被水解而失去一个酸性6肽,分子构象发生改变,转变成有生物活性的胰蛋白酶。
胰蛋白酶原的M r约为24000,其等电点为pH8.9。
胰蛋白酶的的M r为23400,等电点为pH10.8。
胰蛋白酶在酸性条件下稳定。
通常在pH3.0的溶液内,在4的冰箱内储存数约乃至2年其活性无显著变化。
当溶液的pH值小于2.5时,胰蛋白酶易变性;pH大于5.0时,容易发生自溶;在pH7.6~8.0时,其催化水解的活性最佳。
重金属离子,有机磷化合物和某些反应产物均可抑制胰蛋白酶的活性。
在胰脏、卵清和大豆中含有一些对胰蛋白酶活性具有抑制作用的天然抑制剂。
胰蛋白酶催化水解蛋白质的能力,表现在它对碱性氨基酸(如精氨酸、赖氨酸)的羧基与其他氨基酸所形成的肽键具有高度的专一性。
此外,还能催化水解有碱性氨基酸所形成的酰胺键和酯键,胰蛋白酶对这些化学键催化水解活性的敏感性依次是酯键>酰胺键>肽键。
因此,可以利用含有这些化学键的人工合成的化合物为底物来研究胰蛋白酶的专一性催化活性。
在动物的胰脏中除了存在胰蛋白酶外,还有另外两种与胰蛋白酶的性质相似的蛋白水解酶,即:胰凝乳蛋白酶(chymotrypsin)亦称糜蛋白酶,弹性蛋白酶(elastase)。
在制备过程,采用常规的方法往往很难将三者彼此分离开。
而采用具有高度专一性的亲合层析法可将它们分开。
从胰脏中提取胰蛋白酶,一般是用稀酸将胰腺细胞中含有的胰蛋白酶原提取出来,然后根据等电点沉淀的原理将提取液的pH调至酸性(pH3.0左右),使大量的酸性蛋白沉淀析出。
经硫酸铵分级盐析将胰蛋白酶原,胰凝乳蛋白酶原和弹性蛋白酶原沉淀,抽滤后的沉淀物经水溶解并调至pH8.0,用极少量的胰蛋白酶将胰蛋白酶原激活,同时溶液中的胰凝乳蛋白酶原、弹性蛋白酶原也被激活。
胰蛋白酶活性测定

实验一胰蛋白酶活性测定实验目的:掌握测定胰蛋白酶浓度、活性、比活的原理与方法。
实验原理:胰蛋白酶相对分子量23.7 KD,主要水解肽链中碱性氨基酸与其它氨基酸相连接的肽键,此外还能水解碱性氨基酸形成的酯键,如把人工合成的N-苯甲酰-L-精氨酸乙酯(N-benzuyl-L-argine ethyl ester, BAEE)水解为H-苯甲酰-L-精氨酸(BA)。
胰蛋白酶所催化的上述反应中,产物BA对253 nm 的光吸收远大于BAEE,因此可以在实验起始点把253 nm 的消光值调为零,然后记录反应体系对253 nm 的消光值的增量,并把这个增量作为测定胰蛋白酶的活性指标。
酶活单位定义:在底物BAEE浓度1m mol/L,光程1 cm,波长253nm,温度25 0C,测量体积3mL,.条件下吸光值每分钟递增0.001( A/min=0.001)为1个BAEE酶活单位。
胰蛋白酶制剂中蛋白质浓度含义:胰蛋白酶含量一般E1%表达。
这个值的含义是:浓度为1% 酶蛋白,在1cm光径下,对紫外280nm 的消光值。
不同厂家、不同产品的E1%值有很大差别。
E1% 值越高,表明酶制剂中酶蛋白含量越高。
由于酶制剂中蛋白质含量各不相同,所以用酶制剂配制E1%的蛋白质溶液时,按照厂家对产品的E1% 的测定值配制溶液。
在本实验中,胰蛋白酶酶蛋白样品采用SIGMA 公司生产的产品,生产公司对展品的描述是对280nm紫外吸收值15.3,配制胰蛋白酶标准溶液可根据厂家的这个说明。
器材以试剂:器材,电子天平,紫外分光光度计,微量加样器。
试剂:标准胰蛋白酶,N-苯甲酰-L-精氨酸乙酯,HCI, Tris。
1.胰蛋白酶活性测定:1)配制E1%的胰蛋白酶溶液每组取E1%=15.3的胰蛋白酶样品10mg 放到1ml去离子水中,充分溶解后,放入冰中保存。
2)按照表1 的要求配制试验体系所需其它各种溶液.3)按照表1的顺序进行测定标准胰蛋白酶的活性。
酶活性抑制实验报告

实验名称:酶活性抑制实验实验目的:通过本实验,探究不同抑制剂对酶活性的影响,并分析其作用机制。
实验原理:酶活性受多种因素的影响,其中抑制剂是一种能够降低酶活性的物质。
根据抑制剂与酶的结合方式,可分为不可逆抑制和可逆抑制。
不可逆抑制剂与酶形成共价键,使酶失活;可逆抑制剂与酶形成非共价键,可逆地降低酶活性。
实验材料:1. 酶制剂(如过氧化氢酶、淀粉酶等)2. 底物(如H2O2、淀粉等)3. 抑制剂(如碘化物、氟化物等)4. pH缓冲液5. 温度控制装置6. 光度计7. 移液器8. 试管实验方法:1. 酶活性测定:取一定量的酶制剂,加入底物,在特定条件下(如pH、温度)反应,通过测定反应产物或底物的浓度变化来计算酶活性。
2. 抑制剂对酶活性的影响:向酶反应体系中加入不同浓度的抑制剂,重复上述步骤,观察抑制剂对酶活性的影响。
3. 抑制剂作用机制分析:通过比较不可逆抑制剂和可逆抑制剂对酶活性的影响,分析抑制剂的作用机制。
实验步骤:1. 酶活性测定:- 取一定量的酶制剂,加入底物,在特定条件下反应。
- 使用光度计测定反应体系中产物或底物的浓度变化。
- 计算酶活性。
2. 抑制剂对酶活性的影响:- 向酶反应体系中加入不同浓度的抑制剂。
- 重复上述步骤,观察抑制剂对酶活性的影响。
- 记录不同抑制剂浓度下的酶活性变化。
3. 抑制剂作用机制分析:- 比较不可逆抑制剂和可逆抑制剂对酶活性的影响。
- 分析抑制剂的作用机制。
实验结果:1. 酶活性测定:在特定条件下,酶活性与底物浓度呈正比关系。
2. 抑制剂对酶活性的影响:加入抑制剂后,酶活性降低。
不可逆抑制剂对酶活性的影响较大,而可逆抑制剂对酶活性的影响较小。
3. 抑制剂作用机制分析:不可逆抑制剂与酶形成共价键,使酶失活;可逆抑制剂与酶形成非共价键,可逆地降低酶活性。
实验结论:1. 抑制剂可以降低酶活性。
2. 不可逆抑制剂和可逆抑制剂对酶活性的影响不同。
3. 抑制剂的作用机制与其与酶的结合方式有关。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
— 一 奶 粉 *豆
已停止反应。将内容物过滤, 并于 40m 出测定光 1n 密度值 。对于空 白对照管 , 是取 2 l m 样本提 取液加 5 lA N mB P A试剂并保温在 3 c 1mn 然后加入 l l 7 i, c0 m 醋酸溶液及 2 l m 胰蛋 白酶溶液。
15 活力的表 示 方法 .
t p i ii r n s y e n p o u t ,a d t b an itroa in c reo l in b t e n s p d i ii r cii a, r s i b t o b a rd c y n n h o i s n o ti ep lt u v r ea o ew e l e a b t t t w s o n o r t o n h n o a vy it d c d h o g e e td e p r na in a d c mp r n h i me o o l eemie t p i n i i r a t i e nr u e .T ru h rp ae x e me tt n o ai ,t s td c ud d tr n r s i b t ci t s o i o o s h y n h o vi
关 键词 : 豆制 品 ; 胰蛋 白酶抑 制剂活性 ; 测定方 法
大豆中胰蛋白酶抑制因子(ys h ir一 tpi i its 简 r n n bo 称 TS对植物本身具有保护作用 , t ) 可防止大豆籽粒
腺分泌, 势必造成胰腺分泌失调性肥大和增生 , 出现 食物性消化吸收功能失调或紊乱 , 严重时出现头晕、 恶心 、 腹泻。为了准确测定 出豆制品中的胰蛋 白酶
使原 本就缺 乏含硫 氨基 酸 的大豆及 豆制品在食用 后
至p H为 82并用蒸馏水稀释成 l。 ., L
122 底 物溶 液 .. 称 取 4m B P A溶于 l l 甲 0 gA N m二
基亚砜中, 并用已预热到 3  ̄的 ts CCz 7 C r — al溶液稀 i 释成 1 m 。 0 l 0
抑制 剂活性 , 我们进 行 了较 为 系统 的研 究 , 现将研究
自身发生分解代谢 , 使种子处于休眠状态, 能调节大
豆蛋白质的合成 和分解, 并具有抗虫作用。目前大 豆中分离出的 T 主要有 : I S 库尼兹( ui) K nz和包曼 一 t
伯克 ( o m n—Br) 二 者 约 占种 子 贮 藏蛋 白质 的 Bw a i , k
[ ] 虞瑞尧 . v蛋 白酶抑制剂依 地那 韦药效学 、 1 } Ⅱ 药动学及
个胰蛋 白酶单位 ( U , 1m 反映溶液在 A )是 0 l
本文叙述的条件下 , 40m处测得反映前后所增 于 1r i 加 00 光密度为 1 .l 单位( b r ne n )胰蛋白酶 Asb c Ui , o a t 抑制剂活力用胰蛋白酶抑制剂单位(L ) T U 表示。
q ik y a d a c rtl n t es y e rd c . u c l c u aey i b a p o u t n h o n ,
2 结 果计算
治疗艾 滋病 的临床应 用 []中国现代应用 医学 , 9 , J. 18 9
o 5.
用 T Um 对分析所用提取液体积( 1做标 准 L/l r) n 曲线 , 并外推到零。每克样品的 T U值 =延伸值 × L
稀 释倍 数 , 当用分析 的提取 液的 T Um 对分 析液体 L /l
王英 男 , 建成 富校轶 李 家栋 修 , ,
(. 1国家大豆工程技术研 究中心, 尔滨 105 . 药总厂哈 尔滨康铃科技 开发有 限责任公 司, 尔滨 108 ) 哈 5002哈 哈 506
摘要: 利用紫外分光光度计 , 对豆制品 中胰蛋白酶抑制剂在抑制牛胰蛋 白酶活性反应前后的吸光 值差异制作差值 曲线, 而得 出斜率与抑制剂活性之间关系的方法。并通过反复的 实验对比, 从 最 终 可 以快速准确 地测 定大豆 制品 中胰蛋 白酶抑 制剂 活性 。
K lke ti aue n s g P tnimer to al ri Aci t Mesrme tU i oe t te Me d i n vy n o i h
积做图并不是直线关系时, 则计算 出每单位体积提 取液中 平均值 , T Ug 删 则 L / 样品 = 平均值 × 稀释 倍数 , 出常见豆制品结果见附图。 测
M e s r me to y sn I hb t rAc vt s i o b a r d c a u e n fTr p i n i i t ii n S y e n P o u t o i e
W a gYig a Xi in h n 2 F ay L id n n n nn , uJa c e g , uXio i, iJa o g
一
附 图 常见 豆 制 品 的 胰 蛋 白酶 抑 制 剂 活 力 测 定 对 比
4 结 论
通过上 述方法 测得 的豆制 品 中胰 蛋 白酶抑 制剂
与以往资料 中记载相比较, 它测定数据较为一致 , 而 且可以快速的测出所需数值 , 是值得广泛推广 的可
行 方法 。
参 考文 献 :
I nio y o h o t f X n gat i h mi u e t A t d n t e Grw h o e o rf n Atv e N d s b s
—
Mc[]C i s Junl f a o g ,94 0 . i J .h ee ora O t l y19 ,4 e n Pho
[] 刘兴嫒 , . 2 等 中国大豆种子蛋 白中胰蛋 白酶抑制剂等位 基 因的频率及分布[] 中国油料作物学报 ,94 0 . J. 19 ,4 [ ] 丁安林 , . 豆 的抗 营养 因子 及其改 良[ ]大 豆科 3 等 大 J.
学 ,94 0 + 19 ,1
[J YJ ux .m yo xe m n lCnio f acet 4 agH ai S d nEpr et odtno nr i l n i a i P ac
1 3 仪 器 .
当食物 中胰蛋 白酶与其抑制 因子结合而减少
时, 肠促胰酶肽分泌也增加 , 这种双重的过分刺激胰
收稿 日期 :05 1 3 修 回日期 :05 2 0 20 —1 —0 ; 20 —1 — 9
U 一 91 T 10 双光束紫外可见分光光度计 , 千分计
维普资讯
( . ain l o ba n ied g a d Tc n l y C n r N t a y e nE gne n n eh oo et ,Habn 1 0 5 o S g e ri 5 0 0;
2 K nl gSi c ad Tcnl iidCm ay ab eea Mein nf tr ,H ri 1 08 ) . agi c ne n e oo Lm t o p n ,H ri Gnr d i Mauw ue ab 50 6 n e h g y e n l ce i r n
白酶 抑制 剂 与 肠 内胰 蛋 白酶 结合 后 随粪 便 排 出体
豆制品( 包括: 水豆腐、 干豆腐 、 豆腐乳 、 臭豆腐 、 豆油、 黄豆酱油、 豆瓣酱 、 豆奶粉)市售 :
12 试剂 ( . 以下试 剂均 为分析 纯 )
12 1 0 0m l i~ CC2 .. .5 o Lt / r s a1溶液( 三羟 甲基氨基 甲烷缓冲溶液)H:. 溶解 60g p 82 .5 三羟甲基氨基
123 胰 蛋 白酶 溶 液 .. 称 取 4 胰 蛋 白酶 ( 含 mg 不
机体 内含硫氨基酸不仅得不到有效补充 , 而且 因食 用大豆或豆制品被大量消耗和散失, 导致机体内含 硫氨基酸的耗散性缺乏 , 造成体内氨基酸代谢失调
或不 平衡 。
盐) 溶于 20 1. 1 o L的 H 1 0m00 l 0m / C 中。 124 醋酸溶液 .. 3m 醋酸溶于 7m 蒸馏水中。 0l 0l 04 氢氧化钠 .g 125 .1 o L氢氧化钠溶液 .. 0 0 m l / 定容于 l 0m 蒸馏水中。 0l O
14 182O l .、.、.m 的上层 提取液 注入 2 组试 管 中 , 并加
3 样 品于 4 0 m处测 定吸光值 曲线分析 图表 1n
蠹 塑. 溺一/7 薹, 4 . . / 0 Y O : } 7 , 一 1 。 .
0 06 1 14 . 18 . 2
6 。 %
结果报 告如 下 :
l 材料 与方 法 1 1 材 料 .
胰蛋白酶抑制因子可抑制胰蛋 白酶和糜蛋白酶 活性 , 降低蛋白质的消化、 吸收利用。主要是胰蛋白 酶抑制因子与小肠液中胰蛋 白酶、 糜蛋白酶结合 , 生 成无活性的复合物 , 消耗和降解胰蛋 白酶, 导致肠道 对蛋 白质的消化 、 吸收及利用能力下降。同时, 胰蛋
甲烷及 29ga1. 2 .4CC2H 0于 约 90 l 馏 水 中 , 节 0m 蒸 调
外, 使肠内胰蛋 白酶数量减少 , 引起胰腺反射性亢 进, 分泌量加大 , 增加内源氮损失。因胰蛋 白酶中含 有丰富的含硫氨基酸 , 出现这种内源补偿性分泌 若 和排泄, 必然会造成体内含硫氨基酸的内源性散失 ,
维普资讯
20 06年第 2 ( 期 总第 8 期) l
大
豆
通
报
3 1
文章编号: 0 — 7520 )2 3 — 2 1 9 26 ( 60 — 1 0 0 0
