例谈多官能团有机物的最大耗量问题
2021届高三化学一轮复习 有机化学专题复习——多官能团有机物性质的判断(知识梳理与训练)

2021届高三化学一轮复习有机化学专题复习——多官能团有机物性质的判断(知识梳理与训练)知识梳理确定多官能团有机物性质的三步骤注意有些官能团性质会交叉。
例如,碳碳叁键与醛基都能被酸性高锰酸钾溶液氧化,都能与溴水反应使其褪色(碳碳叁键使溴水褪色是加成反应,醛基使其褪色是氧化反应),也能与氢气发生加成反应等。
强化训练1.有机物M的结构简式如图所示,下列说法中正确的是()A.分子式为C17H18O3B.M中所有碳原子均可能在同一平面C.1 mol M最多可以与3 mol NaOH反应D.M可以发生加成、取代、消去等反应答案D解析根据结构简式和碳四价的基本原则可知,该物质的分子式为C17H20O3,A项错误;右侧的环不是苯环,其中含有2个饱和碳原子,结构简式中—CH(CH3)2中的碳是3个饱和碳原子,这几个碳原子均形成四面体结构,导致所有的碳原子不可能共面,B项错误;该分子中羟基为醇羟基,与氢氧化钠不反应,中间的酯基为酚酯基,1 mol该酯基能消耗2 mol NaOH,所以1 mol M最多可以与2 mol NaOH反应,C项错误;因该分子中有苯环、碳碳双键等,因而可以发生加成反应;因结构中有醇羟基、酯基等,因而可以发生取代反应;因结构中含有醇羟基,且与羟基相连的碳原子的相邻碳原子上有氢原子,因而可以发生消去反应,D项正确。
2.有机化合物“利尿酸”是一种常见的兴奋剂,其分子结构如下图,下列说法正确的是()A.利尿酸是芳香烃B.利尿酸与AgNO3溶液反应有白色沉淀生成C.一定条件下,利尿酸能发生取代反应、加成反应和酯化反应D.1 mol利尿酸与饱和碳酸钠溶液反应能放出1 mol CO2答案C解析芳香烃中只含C、H两种元素,该物质中还含有O和Cl元素,不属于芳香烃,故A错误;利尿酸中的氯原子不能电离,与AgNO3溶液不能生成白色沉淀,故B错误;含碳碳双键、碳氧双键及苯环可发生加成反应,含羧基可发生取代和酯化反应,故C正确;含羧基(—COOH)能与饱和碳酸钠溶液反应放出CO2,2 mol利尿酸与碳酸钠溶液反应放出1 mol CO2,故D错误。
多官能团有机物试题解析

多官能团有机物试题解析有机物的官能团决定了一些特征反应和特殊的化学性质,其根本原因是由于官能团的结构存在一定的极性和不饱和性,所以多官能团的有机物分子就显示出多重性。
对于多官能团物质的考查,不仅能考查学生对基础知识的掌握程度,而且能考查学生将题给信息进行综合、对比、分析和判断等多种能力。
多官能团有机物试题类型通常有以下几种情况:1、已知物质的结构推断物质的性质例题1某有机物A 的结构简式为: 某同学对其可能具有的化学性质进行了如下预测,其中错误的是 。
①可以使酸性高锰酸钾溶液褪色②可以和NaOH 溶液反应 ③在一定条件下可以和乙酸发生反应 ④在一定条件下可以发生消去反应⑤在一定条件下可以和新制Cu(OH)2反应⑥遇FeCl 3溶液可以发生显色反应 解析:观察A 的结构可知该物质含有的官能团是苯环、醇羟基、酯基和醛基,分子中甲基与苯环相连,还有醛基均能使酸性高锰酸钾溶液褪色;酯基可在NaOH 溶液中水解;醇羟基在一定条件下可以和乙酸发生酯化反应;醛基在一定条件下可以和新制Cu(OH)2氧化反应。
因为醇羟基的邻位碳原子上没有氢原子,所以不能发生消去反应;又因A 的结构中无酚羟基,所以遇FeCl 3溶液不能发生显色反应。
答案:①②③⑤。
2、根据性质推测有机物的结构例题2下列有机物中既能发生酯化反应、加成反应,又能发生水解反应的是( )A. HOCH 2CH=CHCOOCH 3B. CH 3CH=CHCH 2OHC. OHCCH 2CHCOOCH 2CH 2OHD. HOCH 2CH=CHCOOH解析:解答此类题时应根据反应类型推测可能存在的官能团,再进行综合分析得出结论。
能发生酯化反应的官能团有羧基和羟基,发生加成反应的官能团有碳碳双键、碳碳叁键和醛基,发生水解反应的有卤代烃、酯类物质、二糖或多糖、多肽和蛋白质。
答案:AC.3、多官能团有机物中某官能团的检验例题3醛类因易被氧化为羧酸,而易使酸性高锰酸钾溶液或溴水褪色。
高中化学新教材教案:多官能团有机物性质判断与定量分析

微专题(四)多官能团有机物性质判断与定量分析[核心素养发展目标] 1.能从羟基、醛基、羧基、酯基的成键方式的角度,了解醇、酚、醛、羧酸、酯等含氧衍生物的主要化学性质,理解官能团与化学性质、反应类型之间的关系。
2.能根据有机物分子中含有的官能团推测其具有的性质,形成“结构决定性质”的思维模型,掌握研究有机物的一般方法。
一、多官能团有机物性质的判断1.找出有机物所含的官能团,如碳碳双键、碳碳三键、醇羟基、酚羟基、醛基等。
2.联想每种官能团的典型性质。
3.结合题目分析对有机物性质描述的正误进行判断。
1.(2020·丹东市第四中学高二月考)有机物的结构简式如图所示,则此有机物可发生的反应类型有()①取代②加成③消去④酯化⑤水解⑥氧化⑦中和。
A.①②③⑤⑥B.①②③④⑤⑥⑦C.②③④⑤⑥D.②③④⑤⑥⑦答案B解析①该有机物中含—OH、—COOH、酯基,能发生取代反应;②该有机物中含碳碳双键、苯环,能发生加成反应;③该有机物中含—OH,且与—OH相连的碳原子的邻位碳原子上含H,能发生消去反应;④该有机物中含—OH、—COOH,能发生酯化反应;⑤该有机物中含酯基,能发生水解反应;⑥该有机物中含碳碳双键、—OH,能发生氧化反应;⑦该有机物中含羧基,能发生中和反应;该有机物可发生的反应类型有①②③④⑤⑥⑦,答案选B。
2.(2020·广东省湛江二十一中高一月考)CH3—CH==CH—COOH,该有机物能发生的反应是()①取代反应②加成反应③使溴水褪色④使酸性KMnO4溶液褪色⑤酯化反应⑥聚合反应A.以上反应均可发生B.只有⑤不能发生C.只有⑥不能发生D.只有②不能发生答案A解析有机物含有碳碳双键,可发生加成反应、加聚反应和氧化反应,则②③④⑥正确;含有羧基,可发生酯化反应、取代反应,则①⑤正确,还含有甲基,甲基也能发生取代反应,以上反应均能发生,故答案选A。
3.(2020·献县私立宏志中学高二期中)有机物A的结构简式如图。
2020届高三有机化学二轮复习——多官能团有机物的计算

高高高高高高——高高高高高高高高高高一、单选题(本大题共16小题,共32分)1.柔红酮是一种医药中间体,其结构简式如图所示。
下列说法正确的是()A. 每个柔红酮分子中含有1个手性碳原子(连有四个不同基团的碳原子)B. 柔红酮分子中所有的碳原子都在同一个平面上C. 一定条件下柔红酮可发生氧化、加成、消去反应…D. 1mol柔红酮最多可与4mol氢溴酸发生取代反应2.香豆素−4是一种激光染料,应用于可调谐染料激光器。
香豆素−4由C、H、O三种元素组成,分子球棍模型如图所示。
下列有关叙述正确的是()①分子式为C10H9O3②能与饱和溴水发生取代反应③能与饱和溴水发生加成反应④能使酸性KMnO4溶液褪色⑤1mol香豆素−4最多能与含1mol NaOH的溶液反应A. ①②③B. ③④⑤C. ②③④D. ②③④⑤3.下列说法不正确的是()A. 分子式为C3H8O的所有同分异构体共3种B. 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应C. 用乙醇和浓H2SO4制备乙烯时,不可用水浴加热控制反应的温度D. 迷迭香酸结构如图:1mol迷迭香酸最多能和含6mol NaOH的水溶液完全反应4.下列说法不正确的是()A.Penguinone分子所有碳原子不可能都在同一个平面上B. 1mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为5 mol、3 mol、1 molC. 醋酸和软脂酸互为同系物,C5H12和C9H20也一定互为同系物D. 石油的裂化、裂解属于化学变化,煤的气化、液化则属于物理变化5.某有机物的结构为如图所示,这种有机物不可能具有的性质是()A. 所有碳原子可能共面B. 能使酸性KMnO4溶液和溴水褪色,且原理相同C. 1mol该有机物分别与足量Na或NaHCO3反应,产生气体在相同条件下体积相等D. 能发生酯化、加成、加聚反应6.下列说法中,错误的是()A. 乙酸和乙酸乙酯可用Na2CO3溶液加以区别B. 等物质的量的苯与苯甲酸完全燃烧消耗氧气的量相等C. 某单官能团有机化合物,只含碳、氢、氧三种元素,相对分子质量为58,完全燃烧时产生等物质的量的CO2和H2O.它可能的结构共有5种D. 1mol 可消耗3 molNaOH、3molBr2、7molH27.已知某“瘦肉精”中含有克伦特罗,其结构如图,下列有关克伦特罗的叙述不正确的是()A. 该物质在一定条件下可发生消去反应和酯化反应B. 该物质分子中含有6个饱和碳原子C. 1 mol该物质与足量NaOH溶液反应,最多需NaOH 2 molD. 该物质的分子式为C12H18ON2Cl28.下列说法不正确的是()A. (CH3)2C=CHCH2CH3的名称为2−甲基−2−戊烯B. 乙醇、乙二醇、丙三醇的沸点依次升高C. 1mol乙酰水杨酸()最多可以和2mol NaOH反应D. 可用和HCHO 为原料合成9.下列说法正确的是()A. 按系统命名法,的名称为2,5,6−三甲基−4−乙基庚烷B. 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大C. 肌醇与葡萄糖的元素组成相同,化学式均为C6H12O6,满足C m(H2O)n,因此,均属于糖类化合物D. 1.0 mol的最多能与含5.0 mol NaOH的水溶液完全反应10.乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是()①分子式为C12H19O2; ②不能发生银镜反应;③1mol该有机物最多能与3mol氢气发生加成反应;④它的同分异构体中不可能有酚类;⑤1mol该有机物与NaOH溶液反应最多消耗1mol NaOH;⑥属于芳香族化合物。
高三化学知识梳理及例题解析官能团与有机物类别性质的关系
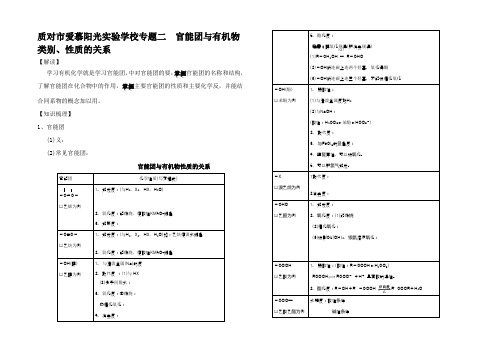
质对市爱慕阳光实验学校专题二官能团与有机物类别、性质的关系【解读】学习有机化学就是学习官能团,中对官能团的要:掌握..官能团的名称和结构,了解官能团在化合物中的作用,掌握..主要官能团的性质和主要化学反,并能结合同系物的概念加以用。
【知识梳理】1、官能团(1)义:(2)常见官能团:官能团与有机物性质的关系官能团化学性质(写方程式)-C=C-以乙烯为例1.加成反:(与H2、X2、HX、H2O)2.氧化反:能燃烧、使酸性KMnO4褪色3.加聚反:-C≡C-以乙炔为例1.加成反:(与H2、X2、HX、H2O)如:乙炔使溴水褪色2.氧化反:能燃烧、使酸性KMnO4褪色-OH(醇) 以乙醇为例1.与活泼金属(Na)的反2.取代反:(1)与HX(2)分子间脱水:3.氧化反:①燃烧:②催化氧化:4.消去反:5.酯化反:注意:醇氧化规律(和消去规律)(1)R-CH2OH →R-CHO(2)-OH所连碳上连两个烃基,氧化得酮(3)-OH所连碳上连三个烃基,不能被催化氧化-OH(酚)以苯酚为例1.弱酸性:(1)与活泼金属反放H2(2)与NaOH:(酸性:H2CO3>苯酚>HCO3-)2.取代反:3.与FeCl3的显色反:4、强复原性,可以被氧化。
5、可以和氢气加成。
-X以溴乙烷为例1取代反:2消去反:-CHO以乙醛为例1.加成反:2.氧化反:(1)能燃烧(2)催化氧化:(3)被制Cu(OH)2、银氨溶液氧化:-COOH以乙酸为例1.弱酸性:(酸性:R-COOH>H2CO3)RCOOH RCOO-+H+具有酸的通性。
2.酯化反:R-OH+R,-COOH R,COOR+H2O-COO—以乙酸乙酯为例水解反:酸性条件碱性条件〔O〕知识络、三羟基比3、四种有机分子的空间结构4、重要有机物的物理性质归纳(1)溶解性:有机物一般溶于有机溶剂。
能溶于水的有机物为:低级醇、醛、酸微溶于水:①苯酚②苯甲酸③C2H5-O-C2H5注意:水溶性规律有机物是否溶于水与组成该有机物的原子团(包括官能团)有密切关系。
多官能团有机物的最大耗量问题

多官能团有机物的最大耗量问题
1.消耗NaOH最大量的计算
有机化学反应中,消耗NaOH的计算,其规律是:酚羟基酯基卤素原子(连在烃基上)肽键磺酸基在反应中均可消耗NaOH。
1mol酚酯基羧基醇酯基(水解生成羧基)均可消耗2molNaOH,1mol苯环上的卤素原子在水解时(生成1mol酚羟基和1molHX)消耗2molNaOH,1mol烃基上的卤素原子在水解时(生成1molHX)消耗1molNaOH。
2消耗H2最大量的计算
有机化学反应中,消耗H2的规律:1mol -C=C- 加成时需1molH 2,1mol -C=C-完全加成时需2molH 2 1mol苯环加成时需3molH2,1mol-CHO加成时需1molH2,1mol-CO-(酮中羰基加成需1molH 2,
3消耗Br2最大量的计算
有机化学反应中,消耗溴的的规律:1mol -C=C- 加成时需1molBr 21mol -C=C-完全加成是需2molBr2;酚羟基的两个邻位和一个对位的氢原子均可以被溴原子取代,且每取代一个氢原子需要一个Br 2,若有机物结构中酚羟基的邻、对位已经有取代基,则不能再被溴原子取代;醛基与溴水发生氧化反应,1mol-CHO消耗1molBr2。
4.消耗Na最大量的计算
有机化学反应中,消耗Na的规律:羟基(醇羟基酚羟基)羧基能与钠反应,且消耗钠的物质的量分别与羟基羧基的物质的量相同。
5.消耗H2O最大量的计算
有机化学反应中消耗H2O的规律:酯(包括油脂)水解,分子中有几个-COO-在水解时就会消耗几个H2O ;多肽(蛋白质)水解,分子中有几个肽键水解时会消耗几个H2O。
有机物完全燃烧耗氧量规律

有机物完全燃烧耗氧量规律一、烃完全燃烧耗氧量规律1摩尔烃燃烧耗氧量--"等碳,1/4氢"分析:1mol某烃C x H y完全燃烧的反应方程式为:C x H y +(x + y/4)O2xCO2 + y/2H2O由此可知,每摩烃完全燃烧时耗氧量相当于每摩烃中碳元素和氢元素分别燃烧时耗氧量之和(x +y/4)。
例1.常温常压下,取下列4种气态烃各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是()A.甲烷B.乙烷C.乙炔D.乙烯答案:B例2.1mol的某烷烃完全燃烧,需要8mol的氧气,这种烷烃的分子式可能是()A.C3H8B.C4H10C.C5H12D.C6H14答案:C二、等质量的烃类完全燃烧时耗氧量规律质量相同的烃类完全燃烧时,耗氧量最多的是含氢量最高的;耗氧量最少的是含碳量最高的。
即:对于CxHy,质量一定时:①耗氧量最多的是最大的;②耗氧量最少的是最小的。
例3.等质量下列各类烃:1. C6H6 2. C7H8 3. C4H10 4. C3H8,分别完全燃烧时,其耗氧量由大到小的顺序排列的是()A.1234B.4321C.2134D.3412答案:B例4.等质量的下列烃完全燃烧生成CO2和H2O时,耗氧量最多的是()A.C2H6B.C3H8C.C4H10D.C5H12答案:A例5.等质量的下列烃,完全燃烧时消耗O2最多的是()A.甲烷B.乙烷C.乙炔D.乙烯答案:A三、烃的含氧衍生物完全燃烧时耗氧量规律1mol某烃的含氧衍生物完全燃烧的化学方程式为:C x H y O z + (x + y/4 -z/2)O2xCO2 + y/2H2O即:"等碳,1/4氢,去1/2氧"。
例6.若1mol有机物在完全燃烧时,消耗的氧气的物质的量为(3n-1)/2 mol,则它的组成通式可能是()A.C n H2n O B.C n H2n+2OC.C n H2n-2D.C n H2n答案:AC四、总质量一定的混合物,只要各组分的最简式相同,则完全燃烧时,其耗氧量为定值而与混合物各组分的含量无关,恒等于同质量的某单一组分完全燃烧时的耗氧量。
有机物化学式,消耗物质的量有关计算

有机物化学式,消耗物质的量有关计算求耗氧量、耗氢量、耗溴量、耗NaOH量、耗碳酸钠量、耗碳酸氢钠量、分⼦式富源学校⾼⼆化学备课组孙法军⼀、1mol有机物完全反应消耗某物质的量1、化合物I的分⼦式为,1mol该化合物若与H2加成,最多消耗H2mol;若完全燃烧需要消耗mol O2。
若与浓溴⽔反应可消耗____ molBr2 , 若与氢氧化钠溶液反应可消耗____ molNaOH , 若与碳酸钠溶液反应可消耗____ molNa2CO3。
2、化合物II分⼦式为1mol该化合物完全燃烧需要消耗mol H2。
3、化合物III含官能团是(写名称)若与H2加成,最多消耗mol,若与浓溴⽔反应可消耗____ molBr2 , 若与氢氧化钠溶液反应可消耗____ molNaOH , 若与碳酸钠溶液反应可消耗____ molNa2CO3。
4.化合物IV的分⼦式为__________ ,1mol化合物IV最多可与_____ molNaOH溶液反应。
若与浓溴⽔反应可消耗____ molBr2, 若与碳酸钠溶液反应可消耗____ molNa2CO3;若与碳酸氢钠溶液反应可消耗____ molNaHCO3;⼆、历届⾼考题1、(2012·⼤纲版)13.橙花醇具有玫瑰及苹果⾹⽓,可作为⾹料,其结构简式如下下列关于橙花醇的叙述,错误的是A.既能发⽣取代反应,也能发⽣加成反应B.在浓硫酸催化下加热脱⽔,可以⽣成不⽌⼀种四烯烃C.1mo1橙花醇在氧⽓中充分燃烧,需消耗470.4L氧⽓(标准状况D.1mo1橙花醇在室温下与溴四氯化碳溶液反应,最多消耗240g溴(2012·江苏)11. 普伐他汀是⼀种调节⾎脂的药物,其结构简式如图6 所⽰(未表⽰出其空间构型)。
下列关于普伐他汀的性质描述正确的是A.能与FeCl3溶液发⽣显⾊反应B.能使酸性KMnO4溶液褪⾊C.能发⽣加成、取代、消去反应D. 1 mol 该物质最多可与1 mol NaOH 反应【答案】BC【解析】A选项错误,分⼦中⽆苯环,不含酚羟基;B选项正确,碳碳双键、醇都能使酸性⾼锰酸钾溶液退⾊;C选项正确,双键能加成,醇能取代和消去反应;D选项错误,羧基和酯基个消耗1个氢氧化钠。
有机物耗量的计算课件

质量平衡法
01
02
03
04
定义
适用范围
优点
缺点
实验测定法
定义
。
适用范围
优点 缺点
物料衡算法
定义
优点
适用范围 缺点
CHAPTER
有机物耗量的影响因素
反应条件的影响
反应温度
反应压力
催化剂
原料质量的影响
纯度 水分 杂质
设备性能的影响
设备材质 设备结构 设备维护
CHAPTER
丙烯腈生产工艺简介 有机物耗量计算 计算细节
WATC有机物耗量的计算基础 • 有机物耗量的计算方法 • 有机物耗量的影响因素 • 有机物耗量的控制措施 • 有机物耗量的计算案例
CHAPTER
有机物概述
有机物的定 义 01 02
有机物的分 类
有机物的分 类
01
02
03
04
有机物的性 质
有机物的性质主要取决于其分子结构,包括碳原子的数目、排列方式以及与其它 元素的结合方式。
去除杂质
通过去除原料中的杂质,提高原料的纯度,从而提高原料的利用 率,降低有机物耗量。
CHAPTER
有机物耗量的计算案例
案例一:甲醇合成工艺中的有机物耗量计算
01
甲醇合成工艺简介
02
有机物耗量计算
03
计算细节
案例二:乙炔制备过程中的有机物耗量计算
乙炔制备工艺简介 有机物耗量计算 计算细节
案例三:丙烯腈生产过程中的有机物耗量计算
有机物耗量的控制措施
优化工艺流程
减少不必要的化学反应
01
优化反应条件
02
改进合成路线
分子式,官能团,耗量

有机化学专题训练(一)分子式,官能团,物质耗量基础知识复习:1、有机物的常见官能团名称和结构式: 。
2、烃的分子通式是: ,1mol 物质耗氧量为: 。
3、能与氯气发生反应的有机物质类别: 。
能与溴水反应的有机物质类别: 。
能与溴单质(或溴的四氯化碳溶液)反应的有机物质类别: 。
能与氢氧化钠反应的有机物质类别: 。
能与氢气发生反应的有机物质类别: 。
能使高锰酸钾溶液褪色的有机物质类别: 。
试题练习:1.右图有机物的分子式是 ,写出官能团的名称 。
2.写出莽草酸分子中任意两个官能团名称..:_____________、_______________。
该有机物分子1moL 最多能和 moLNaOH 发生反应。
3.绿原酸()是注射用双黄连的主要成分。
(1)绿原酸中含有________种官能团,分别是________________________(写名称); (2)1mol 绿原酸消耗________molNaOH ,消耗_______mol 氧气,消耗_______molBr 2。
4.(1)曲酸是一种非常有潜力的食品添加剂,经测定曲酸的分子式为C 6H 6O 4,结构简式为 ,其所含有的官能团有(写结构简式)_________________。
(2)L -多巴用于帕金森综合症的治疗,其结构简式为:H HO O OOHCH 3CH3OO HCOOHOHHO。
这种药物的研制是基于获得2000年诺贝尔生理学和医学奖的研究成果,L -多巴分子中所含的官能团的名称是:____________________________________________________。
该有机物分子式为:_________________。
[2013潮州]30.姜黄素具有抗突变和预防肿瘤的作用,其合成路线如下:(1)有机物Ⅳ的分子式为,含有官能团的名称为醚键和。
[2013东莞]30.已知:(1)化合物I的分子式为,化合物Ⅲ的含氧官能团的名称(写一种)。
各种官能团消耗NaOH的量

各种官能团消耗NaOH的量官能团是有机分子中的一些特殊基团,它们能够和其他分子进行化学反应,从而改变分子的性质。
在有机合成中,对官能团的认识非常重要,因为它们可以作为反应的起点或终点。
同时,官能团也可以用于分析有机物质的性质。
本文将介绍几种常见的官能团,并探讨它们与NaOH反应时消耗的量。
一、羧基羧基是一种含有碳氧双键和一个羟基的官能团,通式为-COOH。
羧基在有机化学中有着重要的地位,因为它们可以与其他分子进行酯化、酰化、酸酐化等反应。
羧基也可以与NaOH反应,生成相应的盐和水。
例如,苯甲酸与NaOH反应的方程式为:C6H5COOH + NaOH → C6H5COONa + H2O羧基对NaOH的消耗量取决于羧基的浓度和NaOH的用量。
在实验中,可以通过酸度滴定法来测定羧基的浓度,并计算出所需的NaOH 用量。
在一般情况下,1 mol的羧酸需要1 mol的NaOH完全中和。
二、羟基羟基是一种含有氧和氢的官能团,通式为-OH。
它可以与其他分子发生酯化、醚化、氧化等反应。
羟基也可以与NaOH进行中和反应,生成相应的盐和水。
例如,乙醇与NaOH反应的方程式为:C2H5OH + NaOH → C2H5ONa + H2O羟基对NaOH的消耗量取决于羟基的浓度和NaOH的用量。
在实验中,可以通过酸度滴定法来测定羟基的浓度,并计算出所需的NaOH用量。
在一般情况下,1 mol的羟基需要1 mol的NaOH完全中和。
三、胺基胺基是一种含有氮和氢的官能团,通式为-NH2。
它可以与其他分子发生酰化、烷基化、磺化等反应。
胺基也可以与NaOH进行中和反应,生成相应的盐和水。
例如,乙胺与NaOH反应的方程式为:C2H5NH2 + NaOH → C2H5NHNa + H2O胺基对NaOH的消耗量取决于胺基的浓度和NaOH的用量。
在实验中,可以通过酸度滴定法来测定胺基的浓度,并计算出所需的NaOH 用量。
在一般情况下,1 mol的胺基需要1 mol的NaOH完全中和。
高中化学有机化合物官能团的计数题解析与答题技巧详解

高中化学有机化合物官能团的计数题解析与答题技巧详解在高中化学学习中,有机化合物是一个重要的内容,而官能团的计数题则是其中的重点和难点之一。
官能团的计数题要求我们根据化学式,准确地计算出有机化合物中各种官能团的个数。
本文将详细解析官能团的计数题,并提供一些解题技巧,帮助读者更好地应对这类题目。
首先,我们需要了解什么是官能团。
官能团是有机化合物中具有一定化学性质和功能的基团,是有机化合物中的重要特征之一。
常见的官能团包括羟基、醛基、酮基、羧基、胺基、酯基等。
在官能团的计数题中,我们需要根据化学式,确定有机化合物中各种官能团的个数。
那么,我们如何准确地计算官能团的个数呢?首先,我们需要分析有机化合物的化学式,确定其中的官能团。
以化学式C6H6O为例,我们可以看出其中包含了一个醛基和一个羟基。
因此,它的官能团个数为2。
在解决官能团计数题时,我们可以按照以下步骤进行:第一步,分析化学式,确定有机化合物中的官能团。
我们可以根据化学式中的元素和官能团的特征,准确地确定有机化合物中的官能团。
第二步,计算官能团的个数。
根据确定的官能团,我们可以对每种官能团进行计数,最后将计数结果相加,得到有机化合物中官能团的总个数。
第三步,检查计算结果。
在计算完成后,我们需要仔细检查计算结果是否准确。
可以通过重新分析化学式,对照计算结果进行核对,确保计算的准确性。
除了以上的基本步骤外,还有一些常见的官能团计数题的解题技巧,我们可以参考以下几点:1. 注意官能团的特征。
不同的官能团具有不同的特征,比如羟基的化学式中含有-OH,醛基的化学式中含有-C=O等。
我们可以根据这些特征来准确地确定官能团的个数。
2. 注意官能团的位置。
有机化合物中的官能团可以出现在不同的位置,比如链状、支链状或环状。
我们需要仔细分析化学式,确定官能团的位置,以便准确计算官能团的个数。
3. 注意官能团的重复。
有时候,有机化合物中可能存在多个相同的官能团。
在计算官能团的个数时,我们需要将这些重复的官能团都计算在内,确保计算结果的准确性。
有机物官能团的定量关系在解题中的应用

化生 成 一 个
加 14。
该物 质 分 别 与 足 量 Na、
B.
NaOH 反 应,
消耗二者物质的量之比为 6∶1
C.
1mo
l该物质最 多 可 与 2mo
lH2 发 生
加成反应
该物质可被酸性 KMnO4 溶液氧化
D.
1mo
l该 分 子 中 含 有 1 mo
l
可与 NaHCO3 反 应
COOH ,
CH2 OH 最 终 氧
D.
C8H10 、
C6H6
分
C3H8 和 C8H18 均 为 烷 烃,
子组成上相差 5 个 CH2 原子团,
是同系物,
A 项 正 确。C2H4 和 C3H6 不 一 定
互 为 同 系 物,当 二 者 都 是 烯 烃 时,是 同 系 物;
当 C3H6 是环丙 烷 时,
和 C2H4 不 是 同 系 物,
COOH ,相 对 分 子 质 量 增
酚的定性检验。
8.
苯酚与浓溴水反应 时,在 酚 Nhomakorabea 基 的 邻、
对
位发生 取 代。 若 其 邻、
对 位 均 有 氢,
则酚羟基
2
2.
4L,
A 项 正 确。1mo
l分 子 中 含 5mo
l羟
基和 1mo
与 Na 发生置换反应 产 生 氢
l羧基,
气,
而只有羧基可与氢氧 化 钠 发 生 中 和 反 应,
→
氢氧化铜的显色反应。
4.
醛与新制备的氢氧 化 铜 的 反 应 中,
醛 基、
例1
的是(
下列 各 组 物 质 中 一 定 互 为 同 系 物
有机物耗量的计算

第七部分 有机合成与推断
合成有机高分子化合物
1.(2012·北京理综,28)优良的有机溶剂对孟 烷、耐热型特种高分子功能材料PMnMA的 合成路线如下:
已知芳香化合物苯环上的氢原子可被卤代烷 中的烷基取代。如:
(1)B为芳香烃。
①由B生成对孟烷的反应类型是 ____________________。
反应的化学方程式呢?
示例3 确定 H2或NaOH的最大用量
最近,媒体报道不法商贩销售“致癌大米”, 已验证这种大米中含有黄曲霉毒素(AFTB),其 分子结构式为如右图所示,人体的特殊基因在 黄曲霉素的作用下会发生突变,有转变为肝癌的 可能。一般条件下跟1mol AFTB起反应的H2或
C NaOH的最大量分别是( )
况
相等
量相等
量均相等
需满足 不同分子中 不同分子中 不同分子中 C%、
的条件 C% 须相等 H% 须相等 H% 均相等
(2)等物质的量的不同有机物完全燃烧
燃烧情 产生 CO2 的 产生 H2O 的量 产生 CO2、H2O 的量
况 量相等
相等
均相等
不同的分子 需满足
中含 C 原子 的条件
个数须相等
不同分子中含 不同分子中含 C、H 原
最简式相同的物质有:
CH2O——甲醛、乙酸、甲酸甲酯; HCHO\CH3COOH\HCOOCH3
CnH2nO——饱和一元醛、酮与二倍于其碳原子数的饱和一元羧酸或酯(如乙醛与丁酸)。
2.燃烧产物为一定量时分子组成需满足的条件
(1)等质量的不同有机物完全燃烧
燃烧情 产生 CO2 的量 产生的 H2O 的 产生 CO2、H2O 的
A .6:4:5 B.3:2:2 C.3:2:3 D.6:4:1
对高考试题中有机物消耗NaOH量的分析

对高考试题中有机物消耗NaOH量的分析佚名【期刊名称】《《高中数理化》》【年(卷),期】2019(000)007【总页数】3页(P67-69)【正文语种】中文高考试题中,对于有机物的考查主要是选择题及推断题.随着高考复习的推进,笔者发现,在备考中,对于有机物消耗NaOH量的问题一直是学生的疑惑点.在有机化学中能够与NaOH反应的官能团主要有:酚羟基、卤素原子、羧基、酯基.试题中还会涉及误导项醇羟基和醚键.1 高考试题中常见的类型1.1 羧基和酚羟基消耗NaOH的类型例1 (2015年山东卷) 分枝酸可用于生化研究,其结构简式为.下列关于分枝酸的叙述正确的是( ).A 分子中含有2种官能团;B 可与乙醇、乙酸反应,且反应类型相同;C 1 mol 分枝酸最多可与3 mol NaOH发生中和反应;D 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同分枝酸中含有的官能团有羧基、醇羟基、醚键和碳碳双键,1 mol该化合物中,含有2 mol羧基,共消耗2 mol NaOH,其他官能团均不消耗NaOH,所以1 mol分枝酸最多可与2 mol NaOH发生中和反应,选项C说法错误.本题答案为B.提醒各位考生,一定要区分清楚酚和醇,酚中的羟基直接连在苯环上,醇中的羟基与链烃基或者是芳香烃侧链上的碳原子相连.醇羟基不与NaOH反应,而酚羟基可以与NaOH反应.1.2 酯水解反应消耗NaOH的类型例2 迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图1所示.下列各项叙述正确的是( ).图1A 迷迭香酸属于芳香烃;B 迷迭香酸含有5种官能团;C 1 mol迷迭香酸最多能和6 mol溴水发生反应;D 1 mol迷迭香酸最多能和含6 mol NaOH的水溶液完全反应迷迭香酸中含有的官能团有酚羟基、羧基、酯基和碳碳双键,1 mol 该化合物中,含有4 mol酚羟基,共消耗4 mol NaOH,含有1 mol羧基,消耗1 mol NaOH,含有的酯基能够发生水解反应,消耗NaOH的原理可以考虑成该化合物先水解生成酸和醇,然后再分别考虑两种产物消耗NaOH的量,产物中羧基能与NaOH反应,消耗1 mol NaOH,而产物中醇羟基不与NaOH反应,不消耗NaOH,其他官能团也不消耗NaOH,所以1 mol迷迭香酸最多能和含6 mol NaOH的水溶液完全反应,选项D 正确.本题答案为D.提醒各位考生,在有机物的键线式结构中,一定要找准官能团.图2例3 (2016年江苏卷) 化合物X是一种医药中间体,其结构简式如图2所示.下列有关化合物X的说法正确的是( ).A 分子中两个苯环一定处于同一平面;B 不能与饱和Na2CO3溶液反应;C 在酸性条件下水解,水解产物只有一种;D 1 mol化合物X最多能与2 mol NaOH反应化合物X中含有的官能团有羧基和酯基,1 mol化合物X中,含有1 mol羧基,消耗1 mol NaOH,而化合物X右上角的酯基能够发生水解反应,消耗NaOH的原理可以考虑成化合物X先水解生成酸和酚,然后再分别考虑2种产物消耗NaOH的量,由于产物羧基和酚羟基均能与NaOH反应,共消耗2 mol NaOH,所以1 mol化合物X最多能与3 mol NaOH反应.选项D错误.本题答案为C.提醒各位考生,一定要清晰区分出酯基水解产物是醇羟基还是酚羟基.1.3 卤素原子水解反应消耗NaOH的类型例4 某有机化合物的结构简式为(),下列有关该物质的叙述不正确的是( ).A 不易溶于水,可以发生加成反应和取代反应;B 1 mol该物质最多可以消耗2 mol Na;C 1 mol该物质最多可以消耗6 mol热的NaOH溶液;D 能与Na2CO3溶液反应本题的选项C,该有机化合物中含有的官能团有酚羟基、醇羟基、氯原子和酯基,1 mol该有机物中,含有1 mol酚羟基,消耗1 mol NaOH,醇羟基不消耗NaOH,有机物中的卤素原子会发生水解反应,其消耗NaOH的原理可以考虑为先水解(消耗NaOH)生成醇或者酚,再考虑醇或酚消耗NaOH的情况,此有机物左侧的氯原子,先消耗1 mol NaOH生成醇,醇不再与NaOH反应,所以左侧的氯原子消耗1 mol NaOH,而有机物下方的氯原子,先消耗1 mol NaOH生成酚,酚再消耗1 mol NaOH,共消耗2 mol NaOH,有机物右上侧的酯基与例3中的酯基消耗NaOH的原理一样,消耗1 mol NaOH,有机物右下侧的酯基与例2中的酯基消耗NaOH的原理一样,消耗2 mol NaOH,所以1 mol该物质最多可以消耗7 mol热的NaOH溶液.选项C错误.本题答案为C.1.4 卤素原子消去反应消耗NaOH的类型例5 某有机化合物的结构简式如图3所示,下列有关该物质的叙述正确的是( ).图3A 该物质可以发生还原反应、取代反应和加聚反应;B 分子式为C12H15Cl2;C 1 mol该物质最多可以消耗3 mol热的NaOH溶液;D 1 mol该物质发生消去反应时,消耗1 mol NaOH本题的选项D,该有机化合物中含有氯原子,消去反应发生的条件为“与卤素原子相连的碳原子的邻位碳原子上必须有氢原子”.该有机物中与左侧氯原子相连的碳原子的邻位碳原子上没有氢原子,不能发生消去反应,右侧氯原子能发生消去反应,消耗1 mol NaOH.选项D正确.本题答案为D.2 高考试题中消耗NaOH多少的类型汇总现将考试中涉及的官能团的考查归结到一种有机物中,如图4,并将官能团编号,如图5.图4 图5假设有机物物质的量为1 mol.官能团①为醇羟基,不能电离出H+,不与NaOH反应; 官能团②为酚羟基,能够电离出1 mol H+,消耗1 mol NaOH; 官能团③为羧基,能够电离出1 mol H+,消耗1 mol NaOH; 官能团④为氯原子,该氯原子能发生水解反应,生成NaCl和醇(原氯原子的位置被羟基取代),按照原子守恒规律,1 mol Cl 原子对应1 mol Na+即消耗1 mol NaOH,而生成的醇不与NaOH反应,所以消耗NaOH的物质的量为1 mol; 官能团⑤为氯原子,该氯原子发生水解反应,生成NaCl 和酚(原氯原子的位置被羟基取代),按照原子守恒规律,1 mol Cl原子对应1 mol Na+即消耗1 mol NaOH,且生成的酚羟基也能与NaOH反应,消耗1 mol NaOH,所以消耗NaOH的物质的量为2 mol; 官能团⑥为酯基,由于酯基的水解反应,产物为酸和醇(可以先考虑酯基水解生成酸和醇,然后再考虑2种产物消耗NaOH的数目),只有羧基消耗1 mol NaOH,醇不反应,所以消耗NaOH的物质的量为1 mol; 官能团⑦为酯基,由于酯基的水解反应,产物为酸和酚(可以先考虑酯基水解生成酸和酚,然后再考虑2种产物消耗NaOH的数目),羧基消耗1 mol NaOH,酚羟基也消耗1 mol NaOH,所以消耗NaOH的物质的量为2 mol.3 习题延伸拓展拓展1 表没食子儿茶素没食子酸酯(EGCG)是绿茶中主要的活性成分之一,下列说法正确的是( ).图6A 分子式为C22H20O11;B 分子中只有1个手性碳原子;C 分子易发生氧化反应,因此绿茶具有抗氧化性;D 1 mol该化合物与足量的NaOH溶液反应,最多消耗10 mol NaOH该有机化合物中含有的官能团为酚羟基、醚键和酯基,注意,该有机物中间的环不是苯环,1 mol该有机物中,8 mol酚羟基消耗8 molNaOH,1 mol酯基消耗1 mol NaOH(与图5中位置⑥的酯基消耗NaOH的原理一样),其他官能团不消耗NaOH,所以 1 mol该化合物与足量的NaOH溶液反应,最多消耗9 mol NaOH.选项D 错误.本题答案为C.拓展2 已知卤代烃在碱性条件下易水解,某有机物的结构简式如图7所示,1 mol该有机物与足量的NaOH溶液混合共热,充分反应最多可消耗a mol NaOH,则a为( ).图7A 5;B 6;C 8;D 2该有机物中含有溴原子、氯原子、硝基、羧基和酯基,1 mol羧基消耗1 mol NaOH,酯基消耗2 mol NaOH(与图5中位置⑦的酯基消耗NaOH的原理一样),左上角的溴原子消耗1 mol NaOH(与图5中位置④的卤素原子消耗NaOH的原理一样),左下角的溴原子和右下角的氯原子分别消耗2 mol NaOH(与图5中位置⑤的卤素原子消耗NaOH的原理一样),羧基消耗1 mol NaOH,其他官能团不消耗NaOH,所以1 mol该有机物与足量的NaOH溶液混合共热,充分反应最多可消耗8 mol NaOH.本题答案为C.拓展3 某有机物X的结构简式如图8所示,下列有关说法中不正确的是( ).图8A 能发生加成、取代、氧化反应;B 1 mol该物质最多可与7 mol NaOH反应;C 1 mol该物质最多可与6 mol H2反应;D 能与FeCl3溶液发生显色反应该有机物含有羧基、醇羟基、酚羟基、氯原子和酯基,1 mol羧基消耗1 mol NaOH,1 mol酚羟基消耗1 mol NaOH,1 mol氯原子消耗2 molNaOH(与图5中位置⑤的卤素原子消耗NaOH的原理一样),与苯环相连的酯基消耗2 mol NaOH(与图5中位置⑦的酯基消耗NaOH的原理一样),最右侧的酯基消耗1 mol NaOH,其他官能团不消耗NaOH,所以1 mol该物质最多可与7 mol NaOH反应.选项B正确.本题答案为C.通过以上例题及练习题的分析,我们发现,只要把有机物中各个官能团分别消耗NaOH的原理分析透彻,应对这样的题目是轻而易举的.(本文系河北省教育科学研究“十三五”规划2016年度重点资助课题《新形势下普通高中理综教学改革研究与实践》(No.162023)阶段性研究成果.)。
2021届高三化学一轮复习——多官能团有机物的定量分析学案及训练

2021届高三化学一轮复习——多官能团有机物的定量分析学案及训练知识梳理1.醛发生银镜反应或与新制Cu(OH)2反应时,量的关系为R—CHO~2Ag、R—CHO~2Cu(OH)2~Cu2O;“一醛二银或一醛二铜”。
甲醛()相当于含有2个醛基,故甲醛发生银镜反应或与新制Cu(OH)2反应时,量的关系分别为HCHO~4Ag、HCHO~4Cu(OH)2~2Cu2O。
2.醇、酚与Na反应中量的关系:2—OH~2Na~H2(钠原子只置换羟基氢)。
3.烯烃、炔烃、苯的同系物等与H2反应中量的关系:~H2、—C≡C—~2H2、~3H2。
4.卤代烃、酚与NaOH反应中量的关系:R—X~NaOH、—OH(酚羟基)~NaOH。
5.酯与NaOH反应中量的关系:~NaOH,若为酚酯,则有~2NaOH。
6.~X2~HX,即取代1 mol氢原子,消耗1 mol卤素单质,同时生成1 mol HX。
例1Y是一种皮肤病用药,它可以由原料X经过多步反应合成。
―→…―→原料X产物Y下列说法正确的是()A.X与Y互为同分异构体B.1 mol X最多可以与5 mol H2发生加成反应C.产物Y能发生氧化、加成、取代、消去反应D.1 mol Y最多能与2 mol NaOH发生反应答案A解析原料X与产物Y的分子式相同,但结构不同,则二者互为同分异构体,故A正确;X 中苯环和碳碳双键能与氢气加成,则1 mol X最多可以与4 mol H2发生加成反应,故B错误;苯环较稳定,羟基连接在苯环上,不能发生消去反应,故C错误;Y中酚羟基和酯基能和NaOH反应,并且酯基可水解生成酚羟基和羧基,则1 mol Y最多能与3 mol NaOH发生反应,故D错误。
例2某有机物M的结构简式如图所示,若等物质的量的M在一定条件下分别与金属钠、氢氧化钠溶液、碳酸氢钠溶液反应,则消耗的钠、氢氧化钠、碳酸氢钠的物质的量之比为()A.1∶1∶1 B.2∶4∶1C.1∶2∶1 D.1∶2∶2答案B解析金属钠可以与M中的酚羟基、羧基发生反应;氢氧化钠溶液能使酯基水解,溴原子水解,也能与酚羟基和羧基反应;碳酸氢钠溶液只能与羧基发生反应,因此1 mol M消耗的钠、氢氧化钠、碳酸氢钠的物质的量分别为2 mol、4 mol、1 mol。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例谈多官能团有机物的最大耗量问题
长沙市第21中学特级教师邵国光
官能团是决定有机物化学特性的原子或原子团,它是烃的衍生物的性质之源,反应之本,含多个官能团的有机物具有复杂的化学性质,它不仅能与多种物质反应,还存在多个官能团与同一种物质反应的情况。
因此,高考试题中有关多官能团有机物的的最大耗量问题的考查,不仅能考查学生对官能团的结构和性质等基础知识的掌握程度,还能从定量的角度考查学生灵活运用多个官能团知识综合解决实际问题的能力。
在解答此类问题时,必须熟练掌握如下各类官能团的结构与性质。
一、确定 Br
2或H
2
的最大用量
[例1](1998年全国高考题)白藜芦醇广泛存在于食物如桑椹、花生、尤其是
葡萄)中,它可能具有搞癌性。
能够跟1摩尔该化合物起反应的Br
2或H
2
的最大
用量分别是()
A、1mol 1mol
B、3.5 mol 7mol
C、3.5mol 6mol
D、6mol 7mol
解析:在白藜芦醇分子结构中,有C=C、苯环能和H
2
发生加成反应,1mol白
藜芦醇与H
2加成时需7molH
2
;而与Br
2
反应时,既可在苯环上发生取代反应,也可
以与C=C发生加成反应。
酚与Br
2
发生取代反应时,溴原子只能进攻羟基的邻,对
位, 发生取代反应需Br
25mol, 与C=C发生加成反应需Br
2
1mol,共需Br
2
6mol。
故选D。
二、确定 Br
2
或NaOH的最大用量
[例2]中草药秦皮中含有的七叶树内酯(碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用。
若1mol 七叶树内酯,分别与浓
溴水和NaOH溶液完全反应,则消耗的Br
2
和NaOH的物质的量分别为( ) A.3mol Br2;2mol NaOH B.3mol Br2;4mol NaOH
C.2mol Br2;3mol NaOH D.4mol Br2;4mol NaOH
解析:本题要求学生在理解酚和酯的结构及其性质的基础上,将获取的有关规律迁移到题目所指定的有机物中。
由于学生在课本中学习的是一元酚和普通酯,而题设物质却是一种既可以看成二元酚,又可看成酯(内酯)且含有双键的复杂有机物,所以本题在考查相关知识点的同时,也在一定程度上考查学生思维的灵活性、广阔性和创造性。
仔细观察该有机物的结构简式并结合已有知识,不难得知:1mol七叶树内酯可与3mol Br2相作用,其中2mol Br2用于酚羟基的邻位氢的取代(注:对位无氢可取代),1mol用于酯环上C=C双键的加成,其反应原理为:
当1mol七叶树内酯与NaOH反应时,需4mol NaOH,其中3mol NaOH与酚羟基(包括水解后生成的)作用,1mol NaOH与水解后产生的羧基发生中和反应,其反应原理为:
故选B。
三、确定 H
2
或NaOH的最大用量
[例3] 最近,媒体报道不法商贩销售“致癌大米”,已验证这种大米中含有黄曲霉毒素(AFTB),其分子结构式为如右图所示,人体的特殊基因在黄曲霉素的
作用下会发生突变,有转变为肝癌的可能。
一般条件下跟1mol AFTB起反应的H
2或NaOH的最大量分别是( )
A.6mol;1mol B.5mol;1mol
C.6mol;2mol D.5mol;2mol
解析:与H
2反应的有C=C、苯环和羰基,1mol AFTB起反应的H
2
为6mol。
与
NaOH反应时发生水解,该分子中环内酯的水解产物中存在酚羟基和羧基,1mol AFTB起反应的NaOH为2mol。
故答案为C。
四、确定Na、NaOH、新制Cu(OH)
2
的最大用
量
[例4]某有机物的结构简式为
1mol该有机物分别与足量的Na、NaOH溶液、新制氢氧化铜浊液(可加热)
反应时所消耗的Na、NaOH、新制Cu(OH)
2
的物质的量之比为()
A .6:4:5 B.3:2:2 C.3:2:3 D.6:4:1
解析:与Na反应的有醇羟基、酚羟基和羧基,1mol该有机物与足量的Na 反应时所消耗的Na的物质的量为3mol;与NaOH反应的有酚羟基和羧基,1mol 该有机物与足量的NaOH反应时所消耗的NaOH的物质的量为2mol;与新制氢氧化铜反应的有醛基和羧基,1mol醛基(—CHO)被氧化生成羧基(—COOH)消耗
2mol Cu(OH)
2
,但必须注意的是醛基的氧化产物是羧基,新生成的羧基和原有的
羧基共2mol,也会与新制Cu(OH)
2中和反应消耗1mol Cu(OH)
2
,因此1mol该有
机物与足量的新制Cu(OH)
2反应时所消耗的新制Cu(OH)
2
的物质的量为3mol。
答
案选C。
五、确定NaOH的最大用量
[例5]已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如下:
1mol该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为a(不考虑醇羟基和硝基与氢氧化钠的反应,下同),溶液蒸干得到的固体产物再与足量的干燥碱石灰共热,又消耗氢氧化钠的物质的量为b,则a,b分别是( )
A.5mol,10mol B.6mol,2mol C.8mol,2mol D.8mol,4mol
解析:根据有机物的结构,对它在碱溶液中的反应进行分步分析。
第一步,结构中—Br、—Cl、—COO—在碱性条件下发生水解反应,其反应方程式为:
第二步,水解产物与NaOH反应。
综观上述水解产物,能与NaOH反应的有3mol 酚羟基,2mol羧基,2molHBr,1molHCl,则消耗NaOH共8mol。
当所得溶液蒸干后,因产物中有2mol —COONa ,加热时可与2molNaOH发生脱羧反应(即:
CH
3COONa+NaOH CH
4
↑+Na
2
CO
3
)。
综上分析,得a=8mol,b=2mol。
答案
选C。
六、确定 H
2
的生成或消耗的最大量
[例6]军事上的“地表伪装’’是军事上保护的外观色彩、红外反射与环境吻合。
BASF是新型红外伪装还原染料,为橄榄色或黑色。
其化学结构如下:
1mol该物质与钠在一定条件下反应,产生氢气的物质的量以及在催化剂作用下加成所需氢气物质的量,最大值分别为( )
A.1 mol,4mol B.2 mol,10 mol C.1 mol,14 mol D.2 mol,14mol
解析:由有机物的结构可知,分子中有2个羟基(—OH),1mol该物质可与2mol钠反应,产生氢气的物质的量为1mol;且分子中含有4个羰基(C==O)和4个苯环,1mol该物质在催化剂作用下可与氢气发生加成反应,共需氢气物质的量为14mol。
答案为C。
七、确定O
2
的最大用量
[例7]鸦片具有复杂的组成,其中的罂粟碱的分子结构如下:鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾,使人体质衰弱,精神
颓废,寿命缩短。
已知该物质的燃烧产物为CO
2、H
2
O和N
2
,1 mol该化合物
完全燃烧消耗O
2的物质的量及在一定条件下与Br
2
发生苯环取代反应生成的
一溴代物同分异构体的种数分别是( )
A.23.75 mol;5
B.23.75 mol;7
C.24.5 mol;8
D.26.5 mol;6
解析:根据罂粟碱的分子结构可推出其分子式为C
20H23O
4
N,其燃烧的化学方
程式为:,据此可知1 mol该化合物完全
燃烧消耗O
2
的物质的量为23.75mol;由罂粟碱的分子结构可知有两个苯环,且
这两个苯环结构均不对称,苯环上共有5个氢原子在一定条件下与Br
2
发生取代反应,生成的一溴代物同分异构体有5种。
答案选A。
