单次静滴注射用头孢噻肟钠舒巴坦钠注射液人体耐受性试验
头孢噻肟与舒巴坦不同配比的体外抗菌活性
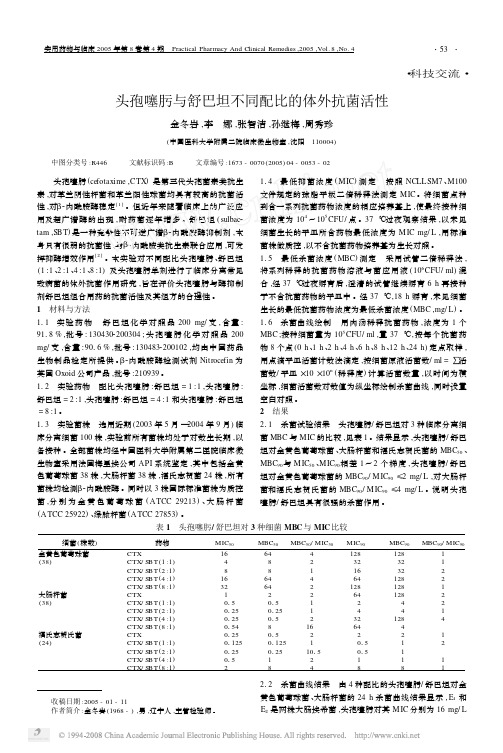
・科技交流・头孢噻肟与舒巴坦不同配比的体外抗菌活性金冬岩,李 娜,张智洁,孙继梅,周秀珍(中国医科大学附属二院临床微生物室,沈阳 110004) 中图分类号:R446 文献标识码:B 文章编号:1673-0070(2005)04-0053-02 头孢噻肟(cefotaxime,CTX)是第三代头孢菌素类抗生素,对革兰阴性杆菌和革兰阳性球菌均具有较高的抗菌活性,对β2内酰胺酶稳定[1]。
但近年来随着临床上的广泛应用及超广谱酶的出现,耐药菌逐年增多。
舒巴坦(sulbac2 tam,SB T)是一种竞争性不可逆广谱β2内酰胺酶抑制剂,本身只有很弱的抗菌性,与β2内酰胺类抗生素联合应用,可发挥抑酶增效作用[2]。
本实验对不同配比头孢噻肟、舒巴坦(1:1、2:1、4:1、8:1)及头孢噻肟单剂进行了临床分离常见致病菌的体外抗菌作用研究,旨在评价头孢噻肟与酶抑制剂舒巴坦组合用药的抗菌活性及其组方的合理性。
1 材料与方法111 实验药物 舒巴坦化学对照品200mg/支,含量: 9118%,批号:1304302200304;头孢噻肟化学对照品200 mg/支,含量:9016%,批号:1304832200102,均由中国药品生物制品检定所提供。
β2内酰胺酶检测试剂Nitrocefin为英国Oxoid公司产品,批号:210939。
112 实验药物 配比头孢噻肟:舒巴坦=1:1,头孢噻肟:舒巴坦=2:1,头孢噻肟:舒巴坦=4:1和头孢噻肟:舒巴坦=8:1。
113 实验菌株 选用近期(2003年5月—2004年9月)临床分离细菌100株,实验前所有菌株均处于对数生长期,以备接种。
全部菌株均经中国医科大学附属第二医院临床微生物室采用法国梅里埃公司API系统鉴定,其中包括金黄色葡萄球菌38株,大肠杆菌38株,福氏志贺菌24株,所有菌株均检测β2内酰胺酶。
同时以3株国际标准菌株为质控菌,分别为金黄色葡萄球菌(A TCC29213)、大肠杆菌(A TCC25922)、绿脓杆菌(A TCC27853)。
注射用头孢噻肟钠说明书

亲爱的朋友,很高兴能在此相遇!欢迎您阅读文档注射用头孢噻肟钠说明书,这篇文档是由我们精心收集整理的新文档。
相信您通过阅读这篇文档,一定会有所收获。
假若亲能将此文档收藏或者转发,将是我们莫大的荣幸,更是我们继续前行的动力。
注射用头孢噻肟钠说明书注射用头孢噻肟钠用于各种敏感细菌引起的严重感染,包括呼吸道感染、泌尿生殖道感染、骨盆炎、子宫内膜炎、盆腔蜂窝织炎、菌血症、败血症、皮肤及软组织感染、腹内感染、骨和关节感染、中枢神经系统感染。
下面是我们整理的,希望对大家有所帮助!注射用头孢噻肟钠商品介绍通用名:注射用头孢噻肟钠生产厂家: 西南制药一厂批准文号:药品规格:2g药品价格:Y 0元【中文名称】头孢噻肟钠【英文名称】Cefotax【功效主治】各种敏感细菌引起的严重感染,包括呼吸道感染、泌尿生殖道感染、骨盆炎、子宫内膜炎、盆腔蜂窝织炎、菌血症、败血症、皮肤及软组织感染、腹内感染、骨和关节感染、中枢神经系统感染。
也可预防术后感染。
【化学成分】头孢噻肟钠其化学名为(6R,7R)-3-[(乙酰氧基)甲基]-7-[2- 氨基-4- 噻唑基-(甲氧亚氨基)乙酰氨基]-8- 氧代-5- 硫杂-1- 氮杂双环[4.2.0] 辛-2- 烯-2- 甲酸钠盐。
其分子式:C16H16N5NaO7S分子量:477.45【药理作用】每克注射粉剂含大约50.5mg 的头孢氨噻肟,其水溶液呈淡黄色至琥珀色,水溶液的颜色决定于其浓度。
水溶液pH 值5.0-7.5 。
本药为瓶装干燥粉末。
本药通过阻止细菌细胞壁的合成而发挥抗菌作用。
本药在B-内酰胺酶存在下具高度的稳定性,且能阻止革兰氏阴性菌产生此酶。
微生物学需氧革兰氏阳性菌:金黄色酿脓葡萄球菌,包括青霉素酶和非青霉素酶产生的菌株,表皮葡萄球菌、酿脓链球菌、无乳链球菌、肺炎链球菌。
需氧革兰氏阴性菌:肠杆菌种、大肠杆菌、流感嗜血杆菌(包括抗氨苄青霉素的流感嗜血杆菌)、淋病奈瑟氏菌(包括青霉素酶和非青霉素酶产生的菌株)、脑膜炎奈瑟氏菌、奇异变杆菌、普通变形杆菌、沙门氏菌。
静脉输液治疗存在的问题

不宜与葡萄糖注射液配伍
抗菌药物美洛西林、阿洛西林、哌拉西林、氨苄西林、氨 苄西林/舒巴坦钠、阿莫西林/克拉维酸钾、乳糖酸红霉素、 新生霉素、伊曲康唑等;抗肿瘤药物羟基喜树碱、依托泊苷、 替尼泊苷、博来霉素、卡莫司汀、顺铂、克拉屈滨、阿法 依泊汀、曲妥珠单抗等;中草药注射剂灯盏细辛、鸦胆子油 乳等。
溶媒用量选择,每种注射剂不仅要有适宜得 溶媒品种,还须适宜得用量配制适宜浓度得 药液。
不溶性微粒影响
输液中加入药物,其不溶性微粒会增加,且加入药物越多,不 溶性微粒数累加越多,不仅超出药品标准,还就是引起输液 反应得一个重要因素。有人曾对临床发生输液反应得残留 液几十批进行检验,结果大部分微粒超过药典规定得几倍至 十几倍,且大多有肉眼可见得杂质,用滤膜法可看到各种各 样得异物,多为碎胶塞、纤维、白点、白块。我国药典 2000年版一部和二部对装量100mL以上静脉注射液中不溶 性微粒有限量要求,而对100mL以下注射剂未作相应要求, 因此100mL以下注射剂加入输液中混合后,难免使输液中 不溶性微粒超标。
输液途径不正确
有些药物只能静脉滴注,不能静脉推注、肌 注等,如广谱半合成青霉素呋布西林钠因溶 解度小,局部刺激性大,不宜作静脉推注或肌 肉注射。类似不宜静推得药物还常见于氨基 糖苷类、氟喹诺酮类、林可霉素类、抗真菌 类药物及钾盐、万古霉素、去甲万古霉素等。 但抗肿瘤药柔红霉素不宜静脉滴注,仅能静 脉注射。
药效学方面得不良相互作用
指输注药物之间,以及同时使用得口服药物之间得药理作用 产生拮抗,致使药效相抵而影响治疗。如对一些青霉素过敏 患者,有医嘱将克林霉素磷酸酯加入输液中静滴,同时口服 红霉素肠溶微丸胶囊或琥乙红霉素,结果不仅患者反映胃肠 不适,且效果不如单用克林霉素者。因为克林霉素与红霉素 及琥乙红霉素(在体内水解释放出红霉素起作用)均作用在 细菌50S核糖体亚单位,通过阻断转肽作用和mRNA位移而 抑制细菌蛋白质合成,联用后呈拮抗作用,使克林霉素和红 霉素作用降低,在克林霉素药品说明书中也提到不宜与红霉 素联用。
注射用头孢哌酮钠舒巴坦(1:1)的细菌内毒素检查法

药 物鉴定
波长处有相近吸收度( n=9 , △ 。 接 近 于 0 故 选 2 8n ) 即 A, 值 , 5 m
为 测 定 波 长 A。 2 3 线 性 关 系考 察
20 08年 第 l 7卷第 3期
2 7 数 据 处 理 ቤተ መጻሕፍቲ ባይዱ 有 效 期 预 测 .
表 2 以黄芩苷为指标的洁肤康洗剂加速试验结果
温度 ( )时 间 ()1 ( 0 ℃ h /r ×1 )残 存 率( ) % =(0 10一G% ) /t l1 gI o
精 密 称 取 黄 芩 苷 对 照 品 20m , 5 % 甲 醇 溶 解 后 , 量 至 . g用 0 定 2 L量 瓶 中 , 匀 , 成 质 量 浓 度 为 8 g mL的 黄 芩 苷 标 准 贮 5m 摇 制 0I / x 备 液 。 密 吸取 上 述 溶 液 0 2 04,. ,. ,. ,. ,. ,. L 精 . ,. 06 0 8 10 12 14 16m , 分 别 置 1 L量 瓶 中, 5 % 甲醇 至 刻 度 , 匀 , 5 % 甲 醇作 空 0m 加 0 摇 用 0 白溶 液 , 2 6a 和 2 8a 波 长 处 分 别 测 定 吸 收 度 , 在 7 m 5 m 将 对 C 进 行线 性 回归 , 回归 方 程 C=2 . 6 一 . 9 , = . 9 得 92 1 8 0 0 3 r 0 9 95 8 (l 8 。 果 表 明 黄 芩 苷 质 量 浓 度 在 16~1 . g m ,= )结 . 2 8I / L范 围 内 与 x
和 26a 波长 处 测 定 吸 收 率 。 7 m
[ ]江 3
波 , 世 祥 , 立 立 , .初 均 速 法 预 测 中 药 复 方 注 射 液 的 有 效 期 侯 孙 等
注射用头孢曲松钠_舒巴坦钠健康人体连续给药耐受性及药代动力学研究

◇研究原著◇中国临床药理学与治疗学中国药理学会主办C N 3421206ΠR ,ISS N 100922501E 2mail :ccpt96@ 2006Apr ;11(4):458-4632003201202收稿 2006202227修回王进,女,硕士,副主任医师,主要从事抗感染化疗、抗菌药物合理应用和临床试验研究。
T el :010********* E 2mail :wjlsq @ 肖永红,通讯作者,男,博士,教授、主任医师,硕导,主要从事抗感染化疗、抗菌药物合理应用和细菌耐药机制等研究。
T el :010********* E 2mail :xiaoy onghong @注射用头孢曲松钠Π舒巴坦钠健康人体连续给药耐受性及药代动力学研究王进,肖永红,吕媛,康子胜,张明,梁军,刘燕,张曼,李天云北京大学第一医院临床药理研究所,北京100083摘要 目的:评价中国健康男性受试者连续7d 静脉滴注头孢曲松钠Π舒巴坦钠(4¬1)的药代动力学特点。
方法:12名受试者静脉滴注头孢曲松钠Π舒巴坦钠(4¬1)注射液2.50g ・d -1,连续7d ,采用高效液相色谱法测定给药后不同时间点头孢曲松和舒巴坦的血、尿浓度,计算主要药代动力学参数。
结果:受试者静脉滴注头孢曲松钠Π舒巴坦钠(4¬1)注射液2.50g ・d -1连续7d 后耐受性良好,头孢曲松血药浓度约在d 4达到稳态,稳态后的平均峰浓度为202.60±26.31mg ・L -1,稳态血药浓度(C av )为60.65±8.85mg ・L -1,AUC ss 为1455.68±212.41mg ・h ・L-1,经计算波动度为3.36%,波动百分数为96.77%;头孢曲松72h 后尿中的累积排泄百分率为43.61%±10.23%,舒巴坦12h 后尿中的累积排泄百分率为71.61%±10.06%。
注射用头孢噻肟钠舒巴坦钠-详细说明书与重点
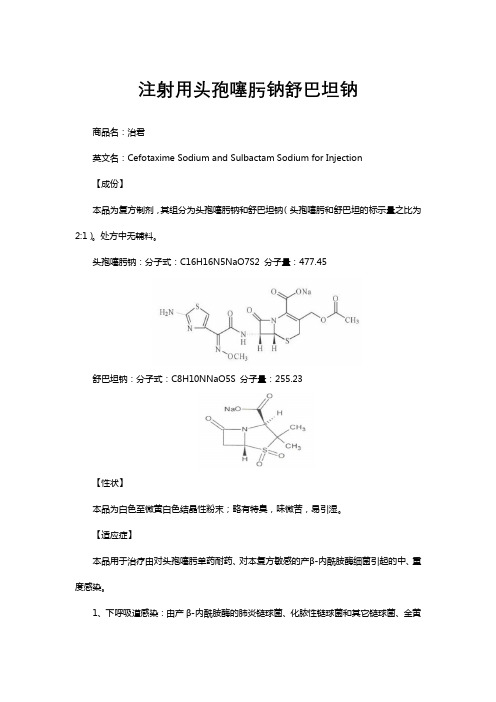
注射用头孢噻肟钠舒巴坦钠商品名:治君英文名:Cefotaxime Sodium and Sulbactam Sodium for Injection【成份】本品为复方制剂,其组分为头孢噻肟钠和舒巴坦钠(头孢噻肟和舒巴坦的标示量之比为2:1)。
处方中无辅料。
头孢噻肟钠:分子式:C16H16N5NaO7S2 分子量:477.45舒巴坦钠:分子式:C8H10NNaO5S 分子量:255.23【性状】本品为白色至微黄白色结晶性粉末;略有特臭,味微苦,易引湿。
【适应症】本品用于治疗由对头孢噻肟单药耐药、对本复方敏感的产β-内酰胺酶细菌引起的中、重度感染。
1、下呼吸道感染:由产β-内酰胺酶的肺炎链球菌、化脓性链球菌和其它链球菌、金黄色葡萄球菌、大肠埃希菌、克雷伯菌属、流感嗜血杆菌等敏感菌所致的肺炎、慢性支气管炎急性发作、急性支气管炎、肺脓肿和其他肺部感染。
2、泌尿生殖系统感染:由产β-内酰胺酶的肠球菌属、表皮链球菌、金黄色葡萄球菌、肠杆菌属、大肠埃希菌、克雷伯菌属等敏感菌所致的急性肾盂肾炎、慢性肾盂肾炎急性发作、复杂性尿路感染、子宫内膜炎、淋病和其它生殖道感染。
3、菌血症/败血症:由产β-内酰胺酶的大肠埃希菌、克雷伯菌属、金黄色葡萄球菌、链球菌属等敏感菌导致的菌血症和败血症。
4、皮肤和皮肤软组织感染:由产β-内酰胺酶的金黄色葡萄球菌、表皮链球菌、化脓性链球菌和其它链球菌、肠球菌属、大肠埃希菌、肠杆菌属、克雷伯菌属、铜绿假单胞菌属、压氧球菌等敏感菌导致。
5、腹腔内感染:由产β-内酰胺酶的链球菌属、大肠埃希菌、克雷伯菌属、拟杆菌属、厌氧球菌、奇异变形杆菌等敏感菌导致。
6、骨和/或关节感染:由产β-内酰胺酶的金黄色葡萄球菌、链球菌属、铜绿假单胞菌和奇异变形杆菌等敏感菌导致的骨和/或关节感染。
7、其他:由产β-内酰胺酶的奈瑟菌属、流感嗜血杆菌等敏感菌导致的脑膜炎,以及外科手术预防感染等。
【规格】2.25g(头孢噻肟1.5g和舒巴坦0.75g)【用法用量】静脉滴注。
注射用头孢哌酮钠舒巴坦钠皮试

注射用头孢哌酮钠舒巴坦钠皮试注射用头孢哌酮钠舒巴坦钠皮试,这是啥玩意儿?俺听过打针,也见过抽血,可这皮试是啥东西呢?别急,听我给你说说。
咱们来聊聊头孢哌酮钠舒巴坦钠。
这是一种抗生素,有点儿像咱们平时感冒发烧吃的阿莫西林。
不过,它可不是用来治感冒的,而是用来对付那些让人难受的细菌。
你说你生病了,医生会给你开这种药,对吧?那这个皮试又是什么呢?皮试,就是给药前先在皮肤上做个小试验,看看你对这个药有没有过敏反应。
这个小试验可重要了,因为有些人对这个药过敏,可能会出现严重的副作用,甚至危及生命。
所以,医生在给你开这种药之前,一定要先做个皮试,确保你是安全的。
那皮试怎么做呢?其实很简单,就是在你的手臂上涂一点点这个药,然后等待一段时间。
如果出现了红肿、瘙痒等症状,说明你对这个药过敏,医生就会建议你不要用这个药。
如果你没有过敏反应,医生才会放心地给你开这个药。
有人说:“这皮试有啥大不了的,不就是做个小试验吗?”其实,这个皮试可是关系到你的身体健康呢!想想看,如果因为皮试没做好,导致你用了过敏的药,那可不是闹着玩儿的。
所以,咱们还是要重视起来,让医生帮你做个皮试,确保你是安全的。
当然啦,虽然皮试很重要,但也不能过于紧张。
有时候,人家医生也是想太多了。
比如说,有个人去做皮试,结果涂了点药就哭爹喊娘的,说自己要死了。
后来医生一查,发现他其实是牙疼,这才恍然大悟。
所以啊,咱们做皮试的时候,也要保持一颗平常心,不要被自己的恐惧所左右。
注射用头孢哌酮钠舒巴坦钠皮试是为了咱老百姓的健康着想。
咱们要相信医生的专业判断,配合他们做好每一个环节。
只有这样,才能让我们的身体更加健康,生活更加美好。
哎呀妈呀,差点儿忘了告诉大家一个好消息。
那个皮试可不是免费的哦!不过没关系啦,毕竟健康是无价的嘛。
而且呢,根据国家规定,对于一些特殊人群,比如孕妇、儿童等,皮试是可以免费做的。
所以,如果你符合条件,千万不要错过这个机会哦!好了好了,今天的“注射用头孢哌酮钠舒巴坦钠皮试”讲座就到这里啦。
高效液相色谱法测定注射用头孢噻肟钠舒巴坦钠中2-巯基苯并噻唑的残留量

高效液相色谱法测定注射用头抱噻肟钠舒巴坦钠中2-疏基苯并噻唑的残留量徐家根1,顾琦欣傅辰超21南京大学医学院附属口腔医院,南京市口腔医院药学部,南京210008;"南京优科制药有限公司,南京210009摘要目的:建立高效液相色谱法测定注射用头孢噻肟钠舒巴坦钠中2-疏基苯并噻唑的残留量。
方法:高效液相色谱法的色谱柱:用十八烷基硅烷键合硅胶为填充剂Kromasil100-5-C i>(250mm!4.6mm,5%;流动相:甲醇-10mmol・L-1乙酸铵(55:45);柱温:30#;检测波长:320 nm;流速:1.0mL•min-1;进样量:10|nL o结果:定量限、检测限、线性关系、耐用性、重复性、进样精密度均良好*结论:本法可用于注射用头孢噻肟钠舒巴坦钠中2-疏基苯并噻唑限度的测定*关键词注射用头孢噻肟钠舒巴坦钠;高效液相色谱法;基因毒性杂质中图分类号R927.11文献标志码A文章编号1673-7806(2020)06-435-03注射用头抱噻肟钠舒巴坦钠⑴用于治疗由头抱噻肟单药耐药、对本复方敏感的产!-内酰胺酶细菌引起的中、重度感染药物o原料药头抱噻肟钠其工艺引入的2-巯基苯并噻坐#2$属于基因毒性杂质⑶,将其作为已知特定杂质进行控制研究。
2-巯基苯并噻坐是一种淡黄色粉末或颗粒,具有令人不愉快的气味;熔点在173.0!以上;难溶于水和正己烷,易溶于丙酮,可溶于乙醇,且具有紫外吸收o 高效液相色谱仪中的紫外检测器检测灵敏度高,对于高沸点、大分子、强极性、热稳定性差化合物的分离分析,显示出优势,所以选择液相色谱法紫外检测器检测注射用头抱噻肟钠舒巴坦钠中2-巯基苯并噻坐的限度更为准确、灵敏。
本方法测定的复方制剂头抱噻肟钠舒巴坦钠,与文献中的头抱噻肟钠相比,成分更加复杂,在文献的色谱条件下检测时,存在干扰,见图1"本方法能够为检测注射用头抱噻肟钠舒巴坦钠中2-巯基苯并噻坐限度提供有效控制方法⑷。
头孢噻肟钠舒巴坦钠皮试方法[精华]
![头孢噻肟钠舒巴坦钠皮试方法[精华]](https://img.taocdn.com/s3/m/606d6ec229ea81c758f5f61fb7360b4c2f3f2a50.png)
关于注射用头孢噻肟钠舒巴坦钠皮试方法
关于注射用头孢噻肟钠舒巴坦钠(2:1,2.25g,含头孢噻肟1.5g)皮试液浓度配置的建议方法如下,敬请参考。
一、皮试溶液的配制:
1、病员少、头孢噻肟钠舒巴坦钠用量少的时候皮试液配制:
2.25g头孢噻肟钠舒巴坦钠+10ml氯化钠注射液,得A液(含头孢噻肟1.5g);
吸取A液0.2ml+0.8ml氯化钠注射液得30mg/ml溶液(B液);
推掉0.9ml,余0.1ml+氯化钠注射液0.9ml得3mg/ml溶液(C液);
推掉0.9ml,余0.1ml+氯化钠注射液0.9ml得0.3mg/ml (D液)即皮试液。
注:1ml头孢噻肟钠舒巴坦钠皮试液现配现用
2、病员多、头孢噻肟钠舒巴坦钠使用频率高的时候皮试液配制:
2.25g头孢噻肟钠舒巴坦钠+10ml氯化钠注射液,得A′液(含头孢噻肟1.5g)
吸取A′液0.2ml+100ml氯化钠注射液(塑料或玻璃瓶装),得0.3mg/ml(B′液)即皮试液.
注:100ml头孢噻肟钠舒巴坦钠皮试液可在无菌操作法冰箱2-8°C冷藏,保存时间不超过24小时
二、皮试方法及结果观察
1、每次抽取皮试液0.1ml做皮内试验。
具体操作及观察方法均同青霉素皮试方法。
2、皮试阴性者,用药后仍有发生过敏的可能,故在用药期间应密切观察。
若有过敏情况,应立即停药,报告医生,及时诊断实施医疗救治。
头孢类药可致交叉过敏,凡使用某一种头孢类药有过敏现象者,一般不可再使用其他品种。
3、其他详见《医疗护理技术操作常规》的有关内容
4、以上仅供参考。
头孢噻肟钠-舒巴坦钠使用量对鲍曼不动杆菌耐药的相关性分析

头孢噻肟钠-舒巴坦钠使用量对鲍曼不动杆菌耐药的相关性分析俞燕华;任可;马卫成【摘要】目的探讨不同使用量的头孢噻肟钠-舒巴坦钠复合制剂与鲍曼不动杆菌耐药性的关系.方法将94株经生化分析和药敏鉴定的痰培养鲍曼不动杆菌分为试验者和对照组.试验组(47株)采用头孢噻肟钠-舒巴坦钠复合制剂抑菌,对照组(47株)采用头孢噻肟钠单方制剂抑菌,比较两组不同抗菌药平均每天每百床患者用药的频率(DDDs/100BD)和同期对鲍曼不动杆菌的耐药率变化,对抗菌药物使用量与耐药率进行分析.结果头孢噻肟钠-舒巴坦钠复方制剂与鲍曼不动杆菌对该药耐药率呈正相关(r=0.9712,P<0.05);头孢噻肟钠单方制剂与鲍曼不动杆菌对该药耐药率也呈正相关(r=0.9907,P<0.05).复方用药相对于单方制剂用药而言,可有效改善耐药菌对抗菌药的敏感性.结论头孢噻肟钠-舒巴坦钠抗菌药物使用量与鲍曼不动杆菌耐药性间存在相关性,且随着抗菌药使用量的增加,细菌的耐药性越强.【期刊名称】《现代实用医学》【年(卷),期】2016(028)004【总页数】2页(P542-543)【关键词】鲍曼不动杆菌;头孢噻肟钠-舒巴坦钠;微生物敏感性试验【作者】俞燕华;任可;马卫成【作者单位】315100 宁波,宁波市鄞州第二医院;315100 宁波,宁波市鄞州第二医院;315100 宁波,宁波市鄞州第二医院【正文语种】中文【中图分类】R446.5鲍曼不动杆菌(Ab)是医院感染的一类重要的革兰阴性非发酵类条件致病菌[1]。
根据2013年中国细菌耐药性监测网数据显示,我国10省市15家教学医院中 Ab占临床分离革兰阴性菌的18.7%,仅次于大肠埃希菌与肺炎克雷伯菌[2]。
因此对Ab的耐药性监测,以及耐药率的变化趋势分析,对指导医院临床用药,减少广谱耐药菌的生成有重要意义。
近年研究表明,广泛使用抗菌药是导致医院耐药菌产生的主要原因,且药物不同比例的使用与耐药菌的耐药性间存在相关性。
注射用头孢哌酮钠舒巴坦钠(2:1)无菌检查法的研究

注射用头孢哌酮钠舒巴坦钠(2:1)无菌检查法的研究刘荔;田妮娜;朱仁愿;张晓萍;李天荣【摘要】建立注射用头孢哌酮钠舒巴坦钠的无菌检查方法.按照《中国药典》2015年版四部通则无菌检测方法适用性实验的有关要求,采用薄膜过滤法进行实验.采用400mL冲洗液并加入青霉素酶时,6株阳性试验菌株均可正常生长,阴性对照及样品无菌生长,试验组有菌生长.此方法可有效消除注射用头孢哌酮钠舒巴坦钠的抑菌活性,可按此方法进行无菌检查.【期刊名称】《甘肃科技》【年(卷),期】2019(035)006【总页数】3页(P94-95,46)【关键词】注射用头孢哌酮钠舒巴坦钠;无菌检查法;薄膜过滤法【作者】刘荔;田妮娜;朱仁愿;张晓萍;李天荣【作者单位】兰州市食品药品检验所,甘肃兰州 730050;兰州市食品药品检验所,甘肃兰州 730050;兰州市食品药品检验所,甘肃兰州 730050;兰州市食品药品检验所,甘肃兰州 730050;兰州大学,甘肃兰州 730000【正文语种】中文【中图分类】R927头孢哌酮钠舒巴坦钠是一种复合制剂,舒巴坦为广谱酶抑制剂,且具有较弱的抗菌活性,对金黄色葡萄球菌及多数阴性杆菌产生的β-内酰胺酶具有强大而不可逆的抑制作用,但对某些阴性杆菌染色体介导的β-内酰胺酶却无活性;头孢哌酮是第三代头孢菌素,对β-内酰胺酶的稳定性较差,与舒巴坦联合使用,可增加头孢哌酮抵抗多种β-内酰胺酶降解的能力,对头孢哌酮产生显著的增效作用[1-2]。
注射用头孢哌酮钠舒巴坦钠临床主要用于治疗由流感杆菌、产气杆菌、摩根杆菌、类杆菌、大肠杆菌、氟劳地枸橼酸杆菌、阴沟肠杆菌、不动杆菌、肺炎杆菌和其他敏感菌所致的呼吸系统感染、泌尿生殖系统感染、腹膜炎、胆囊炎、胆道感染、腹腔内感染、败血症等。
根据《中国药典》2015年版四部通则无菌检测方法要求,无菌制剂必须进行无菌检查,本文旨在探索并建立注射用头孢哌酮钠舒巴的无菌检查法。
1 实验仪器与材料1.1 实验仪器Steritest Equinox无菌智能集菌仪(MerckMillipore公司),IN160 恒温培养箱(Memmert公司),MJ-70-I霉菌培养箱(上海跃进医疗器械有限公司),KDGB330一次性全封闭集菌培养器(浙江泰林生物技术股份有限公司)。
注射用头孢噻肟钠

注射用头孢噻肟钠【药品名称】通用名称:注射用头孢噻肟钠英文名称:Cefotaxime Sodium for Injection【成份】本品主要成分为头孢噻肟钠。
【适应症】用于敏感致病菌所致的下呼吸道感染、尿路、胆道感染,以及腹腔感染、盆腔感染、皮肤软组织感染、骨和关节感染、败血症、脑膜炎等及手术期感染预防。
本品单剂可治疗单纯性淋病。
【用法用量】成人一日2~6g,分2~3次静脉注射或静脉滴注;严重感染者每6~8小时2~3g,一日最高剂量不超过12g。
治疗无并发症的肺炎链球菌肺炎或急性尿路感染,每12小时1g。
新生儿日龄小于等于7日者每12小时50mg/kg,出生大于7日者,每8小时50mg/kg。
治疗脑膜炎患者剂量可增至每6小时75mg/kg,均以静脉给药。
严重肾功能减退病人应用本品时须适当减量。
血清肌酐值超过424?mol/L(4.8mg)或肌酐清除率低于20ml/分时,本品的维持量应减半;血清肌酐超过751?mol/L(8.5mg)时,维持量为正常量的1/4。
需血液透析者一日0.5~2g。
但在透析后应加用1次剂量。
【不良反应】静脉注射发生的血栓性" target=_blank>静脉炎和肌内注射区疼痛均较头孢噻吩为轻为少。
" target=_blank>药疹发生率为1.1%。
嗜酸性粒细胞增加的发生率为1.7%。
单独以药物热为表现的过敏反应也偶有报告。
个别病人可出现暂时性血清转氨酶、碱性磷酸酶升高。
【禁忌】1.对头孢菌素类抗生素过敏者禁用;2.老年患者虚弱、营养不良或有重度肾功能损害者慎用;3.新生儿应慎用或避免使用本品;4.孕妇和哺乳期妇女慎用。
【注意事项】1.交叉过敏反应:对一种头孢菌素或头霉素(cephamycin)过敏者对其他头孢菌素或头霉素也可能过敏。
对青霉素类、青霉素衍生物或青霉胺过敏者也可能对头孢菌素或头霉素过敏。
对青霉素过敏病人应用头孢菌素时发生过敏反应者达5%~10%;如作免疫反应测定时,则对青霉素过敏病人对头孢菌素过敏者达20%;2.对青霉素过敏病人应用本品时应根据病人情况充分权衡利弊后决定。
头孢噻肟钠他唑巴坦钠注射液静脉滴注在健康志愿者的临床药代动力学研究及其算法探讨

头孢噻肟钠他唑巴坦钠注射液静脉滴注在健康志愿者的临床药代动力学研究及其算法探讨许羚;盛玉成;郑青山【期刊名称】《中国临床药理学与治疗学》【年(卷),期】2005(10)11【摘要】目的:研究头孢噻肟钠他唑巴坦钠(31)注射液单次和多次静脉滴注在健康志愿者中的药代动力学和安全性。
方法:男女各半的32名受试者随机分为3个单次给药剂量组和一个多次给药剂量组。
用药后采用高效液相色谱法和液-质联用分别测定4组受试者不同时间点两种药物的血药浓度以及单次给药中剂量组的尿药中两种药物的浓度。
经DAS软件处理后,求出其药动学参数。
结果:受试者用药后头孢噻肟钠、他唑巴坦钠均符合二室模型。
单剂量给药6.0、2.4、1.2g剂量组头孢噻肟钠t12β分别为2.53±1.51、2.23±1.18、2.68±2.65h,MRT0-tn分别为2.1±0.24、1.25±0.19、1.2±0.17h,AUC0-tn分别为312.87±134.15、137.92±39.89、69.18±16.54mg·h·L-1,AUC0-∞分别为318.64±137.4、141.4±40.46、71.26±17.44mg·h·L-1。
他唑巴坦钠t12β分别为0.55±0.07、0.48±0.22、0.47±0.28h,MRT0-tn分别为1.56±0.08、0.91±0.07、0.78±0.04h,AUC0-tn分别为64.5±14.69、22.14±8.41、11.9±3.22mg·h·L-1,AUC0-∞分别为66.63±15.33、23.26±8.29、13.64±3.46mg·h·L-1。
静注头孢噻肟钠致过敏性休克1例

静注头孢噻肟钠致过敏性休克1例
孙丽芬;谭功举
【期刊名称】《四川医学》
【年(卷),期】2002(23)4
【摘要】@@ 患者,女,48岁.咳痰半月,因患支气管炎予静滴青霉素5天,症状无改善,改用头孢噻肟钠3.0g(四川长征制药股份有限公司,川卫药准字1985,第003585号,药品GMP认证,证书编号B0187)加生理盐水100ml静脉注射.拔针前5分钟,病人感心慌、气紧、胸闷,胃部不适,呕吐胃内容物约100ml.同时伴腹泻一次,量较多,查体:病人烦躁不安,面色苍白,口唇发绀,神志不清,肢体冰冷,双侧瞳孔等大等圆,直径约3mm,光反射迟钝,BP0/0,脉搏扪不清.心电图示:心肌缺血.
【总页数】1页(P346)
【作者】孙丽芬;谭功举
【作者单位】成都铁路局中心医院,四川成都,610081;成都铁路局中心医院,四川成都,610081
【正文语种】中文
【中图分类】R97
【相关文献】
1.碘过敏试验阴性静注泛影葡胺致过敏性休克1例 [J], 李菊;陈翔
2.静注硫普罗宁致过敏性休克1例 [J], 孙健苗;何定峰
3.静注维生素K1致过敏性休克2例 [J], 张洪英;杜晓娅
4.静注头孢哌酮舒巴坦钠致过敏性休克的抢救期护理 [J], 段英梅;白娟;李思莹
5.静注头孢哌酮舒巴坦钠致过敏性休克的抢救期护理 [J], 段英梅;白娟;李思莹因版权原因,仅展示原文概要,查看原文内容请购买。
高效液相色谱法测定生物样本中头孢噻肟和舒巴坦的浓度

高效液相色谱法测定生物样本中头孢噻肟和舒巴坦的浓度顾宜;王晓娟;王荣;白娟娟;高苏莉【期刊名称】《第四军医大学学报》【年(卷),期】2006(027)022【摘要】目的: 为静滴注射用头孢噻肟钠舒巴坦钠后在血浆和尿液中的药物浓度分析提供检测方法. 方法:采用HPLC测定头孢噻肟钠血浆和尿液中浓度. 在血样中加入甲醇沉淀蛋白后,尿样用超纯水稀释后取上清液进样,色谱分析条件: 以C18反相柱作分析柱;柱温:室温;流速: 1 Ml/min;头孢噻肟和舒巴坦的流动相分别为:1g/L的三乙胺水溶液(用磷酸调Ph值6.2)∶甲醇=68∶32和84∶16;头孢噻肟和舒巴坦的紫外检测波长分别为254 nm和220 nm. 结果:头孢噻肟血样和尿样的线性范围分别为5.3~530.0 mg/L和5.45~545.00 mg/L,最低检测浓度分别为1.00 mg/L 和0.25 mg/L;舒巴坦血样和尿样的线性范围为1.04~208.00 mg/L,最低检出浓度分别为0.5 mg/L和0.25 mg/L;方法平均提取回收率在 (89~110)%之间;日内、日间RSD均小于5%. 头孢噻肟和舒巴坦血浆和尿液样品置于-20℃冰箱3 d内稳定. 结论:本方法具有快速、简便、灵敏、准确等特点,适合于头孢噻肟和舒巴坦血浆和尿液浓度测定.【总页数】4页(P2106-2109)【作者】顾宜;王晓娟;王荣;白娟娟;高苏莉【作者单位】第四军医大学,口腔医院药剂科,陕西,西安,710033;第四军医大学,口腔医院药剂科,陕西,西安,710033;第四军医大学,口腔医院药剂科,陕西,西安,710033;第四军医大学,口腔医院药剂科,陕西,西安,710033;第四军医大学,西京医院药剂科,陕西,西安,710033【正文语种】中文【中图分类】R4【相关文献】1.不同添加剂处理样本对高效液相色谱法测定血氯氮平及其代谢产物浓度的影响[J], 郭新胜;王冀康;师天元;姜锋;张红亚2.高效液相色谱荧光法测定血浆中左氧氟沙星的浓度及其生物等效性研究 [J], 杨小英;张文萍;王欣瑜;党宏万3.高效液相色谱法测定血清中头孢噻肟浓度 [J], 李发美;郭礼新4.高效液相色谱法测定注射用头孢噻肟钠舒巴坦钠中2-巯基苯并噻唑的残留量 [J], 徐家根;顾琦欣;傅辰超5.高效液相色谱串联质谱法测定人血浆中吲达帕胺浓度及生物等效性研究 [J], 景贤;王医成;欧阳冬生;陈尧;周淦;阳国平;周宏灏;谭志荣因版权原因,仅展示原文概要,查看原文内容请购买。
静滴头孢噻肟钠引起过敏性休克1例

静滴头孢噻肟钠引起过敏性休克1例
孔瑞芳;谢菊萍;蔡英杰
【期刊名称】《中华腹部疾病杂志》
【年(卷),期】2004(4)3
【摘要】病人女,20岁。
有青霉素过敏史。
因支气管肺炎,遵医嘱应用头孢噻肟钠(上海新亚药业有限公司生产,批号:1.0g,H31021720)抗感染治疗。
现配制浓度为0.5mg/ml头孢噻肟钠皮试液,取0.1ml皮内注射,20min观察皮试结果为阴性。
即给予5%糖盐水250ml加头孢噻肟钠1.0g,以约20滴/min 的速度滴入,约10min,病人自述无不适。
而后以40滴/min速
【总页数】1页(P232-232)
【作者】孔瑞芳;谢菊萍;蔡英杰
【作者单位】山东省济宁市第一人民医院,272111;山东省济宁市第一人民医
院,272111;山东省济宁市第一人民医院,272111
【正文语种】中文
【中图分类】R978.1
【相关文献】
1.静滴头孢噻肟钠过敏性休克死亡1例 [J], 任鹏;张书韬;高洪维
2.头孢噻肟钠静滴致过敏性休克1例 [J], 龚学红
3.头孢噻肟钠静滴致过敏性休克1例抢救护理体会 [J], 黄永淑
4.婴儿静滴头孢噻肟钠引起严重过敏反应1例 [J], 孔令芳;曾燕
5.头孢噻肟钠引起过敏性休克二例 [J], 程敏;姜海云
因版权原因,仅展示原文概要,查看原文内容请购买。
注射用头孢噻肟钠他唑巴坦钠(6∶1)含量测定方法的研究

注射用头孢噻肟钠他唑巴坦钠(6∶1)含量测定方法的研究陈爱萍;朱雪萍;戴云志【期刊名称】《天津药学》【年(卷),期】2016(028)005【摘要】Objective:To establish a new method for quantitative determination of cefotaxime and and tazobactam simultaneously in the injection preparation with cefotaxime sodium and tazobactam sodium at a ratio of 6 to 1.Methods: An RP-HPLC method was adopted.The analysis was performed on Agilent Eclipse Plus C18 column (4.6 mm ×250 mm, 5 μm) with a mobile phase consisting of methanol-potassium dihydrogen phosphate buffer (6.7 g potassium dihydrogen phosphate dissolved in water with 3ml of phosphoric acid and 2ml of butyl ammonium hydroxide and diluted to 1 000 ml) (27∶73) .The flow rate of of the mobil phase was 1.0 ml/min.The detection wavelength was set at 220nm;and column temperatu re was 30℃;Injection volume was 20ul.Re-sults:Cefotaxime and tazobactam were well-separated with resolution of 7.89.Cefotaxime and tazobactam was also separated from other impurities.The linear range of cefotaxime and tazobactam were 0.516~4.124μg and 0.083~0.663μg(r=1) respectively with RSD less than 1.04%;LOQs were 0.11 ng and 0.23 ng, respectively;The average recoveries of cefotaxime and tazobactam were 100.6%(RSD was 0.79%,n=9) and 100.4%( RSD was 0.94%,n=9),respectively.Conclusions: This method was proved to be simple,specific, accurate, and can be used to simultaneous determination of cefotaxime and tazobactam in cefotaxime sodium and tazobactam sodium (6∶1) for injection.%目的:建立同时测定注射用头孢噻肟钠他唑巴坦钠(6∶1)中头孢噻肟和他唑巴坦含量的方法。
皮试后静脉滴注头孢噻肟钠致过敏性休克1例

皮试后静脉滴注头孢噻肟钠致过敏性休克1例
陈良容
【期刊名称】《中国实用医药》
【年(卷),期】2009(004)032
【摘要】@@ 1 临床资料rn患者,女,65岁,因患胆囊炎来我院治疗.既往无药物过敏史.查体心肺未见异常.用头孢噻肟钠粉针剂(安徽威尔曼制药有限公司,批号0904017)3.0加入5%葡萄糖液250 ml中静脉滴注,滴注前常规用本品500
μg/ml浓度做皮肤过敏试验,皮试结果阴性后予以静脉滴注.
【总页数】1页(P154)
【作者】陈良容
【作者单位】644603,四川省宜宾县骨科医院
【正文语种】中文
【相关文献】
1.对快速过敏皮试仪皮试结束后观察时间点的探讨 [J], 崔振坤
2.1例头孢噻肟钠静脉滴注致过敏性休克的抢救 [J], 段晓琴
3.静脉滴注头孢噻肟钠致过敏性休克1例 [J], 胡登发;李绍荣
4.静脉滴注头孢噻肟钠致过敏性休克1例 [J], 宋淑文;徐英杰;等
5.6例青霉素皮试后皮试部位感染的原因分析 [J], 陈远森;阮亚雄;向金平
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
单次静滴注射用头孢噻柄钠舒巴坦钠注射液人体耐受性试验作者:罗新民,郭亚权,顾宜,王晓娟,王荣,白娟娟,元英进【关键词】注射用头孢噻肟钠;舒巴坦钠;耐受性;健康志愿者【Abstract】 AIM: To evaluate the safety of cefotaxirae/sulbactamin Chinese healthy volunteers after a single intravenous infusion administration. METHODS: The trial protocol was designed according tothe Good Clinical Practice (GCP). After physical examination andlaboratory tests were performed, 30 healthy volunteers were divided randomly into 3 groups, including 3.0 g (cefotaxime/sulbactam: 2 g/1 g),4.5 g (cefotaxime/sulbactam: 3 g/1. 5 g) and 6. 0 g(cefotaxime/sulbactam: 4 g/2 g) , with 10 subjects in each group (5male and 5 female, age range 30 to 39 years). Clinical symptoms,vital signs, routine blood tests, routine urine tests, hepaticfunction, renal function, blood electrolytes, and electrocardiogramwere observed or examined before and after a single intravenousinfusion administration of cefotaxime/sulbactam. RESULTS: After asingle intravenous infusion of 3-6 g cefotaxime/sulbactam, the vital signs, clinical symptoms and laboratory tests were all in the normal range, and no adverse drug reactions were observed in every healthy volunteer. CONCLUSION: Single intravenous infusion administration of cefotaxime/sulbactam (up to 6 g) in 30 Chinese healthy volunteers issafe and tolerable.[Keywords】 cefotaxime; sulbactam; tolerance; healthy volunteers【摘要】目的:在中国健康志愿者中评价单剂量静滴注射用头孢噻肟钠舒巴坦钠的安全性、耐受性.方法:根据新药临床试验指导原则,将经体检及实验室检査,各项指标均在正常范围内的30名健康成人随机分配至低剂量为3. 0g (头孢噻瑕钠2§和舒巴坦钠1 g),中剂量为4.5 g (头孢噻肟钠3§和舒巴坦钠1.5 g);高剂量为6.0 g (头孢噻瑕钠4 8和舒巴坦钠2 g)的3个剂量组,每组10名受试者,男女各半,年龄30〜39岁.观察指标为临床症状、生命体征、心电图、血常规、尿常规、肝功能、肾功能、电解质等.结果:单次静滴注射用头孢噻肟钠舒巴坦钠3〜6 ^志愿者体温、脉搏、呼吸频率、血压、心电图、血常规、肝功能、肾功能、电解质等各项指标测定值均在正常范围内,用药前后比较差异无统计学意义(P>0.05),所有受试者均无不良反应发生.结论:单次静滴注射用头孢噻肟钠舒巴坦钠最大剂量至6 &比较安全、耐受性较好.【关键词】注射用头孢噻肟钠;舒巴坦钠;耐受性;健康志愿者0引言注射用头孢噻肟钠舒巴坦钠抗菌复合药物是一类化学新药.头孢噻厢钠属第三代半合成头孢菌素类,其抗菌谱广,对革兰阴性菌、革兰阳性菌、需氧菌和某些厌氧菌均有较好的抗菌活性,特别对革兰阴性菌的杀灭作用更强[1]. 随着头孢噻肟在临床的广泛使用,许多临床病原菌对头孢噻厢产生耐药性而导致临床治疗方案的失败[2].这些治疗的失败通常是由细菌产生的0内酰胺酶造成的.细菌产生的^内酰胺酶导致头孢噻肟结构中0内酰胺环被水解破坏.针对临床中耐药菌株日渐增加的情况,临床上采用不可逆的竞争性0内酰胺酶抑制剂作用丁1内酰胺酶的活性部位,使其失活.舒巴坦为半合成0内酰胺酶抑制剂,与头孢噻肟合用时出现协同作用,可以增强头孢噻厢对革兰阴性杆菌的体外抗菌活性,使对头孢噻辟耐药的细菌的最低抑菌浓度下降到敏感范围之内[3-4].体内抗菌试验也表明,注射用头孢噻肟钠舒巴坦钠的抗菌活性对产酶的金葡萄球菌、大肠埃希菌和肺炎克雷伯菌感染小鼠的作用,明显优于单组分头孢噻肟钠[5].经国家药品监督管理局的批准(临床研究批件号:2005L00727),我们对静滴注射用头孢噻肟钠舒巴坦钠进行耐受性临床试验,旨在了解中国人对该药的耐受性和安全性,为确定II期临床试验的安全给药范围提供参考依据.1材料和方法1. 1药品注射用头孢噻肟钠舒巴坦钠(2 : 1),规格为1. 5 g/瓶,批号为040615.由湘北威尔曼制药有限公司提供.1. 2给药途径药物用生理盐水100 mL稀释后,在0. 5 h内静脉滴注.1.3受试者选择标准入选标准:受试者接受全面体检,测量身高、体质量、脉搏、呼吸频率、血压、心电图、胸透、血常规、肝功能、肾功能、电解质、尿常规等实验室检查,选择年龄30〜39岁,体质指数(8姑1)在19〜24以内的体检结果正常、依从性好的志愿者.按照赫尔辛基宣言和00?指导原则,试验前,受试者需获得关于研究的性质、目的、受益和风险的相关信息资料,并自愿签署书面知情同意书,允许其中途退出试验.试验前试验方案需获得伦理委员会审查通过.淘汰标准:既往患有重病;有药物或食物过敏史;3!^内用过已知对某脏器有损害的药物或目前正在使用药物者;滥用药物;4 mo内参加过药物试验;嗜酒、吸烟;妊娠或月经期、哺乳期妇女;在筛选中,实验室资料和全面体检发现存在有临床意义的异常者.1.4试验设计1.4.1剂量设置头孢噻肟钠对成人轻、中度感染的每日常用剂量为2〜6 g,舒巴坦钠的每日最大推荐剂量为4 g.根据本复方制剂有关临床前研究资料及所含两种药物临床常用剂量资料,设计注射用头孢噻西钠舒巴坦钠低剂量为2. 0 g (头孢噻瑕钠 2 g和舒巴坦钠 1 g),中剂量为 4. 5 g (头孢噻肟钠 3 g和舒巴坦钠 2 g).采和舒巴坦钠 1.5 g);高剂量为 6.0 g (头孢噻肟钠 4§用随机化设计方法,将入选30名受试者分配至低中高剂量组,每组10名,男女各半.只有当充分审核低剂量组的安全性和耐受性资料后,才可开始下一组剂量的给药.每位受试者只接受一次试验.每个剂量组要在前一剂量组试验结束后至少48 h后才能进行试验.如果没有出现明显的不可耐受的临床不良反应或有临床意义的实验室检查异常,耐受性试验将持续进行.如果出现以上任何情况,需迅速给予治疗,并停止进一步增加剂量试验时,即迅速通过电话将不良事件报告国家药品临床研究基地和伦理委员会、国家药品监督管理局ADR监察中心及申办单位.1. 4. 2观察指标全部受试者均在临床药理基地I期试验病房住院观察,统一膳食、定时监测.给药前受试者将进行全面体检,包括测量体温、脉搏、呼吸频率、血压、心肺检查等;给药后密切观察受试者神经、呼吸、泌尿、消化等系统的体征和主诉症.给药前 1 (1及给药结束后第1日和第3日受试者将接受血常规检查、血生化检查(包括0?1,GOT,ALP, Y GT, LDH, Cr,BUN,总胆素、尿酸、血糖、甘油三酯等)、尿常规检查、粪常规检查和肝、肾功能,心电图检查.整个试验过程中记录不良事件.1.4. 3追踪随访如果发现有临床意义的异常表现或实验室检査结果,给药7 d后,要随访复查异常项目是否恢复正常.统计学处理:将受试病例资料经核对无误后录入计算机,建立数据库.数据用^±5表示,用3?33 10.0软件处理数据,对各剂量组入选者各项临床指标和实验室指标给药前、给药前后差值及给药后的组间差异等分别进行方差分析,P<0. 05表示差异有统计学意义.2结果2.1受试者一般状况及分析各剂量组间可比性分析见表1.各组入选受试者年龄、身高、体质量、体温、脉搏、呼吸频率、卧立位血压、血常规、肝功能、肾功能、电解质及心电图等各项指标测定值均在正常范围内,极少数化验指标组间差异有统计学意义,但均在正常范围内,无临床意义.各组入选受试者条件均衡,具较好的可比性.表1耐受性试验受试者一般状况(略)2.2各项观察指标的结果及分析给药前后进行了三次全面检查,所有受试者均无异常发现,各项生命体征平稳,试验前后体检心电图、血、尿、粪常规均正常,肝、肾功检查也无异常值,部分体检结果见表2.3讨论复方抗生素的研究与开发是我国抗生素开发领域的热点[6].头孢噻厢钠与舒巴坦钠分别使用时副作用发生率低,主要有过敏反应,瘙痒、荨麻疹、药热、嗜酸性粒细胞增多等,偶见暂时性中性粒细胞减少,表2受试者试验前后部分体检结果略)血小板减少,静滴给药可发生静脉炎.小鼠急性毒性试验结果表明:一次静脉注射用头孢噻肟钠/舒巴坦钠的1050>6§八§;静脉注射用头孢噻肟钠的最大耐受剂量为8§八§;静脉注射用舒巴坦钠的[050为 6.06 g/kg.小鼠一次静脉注射复方注射用头孢噻肟钠/舒巴坦钠的急性毒性介于单方注射用头孢噻肟钠和舒巴坦钠之间[7].头孢噻肟钠与舒巴坦钠合用对人体是否有毒性,这是我们的研究目的.本试验我们对注射用头孢噻肟钠舒巴坦钠进行了在中国健康志愿者中的单次静滴后的安全性、耐受性研究,试验结果表明,注射用头孢噻肟钠舒巴坦钠 3 个给药剂量(3.0, 4.5和 6.0 g)均为健康受试者良好耐受,给药前后主要体检指标无明显变化,也无不良反应发生,最大耐受剂量为6/次.因此该制剂§的11期临床试验剂量静滴 6 g/次以内时安全性良好.以上结果是观察健康志愿者得到的,在患者身上可能会有不同反应,在11期临床使用期间,应注意进一步观察不良反应,并根据微生物学和药代动力学结果确定临床用药剂量和间隔.【参考文献】[1]Barry AL, Brown SD. Revision of quality control limits forcefotaxime disk susceptibility tests [J] . Clin Microbiol Infect,2000,6(5) :285-286.[2]Cheung TK, Chu YW, Chu MY, et al. Plasmidmediatedresistance to ciprofloxacin and cefotaxime in clinical isolates ofsalmonella enterica serotype enteritidis in HongKong [J] . JAntimicrob Chemother, 2005, 56(3):586-589.[3]张永龙,李家泰.舒巴坦与第三代头孢菌素联合对第三代头孢菌素耐药菌的体外抗菌作用研究[J].中国临床药理学杂志,2000,16(5):323-326.[4]金冬岩,李娜,张智洁,等.头孢噻肟与舒巴坦不同配比的体外抗菌活性[J].实用药物与临床,2005,8(4):53-54.[5]符健,邢增术,邢桂兰.注射用头孢噻肟钠舒巴坦钠的体内抗菌作用研究[J].海南大学学报(自然科学版),2004,22(2):167-169.[6]王涛,张克坚.对复方抗生素研发及评价的探讨[_1].中国临床药理学杂志,2003,19(6) :467-470.[7]张淑华,欧真容,黄秀华,等.舒巴坦钠与第三代头孢菌素头孢噻肟钠联合用药的体内外抗菌作用[J].四川生理科学杂志,2003,25(4):177.。
