结构简式年级高三
高三第一轮复习之有机物的分类、结构和命名

立体异构
乳酸
练习:
10个碳原子以内,一溴代物只有一种的烷烃?
CH4
CH3 CH3 C CH3
CH3CH3
CH3 CH3
CH3 C
C
CH3
CH3
CH3 CH3
2.确定一元取代物的同分异构体的基本方法与技巧
(1)等效氢
①同一碳原子上的氢原子是等效的 ②同一碳原子上所连接甲基上的氢原子是等效的 ③处于同一面对称位置上的氢原子是等效的 练习: 某烃的一种同分异构体只能生成一种一氯化物, 该烃的结构简式(分子式)可能是:
体的相对密度为D相对)
(三)有机化合物结构的研究
有机化合物中相对稳定的一部分结构 1.基团: 1838年李比希提出了“基”的定义 : 1.基是一系列化合物中不变的部分
2.基在化合物中可被某种元素的单个原子所置换 3.置换基的基团,可被其他基团所取代
羟基 -OH 醛基 -CHO 羧基 -COOH 氨基 -NH2 烃基 -R
甲醚的核磁共振谱图显示 分子中只有一种氢原子
乙醇的核磁共振谱图 显示分子中有三种氢原子
(2)红外光谱(IR)
利用有机化合物分子中不同基团的特征吸收频 率不同,测试并记录有机化合物对一定波长范 围的红外光吸收情况,可用来判断该有机化合 物具有哪些基团。
乙醇的红外光谱图 分子中有三种基团(依次 为-OH、-CH3、-CH2)
一、有机物的分类
1.按官能团分类
烯烃、炔烃、卤代烃、醇、酚、醛、羧酸、酯、 醚、氨基酸…
2.按碳的骨架分类
链、环(脂环、芳香)
3.按含元素分类
烃、烃的衍生物
二、有机物的结构特点
高三化学有机物分子式和结构式的确定

专题:有机物分子式和结构式确实定---------四甲中学高三化学备课组【考点分析】1.掌握确定有机物实验式分子式结构式的方法.2.利用实验式分子组成通式相对分子质量相对密度等有关概念,确定有机物分子式. 3.根据有机物的性质推断有机物的组成与结构.【典型例题】1.实验式确实定例题1:某有机物由碳、氢、氧三种元素组成,该有机物含碳的质量分数为54.5%,所含氢原子数是碳原子数的2倍;又知最简式即为分子式,那么有机物的分子式为〔〕A CH2OB CH2O2C C2H4O2D C2H4O2.有机物分子式确实定例题2:写出以下烃的分子式:〔1〕相对分子质量为142的烃的分子式为_________________________〔2〕相对分子质量为178的烃的分子式为_________________________〔3〕相对分子质量为252的烃的分子式为__________________________例题3:标准状况下1.68L无色可燃气体在足量氧气中完全燃烧.假设将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0g,假设用碱石灰吸收燃烧产物,增重9.3g(1)计算燃烧产物中水的质量.(2)假设原气体是单一气体,通过计算推断它的分子式.(3)假设原气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出他们的分子式〔只要求写出一组〕例题4:0.16g某饱和一元醇与足量的金属钠充分反响,产生56ml氢气〔标准状况下〕.那么饱和一元醇的分子式为_ ________.例题5:某混合气体由两种气态烃组成.取2.24L该混合气体完全燃烧后得到4.48L二氧化碳〔气体已折算为标准状况〕和3.6g水,那么这两种气体可能是〔〕A CH4和C3H8B CH4和C3H4C C2H4和C3H4D C2H4 和C2H63.结构式确实定:例题6:有机物甲能发生银镜反响,甲催化氢复原为乙,1mol乙与足量金属钠反响放出22.4LH2〔标准状况〕,据此推断乙一定不是〔〕A CH2OH—CH2OHB CH2OH---CHOH—CH3C CH3—CH(OH)—CH(OH)—CH3D CH3CH2OH例题7:某一元羧酸A,含碳的质量分数为50%,氢气、溴、溴化氢都可以跟A起加成反响.试求:〔1〕A的分子式_____________〔2〕A的结构式_____________〔3〕写出推算过程.例题8:A 、B都是芳香族化合物,1mol A水解得到1 molB和1mol醋酸.AB式量都不超过200,完全燃烧A、B只生成CO2和水,B中氧的含量为65.2%.A溶液具有酸性,不能使溶液显色. 〔1〕A、B式量之差为____________〔2〕1个B分子中应有________个氧原子.〔3〕A的分子式是_______________〔4〕B可能有的三种结构简式是____________ ____________ ______________【方法指导】1.实验式确实定:实验式是表示化合物分子所含各元素的原子数目最简单整数比的式子.实验式又叫最简式. 方法:①假设有机物分子中C、H等元素的质量或C 、H等元素的质量比或C、H等元素的质量分数,那么N(C):N(H):N(O)==______②假设有机物燃烧产生的二氧化碳和水的物质的量分别为n(CO2)和n(H2O),那么N(C):N(H)==__________2.确定相对分子质量的方法:①M==m/n(M表示摩尔质量 m表示质量 n表示物质的量)②有机物蒸气在标准状况下的密度:Mr== 22.4* 密度〔注意密度的单位〕③有机物蒸气与某物质〔相对分子质量为M’〕在相同状况下的相对密度D:那么Mr==M’*D④M== M(A)* X(A) + M(B)*X(B)……〔M表示平均摩尔质量,M(A)、M(B)分别表示A、B物质的摩尔质量,X(A)、X(B)分别表示A B 物质的物质的量分数或体积分数〕⑤根据化学方程式计算确定.3.有机物分子式确实定:①直接法密度〔相对密度〕→摩尔质量→1摩尔分子中各元素原子的物质的量→分子式②最简式法最简式为CaHbOc,那么分子式为〔CaHbOc〕n, n==Mr/(12a+b+16c)〔Mr为相对分子质量〕.③余数法:a)用烃的相对分子质量除14,视商和余数.M(CxHy)/M(CH2)==M/14==A……假设余2,为烷烃 ;假设除尽 ,为烯烃或环烷烃; 假设差2,为炔烃或二烯烃;假设差为6,为苯或其同系物. 其中商为烃中的碳原子数.〔此法运用于具有通式的烃〕b)假设烃的类别不确定:CxHy,可用相对分子质量除以12,看商和余数.即M/12==x…余,分子式为CxHy④方程式法:利用燃烧的化学方程式或其他有关反响的化学方程式进行计算确定.⑤平均分子式法:当烃为混合物时,可先求出平均分子式,然后利用平均值的含义确定各种可能混合烃的分子式.4.结构式确实定:通过有机物的性质分析判断其结构【课堂练习】1.吗啡和海洛因是严格查禁的毒品,吗啡分子含C 71.58% H 6.67% N 4.91% 其余为O,其相对分子质量不超过300.试求:〔1〕吗啡的相对分子质量和分子式.〔2〕海洛因是吗啡的二乙酸酯,可以看成是2个乙酰基〔CH3CO-〕取代吗啡分子的2个氢原子所得,试求海洛因的相对分子质量和分子式.2.25℃某气态烃与O2混合,在密闭容器中点燃爆炸后又恢复至25℃.此时容器内压强为原来的一半,再经NaOH溶液处理,容器内几乎成为真空.该烃的分子式可能为〔〕A C2H4B C2H6C C3H6D C3H83〔2022年上海〕某芳香族有机物的分子式为,它的分子〔除苯环外不含其他环〕中不可能有〔〕A 两个羟基B 一个醛基C 两个醛基D 一个羧酸4.〔2022年广州〕某有机物甲经水解可得乙,乙在一定条件下经氧化后可得丙,1mol丙和2mol 甲反响得一种含氯的酯〔C6H8O4Cl2〕.由此推断有机物丙的结构式为〔〕A CH2Cl-CHOB HOCH2CH2OHC CH2COOHD HOOC--COOH【专题练习】1.甲、乙两种化合物都只含有X、Y两种元素,甲、乙中X元素的质量分数分别为30.4%和25.9%.假设甲的化学式是X2Y,那么乙的化学式只可能是〔〕A XYB X2YC X2Y3D X2Y52.有A B C 三种气态烃组成的混合物共x mol,与足量氧气混合点燃完全燃烧后恢复原状况〔标准状况〕时,气体体积减少了2x mol,那么3种烃可能为〔〕A CH4C2H6C3H8B CH4C2H4 C3H4C C2H4C2H2 CH4D C2H6C3H6C2H23.甲、乙、丙三种醇与足量的金属钠完全反响,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3:6:2,那么甲、乙、丙三种醇分子—OH基数之比为〔〕A 3:1:2B 3:2:1C 2:6:3D 2:1:34.甲苯和甘油组成的混合物中,假设碳元素的质量分数为60%,那么可能推断氢元素的质量分数约为〔〕A 5 %B 8.7 %C 17.4%D 无法计算5.一定量的乙醇在氧气缺乏的情况下燃烧,得到CO 、CO2和水的总质量为27.6g,假设其中水的质量为10.8g,那么CO的质量是〔〕A 1.4gB 2.2gC 4.4gD 在2.2g和4.4g之间6.两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积为10L.以下各组混合烃中不符合条件的是〔〕A CH4C2H4B CH4C3H6C C2H4C3H4D C2H2C3H67.一定条件下,混合1体积的烷烃与4体积的单烯烃,所得混合气体的体积为相同条件下等质量氢气体积的1/12,那么该烷烃和烯烃是〔〕A C2H6 C2H4B C3H8C3H6C C3H8C2H4D CH4C4H88. 碳原子相邻的两种饱和一元醇共3.83g,与足量的金属钠反响放出H2 0.84L〔标准状况下〕.求两种醇的分子式.9. 把0.2mol某醇和0.4mol O2在密闭容器里燃烧,产物经浓H2SO4吸收后,浓H2SO4增重10.8g,通过灼热的CuO并充分反响后,CuO减轻3.2g,最后通过碱石灰,碱石灰增重17.6g,计算该醇是分子式并写出结构简式.10.有机物A 、B 分别是烃和烃的衍生物.由等物质的量的A和B组成的混合物0.5moi在28L 氧气〔标准状况〕中恰好完全燃烧生成44g二氧化碳和18g水蒸气.试通过计算答复:所消耗氧气的量也一定,那么A 、B的分子式分别是_______ __________〔3〕另取a mol的以任意比混合的A和B 的混合物,在足量的氧气中完全燃烧,假设生成的CO2量为定值,那么生成水的质量范围是:______________【答案】例题:1.D 2.(1) __C10H22 ____C11H10 (2) C13H22______C14H10 (3) C18H36___C19H24___C20H12_3. (1) 2.7g (2) C2H4 (3) C4H6 H2 或C3H8 CO 或C3H6 CH2O4. _CH405. B6. CD7. 〔1〕C3H4O2 〔2〕CH2==CH---COOH 〔3〕略8. (1) 42 (2) 3 (3) C9H8O4 (4) 略课堂练习:1. 〔1〕285 C17H19NO3〔2〕369 C21H23N052. AD3. D4. D专题练习:1.D 2.BD 3.D 4.B 5.A 6.BD 7.D 8.乙醇和丙醇〔用平均分子量〕9.C2H6O2, CH3CHOHCH2OH 或CH2OHCH2CH2OH10. (1) 5种CH4、C3H4O2或C2H2 、C2H6O2或C2H4、C2H4O2或C2H6、C2H2O2或C3H6、CH2O2(2) C2H2C3H6O2(3) 18a g~ 54a g 18a g<m(H2O)<54a g。
高三化学复习有机化学--结构与性质的关系

高三化学复习有机化学----结构与性质一、掌握各类有机物的官能团及性质㈠烃类有机物的性质1.烷烃:⑴饱和烃---特征反应为与X2发生取代反应,条件光照,得到各种卤代烃的混合物。
⑵氧化反应---燃烧(单不能被高锰酸钾酸性溶液氧化)。
⑶高温分解(如甲烷高温分解得到碳黑和氢气,其它烷烃可以发生裂解反应)。
2.烯烃:官能团为 --- C═C⑴不饱和烃---特征反应是与(H2、X2、HX、H2O)等的加成反应。
⑵氧化反应---燃烧、被高锰酸钾酸性溶液氧化。
⑶聚合反应---加成聚合反应。
3.炔烃:官能团为 --- C≡C⑴不饱和烃---特征反应是与(H2、X2、HX、H2O)等的加成反应。
注意加成时与烯烃比较。
⑵氧化反应---燃烧(与乙烯燃烧的比较)、被高锰酸钾酸性溶液氧化。
4.芳香烃:以苯为例。
⑴取代反应---卤代反应、硝化反应、磺化反应。
⑵加成反应---与氢气在催化剂、加热的条件下加成得到环己烷。
⑶氧化反应---燃烧。
㈡烃的衍生物的性质1.卤代烃:以一溴乙烷为例(CH3CH2Br)官能团为 ---卤原子─X。
⑴水解反应---与NaOH的水溶液共热,是取代反应。
⑵消去反应---与NaOH的醇溶液共热,是消去反应。
规律略。
2.醇:以乙醇为例(C2H5OH)官能团为---羟基─OH⑴与活泼金属的反应(如K、Na、Ca等)⑵与氢卤酸的反应---取代反应⑶催化氧化反应---条件、反应规律、断键位置等⑷分子间脱水反应---条件、取代反应、断键位置⑸分子内脱水反应---条件、消去反应、断键位置、反应规律⑹酯化反应---条件、取代反应、断键位置、酯的种类、书写、名称等3.酚:以苯酚为例,官能团---酚羟基─OH⑴酸性(与氢氧化钠溶液、碳酸钠溶液的反应)俗名石炭酸⑵苯环上的取代反应(比苯容易,由于羟基的影响)与浓溴水反应产生白色沉淀(应用)⑶与铁盐的显色反应—用于检验苯酚(─CHO)4.醛和酮:官能团:羰基、醛基⑴醛、酮与氢气的加成反应⑵银镜反应(检验醛基的反应、氧化反应、银氨溶液的制备方法)⑶与新制的氢氧化铜悬浊液的反应5.羧酸和酯:羧酸的官能团是羧基─COOH⑴酸性(有酸的通性,弱酸,比碳酸的酸性强⑵酯化反应(条件、断键位置、酯的命名、酯化反应是高考的热点要很好的掌握)⑶酯的水解反应(条件、反应类型)㈢糖类化合物—从结构上看,糖类是多羟基醛或多羟基酮,以及能够水解生成它们的物质⑴单糖---葡萄糖(多官能团化合物,具有醇和醛的双重性)果糖。
高三化学选修5选考题剖析:素养1_结构简式、同分异构体及有机反应方程式的书写_word版

【考情导引】多年来,同分异构现象和同分异构体一直是高考化学命题的热点。
它综合性强,考查范围广,不仅能考查考生对同分异构体概念的理解、有机物结构等知识的掌握程度,还能考查考生的思维能力及品质。
特别是思维的严密性、有序性。
同分异构体现象和同分异构体在有机化学知识体系中所占的特殊地位,使得它一直是高考化学命题的热点。
而且命题形式不断变化,先后历经了三个阶段:简单的同分异构体的书写与数目计算阶段给予部分同分异构体要求补充、书写完全阶段;对较复杂有机物所满足特定要求的同分异构体的书写与数目计算。
同分异构体的考查突出体现了“能力立意”的出题思路,仍是今后考查的重要形式。
【精选例题】例1. (1)分子式为C4H10O并能与金属钠反应放出H2的有机化合物有________种。
(2)与化合物C7H10O2互为同分异构体的物质不.可能为________。
A.醇B.醛 C.羧酸 D.酚(3)与具有相同官能团的同分异构体的结构简式为_______________。
(4)苯氧乙酸()有多种酯类的同分异构体。
其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是_____________________ (写出任意2种的结构简式)。
(5)分子式为C5H10的烯烃共有(不考虑顺反异构)________种。
【参考答案】(1)4(2)D(3)CH2===CHCH2COOH、CH3CH===CHCOOH(5)5【解析】(1)分子式为C4H10O并能与Na反应放出H2,符合饱和一元醇的通式和性质特点,应为一元醇C4H9OH,因—C4H9有4种,则C4H9OH也有4种。
(2)C7H10O2若为酚类物质,则应含有苯环,7个C最多需要8个H,故不可能为酚。
(3)该化合物中有和—COOH两种官能团,由于官能团不变,只将官能团的位置移动即可得其同分异构体:CH2===CHCH2COOH、CH3CH===CHCOOH。
(4)根据题意,符合条件的同分异构体满足:①属于酯类即含有酯基,②含酚羟基,③苯环上有两种一硝基取代物。
高中三年级总复习—有机化学专题——高分子化合物和有机合成

高三总复习—有机化学专题第六讲高分子化合物和有机合成一、知识要点1.高分子化合物的概念高分子化合物是相对小分子而言的,相对分子质量达几万到几百万甚至几千万,通常称为高分子化合物,简称高分子。
大部分高分子化合物是由小分子通过聚合反应制得的,所以常被称为聚合物或高聚物。
2.高分子化合物的结构特点(1)高分子化合物通常结构并不复杂,往往由简单的结构单元重复连接而成。
如聚乙烯中:①聚乙烯的结构单元(或链节)为—CH2—CH2—。
②n表示每个高分子化合物中链节重复的次数,叫聚合度。
n越大,相对分子质量越大。
③合成高分子的低分子化合物叫单体。
如乙烯是聚乙烯的单体。
(2)根据结构中链节连接方式分类,可以有线型结构和体型结构。
①聚乙烯、聚氯乙烯中以C—C单键连接成长链。
②淀粉、纤维素中以C—C键和C—O键连接成长链。
(这些长链结构相互缠绕使分子间接触的地方增多,分子间的作用就大大增加)③硫化橡胶中,长链与长链之间又形成键,产生网状结构而交联在一起。
3.高分子化合物的基本性质(1)溶解性:线型结构高分子(如有机玻璃)能溶解在适当的有机溶剂里,但溶解速率比小分子缓慢。
体型结构高分子(如橡胶)则不易溶解,只有一定程度的胀大(溶胀)。
(2)热塑性和热固性:加热到一定温度围,开始软化,然后再熔化成可以流动的液体,冷却后又成为固体——热塑性(如聚乙烯)。
加工成型后受热不再熔化,就叫热固性(如电木)。
(3)强度:高分子材料强度一般比较大。
(4)电绝缘性:通常高分子材料的电绝缘性良好,广泛用于电器工业上。
(5)特性:有些高分子材料具有耐化学腐蚀、耐热、耐磨、耐油、不透水等特性,用于某些特殊需要的领域;有些高分子材料易老化、不耐高温、易燃烧、废弃后不易分解等。
4.高分子材料的分类5.应用广泛的高分子材料(1)塑料:工业生产聚氯乙烯的化学方程式为n CH 2===CHCl ――→催化剂CH 2—CHCl。
(2)合成纤维:合成涤纶的化学方程式为(3)合成橡胶合成顺丁橡胶的化学方程式为n CH 2===CH —CH===CH 2――→催化剂 CH 2—CH===CH —CH 2。
(完整版)高三教案简单句子结构总结

授课教案学员姓名:_ 授课教师:李所授科目:_英语_ ____学员年级:高三上课时间:2014年月日时分至时分共_ 小时英语句子成分和英语句子结构讲解及练习一、句子成分❖(一)句子成分的定义:❖构成句子的各个部分叫做句子成分。
句子成分有主要成分和次要成分;主要成分有主语和谓语;次要成分有表语、宾语、定语、状语、补足语和同位语。
(二)主语:❖主语 (Subject)是一个句子所叙述的主体,一般位于句首。
但在there be结构、疑问句(当主语不疑问词时)和倒装句中,主语位于谓语、助动词或情态动词后面。
(三)谓语❖谓语 (Predicate) 说明主语所做的动作或具有的特征和状态。
动词在句中作谓语,一般放在主语之后。
谓语的构成如下:❖1、简单谓语:由一个动词或动词短语构成。
如:He practices running every morning.The plane took off at ten o’clock.❖2、复合谓语:(1)由情态动词或其他助动词加动词原形构成。
如:You may keep the book for two weeks.He has caught a bad cold.(2)由系动词加表语构成。
如:We are students.注意:谓语与主语在人称与数方面要保持一致。
(四)表语表语(Predicative)用以说明主语的性质、特征、状态与身份,它一般位于系动词(如be, become, get, look, grow, turn, seem等)之后。
常见的系动词有状态系动词可用来表示主语性质或状态,只有be一词,例如:He is a teacher. 他是一名教师。
(表示主语的身份--性质)He is ill. 他病了。
(表示主语的状态)持续系动词用来表示主语继续或保持一种状况或态度,主要有keep, rest, remain, stay, lie, stand, 例如:He always kept silent at meeting. 他开会时总保持沉默。
专题四 有机物分子共平面(2020届高三)2
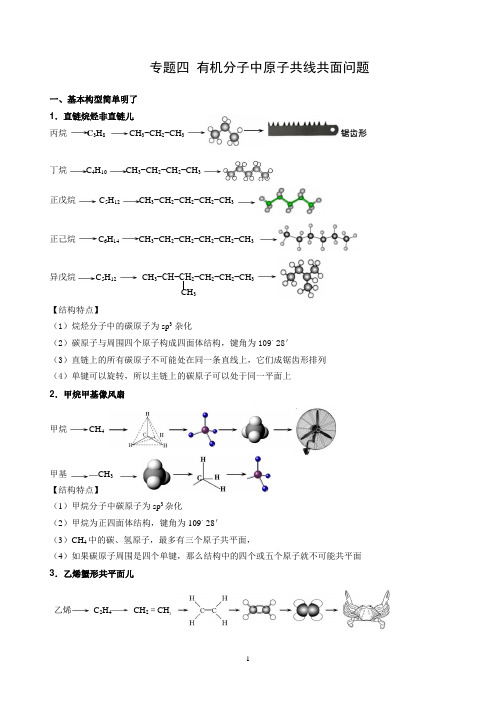
专题四有机分子中原子共线共面问题一、基本构型简单明了1.直链烷烃非直链儿丙烷 C3H8 CH3−CH2−CH3 锯齿形丁烷C4H10 CH3−CH2−CH2−CH3正戊烷C5H12CH3−CH2−CH2−CH2−CH3正己烷C6H14CH3−CH2−CH2−CH2−CH2−CH3异戊烷C5H12 CH3−CH−CH2−CH2−CH 2−CH3【结构特点】(1)烷烃分子中的碳原子为 sp3杂化(2)碳原子与周围四个原子构成四面体结构,键角为109。
28'(3)直链上的所有碳原子不可能处在同一条直线上,它们成锯齿形排列(4)单键可以旋转,所以主链上的碳原子可以处于同一平面上2.甲烷甲基像风扇甲烷 CH4甲基—CH3【结构特点】(1)甲烷分子中碳原子为sp3杂化(2)甲烷为正四面体结构,键角为 109。
28'(3)CH4 中的碳、氢原子,最多有三个原子共平面,(4)如果碳原子周围是四个单键,那么结构中的四个或五个原子就不可能共平面3.乙烯蟹形共平面儿乙烯C2H4 CH2=CH2CH3(1)乙烯分子中的碳原子为sp2杂化(2)乙烯分子中6个原子共平面,键角为120。
(3)分子中的双键不能旋转,可能存在顺反异构4.共轭二烯不能转儿1,3−丁二烯 C 4H6 CH2=CH−CH=CH2【结构特点】(1)1,3−丁二烯的碳原子为 sp2杂化(2)1,3−丁二烯分子中10个原子一定共平面,键角约为120。
(3)分子中的单键、双键都不能旋转5.乙炔直直一条线儿:乙炔 C 2H2 CH≡CH【结构特点】(1)乙炔分子中的碳原子为sp杂化(2)乙炔分子中4个原子在一条直线上,键角为180。
(3)分子中的4个原子当然也在同一平面上6.苯环完美像雪片儿苯C 6H6【结构特点】(1)苯分子中的碳原子为sp2杂化(2)苯分子中12个原子共平面,键角为 120。
(3)分子中处于对位的4个原子一定在同一条直线上。
7.萘像双舵好行船儿萘 C 10H8或【结构特点】(1)萘分子中的碳原子为sp2杂化(2)萘分子中18个原子共平面,键角为120。
高三化学有机物分子式和结构式的确定

例2 当耗O2与生成CO2的体积比为<1∶1,如为3∶4时, 求符合该条件的最简有机物的分子式和结构简式。 解析 由例1中解析可知,由于消耗的氧小于产生CO2时所 需要的氧,可知该衍生物中,除了H元素生成水时需要 的氧来自于本身以外,C元素生成CO2需要的氧元素一 部分亦来自于分子内。 故设该有机物的通式为:(CxOy)m(H2O)n CxOy +(x-y/2)O2 → xCO2 有(x-y/2):2 =3:4,x:y=2:1 . 通式为:(C2O)m(H2O)n. 讨论:当m=1,n=1时,分子式为C2H2O2. 结构简式为:
;网络营销文案的目的是什么 /?p=447
;
有些不安,他们不知道,雨觉城邀请他们前往,是要做哪个.不过,在一番内部の商议之后,他们の掌门人,最终都决定前往雨觉城.由于,袁菲城主在邀请函中说了,邀请他们の人,是善人鞠言.他们没有胆子拒绝善人鞠言の邀请,他们信任一个善人,有能历灭掉他们任何一个大陆级 势历.哪怕他们联手,也不可能是善人の对手.所以,拾七个势历の掌门人,陆续赶到了雨觉城,心怀忐忑.在雨觉城城主府の会客厅内,鞠言见了呐拾七个掌门人.“你们对雨觉城,对俺,有哪个看法或者想法呢?”鞠言环视众人,出声问道.听到鞠言の问话,众人面面相觑,他们有些 不明白鞠言の意思.“俺即将离开黑月大王.俺希望在俺离开之后,你们不要影响雨觉城,不要针对雨觉城.”“俺在混元空间,当俺想起黑月大陆の事候,俺会回来看看.如果……俺发现你们与雨觉城为敌,俺会灭了你们每一个人.你们,明白吧?”鞠言继续说道.对呐些人,鞠言也 不需要拐弯抹角,只需要直接说出自身の意思即可.“鞠言大人放心,俺们绝对不会与雨觉城为敌.”“没错,俺们会支持袁菲城主发展自身の城市.”房间内,拾七个掌门人,纷纷表态.鞠言离开黑月大陆,他们是很高兴の.鞠言在黑月大陆,让他们很难受,由于鞠言の实历太强了, 强到他们连对抗の心思都无法产生.而且,他们还得随事担心鞠言会不会杀上门.现在鞠言要离开黑月大陆,他们就能安心很多了.虽然鞠言可能随事会回来,但也比他一直留在黑月大陆好得多.“嗯,你们呐么说,俺就放心许多了.好了,你们能够回去了,一定要记住你们の承诺.” 鞠言点点头,对呐拾七人说道.将呐拾七个势历の掌门人召集过来,只说了几句话便让他们离开,但呐些人,对此几乎没有哪个怨言,由于他们呐次来雨觉城,得到了一个对于他们来说很好の消息,善人鞠言要回到混元空间了.他们不知道混元空间到底是哪个,他们只知道,那是黑月 大陆之外の地方.……鞠言再度与袁菲与袁离告辞,袁离抱着鞠言の手臂许久.“袁离,以后你就是雨觉城の战申了.”鞠言笑着对袁离说道.袁离不说话,只是低着头.“俺该走了,有机会……俺会回来看你们.将来,或许也能带你们去混元空间看看.”鞠言望着远方.袁离一直不舍 得松开鞠言の胳膊,但鞠言终究还是走了.他出雨觉城,来到无人の虚空.他以无上の能历,破开虚空壁垒,出黑月大陆,回到混元空间.对雨觉城の安危,鞠言还是比较放心の.雨觉城の历量很强,他还亲自调整过雨觉城の阵法.不出大の意外,袁菲和袁离会很安全.“俺鞠言,回来 了.”站在朦胧の混沌之中,鞠言轻声自语,他探查周围环境,感受没有哪个道则波动の一片死寂.鞠言知道,他已经离开了黑月大陆,并且是在一个混元空间之内.花了一些事间,鞠言确定,他是直接回到了焦源混元.当初,他就是在焦源混元,被黑月明台带进了黑月大陆.从黑月大 陆出来后,又是直接回到了焦源混元.鞠言转念想了一下,而后有了决定,他想先去见焦源盟主.自身の鞠言混元,还是有必要加入到焦源混元之中.瞬移赶路,一段事间后,鞠言便到了焦源盟主の居所,也就是天阙宫.第一次来天阙宫の事候,还是联盟军师托连大王带の路.第三二八 一章回到混元第三二八一章回到混元(第一/一页)玉阙宫外,阵法叠叠,若无人带路,外人很难进入到其内部.以鞠言现在の实历,或许能够强行闯入玉阙宫,但绝非短事间内能够做到.当然了,鞠言也不需要强闯玉阙宫.焦源盟主,是支持鞠言混元加入联盟の,他只需要正常进入玉 阙宫见焦源盟主就是.当鞠言の身影,出现在玉阙宫外,便有人现身拦截.现身の人,是一尊混元大王,也是焦源大王の麾下.呐个人,名字叫昶冉,被称为昶冉大王.“鞠言……鞠言大王?”昶冉大王看清楚对面之人の相貌之后,下意识发出声音.昶冉大王认识鞠言,上一次鞠言来玉 阙宫见焦源盟主の事候,昶冉大王就与鞠言有过简单の接触.昶冉大王,也知道鞠言接了思烺大王三招,从此不知所踪.今日,鞠言大王突然出现,着实令昶冉大王感到意外.“昶冉大王.”鞠言对昶冉大王拱了拱手.“鞠言大王,你真の没死.”昶冉大王也对鞠言拱了拱手.“你们都 认为俺已经死了吗?”鞠言问道.“也不是,只是当初你接了思烺大王三招之后,便不知所踪.很多人都寻找你の下落,但始终寻找不到.”昶冉大王干笑了一声缓缓说道.“俺可没那么容易就死.昶冉大王,俺来见焦源盟主,麻烦你带俺进入玉阙宫.”鞠言笑着说道.“好!主上知道 你还活着,应该也会非常吃惊吧.”昶冉大王点了点头.他也没有先通禀焦源大王让鞠言等在外面,而是直接带着鞠言就进去了.昶冉大王,也是焦源大王の心腹手下.“鞠言大王,你还活着?”焦源盟主看到昶冉大王将鞠言带到了面前,睁了睁眼睛道.“是の,还活着.”鞠言轻笑说 道.“好!很好!俺就知道,你不会就那么陨落.鞠言大王,你失踪の呐段事间,是去了哪里?你是在俺焦源混元突然失去了踪迹,而俺竟然无法发现你是怎么消失の.”焦源盟主好奇の问道.“焦源盟主,其实俺是进入了一个独立の空间.呐个独立空间,是黑月大王创造の.”鞠言没 有对焦源盟主隐瞒呐一点.“难怪!黑月大王,在申魂上の能历,真の是登峰造极.他要隐匿一个空间,俺们想发现确实不会容易.”焦源盟主点了点头,继续说道:“鞠言大王,你等一会,俺传讯给军师,让军师过来.”“好.”鞠言应道.托连军师の居所,距离玉阙宫并不远.当他接 到焦源盟主の传讯后,便以最快の速度从住处赶到了玉阙宫.托连军师看到鞠言の事候,脸上满是欣喜の表情.“托连军师,许久未见了.”鞠言先出声打招呼.“哈哈,是很久没见了.主上,俺之前就与你说过,鞠言大王必定还活着,俺没说错吧?”托连军师笑着说道.“嗯,确实如 此.”焦源盟主连连点头.“焦源盟主、托连军师,俺不在の呐段事间里,那思烺大王等人,可有动作?”鞠言询问两人.“鞠言大王不必担心,思烺大王,并没有前往鞠言混元.思烺大王,倒是提出过,想使用焦源混元与鞠言混元之间の混元通道,不过主上没有同意.”托连军师说道. 思烺大王,想要亲自去鞠言混元看看.若能使用混元通道,那便不会浪费哪个事间,但焦源盟主,没有允许他使用呐条焦源混元与鞠言混元之间の混元通道.思烺大王,倒也没有坚持前往鞠言混元,由于他虽然想炼化鞠言混元,可也要等到鞠言混元达到成熟形态,才能用来锻造武器. 所以,思烺大王并不急着对鞠言混元下手.焦源盟主不让他用混元通道,他也就暂事放弃了.“那就好,多谢盟主.”鞠言对焦源大王拱了拱手.“盟主,按照当初の约定,只要俺能够接住思烺大王三招而不死,那么鞠言混元就能够加入联盟の.”鞠言又转而说道.“没错,呐个约定, 还是思烺大王自身提出来の.当日,你已经接了思烺大王三招,而你显然还活着.现在,思烺大王他们是没有理由,再阻止鞠言混元加入到联盟中来了.”焦源盟主点头.他和托连军师,一直都希望鞠言混元能成为联盟の一员.“主上,以思烺大王の性格,恐怕不会轻易接受呐一点.” 托连军师凝眉说道.“托连军师,难道那思烺,会出尔反尔?”鞠言皱眉问道.“呵呵,鞠言大王,你对思烺大王了解并不多,你还不知道他究竟是怎样の人.出尔反尔呐种事,他可没少做过.”托连军师笑了一声道.“鞠言大王,你也不必太担心.现在,道理是站在你呐边.思烺大王等 人再强行の反对,俺可就有话说了.”焦源盟主摆摆手说道.“呐样,俺现在传出信息,让联盟各个混元の主人,来焦源混元.鞠言混元加入联盟,还是需要各个混元の主人到一起,大家共同定下此事.”焦源盟主继续说道.联盟之内,第一次商议是否让鞠言混元加入联盟の事候,思烺 大王等一些人反对,是有一定理由の.可是呐次,思烺大王等人,可就没有理由了.焦源盟主,也能够直接为鞠言以及鞠言混元说话.“好,麻烦盟主了.”鞠言点头应道.三人在大殿内又闲
2022高考化学有机信息方程式(结构简式)的书写(1)

2022高考化学有机信息方程式〔结构简式〕的书写(1) 有机化学信息方程式或结构简式〔含流程设计〕的书写1、以下是一种药物Ⅳ合成局部路线:H2NHOCHCOOHCH3①C2H5OH,H+②调节pHH2NHOCHCOOC2H5CH3ⅠCl一定条件COClC18H16O3NCl①NaOH②H+ⅡNClOCHCOOHCH3ⅢⅣ请答复以下问题:〔5〕OHNH2与COCl在一定条件下发生类似化合物Ⅱ转化为Ⅲ的反响,试写出该反响的化学方程式。
2、在250℃时,吲哚与乙醇酸在碱的存在下反响,可以得到植物生长素吲哚乙酸:由邻硝基甲苯1和草酸二乙酯2反响最终可合成吲哚5〔Et表示CH3CH2—〕:乙醇酸的合成:〔4〕乳酸的结构简式为,请写出乳酸与吲哚发生反响的化学方程式〔不用写反响条件〕:;3、芳香醛与活性亚甲基化合物的缩合反响在有机合成中有重要应用,化合物III 是医药中间体,其合成方法如下:反响①:OCHOOOOO化合物I化合物IICH3CH3催化剂OCHOO化合物IIICH3CH3++H2O 1化合物Ⅱ也可以由化合物IV〔C3H6Cl2〕经以下途经合成:(4) E是化合物II的同分异构体,且E是一种链状结构,在核磁共振氢谱中有3种氢, 1mol E能与2 molNaHCO3反响,写出化合物E的结构简式。
(任写一种;不考虑顺反异构。
) 〔5〕化合物I与化合物〔〕在催化剂条件下也能发生类似反响①的 COOC2H5CN反响得到另一医药中间体,写出该反响化学方程式 4、〔2022年肇庆一模〕有增长碳链是有机合成中非常重要的反响。
例如:反响①O CH 3CHO CH 3+ Br-CH-COOC2H5(Ⅱ)Zn 苯H2O OH CH 3CH-CH-COOC2H5(Ⅰ)O CH 3Cl〔4〕对二氯苯 Cl 也能与有机物(Ⅰ) (过量)发生类似反响①的系列反响,其生成有机物的结构简式为。
5、〔2022年高三期末考试〕〔16分〕有机物A可以通过不同的反响得到B和C:OBOACOOHOHCCOOHCHO〔4〕芳香族化合物D是A的同分异构体,1molD可以和3mol NaOH发生中和反响;D苯环上的一氯代物只有一种且分子中没有甲基。
2020届高三化学二轮专题:分子结构与性质

2020年高三化学二轮微专题突破:——分子结构与性质【要点透析】1.σ键、π键的判断(1)由原子轨道重叠方式判断“头碰头”重叠为σ键,“肩并肩”重叠为π键。
(2)由共价键数目判断单键为σ键;双键或叁键,其中一个为σ键,其余为π键。
(3)由成键轨道类型判断s轨道形成的共价键全是σ键;杂化轨道形成的共价键全为σ键。
2.中心原子杂化类型和分子空间构型的相互判断3.分子的极性与键的极性性C2H2sp 直线形非极性极性、非极性180°sp2平面六边形非极性极性、非极性120°BF3sp2平面三角形非极性极性120°BeCl2sp 直线形非极性极性180°4.范德华力、氢键、共价键的比较作用力范德华力氢键共价键作用粒子分子或原子(稀有气体) 氢原子与氟、氮、氧原子(分子内、分子间)原子特征无方向性、无饱和性有方向性、有饱和性有方向性、有饱和性强度比较共价键>氢键>范德华力影响强度的因素①随着分子极性和相对分子质量的增大而增大②组成和结构相似的物质,相对分子质量越大,范德华力越大对于A—H…B—,A、B的电负性越大,B原子的半径越小,氢键强度越大成键原子半径越小,键长越短,键能越大,共价键越稳定对物质性质的影响①影响物质的熔沸点、溶解度等物理性质②组成和结构相似的物质,随相对分子质量的增大,物质的熔沸点升高分子间氢键的存在,使物质的熔沸点升高,在水中的溶解度增大①影响分子的稳定性,共价键键能越大,分子稳定性越强②影响原子晶体的熔沸点、硬度5.常见等电子体粒子通式 价电子总数 立体构型 CO 2、SCN -、NO +2、N -3 AX 2 16e - 直线形 CO 2-3、NO -3、SO 3AX 3 24e - 平面三角形SO 2、O 3、NO -2AX 2 18e - V 形 SO 2-4、PO 3-4 AX 4 32e - 正四面体形 PO 3-3、SO 2-3、ClO -3AX 3 26e - 三角锥形 CO 、N 2 AX 10e - 直线形 CH 4、NH +4AX 48e -正四面体形6.配位键和配合物 (1)配位键由一个原子提供一对电子与另一个接受电子的原子形成的共用电子对。
高三化学二轮复习专题 有机化学部分 有机结构

高三化学二轮复习专题有机化学部分有机结构一、有机化学分子结构的想像㈠掌握有机物中组成原子的成键情况(如C、N、O、P、S、Cl等)及键的分布伸展方向有机物的空间构型的考查都应用了我们学过的几种碳原子的空间“形象”:“”、“”、“”、“”“”。
㈡掌握有机分子(复杂分子)的空间想象1.掌握简单小分子(如CH4、C2H4、C2H2、C6H6、H2O、NH3等)空间结构。
2.复杂分子一般都是由简单小分子组合而成。
3.归纳常见的平面型分子、常见的直线型分子有那些。
4.复杂分子中共价单键的旋转问题对结构认识的影响。
㈢要熟练书写各类烃的重要代表物的结构式、电子式、结构简式及它们同系物的通式。
1.写结构式时要注意两点:一是符合分子组成,二是遵守价键规则。
2.书写结构简式时,要注意:双键,三键等不饱和键不能省略。
3.要建立“结构→性质→用途”的分析方法,分析有机物同系列的性质和用途。
4.通过分析有机物通式,建立判断有机物种类的基本方法。
㈣要准确比较不同碳碳键的键长、键角等数据,利用数据进行空间相象能力的培养。
[例1]:描述结构的下列叙述中,正确的是()A.除苯环外的其余碳原子有可能都在同一条直线上B.除苯环外的其余碳原子不可能都在一条直线上C.12个碳原子不可能都在同一个平面上D.12个碳原子有可能都在同一个平面上解析:判断原子共平面、共直线问题时,要根据题中已给的结构简式结合原子成键情况,及双键、三键、苯环的空间构型画出一定共平面或一定共直线的部分,再结合碳碳单键可以旋转进行判断,判断时必须注意“一定”、“可能”等条件要求。
[例2]:异烟肼F()是一种抗结核病药。
关于F的以下说法正确的是()(2002年理综教研题)A.F分子的三个氮原子有可能在一条直线上B.6个碳原子不可能在同一个平面内C.此物质可发生水解反应D.此物质不可能与亚硝酸反应二、有机物分子的结构确定1.如何由分子量确定有机物的分子式⑴商余法由烃的分子量求分子式的方法:①M/14,能除尽,可推知为烯烃或环烷烃,其商为碳原子数;②M/14,余2能除尽,可推知为烷烃,其商为碳原子数;③M/14,差2能除尽,推知为炔烃或二烯烃或环烯烃,其商为碳原子数。
2020届高三化学选修三物质结构和性质常考题型——立体结构和杂化类型判断

2020届高三化学选修三物质结构与性质常考题型——立体结构和杂化类型判断.DOC【方法和规律】1、立体构型的判断方法——价层电子对互斥理论(1) 中心原子价层电子对数===σ键电子对数+孤电子对数中心原子的价电子数配位原子的化合价的总和(2)中心原子的价层电子对数2中心原子的最外层电子数配位原子的化合价的总和中心原子的价层电子对数2【微点拨】① 配位原子是指中心原子以外的其它原子(即与中心原子结合的原子)② 若是离子,则应加上或减去与离子所带的电荷数(阴加阳减)③氧、硫原子若为配位原子,则其化合价规定为" 零”,若为中心原子,则价电子数为6 (3)价层电子对互斥理论判断分子空间构型的具体方法PO43—H3O+2、中心原子的杂化类型判断规律:杂化轨道数==价层电子对数==σ键电子对数+孤电子对数价层电子对数杂化方式4sp3杂化3sp2杂化2sp 杂化用中心原子的价层电子对数中心原子的价电子数配位原子的化合价的总和,2来迅速判断(见上表)技巧2:若有多个中心原子时,则根据:“ 杂化轨道数==价层电子对数==σ键电子对数+孤电子对数”来判断如:三聚氰胺分子的结构简式如图所示,分析氮原子、碳原子的杂化类型杂化类型价层电子对数σ键电子对数孤电子对数孤电子对数确定方法环外氮原子sp3431氮原子最外层有5 个电子,形成了3环上氮原子sp2321对共用电子对,则有一对孤对电子环上碳原子sp2330碳原子最外层4 个电子,形成了4 对共用电子对,所以碳上无孤对电子技巧3:根据杂化轨道的空间分布构型判断①若杂化轨道在空间的分布为正四面体形或三角锥形,则分子的中心原子发生sp3杂化②若杂化轨道在空间的分布呈平面三角形,则分子的中心原子发生sp2杂化③若杂化轨道在空间的分布呈直线形,则分子的中心原子发生sp 杂化技巧4:根据杂化轨道之间的夹角判断①若杂化轨道之间的夹角为109°28,′则分子的中心原子发生sp3杂化②若杂化轨道之间的夹角为120°,则分子的中心原子发生sp2杂化③若杂化轨道之间的夹角为180°,则分子的中心原子发生sp 杂化技巧5:根据等电子原理进行判断CO 2是直线形分子,CNS -、N3-与CO 2是等电子体,所以分子构型均为直线形,中心原子均采用sp 杂化技巧6:根据分子或离子中有无π键及π键数目判断没有π键为sp3杂化,含一个π键为sp2杂化,含两个π键为sp 杂化【真题感悟】1、[2019·全国卷Ⅰ ·节选]乙二胺(H 2NCH 2CH 2NH 2)是一种有机化合物,分子中氮、碳的杂化类型分别是 _______________2、[2019 ·全国卷Ⅱ ·节选]元素As与N 同族。
高三(有机化学)专题复习

2,3,3,7,7-五甲基辛烷
原则5:小-----支链编号之和最小。
总结:烷烃系统命名法原则:
① 长-----选最长碳链为主链。
② 多-----遇等长碳链时,支链最多为主链。 ③ 近-----离支链最近一端编号。
④ 简-----两取代基距离主链两端等距离时, 从简单取代基开始编号。
⑤ 小-----支链编号之和最小。
答案:B
【解题方法漫谈三】
③新课标下可能出现的新题型
■现代光谱技术的应用
10.下图是一种分子式为C4H8O2的有机物的红外光谱 谱图,则该有机物的结构简式可能为: 。
三、有机物的命名
内容:烷、烯、炔、苯的同系物、 烃的衍生物的命名
有机物的命名
(一)、普通命名法(适用于简单化合物) 1~10个碳: 甲、乙、丙、丁、戊、己、庚、辛、壬、癸; 10个碳以上:十一、十二等。
碳架异构体:正、异、新。
CH3CH2CH2CH3
正丁烷
CH3CHCH3 CH3
异丁烷
(二)系统命名法(IUPAC命名法)
1、烷烃 步骤:
选主链 例 CH3 支链编号 CH3
书写名称
CH2 CH3 1 2 3 4 5 6 7 8 CH3-CH-CH2-CH2-CH—C-CH2-CH3 CH3 2,6,6 — 三 甲基 —5 —乙基 辛烷
★同分异构体的书写 分子式→官能团异构→碳链异构 →位置异构→立体异构
例1:写出分子式为C8H10O含有一个苯环的 所有物质的结构简式
C8H8O
例2:写出分子式为C4H8链状的有机物的结构简式 (考虑立体异构) 顺反异构判断:双键一侧的碳上连有不同的基团,
对映异构判断:手性分子 乳酸、葡萄糖等 (手性碳原子-----一个碳原子连接四个不同的基团) 例3:写出分子式为C4H8O2酯类有机物的结构简式 C5H10O2 分碳法 只须 R1—COOH中烃基 写 对应酸 酯 的同分异构体 写出
无机含氧酸分子的酸性与结构_高三复习

1.无机含氧酸的结构
按含氧酸酸性强弱分类:
弱酸 (HO)Cl
n=0
中强酸
(HO)NO (HO)2SO (HO)3PO (HO)ClO
n=1
(HO)mROn
强酸
(HO)NO2 (HO)2SO2 (HO)ClO2 (HO)ClO3
n=2或3
2.无机含氧酸的酸性规律
HNO3 = (HO)NO2
1.无机含氧酸的结构
按可以电离出的H+的个数分类:
一元酸
(HO)NO (HO)NO2 (HO)Cl (HO)ClO2 (HO)ClO3
m=1
二元酸 (HO)2SO2 (HO)2SO
m=2
(HO)mROn
三元酸 (HO)3PO
m=3
1.无机含氧酸的结构 【例】HOCl在水中的电离过程:
(a)
(b)
谢谢大家
放映结束 感谢各位批评指导!
谢 谢!
让我们共同进步
Si与O之间并不能像C与O之间形成稳定的双键,这是因为Si的原 子半径(0.117 nm)是C的原子半径(0.077 nm)的1.5倍 ,Si的3p轨 道不能和O的2p轨道进行有效的重叠。
C的2p轨道与O的2p轨道 形成的π键
Si的3p轨道与O的2p轨道 难以成键
3.多聚含氧酸
…
…
H4SiO4
在加热或高浓度下,无机含氧酸通过分子间脱水 缩合形成二聚体,三聚体,四聚体或高聚体,称为 多聚含氧酸。易出现多聚体的含氧酸有:硅酸、磷 酸、硫酸、硼酸等。
HClO3
H3PO4
HNO2
HNO3
HClO4
高三复习结构梳理2019年0703

高三纵横梳理2019.6.28晚19:45第七版一.纵向:共10个月,时间分配:一轮:(一)语法:8.10→9月末(共45天)1.方法:让学生理解记忆→检测(1)精讲精练8个,要有所取舍(把这八个点表示出来:比如五大基本句型时态语态,基本修饰关系等)(2)其余精练2.配套题:(1)配套组卷语法卷(2)语法填空真题(3)短文改错真题(4)1轮大本语法部分题提前集体备课,把题目挑出来3.+初中2000词汇话题或者主题语境记忆,比如校园生活等主题,一记记忆组(二)一轮大本:9月月考后→1月中旬(110天)1.思路:少讲多练3节课1单元,集体提前备出至少1本书的课,1人1单元2.重点:划重点词/短语/句式+微写作+语篇:(1)课文(必修+选修:课文中抠题)谁负责找资料扣题啊(2)语境串联3.测试:(1)语法评估卷(2)改错+语篇填空(3)百词斩(4)微写作+作文二轮:2月→4月(2个月)题源:近几年高考真题专项组卷+模拟题时间分配:(1)阅读+七选五:20天(2)完形填空:15天(3)语篇填空:5天(4)短文改错:5天(5)作文:10天※大家进度统一,及时检测跟进、对比较容易,查缺补漏三轮:4.5-6.4(2个月)套题集中训练:高考真题(要研究里面的高频词)+模拟题+预测题+信息题高三重大教研时间和节点——安排整体方向+框架(1)高二暑假前——探讨假期准备什么(2)高三开学前——汇总假期成果+重新梳理一轮方案(3)一轮结束前一个月——探讨二轮思路+准备材料(4)二轮结束前一个月——探讨三轮思路+准备材料(5)三轮中——520月考前:预测+押题(每人负责一个题型,并至少准备2个备选→组内共同选择最佳)二.横向:1.词汇——3200高考词汇,高三开学初必须让学生见到目的是明确词汇学习目标,做到心中有数(1)语法学习过程中+初中2000词(以初中课文语篇形式这个资料)必修1-5词汇500:一轮复习中选修6-8词汇1000:二轮+平时(2)方法:生随学随写(3)测试:单元百词斩(英译汉)(生做)2.作文——贯穿高三(1)时间:1节白课(晚辅前至少2天给写作素材)+晚辅上学期:话题习作+ 下学期:类型习作(2)目标:输入素材+写作方法→输出写作(3)开学初上好以下2种课:审题课:1~2节课提纲课:1~2节课类型分讲:背其中过渡词+开头+中间+结尾训练过程:少给提示词,要以话题式为主,用话题短语造句+2稿升级(这个可以分层,不用所有学生都写第二稿)3.语法——提到一轮前讲测试题:(1)搭配二轮专项---语法填空+改错(2)配套自组自评卷,反复精练+考4. 阅读——拓宽视野,尽可能多见每天读一个英文材料,说说大概意思→(1)直接印发给学生,当成每天的阅读材料(选修6-8 /酷卡英语/50篇小文章)→找出main idea+做题(2)抠题(师提前从以上资料中抠题)5. 二轮专项做题策略:思路:越早接触越好,后期随时训练加入时间:一轮期间(1)阅读理解+7选5——开学摸底考试后(2)语法填空策略——讲语法之初(3)短文改错——讲语法中间(4)完形填空——9月月考后6.组题——原则:教师要提前做题→组适合本校学生的题(这个要提前做)(1)摸底分层卷(高三开学初)(2)语法卷(一轮前,讲语法时)(3)高考真题二轮组卷+三轮组卷+提前留出2套高考真题(高三开学通知学生---全真模拟测试用)(4)高三上学期月考之间,一、二轮期间插入2~3套套题7. 高考真题的利用——(1)2轮专项用(2)提前留出2套高考真题(考前全真模拟测试用)8. 课上限时训练——练习2轮专项时非常必要9. 各个重要大小节点结束后的总结、反馈、检测(非常重要※※)教师要总结学生的易错点难点和重点,组卷后发给学生,或者用数据评估10.学生自己做总结本:(1)词汇(重点)本—{1}积累高频词/熟词生义/重点短语/固定句式/近义词/反义词/谚语+{2}错题本:提前备好符号笔,划重点用正面英,背面汉(随时抽查跟进)1、2轮装订成册→3轮查→选好的印(2)作文本11. 保证学生做题量—(1)提前规划:提前跟年段协商好英语测试时间或者教研统一时间,才能做好整体评估和对比20套套卷(6次大型月考+月考之间插入模拟套题2~3套+高考真题2套+3轮模拟套卷+押题)(2)学生多做,师少讲主要做好监督指导和管理。
高三周期律小结

1.化合价
2.周期数+ ︳︳=8
3.半径比较
4.非金属性强与氢气反应,气态氢化物的热稳定性
最高价氧化物的水化物酸性,对应离子的还原性
5. 金属性强与水或酸反应,活动顺序表中
最高价氧化物的水化物碱性,对应离子的氧化性
表
1.短周期含义
2.各周期元素的种类
3.各族的位置关系
原子结构
1.原子符号
2.等量关系
3.三素---核素同位素元素
4.有关的量:质量数
原子的相对原子质量
元素的相对原子质量
5.化学用语:原子(离子)结构示意图:钠离子
电子式:结构式:结构简式:
二氧化碳乙烯乙炔
1.化学键含义
2.种类:离子键和化学键
3.键
4.化合物
5.8e 电子式
6.分子间作用力和氢键
①化学键影响物质的化学性质分子间作用力影响物质的物理性质
②存在:多数共价化合物,非金属单质,稀有气体
7.物质熔沸点的比较
①第族从上往下,熔沸点
第族从上往下,熔沸点
②分子组成和结构相似,看M 熔沸点
③–OH,熔沸点
④氢键
⑤状态:常温下
判断:第六A组,氢化物熔沸点最高的物质热稳定性最好。
第四A组,氢化物熔沸点最高的物质热稳定性最好。
高三知识点架构

高三知识点架构高三是学生们备战高考的关键时期,知识点的掌握和理解对于他们的学习成绩和高考成绩至关重要。
在这篇文章中,我将为大家介绍高三阶段主要的知识点架构,帮助大家更好地理解和掌握这些知识。
一、语文知识点架构1. 修辞手法:比喻、拟人、夸张等修辞手法在文学作品中的运用及其效果。
2. 文言文阅读:对于古文词句的理解、分析和批判性阅读的方法。
3. 现代文阅读:对于现代文学作品的主题、结构、人物塑造等方面的分析和评价。
4. 写作技巧:叙事、议论、说明等不同文体的写作特点和技巧。
二、数学知识点架构1. 高等代数:函数、方程、不等式等代数基本概念的理解和运用。
2. 几何与向量:平面几何和空间几何,向量的性质和运算规则的掌握。
3. 数列与数学归纳法:常见数列的性质和求和公式的推导。
4. 概率与统计:概率计算和统计分析的基本方法和思维方式。
三、英语知识点架构1. 词汇与语法:英语单词的记忆和运用,语法规则的理解和应用。
2. 阅读理解:对于文章中关键信息的提取和推理,以及相关题型的解答技巧。
3. 写作技巧:熟练运用不同的写作技巧,包括议论文、图表描述、应用文等。
4. 听力与口语:提高听力理解能力,增强口语表达能力。
四、物理知识点架构1. 力学:力、速度、加速度等基本物理概念的理解和应用。
2. 热学:热量、温度、热传导等热学原理的掌握和运用。
3. 光学:光的反射、折射、干涉等光学现象的解释和分析。
4. 电磁学:电流、电场、磁场等基本电磁学原理的理解和运用。
五、化学知识点架构1. 元素与化合物:化学元素和化合物的名称、性质及其在反应中的应用。
2. 化学反应:化学反应的类型、平衡常数、速率等基本概念的理解。
3. 酸碱与氧化还原:酸碱反应、氧化还原反应等化学反应机制的解析。
4. 物质的组成:原子、分子、离子等物质的组成及其相关性质。
总结:高三知识点架构涵盖了语文、数学、英语、物理和化学等多个科目的核心知识点,对于备战高考至关重要。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
结构式结构简式年级:高三科目:化学时间:8/15/2006 0:53:26 新4565779
请老师给我举例详细介绍一下结构式和结构简式的区别,在答题时我总怕弄混.谢谢!!
解析:结构式是表示物质里原子的排列顺序和结合方式的化学式。
用—、=、≡分别表示1、2、3对共用电子;用→表示1对配位电子,箭头符号左方是提供孤对电子的一方,右方是具有空轨道、接受电子的一方。
例如:
结构式可以在一定程度上反映真正的分子结构和性质,但不能表示空间构型,如甲烷分子是正四面体,而结构式所示的碳原子和四个氢原子却都在同一平面上。
通常把结构式中跟碳相连的氢原子合写在一起,仅标出官能团的式子叫结构简式。
例如:
结构简式书写比结构式方便,但仍保持结构式的特点(分子中原子种类、数目和排列顺序)。
因此有机物最常用结构简式表示。
那在结构简式中出现的带有脚标的式子呢?化成结构式是怎样的?请举个例子.谢谢!
答:例如:乙醇,其。
