苯甲酰硫脲衍生物的合成及生物活性研究
【国家自然科学基金】_硫脲衍生物_基金支持热词逐年推荐_【万方软件创新助手】_20140731

2013年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27
科研热词 推荐指数 硫脲 3 抗肿瘤活性 2 噻二唑 2 合成 2 铜离子 1 配合物 1 蒽醌缩对甲氧基苯基氨基硫脲 1 苯酚 1 碘代芳烃 1 水相 1 氰根离子 1 比色识别 1 杀菌活性 1 无溶剂 1 无水硫酸氢钠 1 微波辅助合成 1 噻唑酮衍生物 1 含硫schiff碱 1 吗啉 1 同步荧光光谱 1 人血清白蛋白 1 二氯甲烷 1 三维荧光光谱 1 一锅法 1 biginelli反应 1 3,4-二氢嘧啶-2(1h)-酮 1 1-芳酰基-3-苯氨基硫脲 1
2012年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32
科研热词 推荐指数 硫脲 3 合成 2 酪氨酸酶 1 表征 1 芳醛缩氨基硫脲 1 绿色合成 1 结构-性能关系 1 生物活性 1 氨基吡啶 1 抗菌活性 1 抗艾滋病药物 1 抗肿瘤活性 1 微波辐射 1 巯基癸氧基12-冠-4 1 密度泛函理论 1 定量构效关系 1 叶绿素 1 双硫脲 1 化学修饰 1 动力学 1 二氢卟吩 1 丙烯海松酸 1 不可逆反竞争性抑制 1 三维全息原子场作用矢量 1 三唑 1 一溴癸氧基12-冠-4 1 一溴己氧基12-冠-4 1 na 1 li 1 8-羟基喹啉-7-醛缩氨基硫脲 1 2-芳醛腙基-4-苯基噻唑 1 132-氧代焦脱镁叶绿酸-a甲酯 1
2014年 序号 1 2 3 4 5 6 7 8 9 10 11
2014年 科研热词 荧光探针 罗丹明 环化 汞离子 固体酸 双取代哌嗪 光谱性能 介孔聚合物 一锅法 biginell 1 1 1 1 1 1
硫脲类化合物研究概述

硫脲类化合物研究概述
翟智卫
【期刊名称】《洛阳理工学院学报(自然科学版)》
【年(卷),期】2011(021)003
【摘要】硫脲类化合物因其独特的分子结构、良好理化性能以及广泛的生物活性,在各行各业具有广泛的应用.本文主要介绍了硫脲类化合物的概念、分类、合成方法以及应用领域,以便于研究工作者快速了解其发展进程.
【总页数】4页(P17-20)
【作者】翟智卫
【作者单位】洛阳理工学院环境工程与化学系,河南洛阳471023
【正文语种】中文
【中图分类】O621
【相关文献】
1.酰氨基硫脲及其相关杂环衍生物的研究(Ⅹ)——1-(4'-吡啶甲酰基)-4-芳酰胺基硫脲类化合物环化反应的研究 [J], 张自义
2.酰氨基硫脲及其相关杂环化合物的研究(Ⅳ)——1-氰乙酰基-4-取代芳酰基硫脲及1,2,4-三唑类化合物的研究 [J], 张自义
3.苯甲酰硫脲类化合物生物活性的QSAR模型和结构修饰的理论研究 [J], 李鸣建;陈艳;冯长君
4.硫脲类化合物铜配合物的合成 [J], 潘霞;杨鹰
5.缩氨基硫脲类化合物DpC抗头颈肿瘤活性的体外研究 [J], 陶泽璋;喻迪;王鹏举;陈晨;李芬
因版权原因,仅展示原文概要,查看原文内容请购买。
N-苯甲酰基-N’-1,3,4-噻二唑-2-基硫脲的合成及生物活性研究

酰基硫脲衍生物及其配合物研究进展

酰基硫脲衍生物及其配合物研究进展
杨小青;董文魁;冯建华
【期刊名称】《山东化工》
【年(卷),期】2006(35)3
【摘要】介绍了酰基硫脲衍生物及其配合物的国内外研究现状、合成方法,并对其应用前景进行了展望.
【总页数】4页(P19-22)
【作者】杨小青;董文魁;冯建华
【作者单位】兰州交通大学化学与生物工程学院,甘肃,兰州,730070;兰州交通大学化学与生物工程学院,甘肃,兰州,730070;兰州交通大学化学与生物工程学院,甘肃,兰州,730070
【正文语种】中文
【中图分类】O623.738
【相关文献】
1.8-羟基喹啉及其衍生物的锌配合物合成研究进展 [J], 康建壮;钟学明;曾鸿泽;吴诗婷
2.四个酰基硫脲衍生物及其配合物的合成与表征 [J], 黄唯平;马衡
3.四唑及其衍生物配体构筑的功能配合物研究进展 [J], 康丽;王潇敏;屈媛媛;张世琛
4.苯甲酰基硫脲衍生物及其配合物的合成及表征 [J], 张斌;苏碧泉;鲜亮;向晓明
5.四氮唑-1-乙酸及其衍生物金属构筑配合物的研究进展 [J], 谢飞;卫芝贤
因版权原因,仅展示原文概要,查看原文内容请购买。
硫脲衍生物的杀菌活性研究进展

第47卷第10期2008年10月农 药AGROCHEMICALSVol. 47, No. 10Oct. 2008硫脲衍生物的杀菌活性研究进展闫志坤,宋宝安,杨 璇,胡德禹,杨 松,金林红,陈广明(贵州大学 精细化工研究开发中心,教育部绿色农药与生物工程重点实验室,贵阳 550025)摘要:硫脲类化合物是一类具有良好杀菌活性的化合物。
从杀菌剂方面对硫脲类化合物的生物活性研究进行了分类综述,重点介绍了烷基/芳环/杂环氮取代硫脲类、缩氨基硫脲类、酰基硫脲类化合物的杀菌活性,并对其发展趋势和应用前景进行了展望。
关键词:硫脲;杀菌活性;进展中图分类号:TQ455.4 文献标志码:A 文章编号:1006-0413(2008)10-0706-04Recent Advances in Antifungal Activity of Thiourea DerivativesYAN Zhi-kun, SONG Bao-an, YANG Xuan, HU De-yu, YANG Song, JIN Lin-hong, CHEN Guang-ming (Center for Research and Development of Fine Chemicals, Key Laboratory of Green Pesticide and Bioengineering,Ministry of Education, Guizhou University, Guiyang 550025, China)Abstract: Thiourea derivatives have good antifungal activities. According to different structure of thiourea compounds, their bioactivities were reviewed, emphasizing their antifungal activity. The main thiourea classes containing alkyl/ aryl/heterocyclic-N-substituted thiourea, thiosemicarbazone, acylthiourea are presented. The development trends and prospects of thiourea compounds for future application also have been discussed.Key words: thiourea; antifungal activity; progress硫脲类化合物具有广泛的生物活性,如抗过敏、消炎、抗菌[1-2]、杀虫和除草[3-4]等,人们对这类化合物产生了极大兴趣并进行了深入研究。
N-二茂铁甲酰基-N′-苯甲酰氨基硫脲的合成与杀菌活性

使二 者相结 合 , 以期 实 现 活 性成 分 的优 化 叠加 . 实
验结果 合成 了一种 新 型 的二 茂铁 酰基硫 脲衍 生物 ,
通 过 I 和 MR 确 认 了 结 构 . 合 成 路 线 如 图 1 R HN 其
所示 .
m 1二 茂 铁 甲酸和 1 0mL石 油 醚 , 拌 溶解 , mo) 5 搅 再
Fe
… …
o
CO NH N H 2
\= =/
F 、i H^ e、 N H N , } / H
抑菌等 生物 活性 , 在 生 物 酶作 用 下 参 与 各 种 代 能 谢 1 , d ad 等 指 出用 二 茂 铁 基 取 代 具 有 3 E w rs ] 生 物活性 分子 的某 些 芳 香 环 可提 高 整 个 分 子 的活
图 1 目标 化 合 物 的 合成 路线
振 仪 ( 国 V r n公 司) D O d 为 溶剂 , MS为 美 ai a , MS — T 内标 . 二茂 铁 甲酸 ( 析 纯 , 海 邦 威 化 工有 限 公 分 上
司 ) 草 酰 氯 ( 析 纯 , 津 市 光 复 精 细 化 工 研 究 ; 分 天
关 键 词 : 茂铁 ; 茂 铁 甲酰 氯 ; 二 二 酰氨 基 硫 脲 ; 成 ; 菌活 性 合 抑 中图 分 类 号 : 2 . O 6 57 文 献 标 识 码 : A 文章 编 号 :6 1— 1 2 2 1 ) 3— 0 7— 3 17 6 3 (0 10 0 3 0
酰 氨 基 硫 脲 类 衍 生 物 具 有 良好 的 生 物 活 性 , 如
c㈣
cod
抗真 菌 、 结 核 、 病 毒 、 草 以 及 植 物 生 长 调 节 抗 抗 除 等 ¨ 也 是重 要 的有 机 合 成 中 间体 。 , , 时 在 同 分子识 别 、 自组 装等超 分 子化学领 域也 显示 出 了 良
N-(3-氟苯甲酰基)-N’-芳基硫脲衍生物的合成及其生物活性

S n h ssa d Bil gc lAciiy y t ei n oo ia tv t
o u r e z y i u e sDe i a i e fFl o b n o lTh o r a rv tv s
H h n—i, Q NJ gdn , H ig WE a—a U C agqu I i —og n U Bn , I i o T b
有鉴于此 , 为研究 硫脲 及其衍 生物 的合 作 成 、 生物活性 晶体结构 引、 。及配位性能 等
工作的一部分 , 我们将超声辐射与相转移催化技
术联用 , P G40为相转移催化剂 , 以 E- 0 通过 3氟 一 苯甲酰氯与硫氰酸铵反应制得 3氟苯 甲酰基异 一
硫氰酸酯( ) 2与芳胺 (a 3 ) 2; 3 一 k 反应 , 高产率地 合成 了 1 种未见文献报道 的 3氟苯 甲酰基硫脲 1 一 衍生物(a l , ce e1 。初步生物活性实验 1 — k Shm )
t n e ce i rmai mi e i i .2 r a td w t a o t a n mme itl o gv e c re p n i g e e e o e u r e z y o h c d ae y t ie t o r s o d n lv n n v lf o b n o l h l
21 0 0年第 1 卷 8 第 1 , 4~ 7 期 4 4
合 成 化 学
C ie eJ un lo y tei e sr hn s o ra fS nht Ch mi y c t
V 11 o . 8,2 1 00
N . 4 o 1. 4—4 7
・
研究 论 文 ・
Ⅳ(. .3氟苯 甲酰基 )Ⅳ . . 芳基硫脲衍生物的合成及其生物活性
硝基苯酰基硫脲衍生物的合成与生物活性研究
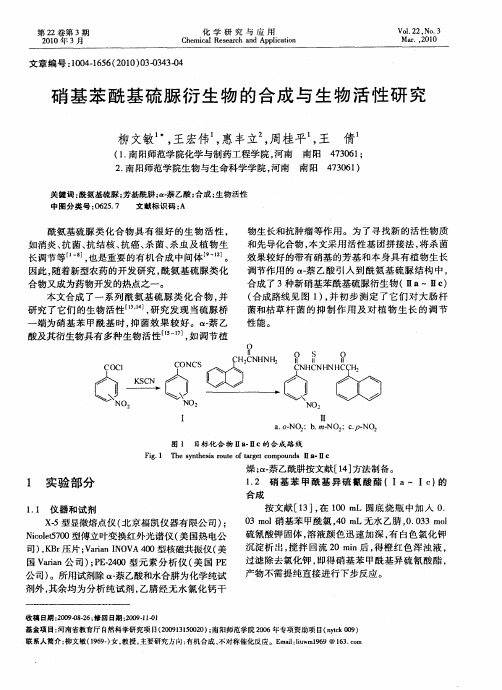
一
南 阳 4 36 ; 70 1
南阳 436 ) 7 0 1
zI N 一 —
一 。
物生长 和抗 肿瘤 等作 用 。 为 了寻 找新 的活性 物 质 和先导 化合 物 , 文采 用 活 性基 团拼 接法 , 杀 菌 本 将
硝 基 苯 酰 基 硫 脲 衍 生 物 的 合 成 与 生 物 活 性 研 究
● Βιβλιοθήκη 柳 文敏 H , 宏 伟 惠 丰立 周 桂 平 王 倩 王 , , ,
( . 阳师 范学 院化 学 与制 药工 程学 院 , 1南 河南
2 南 阳师范学 院生 物与 生命科 学学 院 , . 河南
关键词 : 酰氨基硫脲 ; 芳基酰肼 ; 萘乙酸 ; ・ 合成 ; 生物活性
第2 2卷第 3 期 21 0 0年 3月
化 学 研 究 与 应 用
Ch mi a s a c n p ia in e cl Re e r h a d Ap l t c o
V0 . 2. . I 2 No 3 M a- 2 0 l ., 01
文 章编 号 :0 41 5 ( 0 0 0 -3 3 4 1 0 —6 6 2 1 ) 30 4 - 0
NO,
I
l I a oN :b m- . - O1 . NO, . N02 :CP-
图 1 目标 化 合 物 ia 1c的 合 成 路 线 i. I
F g 1 T e s nh ssr u e o r e o o n s I ・ I i . h y t e i o t f a g tc mp u d 1 8 I c t
化 学 研 究 与 应 用 13 目标 化合 物 ( I —IC 的合成 . Ia I )
《合成化学》2010年(第18卷)总目次

2羟基。. 一 1萘甲醛缩 Ⅳ 氨基 - 苯 甲酰基硫脲 的合成 及其阴离子识别性能 …………… 樊润梅 . Ⅳ-
水溶性双 甲基化大豆苷元磺 酸钴 的合成及其 晶体结构 ……………………… ……… 王秋亚
铜(Ⅱ)一 牛磺酸缩 2 吡啶 甲醛席夫碱 一3 5二羟基苯 甲酸三元配合物 的合成 及其晶体结构 . ,-
合 成 化 学 C ieeJunl f yte cC e s y h s ora o nh t hmir n S i t
一 7 1一 7
《 成化 学》 2 1 ( 1 合 0 0年 第 8卷 )
总 目 次
第1 期
有机小分 子催化不对称 H n 反应 的研究 进展 …………………… 付记亚 er y
二烯丙基 乙胺的合成 … ……………… …………………………… 刘立华
伟 田莉莉 ( 一1 ) I 0 伟 李 杉杉( 1 ) 1— 6
俊 刘 清泉( —2 ) 1 7 云 张 尊 听 ( —3 ) 1 1
… …… …… …………… 丁佩佩
葛凤燕 蔡 再生 ( 3 1—1 ) 丁 国华 张 晓松 ( —2 ) 1 3
纪晨旭 ( 9 ) 1— 9 李爱桃 ( —1 1 1 0) 刘 瑛 ( —14 1 0)
3碘_. . 5甲基. ,- 1 5苯并硫氮杂革- (H)酮 的合成 ………………… 陶李 明 45 -
2 乙氧羰基-- . 3 甲基4,- 5四亚 甲基 吡咯的合成 ……………………… …… …………… 徐海 云 ( )2氨基. ,. s .. 1 1二苯基 一一 1丙醇 的合成 ……………… … 彭化南 余泗莲 余 斌 周安西 杨艳艳
秦敬东
拓宏桂
胡
冰
魏太保 ( — 4 1 4)
含氟苯甲酰基硫脲衍生物的合成及生物活性研究

含 氟苯 甲酰基 硫脲 衍 生 物 的合 成及 生物 活 性研 究
胡 昌秋 , 秦 敬 东 ,胡 冰 ,魏 太 保
( 西北 师 范 大 学 化 学 化 工 学 院 ,甘 肃 省 高 分 子 材 料重 点 实 验 室 ,甘 肃 州 7 0 7 ) 3 0 0
摘
要 :以 P 4 0为催 化 剂 ,将 超 声 波 辐 射 与 相 转 移 催 化 技 术 联 用 ,通 过 含 氟 苯 甲酰 氯 与硫 氰 酸 铵 反 应 合 成 了 中 E 。
p omo i fe to s 2, fu b n oy t i r a e y1 g yc la em u h b te ha na t o e s r tng e f c fbi( 2 一l or e z lh ou e ph n ) l o r c e t r t n mo —hi ur a . Ke r s: fu b n o lt o r a rv tv s; ulr s i p s r n f rc t l ss; bil gy c la tv t y wo d l or e z y hi u e sde ia i e ta on c; ha e t a s e a a y i o o ia c i iy
间体 含 氟 苯 甲酰 基 异 硫 氰 酸 酯 , 它分 别 与 芳胺 和 2 2_ ,. 二氨 基 乙二 醇 二 苯 醚 反 应 , 高产 率 获 得 1 2种 相 应 含 氟 苯 甲酰 基
硫 脲衍 生物 . 初 步 生 物 活性 实验 表 明 , 目标 化 合 物 对 油 莱 和 小 麦 的 生长 均 具 有 显 著 的促 进 作 用 ,且 双硫 脲 衍 生 物 对植 物 生 长 的促 进 作 用优 于 单硫 脲 衍 生物 .
硫脲类化合物研究概述

2)应 用 于 医 药领 域 。硫 脲 类 化合 物 在 医 药 领 域也 表 现 出广 泛 的 生 物 活 性 ,如抗 结核 、抗 肿瘤 、抗
第3 期
翟智卫 硫 脲类 化合物研 究概述
必 要对 硫 脲 类化 合 物 以往 的研 究 状 况做 概 括介 绍 , 以方便 以后 的研 究 工 作者 快 速 了解 其 发展 进程 。下 面 就 从几 个方 面来 概述 硫脲 类 化合 物 的发 展情 况 。
1 硫脲类化合物 的分 类
之 所 以称 为硫 脲 类 化 合物 是 因为 其具 有硫 脲 的基 本结 构( 图1 示 1 如 所 。根 据 与其 基 本 结构相 连 基 团 的 不 同 ,可 以将硫 脲 类 化合 物 分 为 :硫脲 、酰基 硫脲 、氨基 硫脲 、缩 氨 基 硫脲 等 4 。其 中,硫 脲 、酰基 硫 类
第2 卷 第3 1 期 2I年9 0 1 月
洛阳理工学院学报( 然科学版) 自
J u n l f u y n n t u e f S in e n e h o0 y Na u a S in e d t n o r a o o a gI si t c c d T c n 1g ( t r I ce c i o ) L t o e a E i
催化 、橡 胶 防老 化 等领 域 。
1)应 用于农 药领 域 。硫 脲 类化 合 物 具有广 泛 的 生物活 性 ,如 杀 虫 、除草 、 杀菌 、植 物 生长 调节 等 , 从2 世纪6 年代 以来就 受到 了人 们 的高度 关注 。硫脲 类化 合物 托布 津和 甲基托 布津 早 在2 世 纪6 年代就 已 O 0 0 0
酰基硫脲化合物的合成及其植物生测

2016年第8期(下半月)农民致富之友 Nong Min Zhi Fu Zhi You60科研◎农业科学硫脲衍生物不仅是重要有机合成中间体,而且可用作杀虫剂[1]、除草剂[2]和植物生长调节剂,而取代芳酸、胺类化合物、氨基吡啶化合物有上述某种生物活性。
研究同时含有两种基团化合物生物活性,固-液相转移催化法合成三个系列二十八个目标化合物,对化合物进行生理活性初步研究。
1 材料与方法1.1 仪器电热熔点测定仪;元素分析仪;红外光谱仪(KBr 压片);核磁共振仪(TMS 为内标,DMSO-d 6为溶剂);质谱仪;WMK–02型电热恒温培养箱;GXZ 型智能光照培养箱。
1.2 目标化合物的制备称取2.2mmol 邻氯苯酚,加入氢氧化钠,搅拌至55~60℃,加0.02mol 氯乙酸,加50%NaOH ,pH=9~10,至85~90℃,反应3h ,加NaOHpH9~10至反应完毕,不断搅拌加浓HCI 至pH≈1,冷却,抽滤,水洗,乙醇-水重结晶得白色针状晶体,m.p.140~141℃。
将0.02mol 的取代苯氧乙酸加入烧瓶中,加10ml 新蒸二氯亚砜,65~75℃反应4h ,减压蒸出剩余氯化亚酰,得取代苯氧乙酰氯。
所得酰氯不经分离,加20ml 二氯甲烷,0.03mol 硫氰酸铵,搅拌,加0.5g PEG-600,搅拌反应1~2h ,得黄色油状液体。
所得中间体不经分离,搅拌加0.01mol 芳胺,反应1h ,产物倾入混合物,静置,产生大量沉淀,过滤,饱和NaHCO 3洗涤,干燥,DMF ∕乙醇∕水混合溶剂重结晶,得目标化合物。
2 结果与讨论2.1 目标化合物IR 、1H NMR 及元素分析结果对红外光谱IR 数据分析:在3370~3430 cm -1之间有一宽而强吸收峰,为羧基上O —H 伸缩振动吸收峰,由于形成分子内或分子间氢键,所以,较一般O —H 振吸收峰向低波方向移动[2];在3190~3270 cm -1范围有一强而宽吸收峰,此峰为O =CNHC =S 中氮氢及吡啶环氮氢吸收峰。
硫脲类化合物合成方法研究进展

2010年第30卷有机化学V ol. 30, 2010第2期, 173~180 Chinese Journal of Organic Chemistry No. 2, 173~180* E-mail: mjzhangtju@Received February 16, 2009; revised May 10, 2009; accepted July 7, 2009.国家自然科学基金(No. 20802049)资助项目.174有机化学V ol. 30, 2010硫代光气与伯胺缩合制备关键活性中间体异硫氰酸酯后再与胺迅速发生加成反应, 生成相应的硫脲类化合物, 如果是与仲胺反应得到的稳定中间体不是异硫氰酸酯而是二取代氨基硫代甲酰氯, 然后与胺类化合物发生取代反应, 得到目标产物. 例如: 2001年Dalluhn研究组[26]以硫代光气和二甲胺为原料在催化剂三乙胺存在下获得稳定中间体二甲氨基硫代甲酰氯(1), 然后用溶于碱性溶液中的双芳磺酰胺2作为亲核试剂与1发生亲核取代反应, 高收率地得到磺酰仲氮负离子取代Cl的产物双芳磺酰硫脲3 (Scheme 1).Scheme 1但硫代光气是一种剧毒的挥发性液体, 其生产、贮运和使用都不安全、不方便, 且反应中放出HCl气体, 对环境的危害较大. 因此, 一系列使用非硫代光气合成中间体异硫氰酸酯的绿色方法成为人们研究的重点, 其中主要包括从苯环上连接各种强吸电子基的芳(磺酰)伯胺制备相应的异硫氰酸酯的方法[27].非硫代光气法对于从芳(磺酰)胺制备芳(磺酰)异硫氰酸酯已很普遍, 但对于从杯芳胺合成杯芳异硫氰酸酯却未见文献报道. 所以, 尽管硫代光气有巨毒, 基于它极强的反应活性, 仍用于中间体杯芳异硫氰酸酯 4 (Scheme 2)的制备, 4再与胺类化合物发生加成反应获得杯芳硫脲5[28]. .2 以异硫氰酸酯和胺为原料的合成Neville等[29]以四异硫氰酸硅酯和胺为原料首次合成N-单-和N,N-二取代硫脲, 产率高达97%~100%. Neville法是用四氯化硅与硫氰酸铵制备四异硫氰酸硅酯, 再和胺作用后水解, 反应底物适用面宽, 产率高, 避免了硫代光气的使用, 该反应不足之处是使用的溶剂种类较多, 且四异硫氰酸硅酯毒性较大也不易制备.与四异硫氰酸硅酯相比, 异硫氰酸烷基或芳基酯与胺的反应活性以及由它们制备的产品用途远远超过毒性, 所以通过它们合成具有特殊用途且其它反应不易合成的硫脲类化合物, 具有一定的实践意义. 例如: 1994Scheme 2年, Scheerder研究组[30]用异硫氰酸苯酯与四氨基杯芳烃在氯仿溶剂中于室温条件下缩合, 合成可以选择性络合氯离子的中性配位体6 (Eq. 1). 2002年, 杨发福等[31]用过量异硫氰酸苯酯与1,3-二氨基杯[4]-四丁醚于室温条件无溶剂直接缩合, 生成可以选择性络合24H PO-离子的杯[4]-双硫脲.运用异硫氰酸酯法除了制备杯芳硫脲之外, 还可制备芳磺酰硫脲[32]及环硫脲(1-芳磺酰四氢咪唑-2-硫酮). 例如: 最近, Faidallah小组[33]用对取代吡唑苯磺酰胺与异硫氰酸酯为原料在无水碳酸钾存在下于丙酮中回流, 合成了具有降血糖等生物活性的磺酰硫脲类化合物, 关于磺酰环硫脲合成方法研究始于1980年, McFarland 等[34]用对甲苯磺酰异硫氰酸酯与氨基乙醇为底物, 以浓硫酸为催化剂在甲醇中发生分子内关环反应合成芳磺酰环硫脲结构. 之后, 很少有文献用其它反应报道此类结构. 直至2007年, Cutting研究组[35]用磺酰亚胺7与异硫氰酸酯取代的杂环酰亚胺8在手性配体催化下发生No. 2丁从文等:硫脲类化合物合成方法研究进展175对映选择性Mannich 反应合成了手性芳磺酰环硫脲9 (Eq. 2).以异硫氰酸酯和胺为起始原料合成硫脲类化合物的反应普遍在有毒且有挥发性的有机溶剂中进行, 很少于绿色溶剂里发生. 2007年, Xiao 研究组[36]将肉桂酰异硫氰酸酯、取代苯胺与离子液体四氟硼酸1-丁基-3-甲基咪唑盐([Bmim][BF 4])于室温下混合搅拌可合成一系列肉桂酰基硫脲, 产率高达98.3% (Eq. 3). 该方法的优点在于反应时间短(2~12 min), 易于操作, 后处理简单, 环境友好, 离子液体经简单处理后可循环使用至少九次.由于异氰酸酯不稳定, 不便于储存, 而且异硫氰酸酯的制备大都需要较长的反应时间, 生产也极不安全, 因此, 探索快速高效以及环境友好的合成方法具有一定的理论意义和实践价值.3 以硫氰酸盐、酰氯和胺为原料的合成以硫氰酸盐、酰氯和胺为原料可以在原位生成异硫氰酸酯, 不需分离直接和胺反应, 克服了传统的用过量光气与伯胺反应, 将过量的光气除去后得到异硫腈酸酯, 再与另一种伯胺反应合成不对称硫脲, 同时, 由于异硫腈酸酯有毒且相对较活泼, 该方法能够将两步反应连续进行.3.1 三组分直接回流的合成Sridevi 等[37]首次用硫氰酸铵、芳基甲酰氯与2-胺 基-苯并咪唑在无水丙酮中直接回流制备N -苯甲酰基- N I -(苯并咪唑-2-基)硫脲, 同时获得有价值的副产品N -(苯并咪唑-2-基)苯甲酰胺, 从而为绿色化学开辟了一条绿色通道. 2007年, 史达清研究组[38]用硫氰酸钾、取代苯甲酰氯与对硝基苯胺在无水丙酮中回流, 首次合成阴离子受体芳酰基硫脲. 此类方法存在的弊端在于, 回流时间长, 使用无水溶剂, 产率也不高.3.2 相转移催化剂参与下的合成Reeves 等[39]用硫氰酸钾水溶液与酰氯的苯溶液在室温下搅拌, 以四丁基溴化铵(TBAB)为相转移催化剂, 采用液-液相转移催化法, 制备酰基异硫氰酸酯后再与苯胺加热首次合成了N -酰基-N'-苯基-硫脲(Scheme 3).该反应缩短了反应时间, 产率高达82%, 底物酰氯适用面较宽, 但Reeves 法经过了异硫氰酸酯的分离纯化步骤, 并且使用的硫氰酸盐大大过量, 造成了原料不必要的浪费.Scheme 3采用操作更为简便的固-液相转移催化法, 以廉价无毒、来源丰富、稳定性高的聚乙烯醇-400 (PEG-400)为相转移催化剂, 进行固-液相转移催化法合成, 也是近年来研究较多的绿色合成方法之一[40]. 例如1992年,魏太保等[41]以5-芳基-2-呋喃甲酰氯与硫氰酸铵反应, 即得相应的酰基异硫氰酸酯, 可以不经分离直接与芳胺加成, 生成了5-芳基-2-呋喃甲酰基硫脲(Eq. 4). 2001年, Li 研究组[42]以5-(4-氯苯基)-2-呋喃甲酰氯、硫氰酸铵和芳基甲酰肼为原料, 在PEG-400催化下, 于室温条件下合成了1-芳基甲酰基-5-(4-氯苯基)-2-呋喃甲酰基-氨基硫脲.3.3 微波与相转移催化剂参与下的合成微波作为一种高频电磁波, 它能促进许多化学反应的进行, 具有反应速度快、效率高、节约能源、实现原子经济性合成和生态友好绿色合成等优点[43], 有不少文献已将微波应用于硫脲衍生物的合成中. 例如2003年, 李正等[44]利用微波辐射(MWI)技术快速高产率地合成含苯并呋喃甲酰基的氨基硫脲(Scheme 4), 该方法涉及到苯并呋喃甲酰氯、硫氰酸铵和芳甲酰肼等三组分在PEG-400的催化下于氯仿和DMF 溶剂中一锅法缩合,176有 机 化 学 V ol. 30, 2010其中介电常数较大的DMF 溶剂可有效改善微波吸收效率, 利于缩短反应时间和提高产率.Scheme 43.4 超声波与相转移催化剂参与下的合成与常规方法比较, 超声辐射法具有简便易控、能耗低、改善反应条件、加快反应速度、提高反应产率以及使一些用传统方法难以进行的化学反应得以实现的优点, 因此近年来引起化学工作者广泛关注[45]. 例如2006年, 薛思佳等[46]将超声辐射和相转移催化结合起来, 以PEG-400为固-液相转移催化剂, 以乙腈为溶剂, 在超声辐射(USI)下顺利得到酰基硫脲(Scheme 5), 反应中间体酰基异硫氰酸酯也无需隔离, 反应温度由90 ℃降低至60 ℃, 反应总收率由49%提高至70%, 反应时间缩短为3 h.Scheme 52008年, 孙燕荣等[47]报道了类似的工作, 并且和常规加热法进行了比较, 结果表明常规加热法合成目标产物需回流3 h 左右, 而采用超声波辐射法, 只需在60 ℃下超声波辐射约20 min, 反应时间仅是常规方法的11%, 产率比常规方法提高了7%~19%左右. 总之, 超声波辐射法是一个反应时间短、条件温和、产率高、副反应少并且应用面较宽的好方法. 3.5 水介质中相转移催化剂参与下的合成以上合成方法都需经中间体异硫氰酸酯的制备步骤, 并且整个合成需要在相对昂贵、有毒的有机溶剂中进行, 对环境存在着不可避免的污染.随着人们对人类生存环境的日益重视, 越来越多的化学家将合成研究的重点放在对环境无污染的绿色合成上, 绿色合成要求合成中采用无毒的溶剂、试剂或催化剂, 尤其对反应溶剂的选择更是绿色合成研究的重点, 其中水被认为是最理想的绿色溶剂. 例如2006年, 王喜存等[48]在氯化三乙基苄基铵(TEBA)存在下, 于水介质中一步合成N -芳基- N '-(2-苯并呋喃甲酰基)硫脲(11)和1-芳甲酰基-4-(2-苯并呋喃甲酰基)氨基硫脲(12) (Scheme 6), 产率高达72%~87%. 与以上相转移催化方法相比, 本法将多步反应合并为一步, 并且在反应过程中不使用有机溶剂, 避免了资源浪费和环境污染, 具有操作简单、反应条件温和和环境友好等特点. 用水作为有机合成反应的溶剂, 体现了绿色化学中溶剂绿色化的要求, 开辟了合成硫脲类化合物的绿色途径.Scheme 63.6 微波参与下无溶剂无催化剂的合成自从Gedye 等[49]报道了微波作为反应热源可促进有机反应以来, 微波技术的应用即成为有机反应研究的热点之一, 因此, 具有速度快、产率高、操作简单、环境友好等优点的微波促进下的无溶剂非均相有机反 应[50]被成功应用于硫脲衍生物的合成.例如, 2005年, Wang 等[51]在无溶剂和无催化剂条件下, 利用微波间歇加热合成1,4-二取代氨基硫脲衍生物13 (Scheme 7). 反应只需5 min, 产率高达82%~88%, 与以上直接回流和相转移催化方法比较, 该方法避免了有机溶剂的使用和原料的浪费, 为酰氨基硫脲类化合物的合成提供了一条绿色通道.Scheme 74 以二硫化碳和胺为原料的合成4.1 直接加热合成Allen 等[52]报道了用二硫化碳和乙二胺为原料直接No. 2丁从文等:硫脲类化合物合成方法研究进展177加热到一定温度合成环状硫脲(四氢咪唑-2-硫酮)的方法(Eq. 5). 该方法的优点在于产率高, 反应时间短, 避免使用催化剂. 具备这些优点的原因可能是五元环硫脲结构具有很大的稳定性, 一旦生成便以固体形式从反应混合液中很快析出.4.2 催化剂参与下的合成Allen 报道的上述方法除了存在反应体系中有H 2S 气体放出, 污染环境的缺点之外, 在同样的反应条件下, 对于合成其它非环硫脲类化合物还存在回流时间较长、产率很低的问题, 因此人们在催化剂方面作了许多研究, 以使全过程更加简洁高效、环境友好.1999年, Ballabeni 研究组[53]以二硫化碳和伯胺为底物, Zn-Al HT (500)作为催化剂, 在高压釜中进行反应, 首次无溶剂合成了1,3-二取代对称硫脲14 (Eq. 6), 当底物胺是乙二胺和邻苯二胺时, 可得到相应的杂环硫酮产物, 产率高达100%. Ballabeni 催化法操作简单, 反应条件温和, 反应时间较短(2 h), 产率很高(最高达到100%), 催化剂Zn-Al HT (500)可以循环使用, 应用范围广泛, 因此它是一种高效合成对称硫脲、环状硫脲特别是具有光活性硫脲类化合物的绿色方法. 但该反应仍存在一些不足: 底物胺适用面狭窄, 只适合一些活性较强的芳香族伯胺和脂肪族伯胺; 反应中使用的催化剂不易得到, 制备时涉及到高温回流、加热时间过长、需要小心控制等问题.近年来, 基于双氧水作为催化剂的低毒性、低污染、高活性、价廉易得以及对环境友好等优点[64], 倍受化学工作者普遍关注. 例如: 1997年, Li 研究组[54]采用双氧水作为催化剂脱去硫化氢改进了合成路线中关键中间体异硫氰酸酯的制备方法之后, 2000年, Sasaki 等[55]以取代间苄二胺 15 和二硫化碳为原料, 氢氧化钠和双氧水作为催化剂, 用四氢呋喃水溶液作为溶剂, 在氯仿高度稀释条件下得到大环双硫脲16 (Scheme 8), 它可以作为阴离子受体强烈选择性络合24H PO -和Ac -阴离子, 其络合阴离子的能力强于相应的非环状硫脲. 4.3 微波参与下的合成2004年, Sandin 等[56]以2-取代丙二胺17和二硫化Scheme 8碳为原料, 乙醇为溶剂和催化剂, 通过微波辐射方式, 在200 s 内完成了5-取代六氢嘧啶-2-硫酮(18)的合成(Eq. 7). 但是Sandin 微波辐射法, 存在着H 2S 气体从反应中放出污染环境的问题. 此外, 乙醇在该反应中作为溶剂和催化剂在微波辐射下可导致许多副产品生成, 特别是一硫代氨基甲酸乙酯, 相比之下, 廉价易得的无机碱 NaOH 或KOH 溶液作为催化剂的选择较为理想.5 以硫代羰基转移试剂与胺为原料的合成以硫代光气或异硫氰酸酯和伯胺、仲胺为原料合成对称和非对称硫脲已成为人们广泛采用的方法, 然而此类方法涉及到原料的巨毒性, 此外, 用硫代光气或二硫化碳为原料进行反应, 不可避免地放出HCl 或H 2S 气体污染环境. 一系列替代它们的诸如二硫氰三苯膦[57] (TPPT)、三硫代碳酸盐[58]、二硫代或单硫代秋兰姆[59]、苯胺基硫代羰基1,2,4-三唑[60]、活化的二硫代胺基甲酸盐[61]等硫代羰基转移试剂已经吸引了不少研究者目光.以上硫代羰基转移试剂法尽管避免了巨毒的硫代光气或异硫氰酸酯, 也解决了HCl 或H 2S 气体放出污染环境的问题, 从而给反应提供了安全性和环境友好性, 但它们遭受实际条件的限制, 涉及到苛刻的反应条件、无水溶剂的使用、繁琐的多步骤操作、不易得到的起始原料、反应缺乏普遍适用性、总体收率也很低.2000年, Mohanta 研究组[62]以1-(甲基二硫代羰基)咪唑(19)或其N -甲基盐20为硫代羰基转移试剂, 在回流的乙醇溶剂中与胺发生取代反应合成了对称硫脲 21 (Eq. 8)和非对称硫脲22 (Scheme 9), 当反应以乙二胺或178有 机 化 学 V ol. 30, 2010邻苯二胺和19或20为底物在乙醇中加热时, 可得到四氢咪唑-2-硫酮和苯并咪唑-2-硫酮, 产率高达96%.Scheme 9值得一提的是, 硫代羰基转移试剂19或20与仲胺 (N -甲基苯胺、吗啉)按1∶2物质的量比在乙醇中回流时, 没有获得相应的四取代对称硫脲21, 结果生成了意外产物二硫代胺基甲酸甲酯. 然而, 对于非对称硫脲22的合成方法, 底物不管是氨气还是伯胺和仲胺, 都具有一定的普遍适用性.另外, 此类硫代羰基转移试剂的结构类似于硫代光气, 是个高效、安全的硫代羰基转移试剂, 反应条件温和, 操作简单, 反应在无毒的乙醇溶剂中进行, 试剂种类少, 产率高, 这无疑是硫脲类化合物合成研究中的绿色化新进程.6 以取代硫脲与胺为原料的合成以上讨论了胺作为亲核试剂与硫代羰基转移试剂发生亲核取代反应合成N -取代硫脲, 胺作为亲核试剂还可以与N -取代硫脲发生亲核取代反应合成新型硫脲类化合物.1999年, Xian 课题组[63]以一系列烷基伯胺或仲胺作为亲核试剂与N -亚硝基-1,3-二甲基硫脲于室温下在乙腈中发生亲核取代反应, 以95%以上的高产率合成了一系列N -取代硫脲23 (Eq. 9). 与化合物23传统制备方 法[64]相比, 该方法不仅产率高,而且很容易进行.烷基伯胺或仲胺作为亲核试剂, 除了易与亚硝基硫脲发生亲核取代生成N -取代硫脲外, 还易与1,3-二芳基对称硫脲发生亲核取代生成N -取代硫脲, 例如, 1993年, Ramadas 等[65]用1,3-二苯基硫脲在少量三乙胺催化下, 于乙腈中回流, 被伯胺或仲胺亲核取代, 生成非对称硫脲24 (Eq. 10). 与传统的非对称硫脲[66]的制备方法相比较, Ramadas 法反应时间较短(1.5~3 h), 产率较高(70%~92%).作为亲核试剂的烷基伯胺或仲胺是手性胺时, 取代产物将是手性硫脲. 例如, 2008年, 王进家等[67]用手性胺取代1,3-二芳基对称硫脲, 成功地获得了手性硫脲 25 (Eq. 11). 此方法避免了传统方法[10]异硫氰酸酯的使用, 且具有反应简便、产率较高、后处理简单等优点.7 结语和展望硫脲类化合物在各行各业具有广泛的应用, 因此近年来一直都有关于此类化合物合成新方法的文献报道, 从中不难看出, 如何寻找温和高效的催化剂和合成路线将是今后的探索目标, 利用微波加热和超声辐射技术缩短反应时间和优化条件值得尝试. 此外对于磺酰(环)硫脲的新合成方法以及硫脲类化合物的不对称合成研究均较少, 本文课题组正朝这方面开展更加深入的研究, 以经无机碱KOH 水溶液处理的磺酰胺和胺、二硫化碳为原料, 在室温下, 磺酰铵盐(RSO 2NHK)作为亲核试剂在水中与胺和二硫化碳的加合物发生亲核取代反应合成磺酰硫脲(Eq. 12), 底物是N -单磺酰二胺与二硫化碳时, 可发生分子内关环反应生成磺酰环硫脲(Eq. 13). 与以上报道的方法相比, 我们提出的方法全部在水相中进行, 且反应中所用的二硫化碳、KOH 价格均不高, 条件温和, 步骤简单, 具有潜在的应用前景.No. 2 丁从文等:硫脲类化合物合成方法研究进展179References1 Xue, S.-J.; Duan, L.-P.; Ke, S.-Y.; Zhu, J.-M. Chin. J.Struct. Chem. 2004, 23, 441 (in Chinese).(薛思佳, 段李平, 柯少勇, 朱剑明, 结构化学, 2004, 23,441. )2 Bessard, Y.; Crettaz, R. Tetrahedron2000, 56, 4739.3 Sriram, D.; Yogeeswari, P.; Madhu, K. Bioorg. Med. Chem.Lett. 2006, 16, 876.4 Faidallah, H. M.; Al-Saadi, M. S.; Rostom, S. A. F.; Fahmy,H. T. Y. Med. Chem. Res. 2007, 16, 300.5 Venkatachalam, T. K.; Mao, C.; Uckum, F. M. Bioorg.Med. Chem. 2004, 12, 4275.6 Jurasek, A.; Safar, P.; Zvalk, V. Chem. Pap. 1987, 41, 693.7 (a) Wazeer, M. I. M.; Isab, A. A.; Fettouhi, M. Polyhedron2007, 26, 1725.(b) Fettouhi, M.; Wazeer, M. I. M.; Isab, A. A. J. Coord.Chem.2007, 60, 369.8 Linton, B. R.; Goodman, M. S.; Hamilton, A. D. Chem. Eur.J. 2000, 6, 2449.9 Hayashita, T.; Onodera, T.; Kato, R.; Nishizawa, S.;Teramae, N. Chem. Commun. 2000, 755.10 (a) Okino, T.; Nakamura, S.; Furukawa, T.; Takemoto, Y.Org. Lett. 2004, 6, 625.(b) Jiang, L.; Zheng, H. T.; Liu, T. Y.; Yue, L.; Chen, Y. C.Tetrahedron2007, 63, 5123.11 Makhsumov, A. G.; Safaev, A. S.; Abidova, S. V. KatalPererab. Uglevodordn. Syrya1968, 2, 101 [Chem. Abstr.1969, 71, 101668v].12 Alder, A. EP307361, 1989[Chem. Abstr. 1989, 111,173788b].13 De Deyn, P.; Mareseau, B.; Quneshi, I. A.; Mori, A. Gua-nidino Compounds in Biology and Medicine, Vol. 2, John Libbey & Co. Limited, London, 1997.14 Wang, X. C.; Song, A. Y.; Zhu, J. H.; Yang, Z.; Zhang, Z.Synth. Commun. 2007, 37, 1627.15 Griffin, T. S.; Woods, T. S.; Klayman, D. L. In Advances inHeterocyclic Chemistry, Vol. 18, Eds.: Katritzky, A. R.;Boulton, A. J., 1975, p. 99 and references therein.16 Takeuchi, N.; Kasama, T.; Ikeda, R.; Shimizu, K.; Hatake-yama, K. Chem. Pharm. Bull. 1984, 32, 2249.17 Nishizawa, S.; Cui, Y. Y.; Minagawa, M.; Morita, K.; Kato,Y.; Taniguchi, S.; Kato, R.; Teramae, N. J. Chem. Soc.,Perkin Trans. 22002, 866. 18 Kato, R.; Cui, Y. Y.; Nishizawa, S.; Yokobori, T.; Teramae,N. Tetrahedron Lett. 2004, 45, 4273.19 Li, J. Z.; Zhang, Z. F.; Fan, E. K. Tetrahedron Lett.2004,45, 1267.20 Sun, X.-H.; Tao, Y.; Liu, Y.-F.; Jia, Y.-Q.; Chen, B.; Yang,J.-W. Chin. J. Org. Chem. 2008, 28, 155 (in Chinese).(孙晓红, 陶燕, 刘源发, 贾婴琦, 陈邦, 杨建武, 有机化学, 2008, 28, 155.)21 Wilcox, C. S.; Kim, E.; Romano, D.; Kuo, L. H.; Burt, A.L.; Curran, D. P. Tetrahedron 1995, 51, 621.22 (a) Scheerder, J.; Fochi, M.; Engbersen, J. F. J.; Reinhoudt,D. N. J. Org. Chem. 1994, 59, 7815.(b) Raposo, C.; Almaraz, M.; Martın, M.; Weinrich, V.;Mussons, M. L.; Alcazar, V.; Caballero, M. C.; Moran, J. R.Chem. Lett. 1995, 759.23 Tobe, Y.; Sasaki, S.; Hirose, K.; Koichiro, N. TetrahedronLett. 1997, 38, 4791.24 Schroeder, D. C. Chem. Rev. 1955, 55, 18125 Beecham Group Ltd. BE 819436, 1975 [Chem. Abstr. 1977,87, 201318e].26 Dalluhn, J.; Proehl, H. H.; Moers, O. Z. Naturforsch., B2001, 56, 1188.27 (a) Du, X.-H.; Xu, X.-S.; Fu, Y.-F.; Lou, Y.-L.; Xu, Z.-Y.Agrochemicals2004, 43, 78 (in Chinese).(杜晓华, 许响生, 傅幼锋, 楼泳淋, 徐振元, 农药, 2004, 43, 78.)(b) Kou, J.-P.; Luo, X.-Y.; Qin, C.-Y., Gao, J.-J.; Li, J.-Z.Chem. Reag.2009, 31, 67 (in Chinese)(寇景平, 罗旭阳, 秦翠英, 高俊杰, 李继贞, 化学试剂, 2009, 31, 67.)28 Chrisstoffels, L. A. J.; Jong, F.; Reinhoudt, D. N.; Sivelli,S.; Gazzola, L.; Casnati, A.; Ungaro, R. J. Am. Chem. Soc.1999, 121, 10142.29 Neville, R. G.; McGee, J. J. Can. J. Chem.1963, 41, 2123.30 Scheerder, J.; Fochi, M.; Engbersen, J. F. J.; Reinhoudt, D.N. J. Org. Chem. 1994, 59, 7815.31 Yang, F.-F.; Yu, T.-X.; Yang, X.-J. Chin. J. Org. Chem.2002, 22, 1040 (in Chinese).(杨发福, 余天祥, 杨先金, 有机化学, 2002, 22, 1040.)32 Kurzer, F. Chem. Rev. 1952, 50, 1.33 Faidallah, H. M.; Albar, H. A.; Makki, M. S. I.; Sharshira,E. M. Phosphorus, Sulfur Silicon Relat. Elem.2002, 177,685.34 McFarland, J. W.; Kozel, T. H.; Stuhlmacher, K. R.; Cheva-lier, T. S. J. Heterocycl. Chem. 1980, 17, 273.35 Cutting, G. A.; Stainforth, N. E.; John, M. P.; Kociok-Kohn,G.; Willis, M. C. J. Am. Chem. Soc. 2007, 129, 10632.36 Xiao, M. L.; Chen, F. H.; Chen, Z. J.; Guo, B. S.; Lü, X. H.;Tang, W. M. Chin. Chem. Lett.2007, 18, 258.37 Sridevi, G.; Rao, J. P.; Reddy, K. K. Synth. Commun. 1989,19, 965.38 Shi, D.-Q.; Wang, H.-Y.; Yang, F., Li, X.-Y. Acta Chim.Sinica2007, 65, 1713 (in Chinese).(史达清, 王海营, 杨芳, 李小跃, 化学学报, 2007, 65,180有机化学V ol. 30, 20101713.)39 Reeves, W. P.; Simmons, J. A.; Rudis, J. A. Synth. Com-mun. 1981, 11, 781.40 Gil-Molto, J.; Karlstrom, S.; Najera, C. Tetrahedron2005,61, 12168.41 Wei, T.-B.; Chen, J.-C.; Wang, X.-C. Chem. J. Chin. Univ.1992, 9, 1217 (in Chinese).(魏太保, 陈继畴, 王秀春, 高等学校化学学报, 1992, 9, 1217.)42 Li, Z.; Wang, X. C.; Da, Y. X.; Chen, J. C. Synth. Commun.2001, 31, 1433.43 (a)Bose, A. K.; Manhas, M. S.; Ganguly, S. N.; Sharma, A.H.; Banik, B. K. Synthesis2002, 1578.(b) Ii, Z.; Wang, X. C. Synth. Commun. 2002, 32, 3087.44 Li, Z.; Li, Z.-J.; Wang, X.-C. Chin. J. Org. Chem. 2003, 23,822 (in Chinese).(李正, 权正军, 王喜存, 有机化学, 2003, 23, 822.)45 (a) Jia, Z.-X.; Li, Y.-R.; Liu, C.-J. Chin.J. Org. Chem.2005, 25, 1450 (in Chinese).(贾兆祥, 李燕萍, 刘晨江, 有机化学, 2005, 25, 1450.)(b) Zhang, X. L.; Li, Y. P.; Liu, C. J.; Wang, J. D. J. Mol.Catal. A: Chem. 2006, 253, 207.46 Xue, S.-J.; Guo, Y.-L.; Li, J.-Z. Chin. J. Appl.Chem. 2006,12, 1381 (in Chinese).(薛思佳, 郭彦玲, 李景智, 应用化学, 2006, 12, 1381.)47 Sun, Y.-R.; Li, Y.-P.; Liu, C.-J.; Wang, J.-D. Chin. J. Org.Chem. 2008, 28, 151 (in Chinese).(孙燕荣, 李燕萍, 刘晨江, 王吉德, 有机化学, 2008, 28, 151.)48 Wang, X.-C.; Zhang, Z.; Quan, Z.-J.; Wang, M.-G.; Wang,F.; Li, Z.; Yang, C.-Y. Chin. J. Org. Chem. 2006, 26, 967(in Chinese).(王喜存, 张彰, 权正军, 王满刚, 王芳, 李正, 杨春燕, 有机化学, 2006, 26, 967.)49 Gedye, R.; Smith, F.; Westaway, K.; Ali, H.; Baldisera, L.;Laberge, L.; Rousell, R. Tetrahedron Lett. 1986, 27, 279.50 (a) Caddick, S. Tetrahedron1995, 51, 10403.(b) Galema, S. A. Chem. Soc. Rev. 1977, 26, 233. 51 Wang, X. C.; Quan, Z. J.; Li, Z. J.Chem. Res., Synop. 2005,71.52 Allen, C. F. H.; Edens, C. O.; VanAllan, J. Organic Synthe-ses, Vol. 3, Wiley, New York, 1955, p. 394.53 Ballabeni, M.; Ballini, R.; Bigi, F.; Maggi, R.; Parrini, M.;Predieri, G.; Sartori, G. J. Org. Chem. 1999, 64, 1029.54 Li, G.; Tajima, H.; Ohtani, T. J. Org. Chem. 1997, 62, 4539.55 Sasaki, S. I.; Mizuno, M.; Naemura, K.; Tobe, Y. J. Org.Chem. 2000, 65, 275.56 Sandin, H.; Swanstein, M. L.; Wellner, E. J. Org. Chem.2004, 69, 1571.57 (a) Tamura, Y.; Adachi, M.; Kawasaki, T.; Kita, Y. Tetra-hedron Lett. 1978, 1753.(b) Tamura, Y.; Kawasaki, T.; Tanio, M.; Kita, Y. Synthesis1979, 120.(c) Tamura, Y.; Kawasaki, T.; Adachi, M.; Kita, Y. Chem.Pharm. Bull. 1979, 27, 1636.58 Takikawa, Y.; Inoue, N.; Sato, R.; Yakizawa, S. Chem. Lett.1982, 641.59 Ramadas, K.; Srinivasan, N. Synth. Commun. 1995, 25,3381.60 Larsen, C.; Steliou, K.; Harpp, D. N. J. Org. Chem. 1978,43, 337.61 Sugimoto, H.; Makino, I.; Hirai, K. J. Org. Chem. 1988, 53,2263.62 Mohanta, P. K.; Dhar, S.; Samal, S. K.; Ila, H.; Junjappa, H.Tetrahedron2000, 56, 629.63 Xian, M.; Zhu, X. Q.; Li, Q.; Cheng, J. P. Tetrahedron Lett.1999, 40, 1957.64 Okawata, T.; Nakayama, K.; Furukawa, M. Chem. Pharm.Bull. 1983, 31, 507.65 Ramadas, K.; Srinivasan, N.; Janarthanan, N. TetrahedronLett. 1993, 34, 6447.66 Chatterjee, A.; Das, B.; Chaudhury, A. N.; Kirtaniya, D. S.Indian J. Chem. 1980, 19B, 163.67 Wang, J.-J.; Shen, Z.-X.; Zhang, Y.-W. Chin. J. Org. Chem.2008, 28, 1222 (in Chinese).(王进家, 沈宗旋, 张雅文, 有机化学, 2008, 28, 1222.)(Y0902165 Zhao, X.)。
硫脲及其衍生物的合成

1 N, 硫 代 磷 酰 基 芳 酰 胺 基 硫 脲 的 N一
合 威.
金桂玉 等[ 报道 了通过芳 酰肼 与硫代磷 酰基
异 硫 氰 酸 酯 的 加 成 反 应 ,合 成 了 1 4种 化 合 物 即
R 一
N 硫代磷 酰基 N 一 酰胺基硫 脲 ,其具 体合成 路 一 芳
图 2 N- 基 - - 代 - 基 硫 脲及 糖 2取 氨
2 N一 糖基 一一 代 . 基 硫 脲 及 N 糖 基 一 2取 氨
N 糖 基 . 取 代- 二硫 脲 类 化 合 物 的 合成 路 线 - N- 联
N 一 代一 二 硫 脲 类 化 合 物 的合 成 取 联
连 召 斌 等 [报 道 了通 过 糖 基 异 硫 氰 酸 酯 分 2 3 别 与 2肼 基 一一 基 一 , , 一 二 唑 、一 基 一/ 一 一 5芳 1 3 4恶 2肼 4 6
法, 其具体合成路线见 图 4 。
0
C 面S I K面 C N
…
2m 0 L石油醚产 生 白色 沉淀 , 抽滤 , 得 固体 用 乙 所 酸 乙酯和石油醚重结 晶得 白色晶体 。
6 ID 糖基 苯 胺 基 硫 脲 的合 成 3 一 .
肌
孙 卫 东 等 [报 道 了 从 糖 基 异 硫 氰 酸 酯 出发 , 6 J
状或 白色无定形物 。
3 N 取 代 硫 脲 的合 成 一
Miu oo r等 [报 道 了一 种 合 成 硫 脲 的 t oK dmai 。 s ] 方 法 , 具 体 的设 计 路 线 见 图 3 其 。
o
图 5 缩氨 基硫 脲 的 合成 路 线
其具 体合成方案如下 :
NH 4 S
硫脲衍生物及其配合物的生物活性研究进展

述 了硫 脲 衍 生 物 及 其 配 合 物 的 生 物 活 性 研 究 , 结 了取 代 基 影 响作 用 的 规 律 , 归 纳 了具 有 较 强 生 物 活 性 的硫 脲 类 化 合 总 并
物 结 构特 点 .
[ 关键词]硫 脲衍 生物; 配合物 ; 生物活性 [ 中图分类号 】 2 .2 06 36 6 [ 文献 标识码 】 A [ 文章编 号】1 0 —2 0 {0 0 0 —0 0 —0 0 9 12 2 1 )2 0 7 5
硫脲 衍 生物及 其 配合 物具 有除草 、 菌 、 菌、 节植 物 生长和 抗 病毒 等 广泛 的生物 活性 , 非线 性 抑 抗 调 在 光 学材料 以及 催 化合 成等方 面 也具有 应用 价 值 n . 过 该类 化 合 物 的 应 用研 究 , 以使 硫 脲衍 生 物 及 】通 可 其 配合物 的 理论性 研 究成果 转化 为实 际 效益 , 而设 计和 生产 绿色 、 从 环保 、 高效 、 成本 的硫脲 类 农用试 低 剂, 这对 促进 农业 生产 具有 重要 意义 【 2. 前期 的 研究 工作 中 【 J我 们合成 了多 种新 型 酰 基硫 脲衍 1 ]在 - l , 生物 及其 过 渡金属 配合 物 , 并对 其结 构和 生物 活 性进 行 了检测 . 实验 结果 显 示, 些硫 脲衍 生物 具有 较 一 强 的除草 性 能 . 了进 一步 了解 该类 化 合物 的 构效 关系 , 必 要对 其 结 构 和 生物 活 性 之 间 的关 系 进行 为 有
第3 1卷 总 第 7 8期
2 010 年 6 月
西 北 民 族 大 学 学 报( 自然科 学 版 )
Vo . 1 No 2 13 , .
Junl f ot 鹤 I e i r aoatsNaua S i c) ora o N r w t I r t f tnli ( trl c n e h u i sy o N i i v CHHcN — S -2O N儿 C O 一 - N
吡啶甲酰硫脲嘧啶衍生物的合成及生物活性研究(Ⅳ)

化 合 物
x
Y
4 .4 a f
CH 3
CH 3
4 b.4 g
OCH 3
CH3
4 ,4 c h
OC2 Hj
CH 3
4 .4 d i
OCH 3
O CH 3
0C j 2 H 0C 2 H
收 稿 日期 :2 0 一 1 2 . 0 1 l — 5 ・ 基 金 项 目 :上 海 市 科 学 技 术 发 展 基 金 资 助 课 题 ( 0 0 0 ) 20 D 7. 作 者 简 介 :管 谦 ( 9 7 ) 女 , 北 武 汉 人 , 士 研 究 生 , 要 从 事 ( ) 环 类 除 草 剂 的 合 成 及 生 物 活 性 研 究 17 一 , 湖 硕 主 稠 杂
维普资讯
第 3 6卷 第 2期
20 0 2年 6月
华 中师 范大学 学 报 ( 然科学 版 ) 自
J URNAI O OF CENTRA I CHI NA NORM AL U NI VERSI TY ( t c.) Na .S i
V o1 6 N O.2 .3
x N
0 N
S
Y
为 一 啶 甲 酰 硫 脲 ,4~ 4 为 7 吡 啶 甲 酰 硫 脲 ) 吡 f j 一 .
长 , 对 单 子 叶 植 物 安 全 ; 的 则 高 效 抑 制 单 子 叶 而 有
植 物 的生 长 , 双 子 叶 植 物 安 全 . 入 八 十 年 代 后 , 对 进
维普资讯
12 8
华 中师 范大学 学报 ( 自然 科 学 版 )
第3 6卷
l 实 验 部 分
酰基硫脲衍生物的合成工艺优化和药物制剂研究

酰基硫脲衍生物的合成工艺优化和药物制剂研究摘要:硫脲之类的化合物引起具有除草、抗肿瘤、调节植物生长、较高的生物活性、杀虫、抗菌等方面的良好性能,引起了许多学者对其关注和研究。
最近几年以来,人们在酰基硫脲衍生物合成方面进行了大量的分析和研究,许多的文献中也报道了酰基硫脲大量的新物质。
但是后续对它的实际运用没有相关研究,在酰基硫脲衍生物的相关药物或者制剂的运用方面没有相关文献和数据。
本文就酰基硫脲衍生物的合成工艺优化和药物制剂展开研究。
关键词:酰基硫脲;合成工艺;药物机制研制出来的新型农用药剂进入市场,首先在应用的方面要非常的成熟,要反复经过很多次的大田实验以及室内毒理的相关实验和调试,在确定了药剂性能好、安全、稳定、没有安全隐患的存在后才能够使用[1-2]。
所以酰基硫脲衍生物的合成工艺优化和药物制剂的研究有着非常重要的意义。
1.酰基硫脲衍生物的合成工艺优化1.1实验原理和方法在研究酰基硫脲衍生物生产工艺的过程中发现,酰基硫脲衍生物的产率会受诸多因素的影响,如时间、温度、催化剂的有用量等。
因此,需要对这些因素进行多次平行实验和探究,才可以确定酰基硫脲衍生物生产的最佳工艺和参数,利用求标准偏差的方式来提高实验数据的可信度和准确性。
通过比较几种酰基硫脲衍生物生产的方法,本文确定了生产工艺简单、操作方便且产率高的生产工艺,硫氰酸盐合成法合成目标化化物,其生产工艺的流程为:上述反应分两步完成,第一步有催化剂,确定两步的工艺条件。
第一步需要优化的工艺条件有温度、时间和催化剂用量,第二步需要优化的工艺条件有温度和时间。
1.2工艺优化(1)N-(2,3-二甲基笨胺基)-N'-(甲氧酰基)硫脲(DM)合成工艺的优化根据合成反应的方程式,以20mmol酰氯作为标准,计算目标化合物和中间产物KCL的理论产量。
计算后可得,DM和KCL的理论产量为4.8861g和1.4900g。
通过3次平行试验得出第一步反应的最佳温度应该是70°C,碎甲时间是2h,第二步反应的最佳温度是72°C,最佳时间是4.5h。
