药物制剂C T D申报资料(4、5.2类)最新模板.
CTD格式申报资料目录、化学药品申报资料项目(附件二格式)(5篇范例)

CTD格式申报资料目录、化学药品申报资料项目(附件二格式)(5篇范例)第一篇:CTD格式申报资料目录、化学药品申报资料项目(附件二格式)附件:原料药CTD格式申报资料目录管理信息资料:审查意见表/受理通知书(进口申请);药品注册现场核查报告;药品注册现场检查报告;药品注册检验报告申请表;药品研制情况申报表;药品注册现场检查申请表综述资料(文件夹名)1.药品名称。
2.证明性文件。
3.立题目的与依据。
4.对主要研究结果的总结及评价。
5.药品说明书、起草说明及相关参考文献。
6.包装、标签设计样稿。
信息汇总表(文件夹名)信息汇总表资料药学资料(文件夹名)1.基本信息(3.2.S.1)生产信息(3.2.S.2)3.特性鉴定(3.2.S.3)4.原料药的质量控制(3.2.S.4)5.对照品(3.2.S.5)6.包装材料和容器(3.2.S.6)7.稳定性(3.2.S.7)药理毒理研究资料(文件夹名)16.药理毒理研究资料综述。
17.主要药效学试验资料及文献资料。
18.一般药理学的试验资料及文献资料。
19.急性毒性试验资料及文献资料。
20.长期毒性试验资料及文献资料。
21.过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性等特殊安全性试验资料和文献资料。
22.复方制剂中多种成份药效、毒性、药代动力学相互影响的试验资料及文献资料。
23.致突变试验资料及文献资料。
24.生殖毒性试验资料及文献资料。
25.致癌试验资料及文献资料。
26.依赖性试验资料及文献资料。
27.非临床药代动力学试验资料及文献资料。
临床试验资料(文件夹名)案。
30.临床研究者手册。
31.知情同意书样稿、伦理委员会批准件。
32.临床试验报告。
二、制剂CTD格式申报资料电子提交目录管理信息资料:审查意见表/受理通知书(进口申请);药品注册现场核查报告;药品注册现场检查报告;药品注册检验报告申请表;药品研制情况申报表;药品注册现场检查申请表综述资料(文件夹名)1.药品名称。
制剂C T D格式药学研究信息汇总表(4、5.2)
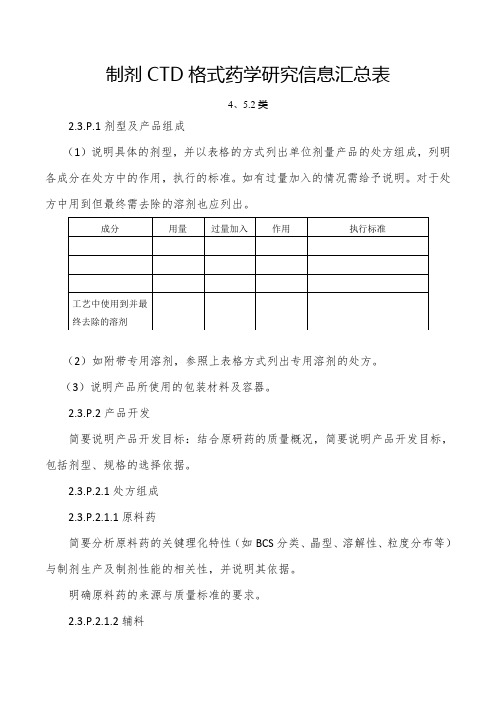
制剂CTD格式药学研究信息汇总表4、5.2类2.3.P.1剂型及产品组成(1)说明具体的剂型,并以表格的方式列出单位剂量产品的处方组成,列明各成分在处方中的作用,执行的标准。
如有过量加入的情况需给予说明。
对于处方中用到但最终需去除的溶剂也应列出。
(2)如附带专用溶剂,参照上表格方式列出专用溶剂的处方。
(3)说明产品所使用的包装材料及容器。
2.3.P.2产品开发简要说明产品开发目标:结合原研药的质量概况,简要说明产品开发目标,包括剂型、规格的选择依据。
2.3.P.2.1处方组成2.3.P.2.1.1原料药简要分析原料药的关键理化特性(如BCS分类、晶型、溶解性、粒度分布等)与制剂生产及制剂性能的相关性,并说明其依据。
明确原料药的来源与质量标准的要求。
2.3.P.2.1.2辅料简述辅料及其用量适合所用的给药途径的依据,结合辅料在处方中的作用简述辅料的与制剂性能相关的关键特性。
简述原料药和辅料的相容性试验的情况,包括试验设计、考察指标、试验结果等。
如未进行原料药和辅料的相容性试验,应提供相应的依据。
2.3.P.2.2 制剂研究2.3.P.2.2.1处方开发过程简述处方研究的主要内容。
包括处方开发的基本思路、试验设计、考察指标和方法、试验结果、与原研药的比较研究情况、处方的放大和调整等。
示例如下:某普通片剂的处方研究小结:参考原研药说明书、原辅料相容性试验情况、相关生产经验等,确定了辅料的基本种类;参考原研药的重量和大小、以及各辅料常规用量,确定了辅料的用量范围,以××××为指标,采用××××方法,对××××的种类和用量进行了比较筛选,对××××处方进行了研究,以原研药为对照药,结果显示××××,根据以上研究确定了初步的处方;在以上研究基础上,进行了影响因素稳定性考察,与原研药进行了××××的质量对比;在批量放大过程中,对××××进行了调整,确定了最终处方。
cde申报资料模板

cde申报资料模板
以下是一些关于CDE申报资料的信息和注意事项:
CDE是药品审评中心的简称,是国家药品监督管理局下属的一个机构,负责药品审评和注册等工作。
在向CDE提交药品注册申请时,需要按照规定的格式和要求提交申报资料,以确保申请能够顺利通过审评。
申报资料的格式和要求因申请类型和药品种类的不同而有所不同,但一般包括以下内容:
1. 药品注册申请表:包括申请人信息、药品基本信息、研究情况、临床试验情况等。
2. 药学研究资料:包括药学研究总结、药学研究报告、质量标准、工艺研究资料、稳定性研究资料等。
3. 临床研究资料:包括临床试验总结、临床试验报告、伦理审查报告等。
4. 综述资料:包括药品概述、药学研究综述、临床研究综述、国内外文献综述等。
5. 其他资料:包括申请人资质证明文件、药品制造和质量控制证书等。
在准备申报资料时,需要注意以下几点:
1. 确保资料完整、真实、准确,符合规定的格式和要求。
2. 按照规定的顺序和要求整理资料,确保审评人员能够顺利查阅和理解。
3. 重视药学研究和临床研究的科学性和规范性,确保数据真实可靠。
4. 注意保护知识产权,避免侵犯他人专利或商标。
5. 在提交申请前,进行自查和审核,确保没有遗漏或错误。
如果您需要更具体的帮助,建议您查阅CDE官方网站或咨询专业人士。
cde申报资料模板

cde申报资料模板CDE(China Drug Evaluation)申报资料是指在中国进行药物注册申报时所需要提交的相关材料。
这些资料主要用于对药物的安全性、有效性和质量进行评价,并最终决定是否批准该药物上市。
为了帮助申报人员准备相应的申报资料,以下是一份相关参考内容,供申报人员参考。
一、企业资质文件1.1 企业营业执照副本复印件1.2 企业生产许可证副本复印件1.3 企业药品生产许可证副本复印件1.4 企业药品GMP证书复印件二、研究开发资料2.1 药物研发计划:包括研究目标、研究设计、研究方案等相关信息2.2 药物临床试验资料:包括临床试验计划、试验结果、药物临床安全性评估等信息2.3 临床试验伦理委员会批准文件及委员会评估报告2.4 药物质量控制文件:包括药物的质量标准和质量控制方法等信息2.5 药物不良反应监测和报告文件:包括不良反应的监测和报告方法、不良反应事件的报告记录等信息三、药物监管文件3.1 药物批准文件:包括国内外相关药物批准文件的复印件3.2 国内外相关药物市场情况的调查分析报告四、药物学资料4.1 药物化学和配方学资料:包括药物的化学结构、化学性质以及配方的成分和比例等信息4.2 药物制剂学资料:包括药物的制剂形式、质量控制和稳定性等信息4.3 药物药理学资料:包括药物的作用机制、药效学、药动学以及药物之间的相互作用等信息4.4 药物毒理学资料:包括药物的急性毒性、亚急性毒性、慢性毒性以及生殖毒性等信息五、药物临床试验资料5.1 药物临床试验同意书和知情同意书5.2 药物临床试验方案和研究计划5.3 药物临床试验结果的统计分析报告5.4 药物临床试验的不良反应监测和报告文件六、药物充分性和适应性资料6.1 药物充分性资料:包括药物的临床试验结果、药物安全性和有效性的评价等信息6.2 药物适应性资料:包括药物的适应症、用法和用量等信息以上是CDE申报资料模板的相关参考内容,具体的申报要求还需要根据相关法规和CDE的相关通知进行调整。
CTD格式申报资料

CTD 格式申报资料撰写要求〔原料药〕一、目录原料药根本信息药品名称结构理化性质生产信息生产商生产工艺和过程控制物料控制要点步骤和中间体的控制工艺考据和议论生产工艺的开发特点判断结构和理化性质杂质原料药的质量控制质量标准解析方法解析方法的考据批检验报告质量标准拟定依照比较品包装资料和容器牢固性牢固性总结上市后牢固性承诺和牢固性方案牢固性数据二、申报资料正文及撰写要求根本信息药品名称供给原料药的中英文通用名、化学名,化学文摘〔 CAS〕号以及其他名称〔包括外国药典收载的名称〕。
结构供给原料药的结构式、分子式、分子量,如有立体结构和多晶型现象应特别说明。
理化性质供给原料药的物理和化学性质〔一般本源于药典和默克索引等〕,详细包括以下信息:性状(如外观,颜色,物理状态) ;熔点或沸点;比旋度,溶解性,溶液pH, 分配系数,解离常数,将用于制剂生产的物理形态〔如多晶型、溶剂化物、或水合物〕,粒度等。
生产信息生产商生产商的名称〔必然要写全称〕、地点、、以及生产场所的地点、、等。
生产工艺和过程控制〔1〕工艺流程图:按合成步骤供给工艺流程图,注明工艺参数和所用溶剂。
如为化学合成的原料药,还应供给其化学反响式,其中应包括初步原料、中间体、所用反响试剂的分子式、分子量、化学结构式。
(2〕工艺描述:按工艺流程来描述工艺操作,以注册批为代表,列明各反响物料的投料量及各步收率范围,明确要点生产步骤、要点工艺参数以及中间体的质控指标。
(3〕生产设备:供给主要和特别设备的型号及技术参数。
(4〕说明大生产的拟定批量范围。
物料控制依照工艺流程图中的工序,以表格的形式列明生产中用到的所有物料〔如初步物料、反响试剂、溶剂、催化剂等〕,并说明所使用的步骤。
比方以下:物料控制信息物料名称质量标准生产商使用步骤供给以上物料的质量控制信息,明确引用标准,或供给内控标准〔包括工程、检测方法和限度〕,并供给必要的方法学考据资料。
关于要点的初步原料,尚需依照相关技术指导原那么、技术要求供给其制备工艺资料。
药物制剂CTD申报资料(4、52类)模板
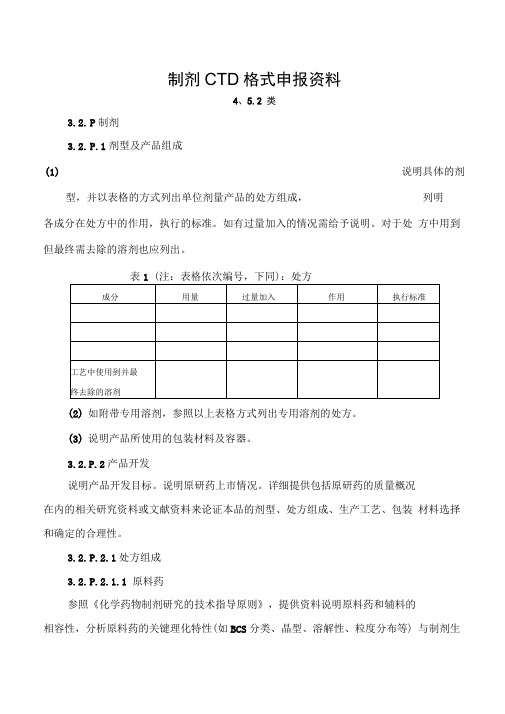
制剂CTD格式申报资料4、5.2 类3.2.P制剂3.2.P.1剂型及产品组成(1)说明具体的剂型,并以表格的方式列出单位剂量产品的处方组成,列明各成分在处方中的作用,执行的标准。
如有过量加入的情况需给予说明。
对于处方中用到但最终需去除的溶剂也应列出。
表1 (注:表格依次编号,下同):处方(2)如附带专用溶剂,参照以上表格方式列出专用溶剂的处方。
(3)说明产品所使用的包装材料及容器。
3.2.P.2产品开发说明产品开发目标。
说明原研药上市情况。
详细提供包括原研药的质量概况在内的相关研究资料或文献资料来论证本品的剂型、处方组成、生产工艺、包装材料选择和确定的合理性。
3.2.P.2.1处方组成3.2.P.2.1.1 原料药参照《化学药物制剂研究的技术指导原则》,提供资料说明原料药和辅料的相容性,分析原料药的关键理化特性(如BCS分类、晶型、溶解性、粒度分布等) 与制剂生产及制剂性能的相关性,并提供相关的研究资料与文献。
3.2.P.2.1.2 辅料说明辅料是否适合所用的给药途径结合辅料在处方中的作用分析辅料的哪些性质会影响制剂特性,提供相关的研究资料与文献。
3.2.P.2.2 制剂研究3.2.P.2.2.1处方开发过程参照《化学药物制剂研究的技术指导原则》,提供处方的研究开发过程和确定依据,包括文献信息(如对照药品的处方信息)、研究信息(包括处方设计,处方筛选和优化、处方确定等研究内容)、辅料种类和用量选择的依据、分析辅料用量是否在常规用量范围内,以及自制样品与原研药的质量特性对比研究结果(需说明原研药的来源、批次和有效期,自研样品批次,对比项目、采用方法),并重点说明在药品开发阶段中处方组成的主要变更、原因以及支持变化的验证研究。
如生产中存在过量投料的问题,应提供过量投料的必要性和合理性的相关研究资料。
3.2.P.2.2.2制剂相关特性对与制剂性能相关的理化性质,如pH、离子强度、溶出度、再分散性、复溶、粒径分布、聚合、多晶型、流变学等进行分析。
CTD申报资料模版

CTD申报资料模版1. 介绍本文档提供了CTD申报资料的模版,帮助申请人编写CTD 申报资料。
CTD,即Common Technical Document,是国际上通用的药品注册申报文档格式。
CTD申报资料是药品注册申请的核心文档,用于向药品监管机构提交药品的安全性、有效性和质量等相关信息。
2. CTD申报资料的结构与内容CTD申报资料包含5个模块,分别是:质量部分(Quality)、非临床部分(Nonclinical)、临床部分(Clinical)、申请人概述部分(Applicant’s Overview)和审核员概述部分(Module 5)。
2.1 质量部分质量部分包括了药品的质量控制和生产工艺方面的信息,主要内容包括:•药品的质量规范(Specifications)•药品的制造工艺(Manufacturing Process)•药品的成分(Composition)•药品的稳定性研究(Stability Studies)•药品的包装和标签(Packaging and labeling)2.2 非临床部分非临床部分包含了药物的非临床研究数据,主要内容包括:•药物的药理学和毒理学研究(Pharmacology and Toxicology Studies)•药物代谢与药物动力学研究(Metabolism and Pharmacokinetics Studies)2.3 临床部分临床部分包含了药物的临床试验数据,主要内容包括:•临床试验设计(Clinical Trial Design)•临床试验结果(Clinical Trial Results)•药物在人群中的疗效(Efficacy)•药物的安全性(Safety)2.4 申请人概述部分申请人概述部分是申请人对药物的总结和解释,主要内容包括:•药物的概述和用途(Overview and Uses of the Drug)•为什么该药物是安全和有效的(Why the Drug is Safe and Effective)•药物的剂量和给药途径(Dosage andAdministration)•药物的不良反应(Adverse Reactions)2.5 审核员概述部分审核员概述部分是药品审评机构对申请资料的总结和评价,主要内容包括:•药物的总结和评价(Summary and Assessment of the Drug)•对申请人的要求和建议(Recommendations for the Applicant)•对药物的批准或拒绝的意见(Opinion on Approval or Rejection of the Drug)3. 编写CTD申报资料的注意事项在编写CTD申报资料时,需要注意以下几点:•按照CTD的结构和内容编写,确保包含了所有必要的信息。
CTD格式申报资料范本

药品注册分类:化学药品六类注册申请分类:仿制药品注册申请药品名称:苯磺酸氨氯地平片(XX g、XX g)资料项目名称:药学研究CTD格式申报资料研究机构名称:XXX制药有限公司研究机构地址:XXXXXXXXX研究机构主要研究者:XXX研究机构电话:XXX注册申请联系人姓名:XXX原始资料的保存地点:XXX制药有限公司注册申请机构联系电话:XXXXXXXXX药品注册申请人:XXX制药有限公司苯磺酸氨氯地平片申报资料(药学部分)目录3.2.P.1 剂型及产品组成 (3)3.2.P.2 产品开发 (4)3.2.P.2.1 处方组成 (4)3.2.P.2.1.1 原料药 (4)3.2.P.2.1.2 辅料 (5)3.2.P.2.2 制剂研究 (5)3.2.P.2.2.1 处方开发过程 (5)3.2.P.2.3 生产工艺的开发 (20)3.2.P.2.4 包装材料/容器 (23)2.3.P.2.5 相容性 (23)3.2.P.3 生产 (23)3.2.P.3.1生产商 (23)3.2.P.3.2批处方 (23)3.2.P.3.3 生产工艺和工艺控制 (24)3.2.P.3.4 关键步骤和中间体的控制 (25)3.2.P.3.5 工艺验证和评价 (26)3.2.P.4 原辅料的控制 (31)3.2.P.5 制剂的质量控制 (31)3.2.P.5.1质量标准 (31)3.2.P.5.2 分析方法 (31)3.2.P.5.3 分析方法的验证 (34)3.2.P.5.4 批检验报告 (93)3.2.P.5.5 杂质分析 (97)3.2.P.6 对照品 (100)3.2.P.7 稳定性 (101)3.2.P.7.1稳定性总结 (101)3.2.P.7.2上市后的稳定性承诺和稳定性方案 (102)3.2.P.7.3 稳定性数据 (102)申报资料正文3.2.P.1 剂型及产品组成苯磺酸氨氯地平片是一种独特的具有高度血管选择性的长效二氢吡啶类钙离子拮抗剂,是心血管治疗药物中比较理想的长效降压药,也是近几年来世界处方量最大的高血压和心绞痛治疗药物。
CTD申报资料模版

CTD申报资料模版1. 引言本文档旨在为CTD(药物临床试验数据)申报提供一个标准化的资料模板,以便帮助申请人整理和准备相关文件。
本模板按照国家药监局的要求进行编写,并参考了相关指南和标准。
2. 资料清单下面是CTD申报资料的清单:1.申请表2.药物研究概况3.临床研究计划4.药物化学和药学附件5.其他相关附件3. 申请表在申请表中,需要填写以下信息:•申请人信息:包括申请人姓名、单位、联系方式等。
•药物信息:包括药物名称、剂型、规格、批号等。
•申报内容:包括申报的研究阶段、测试目标、研究计划等。
•相关声明:包括研究过程中的伦理和合规问题的声明。
4. 药物研究概况药物研究概况需要提供以下信息:•药物研究的背景和目的•相关研究基础和先行研究•临床试验方案的设计和方法•参与者招募和纳入标准•数据收集和统计分析方法•预期研究结果5. 临床研究计划临床研究计划需要提供以下信息:•研究设计与方法:包括研究类型、研究中心、样本大小、随机化方案等。
•研究过程的伦理和合规问题:包括伦理委员会审查、知情同意和机密保护等问题。
•数据收集和管理:包括数据收集时间点、数据管理计划等。
•统计分析计划:包括主要的统计分析方法和假设检验等。
6. 药物化学和药学附件药物化学和药学附件需要提供以下信息:•药物的化学结构和化学性质•药物的制备方法和工艺•药物的质量标准和分析方法(如鉴别、含量测定等)•药物的稳定性研究和储存条件7. 其他相关附件除了上述资料,申请人还需要提供其他相关附件,如:•急救方案和不良事件报告•临床试验结果和分析报告•相关专家和机构的鉴定或推荐信•其他与申报相关的文件8. 结论本文档提供了一个CTD申报资料的模版,帮助申请人整理和准备相关文件。
申请人应根据具体情况进行调整和补充,以确保申报资料的完整和准确。
努力准备好CTD申报资料,将有助于快速获得批准,并推动药物研究的进展。
注意:本文所提供的模版仅供参考,申请人需要根据实际需求和相关法规进行适当的调整和修改。
CTD格式模板资料(制剂)

CTD格式申报资料撰写格式(制剂)3。
2。
P。
1 剂型及产品组成3.2.P。
2 产品开发3。
2。
P。
2。
1 处方组成3.2.P。
2.1。
1 原料药3。
2。
P.2.1。
2 辅料3。
2。
P.2。
2 制剂3。
2.P。
2.2.1 处方开发过程3。
2。
P.2.2.2 制剂相关特性3。
2.P.2。
3 生产工艺的开发3。
2。
P。
2.4 包装材料/容器3。
2。
P。
2。
5 相容性3.2.P.3 生产3.2。
P。
3。
1 生产商3.2。
P.3。
2 批处方3。
2.P。
3.3 生产工艺和工艺控制3。
2。
P。
3。
4 关键步骤和中间体的控制3.2.P。
3.5 工艺验证和评价3。
2。
P。
4 原辅料的控制3.2.P.5 制剂的质量控制3。
2.P。
5.1 质量标准3。
2.P.5.2 分析方法3。
2。
P。
5。
3 分析方法的验证3。
2。
P。
5。
4 批检验报告3.2.P.5。
5 杂质分析3.2.P.5.6 质量标准制定依据3。
2.P。
6 对照品3.2.P。
7 稳定性3。
2。
P。
7.1 稳定性总结3.2.P。
7.2 上市后的稳定性研究方案及承诺3。
2。
P。
7。
3 稳定性数据CTD格式8号申报资料主要研究信息(药学部分:制剂)3。
2。
P。
1 剂型选择依据及产品组成(1)本品为普通片剂,规格为:10mg每片XXXXX片的处方组成见表3。
2。
P.1。
附表3.2.P.1 XXXXX片药物组成表(2)本品在制备过程中没有使用专用的溶剂。
(3)XXXXX片的内包装材料为铝塑板,有避光和防潮的作用,与XXXXX的内包装材质相同。
内包材的生产厂家具有内包材注册证,执行国家标准.3.2。
P。
2 产品开发XXXXX是HMG-CoA还原酶的一选择性、竞争性抑制剂,可以显著降低胆固醇水平,并降低心肌梗死或脑卒中的发病危险.临床试验已经证实XXXXX降低胆固醇的临床疗效明显优于其它汀类药物,对原发性高胆固醇血症、包括家族性高胆固醇血症或混合型高脂血症患者以及纯合子家族性高胆固醇血症者有明显疗效.XXXXX(商品名)作为目前世界上顶级降血脂药物,由美国华纳-兰伯特公司研制开发。
CTD申报资料模版

*********C T D格式申报资料一、目录剂型及产品组成产品开发处方组成原料药辅料制剂研究处方开发过程制剂相关特性生产工艺的开发包装材料/容器相容性生产生产商批处方生产工艺和工艺控制关键步骤和中间体的控制工艺验证和评价原辅料的控制制剂的质量控制质量标准分析方法分析方法的验证批检验报告杂质分析质量标准制定依据对照品稳定性 稳定性总结上市后的稳定性研究方案及承诺 稳定性数据二、申报资料正文剂型及产品组成(1)本品为淡黄色或类白色片,规格为50mg ,单位剂量产品的处方组成,各(2)本品无专用溶剂。
(3)本品采用PVC 铝塑包装,外加聚酯/铝/聚乙烯复合膜袋。
产品开发*********是德国拜耳开发上市的首个口服苷酶抑制剂,1990年首先在德国上市。
于1998年进入我国,商品名为“*********”。
我公司以“*********”为对照药品,研制了*********片,规格为50mg ,按照国家药品注册分类,属于化学药第6类已有国家标准品种。
处方组成 原料药*********化学名称为: 化学结构式为: 分子式: 分子量:*********为白色或类白色无定形粉末,在水中极易溶,在甲醇中溶解,在乙醇中极成 分 用量 百分重量作用 执行标准 微晶纤维素淀粉6026适量填充剂 填充剂 黏合剂中国药典2010年版 中国药典2010年版 中国药典2010年版********* 二氧化硅50活性成分 助流剂中国药典2010年版 中国药典2010年版微溶解,在乙腈和丙酮中不溶。
本品应密封、避光、在阴凉处保存。
辅料“*********”处方中所用的辅料为:微晶纤维素、淀粉、硬脂酸镁、二氧化硅。
本品处方参照“*********”,除加入粘合剂羟丙甲基纤维素外,其他辅料均与上市对照药“*********”一致,辅料相容性试验结果显示羟丙甲基纤维素对活性成分无明显影响。
制剂研究处方开发过程为尽量保证研制品与上市药品安全、有效性一致,我们对上市样品进行了全面的考察及评价,并全面考察原料的性质。
CTD格式申报资料撰写格式(制剂)

一批生产记录(批量、工艺参数、过程控制)和检验报告书
详述并论证批处方(3.2.p.2)中任何辅料范围
制剂特殊设计(片剂刻痕、印记等),提供必要的研究;
3.2.P.2.2.2制剂相关特性
对与制剂性能相关的理化性质,如pH,离子强度,溶出度,再分散性,复溶、粒径分布、聚合、多晶型、流变学等进行分析。提供自研产品与对照药品在处方开发过程中进行的质量特性对比研究结果,例如有关物质,溶出行为等。如为口服固体制剂,需提供详细的自研产品与对照药品在不同溶出条件下的溶出曲线比较研究结果,推荐采用f2相似因子的比较方式。
并以列表的形式提出开发目标(QTTP),包含:(1)预期的临床用途,给药途径、剂型、给药系统;(2)剂量规格(3)容器密闭系统(4)影响药代动力学和质量的关键属性(如:溶出度)(5)适合于拟上市产品的药品质量标准(如:纯度、稳定性和药物溶出);
参考下表:
产品属性
市售品
开发目标
剂型
性状
规格
给药方式
片重
(1)说明具体的剂型,并以表格的方式列出单位剂量产品的处方组成,列明各成分在处方中的作用,执行的标准。如有过量加入的情况需给予说明。对于处方中用到但最终需去除的溶剂也应列出。
成分
用量(百分比)
过量加入
作用
执行标准
重量
%
工艺中使用到并最终去除的溶剂
(2)如附带专用溶剂,参照以上表格方式列出专用溶剂的处方。
3.2.P.5.3分析方法的验证
3.2.P.5.4批检验报告
3.2.P.5.5杂质分析
3.2.P.5.6质量标准制定依据
3.2.P.6对照品
ctd申报模板

ctd申报模板
CTD申报模板是用于向监管机构提交化学药物临床试验申请的表格,通常包括以下内容:
1. 封面页:包括药物名称、申请人信息、申请类型、申报单位等信息。
2. 目录:列出整个申报材料的内容清单,便于审评人员快速了解申报材料的内容。
3. 概述:简要介绍药物的研发背景、目的、主要研究内容、技术方法等。
4. 药学研究总结:详细描述药物的剂型、处方组成、生产工艺、质量标准、稳定性等方面的研究结果。
5. 药理毒理研究总结:详细描述药物的初步药理、毒理、药效学等方面的研究结果。
6. 临床研究总结:详细描述临床试验的设计、实施过程、数据分析、结果评价等方面的研究结果。
7. 风险评估和安全有效性总结:对整个研发过程进行风险评估,并对药物的安全性和有效性进行总结。
8. 药品包装材料和标签说明:详细描述药品的包装材料、标签、说明书等方面的内容。
9. 参考文献:列出所有引用的文献。
以上是CTD申报模板的一般内容,具体内容可能因药物类型、申报目的和监管机构的要求而有所不同。
在编写申报材料时,建议仔细阅读相关法规和指导原则,遵循监管机构的要求,确保申报材料的质量和完整性。
ctd申报资料格式

ctd申报资料格式篇一:CTD格式申报资料范本药品注册分类:化学药品六类注册申请分类:仿制药品注册申请药品名称:苯磺酸氨氯地平片(XXg、XXg)资料项目名称:药学研究CTD格式申报资料研究机构名称:XXX制药有限公司研究机构地址:XXXXXXXXX 研究机构主要研究者:XXX 研究机构电话:XXX 注册申请联系人姓名:XXX 原始资料的保存地点:XXX制药有限公司注册申请机构联系电话:XXXXXXXXX药品注册申请人:XXX制药有限公司苯磺酸氨氯地平片申报资料(药学部分)目录3。
2。
P。
1 剂型及产品组成。
..。
.。
....。
.。
.。
.。
.。
.。
.。
.。
...。
.。
.。
...。
.3 3。
2.P.2 产品开发。
.。
.。
...。
....。
.。
..。
.。
.。
.。
.。
.。
.。
..。
43。
2。
P。
2。
1 处方组成。
..。
...。
.......。
.。
..。
...。
.。
..。
.. 43。
2。
P.2。
1。
1 原料药。
.。
....。
..。
.。
..。
.。
....。
.。
..。
.。
.。
.。
.。
.。
4 3。
2。
P。
2。
1。
2 辅料 ..。
.。
...。
..。
.。
.。
.。
.。
..。
.。
..。
..。
.。
..。
5 3.2。
P.2.2 制剂研究。
.。
.。
...。
.。
..。
...。
.。
.。
.。
...。
..。
53。
2.P.2.2.1 处方开发过程 ..。
.。
.。
...。
.。
.。
.。
.。
..。
.。
..。
...。
5 3。
2.P。
2.3 生产工艺的开发。
....。
.。
..。
..。
..。
....。
.。
.。
.。
...20 3。
2。
P。
2.4 包装材料/容器。
...。
..。
.。
.。
.。
.。
.。
..。
.。
.。
.。
23 2。
3.P.2.5 相容性 .。
...。
.。
.。
.。
...。
.。
..。
..。
..。
.。
.。
.。
...。
23 3.2。
P。
3 生产。
.。
....。
..。
.。
.....。
..。
.。
...。
...。
.。
..233。
CTD申报资料

CTD申报资料注册分类:化药六类 CTD资料*********CTD格式申报资料一、目录 3.2.P.1 剂型及产品组成3.2.P.2 产品开发3.2.P.2.1 处方组成3.2.P.2.1.1 原料药3.2.P.2.1.2 辅料3.2.P.2.2 制剂研究3.2.P.2.2.1 处方开发过程3.2.P.2.2.2 制剂相关特性 3.2.P.2.3 生产工艺的开发3.2P.2.3.1 小试工艺筛选3.2P.2.3.2 中试生产工艺筛选3.2P.2.3.3 生产工艺总结3.2P.2.3.4 关键工艺参数控制3.2P.2.3.5 生产工艺变化汇总3.2P.2.3.6 批分析汇总3.2.P.2.4 包装材料/容器3.2.P.2.5 相容性3.2.P.3 生产3.2.P.3.1 生产商3.2.P.3.2 批处方3.2.P.3.3 生产工艺和工艺控制 3.2.P.3.4 关键步骤和中间体的控制3.2.P.3.5 工艺验证和评价 3.2.P.4 原辅料的控制3.2.P.5 制剂的质量控制3.2.P.5.1 质量标准第 1 页共 36 页注册分类:化药六类 CTD资料 3.2.P.5.2 分析方法3.2.P.5.3 分析方法的验证3.2.P.5.4 批检验报告3.2.P.5.5 杂质分析3.2.P.5.6 质量标准制定依据3.2.P.6 对照品3.2.P.7 稳定性3.2.P.7.1 稳定性总结3.2.P.7.2 上市后的稳定性研究方案及承诺3.2.P.7.3 稳定性数据二、申报资料正文3.2.P.1 剂型及产品组成(1)本品为淡黄色或类白色片,规格为50mg,单位剂量产品的处方组成,各成分在处方中的作用以及执行的标准见表3.2.P.1。
表3.2.P.1 产品组成成分用量百分重量作用执行标准60 69.40 填充剂中国药典2010年版微晶纤维素26 30.08 填充剂中国药典2010年版淀粉0.52 适量黏合剂中国药典2010年版第 2 页共 36 页注册分类:化药六类 CTD资料********* 50 35.71 活性成分中国药典2010年版2.5 1.79 二氧化硅助流剂中国药典2010年版(2)本品无专用溶剂。
CTD格式申报资料范本

药品注册分类:化学药品六类注册申请分类:仿制药品注册申请药品名称:苯磺酸氨氯地平片(XX g、XX g)资料项目名称:药学研究CTD格式申报资料研究机构名称:XXX制药有限公司研究机构地址:XXXXXXXXX研究机构主要研究者:XXX研究机构电话:XXX注册申请联系人姓名:XXX原始资料的保存地点:XXX制药有限公司注册申请机构联系电话:XXXXXXXXX药品注册申请人:XXX制药有限公司苯磺酸氨氯地平片申报资料(药学部分)目录3.2.P.1 剂型及产品组成 (3)3.2.P.2 产品开发 (4)3.2.P.2.1 处方组成 (4)3.2.P.2.1.1 原料药 (4)3.2.P.2.1.2 辅料 (5)3.2.P.2.2 制剂研究 (5)3.2.P.2.2.1 处方开发过程 (5)3.2.P.2.3 生产工艺的开发 (20)3.2.P.2.4 包装材料/容器 (23)2.3.P.2.5 相容性 (23)3.2.P.3 生产 (23)3.2.P.3.1生产商 (23)3.2.P.3.2批处方 (23)3.2.P.3.3 生产工艺和工艺控制 (24)3.2.P.3.4 关键步骤和中间体的控制 (25)3.2.P.3.5 工艺验证和评价 (26)3.2.P.4 原辅料的控制 (31)3.2.P.5 制剂的质量控制 (31)3.2.P.5.1质量标准 (31)3.2.P.5.2 分析方法 (31)3.2.P.5.3 分析方法的验证 (34)3.2.P.5.4 批检验报告 (93)3.2.P.5.5 杂质分析 (97)3.2.P.6 对照品 (100)3.2.P.7 稳定性 (101)3.2.P.7.1稳定性总结 (101)3.2.P.7.2上市后的稳定性承诺和稳定性方案 (102)3.2.P.7.3 稳定性数据 (102)申报资料正文3.2.P.1 剂型及产品组成苯磺酸氨氯地平片是一种独特的具有高度血管选择性的长效二氢吡啶类钙离子拮抗剂,是心血管治疗药物中比较理想的长效降压药,也是近几年来世界处方量最大的高血压和心绞痛治疗药物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
制剂CTD格式申报资料4、5.2类3.2.P 制剂3.2.P.1 剂型及产品组成(1)说明具体的剂型,并以表格的方式列出单位剂量产品的处方组成,列明各成分在处方中的作用,执行的标准。
如有过量加入的情况需给予说明。
对于处方中用到但最终需去除的溶剂也应列出。
表1(注:表格依次编号,下同):处方(2)如附带专用溶剂,参照以上表格方式列出专用溶剂的处方。
(3)说明产品所使用的包装材料及容器。
3.2.P.2 产品开发说明产品开发目标。
说明原研药上市情况。
详细提供包括原研药的质量概况在内的相关研究资料或文献资料来论证本品的剂型、处方组成、生产工艺、包装材料选择和确定的合理性。
3.2.P.2.1处方组成3.2.P.2.1.1原料药参照《化学药物制剂研究的技术指导原则》,提供资料说明原料药和辅料的相容性,分析原料药的关键理化特性(如BCS分类、晶型、溶解性、粒度分布等)与制剂生产及制剂性能的相关性,并提供相关的研究资料与文献。
3.2.P.2.1.2辅料说明辅料是否适合所用的给药途径结合辅料在处方中的作用分析辅料的哪些性质会影响制剂特性,提供相关的研究资料与文献。
3.2.P.2.2 制剂研究3.2.P.2.2.1处方开发过程参照《化学药物制剂研究的技术指导原则》,提供处方的研究开发过程和确定依据,包括文献信息(如对照药品的处方信息)、研究信息(包括处方设计,处方筛选和优化、处方确定等研究内容)、辅料种类和用量选择的依据、分析辅料用量是否在常规用量范围内,以及自制样品与原研药的质量特性对比研究结果(需说明原研药的来源、批次和有效期,自研样品批次,对比项目、采用方法),并重点说明在药品开发阶段中处方组成的主要变更、原因以及支持变化的验证研究。
如生产中存在过量投料的问题,应提供过量投料的必要性和合理性的相关研究资料。
3.2.P.2.2.2制剂相关特性对与制剂性能相关的理化性质,如pH、离子强度、溶出度、再分散性、复溶、粒径分布、聚合、多晶型、流变学等进行分析。
提供自研产品与原研药品的理化性质、质量特性对比研究结果,例如有关物质等。
如为口服固体制剂,需提供详细的自研产品与原研药在不同溶出条件下的溶出曲线比较研究结果,推荐采用f2相似因子的比较方式。
如为手性药物,详细提供光学纯度和构型稳定性的研究控制情况。
3.2.P.2.3生产工艺的开发提供详细的工艺研究资料(包括实验数据及图谱),说明在开发阶段对哪些工艺步骤以何质量指标进行了工艺条件的优选与放大研究。
该资料应能充分证明申报的工艺有充足的研究与放大的数据支持,保证现有的申报工艺的规模、物料控制、操作流程及主要设备均已基本与大生产一致,已生产的批数与各批产品的质量均能反映出工艺具备一定的重现性,进而证明该申报工艺的合理性与大生产的可行性。
详细说明在工艺开发过程中生产工艺的主要变化(包括批量、设备、工艺参数、中间体控制等的变化)及相关的支持性验证研究。
汇总研发过程中代表性批次(应包括但不限于临床试验批、中试放大批、生产现场检查批、工艺验证批等)的样品情况,包括:批号、生产时间及地点、生产工艺、批量、用途(如用于稳定性试验,用于生物等效性试验等)、分析结果(例如有关物质、溶出度以及其他主要质量指标)。
示例如下:表xx:批分析汇总注:表中所列批次的生产工艺如不一致,应注明各工艺的编号,并在表格下另行说明各工艺的不同点。
3.2.P.2.4包装材料/容器(1)包材类型、来源及相关证明文件:表xx:包材类型、来源及相关证明文件注1例如,五层共挤膜输液袋,规格为内层:改性乙烯/丙烯聚合物,第二层:聚乙烯,第三层:聚乙烯,第四层:乙烯甲基丙烯酸酯聚合物,第五层:多酯共聚物;聚丙烯输液瓶,规格为250ml;铝塑泡罩包装,组成为:PVC/铝、PVC/PE/PVDC/铝、PVC/PVDC/铝;复合膜袋包装,组成为:聚酯/铝/聚乙烯复合膜袋、聚酯/低密度聚乙烯复合膜袋。
注2:表中的配件一栏应包括所有使用的直接接触药品的包材配件。
如:塑料输液容器用组合盖、塑料输液容器用接口等。
提供包材的检验报告(可来自包材生产商或供应商)。
(2)阐述包材的选择依据说明原研药所使用的内包材,并说明本品的内包材是否与原研药一致,如不一致,应提供充分的试验与文献依据。
(3)对包材选择的支持性研究详细提供本品与内包材相容性研究的资料,包括相容性试验的内容、每一项研究内容采用的试验设计、考察指标、检测方法及方法学验证、样品制备方法、试验结果及对结果的分析等。
相容性研究可以参考国内外相关指导原则进行。
如未进行包材相容性研究,应说明理由,并提供充分的文献依据。
3.2.P.2.5相容性提供详细的研究资料,说明制剂和附带溶剂或者给药装置的相容性。
3.2.P.3 生产信息3.2. P.3.1生产商详细提供生产商的全称、地址、电话、传真以及生产线的具体地址、电话、传真等。
上述信息应与申请表、证明文件、生产现场检查报告中的地址与生产线完全一致。
3.2.P.3.2 批处方以表格的方式列出典型生产规模产品的批处方组成,列明各成分执行的标准。
如有过量加入的情况需给予说明并论证合理性。
对于处方中用到但最终需去除的溶剂也应列出。
表xx:典型生产批的处方3.2.P.3.3 生产工艺和工艺控制(1)工艺流程图:按制备工艺步骤提供完整、直观、简洁的工艺流程图,应涵盖所有的工艺步骤、各物料的加入顺序,并标明关键步骤以及进行中间体检测的环节。
(2)工艺描述:以目前生产的最大批量为例,按单元操作过程描述工艺(包括包装步骤),明确操作流程、工艺参数和范围。
在描述各单元操作时,应结合不同剂型的特点关注各关键步骤与参数。
如大输液品种的原辅料的预处理、直接接触药品的内包装材料等的清洗、灭菌、去热原等;原辅料的投料量(投料比),配液的方式、温度和时间,各环节溶液的pH值范围;活性炭的处理、用量,吸附时浓度、温度、搅拌或混合方式、速度和时间;初滤及精滤的滤材种类和孔径、过滤方式、滤液的温度与流速;中间体质控的检测项目及限度,药液允许的放置时间;灌装时药液的流速,压塞的压力;灭菌温度、灭菌时间和目标F0值。
生产工艺描述的详略程度应能使本专业的技术人员根据申报的生产工艺可以完整地重复生产过程,并制得符合标准的产品。
(3)主要的生产设备:列表提供本品实际生产线的主要生产设备的相关信息,如型号、操作原理、规格、正常的批量范围、生产厂、用于的工艺步骤等,并说明与现有最大的生产批量的匹配性。
如现有最大的生产批量所用主要生产设备与实际生产线的不一致,应提供相应的放大研究与验证的试验依据,以证明在实际生产线上能采用工艺验证报告或空白的批生产记录上的工艺稳定地生产出合格的药品。
如输液制剂生产中的灭菌柜型号、生产厂、关键技术参数;轧盖机类型、生产厂、关键技术参数;过滤滤器的种类和孔径;配液、灌装容器规格等。
(4)拟定的大生产规模及依据:说明商业大生产的拟定批量及其制定依据。
通常可以结合生产设备情况、处方工艺研究放大情况、验证情况、临床试验/BE 试验样品的生产规模等拟定大生产规模。
如拟定的大生产的批量范围超出了研究开发过程中的最大生产批量(包括临床试验/BE试验样品的批量),应提供充分的放大研究与验证的依据。
3.2.P.3.4 关键步骤和中间体的控制列出所有关键步骤及其工艺参数控制范围。
详细提供界定关键工艺步骤和工艺参数的研究资料,以支持关键步骤确定的合理性以及工艺参数控制范围的合理性。
提供中间体的质量控制标准(包括项目、方法和限度)及质量标准拟定的依据,并提供必要的方法学验证资料。
3.2.P.3.5 工艺验证和评价提供无菌工艺步骤的工艺验证报告(编号:--,版本号:--),工艺必须在预定的参数范围内进行。
工艺验证内容包括:批号;批量;设备的选择和评估;工艺条件/工艺参数及工艺参数的可接受范围;分析方法;抽样方法及计划;工艺步骤的评估;可能影响产品质量的工艺步骤及可接受的操作范围、关键工艺步骤和工艺参数的确认等。
对于非无菌工艺步骤,可提交工艺验证报告(编号:--,版本号:--),也可仅提供工艺验证方案(编号:--,版本号:--)和上市后对前三批商业生产批进行验证的承诺书。
所有制剂均应提供空白的批生产记录样稿。
该样稿应是针对本品的实际生产线按照申报的工艺进行的操作规程,应与今后正常生产本品的SOP保持一致。
验证方案、验证报告、空白的批生产纪录等应有编号及版本号,且应由合适人员(例如QA、QC、质量及生产负责人等)共同签署。
3.2.P.3.6临床试验/BE试验样品的生产情况提供临床试验/BE试验样品的批生产记录和自检报告的复印件,包括相应的图谱。
提供原辅料的来源、相关证明文件以及执行标准。
表xx:原辅料的信息者制剂给药途径的需要精制而得,例如精制为注射给药途径用,需提供精制工艺选择依据、详细的精制工艺及其验证资料、精制前后的质量对比研究资料、精制产品的注射用内控标准及其起草依据。
如制剂生产商对原料药、辅料制定了内控标准,应分别提供制剂生产商的内控标准以及原料药/辅料生产商的质量标准。
提供原料药、辅料生产商的检验报告复印件以及制剂生产商对所用原料药、辅料的检验报告复印件。
提供是否有BSE/TSE风险的声明。
应提供充分的试验资料与文献资料,证明仿制品的质量与已上市原研药的质量是一致的,仿制品的货架期标准是合理可行的,且不低于现行的技术指导原则与各国现行版药典的要求。
3.2.P.5.1 质量标准按下表提供质量标准的分析方法与限度(方法不必详细描述,可简述为HPLC,或中国药典方法等),并与其他药典标准(如,BP、USP、EP等)进行比较。
如具有放行标准和货架期标准,应分别进行说明。
表xx:质量标准比较3.2.P.5.2 分析方法详细提供质量标准中各项目的检查方法及其筛选、优化的过程,并对其他药典收载的主要项目(如有关物质、溶出度、含量等)的方法列表进行比较。
示例可参考原料药项下。
3.2.P.5.3 分析方法的验证按照《化学药物质量控制分析方法验证技术指导原则》、《化学药物质量标准建立的规范化过程技术指导原则》、《化学药物杂质研究技术指导原则》、《化学药物残留溶剂研究技术指导原则》以及现行版《中华人民共和国药典》附录中有关的指导原则,逐项提供详细的方法学验证资料,并提供相关验证数据和图谱。
可采用表格形式整理验证结果,示例如下:表xx:有关物质检查方法——HPLC法的建立表xx:有关物质方法学验证结果有关物质分析方法的验证应采用拟控制的杂质的对照品与供试品进行验证,以充分证明该分析方法确实能有效地检出相应的杂质。
3.2.P.5.4 批检验报告提供不少于三批连续生产的验证批或生产批样品的检验报告。
提供临床试验/BE试验样品的检验报告。
3.2.P.5.5 杂质谱分析以列表的方式列明产品中可能含有的杂质,分析杂质的产生来源,结合相关指导原则要求,对于已知杂质给出化学结构并提供结构确证资料,并提供控制限度。
