食管癌和胃癌的多学科综合治疗现状
食管癌综合治疗的研究进展

万方数据
壁堕基熊皇堕壅!业堡垒旦蔓丝鲞蔓!塑 次,共4周,放疗对39例进行术前治疗,均进行了手术 治疗,手术标本病理完全缓解率为23%,总的3年生 存率为40%,其中病理完全缓解者3年生存率高达 88%。Luu等∽1在1995--2005年对64例食管癌行新 辅助放化疗,与同期58例新辅助化疗对比,两组手术 死亡率分别为6%和0%(P=0.12),术后并发症分别 为48%和33%(P=0.09),完全病理反应分别为17% 和4%(P=0.02),两组的术后复发率比较差异有统计 学意义。新辅助放化疗组的1、3、5年生存率及中位生 存期分别为76%、46%、41%和17个月,而新辅助化 疗组为70%、40%、3l%和21个月。
食管癌是一个全身性疾病,因此任何单一治疗方 式都难以大幅度提高其疗效。多数临床研究表明;多 学科的综合治疗能提高食管癌治疗效果。有目的、有 计划地合理安排综合治疗程序已受到广泛的重视。目 前食管癌主要的综合治疗模式包括术前放疗、术后放 疗、同期放化疗、术前同期放化疗和术后同期放化疗 等,现就其研究进展做一简单综述。
刘敦序等¨1将200例食管癌随机分为术前放疗组 (100例)和单一手术组(100例),结果两组间切除率、 5年和10年生存率比较差异无统计学意义,其中胸上 段食管癌5、10年生存率在术前放疗组中分别为 41.75%、33.58%。在单纯手术组中分别为22.69%、 17.24。差异有统计学意义(P<0.05);胸下段食管癌 术前放疗组的生存率反而低于单纯手术组(P< 0.05)。胸中段食管癌两组生存率比较差异无统计学 意义(P》0.05)。得出结论,术前放疗能提高胸上段食 管癌的远期生存率,而胸下段食管癌患者尽量避免术 前放疗。1998年英国医学研究委员会癌症计划办公 室Meta分析小组,对英、法、丹麦、挪威和我国的6组 共1 147例随机研究资料进行Meta分析¨o,结果与单 纯手术组比较,术前放疗组的死亡危险率下降11%。 术前放疗组的2、5年生存率分别为34%和18%,而手 术组为30%和15%,分别改善了4%和3%。差异无统 计学意义(P=0.062)。该分析倾向于可能达到显性 结果,但病例数需达到2 000例左右。
食管癌治疗的现状和进展

化疗
01
化疗是利用化学药物杀死肿瘤细胞的治疗方法,适 用于晚期食管癌或术后辅助治疗。
02
常用的化疗药物包括顺铂、氟尿嘧啶、紫杉醇等, 根据病情选择合适的药物和剂量。
03
化疗的优点是可以全身治疗,但不良反应较大,需 要密切监测。
其他治疗方法
其他治疗方法包括热疗、免疫治疗、 基因治疗等,目前仍处于研究阶段, 尚未广泛应用。
化疗药物
针对食管癌细胞分裂增殖的特点,开发出新型化疗药物,提高疗效 和降低副作用。
免疫疗法
免疫检查点抑制剂
通过阻断免疫细胞表面的检查点 分子,解除对免疫细胞的抑制作 用,增强免疫系统的抗肿瘤能力。
细胞免疫疗法
利用患者自身的免疫细胞,经过 体外培养和扩增后回输到患者体 内,直接杀伤肿瘤细胞。
肿瘤疫苗
康复训练
对患者进行康复训练,包括吞咽功能、呼吸功能等,帮助他们尽快恢 复日常生活和工作能力。
新型治疗方法的临床应用和推广
01
免疫治疗
随着免疫治疗的发展,越来越多的免疫疗法被应用于食管癌的治疗。如
PD-1抑制剂、CAR-T细胞疗法等。
02
基因治疗
通过修改肿瘤细胞的基因,达到抑制肿瘤生长、扩散的目的。目前已有
通过激发机体免疫系统对肿瘤抗 原的识别和反应,提高机体对肿 瘤的抵抗力。
基因治疗
基因编辑技术
溶瘤病毒
利用CRISPR-Cas9等基因编辑技术, 对食管癌细胞中的特定基因进行敲除、 突变或置换,以达到治疗目的。
利用某些对肿瘤细胞具有高度亲和性 的病毒,选择性地在肿瘤细胞内复制 并破坏肿瘤细胞。
基因疗法
将具有抑制肿瘤生长功能的正常基因 导入到肿瘤细胞中,以纠正异常基因 表达或补充缺失基因。
食管癌外科治疗的现状与未来展望

食管癌外科治疗的现状与未来展望傅剑华;谭子辉【摘要】Surgery is the main treatment of esophageal cancer. Esophagectomy by right transthoracic approach is recently recom-mended in China. Minimally invasive esophagectomy is feasible and safe with low perioperative morbidity and offers results that are as good as open thoractomy. Multimodal treatment, especially neoadjuvant chemoradiotherapy or chemotherapy, may improve surviv-al and has become one of the standard treatments for locally advanced esophageal cancer. Fast-track esophagectomy may reduce length of hospital stay, perioperative morbidity, and hospital charges. The surgery of esophageal cancer tends to be minimally invasive, individual, comprehensive, and standardized.%外科手术仍是治疗食管癌的最重要手段,近10年来国内推荐对胸段食管癌经右胸路径,并渐成共识;微创食管切除术(minimally invasive esophagectomy,MIE)安全可行,有利于减少术后并发症,完全可以与传统开胸手术媲美。
2022食管癌的治疗进展(全文)

2022食管癌的治疗进展(全文)食管癌主要包括食管腺癌(OAC)和食管鳞癌(SCC),是全球第七大常见癌症,每年导致约450000人死亡。
虽然既往被视为预后不佳的癌症,但近年来也出现了令人鼓舞的进展。
首先,高收入国家癌症生存项目(ICBP SURVMARK-2)的报告了1995-1999年和2011-2014年两个时间段食管癌的生存率,结果显示在七个高收入国家中,OAC和SCC的5年生存率大约翻了一番,其中75岁以下的患者影响最大。
其次,在联合治疗时代,食管癌5年生存率基准接近50%,这在20年内也翻了一番。
此外,通过提高癌症意识,监测Barrett食管、胃食管反流病和癌症分期的进步,增加了黏膜和黏膜下病变的早期检出率,并允许对部分患者进行相对低风险的内镜根除治疗(EET),如内镜下黏膜切除术(EMR),内镜粘膜下剥离术(ESD)以及射频消融术(RFA)等。
外科手术的进步,包括手术切除和淋巴结切除术范围的标准化,围术期护理的改善,以及包括微创和机器人辅助技术在内的一系列方法,为提高患者生存率创造了机会。
随着基因组学和分子研究的进步,我们对食管癌变和肿瘤生物学的理解逐步加深,新的治疗方法不断涌现,患者结局得以改善。
然而,尽管食管癌的诊疗已经取得了进步,但在日常的多学科团队讨论和决策中仍然存在一些问题,包括内镜下治疗的标准、新辅助治疗的选择、SCC 和OAC 的差异性、对新辅助治疗有明显完全临床反应的患者是否考虑非手术方法或者手术的方式以及免疫治疗和靶向治疗的作用等。
粘膜癌和粘膜下癌的内镜治疗食管切除术曾经是高度异型增生(high-grade dysplasia,HGD)或黏膜浸润(mucosal invasion,T1a)患者的标准方法,而在这种情况下,淋巴结转移(<2%)的罕见性支持更有针对性的局部治疗方法。
因此,在最新的美国胃肠病学指南中,EMR和ESD优于持续监测或食管切除术。
目前的治疗推荐为T1b的患者保留食管切除术(粘膜下浸润,其中淋巴结转移发生在约20%的病例中,以及多灶性癌或不适合内镜切除的病变)。
晚期胃癌食道癌患者的临床治疗观察

晚期胃癌食道癌患者的临床治疗观察【摘要】目的对晚期胃癌、食道癌的治疗效果进行观察和分析。
方法选取我院2011——2013年间收治的晚期胃癌食道癌患者为研究对象,按照是否接受综合治疗将晚期胃癌患者分为观察组1和对照组1,将晚期食道癌患者分为观察组2和对照组2。
结果观察组1中患者经过综合治疗后,大部分有明显好转,达到显效标准的有1人,达到有效标准的有29人,只有15人治疗无效。
而对照组1中患者经过姑息性治疗后只有3人达到有效标准,其余均无效。
观察组2中患者经过综合治疗有9人达到显效标准,有效22人,只有12人无效;而对照组2中只有1人有效,32人无效。
结论晚期胃癌和食道癌患者接受临床治疗对于缓解症状,改善预后,提高生存率有不可估量的价值。
【关键词】晚期胃癌;晚期食道癌;临床治疗观察doi:10.3969/j.issn.1004-7484(s).2013.09.082 文章编号:1004-7484(2013)-09-4861-01胃癌和食道癌均为最常见的消化道肿瘤,在我国发病率高,预后差,对人们生活质量和生命造成严重危害。
晚期胃癌和食道癌患者多有远处转移[1-2],手术治疗效果不佳,同时患者常伴有明显营养不良和多种并发症,对于手术、放化疗的耐受差。
目前多采用手术联合化学治疗为主的综合治疗,根据病人自身情况制定治疗方案,但患者的预后较差,生存率较低。
我们对我院2011——2013年间收治的180例晚期胃癌、食道癌患者进行临床治疗观察,现报到如下。
1 资料与方法1.1 一般资料选取我院2011——2013年间收治的180例晚期胃癌、食道癌患者作为研究对象。
其中,晚期胃癌患者104例,晚期食道癌患者76例。
104例晚期胃癌患者中,男性61例,女性43例。
其中58人接受综合治疗,作为观察组1;46人由于身体或其他原因不允许,接受姑息性治疗,作为对照组1。
观察组1中男性33人,女性25人,年龄范围35-81岁,平均年龄为50.3±9.3岁;对照组1中男性28人,女性18人,年龄范围37-80岁,平均年龄54.6±12.4岁。
以手术为主的食管癌综合治疗进展

2024晚期胃癌转化治疗的现状与临床问题

2024晚期胃癌转化治疗的现状与临床问题摘要晚期胃癌异质性强、预后差,既往治疗策略以系统姑息治疗为主。
转化治疗旨在对初始不可切除肿瘤经综合治疗后,降低肿瘤分期并完整切除肿瘤, 从而改善患者预后。
近期多项大型临床研究已证实免疫检查点抑制剂联合化疗可显著提高晚期胃癌的客观缓解率并延长生存时间。
同时,随着多学科协作治疗的广泛开展和外科手术技术的进步,转化治疗在改善部分晚期胃癌患者的预后方面展现出巨大潜力。
然而,由于晚期胃癌在局部分期、肿瘤转移部位和分子分型等方面极为复杂,其转化治疗仍存在诸多争议和尚待解决的问题。
笔者深度剖析国内外胃癌转化治疗的相关研究进展,探讨晚期胃癌转化治疗的现状与临床问题。
关键词胃肿瘤;晚期;转化治疗;免疫治疗;多学科协作治疗胃癌是我国常见恶性肿瘤,临床实践中10%~35%的患者确诊时已发展为不可切除晚期胃癌,5年生存率仅10% [1 ]o肿瘤转化治疗是针对初始不可切除晚期肿瘤,经术前治疗后转化为可手术切除状态的治疗策略。
胃癌转化治疗的核心是通过综合应用术前放化疗、免疫治疗、靶向治疗等手段, 缩小初始不可切除肿瘤的体积,使原发灶和转移灶均可达到RO切除,最终目标为改善患者生存。
对于晚期胃癌,以往以药物治疗为主,手术只适用于存在出血、梗阻、穿孔等并发症情况。
前瞻性REGATTA研究结果显示:对于局限性转移晚期胃癌,与单纯姑息性化疗比较,姑息手术联合化疗不能改善患者预后[2 ]o近年来,随着术前精准诊断和治疗、多学科团队(multidisciplinary team , MDT)协作的广泛开展,以及外科手术技术的进步,部分晚期胃癌可通过转化治疗获得RO手术切除,延长患者生存时间。
少部分患者通过转化治疗可达到病理学完全缓解(pathologic complete response , pCR )的治疗效果。
因此,晚期胃癌通过转化治疗行手术切除的临床效果再次受到关注。
笔者对国内外胃癌转化治疗的相关研究进展进行系统阐述,探讨晚期胃癌转化治疗的现状与临床问题。
多学科协作综合医疗模式诊断和治疗进展期胃癌
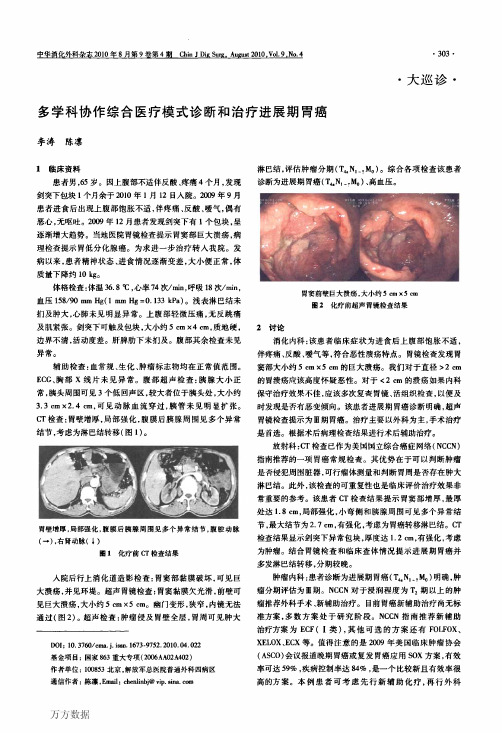
万方数据
·304·
生堡邋丝处拄苤壶垫!Q生!旦筮!鲞筮垒翅£b也』Q嫱坠强,叁!理堕垫!Q:!尘:竺:盥!:生
手术。 普通外科:胃癌诊断和治疗依赖于多学科协作,针对具
体患者进行个体化综合治疗,可以达到最佳治疗效果。胃癌 外科治疗强调手术的根治性和规范化,要求清扫至少15枚 淋巴结。本例患者可先行新辅助化疗,3个周期后全面评估 化疗疗效,选择合适时机行远端胃癌D:根治术。需要注意 的是化疗药物可能会引起局部组织水肿,增加术后出血、吻 合口漏的风险。
刘 政 向明章 牟玮 陈祖林 易 东 郑 江 曾冬竹廖克龙熊鸿燕
张冬 郑红
万方数据
疗强调外科手术,术后进行辅助化疗。但是随着药物和相关
技术的发展,胃癌治疗理念不断更新。通过MDT模式进行
胃癌患者个体化、综合治疗将成为趋势。针对本例患者的病
情,影像学专家进行了准确的肿瘤分期;肿瘤内科专家对胃
癌化疗进行了详细分析,并制定了新辅助治疗策略;普通外
科专家进行了标准的胃癌根治手术,病理学检查结果证实患
3治疗 根据多学科协作综合治疗团队(multi.diseipinary tern。
M町)讨论意见,本例患者分别于2010年1月20日、2月8日、 3月4日进行3次新辅助化疗,方案为SOX(S一1 80 mg/m2, 第1—14天;奥沙利铂130 mg/m2,第1天;每3周1次)。CT 复查提示胃壁较治疗前变薄,强化不明显,胰腺周围淋巴结 缩小,最大者约为1.2 cm(图3);胃镜检查提示病灶明显缩 小,镜下肿瘤大小约为1.5 em×1.0 em;超声胃镜检查提示 肿瘤侵及全层,周围可见肿大淋巴结(图4)。总体疗效评价 为基线肿瘤长径总和缩小≥30%,毒副反应评估为0级。
肿瘤内科:患者诊断为进展期胃癌(T4.N∽M0)明确,肿 瘤分期评估为Ⅲ期。NCCN对于浸润程度为T2期以上的肿 瘤推荐外科手术、新辅助治疗。目前胃癌新辅助治疗尚无标 准方案。多数方案处于研究阶段。NCCN指南推荐新辅助 治疗方案为ECF(I类),其他可选的方案还有FOLFOX、 xEL0x、ECX等。值得注意的是2009年美国临床肿瘤协会 (ASCO)会议报道晚期胃癌或复发胃癌应用SOX方案,有效 率可达59%,疾病控制率达84%,是一个比较新且有效率很 高的方案。本例患者可考虑先行新辅助化疗,再行外科
2023年胃癌精准治疗最新进展

2023年胃癌精准治疗最新进展胃癌和食道癌是世界上发病率第5位和第8位的疾病,2020年分别新增110万和60万新发病例,分别是肿瘤相关死亡的第4位和第6位主要原因,每年共造成130万人死亡。
在高收入国家,二者的预后较差,胃癌的5年生存率为20%-30%,食管癌为15%-25%。
在世界范围内,90%的食道癌是鳞状细胞癌,特别是在东南亚和中亚以及东非发病率较高。
其10%的食管癌是腺癌,主要集中在欧洲和北美。
近几十年来,在西方,位于远端食管的食管腺癌的增加与位于近端胃贲门和胃食管连接处(GEJ)的胃腺癌的增加相一致。
靠近GEJ附近的这些肿瘤与肥胖和反流有关,而与细菌病原体如幽门螺杆菌无关,幽门螺杆菌与非贲门癌更相关,这在非西方国家常见。
在美国,非贲门胃癌的发病率在过去几十年一直在下降,而与此同时,贲门性胃癌的发病率却在增加。
在亚洲,关于贲门癌和非贲门癌发病率的具体数据更为稀少,但报告显示两种腺癌的发病率都在减低。
近年来,随着免疫治疗和靶向治疗研究快速进展,这些新的治疗方法极大的改善了这部分患者的预后。
近期,美国临床肿瘤学会(ASCO)召集了多学科专家小组,在519项研究中筛选出18项Ⅱ或Ⅲ期随机对照临床研究,并对其进行研究回顾,并以此为基础发布了首个关于晚期胃食管癌免疫治疗和靶向治疗的诊疗指南,旨在为晚期胃食管癌患者的诊疗提供更多的循证医学证据。
推荐如下推荐1.1对于人表皮生长因子受体2(HER2)阴性且PD-L1联合阳性评分(CPS)≥5的患者,建议一线治疗选用Nivolumab联合化疗合氟脲嘧啶类和铂类为基础的化疗(类型:基于证据;利大于弊;证据质量:中等;推荐强度:强)。
限定性说明:对于HER2(-)且PD-L1(CPS 1-5)的患者,根据情况可考虑应用Nivolumab联合氟脲嘧啶类和铂类为基础的化疗作为一线治疗。
对于HER2(-)且PD-L1(CPS 0)的患者,推荐氟脲嘧啶类和铂类为基础的化疗作为一线治疗,无需加用Nivolumab。
食管鳞癌围术期综合治疗现状与进展

【摘要】 局部晚期食管鳞癌的治疗策略是以手术为主的综合治疗,如何在围术期合理安排化疗、放疗及免疫治疗是目前学界研究的热点。
新辅助治疗方面,已有多项研究证明化疗以及放化疗能够使远期预后获益,但孰优孰劣仍存在争论;新辅助免疫治疗的加入进一步提高了病理完全缓解率,但如何搭配现有新辅助治疗方案以及疗效的精确评估仍有待进一步研究。
单纯手术后的辅助治疗能够改善转移淋巴结阳性患者的预后,但新辅助治疗后淋巴结持续阳性的患者辅助治疗并不能带来更多获益,术后辅助免疫治疗也许是常规新辅助治疗(化疗或放化疗)后高危患者提高远期生存的有效治疗模式。
【关键词】 食管鳞癌;新辅助治疗;辅助治疗;免疫治疗Current situation and progress of perioperative comprehensive treatment for esophageal squamous cell carcinomaDai Liang, Chen Keneng (The First Department of Thoracic Surgery, Key Laboratory of Carcinogenesis and Translational Research (Ministry of Education), Peking University Cancer Hospital & Institute, Beijing 100142, China)Correspondingauthor:ChenKeneng,E-mail:*******************.cn 【Abstract 】 The treatment strategy of locally advanced esophageal squamous cell carcinoma is surgery-based multidisciplinary treatment. How to reasonably arrange chemotherapy, radiotherapy and immunotherapy perioperatively is a hot topic in the academic field. For neoadjuvant therapy, many studies have proved that chemotherapy and chemoradiotherapy could bring long-term survival benefits for patients, yet which is better still remains controversial. The addition of neoadjuvant immunotherapy further improves the pathological complete response rate of patients, whereas how to arrange the available neoadjuvant therapy as well as the accurate evaluation of curative effect still need further research. Postoperative adjuvant therapy after surgery could improve the prognosis of patients with positive metastatic lymph nodes, but for patients with persistent positive lymph nodes after neoadjuvant therapy, postoperative therapy could not bring more benefits. On the other hand, postoperative adjuvant immunotherapy may be an effective treatment strategy to improve the long-term survival of high-risk patients after conventional neoadjuvant therapy (chemotherapy or chemoradiotherapy).【Key words 】 Esophageal squamous cell carcinoma; Neoadjuvant therapy; Adjuvant therapy; Immunotherapy食管鳞癌围术期综合治疗现状与进展戴亮,陈克能(北京大学肿瘤医院暨北京市肿瘤防治研究所 胸外一科 恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142)基金项目:北京市优秀人才培养资助项目(2018000021469G259);北京市医院管理局消化内科学科协同发展中心专项经费资助(XXT018);吴阶平医学基金(320.6750.2020-15-2)通信作者:陈克能 E-mail :*******************.cn食管癌是我国常见的恶性肿瘤之一,我国食管癌每年新发病例约32万例,死亡病例约30万例,发病率在恶性肿瘤中排名第6位,死亡率排名第4位,其中男性新发食管癌病例22.3万例,死亡20.7万例,女性新发食管癌病例10.1万例,死亡9.4万例[1]。
2022食管癌的诊疗现状及展望(全文)

2022食管癌的诊疗现状及展望(全文)食管癌已是全球范围内常见的恶性肿瘤之一,据2020 年全球癌症统计,食管癌的新发病人数达60.4 万,死亡人数达54.4 万。
中国是食管癌高发地区,虽然中国食管癌的发病率及死亡率均呈下降趋势,但依旧是威胁我国居民健康的主要恶性肿瘤。
我国食管癌主要的组织学类型为鳞状细胞癌为主,好发于食管的中段及中上段,往往需要进行食管大切除手术,患者术后生活质量较差,预后也不理想。
近几年,食管癌的外科机器人手术治疗和内科免疫治疗两个赛道都非常火热,在2022 年中国肿瘤学大会(CCO)上,来自浙江省肿瘤医院毛伟敏教授,作客「丁香大咖时间」栏目,针对今年CCO 食管癌相关的最新报道分享了自己的一些的见解。
Q1:在今年的中国肿瘤学年会(CCO)中食管癌领域的相关报道有哪些特别值得关注的亮点内容呢?1、食管癌微创治疗术的发展腔镜技术、微创机器人手术等新技术在这次CCO 上得到大家的关注肯定和深入交流。
腔镜技术和机器人手术这类微创治疗手术与传统手术相比,患者创伤小,术后恢复好且快,患者生活质量更佳。
同时,术后较好的PS 评分和营养状态也有利于患者更好地耐受术后放化疗。
2、食管癌新辅助和辅助治疗新辅助治疗中免疫治疗联合化疗、免疫治疗放化疗,是这次会议的重大亮点之一。
在免疫治疗的新时代,在食管癌尤其是中国食管鳞癌新辅助当中免疫联合化疗起到了非常好的治疗效果。
3、食管癌外科治疗的技术创新大家交流了食管癌外科手术如何使肿瘤廓清,以及淋巴清扫的廓清,当然这个问题也一直是国内外探讨食管癌外科治疗的热点的问题之一。
4、食管癌术后康复问题如何减少手术当中的一些并发症,以及对并发症的处理,在这次学术的交流当中也有非常亮眼的展现。
Q2:除了传统的放疗化疗和手术之外,食管癌新兴治疗手段也是方兴未艾。
您能谈谈目前哪些新兴疗法是您比较看好的吗?1、免疫治疗目前在食管癌治疗中,首先非常看好免疫治疗的未来发展。
免疫治疗的独到之处是其良好的疗效和较低的不良反应。
食道癌的医疗发展现状
周口师范学院2013~2014学年度第二学期期末考试《人体组织学与解剖学》生命科学与农学学院 生物技术专业 2012级《食道癌的诊断与治疗》【摘要】:食道癌是世界最常见的恶性肿瘤疾病之一,目前关于食道癌发生发展的机制尚不明确。
普遍认为食道癌的发生、发展是环境因素、遗传物质、饮食、生活习惯、病毒等多种因素共同长期作用的结果。
我国是食道癌高发国家,研究食道癌,对预防食道癌、降低食道癌发病率意义重大。
【关键字】: 食道癌 症状 病因 诊断 治疗 预防 【引言】: 食道癌是指由食管鳞状上皮或腺上皮的异常增生所形成的恶性病变。
,食道癌典型的症状为进行性咽下困难,先是难咽干的食物,继而是半流质食物,最后水和唾液也不能咽下。
因此了解食道癌的症状可以及时治疗,防止病情恶化。
近几年来,人们对食道癌发生的相关因素,检测及治疗方法等进行了大量的研究,现对近年来的研究进展作一综述。
1、 食道癌的临床症状1.1进行性吞咽困难 这是食和癌最典型的症状,表现为患者本人自己感觉到在吞咽粗食后有暂时性胸骨后食物停留,如象有气体阻档食物的感觉,尤其晨进第一口食物时表现最为突出。
在发病的初期,由于肿块较小,对进食影响不大,所以十分容易被忽视。
当肿块逐渐增大,食管腔狭小时,可出现进行性吞咽困难。
1.2进食时胸骨后疼痛 在吞咽食物困难的同时,也可以出现胸骨后疼痛的感觉。
这种疼痛为灼痛、钝痛、随进入食物而加重,如果吃的食物比较热或食物的酸性较大,疼痛则更为明显。
当食物咽下后,疼痛略有缓解。
1.3胸胃后不适感 有一些病人并没有胸骨的疼痛的症状,而只是感觉到在胸骨后有不适感。
在食管癌的患者是,大约有1/5的人有此症状,所以对这样病人应该注意。
1.4其他咽喉部干燥和紧缩感,病人常感到脖子发紧,咽下食物不利,并有微疼。
有时还可出现心口窝疼痛,这样情况多在咽下食物时出现。
上面提到的这些早期症状都有一个共同的特点是和咽下食物有关。
一旦发现了这些症状,应引起特别的重视,及时到医院就诊2、食道癌的引发原因2.1、遗传因素据医学统计,发现高发区有百分之五十左右的患者有阳性家族史,可以看出遗传因素在该疾病的发病中占有一定地位。
食道癌的医疗发展现状

周口师范学院2013~2014学年度第二学期期末考试《人体组织学与解剖学》生命科学与农学学院生物技术专业 2012级《食道癌的诊断与治疗》【摘要】:食道癌是世界最常见的恶性肿瘤疾病之一,目前关于食道癌发生发展的机制尚不明确。
普遍认为食道癌的发生、发展是环境因素、遗传物质、饮食、生活习惯、病毒等多种因素共同长期作用的结果。
我国是食道癌高发国家,研究食道癌,对预防食道癌、降低食道癌发病率意义重大。
【关键字】: 食道癌症状病因诊断治疗预防【引言】: 食道癌是指由食管鳞状上皮或腺上皮的异常增生所形成的恶性病变。
,食道癌典型的症状为进行性咽下困难,先是难咽干的食物,继而是半流质食物,最后水和唾液也不能咽下。
因此了解食道癌的症状可以及时治疗,防止病情恶化。
近几年来,人们对食道癌发生的相关因素,检测及治疗方法等进行了大量的研究,现对近年来的研究进展作一综述。
1、食道癌的临床症状1.1进行性吞咽困难这是食和癌最典型的症状,表现为患者本人自己感觉到在吞咽粗食后有暂时性胸骨后食物停留,如象有气体阻档食物的感觉,尤其晨进第一口食物时表现最为突出。
在发病的初期,由于肿块较小,对进食影响不大,所以十分容易被忽视。
当肿块逐渐增大,食管腔狭小时,可出现进行性吞咽困难。
1.2进食时胸骨后疼痛在吞咽食物困难的同时,也可以出现胸骨后疼痛的感觉。
这种疼痛为灼痛、钝痛、随进入食物而加重,如果吃的食物比较热或食物的酸性较大,疼痛则更为明显。
当食物咽下后,疼痛略有缓解。
1.3胸胃后不适感有一些病人并没有胸骨的疼痛的症状,而只是感觉到在胸骨后有不适感。
在食管癌的患者是,大约有1/5的人有此症状,所以对这样病人应该注意。
1.4其他咽喉部干燥和紧缩感,病人常感到脖子发紧,咽下食物不利,并有微疼。
有时还可出现心口窝疼痛,这样情况多在咽下食物时出现。
上面提到的这些早期症状都有一个共同的特点是和咽下食物有关。
一旦发现了这些症状,应引起特别的重视,及时到医院就诊2、食道癌的引发原因2.1、遗传因素据医学统计,发现高发区有百分之五十左右的患者有阳性家族史,可以看出遗传因素在该疾病的发病中占有一定地位。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Surg Clin N Am 89 (2009) 79–96食管癌和胃癌的多学科综合治疗现状Roderick M. Quiros, MD a,*, Courtney L. Bui, MD b关键词•食管癌•胃癌•手术•化疗•放射治疗•新辅助治疗•辅助治疗食管癌和胃癌是全球性疾病,在最常见的恶性肿瘤中分别名列第8位和第4位[1]。
这两种肿瘤早期不易诊断,一般发现时即为晚期肿瘤。
手术切除仍是传统的主要治疗方法,虽然单纯手术后局部和全身复发率较高,因此化疗和放疗已整合到这些癌症的治疗中。
尽管确切的治疗方案因肿瘤的区域水平不同而有所变化,但已有证据表明多模式治疗是改善食管胃癌转归最有希望的策略。
食管癌食管癌(EC)在美国相当罕见,2008年的新发病例为16500例,死亡14300例[2]。
鳞状细胞癌(鳞癌)和腺癌是食管癌最主要的两种组织学亚型。
鳞癌好发于上段食管和中段食管,发病具有一定的地域性,与吸烟和过度饮酒有关。
腺癌好发于下段食管和胃食管结合部,尤其是有胃食管返流性疾病、肥胖或Barrett’s食管患者[3-5]。
临床上,食管癌患者经常表现为进食固体食物时吞咽困难,继而进展为进食流质饮食也出现吞咽困难。
可出现胸骨后疼痛。
胃肠道营养摄入减少,体重下降。
肿瘤侵袭周围组织结构,例如喉返神经、气管支气管树,导致声音嘶哑或进食时剧烈干咳影响呼吸。
液体进入肺部导致吸入性肺炎。
食管造影术常用于可疑性恶性肿瘤的最初诊断,有助于区分肿块症状是功能性的还是机械性的(例如肿瘤引起)。
另外,电子胃镜(EGD)也可用于最初诊断,不仅可以直接观察肿瘤,还可以进行活检和涂片。
此外,食管超声内镜(EUS)可以评估肿瘤侵犯的深度和局部淋巴结的情况,可对肿瘤进行分期并有助于确定后续治疗[6,7]。
其他诊断手段还包括放射性标记的氟代脱氧葡萄糖正电子发射断层显像(CT-PET),其远处转移的检测准确性高于90% [8,9],且可根据肿瘤中可检测的显像剂的代谢活性变化评价肿瘤对术前治疗的反应[10,11]。
在影像学和组织学研究的基础上,可将食管癌分为局限性和转移性,并根据病变程度确定治疗。
手术在美国,手术治疗常采用两种术式。
Ivor-Lewis食管切除术(ILE)采用右侧开胸和开腹,虽然术后肺部并发症的发生率较高,但可以在良好的暴露条件下对胸腔内食管和周围淋巴组织进行切除[12]。
此外,由于需要进行胸内吻合,术后吻合口瘘的发病率较高。
经裂孔食管切除术(THE)包括开腹和颈部切开,但避免了开胸,它是另一种常用的食管切除术,可直接对纵膈内的食管进行切除,同时进行颈部吻合。
Orringer等近期发表了迄今样本最大的THE研究[13],2000多例手术患者30年内的主要并发症发生率低于3%。
在经验丰富的手术中心比较这2种术式发现,两者转归基本相似[12,14],与医院的规模和食管切除术的年台数直接相关[15]。
微创食管切除术(MIE)已被提出作为ILE和THE的替代方法。
Luketich等[16]报道在222例患者中使用胸腔镜进行食管切除术的结果,MIE等同或优于开放手术;与绝大多数开放手术相比,MIE死亡率较低(1.4%)、住院天数较短(7天)。
基于这些结果,一项评价MIE的新的多中心intergroup试验(ECOG 2202)已在进行之中。
内镜下粘膜切除术(EMR)是一种用于早期鳞癌的微创手术,在日本较常用[17]。
它尤其适用于局限于粘膜固有层内的高分化或中度分化的鳞癌。
虽然在食管癌患者中未进行EMR的大样本随机化研究,但是小样本研究显示它可用于西方人群[18],甚至对食管腺癌的治疗也有作用[19]。
确定的非手术治疗放疗作为食管癌确定的治疗手段在已有的系列病例中已进行了评价,并获得了不同程度的成功[20-23]。
但食管癌单纯放疗的生存率较低[24]。
目前,单纯放疗仅用于不适合手术和需要姑息治疗的患者。
除此之外,需要进行全咽喉切除术的颈段食管癌患者或有广泛性纵膈侵袭的患者能从放疗中获益。
虽然单纯放化疗更倾向于治疗鳞癌而非腺癌,但该方法仍能够治愈一部分食管癌患者。
具有里程碑意义的临床研究RTOG85-01,比较了单纯放疗(64 Gy)和放化疗结合方案[(50 Gy放射治疗同时辅助性给予顺铂和5-氟尿嘧啶(5-FU)]治疗T1-3N0-1M0食管癌患者[25]。
其中82%患者为鳞癌,其余为腺癌。
联合治疗方案治疗患者5年和8年生存率分别达到26%和22%;单纯放疗组5年未见存活的患者。
联合方案使得5年肿瘤远处转移率从30%降至16%。
值得注意的是,局部肿瘤持续或复发是2组患者治疗失败最常见的原因,占联合治疗患者的38%。
EST-1282试验也对单纯放疗和放化疗结合方案进行了比较,结果显示放化疗联合应用能改善患者的中位生存期(分别为9.2个月和14.8个月)[26]。
该研究未报道肿瘤复发的模式。
放化疗联合方案的总生存率仍较低、局部复发率仍较高。
为了改善肿瘤局部复发和远处转移,采用了增加放疗照射剂量或化疗强度的方法。
Intergroup 0122试验增加了放射剂量并加入了新辅助化疗,但由于治疗的毒性,该方案并未获得成功[27]。
Intergroup 0123试验应用了与RTOG 85-01试验相同的化疗方案,但照射剂量由50.4 Gy增至64.8 Gy [28]。
转归无显著差异,高剂量组却出现更多的治疗相关性死亡病例。
当时,对于不能手术治疗或患有颈部食管癌的患者,确定的放化疗方案是RTOG 85-01中的方案,直至进一步的研究证明对患者转归有改善的方案出现。
包括手术的联合治疗由于食管癌即使在手术切除后仍然出现局部和全身性肿瘤复发,研究者重点评价二联或三联方案,在食管癌术后或术前采用化疗和放化疗。
一些研究对手术联合术前化疗方案与单纯手术治疗食管癌进行了比较。
美国Intergroup 0113是一项多中心随机试验,在局部和可切除食管癌患者中,比较213例接受手术联合术前化疗方案与227例单纯手术治疗患者的疗效[29]。
术前化疗包括3个疗程的顺铂和5-FU,化疗结束4周内行手术治疗。
患者术后仍接受2个疗程的化疗。
单纯手术治疗组与术前化疗组实施相同的手术方案。
中位随访55.4个月,结果显示2组患者的中位生存期无显著差异,术前化疗组的中位生存期为14.9个月,单纯手术组为16.1个月(P=0.53)。
治疗起始后2年内,2组无显著差异。
加用化疗后,局部或远端复发率也未改变。
这些患者的近期更新数据显示,围手术期化疗与单纯手术组的总生存无差异,但少数接受根治性(R0)切除和术前化疗后肿瘤客观消退的患者,生存率确实得到改善[30]。
医学研究委员会(MRC)针对食管癌患者进行了另一项随机对照研究[31]。
与Intergroup 0113研究结果不同,与单纯手术治疗的患者相比,术前接受2个疗程的顺铂和5-FU化疗的患者总生存期更长(P=0.004)。
单纯手术组的中位生存期为13.3个月,同步化疗组的中位生存期为16.8个月,两者的2年生存率分别为34%和43%。
MRC进行的另一项试验围手术期应用表柔比星、顺铂和5-FU化疗方案治疗可切除食管胃癌患者(MRC胃癌辅助注射疗法/MAGIC试验)[32]。
患有可切除的胃部、胃食管接合部或食管下端腺癌患者接受手术联合术后化疗或单纯手术治疗。
中位随访4年发现,围手术期化疗组总生存率较高个月[40]结果仍受到批判,因为与同期的其他试验相比2008年得出结(P =0.009),单纯手术组5年生存率为23%,围手术期化疗组的5年生存率为36%。
除此以外,围手术期化疗组的肿瘤大小和分期均有下降。
虽然以上结果提示术前化疗对总生存率有部分益处,但该研究中仅有15%患者真正属于下段食管癌。
Malthaner 等[33]对术前随机接受或未接化疗、以生存期为主要转归指标的食管癌潜在可切除的患者进行meta 分析。
该分析包含8项研究,共1729例患者。
有部分证据提示术前化疗能改善患者的生存期。
值得注意的是,没有证据表明术前化疗组与单纯手术组的肿瘤复发率有差异。
作者得出结论:对于可切除食管癌,与单纯手术治疗相比,手术联合术前化疗能延长患者生存期。
历史上,手术切除是食管癌治疗的主要方法,单纯手术的3年总生存率为6%~37% [34-37]。
R0切除患者的3年总生存率仅为39% [30],有29%患者出现肿瘤局部复发[30]。
根治性切除患者中有50%发生了肿瘤远处转移[29]。
单纯术前放疗并未显著改善患者生存情况[38]。
若干研究评价了术前短程同步放化疗的作用,旨在发现更充分的手术切除并能清除微转移病灶。
从接受新辅助治疗的食管癌研究中筛选出一些研究列于表1。
3项研究中的患者为鳞癌,新辅助治疗无效[34,39,40]。
2项为化疗和放疗序贯治疗,疗效不及同步放化疗,而且,该研究中给予的放射剂量和分级不符合美国的标准[34,39]。
中华大学食管癌研究组(CURE )的试验采用更加标准的化疗和放疗剂量,但中位随访时间非常短,仅为16.9。
除了Walsh 等[36]的研究,表1中其余的研究均包含了鳞癌和腺癌。
新辅助治疗可能是应用最广泛的方案,同单纯手术治疗相比,试验在第1周和第6周同步术前接受40 Gy 放疗联合5-FU 和顺铂化疗。
作者发现术前治疗组和单纯手术组的3年总生存率有差异(32%和 6%)。
尽管得出这样的结果,然而他的试验,单纯手术组患者的生存率极低。
Urba 等[35]研究纳入鳞癌和腺癌患者,采取术前5-FU 和顺铂联合45 Gy 同步放疗方案,结果发现新辅助治疗方案组的3年总生存率与单纯手术治疗组相比出现差异,分别为30%和16%。
遗憾的是,该研究并未有力地证明两者的差异,虽然得出的结果有较好的前景,但结果无统计学差异。
近期,癌症和白血病小组B (CALGB )研究者试图评价5-FU 与顺铂联合50.4 Gy 放疗的新辅助方案(RTOG 85-01研究已显示该方案为有效),并将该方案与单纯手术相比较 [37]。
因病例募集缓慢,研究提前终止,原因是该研究实施时医师不愿将患者随机分入单纯手术组。
计划招募的475例患者中仅入组了56例。
随访6年,于果,单纯手术组中位生存期为1.8年,新辅助治疗组中位生存期为4.5年。
虽然新辅助放化疗方案的益处在单项试验中未能取得一致的重现,但几项meta 分析显术治疗时一致性出现病理完全缓解的患者,无进展生存期和总生存期更长[43,44]。
示该方案能改善患者生存期。
Gebski 等[41]研究发现术前放化疗有效,2年绝对生存差异达13%。
另一项meta 分析中,Fiorica 等[42]计算出治疗3年后死亡率的比值比是0.53,放化疗方案更有效。
在多数涉及新辅助放化疗的研究中,病理缓解被认为是主要的终点指标,因为接受手鉴于前述研究结果,在美国,新辅助化疗和放疗后手术切除是食管癌的优选治疗方案。
