人教新课标版高中必修一4.3 硫和氮的氧化物课件(第一课时)
合集下载
高一化学-4.3-硫和氮的氧化物1-新人教版必修1PPT课件

二 看颜色
无色气体
氧 闻气味
强烈的刺激性气味
化 死、亡浓
的 做比较
和空气的平比均空相气密度大
物 理
沸
点
对分子质量对比
沸点为-10容0C易液化
性 溶解性
1解体4积0体的积水的大易二约氧溶可化以于硫溶水
质 二氧化硫是一种无色、有刺激性气味、有毒、
比空气重、容易液化- 、易溶于水的气体。7
程度: 暂时性,加热可复原
范围:漂白某些有色物质,不能使紫
色石蕊试液褪色
-
17
二 探究:在上述实验的试管 氧 中保留1/3溶液,滴入1-2 化 滴品红溶液,振荡,观察
硫 颜色变化。加热试管,再
的 观察。
化 学
现象:品红褪色,加热后溶液又变红。
性 现象分析:SO2跟某些有色物质生成不稳定的无色
质 物质。这种无色物质易分解而使有色物质恢复原来
-
22
-
23
思考与交流:
SO2能使溴水、KMnO4溶液褪
色与SO2使品红褪色,实质相同吗?
不同!
-
24
我们知道SO2 和Cl2都具有漂白性。 为了使漂白性更强,有人提出将两
者混合使用,你认为这种做法能达 到预期目的吗?
SO2 +Cl2+2H2O=H2SO4 +2HCl (两种气体生成两种强酸)
的颜色。
|漂 注:SO2只能使酸碱指示剂变色,不能使之褪色。
白 思考:SO2的漂白原理与Cl2水的漂白原理是否相同?
性
-
18
氯水和二氧化硫漂白性的比较
氯水中HClO将有色物 SO2溶于水与有色物质 质氧化成无色物质 直接结合生成不稳定
人教版高中化学必修1:4.3《硫和氮的氧化物》(共9张PPT)

•
16、业余生活要有意义,不要越轨。2021/8/42021/8/4August 4, 2021
•
17、一个人即使已登上顶峰,也仍要 自强不 息。2021/8/42021/8/42021/8/42021/8/4
谢谢观赏
You made my day!
我们,还在路上……
2NO+O2=2NO2
2× 3NO2+H2O=2HNO3+NO
4NO2+O2+2H2O=4HNO3
3× 2NO+O2=2NO2 2× 3NO2+H2O=2HNO3+NO
4NO+3O2+2H2O=4HNO3
•
9、有时候读书是一种巧妙地避开思考 的方法 。2021/8/42021/8/4Wednesday, August 04, 2021
第四章 非金属及其化合物 第三节 硫和氮的氧化物
一、氮气 ㈠ 、氮气物理性质
无色无味的气体,难溶于水, 密度比空气略小(只能用排水法收集N2)
(二)、氮气化学性质 1、 与金属的反应
(二) 、氮气的化学性质 1、 与金属的反应
3Mg+N2点=燃 Mg3N2
2、与非金属的反应
① 与H2的反应 催化剂
•
10、阅读一切好书如同和过去最杰出 的人谈 话。2021/8/42021/8/42021/8/48/4/2021 7:55:28 PM
•
11、越是没有本领的就越加自命不凡 。2021/8/42021/8/42021/8/4Aug-214-Aug-21
•
12、越是无能的人,越喜欢挑剔别人 的错儿 。2021/8/42021/8/42021/8/4Wednesday, August 04, 2021
N2+3H2 高温 高压 2NH3
人教版化学必修一4.3硫和氮的氧化物(共26张ppt)(共26张PPT)

二 提出实验计划,进行实验探究
氧
化
二氧化硫的化学性质实验报告
硫
的
总结二氧化硫的性质和作用
性
质
酸雨形成
教学过程 ——学
『探究1』从SO2的组成分析可推测,SO2属哪一类氧化 物?溶于水呈酸性还是碱性?
『探究2』在SO2分子中S的化合价是多少?由此推测, SO2是否具有氧化性、还原性?
分组实验探究内容
教学过程 ——学
(3)酸雨的防治措施主要有哪些?
脱 硫 新 技 术
教学过程
——学
(4)如何进行硫、二氧化硫的回收和利用?
目前我国每年从炼油回收硫约8万吨,从烟道气中
回收硫约9万吨,从黄铁矿中炼硫约10万吨,用于
制取硫酸。大大减少了SO2的 排放。
(1)石灰石——石膏法 亚硫酸钠法
(2)氨水法 (3)活性炭法 (4)亚硫酸钠法
增强学生的环境保护意识和健康意识。 培养学生辩证认识事物的两面性的哲学观点。
★重点
教材分析 ——教学重难点
二氧化硫的化学性质
★难点
酸雨的形成原因
学情分析
学生对二氧化硫的有关化学性质可能不了解, 但对有二氧化硫引起的一些现象却很熟悉,如酸雨对建 筑物的腐蚀、银耳的漂白等。可以由学生的生活经验产 生疑问,激发兴趣,导入学习。而且高中的学生具备了 一定的实验操作能力和观察分析能力。
——导
【图片导入】创设情境请同学们观看这两幅图片是在
不同的时间里拍摄的,酸雨使这塑雕像面部全非。
此图片摄于1908年
此图片摄于1968年
教学过程 ——思
思考实例 1、正常雨水的pH约为5.6而不是7,这是为什 么?
2、什么叫酸雨?你知道空气中哪些物质溶解 在雨水中会形成酸雨?
氧
化
二氧化硫的化学性质实验报告
硫
的
总结二氧化硫的性质和作用
性
质
酸雨形成
教学过程 ——学
『探究1』从SO2的组成分析可推测,SO2属哪一类氧化 物?溶于水呈酸性还是碱性?
『探究2』在SO2分子中S的化合价是多少?由此推测, SO2是否具有氧化性、还原性?
分组实验探究内容
教学过程 ——学
(3)酸雨的防治措施主要有哪些?
脱 硫 新 技 术
教学过程
——学
(4)如何进行硫、二氧化硫的回收和利用?
目前我国每年从炼油回收硫约8万吨,从烟道气中
回收硫约9万吨,从黄铁矿中炼硫约10万吨,用于
制取硫酸。大大减少了SO2的 排放。
(1)石灰石——石膏法 亚硫酸钠法
(2)氨水法 (3)活性炭法 (4)亚硫酸钠法
增强学生的环境保护意识和健康意识。 培养学生辩证认识事物的两面性的哲学观点。
★重点
教材分析 ——教学重难点
二氧化硫的化学性质
★难点
酸雨的形成原因
学情分析
学生对二氧化硫的有关化学性质可能不了解, 但对有二氧化硫引起的一些现象却很熟悉,如酸雨对建 筑物的腐蚀、银耳的漂白等。可以由学生的生活经验产 生疑问,激发兴趣,导入学习。而且高中的学生具备了 一定的实验操作能力和观察分析能力。
——导
【图片导入】创设情境请同学们观看这两幅图片是在
不同的时间里拍摄的,酸雨使这塑雕像面部全非。
此图片摄于1908年
此图片摄于1968年
教学过程 ——思
思考实例 1、正常雨水的pH约为5.6而不是7,这是为什 么?
2、什么叫酸雨?你知道空气中哪些物质溶解 在雨水中会形成酸雨?
【最新】人教版必修1 第4章第3节 硫和氮的氧化物(第1课时) 课件(36张).ppt

应
H2O
CO2 CO2+H2O H2CO3
Ca(OH)2+CO2=== CaCO3↓+ H2O
与盐的反 CaSO3+SO2+
应
H2O===Ca(HSO3)2
与碱性氧 化物的反
应
SO2+CaO===CaSO3
弱氧化性 SO2+2H2S===3S↓+2H2O
CaCO3+CO2+H2O=== Ca(HCO3)2
答案
2.硫的物理性质 (1)色态:黄 色晶体,质脆。 (2)溶解性:不溶 于水, 微溶
于酒精,易溶 于CS2。
答案
3.化学性质
相关视频
答案
(2)硫与金属反应规律 ①硫在一定条件下与大多数金属反应生成相应的硫化物。 ②硫与变价金属反应生成低价态金属硫化物。
二、硫的氧化物
1.二氧化硫(SO2) (1)物理性质
解析答案
2.判断下列有关SO2性质的叙述不正确的是________(填序号)。 (1)能使澄清石灰水变浑浊。 (2)能使湿润的蓝色石蕊试纸变红。 (3)能使品红溶液褪色。 (4)通入BaCl2溶液生成白色沉淀。 (5)通入足量的NaOH溶液中再加BaCl2溶液产生白色沉淀,该沉淀能溶于 盐酸。 (6)通入溴水中能使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀生成。 (7)1 mol二氧化硫与足量水反应生成1 mol亚硫酸。 (8)实验室制备SO2时,多余的SO2可用碱液吸收。
相关视频
解析答案
变式训练1 为了除去CO2气体中的SO2气体,下列仪器和药品组 合合理的是( A ) 仪器:①洗气瓶 ②干燥管 药品:③固态生石灰 ④苏打溶液 ⑤小苏打溶液 A.①⑤ B.②⑤ C.①③ D.①④
解析答案
常见漂白性物质及漂白原理
4.3硫和氮的氧化物课件(人教版必修1)
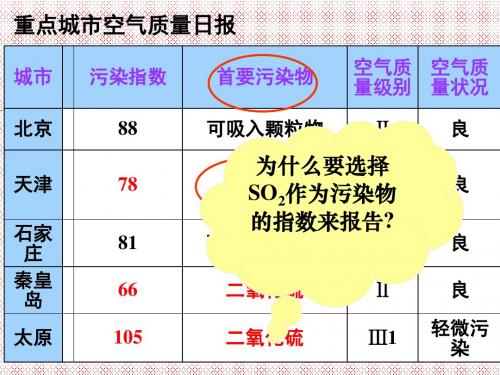
重点城市空气质量日报
城市 北京 天津 污染指数 88 78 首要污染物 可吸入颗粒物 空气质 空气质 量级别 量状况 Ⅱ 良 良
石家 庄 秦皇 岛
太原
81
66 105
可吸入颗粒物
二氧化硫 二氧化硫
为什么要选择 二氧化硫 Ⅱ SO2作为污染物 的指数来报告?
Ⅱ
Ⅱ Ⅲ1
良
良 轻微污 染
酸雨的危害:酸雨是如何形成的?
SO2的化学性质
推 测
SO2作为酸性氧化物应该有那些性质?
与H2O反应生成酸
酸性氧化物通性
与碱反应生成盐和水 与碱性氧化物反生成盐
练一练
请写出SO2与氧化钙、Ca(OH)2溶液反 应的化学方程式。
标出SO2中S元素的化合价推断它应具有怎样 的化学性质?
表现还原性, 需加入 氧化 剂来实现,
如
催化剂 2SO2+O2 ==== 2SO3 。 △
使湖泊中 鱼虾死亡
破坏露天文 物古迹
损坏植物叶面导 致森林死亡
腐蚀建筑物和 工业设备
市场采购: 有黄白两种银耳,买哪种好呢?
4.3 硫和氮的氧化物
二氧化硫
胡学英
认识硫单质
硫单质的物理性质
颜色:黄色晶体,质 脆,易研成粉末。
不 溶解性: __溶于水, 微溶 易 ___于酒精, __溶于 CS2.
中学阶段只 有品红
ቤተ መጻሕፍቲ ባይዱ
SO2和Cl2都能使品红溶液褪色,当在 相同条件下将等体积的SO2和Cl2通入 品红溶液中品红会褪色吗?
想一想
知识梳理
物质分类角度
物理性质 SO2 化学性质
氧化还原角度
酸性氧 化物 以还原性 为主
漂白性
城市 北京 天津 污染指数 88 78 首要污染物 可吸入颗粒物 空气质 空气质 量级别 量状况 Ⅱ 良 良
石家 庄 秦皇 岛
太原
81
66 105
可吸入颗粒物
二氧化硫 二氧化硫
为什么要选择 二氧化硫 Ⅱ SO2作为污染物 的指数来报告?
Ⅱ
Ⅱ Ⅲ1
良
良 轻微污 染
酸雨的危害:酸雨是如何形成的?
SO2的化学性质
推 测
SO2作为酸性氧化物应该有那些性质?
与H2O反应生成酸
酸性氧化物通性
与碱反应生成盐和水 与碱性氧化物反生成盐
练一练
请写出SO2与氧化钙、Ca(OH)2溶液反 应的化学方程式。
标出SO2中S元素的化合价推断它应具有怎样 的化学性质?
表现还原性, 需加入 氧化 剂来实现,
如
催化剂 2SO2+O2 ==== 2SO3 。 △
使湖泊中 鱼虾死亡
破坏露天文 物古迹
损坏植物叶面导 致森林死亡
腐蚀建筑物和 工业设备
市场采购: 有黄白两种银耳,买哪种好呢?
4.3 硫和氮的氧化物
二氧化硫
胡学英
认识硫单质
硫单质的物理性质
颜色:黄色晶体,质 脆,易研成粉末。
不 溶解性: __溶于水, 微溶 易 ___于酒精, __溶于 CS2.
中学阶段只 有品红
ቤተ መጻሕፍቲ ባይዱ
SO2和Cl2都能使品红溶液褪色,当在 相同条件下将等体积的SO2和Cl2通入 品红溶液中品红会褪色吗?
想一想
知识梳理
物质分类角度
物理性质 SO2 化学性质
氧化还原角度
酸性氧 化物 以还原性 为主
漂白性
人教版化学必修一4.3《硫和氮的氧化物(第一课时)硫及其氧化物》同步课件

二、二氧化硫的用途
⑴制造硫酸:
2SO2 + O2催化△剂 2SO3 SO3 + H2O = H2SO4
⑵可以漂白白纸浆、毛、丝、草
编制品等。
⑶杀灭霉菌和细菌。 ⑷作食物和干果的防腐剂。
小结
与水反应
与氧气反应
二
氧
与硫化氢反应
化
硫
与氯水反应
漂白性
用途
酸雨的形成
题号 1 2 3
展示同学
评价同学
题号 1 2 3
氯 橙 黄水 色 绿褪 色色
溴水褪色
例c如. :与与其K他M氧n化O剂4 反反应应使: KMnO4 溶液褪色 5SO2+2KMnO4+2H2O=K2SO4+2Mn
氯水和SO2都具有漂白作用,则 1molSO2通入含1molCl2的氯水中, 所得溶液的漂白作用加强吗? 不会:因为SO2+ Cl2+ 2H2O = H2SO4+ 2HCl
无色物质 氧化型
实质
氧化还原反应 (化学变化)
与色素结合
将有色物质
成不稳定的
的分子吸附
无色物质加和型 在其吸表附面型
非氧化还原反 物理吸附 应(化学变化) (物理变化)
效果 永久性(不可逆) 暂时性(可逆) 暂时性
可漂白大多数有色物 可漂白某些有色 可吸附某些
范围 质,能使紫色石蕊褪 物质,不能使石 有色物质的
色
蕊试液褪色
分子
3、化学性质
(1) SO2是亚硫酸(H2SO3)的酸酐,属于酸性氧化 物,具有酸性氧化物的通性。
①与水化合生成H2SO3:
可逆反应 在相同条件下,既能向正反应方向进行,同时又能
人教版高中化学必修1课件:4.3硫和氮的氧化物(第1课时) (共28张PPT)

学习知识的能力 (学习新知识 速度、质量等)
长久坚持的能力 (自律性等)
什么是学习力-常见错误学习方式
案例式 学习
顺序式 学习
冲刺式 学习
什么是学习力-高效学习必备习惯
积极 主动
以终 为始
分清 主次
不断 更新
高效学习模型
高效学习模型-学习的完整过程
方向
资料
筛选
认知
高效学习模型-学习的完整过程
如何利用规律实现更好记忆 呢?
超级记忆法-记忆规律
记忆后
选择巩固记忆的时间 艾宾浩斯遗忘曲线
超级记忆法-记忆规律
TIP1:我们可以选择巩固记忆的时间! TIP2:人的记忆周期分为短期记忆和长期记忆两种。 第一个记忆周期是 5分钟 第二个记忆周期是30分钟 第三个记忆周期是12小时 这三个记忆周期属于短期记忆的范畴。
草编制品等
⑶杀灭霉菌和细菌
⑷作食物和干果的防腐剂
一、二氧化硫和三氧化硫
一、物理性质
无色、有刺激性气味、有毒、易液化、比空气重、 易溶于水
二、化学性质
1、与水反应生成酸
SO2 + H2O
H2SO3
2、与碱反应生成盐和水
SO2 + 2NaOH==Na2SO3 + H2O 3、既有氧化性,又有还原性
2SO2 + O2 4、漂白性:
某些蛋白质的组成中 含有硫,这也正是因 为石油、天然气、煤 等化石燃料中经常含 硫的原因。
一、二氧化硫和三氧化硫
硫的物理性质: 淡黄色晶体(俗称硫磺)
质脆,容易研成粉末。 不溶于水,微溶于酒精,易溶 于二硫化碳。 熔沸点低(112.8℃, 444.6 ℃)
一、二氧化硫和三氧化硫
长久坚持的能力 (自律性等)
什么是学习力-常见错误学习方式
案例式 学习
顺序式 学习
冲刺式 学习
什么是学习力-高效学习必备习惯
积极 主动
以终 为始
分清 主次
不断 更新
高效学习模型
高效学习模型-学习的完整过程
方向
资料
筛选
认知
高效学习模型-学习的完整过程
如何利用规律实现更好记忆 呢?
超级记忆法-记忆规律
记忆后
选择巩固记忆的时间 艾宾浩斯遗忘曲线
超级记忆法-记忆规律
TIP1:我们可以选择巩固记忆的时间! TIP2:人的记忆周期分为短期记忆和长期记忆两种。 第一个记忆周期是 5分钟 第二个记忆周期是30分钟 第三个记忆周期是12小时 这三个记忆周期属于短期记忆的范畴。
草编制品等
⑶杀灭霉菌和细菌
⑷作食物和干果的防腐剂
一、二氧化硫和三氧化硫
一、物理性质
无色、有刺激性气味、有毒、易液化、比空气重、 易溶于水
二、化学性质
1、与水反应生成酸
SO2 + H2O
H2SO3
2、与碱反应生成盐和水
SO2 + 2NaOH==Na2SO3 + H2O 3、既有氧化性,又有还原性
2SO2 + O2 4、漂白性:
某些蛋白质的组成中 含有硫,这也正是因 为石油、天然气、煤 等化石燃料中经常含 硫的原因。
一、二氧化硫和三氧化硫
硫的物理性质: 淡黄色晶体(俗称硫磺)
质脆,容易研成粉末。 不溶于水,微溶于酒精,易溶 于二硫化碳。 熔沸点低(112.8℃, 444.6 ℃)
一、二氧化硫和三氧化硫
(精品)化学1必修4.3《硫和氮的氧化物》教学课件

2)、NO2的化学性质:
+4
+5
3NO2 + H2O = 2HNO3 + NO(工业制硝酸的第三步)
科 学 自行设计实验:尽可能多的使NO2被水溶解
探
究 填写课本P92页如下表内容
实验步骤
现象
解释
(1)
(2)
……
NO2 和 O2 混和气体溶于水的反应
3NO2 + H2O = 2HNO3 + NO ① ① ×2 + ② 2NO + O2 = 2NO2 ② 总反应:4NO2 + O2 + 2H2O = 4HNO3
硫粉的试管中分 别加入蒸馏水、 酒精。
俗称:硫磺 淡黄色晶体 质脆,容易研成粉末。 不溶于水,微溶于酒精, 易溶于二硫化碳。
密度比水大(约为2 g/cm3 ) 熔沸点低(112.8℃, 444.6 ℃)
硫的氧化物
(3)硫的化学性质
0
点燃 +4
S + O2 = SO2 硫作为还原剂,具有还原性。
现 有刺激性气味的气体生成。 象 硫在空气中安静地燃烧,发出淡蓝色火焰;
82
二氧化硫
广州 2007-12-14
62
可吸入颗粒物
柳州 2007-12-14
103
二氧化硫
Ⅱ Ⅱ Ⅱ Ⅲ1
良 良 良 轻微污染
云浮 2007-12-14
80
可吸入颗粒物
Ⅱ
良
为什么要选择SO2等作为首要污染物呢?它们是
从哪儿来的?具有什么样的性质呢?
思考
二氧化硫对环境的污染
硫的氧化物
二氧化硫和三氧化硫
一辆迎面驶来大货车相撞后翻倒在地,槽罐 车上约32吨液态氯气快速泄漏。事故发生后,
人教版高中化学必修一4.3 硫和氮的氧化物 课件 (共73张PPT)

硫和氮的氧化物
一、硫元素的存在形式
(1)游离态:单质硫存在于火山口附近或 地壳的岩石 (2)化合态——硫化物和硫酸盐: 硫铁矿 FeS2 黄铜矿 CuFeS2 石膏 CaSO4.2H2O 芒硝 Na2SO4.10H2O (3)硫是一种生命元素,组成某些蛋白质时
不可离开它。因此化石燃料中经常含有硫元素。
SO2漂白原理:由于它能与某些有色物质 反应生成不稳定的无色物质。无色物质 容易分解而使有色物质恢复原来的颜色。 注意:可用品红溶液来检验SO2的存在
漂白性物质的对比
名称
二氧化硫
与某些有色物质直 接结合生成不稳定 的无色物质 非氧化还原反应 可逆 漂白某些有色物质,不 能使紫色石蕊试液褪色
氯 水(Na2O2 H2O2 O3、HClO)
将色素氧化 为稳定的无色物质 氧化还原反应 不可逆 漂白大多数有色物质, 能使紫色石蕊试液褪色
原理 实质 程度 范围
活性炭也有一定的漂白性,该物质的漂白原理?
SO2漂白性的应用
SO2常被用来漂白纸浆、草帽、衣物、毛、丝
不良商家用SO2漂白食物
SO2有毒,对人体的肝/肾脏有严重损害, 且有致癌作用。
总结SO2的化学性质
1、酸性氧化物 2、漂白性(并不能漂白所有物质) 检验SO2:品红溶液 3、SO2的氧化性和还原性 还原性:能使紫色的高锰酸钾溶液、氯水褪色 氧化性:能和氢硫酸反应产生黄色沉淀 (一般可用高锰酸钾溶液、氢氧化钠溶液来吸收 SO2)
思考:
1.SO2可以使品红溶液、氯水、高锰 酸钾溶液褪色,原理相同吗?
拓展与应用:
问题:报纸放久了为什么会发黄?
提示:从SO2漂白特
点的角度解释
二氧化硫除具有酸性氧化物的性质 外,还会有哪些性质?
一、硫元素的存在形式
(1)游离态:单质硫存在于火山口附近或 地壳的岩石 (2)化合态——硫化物和硫酸盐: 硫铁矿 FeS2 黄铜矿 CuFeS2 石膏 CaSO4.2H2O 芒硝 Na2SO4.10H2O (3)硫是一种生命元素,组成某些蛋白质时
不可离开它。因此化石燃料中经常含有硫元素。
SO2漂白原理:由于它能与某些有色物质 反应生成不稳定的无色物质。无色物质 容易分解而使有色物质恢复原来的颜色。 注意:可用品红溶液来检验SO2的存在
漂白性物质的对比
名称
二氧化硫
与某些有色物质直 接结合生成不稳定 的无色物质 非氧化还原反应 可逆 漂白某些有色物质,不 能使紫色石蕊试液褪色
氯 水(Na2O2 H2O2 O3、HClO)
将色素氧化 为稳定的无色物质 氧化还原反应 不可逆 漂白大多数有色物质, 能使紫色石蕊试液褪色
原理 实质 程度 范围
活性炭也有一定的漂白性,该物质的漂白原理?
SO2漂白性的应用
SO2常被用来漂白纸浆、草帽、衣物、毛、丝
不良商家用SO2漂白食物
SO2有毒,对人体的肝/肾脏有严重损害, 且有致癌作用。
总结SO2的化学性质
1、酸性氧化物 2、漂白性(并不能漂白所有物质) 检验SO2:品红溶液 3、SO2的氧化性和还原性 还原性:能使紫色的高锰酸钾溶液、氯水褪色 氧化性:能和氢硫酸反应产生黄色沉淀 (一般可用高锰酸钾溶液、氢氧化钠溶液来吸收 SO2)
思考:
1.SO2可以使品红溶液、氯水、高锰 酸钾溶液褪色,原理相同吗?
拓展与应用:
问题:报纸放久了为什么会发黄?
提示:从SO2漂白特
点的角度解释
二氧化硫除具有酸性氧化物的性质 外,还会有哪些性质?
高中化学人教版必修一《4.3硫和氮的氧化物(第1课时).》课件

一、硫( sulphur)
1、硫的物理性质:
淡黄色晶体(俗称硫磺) 质脆,容易研成粉末。 不溶于水,微溶于酒精,易溶于 二硫化碳。 熔沸点低(112.8℃, 444.6 ℃)
2、硫的化学性质:
它能氧化某些非金属单质 S +O2 =点=燃 SO2 硫在空气中燃烧,发出微弱 的淡蓝色火焰,在氧气燃烧 ,明亮的蓝紫色火焰。
硫还是一种生命元素,组成某些蛋 白质离不开它
蛋白质中的硫:蛋黄内含硫,如果煮鸡蛋的 时间过长,硫会转移到蛋黄的边缘,形成灰 色的细环。硫是增强人们体质的蛋白质中至 关重要的一部分。蛋白质分解后会产生硫化 氢,有臭蛋味的有毒气体。
硫还是一种生命元素,组成某些蛋白质离 不开它,石油、天然气、煤等化石燃料中经 常含硫的原因。
除钠、钾、铵盐外, 其余大多难溶于水, 这一点与碳酸盐极为相似。
SO2 中的S化合价是+4价:
-2
S
←→
0
S
←→
+4
S
←→
+6
S
“高价氧化,低价还 ,中间价态两边转” ∴ SO2既有氧化性,又有还原性。
2.还原性
催化剂
2SO2 + O2 加==热==2SO3+4被氧化 +6
SO3 + H2O==H2SO4 S
思考
实验室制SO2气体,应注意什1么?该如何收集? 实验室制SO2应注意防止空气污染! 用向上排空气法收集。
(二).二氧化硫的化学性质:
1、具有酸性氧化物的通性
⑴与水的反应: 【实验】: SO2溶于水
【现象】: ①紫色石蕊试液变成红色; ②液体沿试管内壁上升。
实验:二氧化硫与品红溶液的作用
人教版化学必修一4.3硫和氮的氧化物1优质课件PPT

溶解性:不溶于水,
微溶于酒精,
易溶于二硫化碳。
密度:比水大(约为2 g/cm3 )
熔沸点:低(112.8℃, 444.6 ℃)
3.化学性质:既有氧化性又有还原性!
△
S+Fe=FeS
△
2Cu+S=Cu2S
点燃
S+O2==SO2 (工业制硫酸的第一步)
点燃 +4
S + O2 = SO2 现象: 硫在空气中安静地燃烧, 发出淡蓝色的火焰;硫在纯氧 中发出蓝紫色地火焰。有刺激 性气味的气体生成。
划火柴时常闻到的一股呛鼻的气味,就是 火柴头成份中的硫燃烧后产生的二氧化硫。
(二)二氧化硫 1.物理性质
颜无色色状气态体 刺激性气味气味 密度比空气大 密度
SO2
有毒毒性 沸易点液化
易水溶于性水
硫的氧化物
思考
• 根推据测物其质可的能分有类的和性质SO?2中其硫性元质素类的似化哪合个价氧, 化物?
的无色物质
实 质 氧化还原反应
非氧化还原反应
效果
永久性
暂时性
范围
可漂白大多数有色物 漂白某些有色物质,不
质,能使紫色石蕊试 能使紫色石蕊试液褪色
液先变红后褪色
(石蕊变红)
漂白性物质小结
氧化作用
化合作用 吸附作用
活性炭 SO2
化学变化
化学变化 物理变化
永久漂白
暂时漂白 永久漂白
漂白性物质小结
氧化作用
硫和氮的氧化物
硫的化合物
2010年01月31日 环保网发布的空气质量日报 (部分)
监测点位
空气污染指数(API)
质量描述
二氧化硫 二氧化氮 可吸入颗粒物
化学必修一第四章第三节 硫和氮的氧化物(第一课时)(课件)优秀课件

通入SO2 褪色 加热煮沸 又变红色
褪色
不显红色
通入Cl2
加热煮沸
紫色石蕊溶液
通入SO2 很快变红,但不褪色 立即变红,随后褪色
通入Cl2
3)SO2的氧化性 ----与H2S发生反应
SO2 + 2 H2S = 3 S ↓ + 2 H2O
4)SO2的还原性
催化剂
a. 与O2的反应: 2SO2 + O2 ⇌△ 2SO3
花,水中月,虽然赏心悦目,却非永恒。不如开开心心,坦坦荡荡,不让自己在悲伤中度过,别让自己在徘徊中漫步,随缘起止,生活以开心 为准则。人生一世,其实活在一回心境。
5 、人往往是失去之后才懂得珍惜,可是为时已晚,即使是哭干眼泪也换不回曾经的拥有。多少人都是这样的感叹:拥有时不知道珍惜,失去 时已无可挽回。
氧 化
SO3 + H2O = H2SO4
硫 ⑵可以漂白白纸浆、毛、丝、
的
草编制品等
用
途 ⑶杀灭霉菌和细菌
⑷作食物和干果的防腐剂
思考与交流: SO2与CO2如何鉴别?
品红溶液
稀硝酸
KMnO4溶液 溴水
酸化的硝酸钡 溶液
SO2 CO2 SO2 CO2 SO2 CO2 SO2 CO2 SO2
CO2
品红溶液褪色 无明显现象
(1)物理性质:俗名_硫__黄___,黄色晶体,质脆,易研成
粉末,_不___溶于水,微溶于_酒__精__,易溶于_二__硫__化__碳__。
(2)化学性质:硫在空气中燃烧生成_二__氧__化__硫__。
硫
是
点燃
黄
化学方程式为:S+O2===SO2
色
粉
末
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
可以用它来干燥SO2
2SO2 + O2 == 2SO3
3.三氧化硫——针状晶体
在上面提到的关于SO2的还原性当中,设计 到了另一种酸性氧化物——SO3。它溶于水 生成硫酸,工业上利用这一原理生产硫酸, 化学方程式表示如下: SO3+H2O=H2SO4 SO3与碱性氧化物或碱反应时生成硫酸盐: SO3+CaO=CaSO4 SO3+Ca(OH)2=CaSO4+H2O
硫粉
点燃
SO2
2.二氧化硫
思考1:SO2的物理性质体现在哪些方面?
气体的物理性质可从以下几个等方面去分析: (颜色、状态、气味、毒性、密度、溶解性等) 探究1:请设计一个实验来证明SO2是否易 溶于水? 实验4-7 二氧化硫溶于水
【P84实验4-7:观察并思考】 1、 实验中原盛有SO2 气体的试管水位有什么变 化?说明了什么? ------试管内水位上升;说明SO2易溶水 2、用pH试纸检验试管内水溶液酸碱性。 -------试纸变红色,溶液呈酸性
思考与交流: SO2能使溴水、KMnO4溶液褪 色与SO2使品红褪色,实质相同吗? 小结: 不同。前者缘于SO2的还原性,发 生的是氧化还原反应。后者缘于其漂 白性,发生的是非氧化质
看颜色 闻气味 想原因 做比较 沸 点
无色气体
强烈的刺激性气味
能引发呼吸道疾病、浓度 有 毒 高时会令人死亡 和空气的相对平均分子量对 比空气密度大 比
沸点为-100C
容易液化
溶解性
1体积的水大约可以溶解 40体积的二氧化硫 易溶于水
二氧化硫是一种无色、有刺激性气味、有毒、比 空气重、容易液化、易溶于水的气体。
原理: 二氧化硫与某些有色物质直接生 成不稳定的无色物质 实质: 化合作用 程度: 暂时性,加热可复原
范围: 漂白某些有色物质,不能使紫色石 蕊试液褪色
品红 溶液 SO2与品红 的混合溶液
SO2的 水溶液
①
②
北京市场黄白两种银耳对比 中央电视台《生活》栏目
思考2:请同学们标出SO2中S元素的化合价, 根据SO2中S元素的化合价推断它应具有怎 样的化学性质?
二 氧 SO2与水的反应: 亚硫酸酐 化 H2SO3(亚硫酸) 硫 SO2 + H2O (可逆号) 的 化 可逆反应:在同一条件下既能向正反应 学 方向进行,又能向逆反应方向进行的反应。 性 质 特 正反应和逆反应均不彻底 点 反应物和生成物共存。
(1)SO2具有酸性氧化物通性
请同学们写出SO2与Na2O、NaOH溶液、 Ca(OH)2溶液的反应方程式。 (2)具有漂白性(特性)
-2
S
0
氧化性
+4
S(SO2)
加 还 原 剂
+6
还原性
加 氧 化 剂
S
S
如H2S等
如O2、Cl2、Br2、 KMnO4、HNO3等
(3)既有氧化性,又有还原性
探究2:怎样设计一个实验来证明SO2 具有还原性? SO2 + Br2 + 2 H2O = H2SO4 + 2HBr
★但不能被浓H2SO4氧化,因此
第四章 非金属及其化合物 第三节 硫和氮的氧化物
(第一课时)
同学们:每天,当你阅读报纸、收 听广播或收看电视节目时,经常可以 获得关于空气质量的信息。空气质量 报告各项指标中,有二氧化硫和二氧 化氮的指数?二氧化硫和二氧化氮是 什么?它们是从哪儿来的?空气中有 多种物质,为什么要选择这两种污染 物的指数来报告?它们有什么危害?
思 考
1.硫(存在… … )
(1)物理性质
黄色晶体,质脆。不溶于水,微溶于酒 精,易溶于二硫化碳。
(2)化学性质
点燃
S + O2 == SO2
S + Fe == FeS
△
硫的氧化物
1. SO2的来源
天然: 火山爆发、森林火灾、有机体分解、 海洋雾沫等。 人为: 化石燃料的燃烧、工业尾气等。
S+O2
2007年01月31日 广州环保网发布的空气质量日报 (部分)
监测点位
西村 黄埔大沙 花都新华
空气污染指数(API) 二氧化硫 二氧化氮 可吸入颗粒物 101 101 100 176 159 94 210 136 119
质量描述
中度污染 轻度污染 轻微污染
二氧化硫和二氧化氮是什么?你们对它们有 什么样的印象?
2SO2 + O2 == 2SO3
3.三氧化硫——针状晶体
在上面提到的关于SO2的还原性当中,设计 到了另一种酸性氧化物——SO3。它溶于水 生成硫酸,工业上利用这一原理生产硫酸, 化学方程式表示如下: SO3+H2O=H2SO4 SO3与碱性氧化物或碱反应时生成硫酸盐: SO3+CaO=CaSO4 SO3+Ca(OH)2=CaSO4+H2O
硫粉
点燃
SO2
2.二氧化硫
思考1:SO2的物理性质体现在哪些方面?
气体的物理性质可从以下几个等方面去分析: (颜色、状态、气味、毒性、密度、溶解性等) 探究1:请设计一个实验来证明SO2是否易 溶于水? 实验4-7 二氧化硫溶于水
【P84实验4-7:观察并思考】 1、 实验中原盛有SO2 气体的试管水位有什么变 化?说明了什么? ------试管内水位上升;说明SO2易溶水 2、用pH试纸检验试管内水溶液酸碱性。 -------试纸变红色,溶液呈酸性
思考与交流: SO2能使溴水、KMnO4溶液褪 色与SO2使品红褪色,实质相同吗? 小结: 不同。前者缘于SO2的还原性,发 生的是氧化还原反应。后者缘于其漂 白性,发生的是非氧化质
看颜色 闻气味 想原因 做比较 沸 点
无色气体
强烈的刺激性气味
能引发呼吸道疾病、浓度 有 毒 高时会令人死亡 和空气的相对平均分子量对 比空气密度大 比
沸点为-100C
容易液化
溶解性
1体积的水大约可以溶解 40体积的二氧化硫 易溶于水
二氧化硫是一种无色、有刺激性气味、有毒、比 空气重、容易液化、易溶于水的气体。
原理: 二氧化硫与某些有色物质直接生 成不稳定的无色物质 实质: 化合作用 程度: 暂时性,加热可复原
范围: 漂白某些有色物质,不能使紫色石 蕊试液褪色
品红 溶液 SO2与品红 的混合溶液
SO2的 水溶液
①
②
北京市场黄白两种银耳对比 中央电视台《生活》栏目
思考2:请同学们标出SO2中S元素的化合价, 根据SO2中S元素的化合价推断它应具有怎 样的化学性质?
二 氧 SO2与水的反应: 亚硫酸酐 化 H2SO3(亚硫酸) 硫 SO2 + H2O (可逆号) 的 化 可逆反应:在同一条件下既能向正反应 学 方向进行,又能向逆反应方向进行的反应。 性 质 特 正反应和逆反应均不彻底 点 反应物和生成物共存。
(1)SO2具有酸性氧化物通性
请同学们写出SO2与Na2O、NaOH溶液、 Ca(OH)2溶液的反应方程式。 (2)具有漂白性(特性)
-2
S
0
氧化性
+4
S(SO2)
加 还 原 剂
+6
还原性
加 氧 化 剂
S
S
如H2S等
如O2、Cl2、Br2、 KMnO4、HNO3等
(3)既有氧化性,又有还原性
探究2:怎样设计一个实验来证明SO2 具有还原性? SO2 + Br2 + 2 H2O = H2SO4 + 2HBr
★但不能被浓H2SO4氧化,因此
第四章 非金属及其化合物 第三节 硫和氮的氧化物
(第一课时)
同学们:每天,当你阅读报纸、收 听广播或收看电视节目时,经常可以 获得关于空气质量的信息。空气质量 报告各项指标中,有二氧化硫和二氧 化氮的指数?二氧化硫和二氧化氮是 什么?它们是从哪儿来的?空气中有 多种物质,为什么要选择这两种污染 物的指数来报告?它们有什么危害?
思 考
1.硫(存在… … )
(1)物理性质
黄色晶体,质脆。不溶于水,微溶于酒 精,易溶于二硫化碳。
(2)化学性质
点燃
S + O2 == SO2
S + Fe == FeS
△
硫的氧化物
1. SO2的来源
天然: 火山爆发、森林火灾、有机体分解、 海洋雾沫等。 人为: 化石燃料的燃烧、工业尾气等。
S+O2
2007年01月31日 广州环保网发布的空气质量日报 (部分)
监测点位
西村 黄埔大沙 花都新华
空气污染指数(API) 二氧化硫 二氧化氮 可吸入颗粒物 101 101 100 176 159 94 210 136 119
质量描述
中度污染 轻度污染 轻微污染
二氧化硫和二氧化氮是什么?你们对它们有 什么样的印象?
