17α—羟孕酮测定试剂盒(化学发光免疫分析法)产品技术要求mairui
CFDA-20171031 孕酮检测试剂(化学发光免疫分析法)注册技术审查指导原则(征求意见稿)(20171031)

附件2孕酮检测试剂(化学发光免疫分析法)注册审查技术指导原则(征求意见稿)2017年7月本指导原则旨在指导注册申请人对孕酮测定试剂盒(化学发光免疫分析法)注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本指导原则是对孕酮测定试剂盒(化学发光免疫分析法)的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供申请人和审查人员使用的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围从方法学考虑,在本文中孕酮测定试剂是指采用化学发光免疫分析技术,以竞争法为基本原理,利用全自动、半自动化学发光免疫分析仪,在医学实验室对人体样本中孕酮的含量进行体外定量分析的试剂,临床上主要用于先兆流产的辅助诊断。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号),孕酮测定试剂盒管理类别为Ⅱ类,分类代号为6840。
本指导原则不适用于:(一)单独申请注册的孕酮校准品和质控品。
(二)化学发光免疫分析法原理之外的其他孕酮测定试剂盒。
二、注册申报材料要求(一)综述资料综述资料主要包括产品预期用途、产品描述、生物安全性方面的说明、产品主要研究结果的总结和评价以及同类产品上市情况介绍等内容,应符合《体外诊断试剂注册管理办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)的相关要求,下面着重介绍与孕酮测定试剂预期用途有关的临床背景情况及检测方法学。
化学发光免疫类体外诊断试剂(盒)产品技术审评要求规范(2017版)1204(可编辑修改word版)

化学发光免疫类体外诊断试剂(盒)产品技术审评规范(2017 版)本规范旨在指导注册申请人对化学发光免疫类体外诊断试剂(盒)产品注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本规范是对化学发光免疫类体外诊断试剂(盒)产品的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围本规范适用于利用化学发光免疫分析技术对被测物质进行定量检测的第二类体外诊断试剂(包括以微孔板、管、磁颗粒、微珠和塑料珠等为载体的酶促及非酶促化学发光免疫分析测定试剂)的注册技术审查。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第 5 号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242 号)化学发光免疫类体外诊断试剂(盒)产品分类代号为 6840。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告 2014 年第44 号)的相关要求。
(二)主要原材料研究资料(如需提供)主要原材料(例如各种天然抗原、重组抗原、单克隆抗体、多克隆抗体以及多肽类、激素类等生物原科,辣根过氧化物酶、碱性磷酸酶等标记用酶、磁微粒及其他主要原料)的选择、制备、质量标准及实验验证研究资料;校准品、质控品的原料选择、制备、赋值过程及试验资料;校准品的溯源性文件,包括具体溯源链、实验方法、数据及统计分析等详细资料。
促肾上腺皮质激素(ACTH)测定试剂盒(化学发光免疫分析法)产品技术要求mairui

2性能指标
2.1外观
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;Ra 组分应为棕色含固体微粒的液体,无板结、无絮状物。
Rb 组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
2.2装量
应不少于试剂瓶的标示装量值。
2.3准确度
对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10% 范围内。
2.4最低检测限
应不大于1 pg/mL。
2.5线性
试剂盒在1 pg/mL~2000 pg/mL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性
变异系数CV 应≤ 6%。
2.7批间差
变异系数CV 应≤ 10%。
醛固酮(ALD)测定试剂盒(化学发光免疫分析法)产品技术要求mairui

1 性能指标
2.1外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;
Ra:应为棕色含固体微粒的液体,无板结、无絮状物。
Rb:应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
Rc:应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
2.2装量
应不少于试剂瓶的标示装量值。
2.3准确度
对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10%范围内,其中正确度控制品为企业自制。
2.4最低检测限
应不大于14.5 pg/mL。
2.5线性
试剂盒在14.5 pg/mL~2000 pg/mL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性
变异系数CV 应≤ 8%。
2.7批间差
变异系数CV 应≤ 10%。
多项免疫复合定值质控品产品技术要求mairui

性能指标
2.1外观和性状
2.1.1颜色性状
质控品应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
2.1.2包装
分装瓶应为透明塑料管,应盖有塑料外盖;盒贴、瓶贴、标签标识、说明书、参考值表应完整、清晰牢固。
塑料外盖与塑料管身配合后应无渗漏;塑料外盖应无明显划痕、崩缺。
2.2装量
每瓶质控品容量应不少于2.0 mL。
2.3测量准确度
2.3.1质控参考值表
质控品应可提供一份参考值表,包含适用型号的迈瑞化学发光免疫分析系统
的检测项目参考值及参考范围。
2.3.2赋值准确性
经校准的迈瑞全自动化学发光免疫分析仪检测质控品所包含的检测项目,结果应在参考范围内(不同批次的质控品参考范围参见参考值表)。
2.4均一性
2.4.1瓶内均一性
质控品瓶内均一性应满足变异系数CV≤8.0%。
2.4.2瓶间均一性
质控品瓶间均一性应满足变异系数CV≤5.0%。
2.5生物安全性
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂
灵敏度的检测试剂,对质控品中乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体(HIV-I型和HIV-II型)、丙型肝炎病毒抗体、梅毒螺旋体抗体的检测应为阴性。
1。
孕酮(P)测定试剂盒(化学发光免疫分析法) 产品技术要求--性能指标

孕酮测定试剂盒(化学发光免疫分析法)1.性能指标2.1 试剂性能指标2.1.1外观和物理检查试剂盒应组分齐全,内外包装均应完整,标签清晰,液体试剂无渗漏。
其中:酶标记物应为清澈均匀的液体,无沉淀,无絮状物;磁微粒应无板结,液体内无絮状物,无异物;2.1.2装量试剂盒各组分装量应不少于标示量。
2.1.3 检出限检出限应不高于0.48nmol/L;空白限应不高于0.32nmol/L。
2.1.4 准确度相对偏差应在±10%范围内。
2.1.5 线性范围在[0.48,127] nmol/L,相关系数r应不小于0.99002.1.6 重复性使用同一批试剂盒测试浓度[2,14]nmol/L和[46,85]nmol/L的样品,其测试结果的变异系数(CV)应不大于8.0 %。
2.1.7 批间差用三批试剂盒测试浓度[2,14]nmol/L和[46,85]nmol/L的样品,其测试结果的变异系数(CV)应不大于15.0 %。
2.1.8 质控品测定值测试试剂盒内高低值质控品,其测定结果应均在质控品靶值范围内。
2.1.9 特异性分别添加潜在干扰物于含有孕酮的样本中,获得待测样本中孕酮目标浓度为64nmol/L(允许相对偏差为±15%),干扰物浓度如下,各个样本测量结果的均值应在M±2SD范围内。
(M为目标浓度平均值,SD为标准差)干扰物配制浓度分别为11-去氧皮质酮600ng/mL、孕烯醇酮200ng/ mL、皮质酮1000ng/mL、17a-羟基孕酮50ng/ mL、17β-雌二醇10ng/ mL、雌酮为0.1ug/mL、雌三醇10ng/ mL、醛甾酮50ng/ mL、丹那挫100 ng/ mL、11-脱氧皮质醇100 ng/ mL、强的松龙200ng/ mL、皮质醇为1ug/mL、睾酮为1μg/mL、克罗米酚为25μg/mL、保泰松为25μg/mL2.2校准品性能指标2.2.1外观和性状校准品应为澄清液体,无肉眼可见杂质。
人生长激素测定试剂盒(化学发光免疫分析法)产品技术要求mairui

1 性能指标2.1外观和性状试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;Ra 组分应为棕色含固体微粒的液体,无板结、无絮状物。
Rb 组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物;校准品应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
分装瓶应为透明塑料管,盖有塑料外盖。
2.2装量应不少于试剂的标示装量值。
2.3准确度2.3.1将hGH 国家标准品配成两个浓度水平的样品,用待检试剂盒进行检测,其检测结果与标定靶值的相对偏差在±10%范围内。
2.3.2对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10%范围内。
2.4最低检测限应不大于0.02 ng/mL。
2.5线性试剂盒在0.03 ng/mL~50 ng/mL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性变异系数CV 应≤ 5%。
2.7批间差变异系数CV 应≤ 10%。
2.8校准品均一性2.8.1校准品瓶内均一性C0的标准差(SD)应不大于0.024ng/mL,C1和C2的变异系数(CV)应不大于8.0%。
2.8.2校准品瓶间均一性C0 的标准差(SD)应不大于0.02 ng/mL,C1 和C2 的变异系数(CV)应不大于5.0%。
2.9生物安全性使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂,对校准品中乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体(HIV-I 型和HIV-II1型)、丙型肝炎病毒抗体、梅毒螺旋体抗体的检测应为阴性。
2.10稳定性2~8℃避光保存,试剂盒有效期为365 天。
到有效期后90 天内的试剂盒应符合2.1、2.3、2.4、2.5、2.6、2.8 的要求。
2。
孕酮测定试剂盒(磁微粒化学发光法)产品技术要求北京美联泰科

孕酮测定试剂盒(磁微粒化学发光法)适用范围:本试剂盒用于体外定量测定人体血清或血浆中的孕酮(P)含量。
1.1包装规格10人份/盒;40人份/盒;60人份/盒。
1.2主要组成成分试剂盒由检测试剂条、质控品(两水平)、校准品(两水平)组成。
2.1外观试剂盒组分应齐全、完整;检测试剂条应无漏液、无破损、无污染;中文包装标签应清晰,易识别。
2.2 校准品溯源性根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品溯源至本公司的工作校准品。
2.3准确度将已知浓度的孕酮(P)加入到低值样品中,其回收率应在85%~115%范围内。
2.4检出限应≤0.64nmol/L (0.2ng/mL)。
2.5线性范围在[0.64-127.20]nmol/L([0.2,40]ng/mL)的线性范围内,相关系数r 应≥0.9900。
2.6重复性CV≤10%。
2.7批间差CV≤15%。
2.8质控品赋值有效性测定值在质控品质控范围内。
2.9 特异性分别添加潜在干扰物于含有孕酮的样本中,获得待测样本中孕酮目标浓度为64nmol/L (20.1ng/mL)(允许相对偏差为±15%),潜在干扰物浓度分别为10ng/mL的皮质酮和10ng/mL的17α-羟孕酮。
各个样本测量结果的均值应在目标浓度平均值(M)±2标准差(SD)范围内。
2.10校准品和质控品瓶间差校准品瓶间差CV≤10%。
质控品瓶间差CV≤10%。
2.11稳定性2.11.1效期稳定性取效期后的试剂盒检测外观、准确度、检出限、线性范围、重复性、质控品赋值有效性和特异性,应符合2.1、2.3、2.4、2.5、2.6、2.8和2.9的要求。
2.11.2 质控品开瓶稳定性质控品开瓶后,在2℃~8℃密封避光保存,在7天后检测质控品重复性和质控品赋值有效性,应符合2.6和2.8的要求。
孕酮定量检测试剂盒 说明书

5. 所有试剂应视为有潜在的生物危害。实验结束后,所用的物品应采用高压、过氧乙酸或 84 液等侵泡处理。 参考文献 1. Filicori M, Butler JP, Crowley WF Jr.黄体神经内分泌调节,《临床调查》73:1638 1984. 2. Katt JA, Duncan JA, Herbon L 等,促性腺分泌激素的频率决定垂体促性腺分泌激素受体的数量, 《内分泌学》1985; 116:2113. 3. Csapo AI, Pulkkinen MO, Wiest WG:早孕患者切除黄体和孕酮补偿疗法的影响,《妇产科》, 115:759, 1973. 4. 托马斯分娩和诊断 生产企业 企业名称:德国 DRG 诊断设备有限公司 地址:德国 玛堡市斐恩贝塔思路 18 号 邮政编码:35069 电话:49(6421)17000 传真:49(6421)170050 网址:www.drg-diagnostics.de 售后服务单位名称:北京协和洛克生物技术研究开发中心 地址:北京市海淀区恩济庄 18 号院 4-2-302 邮政编码:100036 电话:010-51295656 传真:010-88140690 网址: 医疗器械生产许可证编号 京药管械生产许 20040085 号 医疗器械注册证书编号
复冻融。
3. 含叠氮纳化物不能用于酶反应。
检验方法
1. 实验前所有的试剂、样本和微孔板条达到室温(18~25°C)。
2. 洗液与双蒸水按照 1/40 的比例稀释,稀释后的洗液在室温可保存 2 周。
肌钙蛋白I(TnI)测定试剂盒(化学发光免疫分析法)产品技术要求mairui

2性能指标
2.1外观
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;Ra 组分应为棕色含固体微粒的液体,无板结、无絮状物。
Rb 、Rc 组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
2.2装量
应不少于试剂瓶的标示装量值。
2.3准确度
对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10% 范围内。
2.4最低检测限
应不大于0.006 ng/mL。
2.5线性
试剂盒在0.006 ng/mL~50 ng/mL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性
变异系数CV 应≤ 6%。
2.7批间差
变异系数CV 应≤ 10%。
化学发光免疫类体外诊断试剂(盒)产品技术审评要求规范(2017版)1204

化学发光免疫类体外诊断试剂(盒)产品技术审评规范(2017版)本规范旨在指导注册申请人对化学发光免疫类体外诊断试剂(盒)产品注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本规范是对化学发光免疫类体外诊断试剂(盒)产品的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围本规范适用于利用化学发光免疫分析技术对被测物质进行定量检测的第二类体外诊断试剂(包括以微孔板、管、磁颗粒、微珠和塑料珠等为载体的酶促及非酶促化学发光免疫分析测定试剂)的注册技术审查。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号)化学发光免疫类体外诊断试剂(盒)产品分类代号为6840。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)的相关要求。
(二)主要原材料研究资料(如需提供)主要原材料(例如各种天然抗原、重组抗原、单克隆抗体、多克隆抗体以及多肽类、激素类等生物原科,辣根过氧化物酶、碱性磷酸酶等标记用酶、磁微粒及其他主要原料)的选择、制备、质量标准及实验验证研究资料;校准品、质控品的原料选择、制备、赋值过程及试验资料;校准品的溯源性文件,包括具体溯源链、实验方法、数据及统计分析等详细资料。
人17-羟孕酮(17-OHP)酶联免疫分析试剂盒技术参数

人17-羟孕酮(17-OHP)酶联免疫分析试剂盒技术参数人17-羟孕酮(17-OHP)酶联免疫分析试剂盒实验原理本试剂盒应用双抗体夹心法测定标本中猪17-羟孕酮(17-OHP)水平。
用纯化的猪17-羟孕酮(17-OHP)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入17-羟孕酮(17-OHP),再与HRP标记的17-羟孕酮(17-OHP)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成zui终的黄色。
颜色的深浅和样品中的17-羟孕酮(17-OHP)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中猪17-羟孕酮(17-OHP)浓度。
标本要求1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP)活性。
操作步骤1.标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀释。
2.加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。
在酶标包被板上标准品准确加样50μl,待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl(样品zui终稀释度为5倍)。
加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
3.温育:用封板膜封板后置37℃温育30分钟。
4.配液:将30倍浓缩洗涤液用蒸馏水30倍稀释后备用5.洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复5次,拍干。
6.加酶:每孔加入酶标试剂50μl,空白孔除外。
7.温育:操作同3。
8.洗涤:操作同5。
9.显色:每孔先加入显色剂A50μl,再加入显色剂B50μl,轻轻震荡混匀,。
胃泌素—17测定试剂盒(化学发光免疫分析法)产品技术要求新产业
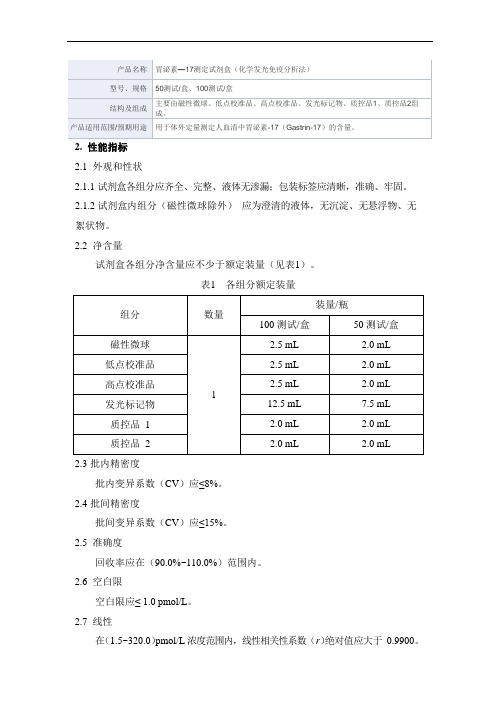
2.性能指标
2.1外观和性状
2.1.1试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固。
2.1.2试剂盒内组分(磁性微球除外)应为澄清的液体,无沉淀、无悬浮物、无絮状物。
2.2净含量
试剂盒各组分净含量应不少于额定装量(见表1)。
表1 各组分额定装量
2.3批内精密度
批内变异系数(CV)应≤8%。
2.4批间精密度
批间变异系数(CV)应≤15%。
2.5准确度
回收率应在(90.0%~110.0%)范围内。
2.6空白限
空白限应≤ 1.0 pmol/L。
2.7线性
在(1.5~320.0)pmol/L 浓度范围内,线性相关性系数(r)绝对值应大于0.9900。
2.8校准品
2.8.1校准品准确度
相对偏差应在±10% 范围内。
2.8.2校准品瓶内均一性
校准品瓶内均一性CV)应≤8%。
2.8.3校准品瓶间均一性
校准品瓶间均一性(CV)应≤10%。
2.9质控品
2.9.1质控品准确度
质控品1 测定均值应在[7.0~13.0] pmol/L,质控品2 测定均值应在[70.0~130.0] pmol/L 浓度范围内。
2.9.2质控品瓶内均一性
质控品瓶内均一性(CV)应≤8%。
2.9.3质控品瓶间均一性
质控品瓶间均一性(CV)应≤10%。
一种17α-羟孕酮的化学发光检测试剂盒及其制备方法和应用[发明专利]
![一种17α-羟孕酮的化学发光检测试剂盒及其制备方法和应用[发明专利]](https://img.taocdn.com/s3/m/63b08bd1534de518964bcf84b9d528ea81c72fcf.png)
(10)申请公布号(43)申请公布日 (21)申请号 201511019364.5(22)申请日 2015.12.30G01N 33/543(2006.01)G01N 33/532(2006.01)G01N 21/76(2006.01)(71)申请人深圳市新产业生物医学工程股份有限公司地址518122 广东省深圳市坪山新区金沙社区金辉路16号(72)发明人饶微 余慧玲 李婷华 彭国涛罗凯 杜凯(54)发明名称一种17α-羟孕酮的化学发光检测试剂盒及其制备方法和应用(57)摘要本发明提供了一种17α-羟孕酮的化学发光检测试剂盒,所述试剂盒包括组分A 和组分B,所述组分A 为17α-羟孕酮抗原衍生物包被的磁球悬浮液,所述17α-羟孕酮抗原衍生物由17α-羟孕酮抗原与蛋白载体偶联而成,所述组分B 为标记17α-羟孕酮抗体的化学发光标记物溶液。
本发明还提供了一种17α-羟孕酮的化学发光检测试剂盒的制备和检测方法及其应用,利用本发明提供的化学发光检测试剂盒,根据竞争法原理,准确、灵敏地测定样本中的17α-羟孕酮含量。
(51)Int.Cl.(19)中华人民共和国国家知识产权局(12)发明专利申请权利要求书2页 说明书19页 附图4页CN 105651990 A 2016.06.08C N 105651990A1.一种17α-羟孕酮的化学发光检测试剂盒,所述试剂盒包括组分A和组分B,所述组分A 为17α-羟孕酮抗原衍生物包被的磁球悬浮液,所述17α-羟孕酮抗原衍生物由17α-羟孕酮抗原与蛋白载体偶联而成,所述组分B为标记17α-羟孕酮抗体的化学发光标记物溶液。
2.根据权利要求1所述的试剂盒,其特征在于,所述蛋白载体选自牛血清白蛋白、人血清白蛋白、兔血清白蛋白、血蓝蛋白、牛IgG、人IgG、卵清蛋白、肌红蛋白和甲状腺球蛋白中的任一种。
3.根据权利要求1所述的试剂盒,其特征在于,所述化学发光标记物选自鲁米诺及其衍生物、异鲁米诺及其衍生物、吖啶酯中的任一种。
基于三种检测方法的17α羟孕酮临床检测比对

基于三种检测方法的17α羟孕酮临床检测比对渠海;吕萌萌;朱宇皇;付光宇【摘要】目的评价具有不同检测原理的3个17α羟孕酮试剂盒,分析其临床检测结果的相关性和一致性. 方法收集2015年2月至10月临床确诊为先天性肾上腺皮质增生症患者的血清120例,设为试验组;收集同期体检健康者血清120例,设为对照组.分别采用3个产品的17α羟孕酮试剂盒进行定量检测,对检测结果进行统计分析. 结果 3个产品的相关性R2分别为0.82、0.76和0.77,临床的阳性符合率为100%、100%和99.2%,阴性符合率为97.5%、98.3%和98.3%,总符合率为98.8%、99.2%和98.8%.3个产品的临床符合率差异无统计学意义(P>0.05). 结论不同检测原理的3个产品的17α羟孕酮试剂盒的临床检测结果具有等效性,符合临床应用要求.【期刊名称】《分子诊断与治疗杂志》【年(卷),期】2017(009)004【总页数】6页(P272-277)【关键词】17α羟孕酮;放射免疫法;酶联免疫法;磁微粒化学发光法【作者】渠海;吕萌萌;朱宇皇;付光宇【作者单位】郑州安图生物工程股份有限公司,河南,郑州450016;郑州市第六人民医院检验科,河南,郑州450015;郑州安图生物工程股份有限公司,河南,郑州450016;郑州安图生物工程股份有限公司,河南,郑州450016【正文语种】中文先天性肾上腺皮质增生症(congenital adrenal hyperplasia,CAH)是一种由于肾上腺皮质激素合成途径中酶的缺陷引起的疾病,属常染色体隐性遗传病[1]。
常见的缺陷酶包括21-羟化酶、17-羟化酶、3-羟脱氢酶和11-羟化酶等,其中21-羟化酶缺陷症(21-hydroxylase deficiency,21-OHD)约占CAH的90%~95%[2]。
临床上通常把CAH分为经典型和非经典型,其中非经典型又称做迟发型(nonclassic 21-hydroxylase deficiency,NCCAH)。
总β人绒毛膜促性腺激素(Total β HCG)测定试剂盒(化学发光免疫分析法)产品技术要求mairui

2性能指标
2.1外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;Ra 组分应为棕色含固体微粒的液体,无板结、无絮状物。
Rb 和Rc 组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
2.2装量
应不少于试剂瓶的标示装量值。
2.3准确度
1.3.1将HCG 国家标准品配成两个浓度水平的样品,用待检试剂盒进行检测,其检测结果与标定靶值的相对偏差在±10%范围内。
1.3.2对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10% 范围内。
2.4最低检测限
应不大于0.5 mIU/mL。
2.5线性
试剂盒在0.5 mIU/mL~5000 mIU/mL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性
变异系数CV 应≤ 5%。
2.7批间差
变异系数CV 应≤ 10%。
2.8特异性
测定浓度200 mIU/mL 的LH,测定结果应不高于本试剂盒的最低检测限;
测定浓度200 mIU/mL 的FSH,测定结果应不高于本试剂盒的最低检测限;
测定浓度200 μIU/mL 的TSH,测定结果应不高于本试剂盒的最低检测限。
2.9稳定性
2~8℃避光保存,试剂盒有效期为365 天。
到有效期后90 天内的试剂盒应符合2.1、2.3、2.4、2.5、2.6 的要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 性能指标
2.1外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;Ra 组分应为棕色含固体微粒的液体,无板结、无絮状物。
Rb 和Rc 组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物;
校准品应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
分装瓶应为透明塑料管,盖有塑料外盖。
2.2装量
应不少于试剂的标示装量值。
2.3准确度
对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10%范围内。
2.4最低检测限
应不大于0.05 ng/mL。
2.5线性
试剂盒在0.05 ng/mL ~30 ng/mL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性
变异系数CV 应≤ 5%。
2.7批间差
变异系数CV 应≤ 10%。
2.8校准品均一性
2.8.1校准品瓶内均一性
C0 的标准差(SD)应不大于0.05 ng/mL,C1 和C2 的变异系数(CV)应不大于8.0%。
2.8.2校准品瓶间均一性
C0 的标准差(SD)应不大于0.05 ng/mL,C1 和C2 的变异系数(CV)应不大于5.0%。
2.9生物安全性
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂,对校准品中乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体(HIV-I 型和HIV-II 型)、丙型肝炎病毒抗体、梅毒螺旋体抗体的检测应为阴性。
2.10稳定性
2~8℃避光保存,试剂盒有效期为365 天。
到有效期后90 天内的试剂盒应符合2.1、2.3、2.4、2.5、2.6、2.8 的要求。
