Bac-to-Bac杆状病毒表达系统
利用杆状病毒Bac-to-Bac系统在Sf9细胞中表达真菌细胞色素P450nor

’ DE< P5H5I5K<K G;**<6H&M &+KH N%*< HE56
".## GMH%GE*%N< >!.# K<];<6G<K I<&%68+68 H% "^. 8<6< Q5N+&+<K +6G&;P+68 C# 8<6<Q5N+&+<K Q*%N 56+N5&K,." 8<6<Q5N+&+<K Q*%N )&56HK,^\ 8<6<Q5N+&+<K Q*%N &%O<* <;W5*M%H<K 56P CC 8<6<Q5N+&+<K Q*%N I5GH<*+5( EHH): SSPN<&K%6 ’ ;HN<6 ’ <P;SGMH%[", B] ’ ZMH%GE*%N< >!.# <6YMN<K ;K;5&&M GE*%N< >!.# _ EHN&)
W6%O6 GMH%GE*%N< >!.# <6YMN<K 5K +H G5H5&MY<K HE< *<5GH+%6 KE%O6 +6 U<5GH+%6 T O+HE%;H 5 *<P%L )5*H6<* K;GE 5K GMH%GE*%N< >!.# *<P;GH5K< 56P HE;K *<G<+J<K <&<GH*%6K P+*<GH&M Q*%N ,(=1 %* ,(=>1’ DE< G5H5&MH+G H;*6%J<* *5H< 585+6KH
Bac-to-Bac杆状病毒表达系统
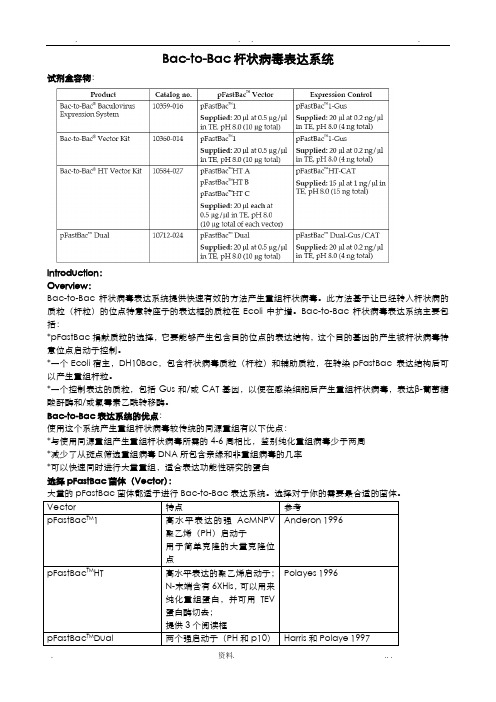
Bac-to-Bac杆状病毒表达系统试剂盒容物:Introduction:Overview:Bac-to-Bac杆状病毒表达系统提供快速有效的方法产生重组杆状病毒。
此方法基于让已经转入杆状病的质粒(杆粒)的位点特意转座子的表达框的质粒在Ecoli中扩增。
Bac-to-Bac杆状病毒表达系统主要包括:*pFastBac捐献质粒的选择,它要能够产生包含目的位点的表达结构,这个目的基因的产生被杆状病毒特意位点启动子控制。
*一个Ecoli宿主,DH10Bac,包含杆状病毒质粒(杆粒)和辅助质粒,在转染pFastBac 表达结构后可以产生重组杆粒。
*一个控制表达的质粒,包括Gus和/或CAT基因,以便在感染细胞后产生重组杆状病毒,表达β-葡萄糖酸酐酶和/或氯霉素乙酰转移酶。
Bac-to-Bac表达系统的优点:使用这个系统产生重组杆状病毒较传统的同源重组有以下优点:*与使用同源重组产生重组杆状病毒所需的4-6周相比,鉴别纯化重组病毒少于两周*减少了从斑点筛选重组病毒DNA所包含亲缘和非重组病毒的几率*可以快速同时进行大量重组,适合表达功能性研究的蛋白选择pFastBac菌体(Vector):指南提供了一个对于Bac-to-Bac表达系统的概述,并对以下提供指导:1、克隆目的基因到pFastBac TM供体质粒的选择2、转化pFastBac TM 结构到最高效的DH10Bac TM产生重组质粒3、转染重组质粒DNA到昆虫细胞产生重组杆状病毒4、扩增滴定(Amplify and titer)杆状病毒株,使用病毒株感染昆虫细胞表达目的重组蛋白重要的:Bac-to-Bac杆状病毒表达系统是用来帮助你产生重组杆状病毒,在昆虫细胞中进行高水平表达目的基因的系统。
虽然他可以帮助你很容易的产生杆状病毒表达你的重组蛋白,但是使用这系统更倾向于有杆状病毒生物学和昆虫表达背景的使用者。
我们高度推荐使用者具有病毒和组织培养的技术和知识。
Bac-to-Bac_表达系统精简

Bac-to-Bac 表达系统I. pFastBac-X重组质粒的构建利用分子生物学技术构建所需的pFastBac重组质粒,以DH5α为宿主,进行扩增.(以下以pFastBac-X为例进行说明.II. pFastBac-x重组质粒的转座步骤:1. 制备LB琼脂平板。
LB培养液(含Agar):胰蛋白冻10g/l,Nacl 10g/l,酵母提取物5g/l,Agar 15g/l 高压灭菌后,培养基温度下降至60℃左右迅速加入下列成分:卡那霉素50ug/ml庆大霉素7ug/ml四环素10ug/mlBluo-gal 100ug/mlIPTG 40ug/ml各成分混匀后,乘热在每块平板中加入约20ml培养基,待凝固后放置37℃烘箱干燥产生的水汽。
2. 取出DH10BacTM感受态细胞冰上融解。
3. 用移液枪吸取100ulDH10BacTM感受态细胞于1.5ml EP管。
4. 轻轻加入1ng(约5ul)重组质粒X于感受态细胞中,轻轻敲打管壁使之混匀。
5. 冰上放置30min。
6. 42℃循环水浴静止45秒。
7. 快速放置冰上2min。
8. 在上述管中加入900ul S.O.C.培养基。
9. 将EP管置于37℃摇床(225rpm)4h。
10. 用S.O.C.稀释上述细胞至10-1、10-2、10-3。
11. 在每块LB培养基中加入上述稀释液100ul,涂布均匀。
12. 37℃培养24-48h。
(单克隆很小,24h前很难分辨是否为蓝色克隆)注:1)1、3、4、8、10、11在超净台内进行。
2)用X-gal代替Bluo-gal会降低颜色浓度。
真正的白色克隆在菌落长得较大时还是呈白色,建议在黑色背景下进行挑选。
III. 重组Bacmid DNA的分离提取(在提取前,可以在含Bluo-gal的LB琼脂平板上划板进一步确认)溶液配置:溶液Ⅰ:Tris-Hcl(15Mm) 0.119gEDTA (10Mm) 0.187gRnase (100ug/ml) 0.5ml(贮备液10mg/ml)用纯水溶解并定容至50ml(调pH8.0)溶液Ⅱ:NaOH 0.2NSDS 1%溶液Ⅲ:醋酸钾(3M)14.7g溶解定容至50ml,pH5.5TE溶液:1. 挑取白色克隆于2mlLB培养基(含50ug/ml卡那霉素、7ug/ml庆大霉素、10ug/ml四环素),37℃摇床250-300rpm培养24h以上。
利用家蚕杆状病毒Bac-to-Bac系统表达大肠杆菌L-天冬酰胺酶Ⅱ

p a B c T 载体, Fs aH b t 大肠杆菌 D 5 ,H 0 aT H a D 1B c , M B N昆虫细胞 , m 由本实验室保存。 a H I, i 1 Bm Hn 1 d1
等限制性内切酶,4D A连接酶 , T N 质粒柱抽试剂盒 ,
费建明 1 吴 岩 ,占鹏飞 1施 国方 1 王文兵 2 , , ,
(. 1浙江省湖州市农业科学研究院 , 浙江 湖州 3 3 0 ;2 江苏大学生命科学研究院, 10 0 . 江苏 镇江 22 1 ) 10 3
摘
要 : 厂天冬酰胺酶(- saaiaeI A P 可以通过 降解 L 天冬酰胺从而抑制肿瘤细胞 中蛋白质的正常合成 , I L ap rg s , _ S ) n , _ 导
致肿瘤细胞的死亡。 通过杆状病毒的 B ct -a 方法 , a-o B c - 将大肠杆菌的 ap 因在家蚕杆状病毒 中表达 , s基 其活性较原核表 达有 明显提高 , 达到 2 0 / 。为利用家蚕生物反应器生产该蛋 白提供 了依据 。 80 mg 关键词: 家蚕 ; 多角体 ; - L 天冬酰胺酶; - 大肠杆菌
(. ei h r ReerhIsi t, zo c d m gi l rl c n e, zo 1 0 0 C ia 1 S r u ue sac tue Huh uA a e yo r ut a S i cs Huh u3 3 0 , hn ; c n t fA c u e
wih t e ba u v r ct cs se t h c l iusBa o Ba y t m
FEIJa - i g. U n, in m n W Ya 2ZH AN e g fP S o f n 1W ANG e - ig P n - e , HIGu - a g, W n bn
杆状病毒表达系统 杆状病毒滴度测定 全攻略

细胞因子的ELISA检测:
(1)于24孔板中加入适量的相关刺激原(based on in vitro dose-response studies),然后将浓度为4×106 cells/ml的细 胞悬液加至各孔内,每孔1 ml。 (2)臵37 ℃,5 % CO2温箱中培养72 h后,收取细胞上清。 (3)详细阅读说明书的实验步骤(不同牌子试剂盒稍有不 同),严格按要求操作。 标准曲线是判定实验的质量。
外周血单核细胞的分离 :
细胞因子的定量PCR检测:
(1)于24孔板中加入适量的相关刺激原(based on in vitro dose-response studies),然后将浓度为4×106 cells/ml的细 胞悬液加至各孔内,每孔1 ml。 (2)臵37 ℃,5 % CO2温箱中培养20 h,提取细胞总RNA并 测定 RNA浓度和纯度。 (3)取0.5 µ g RNA进行逆转录(TOYOBO反转录试剂)。 (4)定量PCR:
供体质粒pFastBac:靶基因位于杆状病毒特异启动子下游 DH10Bac:杆状病毒穿梭载体Bacmid + 辅助质粒
Bac-to-Bac 表达系统的组成和工作原理
Bac-to-Bac 表达系统的组成和工作原理
Expermiantal outline
昆虫细胞的培养
Insect Cell Lines:
杆状病毒滴度测定
两种病毒滴度测定方法的比较: 空斑实验法测定滴度依赖于病毒在感染细胞中的复制以及感染 周边细胞形成局灶型病变;而免疫染色法只需要病毒感染靶细 胞并表达病毒所编码的蛋白。因此,免疫染色法(infectious units per ml, or IFU/ml)测定病毒滴度需要的时间比空斑法 (PFU/ml)更短。
蛇毒cystatin在Bac to Bac杆状病毒表达系统的表达与鉴定

维普资讯
J n eUi 0 p… 4 … 叠攀盟 n 26evl 。 j d v 0S , Fi M u a 。… o
49 1
蛇 毒 c sai在 B ct a ytt n a B c杆状 病 毒 表 达 系统 的 表 达 与鉴 定 o
Bu fr . 5 L,2 5 mmo / d fe 2 . lL NTP 2 “ L,5 0
mmo/ Mg O I, O 引 物 F 、 lI S 41 2 D 1 R1各 0 7 .5
标记 兔 抗 鸡 IG( 海 中科 开 瑞 生 物 科 技 有 限 公 g 上
司 ) 鼠抗 5 Hi 抗 和 碱 性 磷 酸 酶 标 记 羊 抗 鼠 , × s单
IG( 国 N v g n公 司 ) g 德 o ae 。
1 3 引物 . 合成 。
均 由上海 中科 开瑞 生 物 科 技 有 限公 司
1 4 蛇毒 c sai . y tt n基 因 体 外扩 增 根 据 蛇 毒 cs y— tt 计一 对 引物 : ,
F1:5’ ACG 一 CG T CG A CAT GA T CCC A GG TGG
bac-to-bac expression system

Thank you!
Bac-to-Bac expression system
专业:生物化学与分子生物学 姓名:蒋琢璞 学号:200730200
简介
杆状病毒表达系统(Baculovirous Expression Vector System,BEVS)与细菌, 酵母,哺乳动物细胞一起被公认为当今世界 的基因工程的四大表达系统。它作为一种新 型的表达系统,因为其许多特有的优势特点, 逐渐引起了人们越来越多的关注
基本原理
AcNPV为环状双链的DNA病毒,分子量在 90~130kd,是目前应用最广泛的杆状病毒 表达载体。其中的多角体蛋白(Polyhedrin) 对于感染过程不是必需的,因此可以用一 个外源基因来代替多角体蛋白基因,用这 样一个重组的杆状病毒来感染昆虫细胞, 从而实现目的蛋白的高效表达。
为了在昆虫细胞中表达外源基因,重组病毒 质粒的构建和纯化筛选,常常需要依赖基 本的转染和斑点分析方法,这个过程通常 会花费4~6周。然而,如果利用一个既能 在大肠杆菌(Escherichia coli)中进行复制 的,又能感染敏感的鳞翅目昆虫细胞的病 毒穿梭载体(bacmid),那么就可以将周期 降低到几天。
特点
能对高效表达的蛋白质进行较完善的翻译后加工,如糖基 化,磷酸化,酰基化,信号肽的切除等; 与其他真和细胞表达系统相比能获得重组蛋白的高水平表 达,最高甚至可达到细胞总蛋白的50%; 对脊椎动物无感染性,并且也已经证明它们的启动子在大 多数的哺乳动物细胞中也是没有活性的,因此这对于表达 一些致癌基因和潜在的毒蛋白比其他的表达系统更有优势; 能容纳大分子片段的插入和表达; 能同时在一个细胞和载体上表达多个外源基因; 能保证高表达的外源蛋白在细胞内进行正确的折叠,二硫 键的搭配等。
Bac-to-bac中文说明书
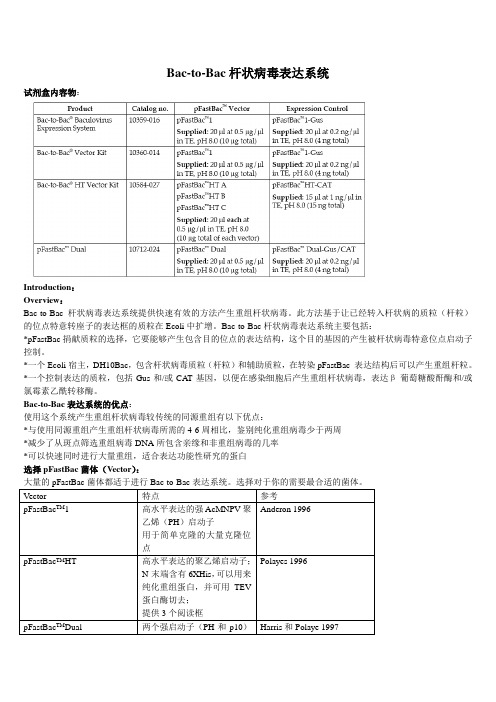
Bac-to-Bac杆状病毒表达系统试剂盒内容物:Introduction:Overview:Bac-to-Bac杆状病毒表达系统提供快速有效的方法产生重组杆状病毒。
此方法基于让已经转入杆状病的质粒(杆粒)的位点特意转座子的表达框的质粒在Ecoli中扩增。
Bac-to-Bac杆状病毒表达系统主要包括:*pFastBac捐献质粒的选择,它要能够产生包含目的位点的表达结构,这个目的基因的产生被杆状病毒特意位点启动子控制。
*一个Ecoli宿主,DH10Bac,包含杆状病毒质粒(杆粒)和辅助质粒,在转染pFastBac 表达结构后可以产生重组杆粒。
*一个控制表达的质粒,包括Gus和/或CAT基因,以便在感染细胞后产生重组杆状病毒,表达β-葡萄糖酸酐酶和/或氯霉素乙酰转移酶。
Bac-to-Bac表达系统的优点:使用这个系统产生重组杆状病毒较传统的同源重组有以下优点:*与使用同源重组产生重组杆状病毒所需的4-6周相比,鉴别纯化重组病毒少于两周*减少了从斑点筛选重组病毒DNA所包含亲缘和非重组病毒的几率*可以快速同时进行大量重组,适合表达功能性研究的蛋白选择pFastBac菌体(Vector):大量的pFastBac菌体都适于进行Bac-to-Bac表达系统。
选择对于你的需要最合适的菌体。
指南用途:指南提供了一个对于Bac-to-Bac表达系统的概述,并对以下提供指导:1、克隆目的基因到pFastBac TM供体质粒的选择2、转化pFastBac TM 结构到最高效的DH10Bac TM产生重组质粒3、转染重组质粒DNA到昆虫细胞产生重组杆状病毒4、扩增滴定(Amplify and titer)杆状病毒株,使用病毒株感染昆虫细胞表达目的重组蛋白重要的:Bac-to-Bac杆状病毒表达系统是用来帮助你产生重组杆状病毒,在昆虫细胞中进行高水平表达目的基因的系统。
虽然他可以帮助你很容易的产生杆状病毒表达你的重组蛋白,但是使用这系统更倾向于有杆状病毒生物学和昆虫表达背景的使用者。
家蚕Polh^+ Bac-to-Bac杆状病毒表达系统的构建

家蚕Polh^+ Bac-to-Bac杆状病毒表达系统的构建曹翠平;兰丽盼;姚慧鹏;何芳青;郭爱芹;吴小锋【期刊名称】《蚕业科学》【年(卷),期】2008(34)2【摘要】为利用杆状病毒的强启动子——多角体启动子而构建的重组杆状病毒一般是多角体缺失型(polh-)病毒。
为了解决家蚕生物反应器规模化生产中病毒必需经皮接种而效率低下的问题,在建立家蚕Bac-to-Bac快速表达系统的基础上,构建了能形成多角体的家蚕Polh+ Bac-to-Bac表达系统。
通过该系统能够产生表达外源目的基因的重组病毒,获得的该重组病毒能在培养细胞内表达,也能通过经口添食感染表达。
利用EGFP报告基因分析了该系统的表达效果,构建的重组病毒不仅有效表达了EGFP蛋白,还在细胞核中形成了大量多角体。
该系统较好解决了重组病毒必需经皮接种感染的缺陷,提高了生产效率,拓宽了杆状病毒在生物杀虫剂、基因治疗等领域的应用前景。
【总页数】7页(P237-243)【关键词】家蚕;杆状病毒表达系统;多角体;经口感染【作者】曹翠平;兰丽盼;姚慧鹏;何芳青;郭爱芹;吴小锋【作者单位】浙江大学动物科学学院【正文语种】中文【中图分类】S884.5;Q78【相关文献】1.利用Bac-to-Bac杆状病毒系统超量表达家蚕 let-7簇microRNAs [J], 何婷;尹权;王伟;黄亚玺;吴小燕;夏庆友;刘仕平2.家蚕核型多角体病毒orf90基因在Bac-to-Bac家蚕杆状病毒系统中快速表达[J], 王强;陈克平;郭忠建;姚勤;王海燕;陈慧卿3.利用家蚕杆状病毒Bac-to-Bac系统表达大肠杆菌L-天冬酰胺酶Ⅱ [J], 费建明;吴岩;占鹏飞;施国方;王文兵4.零背景转座技术高效构建重组家蚕杆状病毒表达系统 [J], 姚伦广;张红玲;冯娟;张二辉;文祯中5.利用细菌转座子构建适于家蚕的Bac-to-Bac快速基因表达系统 [J], 吴小锋;曹翠平;鲁兴萌因版权原因,仅展示原文概要,查看原文内容请购买。
杆状病毒表达系统(昆虫细胞的培养及杆状病毒滴度测定) PPT

杆状病毒滴度测定
两种病毒滴度测定方法的比较:
空斑实验法测定滴度依赖于病毒在感染细胞中的复制以及感染 周边细胞形成局灶型病变;而免疫染色法只需要病毒感染靶细 胞并表达病毒所编码的蛋白。因此,免疫染色法(infectious units per ml, or IFU/ml)测定病毒滴度需要的时间比空斑法 (PFU/ml)更短。
获得重组杆状病毒——转染Sf9 cells
1. 小提好的Bacmid DNA,置4 ℃不超过1周
2. 转染试剂:Cellfectin® ⅡReagent
3. 转染后细胞的形态变化
细胞 变大
增殖明显变慢 或不增殖
脱落 或
融合(VSV/G)
裂解
4. 收毒,短期内4 ℃避光保存,长期保存分装后置-80 ℃
杆状病毒表达系统(昆虫细胞的培养及杆状 病毒滴度测定)
杆
昆虫细胞的培养
状
病 重组pFastBac质粒的构建
毒
表
重组Bacmid的产生与鉴定
达
获得重组杆状病毒
系
统
蛋白表达&病毒扩大
Overview
Bac-to-Bac Baculovirus Expression System能快速并有 效的获得重组杆状病毒,其重组是基于供体质粒表达盒 与杆状病毒穿梭载体Bacmid间发生位点特异性转座。
pipetting across the monolayer scraping cell scrapers hitting the flask against the palm of your hand
Preservation:
90% serum, 10% DMSO 严格程序降温,-80 ℃过夜后转移液氮保存。
杆状病毒表达系统简介

体外基因表达系统包括原核细胞系统和真核细胞系统。
原核细胞系统主要是大肠杆菌细胞,它操作简便、周期短收益大及表达产物稳定,但是表达基因的相对分子质量有限,不宜过大,且不能对表达产物进行一些翻译后加工、修饰。
真核细胞系统包括 CHO等哺乳动物细胞、酵母细胞和昆虫细胞等。
昆虫细胞表达系统(即杆状病毒表达系统)具有独特的生物学特性,日益受到人们的重视。
1、杆状病毒的生物学特性杆状病毒只来源于无脊椎动物,虽然已发现600多种杆状病毒,但进行分子生物学研究的不到20种。
杆状病毒的基因组为单一闭合环状双链DNA分子,大小为80~160 kb,其基因组可在昆虫细胞核复制和转录。
DNA复制后组装在杆状病毒的核衣内,后者具有较大的柔韧性,可容纳较大片段的外源DNA插入,因此是表达大片段DNA的理想载体。
其中,用作外源基因表达载体的杆状病毒,目前仅限于核型多角体病毒(nuclear polyhedrosis virus,NPV)。
该病毒颗粒在细胞内可由多角体蛋白包裹形成长度约1~5 m的包含体病毒,呈多角体形状。
核型多角体病毒有两种形式:一种为包含体病毒(occluded virus,OV),另一种则为细胞外芽生病毒(budded virus,BV)。
它们在病毒感染中扮演的角色不同,包含体病毒是昆虫间水平感染的病毒形式,昆虫往往是食入污染OV的食物后引起感染。
包含体病毒外层裹了一层蛋白晶体,即为29 000的多角体蛋白,它对病毒的水平感染起以下作用:①保护病毒颗粒在外界传播过程中免遭环境因素的破坏而失活。
②保证病毒颗粒在适当的位置释放,引起感染。
昆虫中肠上皮局部的强碱性环境(pH=10.5),可使病毒颗粒释放蛋白酶溶解多角体。
BV病毒是个体内细胞间的感染形式,由细胞芽生出BV,进入血淋巴系统中感染其它部位的细胞或直接在临近细胞内感染。
近几十年,有关杆状病毒基因结构、功能和表达调节的研究进展迅速,其中研究最深入的是苜蓿银蚊夜蛾(autogra— phacalifornica)多核型多角体病毒(multiple nuclear polyhedro-sis virus,MNPV),简称AcMNPV或AcNPV。
用Bac_to_Bac杆状病毒表达系统高效表达绿色荧光蛋白标记的HBVe抗原

用Bac -to -Bac 杆状病毒表达系统高效表达绿色荧光蛋白标记的HBVe 抗原岳莉莉 齐义鹏* 杜全胜 李 燕(武汉大学病毒研究所,武汉 430072) 摘要 通过基因工程操作,使乙型肝炎病毒e 抗原(HBeAg )基因与绿色荧光蛋白基因(GFP )融合,用新型Bac -to -Bac 杆状病毒表达系统在昆虫细胞中高效表达了HBeAg -GFP 双功能融合蛋白。
经EL ISA 法和荧光显微镜观察证实,表达产物既能发射易于检测的绿色荧光,又具有HBV的e 抗原活性,为免疫诊断新方法的建立进行了有益的探索。
关键词 HBeAg 基因,绿色荧光蛋白基因,双功能融合蛋白,Bac -to -Bac 系统 乙型肝炎病毒(HBV )的诊断有三个抗原/抗体系统,其中HBVe 系统是判断传染性与预后及母婴传播关系的重要指标[1]。
所以,HBeAg 的检测具有重要的临床检验意义。
但传统的EL ISA 方法往往费事、费时,不够经济,因此发展新型、特异、灵敏、快速、直观的检测方法具有重要的理论和实践意义。
自从1994年首次对水母的绿色荧光蛋白(Green fluorescent protein ,GFP )基因成功地克隆表达以来[2],1996年朱反修等[3]在昆虫细胞中首次表达了GFP 。
GFP 作为一种新型报道基因引起了广泛的关注[4-6],它编码一种在紫外和蓝光激发下发射绿色荧光的发光蛋白。
我们曾对GFP 的结构与荧光特性的关系作了研究和探讨[7],在已有工作的基础上,又将GFP 基因与HCVc 抗原基因[8]和HBVe 抗原基因[9]嵌合,在大肠杆菌中进行表达。
本文用新型的Bac -to -Bac 杆状病毒表达系统[10],在昆虫细胞中高效表达GFP -HBVe 抗原双功能融合蛋白(既具有发光特性,又具有HBV 的抗原活性)。
拟将GFP 作为一种新型的标记物引入病毒性肝炎的免疫诊断,传统的酶标技术是在检测时在蛋白质水平上用酶标记抗原或抗体,然后加底物进行显色反应,本文是在基因水平上将GFP 基因与抗原基因(HBVe )连结成融合基因,在昆虫细胞中表达GFP/e 抗原融合蛋白。
[医学]杆状病毒表达系统(昆虫细胞的培养及杆状病毒滴度测定)
![[医学]杆状病毒表达系统(昆虫细胞的培养及杆状病毒滴度测定)](https://img.taocdn.com/s3/m/39cdc444964bcf84b9d57bd9.png)
DH10Bac:杆状病毒穿梭载体Bacmid + 辅助质 粒
Bac-to-Bac 表达系统的组成和工作原理
Bac-to-Bac 表达系统的组成和工作原理
Expermiantal outline
昆虫细胞的培养
Insect Cell Lines:
用途
疾病诊断 病毒分离株的鉴定 不同病毒株的抗原关系研究 疫苗免疫原性的评 免疫血清的质量评价 测定实验动物血清中是否存在抗体
材料
1. 病毒
(1)冻存的病毒不能重复使用 (2)进行中和实验前,需先进行病毒滴定(TCID50)的滴定
进行病毒定量
2. 血清样品
(1)血清样品分装冻存于-20℃ ,一般不要反复冻融3次以上。 (2)血清样品不溶血,不长期冻存,以减少对细胞的毒性。 (3)需要有阳性和阴性对照血清,实验前需56℃灭活30分钟。
杆状病毒滴度测定
两种病毒滴度测定方法的比较:
空斑实验法测定滴度依赖于病毒在感染细胞中的复制以及感染 周边细胞形成局灶型病变;而免疫染色法只需要病毒感染靶细 胞并表达病毒所编码的蛋白。因此,免疫染色法(infectious units per ml, or IFU/ml)测定病毒滴度需要的时间比空斑法 (PFU/ml)更短。
将96孔细胞培养板放入37 ℃ 5% CO2培养箱中作用 45 min—60 min。
感作完成后每孔加入100 µl细胞悬液,继续置37℃ 5% CO2培养箱培养,逐日观察并记录结果,一般要 观察4-5天。
结果计算,按Reed-Muench两氏法或Karber法进 行。
中和效价(PD50)的计算:
(2)置37 ℃,5 % CO2温箱中培养72 h后,收取细胞上清。 (3)详细阅读说明书的实验步骤(不同牌子试剂盒稍有不
狂犬病病毒核蛋白在Bac—To—Bac/AcMNPV杆状病毒系统的表达

其他 7种 牛病 阳性血 清发 生 交叉反 应 。检 测 非免 疫无 口蹄 疫 国家牛 阴性血 清 的特异 性 为 10 检 测感 染血 0 %; 清敏 感性 为 9 . 检 测 O— s 的. 价 苗免 疫牛 血 清 , 4种 商品 化试 剂盒 比较 , 符 合 率分别 为 6 . 7 %: 3 Ai I 2 a - 与 其 9 %、 0
C
牛 口蹄疫 病毒 V 2结构 蛋 白抗体 间接 E IA 方法 的建 立 P LS
.
为 建 立牛 口蹄 疫 (MD) 体 的检 测 方 法 , 研 究将 口蹄 疫病 毒 (MDv 的 V 2基 因 , 过 p ROE M F 抗 本 F ) P 通 P XT
HT b表 达 载体 在 大肠 杆 菌 DH5 ̄中表 达 , o 获得 大 小为 3 k 5 u的重 组 V 2蛋 白( 2, s r lt 实 r P P r )we enbo 证 VP t V 2
T 2型细胞 因子 I一 、L 6 I一1 h L 4I一 、 L 0以及 看 家基 因 D at — c n的基 因序 列分 别设 计一 对特 异性 引物 ,构 建含 有 i
各 自 引物 扩 增 序 列 的 重 组 质 粒 作 为 阳性 标 准 品 , 立 了检 测 I 一 、 一 、L 1 建 L 4 I 6 I 一 0及 p at L — ci n的 S R re YB G enI ra i C 方 法 。该 方 法 线 性 关 系好 , 种 细 胞 因 子 及 p at e卜t P R me 各 — ci 准 曲 线 的 相 关 系数 均 达 到 O9 7以上 ; n标 . 9
敏 感性 高 , 始模板 的检 出下 限均 达到 1 l o isI 特 异性 强 , 增 产物 形 成 单一 的特 异 性熔 解峰 ; 初 x 0 cpe x / L; 扩 重 复性 好 . 内与组 间的 变异 系数 均 小于 3 组 %。应 用所 建立 的方 法对猪 繁 殖与 呼吸 综合征 病毒 (RRS ) 染仔 P V感 猪 外周血 单 个核 细胞 (B P MC) I一 、 一 中 L 4 I 6和 I一1 L L 0mRNA 的表 达 水 平进行 了检 测。 结果表 明 , 本研 究建
杆状病毒表达载体系统生产重组蛋白

2:基本原理
❖ 1:目的基因插入转移载体。 ❖ 2:目的基因转移到病毒基因组靶位点,空斑纯
化获得重组病毒。
❖ 3:重组病毒感染宿主培养细胞或幼虫。
❖ 4:纯化目的蛋白
杆状病毒表达载体的构建
❖ 转移载体 通常由三部分组成: ❖ E. coli质粒的复制原点和抗生素抗性基因(如Ampr),保
弃滤液。重复洗涤一次。 ❖ 9 室温或风干DNA,加入50-80ulEluent溶液,冰上溶解
10min ,4℃保存。
Sf9细胞转染
❖ 1.37℃预热Sf900TM- III SFM培养基; ❖ 2.准备重组质粒和细胞转染试剂的混合物:
a.溶解5μl纯化的杆状病毒重组质粒于100μl Sf900TMIII SFM培养基;
b.转染试剂充分摇匀后取8μl加入100μl Sf900TM- III SFM培养基,混匀;
c.将上述稀释好的质粒及稀释好的转染剂混匀,室温孵育 20min;
❖ 3.Sf9细胞计数,取6孔板,每孔加入1.6×106个细 胞(其中一孔设为空白对照),补加预热的Sf900TMIII SFM培养基至2ml,混匀,室温静置15min,使细 胞贴壁;(加第一孔细胞时显微镜下观察细胞密度, 观察是否符合需求量)
存。
转化DH10BACTME.coli
❖ 1.冰上融化DH10BACTM E.coli感受态细胞(约5min); ❖ 2.取1ng pFastbac-重组质粒至DH10BACTM E.coli感受态
细胞轻弹两下混匀,冰上静置30min; ❖ 3.42℃热击45秒;立即转移至冰上冰浴2min; ❖ 4.加800μl室温预热的LB培养基,37℃,220rpm,4h; ❖ 5.涂布至LB琼脂平板(含Kan,Tet,Gen), ❖ 6.挑取白色菌落接种至5mLLB液体培养基(抗生素如上),
Bac to Bac

Bac-to-Bac杆状病毒表达系统是一种快速、高效产生重组苜蓿银纹夜蛾核型多角体病毒(AcNPV)的技术(Luckow et al., 1993),利用细菌转座子原理,在大肠杆菌内就能完成重组病毒的构建,取名为Bac-to-Bac表达系统,意即从细菌(bacterium)到杆状病毒(baculovirus),革命性地改变了重组昆虫杆状病毒的构建方法。
其基本原理为:将一个改造后的AcNPV基因组转化入大肠杆菌,使它像普通质粒一样能在细菌中复制(由于太大,只限单拷贝),将其称之为杆状病毒穿梭载体(baculovirus shuttle vector,又称病毒质粒baculovirus plasmid,将其首尾合写而成为Bacmid),通过位点特异性转座,在大肠杆菌内完成病毒基因组的重组。
杆状病毒穿梭载体Bacmid含有细菌单拷贝数mini-F复制子、卡那霉素抗性选择标记基因及编码β-半乳糖苷酶α肽的部分DNA片段。
在lacZα基因的N氨基末端插入一小段含有细菌转座子Tn7整合所需的靶位点(mini-att Tn7),但它的插入不影响lacZα基因的表达阅读框。
将杆状病毒穿梭载体(130kb)转化入大肠杆菌DH10β,获得转化子将其命名为DH10Bac。
因此,杆状病毒穿梭载体像一个大质粒一样,可以在大肠杆菌中增殖并使细菌细胞获得卡那霉素抗性,且与存在与受体菌染色体上的lacZα缺失产生互补,在IPTG诱导和X-gal或Blue-gal生色底物存在下转化体产生蓝斑(lacZ+)。
重组Bacmid通过pFASTBAC供体质粒(donor plasmid)上的mini-Tn7转座子,在另一个辅助质粒(helper plasmid,13.2kb)的功能作用下将外源目的基因插入到Bacmid中来完成。
Helper plasmid表达转座酶并含有四环素(tetracycline)抗性基因。
pFASTBAC系列供体质粒具有共同的特征:每个质粒都含有杆状病毒启动子(polh或p10启动子),在mini-Tn7左右臂间由一个完整的表达框,包括庆大霉素(gentamincin)抗性基因、杆状病毒启动子、多克隆位点及SV40 poly(A)。
用Bac-to-Bac杆状病毒系统表达人生长激素

用Bac-to-Bac杆状病毒系统表达人生长激素耿朝晖;郜鹏;刘莹;赵东明;张宝珠;俞新大;李建民【期刊名称】《中国生物化学与分子生物学报》【年(卷),期】2002(18)1【摘要】利用Bac to Bac杆状病毒载体表达系统将人生长激素(humangrowthhormone ,hGH)基因cDNA克隆至转移载体pFastBac1中 ,得到pFastBac hGH ,再将其转化进入含穿梭载体Bacmid的受体菌DH10Bac中 ,发生转座作用 ,得到含hGH基因的重组穿梭载体rBacmid hGH .纯化DNA ,直接转染培养的昆虫细胞Sf9,得到重组病毒rAcV Bac hGH .经酶切PCR及Southern杂交鉴定 ,hGH基因正确地插入病毒基因组的多角体蛋白基因启动子下 ,SDS PAGE测得产物蛋白分子量为 2 2kD左右 .用免疫化学发光法测得转染上清中hGH表达水平可达18μg ml ,与用传统的BEVS表达hGH相比 ,转染上清中hGH表达水平提高 4 0【总页数】5页(P59-63)【关键词】Bac-to-Bac系统;昆虫细胞;hGH;基因表达;杆状病毒;生长激素【作者】耿朝晖;郜鹏;刘莹;赵东明;张宝珠;俞新大;李建民【作者单位】南开大学生物化学及分子生物学系【正文语种】中文【中图分类】Q575.11;Q78【相关文献】1.应用bac-to-bac杆状病毒表达系统在sf9昆虫细胞中重组表达CDNF蛋白 [J], 张俊;牛朝诗;梅加明;汤深凤;李静2.应用bac-to-bac杆状病毒表达系统在sf9昆虫细胞中重组表达保守性多巴胺能神经营养因子蛋白 [J], 张俊;牛朝诗;梅加明;汤深凤;李静3.Bac-to-Bac杆状病毒表达系统在BHK细胞表达鼠IL-2蛋白的研究 [J], 黄大林;戴支凯;王鑫;李彬彬;钟江4.鹅副粘病毒与鹅细小病毒主要免疫原性基因在Bac-to-Bac杆状病毒表达系统中的共表达及其免疫 [J], 毕玉海;曹璐;李志杰;母连志;徐明;丁壮5.Bac-to-Bac杆状病毒表达系统表达鼠IL-4受体拮抗体蛋白的研究 [J], 田代印;符州;王晓芳;王莉佳因版权原因,仅展示原文概要,查看原文内容请购买。
用Bac-to-Bac杆状病毒表达系统高效表达绿色荧光蛋白标记的HBVe抗原

用Bac-to-Bac杆状病毒表达系统高效表达绿色荧光蛋白标记
的HBVe抗原
岳莉莉;齐义鹏;杜全胜;李燕
【期刊名称】《病毒学报》
【年(卷),期】1998(14)3
【摘要】通过基因工程操作,使乙型肝炎病毒e抗原(HBeAg)基因与绿色荧光蛋白基因(GFP)融合,用新型Bac-to-Bac杆状病毒表达系统在昆虫细胞中高效表达了HBeAg-GFP双功能融合蛋白。
经ELISA法和荧光显微镜观察证实,表达产物既能发射易于检测的绿色荧光,又具有HBV的e抗原活性。
【总页数】6页(P234-239)
【关键词】HBeAg基因;双功能融合蛋白;GFP基因
【作者】岳莉莉;齐义鹏;杜全胜;李燕
【作者单位】武汉大学病毒研究所
【正文语种】中文
【中图分类】Q939.4;R446.61
【相关文献】
1.应用bac-to-bac杆状病毒表达系统在sf9昆虫细胞中重组表达CDNF蛋白 [J], 张俊;牛朝诗;梅加明;汤深凤;李静
2.应用bac-to-bac杆状病毒表达系统在sf9昆虫细胞中重组表达保守性多巴胺能神经营养因子蛋白 [J], 张俊;牛朝诗;梅加明;汤深凤;李静
3.Bac-to-Bac杆状病毒表达系统在BHK细胞表达鼠IL-2蛋白的研究 [J], 黄大林;戴支凯;王鑫;李彬彬;钟江
4.狂犬病病毒糖蛋白在Bac-to-bac杆状病毒系统中的表达及应用 [J], 范晓娟;李刚;李伟;曾妮;宫苗苗
5.Bac-to-Bac杆状病毒表达系统表达鼠IL-4受体拮抗体蛋白的研究 [J], 田代印;符州;王晓芳;王莉佳
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Bac-to-Bac杆状病毒表达系统试剂盒内容物:Introduction:Overview:Bac-to-Bac杆状病毒表达系统提供快速有效的方法产生重组杆状病毒。
此方法基于让已经转入杆状病的质粒(杆粒)的位点特意转座子的表达框的质粒在Ecoli中扩增。
Bac-to-Bac杆状病毒表达系统主要包括:*pFastBac捐献质粒的选择,它要能够产生包含目的位点的表达结构,这个目的基因的产生被杆状病毒特意位点启动子控制。
*一个Ecoli宿主,DH10Bac,包含杆状病毒质粒(杆粒)和辅助质粒,在转染pFastBac 表达结构后可以产生重组杆粒。
*一个控制表达的质粒,包括Gus和/或CA T基因,以便在感染细胞后产生重组杆状病毒,表达β-葡萄糖酸酐酶和/或氯霉素乙酰转移酶。
Bac-to-Bac表达系统的优点:使用这个系统产生重组杆状病毒较传统的同源重组有以下优点:*与使用同源重组产生重组杆状病毒所需的4-6周相比,鉴别纯化重组病毒少于两周*减少了从斑点筛选重组病毒DNA所包含亲缘和非重组病毒的几率*可以快速同时进行大量重组,适合表达功能性研究的蛋白选择pFastBac菌体(Vector):大量的pFastBac菌体都适于进行Bac-to-Bac表达系统。
选择对于你的需要最合适的菌体。
指南用途:指南提供了一个对于Bac-to-Bac表达系统的概述,并对以下提供指导:1、克隆目的基因到pFastBac TM供体质粒的选择2、转化pFastBac TM 结构到最高效的DH10Bac TM产生重组质粒3、转染重组质粒DNA到昆虫细胞产生重组杆状病毒4、扩增滴定(Amplify and titer)杆状病毒株,使用病毒株感染昆虫细胞表达目的重组蛋白重要的:Bac-to-Bac杆状病毒表达系统是用来帮助你产生重组杆状病毒,在昆虫细胞中进行高水平表达目的基因的系统。
虽然他可以帮助你很容易的产生杆状病毒表达你的重组蛋白,但是使用这系统更倾向于有杆状病毒生物学和昆虫表达背景的使用者。
我们高度推荐使用者具有病毒和组织培养的技术和知识。
Bac-to-Bac表达系统表达系统的成分:表达系统简单高效的产生重组杆状不能给党。
基于Luckow1993年的方法,此系统利用了位点特意的专座子Tn7区简化和提高重组质粒DNA*系统的第一个成分是用来克隆目的基因的pFastBac TM菌株。
基于pFastBac TM菌株的选择,表达基因被AcMNPV的PH或p10启动子控制,在昆虫细胞内高水平表达表达框被Tn7 的左右臂包围,并且包含一个庆大霉素抗性点和SV40多腺苷酸化信号,形成一个微型的Tn7*第二个主要结构是Ecoli的DH10Bac TM品系,用来作为pFastBac TM菌株的宿主。
DH10Bac TM细胞包含带有微型-attTn7靶位点的病毒质粒和辅助质粒(详细见下文)。
一旦pFastBac TM表达质粒转入DH10Bac细胞,转化就会发生在pFastBac TM菌株的微型Tn7单位和微型-attTn7的靶位点之间产生重组质粒。
这个转化反应发生在辅助质粒提供的转化蛋白处。
如果你已经完成了转化反应,你需要分离这个高分子量的重组质粒DNA并将质粒DNA转染如昆虫细胞趋产生重组杆状病毒,用来进行初步表达实验。
在杆状病毒株扩增和滴定后,高效价的病毒株可以用来感染细胞,进行大规模的重组蛋白的表达。
杆状病毒菌株:病毒菌株(杆粒),bMON14272(136KB),在DH10Bac Ecoli中包括:*一个低拷贝的微型F复制子*卡那霉素的抗性标记*一个来自于pUC载体的编码LacZa肽的DNA片段,用来接触病毒转座子,Tn7(微型attTn7)已经被插入。
插入的微型attTn7不会中断LacZa肽的阅读框。
杆粒在具有卡那抗性的大的质粒Ecoli DH10Bac中扩增,在显色物质如Bluo-gal 或X-gal和诱导剂IPTG 存在时,能补充染色体LacZ的缺失形成蓝斑(LacZ+)辅助质粒:DH10Bac Ecoli也包含辅助质粒,pMON7124(13.2kb),他编码转移酶和四环素抗性基因。
这个辅助质粒提供Tn7 转化功能。
图示Bac-toBac系统:下图刻画了重组病毒的产生和目的基因的表达实验轮廓:流程:下图揭示了表达目的基因的一般步骤1、pFastBac donor 质粒(步骤:目的基因的克隆)得到2、pFastBac重组体(转化至DN10Bac细胞(含有杆粒和helper))得到3、含有重组杆粒的Ecoli细胞(重新划线)得到4、验证过的含有重组杆粒的Ecoli细胞(过夜培养,分离重组杆粒DNA)得到5、重组杆粒DNA (使用Cellfectin试剂感染细胞)得到6、P1 重组杆状病毒株(>106pfu/ml)(感染昆虫细胞扩增病毒)得到7、P2 重组杆状病毒株(>107pfu/ml)(滴定感染昆虫细胞)得到8、蛋白的表达培养昆虫细胞:一般指导:介绍:对于您的杆状病毒转移菌,我们推荐使用Sf9和Sf21昆虫细胞作为宿主。
在开始你的转化试验和表达之前,确定你有收获的Sf9和Sf21,并将其冻存。
使用无血清的介质:昆虫细胞可能在无血清的条件下收获。
我们推荐使用Sf900 ⅡSFM。
Sf900 ⅡSFM 对于维持Sf9 和Sf21以及对于大规模生产重组蛋白,都是无蛋白的最优的介质。
昆虫细胞培养参考指导:维持和传代昆虫细胞在贴壁和悬浮条件下冷冻细胞使用无血清的介质按比例增加细胞产量一般指导:昆虫细胞对于环境很敏感,此外化学和营养因素,物理因素都可以影响昆虫细胞的成长。
需要优化以得到最大产量。
考虑以下培养条件:*温度:细胞的感染和成长的最适合范围是27-28度*PH:对于许多培养系统6.1-6.4时合适的范围。
Sf900 ⅡSFM在此范围内支持一般的空气和开盖培养*同渗重摩:鳞翅类细胞使用介质的最优同渗重摩是345-380 mOsm/kg*通风:对于最优生长条件和蛋白的表达,昆虫细胞要求被动的通氧。
积极的通氧系统要求溶氧饱和在10%-50%*剪切力:悬浮培养产生机械剪切力。
生长的昆虫细胞在含有血清的介质中(10%-20% FBS),对于细胞的剪切力一般会得到足够的保护。
如果你的细胞在无血清条件下生长,加入剪切力保护剂例如PluronicF-68。
注意:在Sf900 ⅡSFM中生长的细胞不需要加入剪切力保护剂。
转染的细胞:你需要的是对数期的细胞>95%发育能力,可以完成成功的转染。
产生重组的pFastBac TM菌株(Vector)一般信息:介绍:为了产生包含目的基因的重组质粒,使用Bac-to-Bac杆状病毒表达系统,你需要使用限制酶消化和连接,将你的目的基因克隆进入pFastBac 菌的其中一种。
一般分子生物学技术:为了帮助限制酶消化和连接DNA的序列,需要其他一般的分子生物学技术扩增和保存质粒:pFastBac菌种和他的相应的表达对照质粒包含氨苄青霉素抗性基因,可以使用Ecoli进行Amp筛选。
为了扩增和保存pFastBac和pFastBac对照质粒,使用以下方法:1、使用载体株系感染一个recA ,endA Ecoli株,例如Top10,DH10B或者DH5α2、在含有100ug/ml Amp的LB琼脂糖平板选择转化株。
3、选择含有质粒的转化子制备甘油菌以便长期保存克隆进入pFastBac TM1介绍:为了帮助你设计策略克隆你的目的基因进入pFastBac TM1,参考以下建议和表格克隆考虑事项:pFastBac TM1菌株是非融合菌株(无融合标签)。
为了保证重组蛋白的表达,你的插入必须含有:*一个ATG起始密码子用于转录起始*一个终止密码子。
注意:终止密码子包含在所有三个阅读框中的多克隆位点中注意:重组蛋白的产生要求你的插入包含一个转录起始ATG。
一般来说,转移载体包含完整的PH引导序列,可以提高表达的产量。
蛋白翻译能够起始于多克隆位点上游突变的A TG(ATT),尽管如此,从这个位点起始的效率是低的,而且一般不干涉表达和重组蛋白的检测。
pFastBac TM1的多克隆位点:下图是pFastBac TM1的多克隆位点。
限制位点标出来以便显示实际切刻位点。
潜在的终止密码子下划线表示。
pFastBac TM1的全序列可以从网站下载。
pFastBac TM1的图谱和描述见后缀克隆进入pFastBac TM HT A,B,C介绍:pFastBac TM HT载体由三个读码框(A,B,C)提供的多克隆位点从而实现克隆目的基因,并且在N 端带有6XHis。
克隆:pFastBac TM HT菌株是融合菌株。
为了保证表达重组蛋白,你必须:*克隆你的基因要带有ATG,位于4050-4052碱基对间。
这个将会产生融合表达,带有6XHis标签,可以用TEV切除*你的插入要含有终止密码注意:重组蛋白的产生要求你的插入包含一个转录起始ATG。
一般来说,转移载体包含完整的PH引导序列,可以提高表达的产量。
蛋白翻译能够起始于多克隆位点上游突变的A TG(ATT),尽管如此,从这个位点起始的效率是低的,而且一般不干涉表达和重组蛋白的检测pFastBac TM HT A的多克隆位点:下图是pFastBac TM HT A的多克隆位点。
其实ATG用黑体标出。
限制性位点标出来以便显示实际切刻位点。
pFastBac TM HT B的多克隆位点:下图是pFastBac TM HT A的多克隆位点。
其实ATG用黑体标出。
限制性位点标出来以便显示实际切刻位点。
框住的核苷酸显示出的是易变区域。
pFastBac TM HT C的多克隆位点:下图是pFastBac TM HT A的多克隆位点。
其实ATG用黑体标出。
限制性位点标出来以便显示实际切刻位点。
框住的核苷酸显示出的是易变区域。
注意pFastBac TM HT C在Xba Ⅰ位点内有一个终止密码子,他在N端标签框内。
确定你的基因的5`端是在Xba Ⅰ位点上游开始。
克隆进入pFastBac TM Dual介绍:pFastBac TM Dual包含两个多克隆位点,可以同时表达两个异源基因,一个通过PH启动子控制,另一个通过P10启动子控制。
参见下列建议以便有助于你的基因克隆克隆事项:pFastBac TM Dual是一个非融合载体。
为了保证重组蛋白的表达,你的插入必须含有以下两点*一个ATG起始密码子*如果你不使用多克隆位点中的终止密码子,就必须要有一个终止密码子注意:重组蛋白的产生要求你的插入包含一个转录起始ATG。
一般来说,转移载体包含完整的PH引导序列,可以提高表达的产量。
对于插入克隆上游的聚乙烯启动子,注意到蛋白翻译能够起始于多克隆位点上游突变的ATG(ATT),尽管如此,从这个位点起始的效率是低的,而且一般不干涉表达和重组蛋白的检测。
