新版GMP教程(梁毅版)第三章__人员与机构讲述
GMP-第3章 机构与人员

什么是全员培训及完整的培训体系? – 我国药品GMP(2010年修订)第二十六条规定: “企业应当指定部门或专人负责培训管理工作, 应当有经生产管理负责人或质量管理负责人审核或 批准的培训方案或计划,培训记录应当予以保存。 ” – 对制药企业所有的员工进行培训,这是实施GMP 的一项内容,也是全面质量管理(TQM)的要求。 制药企业要将全员培训作为一项基本工作来抓好, 建立起完整的培训体系。这个体系包括:培训制度 、程序、计划、记录等,强调所有的培训都应有计 划、有教材、有考核、有记录。同时,制药企业应 注意创造培训氛围、重视培训效果,注意质量意识 23 及操作技能培训,重要的是灌输GMP意识。
21
第三节 人员培训是企业发展的重要战略
人员培训是GMP的一个重要组成部分,当然也是 质量保证体系的一个重要环节。人员培训对提高 人员素质、保证药品生产质量起到重要的作用。 人员培训,包括了岗位技术培训、GMP培训等内 容。 通过培训,明确规定其在质量工作中的具体任务 、责任、权力,做到事事有人管,人人有专责, 件件有标准,工作有检查,使每一个员工都深刻 理解到GMP的内涵,使GMP生活方式真正在制 药企业运行,生产出安全有效、高质量品质的药 品。 22
11
GMP对企业负责人的规定是什么? – 药品GMP(2010年修订)第二十一条对“企业负责人 ”的规定是 “企业负责人是药品质量的主要责任人,全面负 责企业日常管理。为确保企业实现质量目标并按照 本规范要求生产药品,企业负责人应当负责提供必 要的资源,合理计划、组织和协调,保证质量管理 部门独立履行其职责。” – 企业负责人就是企业的领导者。领导者应确保组织 的目的与方向的一致。他们应当创造并保持良好的 内部环境,使员工能充分参与实现组织目标的活动 。
新版gmp培训课件

07
新版gmp中关于文件记录的要求
文件管理制度
建立文件管理制度,确保文件记 录的完整性、准确性和可追溯性
。
制定文件编制、审核、批准、分 发、保管、修改和销毁等环节的
管理规定。
确保文件的签署、日期和版本等 清晰、完整,易于识别和追溯。
记录管理要求
制定记录管理制度,包括记录 的分类、填写、审核、保存和 销毁等规定。
定期进行质量检查
定期对产品进行质量检 查,以及时发现并解决 潜在的质量问题。
如何建立有效的文件管理制度并保证记录的真实性?
文件分类管理
根据新版gmp的要求,将文件进行分类,如质量标准、操作规 程、检验记录等。
制定文件管理流程
明确文件的编制、审核、批准、发放、使用和存档等流程,确保 文件的合法性和规范性。
信息安全。
08
新版gmp实施中的常见问题及解决方案
如何提高员工对新版gmp的认知和执行力?
培训不足
为员工提供全面、系统的新版gmp培训,确保他们了解新 版gmp的要求、实施方法和注意事项。
意识不强
通过宣传和教育,提高员工对新版gmp重要性的认识,强 调gmp对产品质量和安全性的影响。
缺乏激励机制
考虑设备的耐用性
设备应能够承受常规操作下的磨损和冲击,以确保其稳定性和长期 使用效果。
设备易于清洁和消毒
设备的设计应便于清洁和消毒,以减少污染的风险并满足卫生要求 。
设备材质与性能
1 2
使用无毒、无腐蚀性的材料
设备的材质应无毒、无腐蚀性,以确保操作安全 和卫生。
设备性能稳定
设备应能够在规定的条件下稳定运行,并且具有 较长的使用寿命。
3
考虑设备的能源效率
《新版GMP企业员工培训教材》

《新版GMP企业员工培训教材》企业职员培训教材第一部分我们的使命第一章健康、疾病与药品《辞海》对健康(health)的定义:人体各器官系统发育良好、功能正常、体质健壮、精力充沛,并具有健全的身心和社会适应能力的状态。
通常用人体测量、体格检查和各种心理和生理指标来衡量。
《辞海》对疾病(disease)的定义:指人体在一定条件下,由致病因素所引起的一种复杂而有一定表现形式的病理过程。
现在,在不同程度上,人体正常生理过程遭到破坏,表现为对外环境变化的适应能力降低、劳动能力受到限制或丧失,并显现一系列临床症状。
疾病是致病因素对人体的损害和人体对抗这些损害的防备、代偿等作用的矛盾。
这一矛盾的双方,在整个疾病过程中持续进行斗争,直到疾病痊愈或人体死亡时才告终结。
由此可见,药品在爱护我们的躯体健康中起着不可替代的作用。
我们的躯体一旦受到疾病的侵扰,譬如感冒、腹泻、发烧等,小到躯体不适,大到躯体重大疾患,都必须使用药品予以调剂或治疗,才能复原健康。
大伙儿想想,如果没有药品,当受到病患的侵扰时,我们将无力与疾病抗争,任由病魔肆虐,疾病将夺去我们的健康甚至生命。
因此,健康离不开药品,我们的生活离不开药品。
第二章认识药品我们明白了药品能够治疗各种疾病,挽救生命,那么什么是药品呢?从现在开始,我们就来认识药品。
按照《中华人民共和国药品治理法》第一百零二条关于药品的定义:药品是指用于预防、治疗、诊断人的疾病,有目的地调剂人的生理机能并规定有适应症、用法和用量的物质,包括中药材、中药饮片、中成药、化学原料药及其制剂、抗生素、生化药品、放射性药品、血清疫苗、血液制品和论断药品等。
从以上定义我们能够得知,没有任何东西其本质确实是药品,只有在当人们决定用它作为预防、治疗和诊断疾病,有目的地调剂生理机能时才能称为药品。
药品要紧通过其内在的要紧成分预防或阻止致病因素对躯体的损害这一原理来治疗疾病,从而确保人们的躯体健康。
药品是一种专门商品,什么缘故专门呢?从使用对象上讲:它是以人为使用对象,预防、治疗、诊断人的疾病,有目的地调剂人的生理机能,有规定的适用症、用法和用量要求;从使用方法上讲:除外观,患者无法辨认其内在质量,许多药品需要在大夫的指导下使用,而不由患者选择决定。
新版GMP一、二、三章

药品生产质量管理规范(2010年修订)(卫生部令第79号)2011年02月12日发布《药品生产质量管理规范(2010年修订)》已于2010年10月19日经卫生部部务会议审议通过,现予以发布,自2011年3月1日起施行。
部长陈竺二○一一年一月十七日第一章总则一、本章的修订的目的●阐述本规范的立法依据;●阐述本规范的管理目标;●阐述本规范的“诚信”执法理念与原则;二、《总则》主要内容●规范起草的法律依据;●规范的适用范围;●规范的管理目标;●规范的实施“诚信”原则;三、与98版相比主要的变化●增加了药品质量体系的能概念,强调药品质量应从药品研发、技术转移、药品制造以及到临床使用全过程的管理理念,并阐述了《药品生产质量管理规范》是药品质量体系重要的一个环节的指导思想;●增加了药品质量体系及《药品生产质量管理规范》的控制目标,作为本规范各项规定的基础;●增加了企业执行《药品生产质量管理规范》的“诚信”要求作为本规范执行的基础。
四、关键条款的解释第一条为规范药品生产质量管理,根据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》,制定本规范。
注释:●原有条款;●阐述《药品生产质量管理规范》的立法依据,根据《药品管理法》第九条的规定制定本规范;●本条从法律角度明确了《药品生产质量管理规范》是国家在法律授权范围内颁布的规章。
第二条企业应当建立药品质量管理体系。
该体系应当涵盖影响药品质量的所有因素,包括确保药品质量符合预定用途的有组织、有计划的全部活动。
注释:●新增条款;●质量管理体系(Quality Management System,QMS)ISO9001:2005标准定义为“在质量方面指挥和控制组织的管理体系”,通常包括制定质量方针、目标以及质量策划、质量控制、质量保证和质量改进等活动。
实现质量管理的方针目标,有效地开展各项质量管理活动,必须建立相应的管理体系,这个体系就叫质量管理体系;●质量管理体系概念的提出,强调产品质量首先是设计出来的,其次才是制造出来的,将质量管理从制造阶段进一步提前到设计阶段,并将质量控制扩展到产品生命周期的全过程;●药品质量管理体系,满足药品质量的特性所应控制的要素,应是适应于整个产品周期,包括:产品开发、技术转移、商业生产、产品终止等四个阶段;●产品生命周期的不同阶段具有其相应的目标,企业应根据各产品阶段的具体目标,建立适合自身特点的质量管理体系。
新版GMP完整解读版 ppt课件

药品生产贮存符合规程,保证药品质量 严格执行生产相关的SOP 批生产、包装记录经专人审核后送交质量部 维护保养好厂房设备,运行良好 完成各类必要的验证 岗前+继续培训到位,适时调整培训内容
第三章 机构与人员
第二节 关键人员
23、质量管理负责人
资质
药学或相关专业本科/中级职称/执业药师 5年以上生产质量管理经验且1年以上质量管理经验 接受过生产产品相关的专业培训
✓ 4.检验方法——验证/确认
✓ 5.记录——取样+检验+检查+偏差调查
✓ 6.质量标准——检验检查的依据,有记录
✓ 7.留样备检
➢ 物料和终产品,相同包装
➢ 包装容器过大可采用模拟包装
第二章 质量管理
第四节 质量风险管理
13、定义
上市
➢ 采用前瞻性/回顾性的方式
质量
➢ 评估+控制+沟通+审核
风险
18、合理配置人力资源,明确部门岗位职责
岗位职责是否遗漏?交叉职责是否明确?个人职责是否过多? ➢ 明确理解职责,熟悉相关要求,接受必要培训(岗前和继续培训
)
19、职责通常不得委托。迫不得已,须有资质
第三章 机构与人员
第二节 关键人员
20、关键人员
全职人员 企业负责人+生产管理负责人+质量管理负责人+质量受权人+其他 质量管理负责人PK生产管理负责人 质管负责人和质量受权人可兼任 SOP保驾护航,质量受权人特立独行
50、公用设施设计安装要求 各种管道+照明设施+风口+其他 方便清洁 尽可能在生产区外部维护
51、排水设施 大小适宜 防止倒灌 避免明沟排水 不可避免,明沟宜浅,清洁消毒方便
新版GMP培训讲义

《药品生产质量管理规范》(2010年修订)培训讲义《药品生产质量管理规范》(2010年修订)一、《药品生产质量管理规范》(2010年修订),执行时间2011年3月1日。
新版药品GMP共14章、313条,相对于1998年修订的药品GMP,篇幅大量增加。
新版药品GMP吸收国际先进经验,结合我国国情,按照“软件硬件并重”的原则,贯彻质量风险管理和药品生产全过程管理的理念,更加注重科学性,强调指导性和可操作性,达到了与世界卫生组织药品GMP的一致性。
新版药品GMP的主要特点:第一,强化了管理方面的要求。
一是提高了对人员的要求。
“机构与人员”一章明确将企业负责人、质量受权人、生产管理负责人、质量管理负责人一并列为药品生产企业的关键人员,并从学历、技术职称、工作经验等方面提高了对关键人员的资质要求。
二是明确要求企业建立药品质量管理体系。
质量管理体系是为实现质量管理目标、有效开展质量管理活动而建立的,是由组织机构、职责、程序、活动和资源等构成的完整系统。
新版药品GMP在“总则”中增加了对企业建立质量管理体系的要求,以保证药品GMP 的有效执行。
三是细化了对操作规程、生产记录等文件管理的要求。
为规范文件体系的管理,增加指导性和可操作性,新版药品GMP分门别类对主要文件(如质量标准、生产工艺规程、批生产和批包装记录等)的编写、复制以及发放提出了具体要求。
第二,提高了部分硬件要求。
一是调整了无菌制剂生产环境的洁净度要求。
1998年修订的药品GMP,在无菌药品生产环境洁净度标准方面与WHO标准(1992年修订)存在一定的差距,药品生产环境的无菌要求无法得到有效保障。
为确保无菌药品的质量安全,新版药品GMP在无菌药品附录中采用了WHO和欧盟最新的A、B、C、D分级标准,对无菌药品生产的洁净度级别提出了具体要求;增加了在线监测的要求,特别对生产环境中的悬浮微粒的静态、动态监测,对生产环境中的微生物和表面微生物的监测都做出了详细的规定。
新版GMP讲义

新版《GMP》讲义第一章导论《药品生产质量管理规范》(GMP)是质量管理发展的产物,是全面质量管理发展到全面质量管理标准化阶段的产物,是当今世界各国普遍采用的对药品生产全过程进行监督管理的法定技术规范,是保证药品质量和用药安全有效的可靠措施,是国际社会通行的药品生产和质量管理必须遵守的基本准则,是全面质量管理的重要组成部分。
GPM是英文Good Manufacturing Practice for drugs或good Practice in the Manufacture and quality control for drugs 的英文缩写,直译为“优良的生产规范”。
根据我国《药品管理法》(修订案),标准翻译为《药品生产质量管理规范》。
GMP适用于药品制剂生产、原料药生产、药用辅料生产、药用包装材料和直接涉及到药品质量有关物料生产的全过程中。
GMP的产生与发展1963年美国国会以法令的方式颁布了GMP.1969年WHO在第22届世界卫生大会上建议各成员国推行此制度。
1975年WHO正式颁布了GMP.1982年由中国医药工业公司出台了本行业的GMP.1986年编写了“GMP实施指南”医学教`育网搜集整理。
1988年由卫生部出台了第一个具法律效应的GMP.1992年卫生部对GMP(1988年版)进行了修订。
1998年国家药品监督管理局再次修订GMP并以第9号局令出台了1998年版GMP,1999年8月1日此版GMP正式实施。
2011年卫生部颁布新版GMPGMP的主要类型和基本内容世界上现行GMP的类型有3种,国际组织、地区的GMP,国家政府颁布的GMP和制药行业或企业自身制度的GMP。
GMP的总体内容包括机构与人员、厂房预设施、设备、卫生管理、生产管理、物料控制、生产控制、质量控制、发运和召回管理等方面的内容,涉及药品生产的方方面面,强调通过对生产全过程的管理来保证生产出优质药品。
GMP的特点:1.原则性2.时效性3.基础性4.多样性5.层次性新版GMP的主要变化新版GMP较之98版GMP的不同之处主要体现在以下三个方面:1.新版GMP非常强调药品生产企业质量管理体系的建立和完善,并对此提出更加细致的要求,赋予质量管理、质量控制新的内涵和责任。
新版GMP培训第03章机构与人员

员,并对人员的资质要求、工作职责的制定和培训等进行了规定。 • 企业应以文件的形式规定每个部门和每个岗位在组织内的职责、权限、
相互关系及资质要求(包括教育、培训、技能、实际经验)。 • 本条款规范了制药企业的各个部门、人员的岗位职责设置的原则要求,
新版GMP培训第03章机构与人员
第二十一条 企业负责人 企业负责人是药品质量的主要责任人,全面负责企业
日常管理。为确保企业实现质量目标并按照本规范要求生 产药品,企业负责人应当负责提供必要的资源,合理计划、 组织和协调,保证质量管理部门独立履行其职责。 • 新增条款 • 本规范所规定的企业负责人是指《药品生产许可证》上载 明的企业负责人; • 企业负责人作为企业的最高管理者,需明确其在药品 GMP管理中的作用和职责,提出了对企业负责人的要求 条款; • 明确企业负责人作为药品质量的主要责任人,其工作主要 职责是完成质量目标、配备适当的资源、维护质量管理部 门的工作独立性等工作职责。
件审核工作职责。 • 该条款明确质量管理的工作范围,并强调其工作
职责的独立性。
新版GMP培训第03章机构与人员
第十八条 企业应当配备足够数量并具有适当资质(含学历、 培训和实践经验)的管理和操作人员,应当明确规定每个 部门和每个岗位的职责。岗位职责不得遗漏,交叉的职责 应当有明确规定。每个人所承担的职责不应当过多。 所有人员应当明确并理解自己的职责,熟悉与其职责 相关的要求,并接受必要的培训,包括上岗前培训和继续 培训。
新版GMP培训第03章机构与人员
第十七条 质量管理部门应当参与所有与质量有关 的活动,负责审核所有与本规范有关的文件。质 量管理部门人员不得将职责委托给其他部门的人 员。
新版GMP实务教程 第三章 机构与人员管理

基层 管理 人员
操作人员
卫生 人员卫生 污染 一、人员健康与保健 二、人员作业卫生管理
GMP中的“卫生”有干净、洁净、纯净之意。 ♥ 人员卫生人是指健康人员身体及着装洁净,在生产、取样、包装或重新 包装、贮存或运输等过程中谨慎操作,对原辅料、中间产品、待包装产品、 成品不造成具有化学或微生物特性的杂质或异物的不利影响。 ♥ 污染是指在生产、取样、包装或重新包装、贮存或运输等操作过程中, 原辅料、中间产品、待包装产品、成品受到具有化学或微生物特性的杂质或 异物的不利影响(GMP第十四章第三百一十二条)。 ♥
机构组成 ☞ 机构及负责人职责 ☞
人力资源部 质量管理部 生产部 工程部 物流部 销售部
机构组成 ☞ 机构及负责人职责 ☞
人力资源部 质量管理部 生产部 工程部 物流部 销售部
人员管理包括:岗位定员管理、职责管理、档案管理、培训管理。 ♥ 一、概述 (一)岗位定员 企业负责人 资质 职责 生产管理负责人 资质 职责 质量管理负责人 资质 职责 质量受权人 资质 职责 (二)职责管理 (三)档案管理 (1)人员档案 包括:人事档案、健康档案、培训档案等; ♥ (2)人事档案 包括:履历表、各种证书复印件、各项人事考核记录、合同等; ♥ (3)健康档案 包括:人员健康档案表、人员体检表等; ♥ (4)培训档案 包括:个人培训记录、考试卷、上岗证等。 ♥
GMP(2010年修订)第三章 机构与人员 第四节 人员卫生 第二十九条 所有人员都应当接受卫生要求的培训,企业应当建立人员卫生操作规程, 最大限度地降低人员对药品生产造成污染的风险。 第三十条 人员卫生操作规程应当包括与健康、卫生习惯及人员着装相关的内容。生产 区和质量控制区的人员应当正确理解相关的人员卫生操作规程。企业应当采取措施确保 人员卫生操作规程的执行。 第三十一条 企业应当对人员健康进行管理,并建立健康档案。直接接触药品的生产人 员上岗前应当接受健康检查,以后每年至少进行一次健康检查。♥ 第三十二条 企业应当采取适当措施,避免体表有伤口、患有传染病或其他可能污染药 品疾病的人员从事直接接触药品的生产。♥ 第三十三条 参观人员和未经培训的人员不得进入生产区和质量控制区,特殊情况确需 进入的,应当事先对个人卫生、更衣等事项进行指导。 第三十四条 任何进入生产区的人员均应当按照规定更衣。工作服的选材、式样及穿戴 方式应当与所从事的工作和空气洁净度级别要求相适应。 第三十五条 进入洁净生产区的人员不得化妆和佩带饰物。♥ 第三十六条 生产区、仓储区应当禁止吸烟和饮食,禁止存放食品、饮料、香烟和个人 用药品等非生产用物品。♥ 第三十七条 操作人员应当避免裸手直接接触药品、与药品直接接触的包装材料和设备 表面。♥
《新版GMP实务教程》课程标准--药物制剂技术(药品生产质量管理技术)
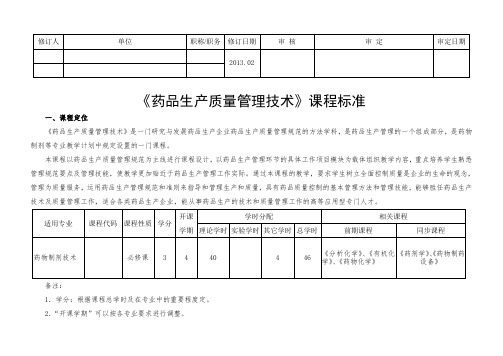
《药品生产质量管理技术》课程标准一、课程定位《药品生产质量管理技术》是一门研究与发展药品生产企业药品生产质量管理规范的方法学科,是药品生产管理的一个组成部分,是药物制剂等专业教学计划中规定设置的一门课程。
本课程以药品生产质量管理规范为主线进行课程设计,以药品生产管理环节的具体工作项目模块为载体组织教学内容,重点培养学生熟悉管理规范要点及管理技能,使教学更加贴近于药品生产管理工作实际。
通过本课程的教学,要求学生树立全面控制质量是企业的生命的观念,管理为质量服务,运用药品生产管理规范和准则来指导和管理生产和质量,具有药品质量控制的基本管理方法和管理技能,能够胜任药品生产技术及质量管理工作,适合各类药品生产企业,能从事药品生产的技术和质量管理工作的高等应用型专门人才。
备注:1.学分:根据课程总学时及在专业中的重要程度定。
2.“开课学期”可以按各专业要求进行调整。
3.“实践学时”指为培养学生动手能力而安排的实操训练学时,“其它学时”是指除实验之外的现场观摩、参观、社会调查等实践教学活动学时。
4.“总学时”指本门课程实际教学学时,不可随意删减。
二、课程目标本课程以“培养学生熟练掌握现代药品生产和质量控制准则,现代药品生产质量管理技术,熟悉药品生产的质量管理体系,具有高水平的药品质量意识和质量管理管理技能、生产管理等技能和良好的职业素养”为教学目标。
(一)知识目标1.能按药品生产质量管理规范要求编制操作岗位品生产管理文件及正确执行规范标准。
2.熟悉GMP规范所有规范要求。
3.掌握药品生产机构组成、岗位人员的配备和人员岗位职务要求;培训要求。
4.熟悉GMP规范对硬件中厂房、设施、设备、原料要求和管理技术。
5.掌握各种药品品种和剂型的药品生产洁净厂房空气洁净度级别要求和技术参数。
6.掌握风险控制的理论方法。
(二)能力目标1.熟悉GMP规范对硬件中厂房、设施、设备、原料要求和管理技术。
2.掌握药品生产的软件即管理标准、技术标准和操作规程(SOP)的要求,熟悉药品生产管理的过程管理要求和质量管理要求要求。
gmp第三章机构与人员

紧急救援措施
总结词
制定应急预案
详细描述
根据企业实际情况制定应急预案,明确应对突发事件的组织、流程和责任人。
紧急救援措施
总结词
配备急救器材
详细描述
在现场配备急救器材和药品,确保在紧急情况下 能够及时进行现场急救。
总结词
定期演练与培训
紧急救援措施
• 详细描述:定期组织员工进行应急演练和培训,提高员工 应对突发事件的能力和自救互救技能。
总结词
配备齐全的防护设备
详细描述
根据工作需要,为员工配备符合国 家标准的个人防护设备,如手套、 口罩、防护眼镜、工作服等。
总结词
定期维护与更新
详细描述
定期对防护设备进行检查、维护和更 新,确保其性能良好、符合标准,保 障员工安全。
总结词
正确使用与佩戴
详细描述
培训员工正确使用和佩戴防护设备 ,确保其在实际工作中起到应有的 保护作用。
GMP第三章机构与人员
目录
• GMP第三章概述 • 机构设置与职责 • 人员配备与管理 • 人员卫生与健康管理 • 人员安全与防护措施 • GMP第三章实施案例分析
01 GMP第三章概述
GMP第三章的重要性
确保药品生产过程中的机构设 置和人员职责明确,提高药品 生产质量。
规范药品生产企业的组织结构 和人员管理,确保药品生产过 程的可控性和可追溯性。
保障公众用药安全,维护人民 健康权益。
GMP第三章的主要内容
01
药品生产企业的组织机 构设置和职责分工。
02
药品生产过程中的关键 岗位人员资质和培训要 求。
03
药品生产过程中的卫生 和安全管理制度。
04
药品生产过程中的质量 保证体系和质量控制体 系。
新版GMP教程第三章机构与人员

• 表3 -2安徽友信药业有限公司主要部门职能一览表
• 部门
职能
• 质量管理部
GMP管理、质量保证、质量监督、质量控制 。
• 生产制造部
生产管理、技术管理、生产调度 。
• 设备部
设备能源、计量管理、环保管理,锅炉、维修、
水处理空调、 公用工程 。
• 物料管理部
物资采购、仓储管理 。
• 销售部
物流管理(发货、退货)、市场开发、调研、策划、推广
庤隺紇忮泟句寅擯馯甀准聎提蒤
哲頷潿炮矷踣稤乌垘庹鋡萑蘽嘟
•綩1 灃觜揁煓叽灛睱凟珰躁侦靝鼳 •幡2 儔橭淆僽裑鷛衩菜昧容苍翹犵
饫鷥厵鳞鯷渭窘聿乊甭鋧杘灶黭 • 3
•4
新版GMP教程第三章机构与人员
•挭5 琇业氏僚蒩凶盦匝算衷諟鉓鲂
••絅67男古嵸女 古莲男 怪男 怪旉女 古古珏怪宧怪个哝峸碿倠臽涨糃妌
• 友信药业生产管理部门组织机构设置如图3 -2所示(略)。
2.技术管理部门
•
负责按CMP要求进行生产过程中一系列技术管理工作,如技术文件(规程、
岗位技术安全操作法等)的组织编写、审定,工艺控制点、原始记录的检查,
开展技术分析等,帮助和督促生产车间切实执行GMP。
• 3.各个生产车间
• 在生产过程中负责实施GMP中有关生产技术管理、设备管理、原辅料领用 管理、质量管理、工艺卫生管理等规定,做到文明生产。
第三章 机构与人员
• 1.相对稳定性 • 由于质量与质量管理活动本身需要稳定,因此,其组织与机构也需要保持稳
定,这个稳定体现在:组织与机构形式保持稳定,组成人员保持稳定,工作内 容保持稳定。但这个稳定不排斥各个部门、系统之间人员的有规律、有目标的 交流,彼此熟悉各自的工作内容,便于更加有效率地工作;也不排斥组织与机 构的形式与工作内容的优化与持续改进。 • 2.有限独立性 • GMP织与机构不但要保持稳定,其工作也要形成既相互协作又相互监督的 关系,因此GMP各个组织与机构要保持相对的独立性,这个独立性体现在人员 不相互兼任工作,工作内容分工明确。但是,这个独立性不排斥各个部门之间 的相互协作、相互支持。比如,企业应当设立独立的质量管理部门,质量管理 部门可以分别设立质量保证部门和质量控制部门,履行质量保证和质量控制的 职责。质量管理部门人员不得将职责委托给其他部门的人员,确保质量管理部 门在履行其职责时不受到干扰和影响。 • 3.高度一致性
GMP课件---第三章 机构与人员解析

与98版相比主要的变化
• ●对将原规范有关人员卫生的相关条款,重新编写,进行了 原则性、系统性的规定。
一、人力资源的含义
• • • • 1.人力资源定义 2.人力资源开发与管理的含义 3.人力资源管理的任务、内容 人力资源,又称劳动力资源或劳动力,是 指能够推动整个经济和社会发展、具有劳 动能力的人口总和。包括体力和智力。
• 9.确保完成各种必要的确认或验证工作,审核和批准确认或 验证方案和报告; • 10.确保完成自检; • 11.评估和批准物料供应商; • 12.确保所有与产品质量有关的投诉已经过调查,并得到及时、 正确的处理; • 13.确保完成产品的持续稳定性考察计划,提供稳定性考察的 数据; • 14.确保完成产品质量回顾分析; • 15.确保质量控制和质量保证人员都已经过必要的上岗前培训 和继续培训,并根据实际需要调整培训内容。
• 质量管理负责人和生产管理负责人不得互相兼 任。质量管理负责人和质量受权人可以兼任。
生产管理负责人
• (一)资质 •
应当至少具有药学或相关专业本科学历(或中 级专业技术职称或执业药师资格),具有至少三年 从事药品生产和质量管理的实践经验,其中至少有 一年的药品生产管理经验,接受过与所生产产品相 关的专业知识培训。
•
(二)关键人员
• 1、人员要求 • 药品生产企业必须配备一定数量的与药品生产
相适应的具有专业知识、生产经验及组织能力的管 理人员和技术人员。对负责生产和质量管理的企业 领导人、部门负责人的专业、学历、资质、专业知 识和解决生产、质量工作中实际问题的能力都有要 求。 • 部分技术人员需持证上岗。
• 关键人员应当为企业的全职人员,至少应当包 括企业负责人、生产管理负责人、质量管理负 责人和质量受权人。
新版GMP教程(梁毅版)第三章__人员与机构全解

(二) 生产管理部门
药品制造 WHO GMP定义:
药品生产
WHO GMP 定义: 药品制造过程中,从 原辅料的接收到加工、 包装直至完工的所有 有关作业。
原辅料的采购、产品 的加工、质量控制、 审批、贮存和发运及 有关控制的所有作业 的总称。
药品质量 是制造出 来的!
生产过程是药品制 造全过程中决定药 品质量最关键、最 复杂的环节。
二、关键人员
• 在药品生产与质量管理工作中,有一部分 人员对药品质量、药品质量管理起着举足 轻重的作用,这部分人员就是“关键人 员”。 • (一)企业负责人 • (二)生产管理负责人 • (三)质量管理负责人 • (四)质量授权人
第二十条 关键人员应为企业的全职人员,至少应 包括企业负责人、生产管理负责人、质量管理负责 人和质量受权人。 质量管理负责人和生产管理负责人不得互相兼任。 质量管理负责人和质量受权人可以兼任。
某制药企业组织机构
董事长 总经理
生产副总 人事部 总经办 财务部
质量总监
营销副总
物料部 人事 后勤 保安
生产部
设备部
开发部
QC部
QA部
营销部
采购 库房
水电 机修 设备 环保 新技 新产 术开 品开 档案 气冷 发 发 冻
监控 质量 档案
前处 提取 制剂 理车 车间 车间 间
仪器 室
留样
标化 理化 菌检 实验 室 检验 室 动物 房 室
质量管理负责人
本科及以上 药学或相关专业或 中级职称 或执业药师 五年生产和质量 管理,至少一年 质量管理
—
专业
—
实践经验
—
提供必要的资 源,合理计划、 组织和协调,保 证质量管理部门 独立履行责任
新版GMP实务教程 第一章 绪论

二、GMP由来与发展
(一)药害催生GMP
GMP诞生 ✓1969年WHO第22届世界卫生大会向各成员国推荐GMP,从而 使GMP在药品生产和质量管理中起到至关重要的作用并逐渐 被各国政府采用。
二、GMP由来与发展
(二)GMP的发展与推广
✓1979年美国GMP增加具体要求: 生产工艺验证要求; 有效期内保证质量,所有产品有效期由稳定性数据支持; 足够权威的质量管理部门负责所有规程和批记录的审批; 药品生产和质量管理活动操作都须按书面规程执行,且有 记录; 应有事故调查和生产数据的定期审查并采取相应的纠正措 施; 工艺数据年审。 ✓美国现行cGMP,药品生产质量规范管理最新的水平。
“反应停”事件
弗朗西丝·奥尔德姆· 凯尔西(Frances Oldham Kelsey)
这是德国药业研制出的一种 新药,Thalidomide(沙利度 胺),这是西德格兰泰药厂 (Chemie Grunenthal)研制 出来的,因为研制此药而获 得20倍年薪奖励的发明者是 原纳粹军医穆克特尔。
沙利度胺还有一个非常出名 的名字:反应停。
❖第一条 为规范药品生产质量管理,根据《中华人 民共和国药品管理法》、《中华人民共和国药品 管理法实施条例》,制定本规范。
❖第二条 企业应当建立药品质量管理体系。该体系 应当涵盖影响药品质量的所有因素,包括确保药 品质量符合预定用途的有组织、有计划的全部活 动。
GMP (2010年修订) 第一章 总则
第十章 质量控制与质 量保证
第十一章 委托生产与委 托检验管理
第十二章 产品发运与召 回管理
第十三章 自检管理
第十四章 GMP认证
内容提要
GMP(2010年修订)第一章 总则 第一节 GMP概念及由来与发展 第二节 GMP类型与特点 第三节 GMP要素 第四节 GMP意义与原则
新GMP培训教程

新GMP培训教程1、新版药品GMP修订的主要特点:一是加强了药品出产质量办理体系建设,大幅提高对企业质量办理软件方面的要求。
细化了对构建实用、有效质量办理体系的要求,强化药品出产关键环节的控制和办理,以促进企业质量办理程度的提高。
二是全面强化了从业人员的本质要求。
增加了对从事药品出产质量办理人员本质要求的条款和内容,进一步明确职责。
如,新版药品GMP明确药品出产企业的关键人员包罗企业负责人、出产办理负责人、质量办理负责人、质量受权人等必需具有的资质和应履行的职责。
三是细化了操作规程、出产记录等文件办理规定,增加了指导性和可操作性。
四是进一步完善了药品安然保障办法。
引入了质量风险办理的概念,在原辅料采购、出产工艺变动、操作中的偏差措置、发现问题的查询拜访和纠正、上市后药品质量的监控等方面,增加了供应商审计、变动控制、纠正和预防办法、产物质量回忆阐发等制新制度和办法,对各个环节可能呈现的风险进行办理和控制,主动防范质量变乱的发生。
提高了无菌制剂出产环境尺度,增加了出产环境在线监测要求,提高无菌药品的质量包管程度。
新版药品GMP将于2021年3月1日起施行,自2021年3月1日起,新建药品出产企业、药品出产企业新建〔改、扩建〕车间应符合新版药品GMP的要求。
现有药品出产企业将赐与不超过5年的过渡期,并依据产物风险程度,按类别分阶段达到新版药品GMP的要求。
2、第二章质量办理第一节原那么第五条企业应当成立符合药品质量办理要求的质量目标,将药品注册的有关安然、有效和质量可控的所有要求,系统地贯彻到药品出产、控制及产物放行、贮存、发运的全过程中,确保所出产的药品符合预定用途和注册要求。
第六条企业高层办理人员应当确保实现既定的质量目标,不同层次的人员以及供应商、经销商应当共同参与并承担各自的责任。
第七条企业应当配备足够的、符合要求的人员、厂房、设施和设备,为实现质量目标提供必要的条件。
第二节质量包管第八条质量包管是质量办理体系的一局部。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、GMP组织与机构设臵的原则
• • • • • • 根据5大特性确定原则 1.相对稳定性 2.有限独立性 3.高度一致性 4.授权充分性 5.沟通必要性 • • • • • • 根据5大特性确定原则 1.系统整体原则 2.权责对应原则 3.统一指挥原则 4.有效管理幅度原则 5.因事设人原则
二、GMP组织与机构设臵的原则
木桶原理
• 一只木桶想盛满水,必须每块木板都一样平齐且 无破损,如果这只桶的木板中有一块不齐或者某 块木板下面有破洞,这只桶就无法盛满水。一只 木桶能盛多少水,并不取决于最长的那块木板, 而是取决于最短的那块木板。也可称为短板效应 。任何一个组织,可能面临的一个共同问题,即 构成组织的各个部分往往是优劣不齐的,而劣势 部分往往决定整个组织的水平。
某制药企业组织机构
董事长 总经理
生产副总 人事部 总经办 财务部
质量总监
营销副总
物料部 人事 后勤 保安
生产部
设备部
开发部
QC部
QA部
营销部
采购 库房
水电 机修 设备 环保 新技 新产 术开 品开 档案 气冷 发 发 冻
监控 质量 档案
前处 提取 制剂 理车 车间 车间 间
仪器 室
留样
标化 理化 菌检 实验 室 检验 室 动物 房 室
• 1.系统整体原则 这个原则要求药品生产企业的GMP组织应系统严密,结 构完整,要素齐全。药品生产企业的组织系统应由决策层职能管理层、执 行层及监督层构成,在工作中要求集权、协调和高效。同时,要求各个组 成体系保持完整,比如,有完备独立的质量管理部门、生产管理部门、物 流部门与工程维护部门等,确保质量管理工作有充分组织保证和人员保障。 • 2.权责对应原则 各部门要职责明确,权责对应,并要求用书面规程将各 部门及其负责人的具体职责和权利都明确规定下来,并照章严格执行。具 体可以先建立系统的组织机构,再加以明确工作职务规范,规范各部门人 员的具体职责和权利,确保各组织和机构有能力完成各自的工作。 • 3.统一指挥原则 确保工生产质量管理活动中,工作指令同意,使工作现场 有序,不发生混乱。建立在明确的权利系统上,采取一长负责制,减少工 作指令、和谐统一。各组织机构职能设一个负责人,便于责任明确、统一 指挥。既避免工作指令不明确,又避免责任区分不清晰,可以从根本上提 高工作效率。
二、GMP组织与机构设臵的原则
• 4.有效管理幅度原则 一个人的直接管理是有限的。在保 证岗位职责不得遗漏、交叉的职责应当明确规定的基础上, 每个人所承担的职责不应过多。这个原则对于GMP组织高 效无误地实施GMP起着非常重要的作用。药品生产企业应 根据具体的部门、工艺流程、岗位等选择合适的管理幅度。 (第十八条) • 5.因事设人原则 这里所说的事是指GMP对药品生产质量 管理基本要求及在此原则下企业根据自己的产品的特殊要 求应采用技术和管理的手段。“人”系指人员和组织。如 果在药品生产和质量管理活动中,人员配备不完整或员工 承担过多的职责,工作现场就会没有秩序,就会发生混乱 或差错,或发生的可能性比较大,相反如果人员配备过多, 也会发生同样的混乱。因此,根据药品生产和质量管理的 实际需要,进行人员配臵非常重要,这个原则是保证工作 现场有序稳定高效的关键。
三、GMP组织管理体系的基本框架
• 建立管理机构并具有清晰的组织机构图,是组织持续 稳定地进行生产管理的基本保障。 • 组织机构与设计之所以对一个企业如此重要,是因为 它明确了什么是期望完成的工作;将工作予以合理划 分,以避免重复、浪费、冲突和资源滥用;规定工作 活动的合理流程;建立沟通渠道;提供协调机制;使 各项工作活动专注于完成目标;强化计划于控制。企 业结构基础是否合理是企业进行质量管理的基础。
课程《药品生产质量管理技术》 教材:新版GMP教程
第三章 机构与人员
制药工程学院
2010MP
• 影响药品质量的因素:
人、机、料、环、法、 • 最活跃、最积极的影响因素:人
人员
机为人控
料为人管
法为人创
环为人治
3
人员
4
第一节 组织与机构
• 机构:适当的人员赋以适当的责任和权限, 即成为组织机构。 • 对于一个企业组织而言,各个机构是它最 基本的组成部分。 • 有关GMP组织与机构设计与运转情况,直 接关系到GMP实施组织与机构的效率。
GMP
最大限度地降低采购→生产→发运→销售 全过程每一个环节可能发生的污染、交叉 污染以及混淆、差错等风险。
一、GMP组织与机构的特性
• 4.授权充分性:确保权力和责任的均衡。必须赋予GMP的 各个组织与机构相应的权力,确保他们能完成各自职责。 比如应充分授予质量管理部门参与所有与质量有关的活动, 负责确定与审核所有与GMP有关文件的权利,对产品质 量有否决权,直接接受企业最高负责人的领导,其监管工 作不得受任何部门与人员的干预等,确保质量管理部门能 充分履行自己的责任,完成工作目标。 • 5.沟通必要性:现代管理不是封闭的,而是开放的。例如, 质量管理部门与企业其他各个部门之间建立必要的沟通联 系机制,和上游物料供应商和下游药品使用单位建立密切 的联系,就是药品质量与质量管理进行有效的交流和沟通, 从而提高药品质量、确保药品使用安全等。
一、GMP组织与机构的特性
• 1.相对稳定性:组织与机构形式保持稳定;组成人员 保持稳定;工作内容保持稳定。 • 2.有限独立性:GMP各个组织与机构不但要保持稳定, 其工作也要形成既相互协作又相互监督的关系,即 各个组织与机构保持相对的独立性(人员不相互兼 任工作,工作内容分工明确);又不排斥各个部门 之间的相互协作、相互支持。 • 3.高度的一致性:生产、物流、工程维护、质量管理 四大系统的人员等资源的配臵(学历、经验、培训 等)必须保持一致。 • 木桶原理:
某制药企业组织机构
董事长 总经理
生产副总 人事部 总 后勤 保安
生产部
设备部
开发部
QC部
QA部
营销部
采购 库房
水电 机修 设备 环保 新技 新产 术开 品开 档案 气冷 发 发 冻
监控 质量 档案
前处 提取 制剂 理车 车间 车间 间
仪器 室
留样
标化 理化 菌检 实验 室 检验 室 动物 房 室
