神经元的高尔基染色法(protocol)
高尔基染色中文说明书

下面是FD 快速高尔基染色试剂盒(PK401)中文版的说明书,仅供参考:FD Rapid GolgiStain TM KitFD快速高尔基染色试剂盒神经元和胶质细胞形态学研究的完整Golgi-Cox染色体系使用手册中文版PK401/PK401A仅用于体外研究不能用于诊断或其它用途I. 介绍Golgi-Cox浸染法是研究神经元和胶质细胞正常和非正常形态最有效的方法之一。
使用Golgi 技术,在药物处理过的动物脑中和因神经疾病死亡的病人脑中发现了神经树突和树突微小的形态改变。
然而Golgi染色法的不可靠性且费时已成为这种方法广泛应用的障碍。
FD Rapid GolgiStainTM Kit(FD快速高尔基染色法)是根据Ramón-Moliner,Glaser和Van der Loos所阐述的方法原理设计的。
该试剂盒不仅极大地改进并简化了Golgi-Cox技术,而且被证实在显示神经元和胶质细胞,尤其是树突棘的形态细节极为灵敏可靠。
启维益成的FD Rapid GolgiStainTM Kit已被广泛测试并用于数种动物脑及去世病人的脑。
II. 试剂盒组分室温保存PK401A PK401溶液A 125 ml 250 ml溶液B 125 ml 250 ml溶液C 125 ml x 2 250 ml x 2溶液D 125 ml 250 ml溶液E 125 ml 250 ml琉璃样品回收器 2 2天然毛画笔 2 2滴瓶 1 1塑料镊子 1 1使用手册 1 1III. 需要但未包括在试剂盒里的物品1. 双蒸水或Milli-Q水2. 塑料/玻璃管或瓶3. 组织学耗材:明胶包被的显微镜载玻片(Cat.#PO101)盖玻片染色罐乙醇二甲苯树胶封片剂Permount®光学显微镜IV. 安全操作注意事项1. FD Rapid GolgiStainTM Kit仅用于体外研究,不能用于诊断或其它应用。
2. 试剂盒所包含有试剂是有毒的,吸入或接触皮肤是有害的,如果吞咽可能是致命的。
全组织神经元高尔基法染色试剂盒产品说明书(中文版)

全组织神经元高尔基法染色试剂盒产品说明书(中文版)主要用途全组织神经元高尔基法染色试剂是一种旨在使用亲银还原技术,分析新鲜组织块里神经元(neuron)、锥体细胞(pyramidal cell)、胶质细胞(glia cell)、少突触胶质细胞(oligodendrocyte)和其它突起(process)尤其树突(dendrites)形态学的权威而经典的技术方法。
该技术经过精心改良传统方法、成功实验证明的。
主要适用于各种新鲜或冰冻脑组织的相关神经细胞检测。
广泛用于动物脑神经病理生理解剖学的研究。
产品严格无菌,即到即用,操作简捷,性能稳定,显色清晰。
技术背景意大利科学家高尔基(Camillo Golgi)于1873年发明了神经细胞黑色反应的浸银染色技术,从而开辟了神经系统形态结构、演变、单系发生、构建以及疾病等学科研究,并建立了神经学说。
脑神经组织经固定,亲银染色后,呈现部分神经细胞完全染色,而其它神经细胞没有任何着色的高度选择性染色。
产品内容固着液(Reagent A)200毫升氧化液(Reagent B)100毫升营养液(Reagent C)100毫升强化液(Reagent D)100毫升清理液(Reagent E)100毫升染色液(Reagent F)30毫升产品说明书1份保存方式保存在4℃冰箱里,避免光照;有效保证3月用户自备无菌手术刀和镊子:用于解剖动物脑组织小型玻璃染色缸或玻璃培养皿:用于组织处理的容器火棉胶(collodion):用于保护固着处理后的组织样品切片机:用于组织切片明胶化载玻片和盖玻片:用于切片后铺片光学显微镜:用于切片染色后观察分析实验步骤一、样本固着处理1.常规麻醉动物和手术(建议:使用生理盐水由心脏处灌注三次,每次60毫升,去除血液直至澄清)2.使用适量的固着液(Reagent A)灌注处理3.即刻小心取出脑组织4.小心放进到20毫升固着液(Reagent A)里5.室温下浸泡孵育1小时6.用无菌手术刀将脑组织切成0.5厘米厚的组织块7.即刻用无菌镊子夹起组织块8.小心转移到20毫升氧化液(Reagent B)里(20毫升/2块组织块)9.室温下浸泡孵育2周,避免光照10.小心转移到20毫升营养液(Reagent C)里11.室温下浸泡孵育48小时,避免光照12.小心转移到20毫升强化液(Reagent D)里13.室温下浸泡孵育48小时,避免光照(注意:可以孵育1周)14.用绵纸吸干组织快二、样本染色处理1.准备1个6孔细胞培养皿2.放进上述预处理的动物组织样本3.小心加入3毫升清理液(Reagent E),清洗组织样本4.室温下孵育2分钟5.小心抽去清理液6.重复实验步骤3至5一次7.加入3毫升染色液(Reagent F)到培养孔里,浸没整个组织(注意:出现明显沉淀,换液一次)8.室温下孵育24小时,直至呈现黑色,即刻终止,避免光照(注意:期间可以在显微镜下观察)9.小心抽去染色液(Reagent F)10.小心加入3毫升清理液(Reagent E),清洗组织样本11.室温下孵育2分钟12.小心抽去清理液13.(选择步骤)进行复染操作(建议使用甲苯酚紫(CRESYL VIOLET)复染试剂盒-HL80052)14.用绵纸吸干组织快15.即刻使用用户自备的火棉胶(collodion)包埋16.取出组织块,进行缓慢切片,为20至100微米厚,并铺片在明胶化载玻片上17.在一般光学显微镜下观察:神经元、锥体细胞、胶质细胞、少突触胶质细胞(椭圆形如同串珠)和其它突起,呈现黑色(如果复染――细胞核呈现蓝色,胞浆尼氏(体)物质呈现粉红至紫色)注意事项1.本产品为10次操作2.操作时,须戴手套3.染色液(Reagent F)避免光照4.建议使用玻璃染色缸或玻璃培养皿5.整个操作,在避光状态下进行6.染色完成后,铺片须使用明胶化载玻片,否则会掉片:第一用毛笔涂刷;第二保持湿润;第三用PARAFIN 包裹后压片7.切片建议100至200微米,过厚和过薄不利于检测神经细胞8.全组织染色存在其染色不均匀、组织内部染色渗透困难等局限9.样品染色后保存,避免光照10.本公司提供系列组织细胞神经系统成分染色试剂产品质量标准1.本产品经鉴定性能稳定2.本产品经鉴定显色清晰。
高尔基染色法原理

高尔基染色法原理
高尔基染色法是一种能够使细胞核染色的重要方法,它是由德国生物学家高尔基于1870年发明的。
该方法使用的染色剂是甲基绿和碘化苏丹红。
甲基绿首先将细胞染成绿色,然后用碘化苏丹红使部分细胞染成红色。
这样做减少了细胞核和细胞质之间的区别,使得检测它们之间的联系变得更加容易。
高尔基染色法的主要原理是,组成细胞核的DNA和RNA会与甲基绿结合形成绿色复合物,而细胞核的蛋白质会与碘化苏丹红结合形成红色的复合物。
但是,这种方法并不允许观察到细胞核中的细节结构,它只能看到一个细胞核是否已经在细胞中,以及相邻细胞之间的关系。
此外,染色还需要一些特定的条件,例如时间、温度和甲基绿和碘化苏丹红的浓度等。
高尔基染色法在生物学领域中应用广泛,可以用于研究细胞的形态和生理功能,也可以用于疾病的诊断和治疗。
例如,在癌细胞的研究中,高尔基染色法能够检测到细胞核的异型性,帮助诊断癌症和确定治疗方案。
总之,高尔基染色法是一种重要的工具,能够提供细胞核相关的有价值的信息。
在合适的条件下使用,它可以促进生物学研究和促进医学进步。
高尔基染色法原理

高尔基染色法原理
高尔基染色法是一种用于细胞核和染色体的染色方法,它是通过特定的染色剂将细胞核和染色体染色,从而使其在显微镜下能够清晰可见。
这种染色法在生物学研究中被广泛应用,能够帮助科研人员观察细胞核和染色体的形态、数量和结构,为细胞遗传学和细胞生物学研究提供了重要的技术手段。
高尔基染色法的原理主要包括以下几个方面:
首先,高尔基染色法利用了染色剂的亲和性。
染色剂是一种具有特异性亲和性的化学物质,它能够与细胞核和染色体中的特定成分结合,从而使其着色。
在高尔基染色法中,常用的染色剂包括甲苯胺蓝、伊红等,它们能够与DNA、RNA等核酸成分结合,使细胞核和染色体呈现出特定的颜色。
其次,高尔基染色法利用了酸碱性的原理。
细胞核和染色体中的DNA、RNA 等核酸成分具有不同的酸碱性,而染色剂对不同酸碱性的物质有着不同的亲和性。
通过调节染色剂的pH值和染色时间,可以使其选择性地染色细胞核和染色体中的特定成分,从而实现对细胞核和染色体的染色。
另外,高尔基染色法还利用了显微镜下的观察原理。
染色后的细胞核和染色体能够在显微镜下清晰可见,通过对其形态、数量和结构的观察,可以获取关于细胞遗传学和细胞生物学的重要信息。
这种染色方法为科研人员提供了一种直观、可靠的手段,帮助他们深入了解细胞核和染色体的性质和功能。
总的来说,高尔基染色法是一种基于染色剂的亲和性、酸碱性原理和显微镜观察原理的染色方法,它能够帮助科研人员清晰地观察细胞核和染色体的形态、数量和结构,为细胞遗传学和细胞生物学的研究提供了重要的技术支持。
在今后的生物学研究中,高尔基染色法将继续发挥重要作用,为人们对生命奥秘的探索提供有力的支持。
高尔基染色法

高尔基染色法
高尔基染色法(Golgi staining)是一种常用的生物染色技术,用于显示和研究细胞内的高尔基体(Golgi apparatus)。
高尔基体在细胞内扮演着非常重要的角色,负责对蛋白质进行加工、分类和运输。
高尔基染色法的原理是通过使用特殊的染料将高尔基体染成特定的颜色。
最常见的染料是硫酸氨基苯汞(ammonium mercuric thiocyanate),在染料处理后,高尔基体通常会呈现棕色或黑色。
步骤:
1. 样品制备:将需要染色的细胞样品固定在玻璃片上,通常使用甘氨酸或乙醇固定。
固定过程有助于保持细胞结构,以便进行染色。
2. 染色:将固定好的样品放入装有硫酸氨基苯汞的染色液中,染色时间通常为15-30
分钟。
3. 脱水:将染色好的样品放入不同浓度的乙醇溶液中进行脱水,逐渐增加乙醇浓度,直到样品中的水分完全被去除。
4. 封片:将脱水后的样品放入装有覆盖剂(如加拿大树胶)的载玻片上,并盖上盖玻片。
覆盖剂用于保护样品并防止染料扩散。
5. 显微镜观察:将封好的载玻片放在显微镜下观察,可以看到高尔基体呈棕色或黑色。
通过高尔基染色法,科学家们可以更好地了解高尔基体的形态、结构和功能,以及其在细胞内与其他细胞器之间的相互作用。
高尔基染色步骤

高尔基染色步骤高尔基染色(Giemsa staining)是一种常用的染色方法,可用于观察细胞核和染色体的结构,广泛应用于细胞学和遗传学研究中。
下面将详细介绍高尔基染色的步骤。
1. 准备工作在进行高尔基染色前,需要准备好以下材料:高尔基染色剂、显微镜玻片、试管、蒸馏水、显微镜等。
同时,确保实验室的工作台面和仪器是干净的,以避免污染样品。
2. 固定细胞将待染细胞固定在显微镜玻片上。
固定可以使用甲醛、乙醛或酒精等化学试剂进行。
固定的目的是保持细胞的形态结构和细胞内的染色体完整。
3. 染色将固定的细胞放入试管中,加入适量的高尔基染色剂。
高尔基染色剂是一种含有甲苯胺类染料的溶液,可以染色细胞核和染色体。
染色剂的浓度和染色时间可以根据实验需要进行调整。
4. 清洗将染色的细胞用蒸馏水洗净,以去除多余的染色剂。
可以轻轻摇晃试管,使水流冲洗细胞。
重复此步骤2-3次,直到洗涤液变清澈为止。
5. 干燥将洗净的细胞玻片放置在通风处晾干,或用吹风机低温吹干。
确保细胞完全干燥后,即可进行显微镜观察。
6. 显微镜观察将干燥的细胞玻片放置在显微镜上,调节镜头以获得适当的放大倍数。
通过显微镜观察细胞核和染色体的结构。
高尔基染色后,细胞核呈现出深紫色,染色体则呈现出条纹状或颗粒状。
通过以上步骤,我们可以成功地进行高尔基染色实验,观察细胞核和染色体的结构。
高尔基染色可以帮助研究人员更好地了解细胞的功能和遗传特性,对于细胞学和遗传学的研究具有重要意义。
值得注意的是,在进行高尔基染色实验时,需要注意以下几点:1. 染色剂的浓度和染色时间要根据实验需要进行调整,避免染色过度或不足。
2. 在固定细胞时,要确保细胞完全固定,以保持细胞的形态结构和染色体完整。
3. 洗净细胞时要充分清洗,以去除多余的染色剂。
4. 在显微镜观察时,要调节适当的放大倍数,以获得清晰的图像。
高尔基染色是一种常用的染色方法,可用于观察细胞核和染色体的结构。
通过准备工作、固定细胞、染色、清洗、干燥和显微镜观察等步骤,我们可以成功地进行高尔基染色实验,并获得有关细胞结构的重要信息。
高尔基染色法原理

高尔基染色法原理高尔基染色法是一种常用的细胞染色技术,它是通过对细胞进行染色,使细胞的结构和形态更加清晰可见,从而为细胞学研究提供了重要的帮助。
高尔基染色法的原理主要是利用染色剂与细胞内部的特定结构或化合物发生特异性的化学反应,从而使细胞部分区域染色,使其在显微镜下更容易观察和分析。
高尔基染色法的原理主要包括以下几个方面:1. 染色剂的选择,高尔基染色法使用的染色剂通常具有亲和性,能够与特定的细胞结构或化合物结合,形成可见的染色物质。
常用的染色剂包括伊红、结晶紫、甲苯紫等,它们能够与细胞内的核酸、蛋白质等发生化学反应,使细胞染色。
2. 细胞固定,在进行高尔基染色之前,需要对待染细胞进行固定处理,以保持细胞的形态和结构。
常用的固定剂包括甲醛、乙醛等,它们能够使细胞内的蛋白质和其他分子发生交联,从而固定细胞的形态。
3. 染色过程,在固定后的细胞中加入染色剂,经过特定的染色时间和染色条件,使染色剂与细胞内的特定结构发生反应,形成可见的染色物质。
不同的染色剂对不同的细胞结构具有特异性,因此可以选择合适的染色剂来染色特定的细胞结构。
4. 洗涤和封片,染色完成后,需要对细胞进行洗涤,去除多余的染色剂和固定剂,然后将细胞封在载玻片上,以便在显微镜下观察。
总的来说,高尔基染色法的原理是通过染色剂与细胞内的特定结构发生化学反应,使细胞染色,从而在显微镜下更清晰地观察和分析细胞结构和形态。
这种染色技术在生物学研究中具有重要的应用价值,为科学家们提供了强大的工具,帮助他们更深入地了解细胞的结构和功能。
在实际应用中,高尔基染色法不仅可以用于观察细胞的形态和结构,还可以用于细胞分类、研究细胞生理功能、病理诊断等方面。
因此,掌握高尔基染色法的原理和技术操作是非常重要的,它不仅可以帮助科研工作者开展细胞学研究,还可以在医学诊断和治疗中发挥重要作用。
总之,高尔基染色法作为一种重要的细胞染色技术,其原理简单清晰,应用广泛,为细胞学研究和临床诊断提供了重要的帮助。
猫神经节细胞高尔基体的固定与染色法

猫神经节细胞高尔基体的固定与染色法
猫神经节细胞高尔基体的固定与染色法是一种常用的细胞学方法,可以用于研究猫神经节细胞的结构、形态和功能。
固定和染色法的基
本步骤如下:
1. 准备细胞样本
从猫的大脑中切取猫神经节组织,随后将其悬浮在特定浓度的PBS液
体(磷酸缓冲溶液)中,以便下一步实验进行。
2.细胞固定
将细胞样本加入4%的甲醛溶液中,在室温下固定10-20分钟,以止血反应和凝胶化反应,让细胞固定于滑片表面。
3.细胞涂片
在涂片过程中,会使用高尔基体凝胶,3%蛋白溶剂等复合物悬浮液,
将固定后的猫神经节细胞转移到滑片上,并让涂片完全干燥。
4.染色
使用染色剂,比如组织胺嘌呤染色,混合液可以分别浸泡滑片30-60
分钟,或在室温下浸泡7-12小时进行染色,从而观察和分析猫神经节
细胞形态结构特征。
5. 细胞脱色
染色后的细胞可以用水或碱类溶液脱色,以此来减少影响观察的杂质。
6.完成染色
细胞脱色后,便可完成猫神经节细胞高尔基体的固定与染色,最终得
到细胞形态结构特征的完整图像。
Golgi Staining Protocol
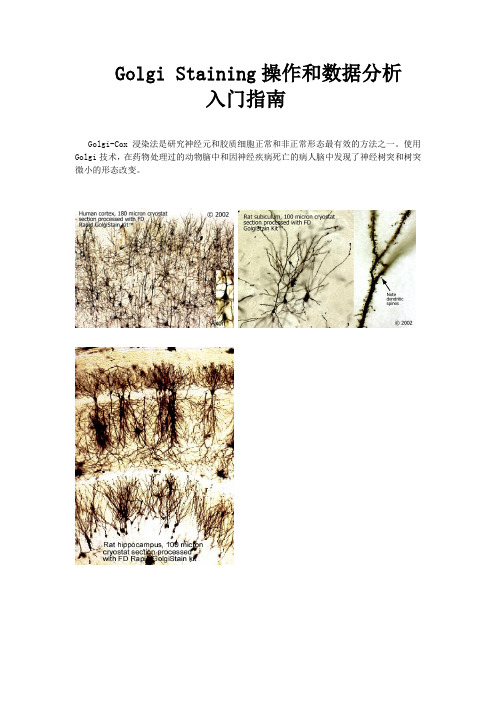
Golgi Staining操作和数据分析入门指南Golgi-Cox浸染法是研究神经元和胶质细胞正常和非正常形态最有效的方法之一。
使用Golgi技术,在药物处理过的动物脑中和因神经疾病死亡的病人脑中发现了神经树突和树突微小的形态改变。
Part A 高尔基染色原理:用重铬酸钾和铬酸钾,氯化汞作为初步固定剂浸润组织,铬盐和神经细胞中的蛋白质结合,氯化汞通过白色沉淀来标记单个细胞,进一步经过碱处理,使沉淀物变黑(硫化汞)。
该法最显著的特点是其反应终产物都局限于单个神经细胞的内部,而其周围去多类似的神经细胞不着色,从外观上看,就好像从固定到脱水的全过程在细胞膜水平都存在一个阻止可见产物扩散的屏障。
The beauty of the method lies in one of its shortcomings: the Golgi protocol stains only a few hundred neurons out of the millions present. Thus, it is possible to visualize neurons and trace their path and connections in the brain against a pale yellow background with unsurpassed clarity. Without this ability to stain the few select neurons, everything would have looked like a large black blob on the brain section.。
1.明胶玻片的制备高尔基染色的脑片较厚,如果使用普通玻片贴片,在染色过程中,脑片很容易从玻片上脱落下来,影响实验结果,对此需制备特殊明胶包被载玻片,以供高尔基染色使用。
方法:加热500 mL双蒸水,后加入10g明胶,搅拌溶解。
tunel染色方法

tunel染色方法图涅尔染色法:神经组织的神秘探索图涅尔染色法是一种先进的神经组织染色技术,为神经科学研究打开了一扇新窗口。
通过可视化神经元的复杂结构,它使科学家能够深入了解大脑的内在运作。
原理及机制图涅尔染色法的基础是甲苯胺蓝(TB)和高锰酸钾(KMnO4)的反应。
TB是一种阳离子染料,而KMnO4是一种氧化剂。
当这两种物质结合时,它们会产生一种不溶性的蓝色化合物。
神经元对图涅尔染色法具有特殊的亲和力,因为它们的细胞膜富含阴离子成分。
这些阴离子成分与TB阳离子相互作用,允许染料渗入神经元并与内膜结合。
染色步骤图涅尔染色法的过程涉及以下步骤:1. 固定:将组织固定在甲醛中以保持其结构。
2. 脱水:将组织通过一系列梯度乙醇进行脱水以去除水分。
3. 甲苯胺蓝染色:将组织浸泡在甲苯胺蓝溶液中,让染料渗透入神经元。
4. 高锰酸钾染色:将组织转移到高锰酸钾溶液中,使其与甲苯胺蓝反应形成蓝色化合物。
5. 分化:使用乙醇和二甲苯溶液洗涤组织以去除多余的染料。
6. 透明:将组织浸泡在二甲苯中使其透明,以便在显微镜下观察。
应用及重要性图涅尔染色法在神经科学研究中有着广泛的应用,包括:神经元形态学研究:可视化神经元的突触、树突和轴突,揭示神经网络的复杂性。
神经退行性疾病研究:识别和表征阿兹海默症、帕金森症等神经退行性疾病中的病变。
神经发育研究:追踪神经元的形成和成熟,了解大脑发育的机制。
神经可塑性研究:研究学习和记忆过程中神经网络的变化。
图涅尔染色法的独特之处在于它能够提供神经元的高对比度图像,突出显示其形态特征,同时保持组织的整体性。
这使得它成为神经科学研究中一个极其有价值的工具。
局限性尽管图涅尔染色法功能强大,但也有一些局限性:选择性:该方法对神经元具有特殊亲和力,但可能会错过神经胶质细胞和其他神经系统细胞。
灵敏度:它可能无法检测到非常细小的神经元或突触,导致可能低估神经网络的复杂性。
时间消耗:染色过程需要数小时到数天,这对于某些研究流程来说可能不切实际。
fd高尔基染色 中文说明书

fd高尔基染色中文说明书
一、产品简介
fd高尔基染色是一种常用的组织学染色技术,用于显示细胞内的不同结构。
该染色方法主要基于高尔基体的化学性质,能够将细胞内的不同成分进行区分和着色,从而帮助研究者更好地观察和研究细胞的结构和功能。
二、染色原理
fd高尔基染色主要利用高尔基体中的特殊化学成分进行染色。
高尔基体是细胞内的一种重要细胞器,负责蛋白质的加工和转运。
fd高尔基染色通过将细胞内的不同成分与特定的染料结合,从而产生不同的颜色反应,达到区分和着色的目的。
三、适用范围
fd高尔基染色适用于各种需要进行细胞内结构观察的实验和研究,尤其适用于神经科学、细胞生物学、病理学等领域的研究。
四、使用方法
1. 样品准备:将需要染色的组织或细胞样品进行固定、包埋、切片等处理,以便后续染色。
2. 脱蜡:将切片放入脱蜡缸中,按照规定程序进行脱蜡处理。
3. 染色:将脱蜡后的切片放入染色缸中,加入适量的fd高尔基染色液,按照规定程序进行染色处理。
4. 冲洗:将染色后的切片进行冲洗,去除多余的染料。
5. 观察:将切片放在显微镜下观察,记录染色结果。
五、结果观察
fd高尔基染色的结果观察需要借助于显微镜进行。
染色的结果显示为细胞内的不同成分呈现出不同的颜色。
研究者可以根据颜色变化来判断细胞内的不同结构和功能状态。
六、注意事项
1. 染色过程中应注意保持染色缸的清洁,避免污染。
2. 冲洗时要彻底去除多余的染料,以免影响观察结果。
3. 染色后的切片应保存在干燥、阴凉的地方,避免阳光直射和潮湿环境。
高尔基染色法原理

高尔基染色法原理
高尔基染色法是一种常用的细胞核染色方法,它可以使细胞核
更加清晰可见,方便观察和研究。
这种染色方法的原理主要是利用
染色剂与细胞核内的DNA结合,从而呈现出不同颜色的细胞核。
下
面我们就来详细了解一下高尔基染色法的原理。
首先,高尔基染色法的原理是基于DNA的亲和性染色。
DNA分
子是带负电的大分子,而染色剂是带正电的,因此染色剂会与DNA
分子发生静电作用,使得染色剂能够在细胞核内部结合并着色。
这
种亲和性染色的原理是高尔基染色法能够成功染色的关键。
其次,高尔基染色法的原理还与染色剂的成分有关。
高尔基染
色法使用的染色剂通常是甲苯胺蓝、伊红等,它们都是带正电的染
色剂。
这些染色剂在与DNA结合后,能够呈现出蓝色或红色的颜色,从而使细胞核清晰可见。
此外,高尔基染色法的原理还与染色过程中的酸性条件有关。
在高尔基染色法的染色过程中,通常会加入醋酸或盐酸等酸性溶液,这样可以使细胞核内的核蛋白质变性,从而更容易与染色剂结合,
使细胞核染色更加明显。
最后,高尔基染色法的原理还与染色后的显微镜观察有关。
在
染色后,需要用显微镜对细胞进行观察,这样才能看清细胞核的染
色情况。
因此,高尔基染色法的原理不仅包括染色过程中的化学作用,还包括染色后的显微镜观察。
总之,高尔基染色法的原理涉及到DNA与染色剂的亲和性作用、染色剂的成分、酸性条件以及显微镜观察等多个方面。
通过对这些
原理的深入了解,我们可以更好地掌握高尔基染色法的操作方法,
从而更准确地观察和研究细胞核的结构和功能。
神经元的高尔基染色法(protocol)

神经元的高尔基染色法(protocol)神经元的高尔基染色方法(protocol)针对神经元的Golgi-Cox染色方案和处理制作人:T racey Wheeler(George Mason Univesity)1.配置高尔基溶液(1L容量)A溶液:5%重铬酸钾溶液——重铬酸钾5g+蒸馏水200ml(最好在通风的情况下,用玻璃棒在烧杯中搅拌均匀)。
B溶液:5%升汞——升汞10g+蒸馏水200ml(最好在通风的条件下,用玻璃棒在烧杯中不断搅拌,适合加热直至溶解。
C溶液:5%铬酸钾溶液——铬酸钾8g+蒸馏水160ml(最好在通风情况下,用玻璃棒在烧杯中搅拌均匀)。
将A溶液和B溶液倒入500ml烧杯中搅拌均匀,C溶液倒入1000ml烧杯中,用400ml 蒸馏水稀释,在不断搅拌中缓慢将A、B混合溶液倒入C溶液中,保存在带有棉花塞子的玻璃瓶中熟化5天(黑暗中)。
备注:根据下面的比率以及需要配置溶液的量加以配置5体积的5%重铬酸钾5体积的5%升汞4体积的5%铬酸钾10体积的蒸馏水加入C溶液中2.将高尔基同业转入小玻璃瓶中用塑料吸管从大玻璃瓶中吸取高尔基溶液(尽量避免吸入红色沉淀物)放入小玻璃瓶中,大约为整瓶体积的3/4(剩下的容积足够容纳一只动物大脑)。
3.用盐水注射技术处死动物动物麻醉后,绑在空饲养盒子上(可以让血流入盒子中),打开胸腔暴露心脏,将0.9% 盐水60ml注入右侧心室底部(即动物的左心室),剪开左侧,心室底部(即动物的右心室),缓慢注入盐水,直至左侧的心室的血液全部消除(可能需要注射三次),断头取脑,放入配置好的高尔基溶液中,在黑暗中储存14天,2天后更换新鲜高尔基溶液。
4.将脑组织转入蔗糖溶液中蔗糖溶液:300g蔗糖+1000ml蒸馏水(用玻璃棒在烧杯中不断搅拌,适当加热直至溶解),然后放入冰箱中冷藏(一旦变冷即可使用)倒掉高尔基溶液,将脑组织在滤纸上轻轻吸干,用蒸馏水冲洗广口瓶,放入3/4蔗糖溶液(有足够空间容纳脑组织),然后将脑组织放入广口瓶中(脑组织会漂浮起来),放入冰箱储存。
高尔基染色

高尔基染色一. 实验原理重铬酸钾与硝酸银发生反应,生成黑色的铬酸银沉淀,由于组织的嗜银性而沉积于神经元中。
二. 药品、试剂、仪器药品和试剂:水合氯醛、重铬酸钾、40 %甲醛、硝酸银、火胶棉、二甲苯、梯度酒精、树胶、明胶仪器设备:输液器、染色缸、手术器械、Leica震荡切片机、毛笔三. 实验步骤1. 10 %水合氯醛以0.1 ml/10 g体重经腹腔麻醉小鼠。
一般2-3 min 后出现麻醉效应。
若个别小鼠麻醉效果不好,可少量追加麻药。
2. 灌注与固定用0.5 %亚硝酸钠的生理盐水溶液(现配现用)从小鼠左心室灌注,同时打开右心耳,至从右心耳流出的液体无血色(5-10 min),遂将灌注液换成l0 %甲醛生理盐水溶液继续灌注进行固定。
这一过程中前液使血管扩张,后液使组织充分固定。
因此,在灌注固定液时,宁可多用固定液使之充分将前液置换。
3.固定液灌注充分(约需200-300 ml)后,用血管钳夹住右心耳,静候1—2小时。
4. 打开血管钳,用下列媒染液灌注,至流出液显浓厚桔红色,再夹住右心耳静待1—2小时,至此已完成灌注过程。
媒染液配方;水合氯醛50 g重铬酸钾50 g蒸馏水400 mI待以上成分溶解后加40 %甲醛液100m1摇匀,最后加蒸馏水1000m1。
5.开颅取出所需组织。
用刀片将组织冠状切为厚约5 mm 的小块,仍用媒染液浸泡,置暗处避光,室温3天。
6.换瓶用1.5%硝酸银水溶液浸泡镀银,置暗处3(7)天。
每日换新银液一次(换新的瓶子,用锡箔纸包好,不能用镊子,用长的棉签杆),并及时摇动瓶,使镀银充分。
7.用火棉胶包埋组织块(1 min)后用Leica震荡切片机切为厚度为50μm (100-150um,50um效果不太好)的切片。
切片再浸于2%(3.5%)重铬酸钾水溶液漂洗10 min。
如果不长期储存,可以直接将组织放在载玻片,盖一个盖玻片,直接观察,但是必须当天做完,如果长期保存按下面操作进行。
高尔基染色和电镜观察突触

高尔基染色和电镜观察突触
高尔基染色和电镜观察是两种常用的神经科学研究方法,用于研究突触的结构和功能。
高尔基染色是一种组织染色技术,通过染色剂将神经元和突触等细胞结构显色,以便观察和分析。
这种染色方法可以提供有关突触的位置、数量和形态等信息。
通过高尔基染色,我们可以观察到突触的分布情况,了解突触之间的连接方式,并进一步研究突触在神经网络中的功能和重要性。
电镜观察是一种高分辨率显微镜技术,可以观察到更细微的细胞结构和突触的超微结构。
通过电镜观察,我们可以看到突触的精细结构,包括突触前膜、突触后密附区、突触小泡等。
此外,电镜还可以提供更详细的突触形态、突触间隙的大小和神经递质释放的过程等信息。
综合使用高尔基染色和电镜观察可以帮助科学家们更全面地了解突触的结构和功能,进而深入研究神经系统的工作原理和相关疾病。
这些方法在神经科学研究中起着重要的作用。
银染高尔基染色法用于神经元完整结构成像

银染高尔基染色法用于神经元完整结构成像周峰;蔡小青;汤乔伟;诸颖;王丽华;胡钧【期刊名称】《应用化学》【年(卷),期】2024(41)5【摘要】高尔基染色是神经元树突和树突棘可视化的经典方法,目前仍被广泛用于神经元形态可视化。
银高尔基染色目前存在易产生黑色沉淀、染色神经元形态结构不完整等问题。
对重铬酸钾(K_(2)Cr_(2)O_(7))和硝酸银(AgNO_(3))如何影响银染高尔基染色方法的染色效果进行了研究,通过研究染色液组成成分重铬酸钾、硝酸银质量浓度变化和组分的不同作用方式,实现了对银染高尔基染色方法的优化。
结果表明,35 mg/mL多聚甲醛(Paraformaldehyde,PFA)和20 mg/mLK_(2)Cr_(2)O_(7)混合液染色效果要明显优于20 mg/mL K_(2)Cr_(2)O_(7)单独染色效果,在K_(2)Cr_(2)O_(7)的质量浓度优化过程中,80 mg/mL K_(2)Cr_(2)O_(7)的染色效果最佳,35 mg/mL PFA与20 mg/mL K_(2)Cr_(2)O_(7)混合溶液和80 mg/mL K_(2)Cr_(2)O_(7)最佳染色时长比为3∶1,染色过程中AgNO_(3)的最佳质量浓度为10 mg/mL,在最终的染色液组成成分以及作用方式中40 mg/mL PFA固定2 d、35 mg/mL PFA和20 mg/mL K_(2)Cr_(2)O_(7)混合溶液处理3 d、80 mg/mL K_(2)Cr_(2)O_(7)处理1 d和10 mg/mL AgNO_(3)处理5 d对脑组织神经元形态的可视化具有最佳效果。
优化后的银染高尔基染色方法可实现对神经元的完整形态结构染色,同时在染色过程也将产生更少的成像杂质沉淀噪点。
该工作将提供一种新的高尔基改良染色方法,实现神经元完整形态结构的染色,有望为研究脑神经元结构变化与脑疾病之间的关系提供新的染色方法。
神经组织切片技术

神经组织切片技术目录绪论固定切片神经组织染色第一章石蜡切片一、取材二、固定三、脱水透明四、浸蜡包埋五、切片第二章火棉胶切片一、取材固定二、脱水三、浸胶四、包埋五、切片第三章苏木精-伊红染色第四章神经元(神经细胞)第一节神经元胞体和突起高尔基(Golgi)法Golgi法Bubenaite法Cox法第三节轴突(轴索,正常轴突、变性轴突)Nauta和Gygax法染变性轴突和正常轴突Davenport石蜡切片銀浸法第四节神经原纤维Gros-Bieschowsky染色法Bielschoesky染色法Bielchowsky整块染色法Bielchowsky吡啶整块染色法Ramon Y Cajal神经原纤维染色法Cajal Ⅰ法Cajal Ⅱ法Cajal Ⅲ法Cajal Ⅳ法Cajal Ⅴ法Cajal Ⅵ法Bethe甲苯胺蓝染色法第五节尼氏体Nissl染色长期固定于甲醛液的陈旧标本染色法Killer焦油紫染色法Clrak & Sterry硫堇法Einarson没食子蓝法石炭酸硫堇染色法第六节突触高尔基-坚聂克原法第五章神经胶质细胞Mallory磷钨酸苏木精染色法Ramon Y Cajal氯化金升汞法Del Rio –Horlega改良法(Penfield)第六章神经纤维和神经末梢第一节神经纤维Bodian法水合氯醛银浸法水合氯醛银浸法Naura Gygax法Ranson吡啶銀法显示无髓神经纤维锇酸法Ranvier结石蜡切片法第二节髓鞘和变性髓鞘一、髓鞘Weigert法Well法Spielmeyer法染冰冻切片Luxol Fast blue染色法Luxol Fast blue-Holmes硝酸銀法苏丹黑B染色法二、变性髓鞘Marchi锇酸法Donaggio苏木精法第三节溃变纤维Swank-Davenport法Nauta(1957)法Fink-Heimer(1967)Ebbesson-Robinson双重銀法(1970) 第四节神经末梢一、肌梭蚁酸-氯化金法二、运动终板Lowit蚁酸法蚁酸-氯化金法蚁酸-氯化金法Cole法Gray法三、触觉小体Ranvier蚁酸法四、环层小体蚁酸-氯化金法五、腱梭Ranvier改变法六、游离神经末梢吡啶銀法显示毛囊神经末梢De Castro内耳双极神经元显示法胚胎性神经组织改良銀染法(Rager等)H.F.Glassner心脏神经纤维镀银法(1954)Cajal改良Golgi视网膜神经元铬銀法七、肌间神经丛铅盐镀染法肠肌丛显示法小肠纵行肌铺片法眼球肌或肋间肌Lowit蚁酸法附:电镜标本制作绪论固定中枢神经系统(脑、脑干及脊髓)固定根据需要有两种形式:脑、脊髓组织柔软(尤其是幼小动物及胚胎)及结构细致,最好用整体固定法。
活神经元荧光染色的新方法

活神经元荧光染色的新方法刘畅;周雪;章为【期刊名称】《四川解剖学杂志》【年(卷),期】2001(009)001【摘要】@@ 1 概述rn自一百多年前Golgi法诞生至今,神经元的染色技术一直在神经生物学研究中发挥着重要的作用.Golgi法的成功在于使组织中2%的神经元被完整标记,从而可在厚切片中清楚地观察单个细胞及其间的连接,并且不因为其他染色细胞的影响而变得模糊. 继之,Ehrlich法用美蓝对神经组织染色,得到了与Golgi法相似的效果 [1].但上述方法都难以根据研究的要求, 对特定的神经元标记[2].后来,在Golgi法基础上发展起来的Wigert 法(特异地对髓鞘染色)以及Marchi 法和Nauta法(标记变性轴突)则为追踪轴突的走行,研究神经传导通路提供了工具[1].【总页数】4页(P11-14)【作者】刘畅;周雪;章为【作者单位】华西医科大学组织学研究室,;华西医科大学组织学研究室,;华西医科大学组织学研究室,【正文语种】中文【中图分类】R3【相关文献】1.荧光染色剂Calcofluor White在活检组织中真菌染色的应用 [J], 杨通;何炼图;陈涛;谭亚夏2.环丙沙星铽荧光配合物与DNA的相互作用及染色新方法 [J], 杨军;任宇;徐怡庄;苏允兰;张莉;刘智;王凡;杨丽敏;王晶;高宏成;叶放;吴瑾光3.鉴别直肠组织癌变的环丙沙星铽络合物荧光染色新方法 [J], 孟涛;徐端夫;赵莹;王笃金;徐怡庄;齐剑;吴瑾光4.异质性荧光染色的巨噬细胞功能研究──Ⅱ.异质性荧光染色的巨噬细胞过氧化物酶活性 [J], 梁玉;任怡敏;许屏;白岚5.异质性荧光染色的巨噬细胞功能研究I.异质性荧光染色的巨噬细胞吞噬活性[J], 任怡敏;许屏;梁玉;梁从云;王世忠因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
神经元的高尔基染色方法(protocol)
针对神经元的Golgi-Cox染色方案和处理
制作人:T racey Wheeler(George Mason Univesity)
1.配置高尔基溶液(1L容量)
A溶液:5%重铬酸钾溶液——重铬酸钾5g+蒸馏水200ml(最好在通风的情况下,用玻璃棒在烧杯中搅拌均匀)。
B溶液:5%升汞——升汞10g+蒸馏水200ml(最好在通风的条件下,用玻璃棒在烧杯中不断搅拌,适合加热直至溶解。
C溶液:5%铬酸钾溶液——铬酸钾8g+蒸馏水160ml(最好在通风情况下,用玻璃棒在烧杯中搅拌均匀)。
将A溶液和B溶液倒入500ml烧杯中搅拌均匀,C溶液倒入1000ml烧杯中,用400ml 蒸馏水稀释,在不断搅拌中缓慢将A、B混合溶液倒入C溶液中,保存在带有棉花塞子的玻璃瓶中熟化5天(黑暗中)。
备注:根据下面的比率以及需要配置溶液的量加以配置
5体积的5%重铬酸钾
5体积的5%升汞
4体积的5%铬酸钾
10体积的蒸馏水加入C溶液中
2.将高尔基同业转入小玻璃瓶中
用塑料吸管从大玻璃瓶中吸取高尔基溶液(尽量避免吸入红色沉淀物)放入小玻璃瓶中,大约为整瓶体积的3/4(剩下的容积足够容纳一只动物大脑)。
3.用盐水注射技术处死动物
动物麻醉后,绑在空饲养盒子上(可以让血流入盒子中),打开胸腔暴露心脏,将0.9% 盐水60ml注入右侧心室底部(即动物的左心室),剪开左侧,心室底部(即动物的右心室),缓慢注入盐水,直至左侧的心室的血液全部消除(可能需要注射三次),断头取脑,放入配置好的高尔基溶液中,在黑暗中储存14天,2天后更换新鲜高尔基溶液。
4.将脑组织转入蔗糖溶液中
蔗糖溶液:300g蔗糖+1000ml蒸馏水(用玻璃棒在烧杯中不断搅拌,适当加热直至溶解),然后放入冰箱中冷藏(一旦变冷即可使用)
倒掉高尔基溶液,将脑组织在滤纸上轻轻吸干,用蒸馏水冲洗广口瓶,放入3/4蔗糖溶液(有足够空间容纳脑组织),然后将脑组织放入广口瓶中(脑组织会漂浮起来),放入冰箱储存。
脑组织一旦下沉,就可以准备切片。
5.使用振动切片机切片
将刀片在二甲苯中浸泡5min去除油脂后(在通风条件下),取出擦干。
配制6%的蔗糖溶液(蔗糖6g+100ml蒸馏水),在室温和低于室温下保存。
将6%蔗糖溶液倒入振动切片机的储存室直至刀片被覆盖。
将脑组织(直到整个大脑的1/2)用强力胶固定在振动切片机的平台上(需要5~7min或更长时间,以确保组织在切片上被粘牢)。
然后将粘有脑组织的平台插入储存室。
将切片机的速度和幅度均调至中点(可根据不同的仪器和安全要求进行操作),在200μm或需要的厚度处切片(超过400μm的切片分析有困难)。
用小画笔将切片移动到明胶化的玻璃片上。
用石蜡膜覆盖组织。
玻片比较平的一面用吸水海绵覆盖,石蜡膜一侧也用吸水海绵覆盖,用手掌轻轻压,尽量不要移动位置(目的是将组织切片压在玻片的明胶上,在染色过程中能够粘附在玻片上),取掉海绵纸将玻片在湿润的环境中。
6. 染色
配置新鲜的溶液(足够覆盖所有玻片)
蒸馏水(3体积)
氨水(1体积,在通风环境下)
柯达固定液(1体积,在通风条件下,黑暗中)
50%乙醇(1体积)
70%乙醇(1体积)
95%乙醇(1体积)
100%乙醇(3体积)
CXA溶液(1体积)
柯达固定液:将所有成分放在烧杯中,按顺序混合(避光)
加1010ml蒸馏水,加251ml柯达固定液A,加28ml柯达固定液B,加2020ml蒸馏水。
(可根据需要每次配1/2或1/3)
CXA溶液:1000ml氯仿+1000ml二甲苯+1000ml乙醇(可根据需要每次配1/2或1/3,必要的话揭掉玻片上的石蜡膜,将玻片放入玻璃托盘通过以下环节染色
⑴用蒸馏水冲洗1min
⑵氢氧化铵溶液中浸泡30min(黑暗中)
⑶用蒸馏水冲洗1min
⑷柯达固定液浸泡30min(黑暗中)
⑸用蒸馏水冲洗1min(只要在水中就可以开灯)
⑹用50%乙醇脱水1min
⑺用70%乙醇脱水1min
⑻用95%乙醇脱水1min
⑼用100%乙醇脱水5min
⑽用100%乙醇脱水5min
⑾用100%乙醇脱水5min
⑿在CXA溶液中放置15min(在通风条件下,玻片保存在CXA溶液中,当盖片时,依次取出玻片)
备注:经常换手套,在CXA溶液中手套易破裂
7.用中性树胶盖玻片,然后晾干
如果可能所有的玻片都应该在通风环境下盖片,玻片应该在通风情况下平放保存24h,依次从CXA溶液中取出玻片,用玻璃滴管在组织上滴两滴中性树胶(切片很快就变干,不要提前从CXA溶液中取出玻片,在空气中的时间不要超过20秒)。
将盖玻片在切片上,尽量避免产生气泡。
备注:中性树胶太少组织会变干,太多会使盖玻片滑动。
将玻片放在吸水纸上(通常在鼠笼中使用白色的托盘衬垫),让玻片平放24h,然后玻片放在盒中保存(盒一定要打开)6个月才能进行分析。
