上海大学 上大 2001年有机化学二 考研真题及答案解析
大二有机化学习题答案

第二章烷烃1,用系统命名法命名下列化合物(1)2,3,3,4-四甲基戊烷(2)3-甲基-4-异丙基庚烷(3)3,3,-二甲基戊烷(4)2,6-二甲基-3,6-二乙基辛烷(5)2,5-二甲基庚烷(6)2-甲基-3-乙基己烷(7)2,2,4-三甲基戊烷(8)2-甲基-3-乙基庚烷2,试写出下列化合物的结构式(1) (CH3)3CC(CH3)2CH2CH3 (2) (CH3)2CHCH(CH3)CH2CH2CH2CH3 (3) (CH3)3CCH2CH(CH3)2 (4) (CH3)2CHCH2C(CH3)(C2H5)CH2CH2CH3 (5)(CH3)2CHCH(C2H5)CH2CH2CH3 (6)CH3CH2CH(C2H5)2(7) (CH3)2CHCH(CH3)CH2CH3 (8)CH3CH(CH3)CH2CH(C2H5)C(CH3)3 3,略4,下列各化合物的系统命名对吗如有错,指出错在哪里试正确命名之.均有错,正确命名如下:(1)3-甲基戊烷(2)2,4-二甲基己烷(3)3-甲基十一烷(4)4-异丙基辛烷(5)4,4-二甲基辛烷(6)2,2,4-三甲基己烷5,(3)>(2)>(5)>(1) >(4)6,略7,用纽曼投影式写出1,2-二溴乙烷最稳定及最不稳定的构象,并写出该构象的名称.8,构象异构(1),(3) 构造异构(4),(5) 等同)2),(6)9,分子量为72的烷烃是戊烷及其异构体(1) C(CH3)4 (2) CH3CH2CH2CH2CH3 (3) CH3CH(CH3)CH2CH3 (4) 同(1) 10, 分子量为86的烷烃是己烷及其异构体(1) (CH3)2CHCH(CH3)CH3 (2) CH3CH2CH2CH2CH2CH3 ,(CH3)3CCH2CH3(3)CH3CH2CH(CH3)CH2CH3 (4)CH3CH2CH2CH(CH3)214, (4)>(2)>(3)>(1)第三章烯烃1,略2,(1)CH2=CH— (2)CH3CH=CH— (3)CH2=CHCH2—3,(1)2-乙基-1-戊烯(2) 反-3,4-二甲基-3-庚烯(或(E)-3,4-二甲基-3-庚烯(3) (E)-2,4-二甲基-3-氯-3-己烯(4) (Z)-1-氟-2-氯-2-溴-1-碘乙烯(5) 反-5-甲基-2-庚烯或(E)-5-甲基-2-庚烯(6) 反-3,4-二甲基-5-乙基-3-庚烯(7) (E) -3-甲基-4-异丙基-3-庚烯(8) 反-3,4-二甲基-3-辛烯4,略5,略6,7,活性中间体分别为:CH3CH2+ CH3CH+CH3 (CH3)3C+稳定性: CH3CH2+ > CH3CH+CH3 > (CH3)3C+反应速度: 异丁烯> 丙烯> 乙烯8,略9,(1)CH3CH2CH=CH2 (2)CH3CH2C(CH3)=CHCH3 (有顺,反两种)(3)CH3CH=CHCH2CH=C(CH3)2 (有,反两种)用KMnO4氧化的产物: (1) CH3CH2COOH+CO2+H2O(2)CH3CH2COCH3+CH3COOH(3) CH3COOH+HOOCCH2COOH+CH3COCH310,(1)HBr,无过氧化物(2)HBr,有过氧化物(3)①H2SO4 ,②H2O(4)B2H6/NaOH-H2O2 (5)①Cl2,500℃②Cl2,AlCl3(6)①NH3,O2 ②聚合,引发剂(7)①Cl2,500℃,②Cl2,H2O ③NaOH11,烯烃的结构式为:(CH3)2C=CHCH3 .各步反应式略12,该烯烃可能的结构是为:13,该化合物可能的结构式为:14,(CH3)2C=CHCH2CH2C(CH3)=CHCH3 及CH3CH=CHCH2CH2C(CH3)C=C(CH3)2以及它们的顺反异构体.15,①Cl2,500℃②Br2,炔烃二烯烃1,略2,(1)2,2-二甲基-3-己炔(或乙基叔丁基乙炔) (2) 3-溴丙炔(3) 1-丁烯-3-炔(或乙烯基乙炔)(4) 1-己烯-5-炔(5) 2-氯-3-己炔(6 ) 4-乙烯基-4-庚烯-2-炔(7) (3E)-1,3,5-己三烯3,(7) (CH3)3C—C≡CCH2CH34,(1) CH3CH2COOH+CO2 (2) CH3CH2CH2CH3 (3) CH3CH2CBr2CHBr2 (4) CH3CH2C≡CAg (5) CH3CH2C≡CCu (6)CH3CH2COCH35,(1)CH3COOH (2)CH2CH=CHCH3 , CH3CHBrCHBrCH3 , CH3C≡CCH3 (3) [CH3CH=C(OH)CH3] , CH3CH2COCH3 (4) 不反应6,(1) H2O+H2SO4+Hg2+ (2) ①H2,林德拉催化剂②HBr (3) 2HBr(4) ①H2,林德拉催化剂②B2H6/NaOH,H2O2 (5) ①制取1-溴丙烷(H2,林德拉催化剂;HBr,ROOH ) ②制取丙炔钠(加NaNH2) ③CH3CH2CH2Br+CH3C≡Can7,8,(1) CH2=CHCH=CH2+ CH≡CH (2) CH2=CHCH=CH2 + CH2=CHCH=CH2 (3) CH2CH=C(CH3)=CH2 + CH2=CHCN(2) 可用(1)中制取的1-丁炔+ 2HCl(3) 可用1-丁炔+ H2,林德拉催化剂,再加HBr + ROOH10,11,(1) ①Br2/CCl4 ②银氨溶液(2) 银氨溶液12,(1) 通入硝酸银的氨溶液中,乙炔迅速生成乙炔银沉淀而除去.(2) 用林德拉催化剂使乙炔氢化为乙烯.13,(1) 1,2-加成快,因为1,2-加成活化能低于1,4-加成活化能.(2) 1,4-加成产物比1,2-加成产物的能量低,更稳定.14,可利用"动力学控制"和"热力学控制"理论解释.15,此烃为: CH2=CHCH=CHCH=CH2 (有顺反异构体)第五章脂环烃1,(1)1-甲基-3-异丙基环己烯(2)1-甲基-4-乙烯基-1,3-环己二烯(3)1,2-二甲基-4-乙基环戊烷(4)3,7,7-三甲基双环[4.1.0]庚烷(5)1,3,5-环庚三烯(6)5-甲基双环[2.2.2]-2-辛烯(7)螺[2.5]-4-辛烯3,略4,(1),)2),(3)无(4)顺,反两种(5)环上顺反两种,双键处顺反两种,共四种(6)全顺,反-1,反-2,反-4 共四种5,6,7,该二聚体的结构为:(反应式略) 8,9,单环芳烃1,略2,3,(1)叔丁苯(2)对氯甲烷(3)对硝基乙苯(4)苄醇(5)苯磺酰氯(6)2,4-二硝基苯甲酸(7)对十二烷基苯磺酸钠(8)1-对甲基苯-1-丙烯4,(1)①Br2/CCl4 ②加浓硫酸(或HNO3+H2SO4)(2)①Ag(NH3)2NO3 ②Br2/CCl46,(1)AlCl3 ClSO3H7,(1)A错,应得异丙苯;B错,应为氯取代α-H .(2)A错,硝基苯部发生烷基化反应;B错,氧化应得间硝基苯甲酸.(3)A错,-COCH3为间位定位基;B错,应取代环上的氢.8,(1)间二甲苯> 对二甲苯> 甲苯> 苯(2)甲苯> 苯> 溴苯> 硝基苯(3)对二甲苯> 甲苯> 对甲苯甲酸> 对苯二甲酸(4)氯苯> 对氯硝基苯> 2,4-二硝基氯苯9,只给出提示(反应式略):(1)4-硝基-2-溴苯甲酸:①硝化②溴代(环上) ③氧化3-硝基-4-溴苯甲酸:①溴代(环上) ②氧化③硝化(2)①溴代(环上) ②氧化(3)①氧化②硝化(4)①硝化②溴代(环上) (5)①硝化②氧化(6) ①烷基化②氧化③氯代10,只给出提示(反应式略):(1)以甲苯为原料:①Cl2/Fe ②Cl2,光(2)以苯为原料: ①CH2=CH2 ,AlC3 ②Cl2 ,光③苯,AlCl3(3)以甲苯为原料:①Cl2 ,光②CH3Cl ,AlCl3 ③甲苯,AlCl3(4)以苯为原料: ①CH3CH2COCl ,AlC3 ②Zn-Hg+ HCl11,(1)乙苯(2)间二甲苯(3)对二甲苯(4)异丙苯或正丙苯(5)间甲乙苯(6)均三甲苯12,两种:连三溴苯;三种:偏三溴苯;一种一元硝基化合物:均三溴苯.13,14,15,略第七章立体化学1,(1)3 (2)4 (3)2 (4)8 (5)0 (6)4 (7)0 (8)2 (9)32,略3,(1)(4)(5)为手性分子4,对映体(1)(5) 相同(2)(6) 非对映体(3)(4)5,7,(4)为内消旋体8,(1)(2);(5)(6);(7)(8)为对映体(5)(7);(5)(8);(6)(7);(6)(8)为非对映体9,(A)CH3CH2CH(OH)CH=CH2 (B)CH3CH2CH(OH)CH2CH310,(A)CH2=CHCH2CH(CH3)CH2CH3 (B)CH3CH=CHCH(CH3)CH2CH3 (C)CH3CHCH2CH(CH3)CH2CH311,卤代烃1,(1)1,4-二氯丁烷(2)2-甲基-3-氯-6-溴-1,4-己二烯(3)(E)-2-氯-3-己烯(4)2-甲基-3-乙基-4-溴戊烷(5)对氯溴苯(6)3-氯环己烯(7)四氟乙烯(8)4-甲基-1-溴-1-环己烯2,(1) CH2=CHCH2Cl (3)CH3C≡CCH(CH3)CH2Cl(6)Cl2C=CH2 (7)CF2Cl2 (8)CHCl33,(1)CH3CHBrCH3 CH3CH(CN)CH3(2)CH3CH2CH2Br CH3CH2CH2OH(3)ClCH2CH=CH2 ClCH2CH(OH)CH2Cl(6)CH3CH(CH3)CHClCH3 CH3CH(CH3)CH(NH2)CH3(7)(CH3)2C=CH2 (8)PBr3 CH3CH(ONO2)CH3+AgBr↓(9)CH3CH2CH2CH2C≡CM gBr + C2H5 (10)ClCH=CHCH2OCOCH3(11)Cl2CHCHCl2 Cl2C=CHCl4,(只给出主要产物,反应式略)(1)CH3CH2CH2CH2OH (2)CH3CH2CH=CH2(3)A:CH3CH2CH2CH2MgBr B:CH3CH2CH2CH3+ HC≡CMgBr(4)CH3CH2CH2CH2I + NaBr (5)CH3CH2CH2CH2NH2(6)CH3CH2CH2CH2CN(7)CH3CH2CH2CH2ONO2 + AgBr↓ (8)CH3C≡CCH2CH2CH2CH3(9)CH3(CH2)6CH3 (10)CH3CH2CH2CH2N(CH3)25,(1)加AgNO3(醇),有白色沉淀析出,反应速度:CH2=CHCH2Cl > CH3CH2CH2Cl > CH3CH=CHCl (几乎不反应)(2)加AgNO3(醇),有白色沉淀析出,反应速度:苄氯> 氯代环己烷> 氯苯(不反应)(3)加AgNO3(醇),分别有白色,蛋黄色,黄色沉淀生成(4)试剂,现象同(2),反应速度:苄氯> 1-苯基-2-氯乙烷> 氯苯(不反应)6,(1)a:(CH3)3CBr > CH2CH2CHBrCH3 > CH3CH2CH2CH2Br(2)a:CH3CH2CH2Br > (CH3)2CHCH2Br > (CH3)3CCH2Brb:CH3CH2CH2CH2Br > CH3CH2CHBrCH3 > (CH3)3CBr7,(1)(CH3)2CBrCH2CH3 > (CH3)2CHCHBrCH3 > (CH3)2CHCH2CH2Br 8,(1)CH3CH2CH2CH2Br反应较快.因为甲基支链的空间阻碍降低了SN2反应速度.(2)(CH3)3CBr反应较快,为SN1反应.(CH3)2CHBr 首先进行SN2 反应,但谁为弱的亲核试剂,故反应较慢.(3)-SH 反应快于-OH ,因为S的亲核性大于O.(4)(CH3)2CHCH2Br快,因为Br比Cl 易离去.9,(1)SN2 (2)SN1 (3)SN2 (4) SN1 (5) SN1 (6)SN2 (7)SN210,(1)(A)错,溴应加在第一个碳原子上.(B)错,-OH中活泼H会和格氏试剂反应.(2)(A)错,HCl无过氧化物效应.(B)错,叔卤烷遇-CN易消除.(3)(B)错,和苯环相连的溴不活泼,不易水解.(4)错,应消除和苯环相邻碳上的氢.11,只给出提示(反应式略):(1)①KOH(醇) ②HBr 过氧化物(2)①KOH(醇) ②Cl2 ,500℃③[H](3)①KOH(醇) ②Cl2 ③2KOH(醇) ④2HCl(4)①KOH(醇) ②Cl2 ,500℃③Cl2(5)①Cl2 ,500℃②HOCl ③Ca(OH)2,100℃(6)①Cl2 ,500℃②Cl2 ③KOH(醇) ④KOH,H2O ⑤KOH(醇)(7)①KOH(醇) ②HCl (8)①KOH(醇) ②Br2(9)①Cl2 ②H2/Ni ③NaCN(10)1,1-二氯乙烯:①HCl ②Cl2 ③KOH(醇)三氯乙烯:①2Cl2 ②KOH(醇)(11)①KOH(醇) ②Cl2 ,500℃③KOH,H2O(12)①HCHO/ZnCl2+HCl ②KOH,H2O(13)①KOH(醇) ②Br2 ③2KOH(醇) ④Na,液氨⑤CH3CH2CH2Br12,略13,(反应式略)14,(反应式略)A: CH2=CHCH(CH3)CH2CH3 B;CH3CH2CH(CH3)CH2CH3 (无旋光性)15,(反应式略)A:CH3CH(Br)CH=CH 2 B: CH3CHBrCHBrCH2Br C: CH3CH(OH)CH=CH2 D: CH3CH=CHCH2OH E: CH3CH(OH)CH2CH3F:CH3CH2CH2CH2OHwsy024第十章醇和醚1,(1)2-戊醇2° (2)2-甲基-2-丙醇3° (3)3,5-二甲基-3-己醇3°(4)4-甲基-2-己醇2° (5)1-丁醇1° (6)1,3-丙二醇1°(7)2-丙醇2° (8)1-苯基-1-乙醇2° (9)(E)-2-壬烯-5-醇2°(10)2-环己烯醇2° (11)3-氯-1-丙醇1°2,(2)>(3)>(1)3,按形成氢键多少和可否形成氢键排列:(4)>(2)>(1)>(3)>(5)4,(1)①Br2 ②AgNO3 (醇)(2)用卢卡试剂(ZnCl+HCl),反应速度:3°>2°>1°(3)用卢卡试剂(ZnCl+HCl),α-苯乙醇反应快.5,分别生成:3-苯基-2-丁醇和2-甲基戊醇6,只给出主要产物(1)CH3CH=C(CH3)2 (2) (CH3)2C=CHCH2OH (3) C6H5-CH=CHCH3(4)C6H5-CH=CHCH(CH3)2 (5)CH3CH=C(CH3)C(CH3)=CHCH37,(1)对甲基苄醇> 苄醇>对硝基苄醇(2)α-苯基乙醇> 苄醇>β-苯基乙醇8,提示:在反应过程中,形成烯丙基正离子,因而生成两种产物.9,略10,(反应式略)(1)CH3CH2CH2MgBr + CH3CHO 或CH3MgBr + CH3CH2CH2CHO(2)CH3MgBr + CH 3COCH2CH3 或CH3CH2MgBr + CH3COCH3(3)CH3CH2MgBr + C6H5-CHO 或C6H5-MgBr + CH3CH2CHO(4)CH3MgBr +C6H5-COCH3 或C6H5-MgBr + CH3COCH3(5)①Cl2 ,500℃②H2O,NaOH ③HOCl ④H2O,NaOH ⑤3HNO312,只给出提示(反应式略):(1)①–H2O ②HCl (2)①-H2O ②直接或间接水合(3)①–H2O ②HBr ③KOH/ 醇13,只给出提示(反应式略):(1)①PBr3 ②Mg/干醚③环氧乙烷④H2O(2)①CH3CH2CH2Mg,干醚②H3O+ ③–H2O/H+,△④硼氢化氧化(3)①C2H5Cl/AlCl3 ②NaOH ③CH3I ④CH3CH2CH2COCl/AlCl3 ⑤LiAlH4(4)选1,3-丁二烯和3-丁烯-2-酮①双烯合成②CH3Mg ③H3O+ ④H2/Ni14,该醇的结构式为:(CH3)2CHCH(OH)CH315,原化合物的结构式为: CH3CH(OH)CH2CH3 或CH3CH2CH2CH2OH (反应式略)16,A:(CH3)2CHCHBrCH3 B: (CH3)2CHCH(OH)CH3 C:(CH3)2C=CHCH3 (反应式略)18,A:CH3CH2CHBrCH(CH3)2 B:CH3CH2CH=C (CH3)2C:CH3CH=CHCH(CH3)2D:CH3CH2CHO E:CH3COCH3(各步反应式略)19,(1)CH3OCH2CH2CH3 甲丙醚(甲氧基丙烷) C2H5OC2H5 乙醚(乙氧基乙烷)CH3OCH(CH3)2 甲异丙醚(2-甲氧基丙烷)(2)CH3OCH2CH2CH2CH3 甲丁醚(甲氧基丁烷)CH3OCH(CH3)CH2CH3 甲仲丁醚(2-甲氧基丁烷)CH3OCH2CH(CH3)2 甲异丁醚(1-甲氧基-2-甲基丙烷)CH3OC(CH3)3 甲叔丁醚(2-甲氧基-2-甲基丙烷)CH3CH2OCH2CH2CH3 乙丙醚(乙氧基丙烷) CH3CH2OCH(CH3)2 乙异丙醚(2-乙氧基丙烷)20,(1)加金属钠,乙醇钠在乙醚中是固体,可分离.(2)①加Ag(NH3)2NO3 ,1-戊炔有白色沉淀生成,分离,再加稀硝酸可还原为炔.②加金属钠,1-甲氧基-3-戊醇可生成醇钠(固体),分离,再加水可还原为原化合物. 21,(只给出主要产物,反应式略)(1)CH3OCH2CH2CH3 + NaI (2)CH3CH2OCH(CH3)CH2CH3 + NaBr(3)CH3CH2C(CH3)2OCH2CH2CH3 + NaCl (4)(CH3)2C=CH2+CH3CH2CH2OH +NaCl22,只给出提示(反应式略):(1)制取乙二醇二甲醚:①乙烯O2/Ag,△②2CH3OH制取三甘醇二甲醚:①乙烯O2/Ag,△②H2O,H+③环氧乙烷④环氧乙烷⑤2CH3OH/H2SO4,△(2)①O2/Ag,△②NH3 ③环氧乙烷(3)①O2/ Cu, 加压,△制得甲醇②–H2O(4)①直接或间接水合制异丙醇②–H2O(5)从苯出发:①Cl2/Fe ②HNO3+H2SO4 ③Na2CO3 ④CH3Br其中CH3OH + HBr → CH3Br + H2O(6)①由CH2=CH2 → CH3CH2MgBr ②由CH2=CH2 → 环氧乙烷③由①和②→ CH3CH2CH2CH2OH ④–H2O23,因分子中含有羟基越多则形成分子间氢键越多,沸点越高.乙二醇二甲醚不能形成分子间的氢键,因而沸点是三者中最低的.24,(1)CH3I ,CH3CH2CH2CH2I (2)CH 3I ,CH3CH(I)CH2CH2CH3(3)CH3I ,CH3CH2CH(CH3)CH2I25,该化合物的结构式为:CH3CH2CH2OCH2CH2CH3 (有关反应式略)26,此化合物为:CH3(CH2)4-O-CH2CH327,m molAgI = m mol CH3I 化合物C20H21O4N 相对分子质量为339,所以11.62mg/235mg(1mol AgI)=11.62/235(1molCH3I)第十一章酚和醌1,(1)间甲苯酚(2)4-乙基-1,3-苯二酚(3)2,3-二甲基苯酚(4)2,4,6-三硝基苯酚(5)邻甲氧基苯酚(6)对羟基苯磺酸(7)1-甲基-2-萘酚(8)9-蒽酚(9)1,2,3-苯三酚(10)5-甲基-2-异丙基苯酚(11)5-硝基-1-萘酚(12)β-氯蒽醌4,①FeCl3 ②Na5,(1)用氢氧化钠水溶液,苯酚成酚钠溶于水,然后用分液漏斗分离,再酸化. (2),(3),(4)同样可用氢氧化钠水溶液将相应得酚分离出来.6,在苯酚分子中引入吸电子基可使酸性增强,其中邻,对位的酸性大于间位,所以酸性由大到小的顺序为:2,4-二硝基苯酚> 对硝基苯酚> 间硝基苯酚> 苯酚7,水杨醇不溶于碳酸氢钠溶液而容于氢氧化钠溶液,酸化后又可析出,且和三氯化铁溶液反应显蓝紫色,故可证明分子中含有酚羟基.当用氢溴酸处理,分子中羟基被溴原子取代,有分层现象出现,证明分子中有醇羟基.8,(2),(4)能形成分子内氢键,(1),(3)能形成分子间氢键.9,(1)以苯为原料:①浓硫酸(磺化)生成间苯三磺酸②NaOH,△(碱熔)③H+(2)以苯为原料:①C2H5Cl,AlCl3 ②浓硫酸(磺化)生成4-乙基-1,3-苯二磺酸③NaOH,△(碱熔)④H+(3)苯:①磺化, ②NaOH,△(碱熔) ③H+ ④HNO2(4)由上制得苯酚钠,再加C2H5I即可.(5)①由上得苯酚②Cl2,△③Cl2,△制得2,4-二氯苯酚④NaOH ⑤CH2ClCOOH(6)①由上制得苯酚钠②CH3I ③硝化(9)①制取苯酚②磺化→ 对羟基苯磺酸③Cl2 ④H1O ,H+ ,△(10)①制取苯酚②C2H5Cl ,AlCl3 ③Br2,FeCl310,11,(1)①磺化,碱熔→ 间苯二酚钠②CH3I(3)①磺化,NaOH,△(碱熔),H+ →对甲苯酚②CH3COCl , AlCl312,该化合物结构式为:第十二章醛,酮1,(1)3-甲基戊醛(2)2-甲基-3-戊酮(3)甲基环戊基甲酮(4)间甲氧基苯甲醚(5)3,7-二甲基-6-辛烯醛(6)α-溴代苯乙酮(7)乙基乙烯基甲酮(8)丙醛缩二乙醇(9)环己酮肟(10)2,4-戊二酮(11)丙酮-2,4-二硝基苯腙3,略4,(1)CH3CH2CH2OH (2)CH3CH2CH(OH)C6H5 (3)CH3CH2CH2OH(4)CH3CH2CH(OH)SO3Na (5)CH3CH2CH(OH)CN(6)CH3CH2CH(OH)CH(CH3)CHO (7)CH3CH2CH=C(CH3)CHO7,(1)(3)(6)(7)能发生碘仿反应;(1)(2)(4)能和NaHSO3发生加成反应,8,(1)CF3CHO > CH3CHO > CH3COCH3 > CH3COCH=CH2(2)ClCH2CHO > BrCH2CHO > CH3CH2CHO > CH2=CHCHO9,(1)加2,4-二硝基苯肼(2)加托伦试剂(3)碘仿反应(4)饱和NaHSO3水溶液(5)2,4-二硝基苯肼(6)碘仿反应10,只给出主要产物,反应式略:也可通过格氏试剂增碳,水解,氧化得到.红外光谱1690 cm-1 为羰基吸收峰.核磁共振普δ1.2(3H)三重峰是—CH3;δ3.0(2H)四重峰是—CH2—;δ7.7(5H)多重峰为一取代苯环.红外光谱1705 cm-1 为羰基吸收峰.核磁共振普δ2.0(3H)单峰是—CH3;δ3.5(2H)单峰是—CH2—;δ7.1(5H)多重峰为一取代苯环.14,该化合物结构式为: (CH3)2COCH2CH3 (反应式略)15,A:CH3COCH2CH2CH=C(CH3)2 或(CH3)2C=C(CH3)CH2CH2CHOB:CH3COCH2CH2CHO红外光谱1710 cm-1 为羰基吸收峰.核磁共振普δ2.1(3H)单峰是—CH3;δ3.2(2H)多重峰是—CH2—;δ4.7(1H)三重峰是甲氧基中的—CH3.(反应式略)19,红外光谱1712 cm-1 为羰基吸收峰,1383,1376为C—C的吸收峰.核磁共振普δ1.00 ,δ1.13是—CH3;δ2.13—CH2—;δ3.52 是CH.A:(CH3)2CHCOCH2CH3 B:(CH3)2CHCH(OH)CH2CH3C:(CH3)2C=CHCH2CH3 D: CH3COCH3 E:CH3CH2CHO(反应式略)第十三章羧酸及其衍生物1,(1) 己酸(2) 2,2,3-三甲基丁酸(3) 2-氯丙酸(4) β-萘甲酸(5) 3-丁烯酸(6) 环己烷羧酸(7) 对甲基苯甲酸甲酯(8) 对苯二甲酸(9) α-萘乙酸(10) 乙酸酐(11) 甲基丁烯二酸酐(12) N,N-二甲基甲酰胺(13) 3,5-二硝基苯甲酰氯(14) 邻苯二甲酰亚胺(15) 2-甲基-3-羟基丁酸(16) 1-羟基环戊烷羧酸2,3,略4,(1)草酸> 丙二酸> 甲酸> 乙酸> 苯酚(2)F3CCOOH > ClCH2COOH > CH3COOH > C6H5OH > C2H5OH(3)对硝基苯甲酸> 间硝基苯甲酸> 苯甲酸> 苯酚> 环己醇5,(1)①Ag(NH3)2OH ②I2 + NaOH (或NaHCO3)(2)①Ag(NH3)2OH ②△(3)①Br2 ②KMnO4(4)①FeCl3/H2O ②NaHCO3(5)①AgNO3 (乙酰氯有AgCl 生成) ②AgNO3/C2H5OH6,(1) CH3CBr(CH3)COOH (2) (CH3)2CHCH2OH (3) (CH3)2CHCOCl (4) (CH3CH(CH3)CO)2O (5) (CH3)2CHCOBr(6) (CH3)2CHCOOC2H5 (7) (CH3)2CHCONH27,9,(1)A: H3O+ B:PCl3,PCl5(或SOCl2) C:NH3 D:P2O5,△E:NH3 ,△F:NaOBr + NaOH G:H2/Pd-BaSO4(3)2NH3 ,H2NCONHCONH210,12,(1) HCOOCH3 > CH3COOCH3 > CH3COOC2H5 > CH3COOCH(CH3)2 > CH3COOC(CH3)314,从氯到两个羧基的距离不同,诱导效应也不同来解释.15,(1)CH3CO2—负离子的负电荷平均分配在两个碳原子上,而CH3CH2O—负离子的负电荷定域在一个氧原子上,所以较不稳定,和质子作用的倾向较大.(2)CH3CH2CH2CO2— > ClCH2CH2CO2—(由于Cl的诱导作用而较稳定)(3)ClCH2CH2CO2— > CH3CH(Cl)CO2— (Cl 靠近—CO2—中心而较稳定)(4)FCH2CO2— > F2CHCO2— (含有两个氟原子)(5)CH3CH2CH2CO2—> HC≡CCH 2CO2—(HC≡C—吸电子诱导效应) 16,10×1000×(183.5/1000)=1835克,需KOH 1.835千克17,反应式略(A)的结构式为:HOOCCH2CH(C2H5)CH2COOH(B)的结构式为:HOOCCH2CH(C2H5) COOH18,(A)的结构式为:CH3COOCH=CH2 (B)的结构式为:CH2=CHCOOCH3 20,(1)HCOOCH2CH2CH3 (2)CH3CH2COOCH3 (3)CH3COOCH2CH3第十四章β—二羰基化合物1,(1)2,2 -二甲基丙二酸(2)2-乙基-3-丁酮酸乙酯(3)2-氧代环己烷甲酸甲酯(4)甲酰氯基乙酸(5)3-丁酮酸(乙酰乙酸)2,(1)环戊酮(2)CH3COCH2CH2CH2COOH (3)CH3CH2CH2COOH3,(1)加FeCl3/H2O CH3COCH(CH3)COOC2H5 有颜色反应.(2)加FeCl3/H2O CH3COCH2COOH有颜色反应.4,(1)互变异构(2)共振异构(3)互变异构5,C2H5ONa , CH3CH(Br)COOC2H5 , CH3COCH2CH(CH3)COOC2H5 HOCH2CH2OH / 干HCl , CH3COCH2C(OH)(C6H5)28,丙二酸酯合成:1,2-二溴乙烷合成酮(3).(5) 1,2-二溴乙烷合成同(4).9,乙酰乙酸乙酯合成:10,该化合物为:CH3COCH2CH2COOH 反应式略.11,A: CH3CH2COOC2H5 B: CH3CH2COCH(CH3)COOC2H5C: C2H5COC(C2H5)(CH3)COOC2H5 D: CH3CH2COCH(CH3)CH2CH3反应式略.第十五章硝基化合物和胺1, (1)2-甲基-3-硝基戊烷(2)丙胺(3)甲异丙胺(4)N-乙基间甲苯胺(5)对氨基二苯胺(6)氢氧化三甲基异丙铵(7)N-甲基苯磺酰胺(8)氯化三甲基对溴苯铵(9)对亚硝基-N,N-二甲基苯胺(10)丙烯腈2,3,(1) ①Ag(NH3)2OH ②CHCl3/KOH (异腈反应) ③NaHCO3 溶液(3) CHCl3/KOH (异腈反应)(4) Br2/H2O (或用漂白粉溶液,苯胺显紫色)4,5,(1)甲胺> 氨> 苯胺> 乙酰胺(2)苄胺> 对甲苯胺> 对硝基苯胺> 2,4-二硝基苯胺(3)甲胺> N-甲基苯胺> 苯胺> 三苯胺6,(1)CH3CH2COOH , CH3CH2COCl , CH3CH2CON(CH2CH2CH3)2 ,(CH3CH2CH2)3N7,8,9,(3)的合成路线最合理.10,略11,A:CH2=CHCH2NH2 B:CH3CH2CH2CH2NH2C:[CH2=CHCH2CH2N(CH3)3]+ I –D:CH2=CH—CH=CH212,该化合物为:第十六章重氮化合物和偶氮化合物1,(1) 重氮苯硫酸盐(2) 对乙酰基重氮苯盐酸盐(3) 4-甲基-4'-羟基偶氮苯(4) 4-(N,N-二甲胺基)-4'-甲基偶氮苯(5) 2,2'-二甲基氢化偶氮苯(6) 二氯碳烯2,增强.因为苯基重氮盐是一种弱的亲电试剂,故当重氮基邻位或对位上连有强吸电子基硝基时,增强了重氮盐的亲电性,使偶合反应活性提高.3,重氮盐和苯胺偶合在弱酸中有利,重氮盐和酚偶合在弱碱中有利.10,该化合物是: 合成方法略.11,该化合物是: 合成方法略.第十七章杂环化合物4,从杂原子对芳杂环上电子云密度影响去解释.7,苄胺> 氨> 吡啶> 苯胺> 吡咯8,具有芳香性的化合物有:9,六元环上的两个N为吡啶型N,五元环上的两个N为吡咯型.11,原来的C5H4O2 的结构是;第十八章碳水化合物1,D-核糖,D木糖,D-阿洛糖和D-半乳糖2,D-核糖,2R,3R,4R D-阿拉伯糖,2S,3R,4R, D-木糖,2S,3S,4R D-米苏糖,2S,3S,4R3,(1)不是对映体,是差向异构体.(2)不是对映体,是差向异构体,异头物.4,(1)前者有还原性,可发生银镜反应,后者无还原性.(2)前者无还原性,后者有还原性.(3)前者有还原性,后者无还原性或者前者无酸性,后者又酸性.(4)前者有还原性,后者无还原性(5)前者中性,后者酸性.5,它们和过量的苯肼能生成相同结构的脎,由此可见它们的C-3,C-4,C-5具有相同的构型.第十九章氨基酸,蛋白质和核酸(3) (b)有明显酸性;(d)又明显碱性;余下(a)和(c)其中(c)可和HNO3作用有N2↑.第二十章元素有机化合物略.2,(1)对甲基苯基锂(2)二乙基膦(3)碘化四乙基鏻(4)二苯基二氯甲硅烷 (5)三正丙基铝11 / 1111 / 11。
2001级期末考试试题(A)

2001级有机化学期末考试试题(A)一. 写出下列反应或反应系列的主要有机产物(将答案写在每小题的后面,每空2分,共36分。
C O O C H 3LiA lH 4E t 2OAH O +C25B+C O O HS O C l AN H B B r ,O H -C H 3C H 2C H 2O HC H C O C lA500BC+C O N H2P O H 2N C H 2C O 2H()S O C l (2)C 2H 5O HC H 3C H 2C H 2C O O (C H 3)2N H 1701.2.3.4.5.6.CCH 3CH 2CH 2COOH3+A3H O +B7.CH 3CO CH 2CO O EtO Na BrCH CH BrA3EtO Na/EtO HB()OH -/H O (2)H 3O +,C228.二. 分析反应历程(每题6分,共12分)(1)当环己基甲酰胺在甲醇中用溴和甲醇钠处理时,得到的产物是N-环己基氨基甲酸甲酯,试提出适当的反应历程加以说明。
(2) 羧酸衍生物可被水、醇、氨等亲核试剂进攻,其中酯的水解历程研究得最多。
酯的水解是酯化反应的逆反应,水解时可能是酰氧键断裂,也可能是烷-氧键断裂;每种断裂方式都可按单分子或双分子历程进行,所以有四种可能的历程。
同样碱性水解也有四种可能历程。
这八种酯水解机理中,以酯的酸性(A Ac 2)或碱性(B Ac 2)水解双分子酰氧键断裂最为常见,以(B Ac 2)为例作一说明。
三. 以下列化合物为原料合成指定的化合物(每题12分,共24分)(1)(2)四. 应用题(第一小题12分,第二小题16分)(1)某化合物A ,分子式为C 9H 10O 2, 能溶于NaOH 溶液,易与溴水、羟氨反应,不能与托伦试剂反应。
A 经LiAlH 4还原后得化合物B ,分子式为C 9H 12O 2。
A 、B 都能发生碘仿反应。
A 用Zn-Hg 在浓盐酸中还原得化合物C ,分子式为C 9H 12O ,C 与NaOH 反应再用碘甲烷煮沸得化合物D ,分子式为C 10H 14O ,D 用高锰酸钾溶液氧化后得对甲氧基苯甲酸,试推测各化合物的结构,并写出有关反应式。
徐寿昌《有机化学》(第2版)配套题库【名校考研真题】(下册)-第1~20章【圣才出品】

第一部分名校考研真题第11章酚和醌一、选择题1.下列化合物碱性最强的是()。
[中国科学院-中国科学技术大学2001研]【答案】(A)【解析】酚的碱性与酚羟基上氧的孤对电子有关,氧原子上的电子云密度越大,碱性越强。
氰基、溴原子都为吸电子基,使氧原子上电子云密度降低。
2.下列化合物中,酸性最强的是()。
[天津大学2000研]【答案】(D)【解析】硝基为吸电子基,使邻、对位的电子云密度降低,使酚羟基的酸性增强。
3.下列物种作为离去基团时最易离去的是()。
[大连理工大学2004研]【答案】(A)【解析】硝基为吸电子基,使负电荷得以分散,故(A)最稳定,作为离去基团,最易离去。
二、简答题1.为什么?[上海大学2004研]答:甲氧基的给电子共轭效应使对位电子云密度增大,从而使对位酚羟基的酸性减弱,而间位甲氧基只有吸电子的诱导效应而无给电子的共轭效应,故间甲氧基苯酚的酸性比对甲氧基苯酚强。
2.从反应机理说明为什么烷芳混合醚(ArOR)在与氢碘酸共热时,只得到RI和ArOH,而不是ArI和ROH。
[南京大学2002研]答:醚与氢碘酸共热时先生成烊盐,然后发生碳氧键的断裂,生成醇和碘代烷。
对于混合醚,碳氧键断裂的顺序为:三级烷基>二级烷基>一级烷基>芳基,芳基与氧的孤对电子共轭,因此烷芳混合醚与氢碘酸共热时,芳基与氧相连的碳氧键没有断裂,烷基与氧相连的碳氧键断裂,产物为酚和碘代烷。
3.化合物(A)和(B)中哪个酸性较强?(C)和(D)相比较呢?简述理由。
[华东理工大学2003研]答:硝基的吸电子共轭效应,使邻、对位电子云密度降低,酚羟基的酸性增强,故酸性(B)>(A);甲基的立体效应使(C)中硝基的π-π共轭效应减弱。
化合物(A)和(B)中酸性(B)>(A);化合物(C)和(D)中酸性(D)>(C)。
甲基的立体效应使(C)中硝基的共轭效应减弱。
4.以苯以及必要的有机、无机试剂为原料合成3,4,5-三溴苯酚。
[武汉大学2002研]答:酚羟基为邻对位定位基,若先合成苯酚,再溴化将得到2,4,6一三溴苯酚,而题目要求合成3,4,5一三溴苯酚,故必须借助氨基的定位效应来定位,然后通过重氮化来完成目标产物的合成。
徐寿昌《有机化学》(第2版)名校考研真题(羧酸及其衍生物)【圣才出品】

第13章羧酸及其衍生物一、选择题1.下面物质中,酸性最强的是(),最弱的是()。
[云南大学2004研]A.丙炔酸B.丙烯酸C.丙酸D.丙氨酸【答案】A;D【解析】叁键碳为sp杂化,双键碳为sp2,而饱和碳为sp3杂化,s成分越多,吸电子能力越强,故丙炔酸酸性最强,丙氨酸属两性物质,其酸性最弱。
2.下列化合物发生水解反应,()活性最大。
[大连理工大学2004研]【答案】(A)【解析】酯羰基碳缺电子程度越高,则越易发生亲核取代反应,水解反应活性越大。
-NO2为吸电子基,使酯基的电子云密度减小,水解反应活性最大。
3.植物油中含有的脂肪酸为()。
[大连理工大学2002研]A.较多的饱和直链B.较多不饱和直链C.较多不饱和偶数碳直链D.较多不饱和奇数碳直链【答案】C【解析】植物油中含有较多的不饱和碳,且碳原子数一般都是偶数。
4.下列化合物酸性最强的是()。
[大连理工大学2004研]【答案】(B)【解析】(B)电离产生的羧酸跟离子与邻位羟基之间存在氢键而稳定,故(B)的酸性最强。
5.加热时可以生成内酯的羟基酸是()。
[华中科技大学2002研]A.α-羟基酸B.β-羟基酸C.γ-羟基酸D.δ-羟基酸【答案】C,D【解析】加热时,γ-羟基酸、δ-羟基酸分别可形成五元环和六元环的内酯。
二、填空题1.下列化合物用氢氧化钠水溶液水解,请按反应速度由快到慢的顺序排列:。
[厦门大学2002研]【答案】(A)>(D)>(C)>(B)【解析】羰基附近的碳上有吸电子基,空间位阻越小,越有利于酯的水解;酯基中与氧相连的烷基碳上的取代基越多,空间位阻越大,水解反应速度越慢。
2.将下列负离子按稳定性大小排列成序:。
[华中科技大学2003研]【答案】(C)>(A)>(B)【解析】吸电子基使羧酸根离子上的负电荷分散,稳定性增大,相反,给电子基使其稳定性减小。
3.下列化合物与乙醇钠/乙醇溶液发生醇解反应,请按反应活性由高到低的顺序排列:。
各个重点大学考研有机化学真题试题及答案

考研有机化学试题及答案2010.3.13更新目录广告 (2)中国科学院 (3)2009 (3)2009答案 (7)中国科学技术大学&中科院合肥所 (13)2009 (13)2009标准答案 (18)东南大学 (25)2005 (25)2005详细答案 (27)杭州师范大学 (31)2009 (31)2008 (34)江苏大学2004 (38)南开大学2009参考答案 (44)青岛大学2009 (49)青岛科技大学 (55)2007 (55)2005 (59)山东科技大学 (63)2006 (63)2004 (68) (72)2006........................................................................................................天津工业大学2006 (76)浙江理工大学20092009........................................................................................................广告1推荐的教科书推荐高教、邢其毅的《基础有机化学》(第三版),此书编的较好,内容略多,共上下两册,建议至少购买上册。
配套的习题解答不是很有必要买,然而你报考的院校推荐的教科书则非买不可,而且配套的习题解答也必须购买,因为那上面的习题很容易被出到。
其他的辅导书也可以根据需要购买。
2推荐的复习方法如果在考研复习之前没有系统地和高强度地复习过有机化学,那么就要分章节复习,等各个章节都复习过了之后,再开始做真题。
做真题时,做完后要仔细地对答案。
对于做错的题目,要知道自己错在哪,翻看教材的相关章节,保证以后不会因为这个知识点再丢分。
核对答案千万不能仅仅知道自己得了多少分,尤其是……选择题!3报考外校报考外校的考生,到考试时考场是报考单位安排的,但是住宿问题得自己解决。
历年有机化学考研试题
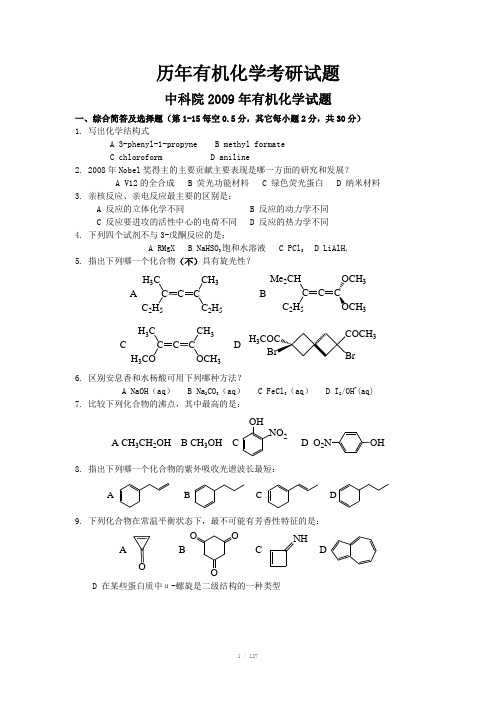
(每小题6分,共30分)
四,对下列转变提出合理的反应机理.(每小题6分,共24分)
五,芥子气(ClCH2CH2SCH2CH2Cl)是一种由环氧乙烷及H2S等合成得到的糜烂性素毒剂,其主要特征是使人体内一些重要的代谢酶烷基化而失活,从而破坏细胞,造成糜烂.①请解释该毒剂极易使酶烷基化的原因(提示:将酶结构简化为○酶-NH2)②使用某些漂白剂(如NaOCl)使芥子气失活,请解释其原因.(本题共6分).
2.根据下列化合物的结构,判断哪一个名称是正确的?( )
A.Z-1-氟-1-氯-2-溴乙烯B.E-1-氟-1-氯-2-溴乙烯
C.反式-1-氟-1-氯-2-溴乙烯D.顺式-1-氟-1-氯-2-溴乙烯
3.下列哪一个化合物与强酸、强碱和强氧化剂等都不发生化学反应?( )
A.己烷B.己烯
C.环己烯D.甲苯
4.下列哪一个化合物分子具有sp杂化碳原子?( )
A.甲苯B.硝基苯
C.苯甲酸D.氯苯
11.下列物质中,能与钠反应并生成氢气的是( )。
A.溴乙烷B.乙醇
C.丙酮D.苯甲醛
12.下列有机物中,不属于烃的衍生物的是( )。
A.氯丙烷B.甲苯
C.硝基苯D.乙醛
13.下列化合物中属于非还原性二糖的是( )。
A.葡萄糖B.果糖
C.麦芽糖D.蔗糖
14.戊烷有几个同分异构体?( )
四机理10分每题5500chchochcoonachohch五合成题30分每题51以甲苯为原料及必要的有机和无机试剂合成2用苯和不超过两个碳的有机原料和必要的有机无机试剂合成3以小于等于4个碳的有机物为原料和必要的有机无机试剂合成4以邻苯二甲酰亚胺及cich2ch2sch3为原料和必要的有机无机试剂合成ch3sch2ch2chcoonh35以环已酮及小于等于3个碳的有机物为原料和必要的有机无机试剂合成6用不超过三个碳的有机物及必要的无机试剂合成ch3cch2ch2ch2ch2cooh南开大学1989年研究生入学考试试题有机化学chocncchohchclclcochcooh一命名下列化合物或写出其结构5分ohchohcoohohhohiocoohcn10ch11
大二有机化学试题库及答案解析

大二有机化学试题库及答案解析一、选择题(每题1分,共20分)1. 下列哪个化合物不是芳香族化合物?A. 苯B. 甲苯C. 环己烯D. 吡啶2. 以下哪个反应是亲电取代反应?A. 水解反应B. 酯化反应C. 卤代反应D. 还原反应3. 以下哪个反应是消除反应?A. 醇的氧化B. 酯的水解C. 醇的脱水D. 卤代烷的消去4. 以下哪个化合物是手性分子?A. 甲烷B. 乙醇C. 2-丁醇D. 2,3-丁二醇5. 以下哪个化合物具有顺反异构体?A. 乙烯B. 乙炔C. 1,2-二氯乙烷D. 1,3-丁二烯...(此处省略15题,以保持题目数量为20)二、填空题(每空1分,共10分)6. 芳香族化合物的特征是具有_______电子的共轭体系。
7. 亲电取代反应中,亲电试剂首先攻击的是_______。
8. 消除反应通常发生在_______的化合物上。
9. 手性分子的两个异构体被称为_______。
10. 顺反异构体是由于分子中存在_______而引起的。
...(此处省略10空,以保持题目数量为10)三、简答题(每题5分,共20分)11. 简述芳香性的概念及其判断标准。
12. 描述亲电取代反应的机理。
13. 解释什么是消除反应,并给出一个例子。
14. 说明手性分子的特点及其在药物化学中的应用。
四、计算题(每题10分,共20分)15. 某化合物的分子式为C5H10O,其红外光谱显示有3300 cm^-1的宽峰和1745 cm^-1的尖锐峰,请计算其不饱和度,并推测可能的结构。
16. 给定一个有机反应的化学方程式:A + B → C + D,如果A的摩尔质量为90 g/mol,B的摩尔质量为60 g/mol,C的摩尔质量为120 g/mol,D的摩尔质量为30 g/mol,且反应物A和B的摩尔比为1:1。
若反应物B消耗了0.5 mol,计算生成物C和D的摩尔数。
五、综合分析题(每题15分,共30分)17. 某有机化合物在核磁共振氢谱中显示有三种不同的化学位移,分别为δ 1.2, δ 2.5, 和δ 7.3。
2001年高考上海化学试题和参考答案

2001年高考上海化学试题和参考答案本试卷分为第Ⅰ卷(第l~4页)和第Ⅱ卷(第5~10页)两部分。
全卷共10页。
满分150分。
考试时间120分钟。
第Ⅰ卷(共75分)相对原子质量:H—l C—12 N—14 O-16 Mg-24S—32 K—39 Fe—56 I—127 Cl—35.5一、选择题(本题共10分),每小题2分,只有一个正确选项,答案涂写在答题纸上。
1.漂粉精的有效成分是A Ca(OH)2B Ca(ClO)2C CaCl2D CaCO32.美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素原子核内的中子数与核外电子数之差是A 57B 47C 61D 2933.下列物质不属于“城市空气质量日报”报道的是A 二氧化硫B 氮氧化物C 二氧化碳D 悬浮颗粒4.下列分子的电子式书写正确的是A 氨B 四氯化碳C 氮D 二氧化碳5.下列科学家中,为我国化学工业作出重大贡献的是A 邓稼先B 李四光C 华罗庚D 侯德榜参考答案:1.B 2.A 3.C 4.C 5.D二、选择题(本题共36分),每小题3分,只有一个正确选项,答案涂写在答题纸上。
6.下列物质属于分子晶体的化合物是A 石英B 硫磺C 干冰D 食盐7.铜片和锌片用导线连接后插入稀硫酸中,锌片是A 阴极B 正极C 阳极D 负极第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要。
天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳五个CH4分子或1个游离H2O分子。
根据上述信息,完成第8、9题:8.下列关于天然气水合物中两种分子极性的描述正确的是A 两种都是极性分子B 两种都是非极性分子C CH4是极性分子,H2O是非极性分子D H2O是极性分子,CH4是非极性分子9.若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为ACH4·14H2O B CH4·8H2O C CH4·(23/3)H2O D CH4·6H2O 10.标准状况下H2S和O2混合气体100mL,经点燃后反应至完全,所得气体经干燥后,恢复到原来状况时体积为10mL,该10mL气体可能是A H2S、SO2B O2C H2SD SO311.碱金属与卤素所形成的化合物大都具有的性质是①高沸点②能溶于水②水溶液能导电④低熔点⑤熔融状态不导电A ①②③B ③④⑤C ①④⑤D ②③⑤12.下列离子在溶液中因发生氧化还原反应而不能大量共存的是A H3O+、NO3-、Fe2+、Na+B Ag+、NO3-、Cl-、K+C K+、Ba2+、OH-、SO42-D Cu2+、NH4+、Br-、OH-13.下列反应的离子方程式错误的是A 向碳酸氢钙溶液中加人过量氢氧化钠Ca2++2HCO3-+2OH-===CaCO3↓+2H2O+CO32-B 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢按溶液混合Ba2++2OH-+NH++HCO3-===BaCO3↓+NH3·H2O+H2OC 氢氧化铝与足量盐酸反应Al(OH)3+3H+===Al3++3H2OD 过量CO2通入氢氧化钠溶液中CO2+2OH-===CO32-+H2O14.氯化铁溶液与氢氧化铁胶体具有的共同性质是A 分散质颗粒直径都在l~100nm之间B 能透过半透膜C 加热蒸干、灼烧后都有氧化铁生成D 呈红褐色15.下列实验中用错试剂的是A 用稀盐酸清洗做焰色反应的镍铬丝B 用酒精萃取碘水中的碘C 用稀硝酸洗去残留在试管壁上的铜D 用碱石灰吸收氨气中的水蒸气16.设N A为阿佛加德罗常数,下列说法不正确的是A 标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8N AB 18g水中含有的电子数为10N AC 46g 二氧化氮和46g四氧化二氮含有的原子数均为3N AD 在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4N A17.2001年9月1日将执行国家食品卫生标准规定,酱油中3一氯丙醇(ClCH2CH2CH2OH)含量不得超过1ppm。
上海有机化学考研试题及答案

上海有机化学考研试题及答案### 上海有机化学考研试题及答案一、选择题1. 下列化合物中,哪一个是羧酸?- A. 乙醇- B. 乙酸- C. 乙醛- D. 乙酸乙酯2. 以下哪个反应是亲核取代反应?- A. 卤代烃的水解- B. 卤代烃的消去- C. 酯化反应- D. 醇的氧化答案:1. B. 乙酸2. A. 卤代烃的水解二、填空题1. 请写出乙炔与水发生加成反应生成的化合物的化学式:______。
2. 请简述芳香族化合物的典型反应类型。
答案:1. CH₃CHO2. 芳香族化合物的典型反应类型包括亲电取代反应、亲核取代反应、氧化反应等。
三、简答题1. 请解释什么是有机化学中的“共振稳定”?2. 请简述有机反应中“Markovnikov规则”的应用。
答案:1. 共振稳定是指在有机分子中,由于电子的离域作用,使得分子的某些共振形式能够共享电子,从而使得整个分子的能量降低,结构更加稳定的现象。
2. Markovnikov规则是指在有机反应中,当一个质子酸与烯烃发生加成反应时,质子酸的质子会加在烯烃的双键上,使得氢原子加在形成更稳定碳正离子的碳原子上,即在形成碳正离子时,质子倾向于加在取代基较多的碳原子上。
四、计算题1. 某化合物的分子式为C₆H₁₂O₂,它在酸性条件下与水发生水解反应生成一种酸和一种醇。
已知该酸的分子式为C₂H₄O₂,试写出该酸和醇的化学式,并说明反应类型。
答案:该化合物是酯类化合物,水解生成的酸是乙酸(CH₃COOH),醇是正丙醇(CH₃CH₂CH₂OH)。
这是一个酯的水解反应,属于酸催化的水解反应。
五、论述题1. 论述有机化学在药物合成中的应用。
答案:有机化学在药物合成中的应用非常广泛。
首先,有机合成提供了合成药物分子的基本方法,包括构建碳骨架、引入功能团等。
其次,有机化学中的立体化学原理在药物合成中至关重要,因为药物分子的生物活性往往与其立体结构密切相关。
此外,有机化学中的手性合成技术也是药物合成中的关键,许多药物分子具有手性中心,其药效往往与特定的手性形式有关。
徐寿昌《有机化学》(第2版)配套题库【名校考研真题】(上册) 第7章~第10章【圣才出品】

第7章多环芳烃和非苯芳烃一、选择题1.下列化合物有芳香性的是()。
[华中科技大学2000研]【答案】(B),(C)【解析】(B)项分子中有6个π电子,符合休克尔规则;(C)项中的七元环带一个单位正电荷,五元环带一个单位负电荷,这样七元环和五元环的π电子数都为6个,且在同一平面内,都符合休克尔规则。
2.下列化合物中有芳香性的是()。
[中国科学院-中国科学技术大学2001研]【答案】(A)【解析】(A)中有10个π电子数,符合休克尔规则。
3.薁的亲核取代反应容易发生在哪些位置上?()[上海大学2004研]A.1、2和3位B.1和3位C.5和7位D.4、6和8位【答案】D【解析】薁的七元环带一单位正电荷,五元环带一单位负电荷,是典型的非苯芳烃,有芳香性。
七元环显正电性,易受亲核试剂的进攻,同时亲核反应发生在4、6和8位时,活性中间体中五元环带一单位负电荷,较稳定。
4.如果薁进行亲电取代反应,那么容易发生在哪些位置上呢?()[上海大学2004研]A.1、2和3位B.1和3位C.5和7位D.4、6和8位【答案】B【解析】薁的五元环带负电荷,易受亲电试剂进攻,故亲电反应发生在五元环,同时亲电反应发生在1和3位时,活性中间体碳正离子较稳定。
二、填空题1.命名:。
[武汉理工大学2004研]【答案】β-5-硝基萘乙酸(或5-硝基-2-羧甲基萘)【解析】以羧酸作为主体命名或以萘作为主体命名都可。
2.用系统命名法命名:。
[华中科技大学2002研]【答案】5-硝基-1-溴萘【解析】以萘作为主体进行命名,取代基的列出顺序按顺序规则,将小基团优先列出。
3.写出化合物9,10-二溴菲的结构式。
[华东理工大学2004研]【答案】【解析】要熟悉菲的取代基编号顺序:三、简答题1.杯烯具有较大的偶极矩(5.8D),为何?[上海大学2004研]答:杯烯中电子离域,五元环带一个单位负电荷,三元环带一个单位正电荷,这样五元环电子数为6,三元环电子数为2,都符合休克尔规则,为稳定的芳香结构。
上海交大化学基础考研基础有机化学考研真题与解析
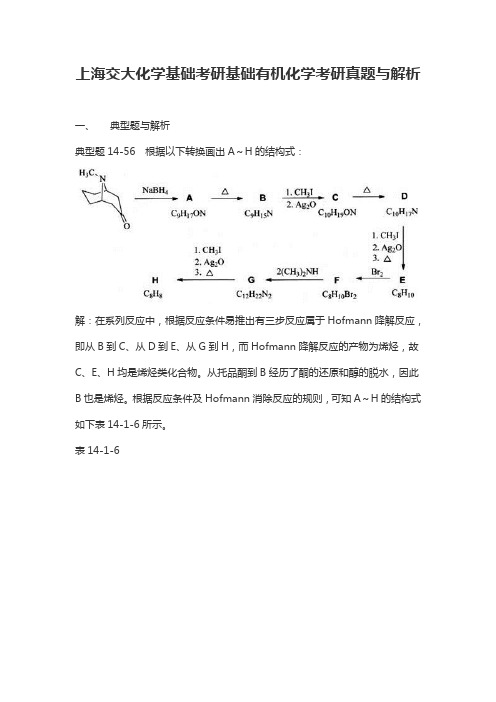
上海交大化学基础考研基础有机化学考研真题与解析一、典型题与解析典型题14-56 根据以下转换画出A~H的结构式:解:在系列反应中,根据反应条件易推出有三步反应属于Hofmann降解反应,即从B到C、从D到E、从G到H,而Hofmann降解反应的产物为烯烃,故C、E、H均是烯烃类化合物。
从托品酮到B经历了酮的还原和醇的脱水,因此B也是烯烃。
根据反应条件及Hofmann消除反应的规则,可知A~H的结构式如下表14-1-6所示。
表14-1-6典型题14-57 胆碱的分子式为C5H15O2N,易溶于水,形成强碱性溶液。
它可以利用环氧乙烷和三甲胺的水溶液反应制备。
画出胆碱和乙酰胆碱的结构式。
解:环氧乙烷和三甲胺为合成胆碱的原料,根据碳的骨架和胆碱的分子式C5H15O2N可以推出胆碱的结构式如下:则乙酰胆碱的结构式为:典型题14-58 根据以下转换和一些相关表征,画出A~D的结构式:化合物A在铂催化下不吸收氢气。
化合物D不含有甲基;紫外吸收表征证明,其结构中没有共轭双键;核磁共振氢谱表明,其结构中一共有8个氢原子与碳碳双键相连。
解:根据胺的特征反应可知:从A到B反应、从B到C反应、从C到D反应均是属于Hofmann重排反应,由此可以推断出A为三级胺。
A在铂催化下不吸收氢气,可知A不含有双键或三键,即A为环状胺。
根据各化合物的分子式可知,A的不饱和度为2,D的不饱和度为3,进而可以推断出A、B、C、D的结构简式如下表14-1-7所示。
表14-1-7典型题14-59 托品酮(tropinone)是一个生物碱,是合成阿托品硫酸盐的中间体。
它的合成在有机合成史上具有里程碑的意义。
托品酮的许多衍生物具有很好的生理活性。
在进行以下衍生化的过程中发现,产物为两个互为立体异构体的A和B:在碱性条件下,A和B可以相互转换,因此,任何一个纯净的A或B在碱性条件下均会变成一混合物。
画出A和B的立体结构式,以及在碱性条件下A和B 相互转换的反应机理。
2001年试题

研究生入学考试2001有机化学试题一,写出下列反应的主要产物(40%)1.2PhCHONaCN2.CH 33H Br Br H3. 4.OHCHCl 3/NaOHH 2O5. 6.COOEt COOEt7.8.O+ROHH9.NH 2+OH OH OH H 2SO 4/Fe 2O 310.AcOOH--11.12.3PCOOEt13.14.15.16.AcOOO+CH 2COOEt CH 2COOEtt BuOK/t BuOH 17.+HCOOEtNaOEt/EtOH 18.HOOHn +n OClNaOH19.N+PhCOOEtEtONa/EtOH20.OO二,写出下列反应的反应机理(20%)1.OCl *COOEtCOOEt+**2.CHOOH+Ac 2OOO3.OH COOCH 3+O OCH31.CH 3OK CH 3OH.H OOO4.HO+OHHOHOOH三,完成下列化合物的合成(可用其它必需试剂,15%)1.OHOH & O(CH 2CH 2OCH 2CH 2OH)2O OOOO 2N 2.OH& CH 2=CHCOOH OO 3.&HO & C(CH 2OH)4OO OO四,右旋酒石酸经常用来拆分手性胺。
请设计一个详细的试验方案,以萘为主要原料,合成并拆分β-萘乙胺。
(10%)&COOHH OH HO HNH 2(+-)萘 (+)酒石酸五,分析解答题(15%)1.化合物A 为无色液体,b.p.112℃。
经元素分析测得C68.15%;H13.70%; N 0.0%。
其相对分子量为88.15。
A 可与金属钠反应放出氢气;也能发生碘仿反应。
A的HNMR数据如下:δ0.9(双峰,面积6),1.1(双峰,面积3),1.6(多重峰,面积1),2.6(宽峰,面积1,加D2O后消失),3.5(多重峰,面积1)ppm。
A的IR显示在3300cm-1附近有一宽而圆滑的强吸收峰。
2001物理化学与有机化学

武汉大学2001年攻读硕士学位研究生入学考试试题考试科目:物理化学科目代码:一.概念题(20题, 共40分)1. 1mol单原子分子理想气体从298K, 2p0经历: (1)等温可逆; (2)绝热可逆; (3)等压可逆三条途径膨胀至体积为始态的2倍, 所作的功分别为W1,W2和W3, 三种功之间的关系为: ( W3>W1>W2 )2. 298K气相反应: CO(g)+0.5O2(g)=CO2(g), 该反应的∆G___<___∆F, ∆U___>___∆H. (填入>,<,或= 号)3.298K, 1p0下, 1mol甲苯和1mol苯混合形成理想溶液, 此混合过程的∆mix H= _____0____,∆mix S= _____11.526J/K____, ∆mix V= __0______, ∆mix G= ___-3435 J____.4.已知373.2K下, 液体A的饱和蒸汽压为133.32 kPa, 另一液体B可与A形成理想溶液. 当A在溶液中的摩尔分数为0.5时, A在气相中的摩尔分数为2/3, 则在373.2K, 纯B的饱和蒸汽压为: _____66.66kPa_______.5. 4.4%的葡萄糖(C6H12O6)水溶液的密度ρ=1.015×103 kg.m-3, 在300K时, 此溶液的渗透压为: ______6.189×105Pa_______.6.将固体NH4HCO3(s)放入真空容器箱中恒温至400K, NH4HCO3(s)按下式达分解平衡:NH4HCO3(s) = NH3(g) +H2O(g) +CO2(g), 此体系的物种数s=________4_____, 独立组分数C=____1______, 相数Φ=_____2______, 条件自由度f*=______0_______.7.合成氨反应: N2(g) + 3H2(g)= 2NH3(g) 可视为理想气体反应,达平衡后加入惰性气体, 且保持体系的温度, 总压不变, 则有: n(N2):_____增大____, n(H2): ___增大____, n(NH3): ____减小____, K p0:____不变_____.8.用分子配分函数q表达赫氏自由能F时, 独立可别粒子体系的F=______-kTlnq N_____, 不可别粒子体系的F=_____-kTln(q N/N!)_____; 若用体系配分函数Q来表达赫氏自由能F, 其表达式为:______-kTlnQ______.9.I2分子的振动能级间隔为0.43×10-20J, 在298K下, 碘分子某振动能级与较底振动能级上分子数之比N i/N i-1为______0.35______.10.分子配分函数q可以分解为________分运动形式配分函数的乘积_____, 其数学表达式为: q=______q n q e q t q r q v_______.11.在平行反应中, 要提高活化能较底的反应的产率, 应采取的主要措施为:__降低温度____.12.在碰撞理论中, 有效的反应碰撞数占总碰撞数的分数为:____exp(-E c/kT)____.13.已知HI的光分解机理为:HI+hν→H+IH+HI→H2+II+I+M→I2+M该反应的量子效率Φ=____2____.14. 迁移数的测定方法主要有: ( A: 希托夫法; B: 界面移动法; C: 电动势法.)15. 质量摩尔浓度为m的K3PO4溶液, 其平均活度系数为γ±, 则K3PO4的活度a为: ( D )A: 4γ±4(m/m0)4, B: γ±4(m/m0),C: 4γ±(m/m0), D: 27γ±4(m/m0)4,16. 用Zn(s)和Ag(s)插在HCl溶液中所构成的原电池是不可逆电池, 其主要原因是: (电池在充放电时, 电池反应不可逆).17. 用Pt电极电解SnCl2水溶液, 在阴极因H2有超电势故先析出Sn(s), 在阳极上析出O2气,已知: a(Sn2+)=0.10, a(H+)=0.01, 氧在阳极上析出的超电势为0.3V, 已知ϕ0Sn2+,Sn= -0.140V, ϕ0O2,H2O,H+= 1.23V, 则此电池的实际分解电压= ( 1.782V ).18. 表面超量Γ2是指: ( 单位面积的表面层中所含溶质的物质的量与具有相同质量溶剂的本体溶液中所含溶质的物质的量之差), 当dγ/da2<0时, Γ2>0, 此时将发生( 正)吸附; 反之, 当dγ/da2>0时, Γ2<0, 此时将发生( 负)吸附.19. 在298K下, 已知A液的表面张力是B液的一半, A的密度是B的两倍, 如果A液的毛细管上升是1cm, 则用相同的毛细管测定B液, B在毛细管中将会上升( 4 )cm. 20. 混合等体积的0.08 mol.dm-3KI和0.1 mol.dm-3 AgNO3溶液所得溶胶的胶团结构式为: ({(AgI)m·nAg+·(n-x)NO3-}x+·xNO3-), 胶团电泳方向为( 向负极移动); 比较MgSO4, Na2SO4, CaCl2电解质对溶胶的聚沉能力大小循序为: (Na2SO4>MgSO4>CaCl2).二. (10分) 1mol单原子分子理想气体由始态(300K, 10p0), 经历如下途径膨胀到1p0: (1)等温可逆膨胀; (2)等温恒外压(1p0)膨胀; (3)向真空膨胀; (4)等外压(1p0)绝热膨胀, 求此过程的Q, W, ∆U, ∆H, ∆S, ∆F, ∆G? (最后一条途径不必求∆S,∆F和∆G)解: (1) 理想气体等温可逆过程:∵dT=0 ∴∆U=0; ∆H=0Q=W=nRTln(p1/p2)=8.314×300×ln(10/1)= 5743 J∆S=Q r/T=nRln(p1/p2)= 5743/300= 19.14 J.K-1∆F=∆G= nRTln(p2/p1)=-5743 J(2)等温恒外压膨胀:因为途径(2)与途径(1)的始末态相同, 故状态函数的改变值相同, 故有:∆U=0, ∆H=0, ∆S=19.14 J.K-1, ∆F=∆G=-5743 J.Q=W=p2(V2-V1)= p2V2-p2V1=p2V2-0.1p1V1=RT(1-0.1)=0.9RT= 2245 J(3)等温恒外压膨胀:因为途径(2)与途径(1)的始末态相同, 故状态函数的改变值相同, 故有:∆U=0, ∆H=0, ∆S=19.14 J.K-1, ∆F=∆G=-5743 J.∵p外=0 ∴W=Q=0(4) 绝热过程Q=0W=p2(V2-V1)=-∆U=C V(T1-T2)=3/2R(300-T2)RT2-0.1RT1=1.5R(300-T2)=R(T2-30)450-1.5T2=T2-30 2.5T2=480 T2=192K∆U= C V(T2-T1)=1.5R(192-300)=-1347 JW=-∆U= 1347 J∆H= C p(T2-T1)=2.5R(192-300)=-2245 J∆S=C p lnT2/T1+Rlnp1/p2=2.5R·ln192/300+R·ln10/1=9.88 J.K-1三. (10分) 下图为SiO 2-Al 2O 3体系的相图, 固体二氧化硅有白硅石和鳞石英两种晶形, 白硅石在较高温度下稳定, 鳞石英在较低温度下较稳定. (1) 指出图中各区域由哪些相组成;(2) 图中EF, CD, AB 线代表哪些相平衡共存; (3) 画出x, y, z 点的步冷曲线? ( 莫莱石的化学式为: 2Al 2O 3·3SiO 2 ).解:(1) 图中个区域相的组成为:区域1: 两相区, 熔液+二氧化硅, f=1;区域2: 两相区, 熔液+莫莱石, f=1;区域3: 两相区, 熔液+氧化铝, f=1;区域4: 两相区, 莫莱石+二氧化硅, f=1;区域5: 两相区, 鳞石英+莫莱石, f=1;区域6: 两相区, 莫莱石+氧化铝, f=1;区域7: 单相区, 熔液, f=2. (2) 图中的三条线均为三相线, 体系点处于三相线上时体系呈三相平衡态.AB: 鳞石英+白硅石+莫莱石, f=0;CD: 熔液+白硅石+莫莱石, f=0;EF: 熔液+莫莱石+氧化铝, f=0.(3) 步冷曲线见右图.四.(10分) 复相反应 2CuBr 2(s)=2CuBr(s)+Br 2(g) 在487K 下达平衡时, p(Br 2)=0.046p 0. 现有10升的容器, 其中装有过量的CuBr 2(s), 并加入0.1mol I 2(g), 由于发生气相反应: Br 2(g)+I 2(g)=2BrI(g), 使体系在达平衡时的总压为0.746p 0, 试求反应Br 2(g)+I 2(g)=2BrI(g)在487K 的平衡常数? (设气相反应可视为理想气体反应)解: 容器中在加入I 2以前所含Br 2(g)的量为:n(Br 2)=pV/RT=0.046×101325×0.01/(8.314×487)=0.01151 mol2CuBr 2(s) = 2CuBr(s) + Br 2(g) (1)平衡时的摩尔数: 0.01151设加碘后, 碘的反应量为x 摩尔Br 2(g) + I 2(g) = 2BrI(g)(2)加碘后达平衡: 0.01151 0.1-x 2x因为反应(1)的平衡常数是一常数, 故加入碘后, 虽有溴参加反应生成BrI, 但反应体系达平衡后, 体系的溴分压不变, 故溴的量不变.体系中气相物质的总量为: n 总=0.1151+0.1-x+2x=0.11151+x另由理想气体状态方程得: n 总=pV/RT=0.746×101325×0.01/(8.314×487)=0.1867 mol ∴ 0.11151+x=0.1867 x=0.0752 mol∴ n(BrI)=2x=0.1504 mol n(Br 2)=0.01151 mol n(I 2)=0.0248 mol反应(2)是一等分子理想气体反应, 故有:K p 0=K p =K N =n(BrI)2/n(I 2)n(Br 2)=0.15042/(0.0248×0.01151)=79.24反应(2)在487K 下的平衡常数为79.24.五. (15分) 硝胺在水中按下式分解: NO 2NH 2→N 2O(g)+H 2O 反应的经验速率方程为: d[N 2O]/dt=k[NO 2NH 2]/[H 3O +]. 试求:(1) 在缓冲溶液中, 此反应的表观反应级数为多少;(2) 下列反应机理中, 哪一个最能说明上述反应动力学方程式, 并给出理由;机理A: NO 2NH 2−→−1kN 2O+H 2O 机理B: NO 2NH 2+H 3O+ 2NH 3+ +H 2O (快速平衡)NO 2NH 3+−→−3k N 2O+H 3O + (控制步骤) 机理C: NO 2NH 2+H 2O NO 2NH - +H 3O + (快速平衡)NO 2NH -−→−5k N 2O+OH - (控制步骤)H 3O ++OH -−→−6k2H 2O (快反应) (3) 试说明OH -离子催化硝胺分解的作用;(4) 在恒温恒压的缓冲溶液中研究此反应,测定N 2O 的分压得如下结果: (设N 2O 不溶于水)t(min): 0 5 10 15 20 25p(Pa): 0 6800 12400 17200 20800 24000在足够时间后, 压力稳定在40000Pa. (a.) 将压力表达为时间t 和速率常数k 的函数; (b) 计算表观反应速率常数k ’,并给出其单位?解: (1) 在缓冲溶液中pH 值为定值, 故[H 3O +]为常数∴ r=k[NO 2NH 2]/[H 3O +]=k ’[NO 2NH 2]在缓冲溶液中, 反应是表观一级反应.(2) 按机理A: r=k 1[NO 2NH 2], 与实验结果不同.按机理B: r=r 3=k 3[NO 2NH 3+]∵ K=k 2/k -2=[NO 2NH 3+][H 2O]/ [NO 2NH 2][H 3O +]∴ [NO 2NH 3+]=K[NO 2NH 2][H 3O +]/[H 2O]r=k 3 K[NO 2NH 2][H 3O +]/[H 2O]=k ’[NO 2NH 2][H 3O +]与实验所得动力学方程不同.按机理C: 反应速率取决于第二步, 故有:k -2 k 2 k -4 k 4r=k5[NO2NH-]∵K= k4/k-4=[NO2NH-][H3O+]/ [NO2NH2][H2O]∴[NO2NH-]= k4/k-4·[NO2NH2][H2O]/ [H3O+]r=k5·k4/k-4·[NO2NH2][H2O]/ [H3O+]=k[NO2NH2]/[H3O+]其中: k= k5·k4/k-4·[H2O]故机理C与实验结果相吻合.(3) ∵[H3O+]=K w/[OH-]r= k/k w·[NO2NH2][OH-]故此反应的速率与OH-离子的浓度成正比, 所以OH-有催化作用.(4) (a) [N2O]=p(N2O)/RTr=d[N2O]/dt=1/RT·dp(N2O)/dt=k[NO2NH2]/[H3O+]∵[NO2NH2]=(n(NO2NH2)t=0-n(N2O))/V=(n(N2O)t=∞-n(N2O))/V=(p∞-p N2O)/RT∴r=1/RT·dp(N2O)/dt =k(p∞-p N2O)/(RT·[H3O+])dp(N2O)/dt= k(p∞-p N2O)/[H3O+]=k’(p∞-p N2O)积分得:ln(p∞/(p∞-p N2O))=k’t p=p∞(1-e-k’t)(b) 有数据得:k’=3.70×10-2min-1.六. (10分) 298K下有反应: H2(g,1p0)+I2(s)=2HI(aq, a=1)(1)将此反应安排为电化学反应, 写出电池表达式;(2)求298K下此电池反应的∆r G m0, 反应平衡常数K a0, 电池电动势E和E0;(3)若反应写为: 0.5H2(g,1p0)+0.5I2(s)=HI(aq, a=1), 求其∆r G m0, K a0, E和E0;(已知: I-(aq)的标准生成吉布斯自由能∆f G m0(I-,aq,a=1)=-51.67 kJ.mol-1)解:(1) 电池表达式为: Pt| H2(g,1p0)| HI(aq,a=1)| I2(s) |Pt(2) 化学反应式为: H2(g,1p0)+I2(s)=2HI(aq, a=1)∆r G m0=2∆f G m0(H+)+2∆f G m0(I-)-∆f G m0(H2,g)-∆f G m0(I2,s)=0+2×(-51.67)-0-0=-103.34 kJ.mol-1K a0=exp[-∆r G m0/RT]=1.3×1018E=E0=-∆r G m0/2F=0.5354 V(3) 若电池反应写为:0.5H2(g,1p0)+0.5I2(s)=HI(aq, a=1)∆r G m0=-51.67 kJ.mol-1K=1.14×109E=E0=0.5354 V七.(5分) 试求NO(g)在298.15K, 1p0下的标准摩尔熵(不考虑核运动和电子运动对熵的贡献)?已知: NO的Θr=2.42K, Θv=2690K, 电子基态与第一激发态的简并度均为2, 两能级之差为2.473×10-21 J.解: S m,t=R[1.5lnM r+2.5lnT-ln(p/p0)-1.165]=8.314(1.5·ln30.01+2.5ln298.15-1.165)=8.314·18.181=151.159 J.K-1.mol-1 S m,r=Rlnq r+R=R(ln(T/Θr)+1) ∵σ=1 (NO为异核双原子分子)=8.314·(ln(298.15/2.42)+1)=48.336 J.K-1.mol-1S m,v=R·x/(e x-1)-Rln(1-e-x) x=Θv/T=2690/198.15=9.0223=R(9.0223/(e9.0223-1)-ln(1-e-9.0223))=0.010 J.K-1.mol-1S m=151.159+48.366+0.010=199.505 J.K-1.mol-1。
2001年全国普通高等学校招生同一考试(上海卷)化学卷

化学卷
本试卷分为第Ⅰ卷(第 l~4 页)和第Ⅱ卷(第 5~10 页)两部分。全卷共 10 页。满 分 150 分。考试时间 120 分钟。
第Ⅰ卷(共 75 分)
考生注意: 1.答第 I 卷前,考生务必将姓名、高考座位号、校验码等用铅笔正确地涂写在答题
为 175 的超重元素,该元素原子核内的中子数与核外电子数之差是
A 57 B 47 C 61 D 293
3.下列物质不属于“城市空气质量日报”报道的是
A 二氧化硫 B 氮氧化物 C 二氧化
A氨
C氮
5.下列科学家中,为我国化学工业作出重大贡献的是 A 邓稼先 B 李四光 C 华罗庚 D 侯德榜
B 四氯化碳
D 二氧化碳
二、选择题(本题共 36 分),每小题 3 分,只有一个正确选项,答案涂写在答题纸
2.社会主义本质理论对探索怎样建设3.社19会57主年义2月具,有毛重在要《的关实于践正意确义处。理社人会民主内义2.社部本科会矛质学主盾理的义的论1本本问的.邓质质题提小是的》出平创科讲,提新学话为出,内中我“创涵提们社邓新。出寻始会小的邓(找终主平关小1一代义)坚键平种表的我2持在对能.1中本国把科人社9够国质社5发学才会从4先,会展社年,主更进是主作会,人义深生解义为主毛才本层产放制执义在的质次1力生度政理《成所.认社1的产还兴论论长作.识会 发发力刚国和十靠的社主 展展,刚的实大教概会义 才要发建第践关坚育括主本 是求展立一的系2持。,义质 硬、,生,要基》以人一,理 道发大产还务本重发才方从论 理展力力没是成要展资面而把 ,才促,有由果讲社的源强为我 把是进消完中,话会办是调中四们 发(硬先灭全国抓中主法第必国、对 展2道进剥建共住提三义解一)须的科社 生理生削立产“出、经决资采解
有机化学考研习题附带答案解析

综合练习题(一)一 选择题 (一)A 型题1 下列体系中既有p-π共轭又有π-π共轭的是( )2 氨基(-NH 2)既具有邻、对位定位效应,又可使苯环致活的主要原因是( ) A +I 效应 B -I 效应 C 供电子p-π共轭(+C 效应) D π-π共轭效应 E 吸电子p-π共轭(-C 效应)3 化合物 发生硝化反应易难顺序为( )A ④ ① ② ⑤ ③B ③ ⑤ ② ① ④C ⑤ ③ ② ④ ①D ① ④ ② ③ ⑤E ④ ① ⑤ ③ ② 4 下列化合物中最易与 H 2SO 4反应的是( )5 稳定性大小顺序为( )A ① ② ③ ④B ① ③ ② ④C ③ ① ④ ②D ② ① ③ ④E ③ ④ ① ②6 下列卤烃在室温下与AgNO 3醇溶液作用产生白色沉淀的是( ) A 溴化苄 B 异丙基氯 C 3-氯环己烯 D 烯丙基碘 E 丙烯基氯7 ① 吡咯 ② 吡啶 ③ 苯胺 ④ 苄胺 ⑤ 对甲苯胺的碱性由强到弱顺序为( ) A ④ ② ③ ⑤ ① B ② ④ ③ ① ⑤ C ④ ② ⑤ ③ ① D ⑤ ③ ② ④ ① E ② ⑤ ③ ④ ①8 下列化合物即可与NaHSO 3作用,又可发生碘仿反应的是( )A CH 3CHCH 3B CH 2 CC C1CH CH 2D ECH 2OH Br +CH CHCH 3COOH OH NO 2OCOCH 3①②③④⑤AB CDECH 3CHCCH 2CH 3CH 3(CH 3)2CCCH 2CH 3CH 3C CHCH CHCHCH 3CH 3C (CH 3)2CH 23C 2H 5CH3H 5C 2CH 32H 5CH 3H 5C 2CH 3①②③④A (CH 3)2CHCHOB CH 3COCH 3C (CH 3)2CHOHD E9 化合物 与NaOH 醇溶液共热的主要产物是( )10 下列各组反应中两个反应均属同一反应机制的是( )11 化合物的酸性强到弱顺序为( )A ② ④ ⑤ ③ ①B ④ ② ⑤ ① ③C ④ ② ⑤ ③ ①D ⑤ ③ ②④ ① E ② ⑤ ④ ① ③12 下列化合物即能产生顺反异构,又能产生对映异构的是( )A 2,3-二甲基-2-戊烯B 4-氯-2-戊烯C 3,4-二甲基-2-戊烯D 2-甲基-4-氯-2-戊烯E 4-甲基-2-氯-2-戊烯 13 两分子丙醛在稀碱作用下的最终产物是( )14 下列物质最易发生酰化反应的是( )A RCOORB RCORC RCOXD (RCO)2OE RCONH 2 15 在酸性或碱性条件下均易水解的是( )A 油脂B 缩醛C 糖苷D 蔗糖E 淀粉 16 溶于纯水后,溶液PH=5.5的氨基酸,估计其等电点( )COCH 3CH 3CHCH CCH 3Br BrA B C DECH 3CHCH CCH 3Br OH CH 3CH CCH 3Br CHCHCCH 3Br CH 3CHCH CCH 3OHBr CH 3CHCHCBr CH 2CH 2C ABC DECH 3CHCHCHCHO CH 3CHCHCHCHOCH 3CH 2CHCHCH 2CHOCH 3CH 3CH 2CHCCHOCH 3CH 3CH 3CH2CHOCH 3A 等于5.5B 小于5.5C 大于5.5D 等于7E 无法估计17 化合物分子中含有的杂环结构是()A 吡啶B 嘧啶C 咪唑D 嘌呤E 喹啉18 下列物质能发生缩二脲反应的是()19 下列化合物烯醇化趋势最大的是()20 与苯胺、苯酚、烯烃、葡萄糖都能反应,并有明显现象的试剂是()A Fehling试剂B Br2/H2OC FeCl3D Schiff试剂E Tollens试剂(二)X型题21 化合物CH3CH = C(CH3)2与溴水及氯化钠水溶液作用的主要产物有()22 脑磷脂和卵磷脂水解可得到的共同物质是()A 甘油B 胆碱C 胆胺D 脂肪酸E 磷酸23 下列化合物名称正确的是()A 2-乙基-2-戊烯B 3-甲基-2-戊烯C 2-溴-3-戊烯D 3-溴-2-戊烯E 3-甲基-2-苯基-4-氯戊烷24 下列物质能与Tollens试剂作用产生银镜的是()25 下列物质受热即可脱羧的是( )26 下列Fischer 式表示同一物质的有( )化合物27 受热可发生脱水反应的是( ) 28 与浓H 2SO 4共热可放出CO 气体的是( ) 29 下列物质能与HNO 2作用并放出N 2的是( )30 甘氨酸与丙氨酸加热脱水成肽的产物为( )二 判断题31 分子构造相同的化合物一定是同一物质。
大学有机化学二课后题答案

第二章 饱和脂肪烃2.1 用系统命名法(如果可能的话,同时用普通命名法)命名下列化合物,并指出(c)和(d) 中各碳原子的级数。
a.CH 3(CH 2)3CH(CH 2)3CH 3C(CH 3)22CH(CH 3)2 b.C H C H CH H C H HC H CHHc.CH 322CH 3)2CH 23d.CH 3CH 2CHCH 2CH 3CHCH CH 2CH 2CH 3CH 3CH 3e.C CH 3H 3C CH 3Hf.(CH 3)4Cg.CH 3CHCH 2CH 32H 5h.(CH 3)2CHCH 2CH 2CH(C 2H 5)21。
答案:a. 2,4,4-三甲基-5-正丁基壬烷 5-butyl -2,4,4-trimethylnonane b. 正己 烷 hexane c. 3,3-二乙基戊烷 3,3-diethylpentane d. 3-甲基-5-异丙基辛烷 5-isopropyl -3-methyloctane e. 2-甲基丙烷(异丁烷)2-methylpropane (iso-butane) f. 2,2-二甲基丙烷(新戊烷) 2,2-dimethylpropane (neopentane) g. 3-甲基戊烷 3-methylpentane h. 2-甲基-5-乙基庚烷 5-ethyl -2-methylheptane 2.2 下列各结构式共代表几种化合物?用系统命名法命名。
a.CH 3CHCH 32CH3CH 3CH 3 b.CH 3CH3CH 2CHCH 3CH CH 3CH 3c.CH 3CH 3CH CH 3CH 3CH CH 3CH 3d.CH 3CHCH 2CHCH 3CH 3CH H 3CCH 3e.CH 3CH CH CH 2CH CH 3CH 333f.CH 3CH CH 3CH CH3CH 3CHCH 33答案:a =b = d = e 为2,3,5-三甲基己烷c = f为2,3,4,5-四甲基己烷2.3 写出下列各化合物的结构式,假如某个名称违反系统命名原则,予以更正。
有机化学二试题及答案考研

有机化学二试题及答案考研### 有机化学二试题及答案#### 一、选择题(每题2分,共20分)1. 下列化合物中,哪一个是醇?- A. CH₃COOH- B. CH₃CH₂OH- C. CH₃COCH₃- D. CH₃OH答案:B2. 以下哪个反应是亲核取代反应?- A. 酯化反应- B. 卤代烃的水解- C. 格氏试剂与醛的反应- D. 狄尔斯-阿尔德反应答案:B3. 以下哪个化合物是芳香族化合物?- A. 环己烷- B. 苯- C. 环戊烯- D. 环丁醇答案:B4. 以下哪个反应是消除反应?- A. 醇的脱水反应- B. 酯的水解- C. 卤代烃的消去反应- D. 醛的氧化答案:C5. 以下哪个是有机合成中常用的保护基团?- A. 乙酰基- B. 甲基- C. 苯基- D. 羟基答案:A#### 二、简答题(每题10分,共30分)1. 简述羧酸的化学性质。
羧酸具有酸性,可以与碱反应生成盐和水;具有酯化反应性,可以与醇反应生成酯和水;此外,羧酸还可以发生还原反应生成醛或醇。
2. 描述格氏试剂的制备过程。
格氏试剂的制备通常使用卤代烃与金属镁反应,例如:RCl + Mg → R-MgCl。
在这个过程中,卤代烃中的卤素原子被镁原子取代,生成有机镁化合物,即格氏试剂。
3. 什么是迈克尔加成反应?迈克尔加成反应是一种亲核加成反应,其中含有α,β-不饱和羰基的化合物作为电子受体,与含有亲核性的化合物(如烯醇、胺等)发生加成反应,生成新的碳-碳键。
#### 三、计算题(每题25分,共50分)1. 已知某化合物A的分子量为90,其分子式为C₅H₁₀O,计算A的不饱和度。
不饱和度的计算公式为:不饱和度 = (2C + 2 + N - H - X) / 2,其中C、H、N、X分别代表碳、氢、氮、卤素原子的数目。
对于A,C = 5,H = 10,N = 0,X = 0,代入公式得:不饱和度 = (2*5 + 2) / 2 = 1。
