氮氧化物(一氧化氮和二氧化氮)检测原始记录
空气中氮氧化物NOx的测定

四、实验步骤
1. 采样:将10毫升采样用的吸收液注入多孔玻板吸收 管中,吸收管的进气口接三氧化铬 —砂子氧化管,并 使氧化管的进气端略向下倾斜,以免潮湿空气将氧化 剂弄湿污染后面的吸收管。吸收管的出气口与大气采 样器相连接,以 0.4 升 / 分的流量避光采样至吸收液呈 浅玫瑰红色为止(采气4~24升)。如不变色,应加大采 样流量或延长采样时间。在采样同时,应检测采样现 场的温度和大气压力,并做好记录。
2. 注意事项:
①配制吸收液时,应避免在空气中长时间曝露,以免吸收空气中 的氮氧化物。光照射能使吸收液显色,因此在采样、运送及存放 过程中,都应采取避光措施。 ②采样过程中,如吸收液体积显著缩小,要用水补充到原来的体 积(应预先作好标记)。
③氧化管应于相对湿度为30%~70%时使用,当空气相对湿度大
三、实验仪器和试剂
(一)实验用仪器 除一般通用化学分析仪器外,还应具备:
多孔玻板吸收管。 空气采样器(KC—6型)。。
双球玻璃氧化管(内装涂有三氧化铬催化剂的石英砂)。
分光光度计(7220型)。
KC—6D型大气采样器
(二)实验用试剂
所有试剂均用不含硝酸盐的重蒸蒸馏水配制。检验方法是要求用 该蒸馏水配制的吸收液的吸光度不超过 0.005(540 ~ 545nm , 10mm比色皿,水为参比)。 1. 显色液:称取 5.0 克对氨基苯磺酸,置于200 毫升烧杯中,将 50毫升冰醋酸与900毫升水的混合液分数次加入烧杯中,搅拌使 其溶解,并迅速转入 1000 毫升棕色容量瓶中,待对氨基苯磺酸 溶解后,加入0.03克盐酸萘乙二胺,用水稀释至标线,摇匀,贮 于棕色瓶中。此为显色液,25℃以下暗处可保存一月。 采样时,按四份显色液与一份水的比例混合成采样用的吸收液。
氮氧化物的测定实验报告(一)

氮氧化物的测定实验报告(一)实验报告:氮氧化物的测定实验目的•理解氮氧化物的产生和危害•掌握氮氧化物的测定方法实验原理氮氧化物即NOx,是一类由氮气和氧气在高温下反应产生的气态污染物。
其中NO是一氧化氮,NO2是二氧化氮,两者的总和称为NOx。
氮氧化物的来源多种多样,如汽车尾气、工业废气、燃煤烟气等。
它们不仅对人类健康造成威胁,还会对环境产生严重影响。
本实验采用化学吸收法测定氮氧化物的含量。
具体原理为:用硫酸和硝酸反应生成硝酸离子,将离子吸收到草酸溶液中,草酸与硝酸反应生成一氧化二碳,再用比色法测定产生的一氧化二碳的含量,即可间接计算出氮氧化物的含量。
实验步骤1.用草酸溶液洗净试管、瓶塞等玻璃器皿,并将瓶塞塞好。
2.用滴管向瓶中加入一定量的硫酸和硝酸,轻轻摇匀。
3.密闭瓶子,并沉淀30分钟以上,使沉淀物脱水。
4.用滴管向密闭瓶中加入草酸溶液,轻轻摇匀,将草酸与硝酸反应得到一氧化二碳。
5.用积分泵向草酸溶液中通入空气,稀释一氧化二碳,之后用比色皿比色,测定产生的一氧化二碳的含量。
6.根据计算公式,计算出氮氧化物的含量。
实验结果使用上述方法,我们测得采样点的氮氧化物的浓度为30mg/m3。
实验结论本实验使用化学吸收法能够测定出样品中氮氧化物的含量,这是一种间接计算方法,其原理简单易懂,操作相对较容易。
但是此测定方法存在许多局限性,如不适用于高浓度氮氧化物的测定。
参考文献1.周卫, 赵兰英, 王荣芝. 环境质量监测技术与方法. 科学出版社,2014.2.环境质量标准. GB 3095-2012. 国家标准出版社, 2012.实验注意事项•操作过程中要佩戴手套和口罩,避免吸入有害气体和接触有害化学制剂。
•实验器材要先用草酸清洗干净,以避免对测定结果产生影响。
•采样点要选择典型的污染源,以保证实验结果的准确性。
•草酸溶液制备过程中需注意草酸的浓度,过高或过低均会影响测定结果。
实验结果分析本实验测定结果显示,采样点氮氧化物的含量为30mg/m3,属于较高的范围。
大气中氮氧化物的测定实验报告

大气中氮氧化物的测定实验报告一、实验目的。
本实验旨在通过实验方法测定大气中氮氧化物的含量,进一步了解大气污染情况,为环境保护和治理提供科学依据。
二、实验原理。
大气中的氮氧化物主要包括一氧化氮(NO)和二氧化氮(NO2),这两种氮氧化物是大气污染的主要来源之一。
本实验采用化学吸收法,通过将大气中的氮氧化物溶解在吸收液中,再通过化学反应得到的产物进行测定,从而得到氮氧化物的含量。
三、实验步骤。
1. 准备实验设备和试剂,包括吸收瓶、吸收液、分析仪器等;2. 在大气污染较为严重的地区选择实验点,设置吸收瓶,将大气中的氮氧化物吸收到吸收液中;3. 将吸收液中的氮氧化物与试剂进行反应,生成化学物质;4. 采用分析仪器对生成的化学物质进行测定,得出氮氧化物的含量;5. 对实验结果进行统计分析,得出大气中氮氧化物的含量数据。
四、实验结果。
经过实验测定,我们得到了大气中氮氧化物的含量数据。
根据统计分析,我们发现在工业区和交通密集区,氮氧化物的含量明显高于其他地区。
尤其是在高峰时段,氮氧化物的含量更是达到了较高水平,这表明工业排放和交通尾气是大气中氮氧化物的主要来源。
五、实验分析。
大气中的氮氧化物是一种有害的气体污染物,其对人体健康和环境造成了严重的影响。
高浓度的氮氧化物不仅会导致雾霾天气的形成,还会对人体的呼吸系统造成危害,引发呼吸道疾病。
因此,我们需要采取有效的措施来减少氮氧化物的排放,保护大气环境和人民健康。
六、实验总结。
通过本次实验,我们成功测定了大气中氮氧化物的含量,并对其来源和危害进行了分析。
我们应当加强对工业和交通尾气排放的治理,推广清洁能源,减少氮氧化物的排放。
同时,也需要加强大气环境监测,及时掌握大气污染情况,采取有效措施保护环境和人民健康。
七、参考文献。
1. 环境保护部. 大气环境质量标准[S]. GB 3095-2012.2. 郭美玲, 张晓英. 大气污染物的化学测定[M]. 北京: 化学工业出版社, 2008.以上就是本次实验的全部内容,希望对大家有所帮助。
空气中氮氧化物的测定

空气中氮氧化物(NOx)的测定(盐酸萘乙二胺分光光度法)摘要:本文采用盐酸萘乙二胺分光光度法测定室内空气中氮氧化物(NOx),根据配置标准溶液用分光光度计测定其吸光度,绘制标准曲线,分析空气中氮氧化物的含量结果。
关键词:氮氧化物分光光度法含量综述大气中氮氧化物主要包括一氧化氮和二氧化氮,其中绝大部分来自于化石燃料的燃烧过程,包括汽车及一切内燃机所排放的尾气,也有一部分来自与生产和使用硝酸的化工厂、钢铁厂、金属冶炼厂等排放的废气中。
动物实验证明,氮氧化物对呼吸道和呼吸器官有刺激作用,是导致目前支气管哮喘等呼吸道疾病不断增加的原因之一,二氧化氮与二氧化硫和浮游颗粒物共存时,其对人体的影响不仅比单独二氧化氮对人体的影响严重的多,而且也大于各自污染物之和。
对人体的实际影响是各污染物之间的协同作用。
因此大气氮氧化物的监测分析是环境保护部门日常工作的重要项目之一。
采用化学发光法测定空气中氮氧化物较以往的盐酸禁乙二胺分光光度法具有灵敏度高、反应速度快、选择性好等特点 ,现已被很多国家和世界卫生组织全球监测系统作为监测氮氧化物的标准方法 ,也已引起我国环保部门的注意和重视 ,相信不久将来 ,此方法也会成为我国环境空气监测氮氧化物的首推方法。
1、实验目的(1)熟悉、掌握小流量大气采样器的工作原理和使用方法;(2)熟悉、掌握分光光度计的工作原理及使用方法。
(3)掌握大气监测工作中监测布点、采样、分析等环节的工作内容及方法。
2、实验原理,测定氮大气中的氮氧化物(NOx)主要是一氧化氮(NO)和二氧化氮(NO2))氧化管将一氧化氮成二氧化氮。
二氧化氧化物浓度时,先用三氧化铬(CrO3),与对氨基苯磺酸起重氧化反应,再与盐氮被吸收在溶液中形成亚硝酸(HNO2酸萘乙二胺偶合,生成玫瑰红色偶氮染料。
于波长540~545之间测定显色溶液的吸光度,根据吸光度的数值换算出氮氧化物的浓度,测定结果以二氧化氮表示。
本法检出限为0.05μg/5mL,当采样体积为6L时,最低检出浓度为0.01μg /m3。
环境空气和废气现场采样数据记录明细

采样指标氟化物
备注
流量
采样时间 采气量
(L/min)
(m3)
100—120
10 以上
(气流线速约
0.3—0.4m/s)
环境空气二氧化硫的测定(甲醛吸收一副玫瑰苯胺分光光度法)
(L/min)
0.5 45—60min
采气量 (m3)
吸收液温度保持在 23℃—29℃范围。
短时间采 样
环境空气氮氧化物(一氧化氮和二氧化氮)
的测定(盐酸蔡乙二胺分光光度法)
采样指标 NO2
流量
采气时间
采气量
备注
(L/min)
0.4
1h 以内 4L—24L
流量
长时间采 (L/min)
样
0.2
采样时间 24h
采气量 288L
固定污染源排气中氰化氢的测定(异烟酸一—吡唑啉酮分光光度法)
采样指标氰化氢
备注
流量
采样时间 采气量
有组织排放 (L/min) 样品采集
0.5 10—30min
流量 采样时间
无 组 织 排 放 (L/min)
样品采集
0.5 30—60min
采气量
大气固定污染源氟化物的测定(离子选择电极法)
采样指标氟化物
备注
流量
采样时间 采气量
(L/min)
0.5—2.0
5—20min
环境空气氟化物的测定滤膜采样氟(离子选择电极法)
0.2
流量 (L/min)
当吸收液颜色有明显 减退时即停止采样; 如不褪色采样 60min
采样时间
采气量 (m3)
详见 GB16297—1996
0.6 当甲基橙吸收液颜色 明显减退时,即可停 止采样。如不退色, 采样时间选择 60min。
氮氧化物的测定

氮氧化物的测定(依据HJ 693-2014)1含义1.1氮氧化物指固定污染源废气中以一氧化氮(NO)和二氧化氮(NO2)形式存在的氮氧化物。
分析方法本标准规定了测定固定污染源废气中氮氧化物的定电位电解法。
2适用范围本标准适用于固定污染源废气中氮氧化物的测定。
本标准的方法检出限为一氧化氮3mg/m3(以NO2计),二氧化氮3mg/m3;测定下限为一氧化氮12mg/m3(以NO2计),二氧化氮12mg/m3。
3 术语和定义3.1校准量程仪器的校准上限,为校准用标准气体浓度值(若多点校准则为校准用最高标准气体浓度值)。
校准量程(以下用C.S.表示)的选择要适当,所测气态污染物平均浓度应在C.S.的20%~100%之间,不得超过C.S.。
当测定低浓度的氮氧化物(NOx)时,为实现数据质量目标,不要选择过高的C.S.。
C.S.应小于或等于仪器的满量程。
3.2 零点漂移在测定前后,仪器对相同零气的测定结果的偏差与校准量程的百分比。
3.3量程漂移在测定前后,仪器对相同标准气体的测定结果的偏差与校准量程的百分比。
3.4系统偏差标准气体直接导入仪器主机进气口(直接测定模式)得到的测定结果与标准气体由采样管端导入仪器(系统测定模式)得到的测定结果的偏差与校准量程的百分比。
4 方法原理抽取废气样品进入主要由电解槽、电解液和电极(包括三个电极,分别称为敏感电极、参比电极和对电极)组成的传感器。
NO或NO2通过渗透膜扩散到敏感电极表面,在敏感电极上发生氧化或还原反应,在对电极上发生还原或氧化反应。
反应式如下:NO + 2H2O→ HNO3 + 3H+ + 3e (1)NO2 + 2H+ + 2e →NO + H2O (2)或NO2 + 2e →NO + O2–(3)1与此同时产生极限扩散电流i。
在一定的工作条件下,电子转移数Z、法拉常数F、气体扩散面积S、扩散常数D和扩散层厚度ð均为常数,因此在一定范围内极限扩散电流i的大小与NO或NO2的浓度(ρ)成正比。
氮氧化物分析仪日常检查记录(2019新版)

编号:XXXX/JL03-9-4-2019
被检查
仪器设备
名称
氮氧化物NOX分析仪
型号规格
出厂编号
最大允许误差
±4.0%或±25×10-6
周期检定/校准起止时间
20年月日~20年月日
所使用的
标准气体
出厂编号
气体浓度
不确定度
证书编号
O2=20.8%,NO<1×10-6,NO2<1×10-6
本次检查日期20年月日检查人核验人检查环境条件
温度:℃,相对湿度:%,大气压力:kPa
标准值
测量值
平均值
绝对误差
相对误差
1
2
3
NO=3000×10-6
CO2=2.0%
NO2=600×10-6
NO=300×10-6
CO2=12.0%
NO2=50×10-6
NOX传感器的响应时间
T10
T90
数据分析判断及结论:
按照GB3847-2018规定,该仪器示值误差为满足技术要求,响应时间满足技术要求,仪器可继续使用。
按照GB3847-2018规定,该仪器示值误差不满足技术要求,响应时间不满足技术要求,仪器不能继续使用,维修后重新检定方可继续投入使用。
技术负责人签字:
年月日
1%
NO=300×10-6,CO2=2.0%
(根据标准气体实际数值修改)
1%
NO2=50×10-6(根据标准气体实际数值修改)
3%
NO=3000×10-6,CO2=12.0%(根据标准气体实际数值修改)
1%
NO2=600×10-6(根据标准气体实际数值修改)
氮氧化物检测法

环境空气氮氧化物(一氧化氮和二氧化氮)的测定盐酸萘乙二胺分光光度法方法一:高锰酸钾氧化法1 适用范围本法规定了测定环境空气中氮氧化物的分光光度法,适用于环境空气中氮氧化物、二氧化氮、一氧化氮的测定。
本标准的方法检出限为 0.12 µg/10 ml 吸收液。
当吸收液总体积为 10 ml,采样体积为 24 L 时,空气中氮氧化物的检出限为 0.005 mg/m3。
当吸收液总体积为 50 ml,采样体积 288 L 时,空气中氮氧化物的检出限为 0.003 mg/m3。
当吸收液总体积为 10 ml,采样体积为 12~24 L 时,环境空气中氮氧化物的测定范围为 0.020~2.5 mg/m3。
2 方法原理空气中的二氧化氮被串联的第一支吸收瓶中的吸收液吸收并反应生成粉红色偶氮染料。
空气中的一氧化氮不与吸收液反应,通过氧化管时被酸性高锰酸钾溶液氧化为二氧化氮,被串联的第二支吸收瓶中的吸收液吸收并反应生成粉红色偶氮染料。
生成的偶氮染料在波长540 nm 处的吸光度与二氧化氮的含量成正比。
分别测定第一支和第二支吸收瓶中样品的吸光度,计算两支吸收瓶内二氧化氮和一氧化氮的质量浓度,二者之和即为氮氧化物的质量浓度(以NO2计)3 试剂和材料除非另有说明,分析时均使用符合国家标准或专业标准的分析纯试剂和无亚硝酸根的蒸馏水、去离子水或相当纯度的水。
必要时,实验用水可在全玻璃蒸馏器中以每升水加入0.5g高锰酸钾(KMnO4)和0.5g氢氧化钡[Ba(OH)2]重蒸。
3.1 冰乙酸。
3.2 盐酸羟胺溶液,ρ =0.2~0.5 g/L。
3.3 硫酸溶液,c(1/2H2SO4)=1mol/L:取15 ml 浓硫酸(ρ20=1.84 g/ml),徐徐加到500 ml 水中,搅拌均匀,冷却备用。
3.4 酸性高锰酸钾溶液,ρ (KMnO4)=25 g/L:称取25g 高锰酸钾于1 000 ml 烧杯中,加入500 ml 水,稍微加热使其全部溶解,然后加入 1 mol/L 硫酸溶液(3.3)500 ml,搅拌均匀,贮于棕色试剂瓶中。
氮氧化物的测定

零点校准完毕后,将仪器的采样管前端置于排气筒中,堵严采样孔,使之 不漏气。待仪器示值稳定 后,记录示值,每分钟至少记录一次监测结果。取 5min~15min 平均值作为一次测定值。测定期间内, 为保护传感器,应每测定 一段时间后,依照仪器使用说明书用清洁的环境空气或氮气清洗传感器。
测定结束 取得测定结果后,将采样管置于清洁的环境空气或氮气中,使仪器示值 回到零点附近。 关机,切断电源,拆卸仪器的各部分连接,测定结束。 10 结果计算与表示 结果计算 NOx 浓度等于 NO 浓度与 NO2 浓度之和,按下式计算以 NO2 计的标准状态 (273K,)下的 质量浓度。 仪器示值以质量浓度表示时:
8 采样位置和采样点 采样位置和采样点的设置符合 GB/T 16157、HJ/T 373 和 HJ/T 76 的规定。 仪器的采样管前端尽量靠近排气筒中心位置。
9 分析步骤 量程校准 仪器按本标准 条的步骤测定标准气体,若示值误差符合 条(2)的要 求,仪器可用。否则, 需校准。 校准方法: (1) 气袋法:先用气体流量计校准仪器的采样流量。用标准气体将洁净的 集气袋充满后排空,反复 三次,再充满后备用。按仪器使用说明书中规定的 校准步骤进行校准。 (2) 钢瓶法:先用气体流量计校准仪器的采样流量。将配有减压阀、可调 式转子流量计及导气管的 标准气体钢瓶与采样管连接,打开钢瓶气阀门,调 节转子流量计,以仪器规定的流量,通入仪器的进气 口,仪器采样流量示值 与规定值应保持一致。注意各连接处不得漏气。按仪器使用说明书中规定的校 准 步骤进行校准。 测定 零点校准 (1) 按仪器使用说明书,正确连接仪器的主机、采样管(含滤尘装置和加 热装置)、导气管、除湿 冷却装置,以及其它装置。 (2) 将加热装置、除湿冷却装置及其它装置等接通电源,达到仪器使用 说明书中规定的条件。 (3) 打开主机电源,以清洁的环境空气或氮气为零气,进行仪器零点校 准。 样品测定
锅炉二氧化硫、氮氧化物、含氧量比对监测原始记录

(mg/m3)
参比方法
实测标况数据(mg/m3)
CEMS
实测标况数据(mg/m3)
CEMS
பைடு நூலகம்折算数据
(mg/m3)
参比方法
实测标况数据(mg/m3)
CEMS
数据(m/s)
参比方法
数据(m/s)
平均值
备注:
仪器法取5分钟平均值为1个数据
CEMS法废气排放量m3/h
监测人员:校核人:审核人:
年月日年月日年月日
HJNC-A-037
锅炉二氧化硫、氮氧化物、含氧量比对监测原始记录
企业名称监测点位置
监测方法GB/T 16157-1996仪器名称皮托管平行全自动烟尘(气)油烟采样器仪器型号WJ—60B型
监测记录样品编号:
日期
时间
(h:min)
编号
比对项目
二氧化硫
氮氧化物
含氧量
CEMS
实测标况数据(mg/m3)
CEMS
氮氧化物测定实验报告

氮氧化物测定实验报告
《氮氧化物测定实验报告》
实验目的:通过实验测定氮氧化物的含量,了解其在环境中的浓度及对人体健康的影响。
实验原理:氮氧化物是指由氮和氧组成的化合物,其中包括一氧化氮(NO)、二氧化氮(NO2)等。
在环境中,氮氧化物主要来源于工业排放、汽车尾气和燃煤等。
氮氧化物对人体健康有害,容易引起呼吸系统疾病,同时也是导致酸雨的主要原因之一。
实验步骤:
1. 收集空气样品:使用气泵将环境空气抽入采样瓶中,保证采样时间和流量的准确性。
2. 氮氧化物的提取:将采样瓶中的气体样品经过化学处理,将氮氧化物转化为易于测定的化合物。
3. 氮氧化物的测定:采用化学分析方法,如化学发光法、光谱法等,测定氮氧化物的含量。
实验结果:通过实验测定,得到了环境中氮氧化物的含量为X mg/m³,超出了国家环境保护标准。
说明该区域的环境空气质量存在严重问题,需要采取有效的措施减少氮氧化物的排放。
实验结论:氮氧化物是环境空气中的重要污染物之一,对人体健康和环境造成严重影响。
通过实验测定,可以及时了解氮氧化物的浓度,为环境保护和健康保障提供科学依据。
实验启示:加强对氮氧化物的监测和控制是保护环境和人类健康的重要举措。
政府部门和社会各界应共同努力,减少氮氧化物的排放,改善环境质量,保障人民的健康。
同时,科研人员也应该不断探索新的氮氧化物测定方法,为环境保护工作提供更多的技术支持。
通过这次实验,我们更加深刻地认识到了氮氧化物对环境和人类健康的危害,也更加坚定了保护环境的决心和信心。
希望我们的努力能够为美丽的地球做出更大的贡献。
实验五空气中氮氧化物的测定

仪器
多孔玻板吸收管,10ml。 空气采样器,流量范围0~1L/min。 双球玻璃管。 分光光度计。
多孔筛板吸收瓶
(Perforated screen absorption method)
可装5~10mL吸收液,采样流量为0.1~ 1.0L/min。吸收瓶有小型(装10~30ml吸收液, 采样流量为0.5~2.0L/min)和大型(装50~ 100mL吸收液。
亚硝酸钠标准溶液
临用前,吸取贮备液5.00ml于100ml容量瓶中,用水稀释至 标线。此溶液每毫升含5.00µg亚硝酸根(NO2-)。
采样
用一支内装5.00ml吸收液的多孔玻板吸收管,进 气口接氧化管,并使管口略微向下倾斜,以免当 湿空气将氧化剂(CrO3)弄湿时,污染后面的吸 收液。以0.4L/min流量,避光采样至吸收液呈微 红色为止,记下采样时间,密封好采样管,带回 实验室,当日测定。采样时,若吸收液不变色, 采气量应不少于12L。
273
P
Vn
Vt
273 t
1013.25
(1) (2)
式中:A-样品溶液吸光度; A0-试剂空白吸光度; b-回归方程式的斜率; a-回归方程式的截距; Vn-标准状态下的采样体积(L); Vt-样品溶液总体积;
0.76-NO2(气)转换成NO2-(液)的系数。
实验报告撰写要求
样品采集 • 样品采集地点介绍; • 样品性状描述; • 样品现场测试所得理化参数。
NO2的转化 NO2活泼,是大气主要污染物之一,也是大气
中O3的人为来源。 NO2在阳光下与OH•、 O3等反应
OH • NO2 M HNO3
这是污染大气中气态HNO3的主要来源,同 时也对酸雨和酸雾的形成起重要作用。气态
氮氧化物检测法【范本模板】

环境空气氮氧化物(一氧化氮和二氧化氮)的测定盐酸萘乙二胺分光光度法方法一:高锰酸钾氧化法1 适用范围本法规定了测定环境空气中氮氧化物的分光光度法,适用于环境空气中氮氧化物、二氧化氮、一氧化氮的测定。
本标准的方法检出限为 0。
12 µg/10 ml 吸收液。
当吸收液总体积为 10 ml,采样体积为 24 L 时,空气中氮氧化物的检出限为 0.005 mg/m3。
当吸收液总体积为 50 ml,采样体积 288 L 时,空气中氮氧化物的检出限为 0.003 mg/m3。
当吸收液总体积为 10 ml,采样体积为 12~24 L 时,环境空气中氮氧化物的测定范围为 0.020~2。
5 mg/m3。
2 方法原理空气中的二氧化氮被串联的第一支吸收瓶中的吸收液吸收并反应生成粉红色偶氮染料。
空气中的一氧化氮不与吸收液反应,通过氧化管时被酸性高锰酸钾溶液氧化为二氧化氮,被串联的第二支吸收瓶中的吸收液吸收并反应生成粉红色偶氮染料。
生成的偶氮染料在波长540 nm 处的吸光度与二氧化氮的含量成正比。
分别测定第一支和第二支吸收瓶中样品的吸光度,计算两支吸收瓶内二氧化氮和一氧化氮的质量浓度,二者之和即为氮氧化物的质量浓度(以NO2计)3 试剂和材料除非另有说明,分析时均使用符合国家标准或专业标准的分析纯试剂和无亚硝酸根的蒸馏水、去离子水或相当纯度的水.必要时,实验用水可在全玻璃蒸馏器中以每升水加入0。
5g 高锰酸钾(KMnO4)和0.5g氢氧化钡[Ba(OH)2]重蒸。
3。
1 冰乙酸。
3。
2 盐酸羟胺溶液,ρ =0。
2~0.5 g/L。
3。
3 硫酸溶液,c(1/2H2SO4)=1 mol/L:取15 ml 浓硫酸(ρ20=1.84 g/ml),徐徐加到500 ml 水中,搅拌均匀,冷却备用.3。
4 酸性高锰酸钾溶液,ρ (KMnO4)=25 g/L:称取25g 高锰酸钾于1 000 ml 烧杯中,加入500 ml 水,稍微加热使其全部溶解,然后加入 1 mol/L 硫酸溶液(3。
空气中氮氧化物的测定实验报告

空气中氮氧化物的测定实验报告一、实验目的氮氧化物(NOx)是大气中的主要污染物之一,对人体健康和生态环境都有严重的危害。
本实验的目的是掌握空气中氮氧化物的测定方法,了解其在环境中的浓度水平,为环境保护和空气质量监测提供科学依据。
二、实验原理空气中的氮氧化物主要包括一氧化氮(NO)和二氧化氮(NO₂)。
在测定过程中,先用三氧化铬石英砂氧化管将一氧化氮氧化为二氧化氮,然后用吸收液吸收二氧化氮,生成亚硝酸和硝酸。
通过显色反应,使溶液呈现出特定的颜色,在一定波长下测量其吸光度,从而计算出氮氧化物的浓度。
三、实验仪器和试剂1、仪器多孔玻板吸收管空气采样器分光光度计比色管移液管2、试剂吸收液:称取 50g 对氨基苯磺酸,溶解于约 200ml 热水中,冷却后加入50ml 冰乙酸和0050g 盐酸萘乙二胺,用水稀释至1000ml,摇匀,避光保存。
三氧化铬石英砂氧化管亚硝酸钠标准溶液:准确称取 01500g 干燥的亚硝酸钠,溶于水,移入 1000ml 容量瓶中,用水稀释至刻度,摇匀。
此溶液每毫升含1000μg 亚硝酸根(NO₂⁻)。
四、实验步骤1、采样将两支内装 100ml 吸收液的多孔玻板吸收管串联,以 05L/min 的流量采气 5-30L。
采样过程中,应注意记录采样时间、地点、气温、气压等参数。
2、标准曲线的绘制取 7 支 10ml 比色管,按下表配制标准系列:|管号| 0 | 1 | 2 | 3 | 4 | 5 | 6 |||||||||||亚硝酸钠标准溶液(ml)| 0 | 010 | 020 | 030 | 040 |050 | 060 ||吸收液(ml)| 100 | 99 | 98 | 97 | 96 | 95 | 94 ||亚硝酸根含量(μg)| 0 | 10 | 20 | 30 | 40 | 50 | 60 |向各管中加入40ml 显色剂,摇匀,放置15min。
用10mm 比色皿,在波长 540nm 处,以水为参比,测定吸光度。
76 环境空气 氮氧化物 原始记录

检测:
复核:
审核:
第 页共 页
FYT/CX-22-JL76-2020A
光度法(氮氧化物)原始记录(1)
任务单号:
(环境空气氮氧化物测定,如果测氮氧化物是二氧化氮与一氧化氮加和,根据情况修改表格)
样品名称
检测项目
检测依据 HJ 479-2009(及修改单) HJ/T 43-1999 采样日期
检测日期
仪器设备及 口紫外可见分光光度计 FYT/FX-028 编号 口其他:
c vt 0.72 Vnd
F
3. 回收率:%=(测定值-本底值)/加标量×100
4. 相对误差:%= |测定值-标液浓度值|/标液浓度值×100
样品编号
吸收液 体积 V(mL)
测定用 体积(mL)
稀释
采样体积 结果值 报出值
倍数 f 吸光度 A Vr(mL) X(
)(
)
检测:
复核:
审核:
第 页共 页
FYT/CX-22-JL76-2020A
备 注 检出限:
光度法(氮氧化物)原始记录(1)(续页)
样品编号
吸收液总
测定用
稀释
采样体积 结果值 报出值
体积 Vt(mL) 体积 Va(mL) 倍数 f 吸光度 A V(
) X(
)(
)
检测:
复核:
审核:
第 页共 页
FYT/CX-22-JL76-2020A
0.20
0.30
b=
0.40
0.50
相关系数 r =
质 口加标回收
加标量:
控 口中间浓度点校准 标液浓度值:
方
式 口质控标样
职业卫生21---一氧化氮的测定原始记录
2
3
4
5
6
标准溶液(ml)
YA/JL-41.20-2016
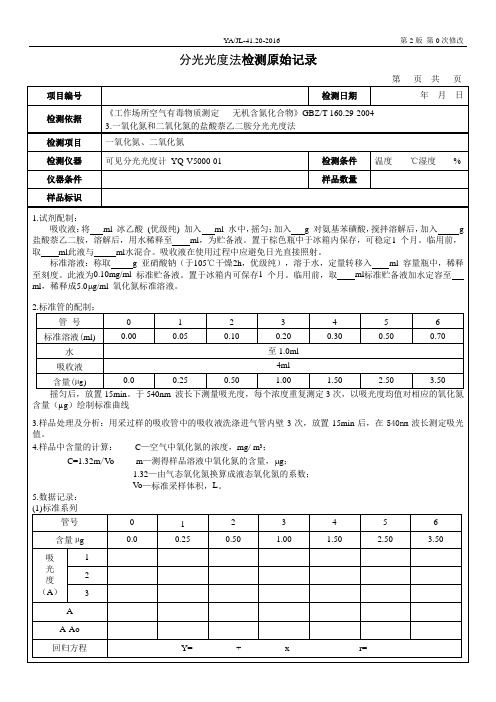
分光光度法检测原始记录
第 2 版 第 0 次修改
项目编号 检测依据
检测项目 检测仪器 仪器条件 样品标识
检测日期
第 页共 页 年月日
《工作场所空气有毒物质测定 无机含氮化合物》GBZ/T 160.29-2004 3.一氧化氮和二氧化氮的盐酸萘乙二胺分光光度法
一氧化氮、二氧化氮
A
对照吸光度
(mg/m3)
复核人:
可见分光光度计 YQ-V5000-01
检测条件 温度 ℃湿度 %
样品数量
1.试剂配制: 吸收液:将 ml 冰乙酸 (优级纯) 加入 ml 水中,摇匀;加入 g 对氨基苯磺酸,搅拌溶解后,加入 g
盐酸萘乙二胺,溶解后,用水稀释至 ml,为贮备液。置于棕色瓶中于冰箱内保存,可稳定1 个月。临用前, 取 ml此液与 ml水混合。吸收液在使用过程中应避免日光直接照射。
吸
1
光
度
2
(A)
3
A
A-Ao 回归方程
Y=
+
x
r=
(2)样品
样品
标识
A1
—
—
—
—
—
—
—
—
—
—
—
—
—
氮氧化物(一氧化氮和二氧化氮)检测原始记录
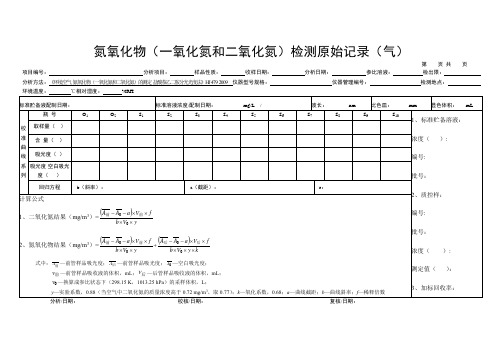
氮氧化物(一氧化氮和二氧化氮)检测原始记录(气)
第页共页
项目编号:分析项目:样品性质:收样日期:分析日期:参比溶液:检出限:. 分析方法:《环境空气氮氧化物(一氧化氮和二氧化氮)的测定盐酸萘乙二胺分光光度法》HJ 479-2009 仪器型号规格:仪器管理编号:检测地点:
环境温度:℃相对湿度:%RH
分析/日期:校核/日期:复核/日期:
氮氧化物(一氧化氮和二氧化氮)检测原始记录(气)续表
第页共页
项目编号:分析项目:样品性质:收样日期:分析日期:参比溶液:检出限:.
分析/日期:校核/日期:复核/日期:。
度法测定考样氮氧化物的实验报告

盐酸萘乙二胺分光光度法测定考样氮氧化物的实验报告一、样品:名称:氮氧化物编号:206140来源:省环境监测总站收样日期:2020年8月16日测定日期:2020年8月16日报告日期:2020年8月16日二、原理空气中的二氧化氮被串联的第一支吸收瓶中的吸收液吸收并反应生成粉红色偶氮染料。
空气中的一氧化氮不与吸收液反应,通过氧化管时被酸性高锰酸钾溶液氧化为二氧化氮,被串联的第二支吸收瓶中的吸收液吸收并反应生成粉红色偶氮染料。
生成的偶氮染料在波长540nm出的吸光度与二氧化氮的含量成正比。
分别测定第一支和第二支吸收瓶中样品的吸光度,计算两支吸收瓶内二氧化氮和一氧化氮的质量浓度,二者之和即为氮氧化物的质量浓度(以二氧化氮计)。
三、试剂①冰乙酸。
②N-(1-萘基)乙二胺盐酸储备液,称取0.50gN-(1-萘基)乙二胺盐酸于500ml容量瓶中,用水溶解稀释至刻度。
③显色液:称取5.0g对氨基苯磺酸溶解于约200ml40℃~50℃热水中,将溶液冷却至室温,全部移入1000ml容量瓶中,加入50mlN-(1-萘基)乙二胺盐酸盐储备液(②)和50ml冰乙酸,用水稀释至刻度。
④标准:准确吸取购置国家环境保护总局标准样品研究所的亚硝酸盐(185010-1标准值1000ug/ml)0.5ml稀释至200ml,浓度为1ml=2.5ug。
四、仪器4.110mL比色管。
4.2分光光度计。
注:所有玻璃器皿均应用稀盐酸或稀硝酸浸泡。
五、实验步骤:1、校准曲线的绘制取8支具塞比色管分别加入0.00,0.00,0.40,0.80,1.20,1.60,2.00mL磷酸盐标准使用溶液,加水至10mL。
各管混匀,于暗处放置20分钟(室温低于20℃时放置40分钟以上),用10mm比色皿,在波长540nm处,以水为参比测量吸光度,扣除1、2号的平均吸光度,对应NO2-的浓度(µg/ml),用最小二乘法计算标准曲线的回归方程。
2、校准曲线的绘制本次实验标准曲线系列如下:3、样品含量3.1空气中二氧化氮质量浓度ρNO2 (mg/m3)表示,按下式计算:(A1−A0−A)式中:m——试样测得含磷量,g ;九、评述1、自我评述此次实验所测项目空白、平行样测定值符合质控要求;所测项目校样测定值均在其给定的保证值范围内;由此证明检验结果和考核结果符合质控要求,准确可靠。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氮氧化物(一氧化氮和二氧化氮)检测原始记录(气)
第页共页
项目编号:分析项目:样品性质:收样日期:分析日期:参比溶液:检出限:. 分析方法:《环境空气氮氧化物(一氧化氮和二氧化氮)的测定盐酸萘乙二胺分光光度法》HJ 479-2009 仪器型号规格:仪器管理编号:检测地点:
环境温度:℃相对湿度:%RH
分析/日期:校核/日期:复核/日期:
氮氧化物(一氧化氮和二氧化氮)检测原始记录(气)续表
第页共页
项目编号:分析项目:样品性质:收样日期:分析日期:参比溶液:检出限:.
分析/日期:校核/日期:复核/日期:。
