第11章多步骤有机合成
有机合成中的多组分反应

有机合成中的多组分反应有机合成是一门研究化学反应如何构建碳碳键的学科,其中多组分反应是一种重要的合成策略。
多组分反应指的是一种在同一反应条件下,引入三个或更多的化合物,经过一系列反应步骤,合成出一个新的有机化合物的反应过程。
这种合成策略具有高效、经济以及原子经济性的特点,在有机合成中被广泛应用。
一、多组分反应的优点多组分反应相比于传统的两组分反应具有以下几个明显的优点:1. 原子经济性高:传统的有机合成往往需要多次反应才能得到目标产物,导致多个废物的产生。
而多组分反应在同一反应条件下,实现了多个化合物的串联反应,减少了废物的生成,具有较高的原子经济性。
2. 反应条件温和:多组分反应一般在室温或者较低的温度下发生,因此对于热敏感化合物的合成具有更好的选择性和适用性。
3. 反应步骤简单:相对于传统的合成策略,多组分反应通常只需要简单的反应步骤,不需要复杂的中间体的制备,从而减少了合成的步骤和时间。
二、多组分反应的不同类型多组分反应可以分为几个不同类型,其中常见的有:1. Ugi反应:Ugi反应是由四个组分组成的反应,包括一种酸、一种酰胺、一种胺和一种醛。
该反应以羧酸为引发剂,经过酰胺与醛的互变异构反应,生成具有四个不同官能团的产物,成为多肽化合物。
2. Petasis反应:Petasis反应是一种以醛、胺和格氏试剂(zinc reagent)为三个组成部分的反应。
这种多组分反应可以高效地构建C-N键和C-C键,合成具有药物活性的杂环化合物。
3. Passerini反应:Passerini反应是由醛、酸和异氰酸酯组成的反应。
该反应通过酸催化下的酯化和异氰化反应,生成具有酰胺和酰干酵素酯结构的碳骨架。
4. Mannich反应:Mannich反应是以醛、胺和羱为三个组分的反应类型。
这种反应可以高效地合成β-胺基酮化合物,具有广泛的应用领域,如药物合成和天然产物的合成等。
三、多组分反应的应用多组分反应在有机合成的领域中有广泛的应用。
大学有机化学有机合成全面总结

OH
α -氰 醇
α -羟 基 酸
应用范围:醛、甲基脂肪酮 、C8以下环酮
2. 增加二个碳原子的反应
R MgX + CH2 CH2 O
R CH2CH2 H3O+ RCH2CH2OH OMgX
3. 增加多个碳原子的反应
① R-C CH NaNH2 R-C CNa R/X R-C C-R/
其中:R/ 为伯卤代烃 X 为Cl、Br、I
H2O / OH- PX3 Mg
NH3 R-NH2
R-MgX
R-X
① ②
CO2 H3O+
R-COOH
H3O+
NaCN
R-CN
R-NH2 R-NHR
[H]
R-CH2NH2
R-X
R-NR2
2. 羧酸及其衍生物的转换
R-COCl
NH3
R-CONH2
R/OH
R-COOH
NH3
R-COOR/
R/OH
(RCO)2O
H2SO4 H2O
① (BH3)2 ② H2O2 /
OH-
R-CH-CH3(符合马氏规则) OH
R-CH2CH2OH(反马氏规则)
[H]
② R-C=O H(R/) [ O ]
R-CH-OH H(R/)
[ H ] = LiAiH4 、NaBH4 、 H2 / Ni、Pt、Pd等
③ R-COOR/ [ H ] R-CH2OH + R/OH [ H ] = LiAiH4 、C2H5OH + Na 、 H2 / Ni、Pt、Pd等
R-NH2
● 碳环的合成
① 双烯合成(D-A反应)
X△
-X
第十一章羧酸及其衍生物

第十章羧酸及其衍生物【教学重点】羧酸及其衍生物的化学性质、丙二酸二乙酯和乙酰乙酸乙酯在合成上的应用。
【教学难点】诱导效应、酰基上的亲核取代反应机理。
【教学基本内容】羧酸的结构;羧酸的制备方法;羧酸及其衍生物的物理性质;羧酸的化学性质——羧酸的酸性及影响酸性强度的因素(诱导效应、共轭效应和场效应);羧酸衍生物的生成;羧基的还原反应;脱羧反应;α-氢原子的卤代反应。
羟基酸的制备方法(卤代酸水解、羟基腈水解、Refomatsky反应)、羟基酸的化学性质——酸性、脱水反应、α-羟基酸的分解。
羧酸衍生物的化学性质——酰基上的亲核取代反应(水解、醇解、氨解)及其反应机理;还原反应;与Grignard反应;酰胺氮原子上的反应(酰胺的酸碱性、脱水反应、Hofmann降解反应)。
乙酰乙酸乙酯的制备方法(Claisen酯缩合);乙酰乙酸乙酯的化学性质——酮式-烯醇式互变异构、酸式分解和酮式分解;乙酰乙酸乙酯在合成上的应用。
丙二酸二乙酯的制备及在合成上的应用。
Ⅰ目的要求羧酸是含有羧基(—COOH)的含氧有机化合物,我们平常所说的有机酸就是指的这类化合物。
所谓羧酸衍生物,包括的化合物种类很多,诸如羧酸盐类、酰卤类、酯类(包括内酯、交酯、聚酯等)、酸酐类、酰胺类(包括酰亚胺、内酰胺)等都是羧酸衍生物,有人甚至把腈类也包括在羧酸衍生物的范围之内。
其实,比较常见的而又比较重要的是酰卤、酸酐、酯和酰胺这四类化合物。
羧酸盐与一般无机酸盐在键价类型上没大区别,不作专门介绍。
至于腈类,将放在含氮化合物中加以介绍。
这四类化合物都是羧酸分子中,因酰基转移而产生的衍生物,所以又叫羧酸的酰基衍生物。
羧酸及其衍生物RCOL(L:-OH、-X、-OOCR′、-OR′、-NH2)在许多重要天然产物的构成以及在生物代谢过程中均占有重要地位。
本章将以饱和一元脂肪酸为重点,讨论羧酸及其衍生物的结构和性质。
鉴于乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的重要地位,本章作概括介绍。
第11章-过渡金属有机配合物催化交叉偶联反应

Cp2TiCl2 R'
O
CHOH
R'
Cp2TiCl2 H2O + (CH3)2CHMgBr
O
OH
R' CH OH
R'
(CH3)2CHOMgX
Cp2TiCl2
(CH3)2CHMgX
(CH3)2CHMgX
R'
Cp2Ti Cl
OCH R'
R' CO
R'
Cp2Ti H Cl
Cp2Ti Cl
CH3 CH
CH3
Kumada将这两个化学计量反应组合 起来并实现了催化循环
11.1.1 Kumada偶联反应催化剂 该反应的催化剂是零价镍有机配合物
11.1.2 Kumada偶联反应底物 卤代芳烃和烷基、芳基Grignard试剂是
Kumada偶联反应底物。
11.1.3 Kumada偶联反应的选择性
1. Kumada偶联反应的化学选择性
Ph L2Ni Cl +
MgCl
Ph L2Ni Cl +
MgCl
L2Ni Ph
Ph
CH2=CHCH3 H NiL2 Ph
CH2=CHCH3 + PhH
CH2CH2CH3 L2Ni Ph
PhCH2CH2CH3
2 . Kumada偶联反应中的立体化学
11.1.4 Kumada偶联反应机理
图11-1 Kumada偶联反应机理
12
Ph3Sb
13.2
5
(4-FC6H4)3P
0.60
13
dppe
0.33
6 (4-ClC6H4)3P
0.71
有机合成反应步骤优化策略与实验验证

有机合成反应步骤优化策略与实验验证有机合成反应是有机化学中非常重要的一环,它能够合成出许多有机分子,用于制备药物、材料和功能分子等。
但是,在实际的有机合成过程中,可能会遇到一些问题,例如反应产率低、副反应多、废物生成量大等。
为了解决这些问题,需要采取合适的优化策略,并通过实验验证,以提高有机合成反应的效率和选择性。
本文将介绍有机合成反应步骤的优化策略,并对其进行实验验证。
一、优化策略1. 反应条件优化反应条件是影响有机合成反应效果的重要因素之一。
在优化反应条件时,可以从温度、溶剂、催化剂和反应时间等方面入手。
首先,通过调节反应温度,可以控制反应速率和产物选择性。
其次,选择合适的溶剂可以提供适当的溶解度和反应条件。
再次,合理选择催化剂可以提高反应速率和选择性。
最后,经过一系列实验,在合适的反应时间内完成反应。
通过这些优化措施,可以提高合成反应的效率和选择性。
2. 底物结构优化底物结构是另一个影响有机合成反应的重要因素。
优化底物结构可以通过合理设计和选择反应基团、取代基、立体和键长等方面进行。
在设计反应基团时,可以选择具有良好反应活性的官能团。
而选择合适的取代基可以改变底物的立体排列和电子性质,从而调控反应的选择性。
同时,优化底物结构还包括设计合适的立体结构,以提高反应的立体选择性。
此外,通过调节键长可以改变反应的反应活性和速率。
通过对底物结构的优化,可以改善有机合成反应的效果。
3. 反应路径优化反应路径是指有机合成反应中反应中间体的生成和转化过程。
优化反应路径可以通过选择合适的反应机制和催化剂等方面进行。
在选择反应机制时,可以通过理论计算和实验验证,确定最佳的反应路径。
另外,选择合适的催化剂也可以加速反应速率和提高选择性。
通过对反应路径的优化,有机合成反应的效果将得到明显的提高。
二、实验验证1. 选择适当的实验方法在实验验证过程中,需要选择适当的实验方法来评估反应的效果。
常用的实验方法包括NMR、IR、质谱和色谱等。
有机合成反应的机理与实验操作

有机合成反应的机理与实验操作有机合成反应是有机化学的核心内容之一,它涉及到有机物的合成和转化过程。
了解有机合成反应的机理和实验操作对于有机化学的学习和研究非常重要。
本文将探讨有机合成反应的机理和实验操作,并介绍一些常见的有机合成反应。
一、有机合成反应的机理有机合成反应的机理是指反应过程中发生的化学变化的详细步骤和反应物之间的相互作用。
了解反应机理可以帮助我们预测反应的产物和调控反应的速率。
有机合成反应的机理可以分为几个基本步骤:反应前的活化步骤、反应中的反应步骤和反应后的消除步骤。
1. 反应前的活化步骤在有机合成反应中,反应物通常需要经过某种方式的活化才能参与反应。
常见的活化方式包括酸催化、碱催化、光化学活化等。
活化步骤可以使反应物分子发生构象变化或者增加反应物分子的反应活性,从而促进反应的进行。
2. 反应中的反应步骤反应中的反应步骤是指反应物之间发生的化学反应。
有机合成反应中常见的反应步骤包括取代反应、加成反应、消除反应等。
在取代反应中,一个官能团会被另一个官能团取代,形成新的化学键。
在加成反应中,两个或多个反应物的化学键会发生断裂和形成,形成新的化学键。
在消除反应中,一个官能团会从分子中被去除,形成新的化学键。
3. 反应后的消除步骤反应后的消除步骤是指反应产物的形成和分离过程。
在有机合成反应中,产物的形成通常需要通过结构重排、消除、加成等步骤。
分离产物则需要通过结晶、萃取、蒸馏等方法进行。
二、有机合成反应的实验操作有机合成反应的实验操作是指在实验室中进行有机合成反应时所需的步骤和技术。
实验操作的正确与否直接影响到反应的成功与否以及产物的纯度和收率。
1. 反应条件的选择在进行有机合成反应时,需要选择适当的反应条件,包括温度、溶剂、催化剂等。
温度的选择要根据反应的速率和产物的稳定性来确定。
溶剂的选择要考虑到反应物的溶解性和反应的速率。
催化剂的选择要根据反应的类型和机理来确定。
2. 反应物的准备和配制在进行有机合成反应前,需要准备和配制好反应物。
化学有机合成步骤

化学有机合成步骤化学有机合成是一种重要的实验技术,用于合成有机化合物和有机分子。
有机合成步骤通常包括反应设计、底物准备、催化剂选择、反应条件控制等几个关键步骤。
本文将依次介绍有机合成的一般步骤。
一、反应设计在进行有机合成之前,首先需要确定目标化合物的结构和所需的化学反应。
这包括确定反应类型(如取代反应、加成反应、消除反应等)、反应物的选择和反应路径的设计。
同时,还要考虑反应的条件(如温度、压力、溶剂等)以及可能的副反应和副产物的生成。
二、底物准备底物的准备包括合成或购买起始原料和中间体以及纯化这些化合物。
通常,合成起始原料和中间体需要多步反应,并在每一步反应后进行分离和纯化。
这包括使用各种化学方法如蒸馏、结晶、溶剂萃取等来得到纯净的底物和中间体。
三、催化剂选择催化剂是有机合成中至关重要的因素之一。
催化剂可以加速反应速率、提高反应选择性,并降低反应条件。
在有机合成中,通常使用金属催化剂、有机催化剂或酶催化剂。
催化剂的选择要根据反应类型和反应条件来确定,同时也需要考虑催化剂的毒性和可再生性。
四、反应条件控制为了获得高的产率和选择性,对反应条件的控制非常重要。
这包括调节反应温度、反应时间、反应物浓度、反应液的pH值等。
在控制反应条件时,还需要注意反应物的逐步加入、温度的恒定和反应液的搅拌等实验操作。
五、反应监测与操作在有机合成中,反应的监测和操作是不可或缺的。
反应的监测可以通过色谱、质谱、红外光谱等技术来进行,以确定反应的进程和产物的纯度。
而反应操作则包括反应溶液的搅拌、加热和冷却、溶剂的蒸发等步骤,在操作过程中需要注意安全和操作规范。
六、产物纯化与结构鉴定反应结束后,产物需要进行纯化和结构鉴定。
纯化可以使用各种技术如结晶、蒸馏、柱层析等来进行,以得到高纯度的化合物。
结构鉴定则可以通过核磁共振、质谱、红外光谱等技术来进行,以确定产物的结构和纯度。
七、实验记录与文献回顾在有机合成实验中,实验记录是至关重要的。
高考生物有机合成路线

高考生物有机合成路线一、概述有机合成是生物学和化学领域重要的研究内容之一,是研究有机化合物的构造、反应和合成方法的过程。
在高考生物中,有机合成路线常常是考生需要掌握的重点之一。
二、合成步骤有机合成路线一般包括以下几个步骤:1. 原料准备:根据所需的目标化合物,选择适当的起始原料,并进行准备工作,如提取、纯化等。
2. 功能团转化:根据目标化合物的结构,选择适当的功能团转化方法,将起始原料转化为中间体。
3. 中间体的合成:利用化学反应,将起始原料经过一系列反应转化为中间体,逐步接近目标化合物的结构。
4. 目标化合物的合成:通过进一步的反应,将中间体转化为目标化合物。
5. 结构确认:对合成得到的目标化合物进行结构分析和鉴定,确保其与预期目标一致。
三、技术要点在高考生物中,有机合成路线的理解和掌握需要注意以下几个技术要点:1. 化学反应的选择:根据反应的需要,选择适当的化学反应方法,如加成反应、消除反应、取代反应等。
2. 反应条件的调控:合理控制反应过程中的温度、压力、PH 值等条件,以保证反应的进行和产物的纯度。
3. 试剂和催化剂的选择:根据反应的需求,选择适当的试剂和催化剂,以促进反应的进行和增加反应的效率。
4. 实验操作的技巧:注意实验操作中的各种技巧,如搅拌、过滤、结晶等,以确保实验的顺利进行和产物的得到。
四、实例分析以下是一个简单的有机合成路线的实例分析:目标化合物:甲基丙烯酸甲酯合成路线:1. 乙醇和丙酮经过酯化反应合成甲基丙烯酸甲酯的中间体。
2. 中间体经过脱水反应生成甲基丙烯酸甲酯。
通过以上合成路线,可合成得到目标化合物甲基丙烯酸甲酯。
五、总结高考生物有机合成路线是考生需要掌握的重要内容之一。
理解合成步骤、技术要点和实例分析,有助于学生在考试中正确运用有机合成知识。
加强对有机合成路线的研究,将有助于提高高考生物的综合素质和解题能力。
参考资料:[1] 《有机合成导论》[2] 《高考生物课程标准》。
物理有机化学第11章自由基和光化学反应

2
CH3
CH3 CH3 (t C4H9O)2 Et C CH2CO Et C CH2CHO CH3 CH3
CO
Et C CH3 CH3 CH2CH3
CH3 Et C CH2 CH3
机理:
引发:
(CH3)3CO-OC(CH 3)3
2 (CH3)3CO
Me Ph C CH2 Me (A)
Me (CH3)3CO Ph C CH2C O Me H
C H
O C N2 O C H CH3 CCl4 CH3 OH -N2 H O C H Cl CH3
C H
O C CH3 H迁移
Hoffmann-Loeffer-Freytag 反应
加热或光照N-卤代胺的强酸性溶液生成四氢吡咯 衍生物的反应。
H
RC H2C H2C H2C H2NR'
Cl
H
RC H2C H2C H2C H2NR'
Zn
CO2气流保护下进行
二聚体(油状物) 蒸发
六苯乙烷
苯
Ph3C•的苯溶液
(黄色)
<O>
振荡
Ph3C-O-O-CPh3
Ph3C H
..
=C(Ph)2
离子游离基
O Na C O Na
当金属钠和二苯甲酮在二甲氧基乙烷中反应时,得到 兰色物质,为二苯甲酮负离子游离基的钠盐
H2SO4 K2S2O8
离子游离基具有顺磁性和导电性,这是由于离子基分 子内的未配对电子和离子键所引起的,多数离子基具 有特殊颜色
反应机理如下:
RCOO 2R -e RCOO -CO2 R
R R
4. 自由基自氧化反应 醛,醚,高分子材料在空气慢慢氧化过程.
有机合成的关键步骤

有机合成的关键步骤有机合成是一种重要的化学反应方法,用于合成有机化合物。
它涉及多个关键步骤,这些步骤对于成功合成目标化合物至关重要。
本文将讨论有机合成中的关键步骤,并介绍它们的作用和常见的方法。
1. 反应选择反应选择是有机合成的第一步,它涉及选择适当的反应类型和条件。
反应类型可以根据目标化合物的结构和功能进行选择,例如加成反应、消除反应、络合反应等。
此外,反应条件如温度、反应时间、溶剂选择等也要考虑。
合理的反应选择可以提高合成的效率和产率。
2. 反应物选择反应物选择是有机合成的关键。
合适的反应物可以提供必要的官能团和结构基础,使得目标化合物的构建更加容易。
通常,反应物可以通过多种方法合成,如功能团转化、取代反应、还原、氧化等。
将合适的反应物引入反应体系,可以为下一步的反应提供合适的基础。
3. 离子反应离子反应是有机合成中常见且重要的一步。
它涉及离子的生成和活化,通过引入正离子或负离子来实现特定的化学转化。
离子反应包括亲电反应和亲核反应。
亲电反应是指亲电体对亲核体发生求电子的反应,而亲核反应则是亲核体对亲电体发生求电子的反应。
4. 串联反应有机合成中的串联反应指将两个或多个反应逐步连接起来,形成复杂的分子结构。
串联反应可以通过控制特定的反应条件和反应体系来实现。
它通常由一系列的中间体和过渡态组成,需要精确的反应条件和催化剂的选择。
通过串联反应,可以高效地构建复杂的有机分子。
5. 功能团转化功能团转化是有机合成的关键步骤之一。
它涉及将一个功能团转化成另一个功能团,通过添加、去除或改变官能团来实现化学转化。
功能团转化通常需要适当的反应条件和催化剂的参与,以实现特定的官能团转换,例如酯化、烯烃加成、氨基化等。
6. 环化反应环化反应是有机合成中常见且重要的步骤之一。
它涉及将线性结构转变为环状结构,通过构建碳-碳键或碳-氧键来实现。
环化反应可以通过热力学控制或动力学控制来实现,具体取决于反应条件和反应物的结构。
11有机合成策略
OH
OH
借鉴此,蒽醌类抗菌素 阿克拉霉素的配基合成 阿克拉霉素的配基合成: 借鉴此,蒽醌类抗菌素-阿克拉霉素的配基合成:
O COOCH3 1) Br2 2) SiO2 OH O OH OH O OH OH O COOCH3
(+) nonactic acid
(-) nonactic acid
Bartlett, P. A. JACS, 1984, 106,5304. , , , , .
S
S
O
SCH2CHO
S
S
OHCH2C S
O
Cl
O EtO + EtO O Cl CH CH2 S CN
N., Kazuhiro; O., Akio; T., Jiro; M., Ichiro. 366-7.
OH
HO HO CH3 O EtOOC COOEt + O CH3 OH CH3 Cl
OH
O OEt
aplasmomycin 抗疟霉素
O O O O
OH O B-
O O O O O
O
OH
O
O COOCH3 S OH TIPSO O OMOM S
Corey, E. J. JACS, 1982,104, 6816. 6818. ,
CH(OMe)2 H OH O H HO H Ph3P=CH2 1. Ni/H2 2. TsCl
O
H MeSOCH2OTs H HO
H
H O
H
三,合成路线的全盘审查
TM
反应 原料
中间体
反应 中间体
【金版学案】新高考化学一轮复习:第11章有机化学基础第3讲烃的含氧衍生物(含答案解析)

课后训练与检测(时间: 45 分钟 )一、选择题1.鉴识苯酚溶液、己烷、己烯、乙酸溶液和乙醇液体,可采纳的最正确试剂是() A.溴水、新制的Cu(OH) 2B. FeCl 3溶液、金属钠、溴水、石蕊试液C.石蕊试液、溴水D. KMnO 4酸性溶液、石蕊试液分析:此题的重点词句是“鉴识液体最正确试剂”,A、B、C选项中试剂均可鉴识上述物质,但 A 需新制 Cu(OH) 2;若用 B 选项中试剂来鉴识其操作步骤较繁琐:用石蕊可鉴识出乙酸溶液,用 FeCl 3溶液可鉴识出苯酚溶液,用溴水可鉴识出己烯,余下的乙醇和己烷可用金属钠鉴识。
而用 C 选项中试剂则操作简捷,现象显然。
答案: C2.以下有机物中,在不一样条件下,既能发生水解反响和消去反响,又能发生酯化反响并能与金属钠反响放出氢气的是()A.②B.②③C.①② D .①②③分析:卤素原子、酯基可水解,羧基和羟基发生酯化反响,卤素原子和醇羟基当邻碳上有氢时,可发生消去反响,羧基和羟基能与钠反响放出氢气。
知足条件只有②、③,故答案选 B。
答案: B3. CPAE 是蜂胶的主要活性成分,它可由咖啡酸合成,其合成过程以下。
以下说法不正确的选项是 ()A. 1 mol CPAE 与足量的NaOH 溶液反响,最多耗费 3 mol NaOHB.可用金属Na 检测上述反响结束后能否残留苯乙醇C.与苯乙醇互为同分异构体的酚类物质共有9 种D.咖啡酸可发生聚合反响,而且其分子中含有 3 种官能团分析:CPAE中酚羟基和酯基都能与NaOH反响, A正确;题述反响方程式中的四种物质都能与Na反响产生氢气,所以用Na 没法查验反响结束后能否残留苯乙醇, B 项错误;与苯乙醇互为同分异构体的酚类物质共有9 种,酸中含有碳碳双键、羧基、酚羟基 3 种官能团,且能发生加聚反响, D 项正确。
答案: B4.物质 X 的构造简式以下图,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是化学中间体。
有机化学中的多步合成与合成路线设计

有机化学中的多步合成与合成路线设计有机化学作为化学科学的重要分支之一,主要研究有机化合物的合成与反应机理。
在有机合成中,多步合成往往是一种常用的合成策略,通过多步反应,逐步构建目标分子的骨架,从而达到目标化合物的合成目的。
本文将介绍有机化学中的多步合成及合成路线设计的基本原理与方法。
一、多步合成的基本原理多步合成是有机化学中常见的合成方法,其基本原理是通过一系列的化学反应,逐步转化原料分子,构建所需的目标化合物。
每一步反应都可以看作是一个中间产物,通过多次反应,逐渐得到目标分子。
多步合成的合成步骤通常包括亲核反应、求电子反应、消除反应等多种类型的反应。
在每一步反应中,需要选择适当的反应条件、催化剂与试剂,以及合理的反应顺序和反应路径,从而实现高效的合成。
二、合成路线设计的基本方法合成路线设计是多步合成中的关键步骤,合理的合成路线设计能够节省合成步骤、提高产率,并最大限度地回收废料。
下面介绍几种常见的合成路线设计方法:1. 逻辑推理法:根据反应类型、反应物性质等信息,通过逻辑推理,确定可能的转化方式与反应路径。
逻辑推理法适用于简单的多步合成,能够快速找到合理的合成路线。
2. 共通中间体法:通过寻找两个或多个目标化合物之间的共通中间体,设计合适的转化方式与反应路径。
共通中间体法能够最大限度地复用中间产物,提高合成效率。
3. 反应优先级法:根据反应的条件、产物稳定性、反应速率等因素,确定反应的优先级,从而合理地选择反应顺序与路径。
反应优先级法能够避免不稳定或容易分解的中间产物的生成,提高合成效果。
4. 变位反应法:通过骨架转化或结构变位反应,将一个复杂的目标分子转化为一个简单的中间产物,再通过简单的反应逐步构建复杂结构。
变位反应法能够简化合成步骤,提高产率。
三、实例分析下面以药物合成为例,介绍多步合成与合成路线设计的实际应用。
以药物A为目标化合物,其结构如下所示:(图略)通过分析药物A的结构与反应类型,可以设计出如下的多步合成路线:1. 氧化反应:将化合物B与氧化剂反应,得到中间产物C。
有机合成的基本步骤及应用

有机合成的基本步骤及应用2023年,有机合成依然是化学领域中的重要部分,它可以用于制备各种化合物,包括药物、农药、塑料和其他工业品。
有机合成通常涉及一系列步骤,包括反应选择、反应条件的优化和化合物纯化等。
本文将介绍有机合成的基本步骤、应用及未来发展。
一、有机合成的基本步骤1、反应选择有机合成的第一步是选择合适的反应类型和反应物。
在选择反应物时,需要考虑其反应活性、稳定性、毒性和成本等因素。
此外,还需要根据所需产物的结构和性质,选择合适的反应类型,例如加成、消除、置换、缩合等。
2、反应条件的优化在确定反应类型和反应物后,需要优化反应条件,包括反应温度、反应时间、反应物浓度、催化剂使用量以及溶剂选择等。
优化反应条件可以提高反应的效率和产物的纯度。
3、产物纯化在反应完成后,需要对产物进行纯化,以消除反应副产物和杂质。
纯化方法包括晶体分离、萃取、蒸馏、柱层析等。
不同的纯化方法适用于不同的产物类型和反应体系。
二、有机合成的应用有机合成在医药、农药、塑料和其他实验室和工业领域中都有广泛应用。
以下是一些常见的应用举例:1、医药有机合成在药物制备中扮演着至关重要的角色。
例如,一些抗癌药物、抗生素和抗病毒药物都是通过有机合成制备而成的。
此外,有机合成还可以用于核苷酸合成、多肽合成和酶催化反应等。
2、农药农药是用于控制、杀灭或防止农作物上的害虫、草本植物和真菌的化学物质。
有机合成可以用于制备各种农药,例如有机磷酸盐、杀真菌剂和杀虫剂等。
3、塑料塑料是指可塑性强、可自由成形和可重复使用的合成材料。
有机合成可以用于制备不同类型的塑料,例如聚乙烯、聚丙烯和聚丁二烯等。
三、有机合成的未来发展有机合成在未来将继续发展。
其中的一些趋势和变化可能包括:1、绿色合成随着对环境保护意识的增强,人们将更加注重使用环保和可持续的有机合成方法。
例如,利用可再生资源和替代溶剂等绿色合成方法将逐渐成为有机合成的主要趋势。
2、计算机模拟计算机模拟是一种用数字模拟化学反应和分子结构的方法。
有机合成实验11-12
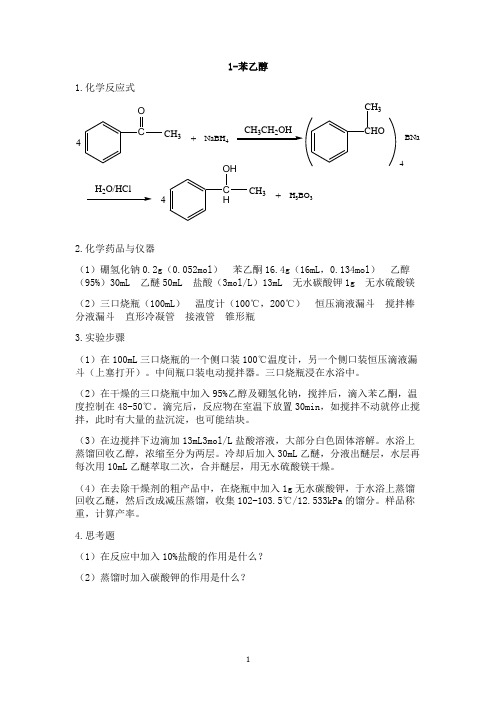
1.化学反应式CO CH 3NaBH 432C HOHCH 3H 3BO 3CHOCH 3BNa4+4H O/HCl4+2.化学药品与仪器(1)硼氢化钠0.2g (0.052mol ) 苯乙酮16.4g (16mL ,0.134mol ) 乙醇(95%)30mL 乙醚50mL 盐酸(3mol/L )13mL 无水碳酸钾1g 无水硫酸镁 (2)三口烧瓶(100mL ) 温度计(100℃,200℃) 恒压滴液漏斗 搅拌棒 分液漏斗 直形冷凝管 接液管 锥形瓶 3.实验步骤(1)在100mL 三口烧瓶的一个侧口装100℃温度计,另一个侧口装恒压滴液漏斗(上塞打开)。
中间瓶口装电动搅拌器。
三口烧瓶浸在水浴中。
(2)在干燥的三口烧瓶中加入95%乙醇及硼氢化钠,搅拌后,滴入苯乙酮,温度控制在48-50℃。
滴完后,反应物在室温下放置30min ,如搅拌不动就停止搅拌,此时有大量的盐沉淀,也可能结块。
(3)在边搅拌下边滴加13mL3mol/L 盐酸溶液,大部分白色固体溶解。
水浴上蒸馏回收乙醇,浓缩至分为两层。
冷却后加入30mL 乙醚,分液出醚层,水层再每次用10mL 乙醚萃取二次,合并醚层,用无水硫酸镁干燥。
(4)在去除干燥剂的粗产品中,在烧瓶中加入1g 无水碳酸钾,于水浴上蒸馏回收乙醚,然后改成减压蒸馏,收集102-103.5℃/12.533kPa 的馏分。
样品称重,计算产率。
4.思考题(1)在反应中加入10%盐酸的作用是什么? (2)蒸馏时加入碳酸钾的作用是什么?1.化学反应式CH3COONaCH2Cl4CH3COOCH2NaCl ++2.化学药品与仪器(1)氯化苄5.7mL(6.3g,0.05mol)醋酸钠三水合物10.2g(0.075mol)四丁基溴化铵0.25g(7.8×10-4mol)碳酸钠溶液(5%)5mL(2)三口烧瓶(100mL)球形冷凝管分液漏斗锥形瓶机械搅拌器减压蒸馏装置3.实验步骤(1)在100mL三口烧瓶中,放置6.3g氯化苄、10.2g醋酸钠三水合物和0.25g 四丁基溴化铵。
《有机合成》教案

《有机合成》教案第一章:有机合成的基本概念1.1 有机合成的定义1.2 有机合成的目的和意义1.3 有机合成的方法和分类1.4 有机合成的基本步骤第二章:有机合成的策略与设计2.1 有机合成的策略2.2 有机合成的设计原则2.3 有机合成的路线设计2.4 有机合成的优化与评价第三章:有机合成的反应类型3.1 加成反应3.2 消除反应3.3 取代反应3.4 缩合反应第四章:有机合成的常用试剂与催化剂4.1 有机合成的常用试剂4.2 有机合成的常用催化剂4.3 试剂和催化剂的选择原则4.4 试剂和催化剂的安全使用第五章:有机合成的实验操作技术5.1 有机合成的实验操作步骤5.2 有机合成的实验操作技巧5.3 有机合成的实验操作注意事项5.4 有机合成的实验操作案例分析第六章:有机合成的实例分析6.1 常见有机化合物的合成实例6.2 有机合成实例的解析与评价6.3 有机合成实例的改进与优化6.4 有机合成实例的综合应用第七章:有机合成的绿色化学7.1 绿色化学的基本概念7.2 绿色化学在有机合成中的应用7.3 绿色化学在有机合成设计的原则和方法7.4 绿色化学在有机合成中的挑战与发展第八章:有机合成的现代技术8.1 有机合成的现代技术概述8.2 有机合成的现代技术方法和原理8.3 有机合成的现代技术应用实例8.4 有机合成的现代技术发展趋势第九章:有机合成的安全与环保9.1 有机合成中的安全问题9.2 有机合成中的环保问题9.3 有机合成安全与环保的法规和标准9.4 有机合成安全与环保的实践措施10.1 实验报告的基本要求10.2 实验报告的内容与结构10.4 实验报告的案例分析与评价第十一章:有机合成的案例研究11.1 重要有机化合物的合成案例11.2 有机合成案例的策略分析11.3 有机合成案例的实验操作步骤11.4 有机合成案例的研究意义与影响第十二章:有机合成的工业应用12.1 有机合成在制药工业中的应用12.2 有机合成在材料科学中的应用12.3 有机合成在食品工业中的应用12.4 有机合成在其他领域中的应用第十三章:有机合成的科研前沿13.1 有机合成领域的最新研究动态13.2 有机合成新技术和新方法的发展13.3 有机合成在解决实际问题中的应用13.4 有机合成研究的未来趋势第十四章:有机合成的教学与实践14.1 有机合成教学的内容与方法14.2 有机合成实验的教学设计14.3 有机合成教学的案例分析14.4 有机合成教学的实践与反思第十五章:有机合成的未来发展15.1 有机合成在科学研究中的作用15.2 有机合成在国民经济中的地位15.3 有机合成面临的问题与挑战15.4 有机合成的可持续发展与展望重点和难点解析重点解析:1. 有机合成的基本概念、目的和意义,以及方法和分类。
2019高考化学第11章(有机化学基础)第4节生质、合成有机高分子化合物考点含解析)

亲爱的同学:这份试卷将再次记录你的自信、沉着、智慧和收获,我们一直投给你信任的目光……第11章(有机化学基础)李仕才第四节生命中的基础有机化学物质、合成有机高分子化合物考点二合成有机高分子化合物1.有机高分子化合物及其结构特点(1)定义相对分子质量从几万到十几万甚至更大的化合物,称为高分子化合物,简称高分子。
大部分高分子化合物是由小分子通过聚合反应制得的,所以常被称为聚合物或高聚物。
(2)有机高分子的组成①单体能够进行聚合反应形成高分子化合物的低分子化合物。
②链节高分子化合物中化学组成相同、可重复的最小单位。
③聚合度高分子链中含有链节的数目。
2.合成高分子化合物的基本方法(1)加聚反应①定义:由不饱和的单体聚合生成高分子化合物的反应。
例如:②特点a.单体必须是含有碳碳双键、碳碳三键等不饱和键的化合物。
例如烯烃、二烯烃、炔烃等含不饱和键的有机物。
b.发生加聚反应的过程中,没有副产物生成,聚合物链节的化学组成跟单体的化学组成相同。
聚合物的相对分子质量为单体相对分子质量的n倍。
③反应类型a.聚乙烯类(塑料纤维)b.聚1,3丁二烯类(橡胶)c.混合加聚类:两种或两种以上单体加聚。
d.聚乙炔类(2)缩聚反应①定义:单体间相互作用生成高分子化合物,同时还生成小分子化合物(如水、氨、卤化氢等)的聚合反应。
②特点a.缩聚反应单体往往是具有两个或两个以上官能团(如羟基、羧基、氨基、羰基及活泼氢原子等)的化合物分子。
b.缩聚反应生成聚合物的同时,有小分子副产物(如H2O、HX等)生成。
c.所得聚合物链节的化学组成与单体的化学组成不同。
③反应类型a.聚酯类:—OH与—COOH间的缩聚。
催化剂nHOCH2—CH2OH+nHOOC—COOH――→;催化剂nHOCH2—CH2—COOH――→。
b.聚氨基酸类:—NH2与—COOH间的缩聚。
c.酚醛树脂类3.高分子化合物的分类其中,塑料、合成纤维、合成橡胶又被称为三大合成材料。
第11章 羟基化技术

磺化碱熔法制2一萘酚的工艺流程如图11一l所示。
酚
苯磺化碱熔法和氯苯水解法制苯酚都存 在很多缺点。利用异丙苯法合成苯酚是当前 世界各国生产苯酚最重要的路线。此法的优 点是以苯和丙烯为原料。在生产苯酚的同时 联产丙酮,不需要消耗大量的酸碱,且“三 废”少,能连续操作,生产能力大,成本低。 此方法已发展成为生产苯酚的主要方法,工 业上已有数万吨级装置。 异丙苯法制苯酚包括以下三步反应
所以在温和条件下由苯直接羟 基化合成酚是一个难题。苯的单程 转化率不高,因此苯的损失大,回 收费用也大。目前的研究主要集中 在氧化剂及相应的催化剂的选择上, 并取得了一定的研究成果,有些成 果已经显示出了工业化的前景。 苯直接羟基化制苯酚的几种催 化反应,包括阳极氧化法、NzO氧 化法、H。o。氧化法、02直接氧化 法等,其中02直接氧化法由于收率 太低,应用受到限制。
芳磺酸盐在高温与熔融的苛性碱(或苛性 碱溶液)作用下,使磺基被羟基所置换的反应 叫做碱熔。
生成的酚钠用无机酸酸化,即转变为 游离酚:
11.3.2影响因素 1.磺酸的结构 碱熔反应是亲核置换反应,因此芳环其他碳 原子上有了吸电子基(主要是磺基积羧基),对磺基 的碱熔起活化作用。硝基虽是很强的吸电子基,但 在碱熔条件下硝基会产生氧化作用而使反应复杂化, 所以含有硝基的芳磺酸不适宜碱熔。氯代磺酸也不 适于碱熔,因为氯原子比磺基更容易被羟基置换。 芳环上有了供电子基(主要是羟基和氨基),对磺基 的碱熔起钝化作用。例如间氨基苯磺酸的碱熔,需 要用活泼性较强的苛性钾(或苛性钾和昔桦铀的混 合物、作碱熔剂。
2.N20氧化法 在高温(约823K)T",以V20s/sioz为催化剂 N2O能把苯直接氧化为苯酚,唯一的副产物是N2。 此法具有高度绿色性和直接性。
有机合成的基本步骤

有机合成的基本步骤嘿,朋友们!今天咱就来聊聊有机合成这档子事儿。
有机合成啊,就像是搭积木,得一步步来,每一步都得稳稳当当的。
首先呢,咱得有个目标分子,就好比你要盖一座房子,得先知道要盖成啥样儿不是?这个目标分子就是咱最终要合成出来的那个宝贝。
然后呢,咱就得分析分析,看看怎么才能把它给拼凑出来。
接下来,就是设计合成路线啦!这可就像是规划一条去远方的路,你得想好走哪条道儿,在哪儿拐弯,在哪儿停歇。
得综合考虑各种因素,比如反应的可行性啊,原料好不好找啊,成本高不高啊。
这可不是随便拍拍脑袋就能决定的事儿,得深思熟虑呢!有了合成路线,那就开始行动吧!准备好各种原料,就像厨师准备食材一样。
这些原料就是搭建目标分子的小砖块儿。
然后呢,让它们在合适的条件下发生反应。
这反应就像是一场奇妙的魔术,各种原子和基团跑来跑去,重新组合,慢慢地就变出我们想要的东西啦。
在这个过程中,可不能马虎大意哦!得时刻关注着反应的进展,就像看着自己的宝贝孩子成长一样。
要是出了啥岔子,得赶紧想办法解决,不然可就前功尽弃啦。
反应完了还没完事儿呢,还得分离和提纯。
这就好比从一堆沙子里把金子给挑出来,得有耐心,还得有技巧。
把杂质去掉,留下纯净的产物,这才是我们真正想要的。
然后呢,还得对产物进行各种检测和分析,确定咱合成的是不是对的东西。
这就像给刚做好的衣服量尺寸,看看合不合身。
要是有问题,那还得重新再来一遍。
有机合成可不是一件容易的事儿啊,它需要我们有扎实的化学知识,敏锐的观察力,还有不怕失败的勇气。
这就跟爬山一样,虽然过程很辛苦,但当你爬到山顶,看到那美丽的风景时,一切都值了!你说,有机合成是不是很神奇?它能让那些原本不存在的分子在我们手中诞生,就像创造了一个新的生命。
这是多么有成就感的一件事儿啊!所以啊,朋友们,别害怕有机合成的困难,只要我们一步一个脚印,踏踏实实地去做,就一定能成功。
加油吧,让我们在有机合成的世界里尽情遨游!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H2
H
RCO3H
① O3 ② Zn/H2O
O +
O
HO OH O
官能团的引入与转化
• 官能团的转化:
O
H2N Y
Y N
O R CH PPh3
HCR
属于碳-碳键形成反应
SOCl 2
R' NH 2
R' OH
O- OCR
O RCX
R 'OH
O RC
O RC
O
H2O
R 'NH
O H2
2
H
2
O
H 2O
O R C OH
O
Cl O
(3) 官能团的保护和R N去H2 保N护。R HN O 氨基甲酸酯
羟基的保护 O
Aurathane O
氨基的保护
R HN O 氨基甲酸酯
R HN OH + HO
羧基的保护
Aurathane
R NH2 + CO2
(1) 官能团的引入与转化;
(2) 碳—碳键的O形成;
H3+O
O
+
(3) 官能团的保护OH和去保护。
多步骤有机合成专题 Multistep Syntheses
逆向合成法——是有机合成路线设计最简单、最基 本的方法,有时也叫做反合成法( antisynthesis)。 其特点是先剖析目标分子(target molecule,TM)的结 构,从目标分子开始,逆推至中间物,逐步倒推至 原料即起始物(starting material,SM)。即从“复杂” 的TM出发,逐步“后退”,“简化”到原料分子 SM。而合成路线时,则从SM开始,逐步前进,最 后得到TM,重要的条件要注明,如反应的温度、压 力、催化剂、重要的溶剂等。
R 'NH
2
R 'OH,H +
O
O
R
C
OR'
R
R'NH2
C
NR2
官能团的除去
• 碳碳重键的催化加氢 • 格式试剂的遇水分解 • 卤代烃、羧酸酯或磺酸酯的还原 • 醛酮羰基的还原 • 芳基磺酸的去磺基 • 芳基重氮盐的去重氮基
四、官能团的保护和去保护
1. 羰基保护
O
HCl,ROH RO OR
H+,H2O
A 目标分子(T.M.)
“
合
成
B
C
D
E
树
” F G H I J K L MN O P
对目标分子A,可能的中间物(B、C、D、E)或起始原 料(F、G……O、P)。
从头完成反应式,重要的条件要注明,如反应的温度、 压力、催化剂、溶剂等。
目标分子拆开的一般方法:
要找到最佳的割切方法,可根据如下原则割切:
O
羟基的保护 O
CF3COOH
O +
OH
氨基的保护
O
H3+O
O +
OH HO
羧基的保护
有机合成中的立体问题
• SN2反应的Walden构型转换、 • E2消去反应中的反式共平面消去 • 烯烃顺式加氢、与硼烷的顺式加成 • 烯烃与溴的反式加成 • 羰基亲核加成的Cram规则 • 环加成和电环化的立体化学专一性 • 碳正离子重排中的反式迁移 • Beckmann重排反应中的反式基团迁移
羟基的保护
R OCH2
H3+O R OH +
氨基的保护 羧基的保护
苄基醚
H2
R OH +
Pd
CH2OH CH3
(1) 官能团的引入与转化;
(2) 碳—碳键的形成;
(3) 官能团的保护和去保护。
MeO
C Cl
羟基的保护
氨基的保护 羧基的保护
选择性地保护10羟基
(1) 官能团的引入与转化;
(2) 碳—碳键的形成; O
如:合成
Oa
=
从a 处分割:
O O
C
O
=
O
C-CH2Br +
O
O
=
从b
处分割:
O O
C b
I
O O
CH2
O
I
Br-C-CH2
CH2COOH CH2CN
Oa
=
O
C
O
b
酰卤反应活性大于卤代烃, 且环上电子云密度高,有 利于酰基化反应。
O
..
Br-C-CH2
O .O.
+
+
HO HO
CH2Br
+ NaCN
③ 考虑问题要全面
CN
C CR R
官能团的引入与转化
• 官能团的转化:
CH2OOH LiAlH4 CONR2 LiAlH4
CH2OH CH2NR2
OH H CH2OH
Cr6+
官能团的去除
O
HH
Cr6+ NaBH4
CHO
LiAlH4
Cr6+
COOH
X
H
HNO 3
X2 Fe
H
2
SO
4
NO2 SO3H
官能团的去除
H
Pt
OsO4
多步骤有机合成 Multistep Syntheses
重新划分有机反应: (1)碳—碳键的形成和断裂; (2)官能团的引入、转化和消除; (3) 官能团的保护和去保护。
一、碳-碳键形成的反应
1、有机金属试剂:RLi,RMgX,R2CuLi • 与R’X反应:合成烃类化合物(增长碳链)
RMgX + R’X 常使用活泼R’X,如苄基型、烯丙型 R2CuLi + R’X 可以使用乙烯型R’X,反应中构型保持 炔基负离子与R’X反应也是得到增长碳链的炔 烃的好方法
官能团的引入与转化
• 官能团的引入: • 官能团的转化:
CC
H+
CC
OH H
C H
CC
CC
X2
hv or
CC X
HA C C A: OH, X HA
XA
C C A: OH, X
XA
CC
:B
CC
OH H
CC N+ H
CC
C X(OTs)
C , C ,C,
OH
OR
SH
C , C ,C,Fra bibliotekSRN
P
C ,C ,C
目标物的合成中要解决以下几个主要问题:
(1)如何构建目标化合物的碳架结构;
(2)如何引入目标化合物中的官能团;
(3)如何达到高选择性合成(立体选择性合成);
——对于多官能团等复杂化合物的合成,为避免不 必要的副反应的发生,需要先保护某些官能团,之 后再去保护。
“拆”是为了合成时的“连”,“拆”是手段, “合”是目的。因此,要学“拆”,必须先学 “合”,能“合”才能“拆”。即积累的有机合成 反应愈多,拆开各种结构的本领就愈大。
• 表示逆合成时,用符号 • 表示合成步骤时,每步常用箭头
• 准确运用拆开法是解决复杂分子合成问题的关键。
“拆”是为了合成时的“连”,“拆”是手段,“合”是目的。 因此,要学“拆”,必须先学“合”,能“合”才能“拆”。即 掌握的合成反应愈多,拆开各种结构的本领就愈大。而在学习合 成时应注重抓住反应的基本特征,即反应前后分子结构的变化。
HOH2C O Base
HH
+ MeO
H
H
OH OH
吡啶
C Cl
MeO
20℃
C OCH2 O
Base
HH
H
H
OH OH
80%乙酸 或吡啶-乙酸
MeO
C OH
HOH2C O Base
+
HH
H
H
OH OH
(2)转化成四氢吡喃醚
H+
+ ROH
O
(混合型缩醛)
O OR
H2O / H+ ROH + HO(CH2)4CHO
2、芳香烃的F-C反应
R
H
RX AlCl3
O XCR AlCl3
OC R
• F-C烷基化反应存在重排副反应
• F-C酰基化反应引入羰基,再还原成亚甲基是有效的 替换方法
• Blanc氯甲基化反应
• 甲酰化反应: Gatermann-Koch反应; Vilsmeier甲酰 化反应;Reimer-Tiemann反应
+
+
hv
5、开环反应
环加成和电环化反应的逆反应;6元环的氧化(环 己烯、环己醇、环己酮);小环的开环加成
二、碳链缩短的方法
不饱和烃和芳烃的氧化(KMnO4/O3); 卤仿反应; 脱羧反应; Hofmann重排反应。
三、官能团的引入、转化与除去
1. 官能团的引入: (1)芳环:
亲电取代;侧链的部分氧化和彻底氧化 (2)饱和碳原子上的卤代反应:
O
RSH
RS SR H2 H H
cat.
2. 羟基的保护
——醇、酚易氧化,易烷化成醚,易酰化成 酯,可通过转化成醚、混合型缩醛、酯进行保 护。
(1)转化成醚
R OH
CH2Br
NaOH
R OCH2
苄基醚
H3+O R OH +
H2
R OH +
Pd
CH2OH CH3
选用Ph3CCl成醚(选择性保护1°醇-OH )
四氢吡喃醚是缩醛结构,在碱、还原剂及格式
试剂存在时是稳定的,但在稀酸催化下易于水解, 是醇羟基的良好保护基团。
