河南省蛋白同化制剂、肽类激素批发经营申请表
关于经营蛋白同化制剂、肽类激素药品的申请模板

关于经营蛋白同化制剂、肽类激素的申请××市食品药品监督管理局:××××医药有限责任公司于年××年×月×日取得《药品经营许可证》属于药品批发企业,且具备经营蛋白同化制剂、肽类激素药品的条件:1.有专门的蛋白同化制剂、肽类激素管理人员;2.有蛋白同化制剂、肽类激素的专储药柜;3.有专门的蛋白同化制剂、肽类激素验收、检查、保管、销售和出入库登记制度。
特此申请蛋白同化制剂、肽类激素药品的经营权,请××市食品药品监督管理局给予考核、批准。
(相关证明材料附后)××××医药有限责任公司××年×月×日所附材料目录1.《药品经营许可证》复印件2.《药品经营质量管理规范》复印件3.专门的蛋白同化制剂、肽类激素管理人员情况4.蛋白同化制剂、肽类激素的专储药柜情况5.蛋白同化制剂、肽类激素验收、检查、保管、销售和出入库登记制度6.拟申请经营的蛋白同化制剂、肽类激素品种目录蛋白同化制剂、肽类激素管理人员情况表蛋白同化制剂、肽类激素的专储药柜情况公司有专门的蛋白同化制剂、肽类激素的储存设施:其中需冷藏集中放于冷库的专属货架,不需要冷藏的放于阴凉库合格区的专属货柜。
拟申请经营的蛋白同化制剂、肽类激素品种目录因为我公司主要服务客户为××市直医疗机构,所以为满足客户需要,我们把兴奋剂目录中蛋白同化制剂、肽类激素部分作为公司拟申请经营的蛋白同化制剂、肽类激素品种目录一、蛋白同化制剂品种序号英文名中文名商品编码1 androstenediol 雄烯二醇 2937290011、30043200112 androstenedione 雄烯二酮* 2937290011、30043200113 androst-4-ene-3α,17α-diol 雄烯二醇(异构体) 2906190012 、30049090744 androst-4-ene-3α,17β-diol 雄-4-烯-3α,17β-二醇* 2906190012、30049090715 androst-4-ene-3β,17α-diol 雄-4-烯-3β,17α-二醇* 2937290011、30043200136 androst-5-ene-3α,17α-diol 雄-5-烯-3α,17α-二醇* 2906190013、30049090727 androst-5-ene-3α,17β-diol 雄-5-烯-3α,17β-二醇* 2906190013、30049090738 androst-5-ene-3α,17β-diol 雄-5-烯-3β, 17α-二醇* 2937290011、30043200149 4-androstenediol androst 雄-4-烯二醇* 2937290012、3004320015 -4-ene-3β,17β-diol10 5-androstenedione 雄烯二酮异构体 2937290012、300432001611 5α-androstane-3α,17α-diol 阿法雄烷二醇2906190011、300490907412 5α-androstane-3α,17β-diol 倍他雄烷二醇异构体2937290012、300432001713 5α-androstane-3β,17α-diol 雄烷二醇异构体2937290012、300432001814 5α-androstane-3β,17β-diol 倍他雄烷二醇2906190011、300490907515 bolasterone 勃拉睾酮(双甲睾酮)2937290012、300432001916 boldenone 勃地酮(宝丹酮)2937290013、300432002117 boldione 1,4-雄二烯-3,17-二酮* 2937290013、300432002218 calusterone 卡普睾酮 2937290013、300432002319 clenbuterol 克仑特罗 2922199020、300439001120 clostebol 氯司替勃(氯斯太宝) 2937290013、300432002421 danazol 达那唑 2937290014、300432002322 dehydrochloromethyltestosterone 脱氢氯甲基睾酮* 2937290014、300432002523 deltal-androstene-3,17-dione 雄-1-烯-3,17-二酮* 2937290014、300432002624 deltal-androstenediol (Δ)雄烯二醇 2937290014、300432002725 dehydroepiandrosterone(DHEA)普拉雄酮* 2937290014、300432002826 desoxymethyltestosterone 去氧甲基睾酮* 2937290014、300432002927 dihydrotestosterone 双氢睾酮 2937290015、300432002928 drostanolone 屈他雄酮(羟甲雄酮) 2937290015、300432002829 drostanediol 5α-雄烷-3β,17β-二醇* 2906190011、300490907630 epi-dihydrotestosterone 表双氢睾酮2937290015、300432003131 ethylestrenol 乙烯雌醇 2937290015、300432001532 fluoxymesterone 氟甲睾酮 2937290015、300432003133 formebolone 甲酰勃龙(醛甲宝龙) 2937290015、300432001234 furazabol 呋咱甲氢龙(夫拉扎勃)2937290016、300432003235 gestrinone 孕三烯酮2937230010、300432003336 4-hydroxytestosterone 4-羟基睾酮 2937290016、300432003337 4-hydroxy-19-nortestosterone 4-羟基诺龙2937290016、300439001238 3α-hydroxy-5α-androstan-17-one 3β-羟基-5β-雄烷-17-酮* 2937290016、300432003439 3β-hydroxy-5α-androstan-17-one 3β-羟基--5β-雄烷-17-酮* 2914400020、300490907740 mestanolone 美雄诺龙2937290017、300432004141 mesterolone 美睾酮 2937290017、300432003542 methandienone 美雄酮2937290017、300432003543 methasterone 2β,17α-二甲基-5β-雄烷-3-酮-17β-醇2937290017、300432003644 methyldienolone 17α-甲基-17β-羟基雌-4,9(10)-二烯-3-酮* 2937290018、300432003745 methyl-1-testosterone 甲基-1-睾酮* 2937290018、300432003846 methylnortestosterone 甲基去甲睾酮* 2937230018、300432003847 methyltrienolone 17α-甲基-17β-羟基雌-4,9,11-三烯-3-酮* 2937290019、300432003948 metenolone 美替诺龙 2937290019、300432004149 methandriol 美雄醇 2937290019、300432004250 methyltestosterone 甲睾酮2937290018、300432004251 mibolerone 米勃龙* 2937290021、300432004252 nandrolone 诺龙2937290021、300432004353 19-norandrostenediol 19-去甲雄烯二醇* 2937290021、300432004454 19-norandrostenedione 19-去甲雄烯二酮* 2937290021、300432004455 19-norandrosterone 去甲雄酮2937290018、300432004556 norboletone 诺勃酮2937290021、300432004357 norclostebol 诺司替勃2937290021、300432004358 norethandrolone 诺乙雄龙(乙基诺龙) 2937290021、300432004559 19-noretiocholanolone 19-去甲本胆烷醇酮* 2937290022、300432004660 oxabolone 羟勃龙(氧宝龙)2937290022、300432004761 oxandrolone 氧雄龙(氧甲氢龙)2937290022、300432004762 oxymesterone 羟甲睾酮2937290023、300432004863 oxymetholone 羟甲烯龙2937290023、300432004864 prostanozol [3,2-c]吡唑-5α-苯别胆烷-17β-4氢吡喃醇* 2937290023、300432004965 quinbolone 奎勃龙2937290024、300432005166 stanozolol 司坦唑醇2937290024、300432005267 stenbolone 司腾勃龙2937290024、300432005268 1-testosterone 1-睾酮2937290024、300432005369 testosterone 睾酮 2937290024、300432005370 tetrahydrogestrinone 四氢孕三烯酮 2937230010、300432005471 tibolone 替勃龙2937230010、300432005172 trenbolone 群勃龙(追宝龙) 2937290024、300432005173 zeranol 折仑诺 2937230010、300432005474 zilpaterol 齐帕特罗2933990040、3004909078二、肽类激素品种序号英文名中文名商品编码75 Corticotrophins 促皮质素 2937190015、300439002676 Erythropoietin(EPO)促红细胞生成素(EPO)2937190011、300439002177 Gonadotrophins (LH,hCG)促性腺激素 2937190013、300439002578 Growth hormone(hGH)生长激素 2937110000、300439002279 Insulin 胰岛素2937120000、300431001080 Insulin-lkie Growth Factor(IGF-1)胰岛素样生长因子1 2937190012、300439002381 Mechano Growth Factors (MGFs)生长因子素 2937190014、3004390024注:1.目录所列物质包括其可能存在的盐及光学异构体;2.目录所列物质包括其原料药及单方制剂;3.目录所列蛋白同化制剂品种包括其可能存在的盐、酯、醚及光学异构体;4.括号内为参考译名,带*为暂译名;5.蛋白同化制剂和肽类激素项下具有商品编码的品种,进出口时需办理进出口准许证。
药品批发企业经营蛋白同化制剂、肽类激素初审事项办理规程

办事指南经营蛋白同化制剂、肽类激素审批办理规程主体南平市食品药品监督管理局设定依据1、《反兴奋剂条例》第九条;2、福建省食品药品监督管理局《关于加强蛋白同化制剂和肽类激素管理的通知》第六条;3、《麻醉药品和精神药品经营管理办法(试行)》第六条。
4、福建省人民政府关于取消、下放和调整一批省级行政许可项目的通知(闽政文﹝2015﹞239号)。
审批条件或标准1、有专门的管理人员;2、有专储仓库或者专储药柜;3、有专门的验收、检查、保管、销售和出入库登记制度;有无数量限制及分配数量的办法无办理程序受理→现场核查→审查→决定申报材料1、申报蛋白同化制剂、肽类激素定点经营申请表2、加盖企业公章的《药品经营许可证》、《药品GSP证书》、《营业执照》复印件(如可查询到电子证照无须提交纸质材料)3、企业如拟由分支机构承担经营活动,应当出具法人委托书4、企业以及工作人员最近2年内没有违反禁毒法律、行政法规规定行为的情况说明5、企业负责人、质量负责人、蛋白同化制剂、肽类激素经营管理专门人员情况6、蛋白同化制剂、肽类激素经营安全的管理制度(包括验收、检查、保管、销售和出入库登记制度),安全设施明细7、企业安全管理和向药品监督管理部门或其指定机构报送经营信息的网络说明材料8、授权委托书(非法人代表或企业负责人来办理的应提交授权委托书)(可容缺后补)备注:以上材料材料使用A4纸打印,制作封面和目录,按以上顺序排列,装订成册,一式两份。
所有材料均须加盖单位公章,复印件注明“系原件复印”,并由办理人签字。
凡能通过电子证照库查询共享到的证照,无需提交相关纸质证照。
办理时限1、法定期限20个工作日2、承诺时限10个工作日收费标准无联系信息1、业务咨询电话:88917072、投诉电话:8069193、88391003、网上申报方法及表格下载:福建省网上办事大厅/→分厅切换→南平市→我要办→部门服务→市药监局→找到需申报事项,即可下载表格或实名注册后网上申报行政服务中心网址/网上申报/表格下载/4、行政服务中心地址:南平市八一路439号后楼(市行政服务中心三楼)。
河南省药品批发企业筹建申请表

运输系统
计算机信息管理系统
配套设施设备
其它
计划经营配送服务区域
申请表填写内容真实性、客观性和可实现性的保证声明
法定代表人或主要负责人签字:年月日(盖章)
筹建地辖区政府或相关部门意见
负责人签字:年月日(公章)
备注:1.本表应以打印方式填写,若内容填写不下,可扩大相应的表格或另附页;2.选择性填写项目或不能填写或尚不存在的项目可不填写,但应在相应栏内注明。
主管药师
药师
药士
其他
各类专业技术人员占职工总数比例
拟建经营仓库面积
占地(亩/平方米)
总建筑面积
总使用面积
常温库
阴凉库
冷库
验收养护室
办公
综合经营业务厅
其它
拟配置经营管理及仓库等主要设施设备情况
自动化立体仓库总层高、层数及现代物流装置和设备选型等详细情况
高架仓库存储系统、零货及整箱拣选设备、自动输送设备、扫描复核等设备选型等详细情况
商品电子标签管理系统建设计划等详情
计算机和服务器中央数据处理信息管理系统建设计划
车辆及冷链运输系统等详情
筹建工作计划完成最终时限(年月)
土地购置或房屋购置
土建工程竣工验收
设施设备安装调试
人员招募培训到岗
经营管理系统建立
模拟经营
最终完成筹建及提出经营许可申请
备注
计划投资情况(万元)
总投资
土地
土建
土地房屋整体够买
电话
拟建企业负责人
职务
学历
毕业院校及专业
职称
电话
拟建企业质量负责人
职务
学历
毕业院校及专业
职称
蛋白同化制剂、肽类激素管理制度

蛋白同化制剂、肽类激素经营管理制度一、目的为加强蛋白同化制剂、肽类激素的经营管理有效地控制蛋白同化制剂、肽类激素的购、存、销行为确保蛋白同化制剂、肽类激素质量及安全根据《药品管理法》、《反兴奋剂条例》、《关于贯彻落实〈反兴奋剂条例〉进一步加强兴奋剂管理的通知》等法律法规和《关于进一步加强蛋白同化制剂、肽类激素药品批发企业管理的通知》甘食药监安2009191号文件特制定本制度。
二、适用范围适用于本公司蛋白同化制剂、肽类激素的经营及安全管理。
三、内容一、蛋白同化制剂、肽类激素购进管理1、严格执行公司《药品采购管理制度》、《药品购进程序》及《首营企业、首营品种审核制度》2、公司只能从具有蛋白同化制剂、肽类激素生产、经营资格的药品生产、经营企业购进蛋白同化制剂、肽类激素购进蛋白同化制剂、肽类激素前供货企业必须提供以下资料供本公司审核其生产、经营资格的合法性1、生产企业须提供a、《药品生产许可证》复印件b、营业执照复印件c、税务登记证复印件d、组织机构代码证复印件e、企业注册商标复印件f、GMP证书复印件g、供货企业质量保证能力情况说明2、经营企业须提供a、《药品经营许可证》复印件b、营业执照复印件c、税务登记证复印件d、组织机构代码证复印件e、GSP证书复印件f、供货企业质量保证能力情况说明以上复印件须加盖供货企业原印章。
3、供货企业销售人员须提供以下资料供公司审核其合法资质1、法人授权委托书原件注明授权范围、被委托人身份证号并有企业公章及法人签章2、被委托人身份证复印件4、从生产企业购进蛋白同化制剂、肽类激素前生产企业须提供以下资料供本公司审核该具体品种的合法性1、药品生产批件复印件2、药品质量标准复印件3、药品物价批文复印件4、药品最小包装、说明书原件5、地市以上药检所检验报告复印件以上复印件须盖企业原印章5、供货企业必须是GSP或GMP达标企业6、为保证药品质量公司应优先选择从生产企业购进蛋白同化制剂、肽类激素7、业务部根据公司可经营蛋白同化制剂、肽类激素目录及销售需求负责填报《药品购货计划表》及具体负责蛋白同化制剂、肽类激素的购进。
蛋白同化制剂、肽类激素药品出入库登记管理制度

蛋白同化制剂、肽类激素药品出入库登记管理制度文件内容:一、目的------------------------------------------------------------------2二、适用范围------------------------------------------------------------2三、职责------------------------------------------------------------------2四、定义------------------------------------------------------------------2五、相关文件------------------------------------------------------------ --2六、内容-----------------------------------------------------------------2七、罚则--------------------------------------------------------------- --3八、历史修订记录和原因----------------------------------------------------3九、相关业务流程图-------------------------------------------------------4十、附录--------------------------------------------------------------- --6【目的】为加强“蛋白同化制剂、肽类激素”药品出入库管理,规范出入库工作行为,确保本公司销售“蛋白同化制剂、肽类激素”药品的质量,杜绝不合格“蛋白同化制剂、肽类激素”的流通,特制订本制度。
蛋白同化制剂肽类激素管理制度

蛋白同化制剂、肽类激素质量管理制度×××医药有限公司二0一二年十一月目录一、蛋白同化制剂、肽类激素购进管理制度二、蛋白同化制剂、肽类激素验收管理制度三、蛋白同化制剂、肽类激素保管养护管理制度四、蛋白同化制剂、肽类激素销售管理制度五、蛋白同化制剂、肽类激素运输管理制度六、蛋白同化制剂、肽类激素退货管理制度七、蛋白同化制剂、肽类激素销毁、报损管理制度八、蛋白同化制剂、肽类激素丢失、被盗安全管理制度蛋白同化化制剂、肽类激素购进管理制度一、蛋白同化制剂、肽类激素的购进必须向具有《药品生产许可证》、《药品经营许可证》及《营业执照》的合法生产或指定经营单位采购。
二、制定购进计划应以市场需要为基准,以销定购。
三、首营品种必须严格按首营品种管理制度办理有关手续。
四、签定购货合同时,必须注明质量条款、包装标识、运输注意事项等要求。
五、购进药品必须完整的做好记录,经办人、负责人应签名,记录妥善保存至超过药品有效期2年。
蛋白同化制剂、肽类激素验收管理制度一、严格按照法定现行质量标准和合同规定的条款,对购进的药品进行逐批验收。
二、验收蛋白同化制剂、肽类激素时必须双人在场,如发现质量可疑,应报质管科复查确认,必要时送当地药品检验所检验。
三、验收时,若原件短少,验收人员应及时写出报告,经单位主管领导签字并加盖公章,附原装箱向供货单位索赔。
四、验收人员有权拒收因包装破损对其质量造成不良影响的药品。
五、验收合格的药品应立即通知入库,不合格药品应拒收。
六、认真做好验收记录,做到字迹清晰,内容真实、完整,记录有双人核对签字并妥善保存至超过药品有效期2年。
蛋白同化制剂、肽类激素保管、养护管理制度一、蛋白同化制剂、肽类激素保管、养护必须设置专库或专柜(加锁),同时应具有防火、防盗等设施。
二、蛋白同化制剂、肽类激素应专库(柜)存放,双人双锁管理、专帐记录、定期盘点,做到帐货相符。
三、药品养护人员要做好药品养护工作,库内要通风并有温控及除湿装置,并认真做养护记录。
蛋白同化制剂、肽类激素药品的管理制度

蛋白同化制剂、肽类激素药品的管理制度为加强蛋白同化制剂、肽类激素药品的管理,防止上述药品流入非法渠道,制定本制度。
本制度适用于蛋白同化制剂、肽类激素药品的购进、验收、储存、销售、运输及相关知识培训等环节。
1、本制度所涉及的药品范围为蛋白同化制剂、肽类激素,对该类药品的管理,除应遵守国家的法律、法规、规章和本公司质量管理制度中对一般药品进行管理的规定外,还应遵守本制度规定的各项管理要求。
2、蛋白同化制剂、肽类激素、含麻黄碱类复方制剂药品的采购管理:依照有关法律法规的规定,我公司只能向依照《中华人民共和国药品管理法》的规定取得《药品生产许可证》、药品批准文号等有关资质的生产企业或者具备蛋白同化制剂、肽类激素经营资质的药品批发企业采购该类药品。
在采购该类药品前,采购部门应及时做好首营资料的收集、报批、备案工作,质量管理部门在对上述资料审查合格后需将该类药品的有关资料存档。
在完成首营资料的审批后方可购进该类药品。
购进进口蛋白同化制剂、肽类激素品时,还应向供货单位索取《进口药品注册证》(或者《医药产品注册证》)复印件、《进口药品检验报告书》复印件或者注明“已抽样”并加盖抽样单位公章的《进口药品通关单》复印件,并在上述各类复印件上加盖供货单位公章。
3、蛋白同化制剂、肽类激素药品的验收入库管理:质量管理部验收组负责此类药品的验收,做到票、帐、货相符。
对有特殊温度(冷库储存的品种)要求的品种验收时要随到随验,验收员不在时应存放在冷库的待验区。
该类药品到货后,验收人员应依据药品说明书中标注的成分及时分辨出该类药品,并按照其储存条件放入相应库的待验区中。
在依照验收程序对该类药品进行实物验收合格后应及时通知仓储部入库。
仓储部应在仓库内设立蛋白同化制剂、肽类激素药品专区,将该类药品集中存放,并设立明显标志。
对不符合运输储存要求及其他不符合规定的该类药品,验收人员应拒收并立即通知质量管理部门进行处理。
4、蛋白同化制剂、肽类激素药品的储存、养护检查和出库复核管理:质管部应将该类药品列为重点养护品种,养护人员按照重点养护品种的标准进行养护,当发现在库药品存在质量问题时应及时上报质管部。
蛋白同化制剂、肽类激素药品管理制度《完》

蛋白同化制剂、肽类激素药品管理制度《完》蛋白同化制剂、肽类激素药品管理制度一、目的:为规范蛋白同化制剂、肽类激素药品进、销、存、运输各环节业务操作,制定本制度。
二、依据:《药品管理法》、《反兴奋剂条例》等法律法规及有关规定,《药品经营质量管理规范》。
三、职责部门:质管部、采购部、销售部、仓储部、运输组四、适用范围:适用于公司蛋白同化制剂、肽类激素药品进、销、存及运输的管理。
五、内容:1. 购进管理:1.1 采购蛋白同化制剂、肽类激素药品必须从药监部门批准生产或经营具有合法资格和质量保证能力的企业购进,并建立供货方档案。
1.2 在编制购货计划时,要以药品质量为重要依据,签订购进合同要明确质量条款。
1.3 购进药品要合法票据,并按规定票、帐、货相符。
记录保存不低于五年。
1.4 购进进口蛋白同化制剂、肽类激素,要有进口药品注册证及进口准许证。
1.5 对首营企业和首营品种要按GSP 规定要求进行审核,并建立档案。
2. 验收管理:2.1 对蛋白同化制剂、肽类激素药品的质量验收,必须严格执行企业《药品收货与验收的管理制度》。
必须由两人进行验收,逐件验收至最小包装,并做好验收记录(双人签字)。
2.2 验收员在指定的场所对购进蛋白同化制剂、肽类激素药品逐批进行验收。
验收进口蛋白同化制剂、肽类激素时应检查《进口药品注册证》及《进口准许证》2.3 药品质量验收内容包括:蛋白同化制剂、肽类激素药品包装、标签、说明书及有关要求的证明或文件进行逐一检查和外观性状的检查。
3. 仓储管理3.1 蛋白同化制剂、肽类激素药品设专区保管储存,实行双人双锁保管。
标识清晰,定期盘点,确保票、账、货相符。
3.2 蛋白同化制剂、肽类激素药品的养护工作执行本企业的《药品养护管理制度》,按重点药品养护原则进行养护。
3.3 对蛋白同化制剂、肽类激素药品实行色标管理和效期管理,并严4. 销售管理4.1 蛋白同化制剂、肽类激素只能销售给取得合法资质并具有该经营范围的药品使用及经营单位。
肽类激素申请材料

药品批发企业许可项变更申请材料申请材料目录1.药品经营企业变更申请表第 1 页2.关于增加蛋白同化制剂、肽类激素经营范围的申请第 2 页3.企业法人营业执照和药品经营许可证、GSP认证证书复印件。
第3-5页4.贵阳市食品药品监督管理局出具的有关无经营假劣药证明。
第6 页5.仓库地址房屋产权材料及蛋白同化制剂和肽类激素专库位置图。
第7-12页6.蛋白同化制剂、肽类激素相关设施设备材料第13页7.蛋白同化制剂和肽类激素人员情况表第14-32页8.相关的质量管理目录第33-35页9.保证申请材料各项内容真实性的承诺书第 36 页10.授权委托书第 37 页关于增加蛋白同化制剂、肽类激素经营范围的申请贵州省食品药品监督管理局:我公司经营范围为“******”。
公司经营发展需要增加蛋白同化制剂、肽类激素的经营范围。
以满足公司经营需要。
为了增加蛋白同化制剂、肽类激素的经营范围,公司专门制定了经营蛋白同化制剂、肽类激素所涉及的质量文件。
库房为了满足蛋白同化制剂、肽类激素储存要求,设置了蛋白同化制剂、肽类激素专库,按照色标管理三色五区进行设置。
申请前通过自查已经符合GSP要求特向贵局申请增加蛋白同化制剂、肽类激素经营范围。
授权委托书xxx省食品药品监督管理局:我公司需办理增加蛋白同化制剂、肽类激素经营范围。
现授权委托我公司员工:***,身份证号码:*****。
前往贵局办理,本委托书有效期自***********望贵局给予接洽受理。
保证申请材料各项内容真实性的声明贵州省食品药品监督管理局:我单位申请增加蛋白同化制剂、肽类激素经营范围。
保证提交的申报材料内容真实、有效,并对申报材料实质内容的真实性负责。
如有虚假,承担法律责任。
蛋白同化制剂、肽类激素相关设施设备材料;12.相关的质量管理目录质量管理制度目录操作规程目录蛋白同化制剂、肽类激素人员情况表。
关于蛋白同化制剂、肽类激素批发企业准入资格有关问题的意见

甘食药监安…2009‟191号关于进一步加强蛋白同化制剂、肽类激素药品批发企业管理的通知各市、州食品药品监督管理局:为进一步加强蛋白同化制剂、肽类激素的监督管理,防治流入非法渠道,建立兴奋剂监管长效机制,根据《反兴奋剂条例》(国务院令第398号)和国家食品药品监督管理局《关于进一步加强兴奋剂管理的通知》(国食药监办2008]712号)有关规定,结合实际,省局对药品批发企业经营蛋白同化制剂、肽类激素申请审批程序进行了调整,对验收标准进行了修订,并经2009年6月2日省局局务会议讨论通过。
现印发给你们,请认真贯彻执行。
一、药品批发企业经营蛋白同化制剂、肽类激素申请审批程序由原来的“市(州)局受理、验收,省局审批”调整为“市(州)局初审,省局受理、验收和审批”。
二、要按照修订后的验收标准,加强蛋白同化制剂、肽类激素药品批发企业的现场验收,严把准入关。
三、已取得蛋白同化制剂、肽类激素药品经营资格的药品批发企业继续经营该类药品的,应符合新标准的要求。
企业应对照新标准进行自查整改。
其《药品经营许可证》有效期满申请换证时,一律按新标准进行审核。
四、取得蛋白同化制剂、肽类激素药品经营资格的药品批发企业,均可经营含麻黄碱类复方制剂。
五、只申请经营含麻黄碱类复方制剂药品批发企业的验收标准仍按照省局《关于含麻黄碱类复方制剂经营(批发)资格有关问题的通知》(甘食药监安…2008‟595号)文件规定执行;申请程序仍执行“企业向当地设区的市级食品药品监督管理局提出申请, 市级食品药品监督管理局进行审查和现场检查,合格的,将审查意见报省局,省局审核批准”的规定。
六、各市、州食品药品监督管理局要加大对蛋白同化制剂、肽类激素药品批发企业的监督检查力度,对擅自降低经营条件和超范围经营的企业,要依法查处,确保蛋白同化制剂、肽类激素药品经营安全。
七、本通知下发之日起,省局《关于做好蛋白同化制剂肽类激素批发企业资格准入工作的通知》(甘食药监安[2007]267号)》中《甘肃省药品批发企业经营蛋白同化制剂、肽类激素的申请条件和程序》终止执行。
蛋白同化制剂肽类激素管理制度

目的:为贯彻执行《反兴奋剂条例》等法律法规,进一步落实兴奋剂管理的有关规定,制定本制度。
范围:适用于本公司蛋白同化制剂、肽类激素药品经营过程的控制和管理。
责任:质量管理部、采购部、销售部、储运部对本制度实施负责。
内容:1、蛋白同化制剂是指所有的合成雄性激素类固醇都有与睾酮相似的化学结构。
这类药物除具有增加肌肉块头和力量,并在主动或被动减轻体重时保持肌肉体积的作用外,还具有雄激素的作用。
为此应加强对蛋白同化制剂、肽类激素药品控制。
对蛋白同化制剂、肽类激素药品购销业务实行专人和全程计算机管理,并建立专账。
2、采购蛋白同化制剂、肽类激素药品,只能从具备经营条件,并经食品药品监督管理部门批准的药品生产企业、药品经营企业购进,不得从任何非法渠道采购;采购人员负责收集供货单位相关证照及合法资质材料,查验所在地药品监督管理部门批准的专门从事蛋白同化制剂、肽类激素的证明文件,录入计算机系统提交质管部和质量副总审核批准,作为基础数据,建立合格供货方档案,并随时掌握变动情况;指定专人签订采购合同和质量保证协议书,并加盖公章、注明交货方式和交货地点。
3、本公司只能向具有蛋白同化制剂、肽类激素经营资格的医疗机构和药品批发企业供应蛋白同化制剂、肽类激素;本公司只能向药品零售企业供应肽类激素中的胰岛素,其他蛋白同化制剂及肽类激素的药品不得向药品零售企业供货;销售人员负责收集购货单位合法资格的资质文件,核实购货单位采购人员或提货人员的身份证明等,并应经质管部审核。
通过计算机系统自动识别和控管证照期限和经营范围;销售部负责建立购货单位档案,随时掌握购货单位变动情况。
档案内容包括:购货单位被指定为蛋白同化制剂、肽类激素药品经营单位的批准文件、医疗机构的合法证照等资质证明材料、采购人员身份证明(与原件核对)、法人委托书(注明授权范围、期限)等;蛋白同化制剂、肽类激素药品禁止使用现金进行交易,但可实行刷卡销售。
4、蛋白同化制剂、肽类激素药品的收货验收、储存保管、养护、出库复核及运输的管理:蛋白同化制剂、肽类激素药品实行双人验收,验收合格后,移交专管员储存于专用仓库内。
蛋白同化制剂、肽类激素管理制度

蛋白同化制剂、肽类激素经营管理制度一、目的为加强蛋白同化制剂、肽类激素的经营管理有效地控制蛋白同化制剂、肽类激素的购、存、销行为确保蛋白同化制剂、肽类激素质量及安全根据《药品管理法》、《反兴奋剂条例》、《关于贯彻落实〈反兴奋剂条例〉进一步加强兴奋剂管理的通知》等法律法规和《关于进一步加强蛋白同化制剂、肽类激素药品批发企业管理的通知》甘食药监安2009191号文件特制定本制度。
二、适用范围适用于本公司蛋白同化制剂、肽类激素的经营及安全管理。
三、内容一、蛋白同化制剂、肽类激素购进管理1、严格执行公司《药品采购管理制度》、《药品购进程序》及《首营企业、首营品种审核制度》2、公司只能从具有蛋白同化制剂、肽类激素生产、经营资格的药品生产、经营企业购进蛋白同化制剂、肽类激素购进蛋白同化制剂、肽类激素前供货企业必须提供以下资料供本公司审核其生产、经营资格的合法性1、生产企业须提供a、《药品生产许可证》复印件b、营业执照复印件c、税务登记证复印件d、组织机构代码证复印件e、企业注册商标复印件f、GMP证书复印件g、供货企业质量保证能力情况说明2、经营企业须提供a、《药品经营许可证》复印件b、营业执照复印件c、税务登记证复印件d、组织机构代码证复印件e、GSP证书复印件f、供货企业质量保证能力情况说明以上复印件须加盖供货企业原印章。
3、供货企业销售人员须提供以下资料供公司审核其合法资质1、法人授权委托书原件注明授权范围、被委托人身份证号并有企业公章及法人签章2、被委托人身份证复印件4、从生产企业购进蛋白同化制剂、肽类激素前生产企业须提供以下资料供本公司审核该具体品种的合法性1、药品生产批件复印件2、药品质量标准复印件3、药品物价批文复印件4、药品最小包装、说明书原件5、地市以上药检所检验报告复印件以上复印件须盖企业原印章5、供货企业必须是GSP或GMP达标企业6、为保证药品质量公司应优先选择从生产企业购进蛋白同化制剂、肽类激素7、业务部根据公司可经营蛋白同化制剂、肽类激素目录及销售需求负责填报《药品购货计划表》及具体负责蛋白同化制剂、肽类激素的购进。
蛋白同化制剂肽类激素经营质量管理规定

蛋白同化制剂肽类激素经营质量管理规定集团标准化工作小组 [Q8QX9QT-X8QQB8Q8-NQ8QJ8-M8QMN]蛋白同化制剂、肽类激素制度目录一、蛋白同化制剂、肽类激素专项药品管理制度---------XRYY-DTQM-001-2016二、蛋白同化制剂、肽类激素采购、销售质量管理制度---XRYY-DTQM-002-2016三、蛋白同化制剂、肽类激素收货、验收质量管理制度---XRYY-DTQM-003-2016四、蛋白同化制剂、肽类激素储存、养护和出库复核管理制-XRYY-DTQM-004-2016五、蛋白同化制剂、肽类激素储运安全管理制度----------XRYY-DTQM-005-2016六、不合格蛋白同化制剂、肽类激素管理制度-----------XRYY-DTQM-006-2016七、蛋白同化制剂、肽类激素退货管理制度-------------XRYY-DTQM-007-2016八、蛋白同化制剂、肽类激素不良反应报告制度---------XRYY-DTQM-008-2016九、含特殊药品复方制剂药品销售管理制度-------------XRYY-DTQM-009-2016十、含麻黄碱类复方制剂安全信息报告制度-------------XRYY-DTQM-010-2016十一、含麻黄碱复方制剂禁毒责任制度-----------------XRYY-DTQM-011-2016十二、蛋白同化制剂、肽类激素丢失、被盗案件报告制度-XRYY-DTQM-012-2016十三、质量教育、培训考核管理制度-------------------XRYY-DTQM-013-2016 十四、蛋白同化制剂、肽类激素经营管理自检自查制度---XRYY-DTQM-014-2016 十五、蛋白同化制剂和肽类激素岗位职责---------------XRYY-DTQM-015-2016甘肃某某有限责任公司质量管理体系文件一、目的:为了规范蛋白同化制剂、肽类激素及含麻黄碱类复方制剂的经营管理工作,保证专项管理药品的购进、验收、储存、销售、运输等环节符合相关规定,依据《反兴奋剂条例》、《易制毒化学品管理条例》、《关于进一步加强含麻黄碱类复方制剂管理的通知》等法律法规制定本制度。
药品经营企业(批发)蛋白同化制剂、肽类激素现场验收标准

药品经营企业(批发)蛋白同化制剂、肽类激素现场验收标准
备注:特殊药品经营企业包括麻醉药品和一类精神药品区域行批发企业、二类精神药品批发企业、医疗用毒性药品批发企业、罂粟壳批发企业。
其他企业可参照此验收标准。
广东省特殊药品监管现场检查表单位类型:□药品生产□药品经营□药品使用□其他
本检查表一式两份,由检查人员和被检查单位各执一份。
填表说明
一、涉及特殊药品行政审批验收、日常监督、投诉举报等现场检查适用该表。
二、“现场检查基本情况以及存在问题”填写至少应包含以下内容:
1.药品经营企业申请经营特殊药品:对照原有验收标准逐项检查,如实填写检查的基本情况(人员、仓库设施设备、安全设施设备和管理制度等)、缺陷项目及存在问题等。
2.特殊药品原料购用:所购买的原料用于生产的产品名称、规格及生产情况;上一次购买的原料库存;仓库安全设施设备、安全保障制度等。
3.麻黄素单方制剂购用:特殊药品经营资质、上次购买的销售情况、库存情况、仓库的设施设备、安全保障等。
4.教学、科研对照品购用:试验设施设备、使用登记制度、储存设施设备、安全保障等。
5.特殊药品科研立项:科研设施设备、技术人员情况,特殊药品安全保障和管理制度等。
6.日常检查和有因检查:对照原有的检查内容逐项检查,如实填写检查的情况及存在问题,重点为所经营的品种销售情况、库存、仓库安全设施设备、安全保障措施等。
7.如填写内容较多,可另附表格。
三、“检查结论以及建议”填写内容:检查结论、整改建议、整改期限等。
蛋白同化制剂和肽类激素申报材料

蛋白同化制剂和肽类激素申报材料篇一:蛋白同化制剂、肽类激素药品管理制度蛋白同化制剂、肽类激素药品管理制度制(修)订人:制(修)订日期:审核人:审核日期:批准人:批准日期:执行日期:分发部门:仓储部、营销部、市场部、采供部、质管部、人事行政部、财务部1、目的:为确保所储存药品数量准确和质量完好,杜绝差错,制定本管理制度。
加强特殊管理监管,确保蛋白同化制剂、肽类激素的合法性,规范经营过程的各个环节,杜绝含蛋白同化制剂、肽类激素从药用渠道流失和滥用。
2、依据:根据《药品经营质量管理规范》、关于蛋白同化制剂、肽类激素药品的相关法律法规及文件要求。
3、适用范围:本制度适用于本企业蛋白同化制剂、肽类激素药品经营的全过程。
4、责任:企业负责人是蛋白同化制剂、肽类激素药品经营安全管理第一责任人。
在公司经营全过程中,凡是与“蛋白同化制剂、肽类激素”相关工作有关的人员均为蛋白同化制剂、肽类激素管理人员。
包括:采购人员、销售人员、仓库管理员、验收员、养护员、复核员、司机、质量管理员等,质量管理部负责对“蛋白同化制剂、肽类激素”相关人员与工作进行监督。
公司质量领导小组及各部门对本制度的实施负责5蛋白同化制剂、肽类激素的采购5.1 蛋白同化制剂、肽类激素品种与供应商的资格审核蛋白同化制剂、肽类激素供应商必须具有合法资质的药品经营企业,并且是经本公司质管部审核合格的合格供货方,不得从任何非法渠道购进蛋白同化制剂、肽类激素。
5.2、当供应商为首营企业时,按《首营企业审批程序》进行审核,采供部负责向供货方索取《营业执照》及其上一年度企业年度报告公示情况、《药品经营/生产许可证》、《GSP/GMP》证书、《税务登记证》、《组织机构代码证》、相关印章、随货同行单(票)样式、开户户名、开户银行及账号。
5.3当购进的药品为首营品种时,按《首营品种审批程序》进行审核,向供货单位索取合法性证明材料:生产批文、产品质量标准、检验报告书、物价批文等资料以及样品、说明书等。
(空白表)药品批发企业经营蛋白同化制剂、肽类激素审批申请表
法定代表人签字
日期:年月 日
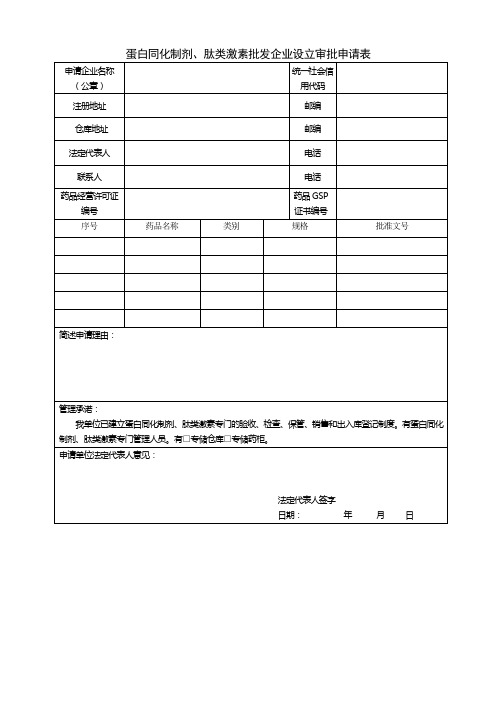
蛋白同化制剂、肽类激素批发企业设立审批申请表
申请企业名称(公章)
统一社会信用代码
注册地址
邮编
仓库地址
邮编Leabharlann 法定代表人电话联系人
电话
药品经营许可证编号
药品GSP证书编号
序号
药品名称
类别
规格
批准文号
简述申请理由:
管理承诺:
我单位已建立蛋白同化制剂、肽类激素专门的验收、检查、保管、销售和出入库登记制度。有蛋白同化制剂、肽类激素专门管理人员。有□专储仓库□专储药柜。
蛋白同化制剂、肽类激素质量管理制度
一、目的确保蛋白同化制剂和肽类激素的经营安全,加强经营过程中的监控管理措施,达到安全、合法经营的管理目标。
二、依据《药品管理法》、《反兴奋剂条例》、《关于进一步加强兴奋剂管理的通知》和《药品经营质量管理规范》及实施条例等相关法律法规。
三、适用范围适用于公司蛋白同化制剂和肽类激素的经营管理。
四、内容“蛋白同化制剂”又称同化激素,俗称合成类固醇,是合成代谢类药物,具有促进蛋白质合成和减少氨基酸分解的特征,可促进肌肉增生,提高动作力度和增强男性的性特征。
肽类激素的作用是通过刺激肾上腺皮质生长、红细胞生成等实现促进人体的生长发育,大量摄入会降低自身内分泌水平,损害身体健康,还可能引起心血管疾病、糖尿病等疾病。
1、蛋白同化制剂和肽类激素的经营管理、药品质量以及安全管理中,企业法人是第一责任人.2、凡购进蛋白同化制剂和肽类激素,均应按《反兴奋剂条例》规定配备专门的管理人员.3、建立蛋白同化制剂和肽类激素的专用账册及购进、入库验收、在库养护、出库复核、销售等各项记录,记录实行计算机管理。
4、蛋白同化制剂和肽类激素账册及记录的保存期限应当自药品有效期期满之日起不少于5年.5、蛋白同化制剂和肽类激素管理人员和直接业务人员应相对稳定,其管理人员和直接业务人员、储存、运输等人员每年接受不少于10学时的特殊药品相关业务培训,经考核合格后方可上岗.6、每月10日前及每季度末,向食品药品监管部门报送上月或上季度蛋白同化制剂和肽类激素购进、销售流向和库存情况。
一、目的严格把好蛋白同化制剂和肽类激素的购进业务质量关,确保依法经营并保证经营质量安全。
二、依据《药品管理法》、《反兴奋剂条例》、《关于进一步加强兴奋剂管理的通知》和《药品经营质量管理规范》及实施条例等相关法律法规。
三、适用范围适用于公司蛋白同化制剂和肽类激素购进环节的质量管理。
四、内容1、药品配置中心指定专人负责蛋白同化制剂和肽类激素的采购工作。
2、采购蛋白同化制剂和肽类激素时,只能从经省级食品药品监督管理部门批准的,具有蛋白同化制剂和肽类激素生产、经营资质的企业购进,不得从任何非法渠道进货。
蛋白同化制剂、肽类激素经营质量管理制度()

蛋白同化制剂、肽类激素制度目录一、蛋白同化制剂、肽类激素专项药品管理制度---------XRYY-DTQM-001-2016二、蛋白同化制剂、肽类激素采购、销售质量管理制度---XRYY-DTQM-002-2016三、蛋白同化制剂、肽类激素收货、验收质量管理制度---XRYY-DTQM-003-2016四、蛋白同化制剂、肽类激素储存、养护和出库复核管理制-XRYY-DTQM-004-2016五、蛋白同化制剂、肽类激素储运安全管理制度----------XRYY-DTQM-005-2016六、不合格蛋白同化制剂、肽类激素管理制度-----------XRYY-DTQM-006-2016七、蛋白同化制剂、肽类激素退货管理制度-------------XRYY-DTQM-007-2016八、蛋白同化制剂、肽类激素不良反应报告制度---------XRYY-DTQM-008-2016九、含特殊药品复方制剂药品销售管理制度-------------XRYY-DTQM-009-2016十、含麻黄碱类复方制剂安全信息报告制度-------------XRYY-DTQM-010-2016十一、含麻黄碱复方制剂禁毒责任制度-----------------XRYY-DTQM-011-2016十二、蛋白同化制剂、肽类激素丢失、被盗案件报告制度-XRYY-DTQM-012-2016十三、质量教育、培训考核管理制度-------------------XRYY-DTQM-013-2016十四、蛋白同化制剂、肽类激素经营管理自检自查制度---XRYY-DTQM-014-2016十五、蛋白同化制剂和肽类激素岗位职责---------------XRYY-DTQM-015-2016甘肃某某有限责任公司质量管理体系文件文件名称蛋白同化制剂、肽类激素专项管理药品管理页数 2制度文件编号XRYY-DTQM-001-2016 版本号2016/1起草人:审核人:批准人:日期:日期:执行日期:分发部门公司各部门保管部门质管部制定依据《反兴奋剂条例》《关于进一步加强含麻黄碱类复方制剂管理的通知》一、目的:为了规范蛋白同化制剂、肽类激素及含麻黄碱类复方制剂的经营管理工作,保证专项管理药品的购进、验收、储存、销售、运输等环节符合相关规定,依据《反兴奋剂条例》、《易制毒化学品管理条例》、《关于进一步加强含麻黄碱类复方制剂管理的通知》等法律法规制定本制度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
□仅限于含麻黄碱类复方制剂
企业拟经营的蛋白同化制剂和肽类激素品种(胰岛素及含麻黄碱类复方制剂品种除外)
药品名称/剂型
规格
蛋白同化制剂、肽类激素药品销售客户范围
□本省具有蛋白同化制剂和肽类激素经营资格的批发企业
□外埠具有蛋白同化制剂和肽类激素经营资格的批发企业
□本省零售药店 □ 本辖区零售药店 □ 外埠零售药店
□本省医疗机构 □ 本辖区医疗机构 □ 外埠医疗机构
□其他(详述)
备注
附件1蛋白同化制剂、肽类激素批发经营申请表
蛋白同化制剂和肽类激素定点批发经营申请表
填表日期: 年 月 日
申请企业名称(加盖公章)
《药品经营许可证》证号
法定代表人
主管蛋白同化肽类质量联系人
联系电话
企业注册地址
蛋白同化肽类仓库地址
拟许可经营的范围
□蛋白同化制剂和肽类激素
