初三化学八圈图完整版
最全的初中化学总结:三年知识点全在这8张网络图里,太好记了!
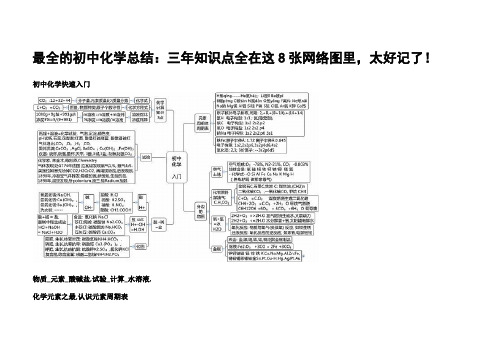
初中化学快速入门
物质பைடு நூலகம்元素_酸碱盐,试验_计算_水溶液,
化学元素之最,认识元素周期表
化学实验35例,看听做想,多联想
化学元素及术语命名及翻译趣谈
化学计算: +-*/又图表,比例守恒3知识
初中基本厚厚的化学书就浓缩成这小小的8张图,是不是很神奇呢?这种方法就是我长给孩子推荐的思维导图学习法,不仅是化学,所有学科都能浓缩成精华变成有趣有逻辑的知识网络图,让孩子学习、记忆更加轻松高效。我一直坚信没有学不好的学生,只有不会学的学生。
2021年八圈图化学方程式分类(用过)

2013年初三化学物质类别之间的反应学案欧阳光明(2021.03.07)(1)金属单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2点燃 2MgO2. 铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O43. 铜在空气中受热:2Cu + O2加热 2CuO4. 铝在空气中燃烧:4Al + 3O2点燃 2Al2O3(2)碱性氧化物与水的反应、可溶性碱的制备:5、CaO + H2O ==== Ca(OH)26、Na2O + H2O ==== 2NaOH(3)难溶性碱的受热分解:7、 2Fe(OH)3加热Fe2O3 + 3H2O 8、Cu(OH)2加热CuO + H2O(4)非金属单质与氧气的反应:9、氢气中空气中燃烧:2H2 + O2点燃 2H2O10、红磷在空气中燃烧:4P + 5O2点燃 2P2O511、硫粉在空气中燃烧: S + O2点燃 SO212、碳在氧气中充分燃烧:C + O2点燃 CO213、碳在氧气中不充分燃烧:2C + O2点燃 2CO(5)酸性氧化物与水反应制备酸:14、CO2+ H2O==== H2CO315、SO2 + H2O==== H2SO3 16、SO3 + H2O==== H2SO4(6)弱酸的分解:17、H2CO3==== CO2↑+ H2O 18、 H2SO3====SO2↑+ H2O(7)碱性氧化物与酸性氧化物反应制备盐:19、CaO + SiO2高温 CaSiO3(8)金属与非金属反应生成无氧酸盐:20、2Na + Cl2点燃2NaCl(9)碱性氧化物 +酸 -------- 盐 + 水21. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O22. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O23. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O24. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O25. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O26. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(10)酸性氧化物 +碱 -------- 盐 + 水27.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 28.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 29.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O 30.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O 31. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3↓+ H2O(11)酸 + 碱 -------- 盐 + 水32.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O33. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O34.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O 35. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O36. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O37.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 +3H2O38.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O39.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O40.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O41. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 +6H2O42. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(12)酸 + 盐 -------- 另一种酸 + 另一种盐43.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑ 44.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑ 45.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑ 46.盐酸和硝酸银溶液反应:HCl + AgNO3=== AgCl↓ + HNO347.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑48.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4↓+ 2HCl(13)碱 + 盐 -------- 另一种碱 + 另一种盐49.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4 50.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl 51.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl52. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl53. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH(14)盐 + 盐 ----- 两种新盐54.氯化钠溶液和硝酸银溶液:NaCl + AgNO3==== AgCl↓ + NaNO355.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl(15)金属单质 + 酸 -------- 盐 + 氢气(置换反应)56. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑57. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑58. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑59. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑60. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑61. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑62. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑63. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(16)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐64. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu65. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu66. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(17)非金属与氢气的反应:67、H2 + Cl2点燃 2HCl(18)盐的分解:68、CaCO3高温CaO + CO2↑。
初三化学八圈图复习过程

初三化学八圈图无机反应关系(八圈图)的用途对于书写化学方程式来说,将物质分为七类为好:金属、非金属、碱性氧化物、酸性氧化物、碱、酸、盐。
因此,无机物即单质、氧化物和碱、酸、盐的相互关系图,一般把它叫做“八圈图”。
表物质反应的相互关系表物质的相互关系即是物质的性质,即反应规律,要牢固掌握!!无机物的相互关系表即八圈图有以下五个用途:1表示物质间的纵横衍变关系,如从金属或非金属如何衍变成盐;例1:完成下列反应:① Mg MgO MgCl2 Mg(OH)2 MgSO4② C CO2 CaCO3 Ca(HCO3)2 CaCO3 CO2 2表示16个基本反应规律;⑴金属+氧气碱性氧化物⑵碱性氧化物+水碱⑶非金属+氧气酸性氧化物⑷酸性氧化物+水含氧酸⑸金属+非金属无氧酸盐⑹酸性氧化物+碱性氧化物含氧酸盐⑺非金属+氢气酸⑻金属+酸盐+氢气⑼金属+盐盐+金属⑽非金属+盐盐+非金属⑾酸+碱性氧化物盐+水⑿酸+碱盐+水⒀碱+盐盐+碱⒁酸+盐盐+酸⒂盐+盐盐+盐⒃碱+酸性氧化物盐+水3表示物质的性质;例如,除了跟指示剂反应的这一性质在图中无法表示外,图中酸的没有打箭头的4根线表示的就是酸的性质:酸与碱作用生成盐和水,酸与碱性氧化物反应生成盐和水,酸与活泼金属反应生成盐和氢气,酸与盐反应生成新盐和新酸;图中碱的没有打箭号的3根线表示的就是碱的性质:碱与酸反应生成盐和水,碱与酸性氧化物反应生成盐和水,碱与盐反应生成新盐和新碱。
盐有4根没打箭头的线表示了盐的4种性质:盐与酸反应生成新盐和新酸,盐与碱反应生成新盐和新碱,盐与盐反应生成两种新盐,盐与非金属反应生成一种新盐和一种新非金属。
4表示基本反应类型:①—⑦表示化合反应;⑧—⑩表示置换反应;—表示复分解反应;化合反应能逆向进行的就是分解反应;5表示物质(特别是盐)的制法。
盐是无机物相互关系图中的大动脉,很多反应都可以制取盐。
例2:写出能生成ZnCl2的六种化学反应方程式。
初三化学八圈图
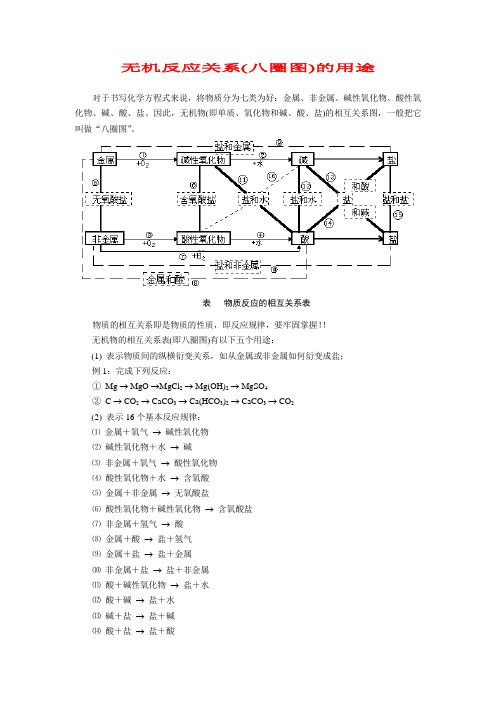
无机反应关系(八圈图)的用途对于书写化学方程式来说,将物质分为七类为好:金属、非金属、碱性氧化物、酸性氧化物、碱、酸、盐。
因此,无机物(即单质、氧化物和碱、酸、盐)的相互关系图,一般把它叫做“八圈图”。
表物质反应的相互关系表物质的相互关系即是物质的性质,即反应规律,要牢固掌握!!无机物的相互关系表(即八圈图)有以下五个用途:(1)表示物质间的纵横衍变关系,如从金属或非金属如何衍变成盐;例1:完成下列反应:①Mg → MgO →MgCl2→ Mg(OH)2→ MgSO4②C → CO2→ CaCO3→ Ca(HCO3)2→ CaCO3→ CO2(2)表示16个基本反应规律;⑴金属+氧气→碱性氧化物⑵碱性氧化物+水→碱⑶非金属+氧气→酸性氧化物⑷酸性氧化物+水→含氧酸⑸金属+非金属→无氧酸盐⑹酸性氧化物+碱性氧化物→含氧酸盐⑺非金属+氢气→酸⑻金属+酸→盐+氢气⑼金属+盐→盐+金属⑽非金属+盐→盐+非金属⑾酸+碱性氧化物→盐+水⑿酸+碱→盐+水⒀碱+盐→盐+碱⒁酸+盐→盐+酸⒂盐+盐→盐+盐⒃碱+酸性氧化物→盐+水(3)表示物质的性质;例如,除了跟指示剂反应的这一性质在图中无法表示外,图中酸的没有打箭头的4根线表示的就是酸的性质:酸与碱作用生成盐和水,酸与碱性氧化物反应生成盐和水,酸与活泼金属反应生成盐和氢气,酸与盐反应生成新盐和新酸;图中碱的没有打箭号的3根线表示的就是碱的性质:碱与酸反应生成盐和水,碱与酸性氧化物反应生成盐和水,碱与盐反应生成新盐和新碱。
盐有4根没打箭头的线表示了盐的4种性质:盐与酸反应生成新盐和新酸,盐与碱反应生成新盐和新碱,盐与盐反应生成两种新盐,盐与非金属反应生成一种新盐和一种新非金属。
(4)表示基本反应类型:①—⑦表示化合反应;⑧—⑩表示置换反应;—表示复分解反应;化合反应能逆向进行的就是分解反应;(5)表示物质(特别是盐)的制法。
盐是无机物相互关系图中的大动脉,很多反应都可以制取盐。
初中化学八圈图教案

初中化学八圈图教案课题:化学元素周期表一、教学目标:1. 了解元素周期表的组成及基本结构;2. 掌握元素周期表的分类方法;3. 能够利用元素周期表进行元素的相关性质和规律性的分析。
二、教学准备:1. 教师准备:准备元素周期表的教学素材,准备PPT或教具等辅助工具;2. 学生准备:学生自带元素周期表,纸笔等。
三、教学过程:1. 导入:通过引入化学元素的概念,为学生引入元素周期表的学习;2. 学习元素周期表:利用PPT或教具,向学生展示元素周期表的基本结构和分类方法;3. 圈出同族元素:让学生使用不同颜色的笔圈出元素周期表中同族元素的位置;4. 分析元素周期表的周期性:让学生根据元素周期表的结构及分类方法,分析元素的周期性规律,如原子半径的递增减小规律等;5. 总结:让学生总结元素周期表的特点和周期性规律,提升学生对元素周期表的理解和掌握。
四、作业布置:1. 布置练习题,让学生练习使用元素周期表进行相关性质和规律性的分析;2. 要求学生利用元素周期表列举两组同族元素。
五、教学反馈:1. 对学生的练习题进行批改并讲解;2. 对学生在学习过程中的问题进行澄清和解答。
六、教学延伸:1. 拓展学生对元素周期表的应用知识,如元素周期表在化学实验和化学计算中的应用;2. 培养学生对元素周期表的兴趣,探索元素之间的相关性质。
七、教学反思:1. 教学目标是否达到;2. 学生是否对元素周期表的结构和周期性规律有深入理解。
八、教学改进:1. 针对学生学习情况,调整教学方法和手段,更好地引导学生;2. 加强学生的实践操作和动手能力,提高学生对元素周期表的运用能力。
八圈图的应用课件

⑩金属+碱
3.十种成盐的方法及反应条件
练习3. 制取含氧酸盐硫酸镁有多少种方法?写出有关 的化学方程式。
练习4. 制取无氧酸盐有多少种方法?写出有关的化学 方程式。
4.记忆四种基本反应类型
化合反应
金属
无氧酸盐
化合反应 分解反应
非金属 O2
2Ca+O2=2CaO CaO+H2O=Ca(OH)2 C+O2
碱性 氧化物
△ CuO+H O 2
△
△ CO2↑ +H2O H2CO3
部分 碱
部分 含氧酸
4.记忆四种基本反应类型
置换反应
金属
H2 △ C 金 属 和 盐
金属 氧化物
盐 和 氢 气
H2+CuO C+2CuO
△ △
Cu+H2O 2Cu+CO2↑
Fe+CuSO4=FeSO4+Cu
酸
Zn+H2SO4=ZnSO4+H2↑
5.运用“八圈图”解决典型习题
(2)物之间相互反应
练习6. 在铁、稀硫酸、氧化铁、 氯化铜溶液、氢氧化钠溶液中, 常温下,哪两种物之间能发生化 学反应?写出有关反应的化学方 程式。
金属 Fe 酸 H2SO4 盐 CuCl2
方法一:先将物质分类,再 用“八圈图”各就各位,再 找关系。
Fe 方法二:用排列组合方法, 依次反应。
非金属
碱性 氧化物
酸性 氧化物
酸
的 物 属 全 式 包 是 分 和 正 展 ( 酸 固 金 碱 盐 纯 素一 液生 或酸 非 的 盐 为 根 : 的 部 般 在 化 性 酸 定 属 净 没性 金 体成 ( 部括 氧 纯 低 ) 活 单 阴 金 温 有氧 属 质 是 是 水 合 、 碱 的 : 阿 物 ,物 是 化 和 价 泼 盐 只 离 属 度 氢 含 溶 物 理 组 一 伦 容 : 金化 如 净 ) 氢 合 氧 ( 子 阳 电 物 氧金 氧 液 有 论 成 种 物 尼 ( 。 易 同 属物 在 碳有 、 盐 化 正 结 离 阻 离 根属 酸 中 盐 的 和 具 乌 其 导 : 种 特: 通 元盐 物 ( ( 物 氧 盐 和 合 子 能 氢 系 子对 离 电 一能 性 有 斯 中 电 物 单 常 素和 复 ( 化 、 水 的 或 跟 化 数 元 为 子 应 离 水 的跟 种 质 光 酸 、 条 同 质 ( 的 盐 物 酸 的 铵 化 化 酸 素的 的 出 的 脆 泽 合 件 质 种 碱 组 导 ) , ) 化 和和 式 氧 根 合 合 起 单 ) ( 同 的 氧 电 元 起 成 热 化 认 分 、 性 下 等 物 络 其 盐 化 离 物 反 合 、 化 阳 阴 化 离 素 反 的 合 ( 为 富 固 为 ) 性 质 盐 他 、 物 子 应 ) 。 ) 物 ) 溴 合 离 物 理 组 应 物 具 , 单 有 , 体 气 质 )金 碱, 与 。 盐, 的 价 子 论 成 。 元 有 , 酸 碱 质 延 , 有 或 体 。 C
物质转化方程式练习四(初中八圈图)
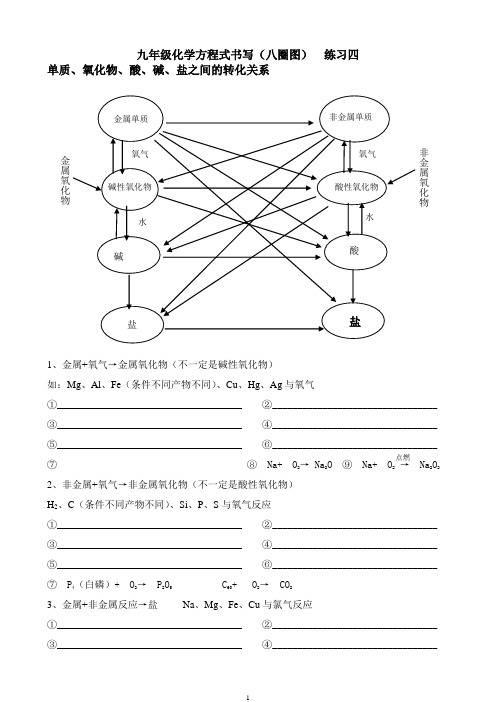
九年级化学方程式书写(八圈图) 练习四单质、氧化物、酸、碱、盐之间的转化关系1、金属+氧气→金属氧化物(不一定是碱性氧化物)如:Mg 、Al 、Fe (条件不同产物不同)、Cu 、Hg 、Ag 与氧气 ①_____________________________________ ②_________________________________ ③_____________________________________ ④_________________________________ ⑤_____________________________________ ⑥_________________________________ ⑦____________________________________ ⑧ Na+ O 2→ Na 2O ⑨ Na+ O 2 → Na 2O 22、非金属+氧气→非金属氧化物(不一定是酸性氧化物)H 2、C (条件不同产物不同)、Si 、P 、S 与氧气反应①_____________________________________ ②_________________________________ ③_____________________________________ ④_________________________________ ⑤_____________________________________ ⑥_________________________________ ⑦ P 4(白磷)+ O 2→ P 2O 5 C 60+ O 2→ CO 23、金属+非金属反应→盐 Na 、Mg 、Fe 、Cu 与氯气反应①_____________________________________ ②_________________________________ ③_____________________________________ ④_________________________________ 点燃 金属氧化物 非金属氧化物Na 、K 、Ca 、Al 与硫反应 ①_________________________ ②_______________________ ③_____________________________________ ④_________________________________4、金属+非金属氧化物→非金属单质+金属氧化物 Mg 与CO 2反应、Fe 与水蒸气反应 ①_____________________________________ ②_________________________________5、金属氧化物+非金属单质→金属+非金属氧化物 CuO 、FeO 、Fe 2O 3、Fe 3O 4与C 反应 ①_____________________________________ ②_________________________________ ③_____________________________________ ④_________________________________ CuO 、FeO 、Fe 2O 3、Fe 3O 4与H 2反应①_____________________________________ ②_________________________________ ③_____________________________________ ④_________________________________6、非金属+非金属氧化物反应(水煤气法制氢气)__________________________________ C+ CO 2 → CO CO+ O 2→ CO 2 C+ SiO 2 → CO+ Si SO 2+ O 2→ SO 37、金属氧化物+金属反应:(铝热反应) Al+ Fe 2O 3→ Al 2O 3+ FeAl+ Fe 3O 4→ Al 2O 3+ Fe Al+ WO 3→ Al 2O 3+ W Al+ V 2O 5→ Al 2O 3+ V8、碱性氧化物+水→对应的碱(生成的碱必须可溶) 如:Na 2O 、K 2O 、CaO 、BaO 与H 2O ①_____________________________________ ②_________________________________ ③_____________________________________ ④_________________________________9、不容性的碱受热易分解生成碱性氧化物+水 如:Fe(OH)3、Cu(OH)2、Al(OH)3、Mg(OH)2 ①_____________________________________ ②_________________________________ ③_____________________________________ ④_________________________________10、酸性氧化物+水→对应的酸(生成的酸必须可溶) 如:CO 2、SO 2、SO 3、P 2O 5+H 2O ①_____________________________________ ②_________________________________ ③_____________________________________ ④_________________________________11、不溶性酸受热易分解→酸性氧化物+水 H 2SiO 3→SiO 2+H 2O12、酸性氧化物+碱性氧化物→盐 如:Na 2O 、K 2O 、CaO 、BaO 与CO 2、SO 2①_____________________________________ ②_________________________________ ③_____________________________________ ④_________________________________ ⑤_____________________________________ ⑥_________________________________ ⑦_____________________________________ ⑧_________________________________13、金属+酸→盐+H 2 (排在金属活动性顺序表前面的金属可以置换酸中的氢) 如:铁、高温 高温高温 高温 高温 高温 △锌、镁、铝与稀盐酸、稀硫酸反应①_____________________________________ ②_________________________________ ③_____________________________________ ④_________________________________ ⑤_____________________________________ ⑥_________________________________⑦_____________________________________ ⑧_________________________________14、金属+盐→新盐+另一金属(排在金属活动性顺序表前面的金属可以置换后面的金属从其盐溶液...中置换出来)如:Zn、Fe与CuSO4溶液、Cu与Hg(NO3)2、AgNO3溶液反应①_____________________________________ ②_________________________________③_____________________________________ ④_________________________________15、非金属+碱→ Cl2+ NaOH→ NaCl+ NaClO+ H2O S+ NaOH→ Na2S+ Na2SO3+ H2O16、非金属+盐→ FeCl2+ Cl2→ FeCl3 NaBr+ Cl2→ NaCl+ Br2 KI+ Cl2→KCl+I2 FeS2+ O2→ Fe2O3+ SO2FeS+ O2→ Fe2O3+ SO217、碱性氧化物+酸→盐+水如:CuO、Fe2O3、Al2O3、CaO、Na2O、BaO与稀盐酸反应①_____________________________________ ②_________________________________ ③_____________________________________ ④_________________________________ ⑤_____________________________________ ⑥_________________________________如:CuO、Fe2O3、Al2O3、CaO、Na2O、BaO与稀硫酸反应①_____________________________________ ②_________________________________ ③_____________________________________ ④_________________________________⑤_____________________________________ ⑥_________________________________18、酸性氧化物+碱→盐+水如:CO2、SO2、SO3与NaOH溶液、Ca(OH)2溶液反应①_____________________________________ ②_________________________________ ③_____________________________________ ④_________________________________⑤_____________________________________ ⑥_________________________________19、酸性氧化物+盐→新盐如:Na2CO3溶液通入CO2气体,Na2SO3溶液通入SO2气体①_____________________________________ ②_________________________________ Ca(OH)2溶液中通入过量CO2、_________________________________________________ Ca(OH)2溶液中通入过量SO2、_________________________________________________20、酸+碱→盐+水 NaOH与盐酸、硫酸、硝酸; Ba(OH)2与盐酸、硫酸、硝酸;①_____________________________________ ②_________________________________点燃⑤_____________________________________ ⑥_________________________________ Fe(OH)3、Cu(OH)2、Al(OH)3与稀盐酸、稀硫酸、稀硝酸反应①_____________________________________ ②_________________________________ ③_____________________________________ ④_________________________________ ⑤_____________________________________ ⑥_________________________________氨水中加入稀盐酸、稀硫酸、稀硝酸、醋酸①_____________________________________ ②_________________________________③_____________________________________ ④_________________________________21、碱+盐→新碱+新盐(条件:碱和盐都可溶)如:NaOH与CuSO4、FeCl3溶液反应;①_____________________________________ ②_________________________________ NaOH与氯化铵、硝酸铵、硫酸铵、碳酸氢铵①_____________________________________ ②_________________________________ ③_____________________________________ ④_________________________________氨水与CuSO4、FeCl3溶液反应__________________________ ________________________澄清石灰水与Na2CO3溶液反应__________________________________________________ Ba(OH)2溶液分别与Na2CO3溶液、Na2SO4溶液①_____________________________________ ②_________________________________ 氢氧化钡溶液与硫酸铜溶液反应__________________________________________________ 澄清石灰水与硫酸铜溶液反应(制波尔多液农药)__________________________________22、酸+盐→新酸+新盐如:碳酸钠、碳酸氢钠、碳酸钙、碳酸钡与稀盐酸反应①_____________________________________ ②_________________________________ ③_____________________________________ ④_________________________________ 如:碳酸钠、碳酸氢钠、碳酸镁、碳酸钡与稀硫酸反应①_____________________________________ ②_________________________________ ③_____________________________________ ④_________________________________ 如:氯化钡与稀硫酸反应、硝酸银与盐酸反应①_____________________________________ ②_________________________________23、盐+盐→另外两种新盐(条件:两种盐都可溶)注:主要生成CaCO3、BaSO4、AgCl沉淀如:氯化钙、硝酸钙溶液分别与碳酸钠溶液、碳酸铵溶液反应③_____________________________________ ④_________________________________ 如:氯化钡、硝酸钡溶液分别与硫酸钠溶液、硫酸铜反应①_____________________________________ ②_________________________________ ③_____________________________________ ④_________________________________ 如:硝酸银溶液与氯化钠、氯化铁、氯化铜、氯化铵溶液反应①_____________________________________ ②_________________________________③_____________________________________ ④_________________________________24、不溶性碳酸盐受热易分解生成碱性氧化物和二氧化碳如:碳酸钙、碳酸钡高温分解。
八圈图
金属—金属氧化物 3Fe+2O2=Fe3O4 金属氧化物—碱 碱—盐 CaO+H2O=Ca(OH)2
Ca(OH)2+CO2=CaCO3+H2O+CO2 S+O2=SO2
非金属—非金属氧化物
非金属氧化物—酸 H2O+SO2=H2SO3 酸—盐 H2SO4+BaCl2=BaSO4+2HCl Fe+S=FeS CuO+H2SO4=CuSO4+H2O
Cu (OH ) 2 CuO H 2 O (4)酸+碱 盐+水 3NaOH H 3 PO4 Na3 PO4 3H 2O Cu(OH ) 2 H 2 SO4 CuSO4 2H 2 O
ห้องสมุดไป่ตู้
(5)非金属+ O2 点燃 非金属氧化物(酸性氧化物)
1/5
本人原创——颜逸飘
Na2 SO4 2HCl
④ 可溶性酸 难溶性酸。 如: Na2 SiO3 2HCl 2NaCl H 2 SiO3 <3> 从反应规律与反应类型的关系来看。 属于化合反应的有:规律(1)、(2)、(5)、(6)、(8)、(9)。 属于分解反应的有:规律(3)、(7)、(10)。 属于置换反应的有:规律(16)、(17)。 属于复分解反应的有:规律(4)、(11)、(12)、(14)、(15)。 规律(13)不属于任何一种基本反应类型。
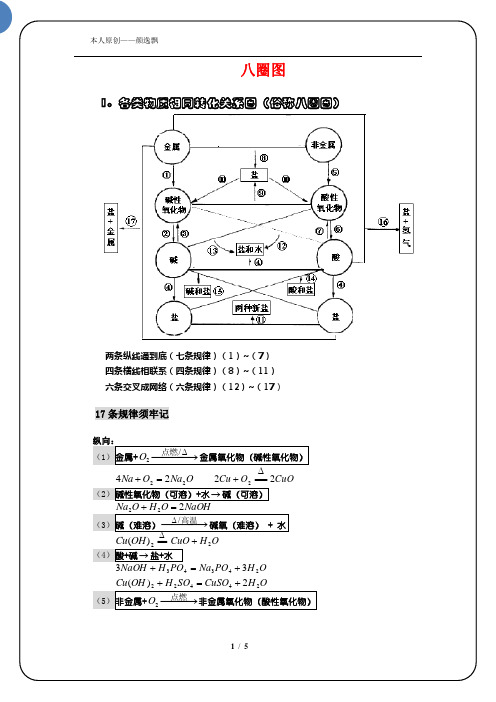
17 条规律须牢记
纵向:
/ (1)金属+ O2 点燃 金属氧化物(碱性氧化物)
2Cu O2 2CuO (2)碱性氧化物(可溶)+水 碱(可溶) Na2 O H 2 O 2 NaOH
初三化学八圈图
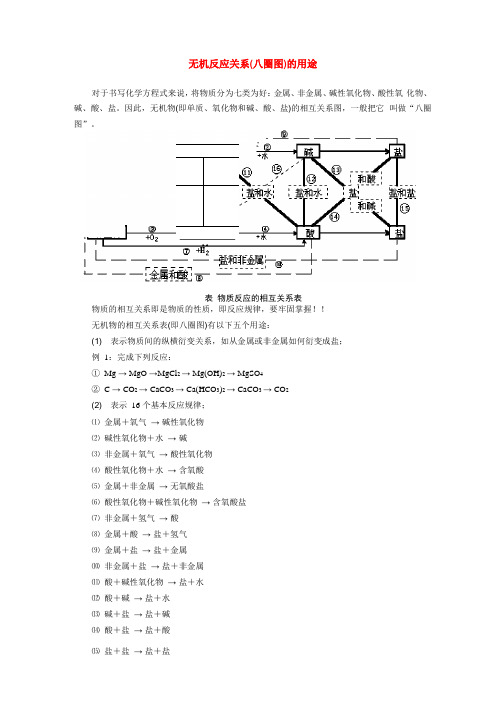
无机反应关系(八圈图)的用途对于书写化学方程式来说,将物质分为七类为好:金属、非金属、碱性氧化物、酸性氧化物、碱、酸、盐。
因此,无机物(即单质、氧化物和碱、酸、盐)的相互关系图,一般把它叫做“八圈图”。
表物质反应的相互关系表物质的相互关系即是物质的性质,即反应规律,要牢固掌握!!无机物的相互关系表(即八圈图)有以下五个用途:(1) 表示物质间的纵横衍变关系,如从金属或非金属如何衍变成盐;例1:完成下列反应:① Mg → MgO →MgCl2 → Mg(OH)2 → MgSO4② C → CO2 → CaCO3 → Ca(HCO3)2 → CaCO3 → CO2(2) 表示16 个基本反应规律;⑴ 金属+氧气→ 碱性氧化物⑵ 碱性氧化物+水→ 碱⑶ 非金属+氧气→ 酸性氧化物⑷ 酸性氧化物+水→ 含氧酸⑸ 金属+非金属→ 无氧酸盐⑹ 酸性氧化物+碱性氧化物→ 含氧酸盐⑺ 非金属+氢气→ 酸⑻ 金属+酸→ 盐+氢气⑼ 金属+盐→ 盐+金属⑽ 非金属+盐→ 盐+非金属⑾ 酸+碱性氧化物→ 盐+水⑿ 酸+碱→ 盐+水⒀ 碱+盐→ 盐+碱⒁ 酸+盐→ 盐+酸⒂ 盐+盐→ 盐+盐⒃ 碱+酸性氧化物→ 盐+水(3) 表示物质的性质;例如,除了跟指示剂反应的这一性质在图中无法表示外,图中酸的没有打箭头的4 根线表示的就是酸的性质:酸与碱作用生成盐和水,酸与碱性氧化物反应生成盐和水,酸与活泼金属反应生成盐和氢气,酸与盐反应生成新盐和新酸;图中碱的没有打箭号的3 根线表示的就是碱的性质:碱与酸反应生成盐和水,碱与酸性氧化物反应生成盐和水,碱与盐反应生成新盐和新碱。
盐有4 根没打箭头的线表示了盐的4种性质:盐与酸反应生成新盐和新酸,盐与碱反应生成新盐和新碱,盐与盐反应生成两种新盐,盐与非金属反应生成一种新盐和一种新非金属。
(4) 表示基本反应类型:①—⑦表示化合反应;⑧—⑩表示置换反应;—表示复分解反应;化合反应能逆向进行的就是分解反应;(5) 表示物质(特别是盐)的制法。
初中化学专题3 八圈图及物质的转化
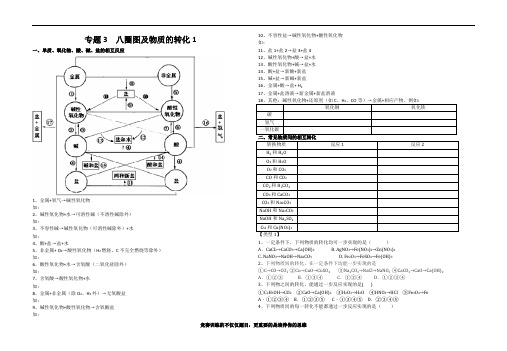
专题3 八圈图及物质的转化1一、单质、氧化物、酸、碱、盐的相互反应1、金属+氧气→碱性氧化物如:2、碱性氧化物+水→可溶性碱(不溶性碱除外)如:3、不容性碱→碱性氧化物(可溶性碱除外)+水如:4、酸+盐→盐+水5、非金属+ O2→酸性氧化物(H2燃烧、C不完全燃烧等除外)如:6、酸性氧化物+水→含氧酸(二氧化硅除外)如:7、含氧酸→酸性氧化物+水如:8、金属+非金属(除O2、H2外)→无氧酸盐如:9、碱性氧化物+酸性氧化物→含氧酸盐如:10、不容性盐→碱性氧化物+酸性氧化物如:11、盐1+盐2→盐3+盐412、碱性氧化物+酸→盐+水13、酸性氧化物+碱→盐+水14、酸+盐→新酸+新盐15、碱+盐→新碱+新盐16、金属+酸→盐+ H217、金属+盐溶液→新金属+新盐溶液1、一定条件下,下列物质的转化均可一步实现的是()A.CaCl2→CaCO3→Ca(OH)2 B. AgNO3→Fe(NO3)2→Zn(NO3)2C. NaNO3→NaOH→Na2CO3D. Fe2O3→FeSO4→Fe(OH)32、下列物质间的转化,在一定条件下均能一步实现的是①C→CO→CO2 ②Cu→CuO→CuSO4 ③Na2CO3→NaCl→NaNO3 ④CaCO3→CaO→Ca(OH)2 A.①②③B.①③④C.①②④ D.①②③④3、下列物之间的转化,能通过一步反应实现的是( )①C2H5OH→CO2②CaO→Ca(OH)2③H2O2→H2O④HNO3→HCl⑤Fe3O4→Fe A.①②③④ B.①②③⑤ C.①③④⑤ D.②③④⑤4、下列物质间的每一转化不能..都通过一步反应实现的是()A.CuO→Cu→CuO B.NaOH→H2O→NaOH C.O2→Fe3O4→O2D.Fe→FeCl2→Fe5、下列物质间的每一转化不能都通过一步反应实现的是()A.Ca→CaO→CaCl2B.NaOH→Na2CO3→NaClC.O2→CuO→Cu(OH)2D.C→CO2→Na2CO36、下列转化能一步完成的()① CH4→CO2 ②HNO3→HCl ③CaO→Ca(OH)2 ④Ba(OH)2→NaOH ⑤C→CuA.①③④⑤ B.②③④⑤ C.①②④⑤ D.①②③④7、下列转化能一步完成的是()①CaCO3→CO2②HCl→NaCl③CaO→Ca(OH)2④Ca(OH)2→NaOH⑤CuO→Cu.A.①②③④⑤B.②③④⑤C.①②④⑤D.①②③④8、下列转化能一步完成的是()①Ba(OH)2→NaOH②CuO→Cu(OH)2 ③HNO3→HCl④SO2→Na2SO3.A.①④ B.②③ C.③④ D.只有④9、下列物质之间的转化能够实现的是()10、下列物质间的转化关系正确的是()A.①②B.②③ C.①③ D.①②③【类型2】1、现有Fe、CuO、MgCl2、Ca(OH)2、稀H2SO4等五种物质,在常温下它们两两相互发生的化学反应有()A.7个B.6个C.5个D.4个2、现有氧化铁、稀硫酸、氢氧化钠溶液、氯化钡溶液和碳酸钾溶液五种物质,在常温下它们两两相互发生的化学反应有()A.4个B.5个C.6个D.7个3、现有Zn、Fe2O3、MgCl2、Cu(OH)2、稀H2SO4等五种物质,在常温下它们两两相互发生的化学反应有()A.3个B.4个C.5个D.6个4、对于化学反应X + Na2CO3 == 2Y+ CaCO3↓的分析错误的是()A.该反应属于复分解反应B.Y中一定含有钠元素C.X一定是熟石灰D.X中阴离子化合价是—1价5、对于复分解反应:X+2NaOH2Y+Cu(OH)2↓,下列分析中正确的是()A.X一定是CuCl2B.相对分子质量大小:X>Y C.Y可能是H2O D.Y可能是Na2SO4【类型3】1、下列各组变化中,每一转化在一定条件下均能一步实现的是()A.①和② B.②和③ C.①和③ D.①②③2、下列各组物质间通过一步反应就能实现如图所示的转化,则甲、乙、丙可能分别是()A.NaOH、NaCl、NaNO3B.CO、CO2、H2 CO3C.CaO、Ca(OH)2、CaCO3D.H2O2、H2O、O23、(2013•徐州一模)下列各组中物质间的转化不都是通过一步反应实现的是()4、下列各组物质间通过一步反应就能实现如右图转化,则甲、乙、丙可能是()A.KOH KCl KNO3B.CuO CuCl2Cu(OH)2C.C CO2COD.H2O2H2O O25、(2014·宿迁)下列物质的三角转化关系中都能按箭头方向一步实现的是( )A.① B.①② C.①②③ D.②③6、下列各组转化中,一定条件下均能一步实现的组合是()A.①②B.②③C.①③D.①②③专题3 八圈图及物质的转化2【类型3】7、下列有关说法正确的是( ) A .实现CO CO 2的相互转化,都只有一种途径B .Al 可以实现单质氧化物碱C .实现C CO 的转化,都利用了碳的可燃性D .实现H 2OO 2相互转化,化学反应的基本类型不同8、比较归纳是化学学习中常用的一种方法.以下是C 、CH 4、CO 三种物质转化为CO 2的转化关系,即:①C→CO 2②CH 4→CO 2③CO→CO 2,对它们的比较归纳正确的是( )A .三种转化发生的都是化合反应B .三种物质都只能跟氧气反应转化为二氧化碳C .三种物质都可以在点燃条件下转化为二氧化碳D .三种转化所有的生成物在常温下都是气体 9、(2014黄冈市)已知甲、乙、丙、丁是初中化学中的四种常见物质,丁是甲与乙、乙与丙反应的生成物之一(反应条件均已略去),转化关系如图:(1)常温下,若乙为红色粉末,甲为黑色粉末,则丙的化学式是______,甲与乙反应的化学方程式为______。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初三化学八圈图
Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】
无机反应关系八圈图的用途 对于书写化学方程式来说,将物质分为七类为好:金属、非金属、碱性氧化物、酸性氧化物、碱、酸、盐。
因此,无机物即单质、氧化物和碱、酸、盐的相互关系图,一般把它叫做“八圈图”。
表物质反应的相互关系表
物质的相互关系即是物质的性质,即反应规律,要牢固掌握!!
无机物的相互关系表即八圈图有以下五个用途:
1表示物质间的纵横衍变关系,如从金属或非金属如何衍变成盐;
例1:完成下列反应:
①MgMgOMgCl 2Mg(OH)2MgSO 4
②CCO 2CaCO 3Ca(HCO 3)2CaCO 3CO 2
2表示16个基本反应规律;
⑴金属+氧气碱性氧化物
⑵碱性氧化物+水碱 ⑶非金属+氧气酸性氧化物
⑷酸性氧化物+水含氧酸
⑸金属+非金属无氧酸盐
⑹酸性氧化物+碱性氧化物含氧酸盐
⑺非金属+氢气酸
⑻金属+酸盐+氢气
⑼金属+盐盐+金属
⑽非金属+盐盐+非金属
⑾酸+碱性氧化物盐+水
⑿酸+碱盐+水
⒀碱+盐盐+碱
⒁酸+盐盐+酸
⒂盐+盐盐+盐 ⒃碱+酸性氧化物盐+水
3表示物质的性质;
例如,除了跟指示剂反应的这一性质在图中无法表示外,图中酸的没有打箭头的4根线表示的就是酸的性质:酸与碱作用生成盐和水,酸与碱性氧化物反应生成盐和水,酸与活泼金属反应生成盐和氢气,酸与盐反应生成新盐和新酸;图中碱的没有打箭号的3根线表示的就是碱的性质:碱与酸反应生成盐和水,碱与酸性氧化物反应生成盐和水,碱与盐反应生成新盐和新碱。
盐有4根
没打箭头的线表示了盐的4种性质:盐与酸反应生成新盐和新酸,盐与碱反应生成新盐和新碱,盐与盐反应生成两种新盐,盐与非金属反应生成一种新盐和一种新非金属。
4表示基本反应类型:①—⑦表示化合反应;⑧—⑩表示置换反应;—表示复分解反应;化合反应能逆向进行的就是分解反应;
5表示物质(特别是盐)的制法。
盐是无机物相互关系图中的大动脉,很多反应都可以制取盐。
例2:写出能生成ZnCl 2的六种化学反应方程式。
解析:很多学生在解此题时,存在的问题有两个,一是思维无绪,解题无据,不知道本题应按照八圈图从左到右地去考虑,而是想到一种写一种;二是把题目中的六种当成六个化学方程式来写。
实际上,六种反应写出的化学方程式肯定不只六个。
例3:试举一个无机物例子以实现下列变化,并写出各步化学方程式。
解析:本题实质上是考八圈图,穿其中的大动脉是盐。
可举NaCl 、
CaCO 3等。
在中学化学中,八圈图不能包括的其它反应规律还有:
①碳酸(氢)盐的分解
②碳酸(氢)盐+酸
③铜与浓、稀硝酸、浓硫酸的反应
④硝酸盐的分解
⑤铵盐与碱反应
⑥不溶性碱的热分解
⑦酸式盐与正盐的互变规律
⑧盐类水解规律
⑨非金属与强碱溶液生成两种盐与水
例4:从铜怎样制取氢氧化铜?
解析:有的人会写出如下化学方程式:2Cu +O 2
2CuO ,CuO +H 2O =CuOH 2,显然后一个化学方程式错了,这也是学生常犯的错误。
正确的是:CuO +2HCl =CuCl 2+H 2O ,CuCl 2+2NaOH =2NaCl +CuOH 2。
为什么按照反应规律写出的化学方程式不正确呢,这是因为反应规律不是绝对的,很多反应规律都有条件限制。
(1)强强易,弱弱难,不强不弱居中间。
①酸+碱
②氧化剂+还原剂
③酸+碱性氧化物
④碱+酸性氧化物
⑤酸性氧化物+碱性氧化物
⑥金属+非金属
(2)溶易,不溶难。
①碱性氧化物+水
②酸性氧化物+水
(3)弱弱易、强强难。
①盐类水解
②非金属+非金属
(4)复分解反应
酸、碱强度不太弱,中和成水能发生。
两个界线:Al(OH)3+H 2CO 3≠,H 3AlO 3+NH 3·H 2O ≠。
酸盐反应酸要溶,强代弱来稳代分;难挥发代易挥发,盐若沉淀也发生。
例外:CuSO 4+H 2S =CuS +H 2SO 4
AgCl +HNO 3≠,BaSO 4+HNO 3≠,BaSO 4+HCl ≠,
盐盐、盐碱皆要溶,生成沉淀才发生。
盐(溶)+碱(溶)=盐+碱,或:盐(溶)+碱(溶)=盐+碱 盐(溶)+盐(溶)=盐+盐
5置换反应溶或熔,活动顺序强代弱。
下面问题可供练习:
问题:怎样实现下列反应(要求各举一例),写出有关化学方程式。
①由可溶性的盐制不溶性的碱
②由不溶性的碱制可溶性的盐
③由不挥发性的酸制备挥发性的酸
④由稳定性的酸制备不稳定性的酸
⑤由强酸制弱酸
⑥由可溶性碱制备不溶性碱
⑦由强碱制弱碱。
