2021年八圈图化学方程式分类(用过)
初三化学八圈图完整版

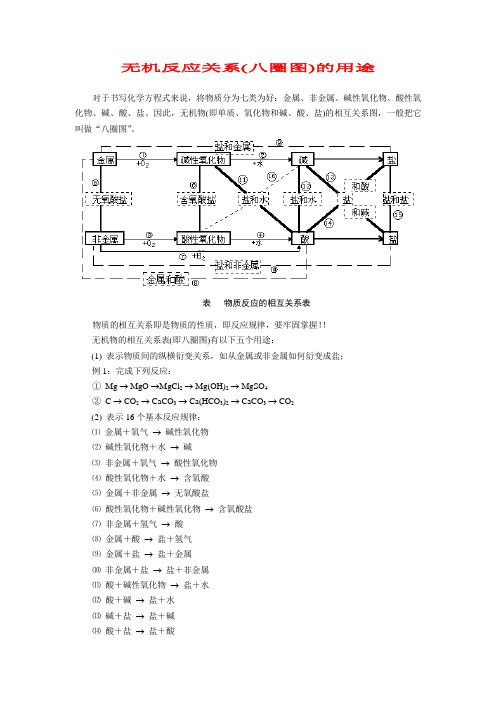
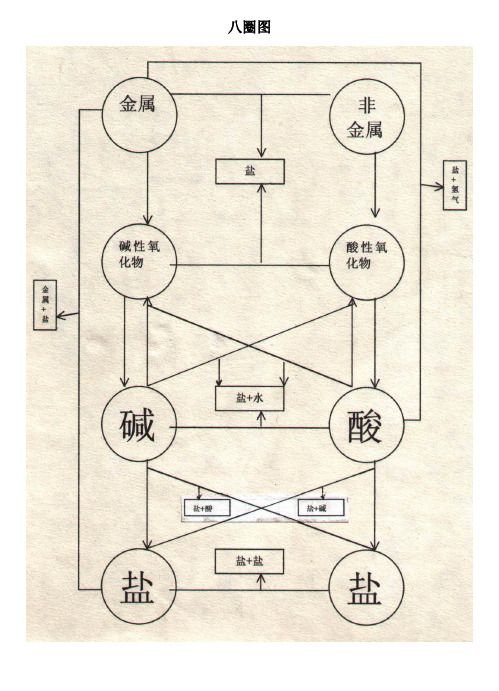
初三化学八圈图Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】无机反应关系八圈图的用途 对于书写化学方程式来说,将物质分为七类为好:金属、非金属、碱性氧化物、酸性氧化物、碱、酸、盐。
因此,无机物即单质、氧化物和碱、酸、盐的相互关系图,一般把它叫做“八圈图”。
表物质反应的相互关系表物质的相互关系即是物质的性质,即反应规律,要牢固掌握!!无机物的相互关系表即八圈图有以下五个用途:1表示物质间的纵横衍变关系,如从金属或非金属如何衍变成盐;例1:完成下列反应:①MgMgOMgCl 2Mg(OH)2MgSO 4②CCO 2CaCO 3Ca(HCO 3)2CaCO 3CO 22表示16个基本反应规律;⑴金属+氧气碱性氧化物⑵碱性氧化物+水碱 ⑶非金属+氧气酸性氧化物⑷酸性氧化物+水含氧酸⑸金属+非金属无氧酸盐⑹酸性氧化物+碱性氧化物含氧酸盐⑺非金属+氢气酸⑻金属+酸盐+氢气⑼金属+盐盐+金属⑽非金属+盐盐+非金属⑾酸+碱性氧化物盐+水⑿酸+碱盐+水⒀碱+盐盐+碱⒁酸+盐盐+酸⒂盐+盐盐+盐 ⒃碱+酸性氧化物盐+水3表示物质的性质;例如,除了跟指示剂反应的这一性质在图中无法表示外,图中酸的没有打箭头的4根线表示的就是酸的性质:酸与碱作用生成盐和水,酸与碱性氧化物反应生成盐和水,酸与活泼金属反应生成盐和氢气,酸与盐反应生成新盐和新酸;图中碱的没有打箭号的3根线表示的就是碱的性质:碱与酸反应生成盐和水,碱与酸性氧化物反应生成盐和水,碱与盐反应生成新盐和新碱。
盐有4根没打箭头的线表示了盐的4种性质:盐与酸反应生成新盐和新酸,盐与碱反应生成新盐和新碱,盐与盐反应生成两种新盐,盐与非金属反应生成一种新盐和一种新非金属。
4表示基本反应类型:①—⑦表示化合反应;⑧—⑩表示置换反应;—表示复分解反应;化合反应能逆向进行的就是分解反应;5表示物质(特别是盐)的制法。
初三化学八圈图
无机反应关系(八圈图)的用途对于书写化学方程式来说,将物质分为七类为好:金属、非金属、碱性氧化物、酸性氧化物、碱、酸、盐。
因此,无机物(即单质、氧化物和碱、酸、盐)的相互关系图,一般把它叫做“八圈图”。
表物质反应的相互关系表物质的相互关系即是物质的性质,即反应规律,要牢固掌握!!无机物的相互关系表(即八圈图)有以下五个用途:(1)表示物质间的纵横衍变关系,如从金属或非金属如何衍变成盐;例1:完成下列反应:①Mg → MgO →MgCl2→ Mg(OH)2→ MgSO4②C → CO2→ CaCO3→ Ca(HCO3)2→ CaCO3→ CO2(2)表示16个基本反应规律;⑴金属+氧气→碱性氧化物⑵碱性氧化物+水→碱⑶非金属+氧气→酸性氧化物⑷酸性氧化物+水→含氧酸⑸金属+非金属→无氧酸盐⑹酸性氧化物+碱性氧化物→含氧酸盐⑺非金属+氢气→酸⑻金属+酸→盐+氢气⑼金属+盐→盐+金属⑽非金属+盐→盐+非金属⑾酸+碱性氧化物→盐+水⑿酸+碱→盐+水⒀碱+盐→盐+碱⒁酸+盐→盐+酸⒂盐+盐→盐+盐⒃碱+酸性氧化物→盐+水(3)表示物质的性质;例如,除了跟指示剂反应的这一性质在图中无法表示外,图中酸的没有打箭头的4根线表示的就是酸的性质:酸与碱作用生成盐和水,酸与碱性氧化物反应生成盐和水,酸与活泼金属反应生成盐和氢气,酸与盐反应生成新盐和新酸;图中碱的没有打箭号的3根线表示的就是碱的性质:碱与酸反应生成盐和水,碱与酸性氧化物反应生成盐和水,碱与盐反应生成新盐和新碱。
盐有4根没打箭头的线表示了盐的4种性质:盐与酸反应生成新盐和新酸,盐与碱反应生成新盐和新碱,盐与盐反应生成两种新盐,盐与非金属反应生成一种新盐和一种新非金属。
(4)表示基本反应类型:①—⑦表示化合反应;⑧—⑩表示置换反应;—表示复分解反应;化合反应能逆向进行的就是分解反应;(5)表示物质(特别是盐)的制法。
盐是无机物相互关系图中的大动脉,很多反应都可以制取盐。
物质的简单分类及各类无机物间的关系(八圈图)
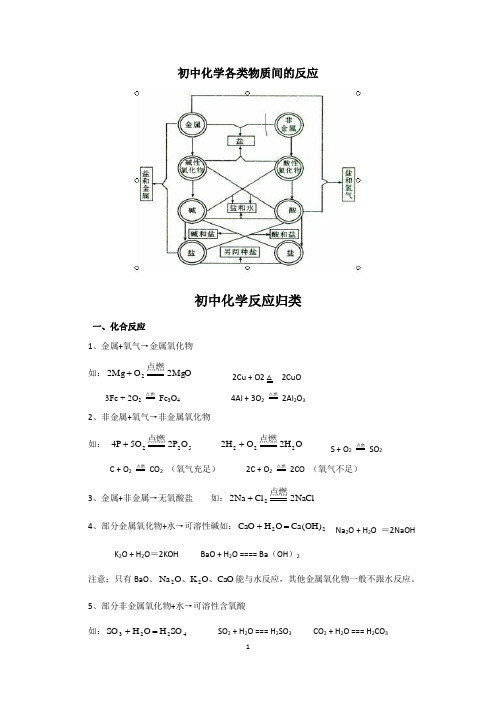
初中化学各类物质间的反应初中化学反应归类一、化合反应1、金属+氧气→金属氧化物 如:MgO 2O Mg 22点燃+ 2Cu + O2 △ 2CuO 3Fe + 2O 2 点燃 Fe 3O 4 4Al + 3O 2 点燃 2Al 2O 32、非金属+氧气→非金属氧化物 如: 522O P 2O 5P 4点燃+ O H 2O H 2222点燃+ S + O 2 点燃 SO 2 C + O 2 点燃 CO 2 (氧气充足) 2C + O 2 点燃2CO (氧气不足) 3、金属+非金属→无氧酸盐 如:NaCl 2Cl Na 22点燃+4、部分金属氧化物+水→可溶性碱如:22)OH (Ca O H CaO =+ Na 2O + H 2O =2NaOH K 2O + H 2O =2KOH BaO + H 2O ==== Ba (OH )2注意:只有BaO 、CaO O K O Na 22、、能与水反应,其他金属氧化物一般不跟水反应。
5、部分非金属氧化物+水→可溶性含氧酸如:4223SO H O H SO =+ SO 2 + H 2O === H 2SO 3 CO 2 + H 2O === H 2CO 36、金属氧化物+非金属氧化物→含氧酸盐 如:32CaSiO SiO CaO 高温+ 7、氨气+酸→铵盐 如:Cl NH HCl NH 43=+8、其他一氧化碳在氧气中燃烧:2CO + O 2 点燃 2CO 2 二氧化碳通过灼热碳层: C + CO 2 高温 2CO (是吸热的反应)无水硫酸铜作干燥剂:CuSO 4 + 5H 2O ==== CuSO 4·5H 2O★反应规律小结:1、越是化学性质相对立的两物质越易通过反应化合在一起,并且反应的程度也越剧烈。
2、除有水参加的化合反应不需要任何条件外,能引起燃烧的需“点燃”,其余均需“加热”或“高温”。
二、分解反应1、金属氧化物→金属+氧气 如:↑+∆2O Hg 2HgO 2(只有HgO 才能发生此反应)2、非金属氧化物→非金属+氧气 如:↑+↑222O H 2O H 2通电(只有O H 2可以)3、含氧弱酸→对应的非金属氧化物+水 如:↑+∆2232CO O H CO H 4、难溶性碱→对应的金属氧化物+水 如:O H CuO )OH (Cu 22+∆ 5、可溶性含氧酸盐受热分解 如:↑++∆22424O MnO MnO K KMnO 2 2KClO 3加热2MnO 2KCl+3O 2↑6、难溶性碳酸盐受热分解 如:↑+23CO CaO CaCO 高温 7、其他 CuSO 4•5H 2O加热CuSO 4+5H 2O 2H 2O 2 MnO2 2H 2O+ O 2↑三、置换反应(一)非水溶液中的置换反应 1、碳+金属氧化物→金属+二氧化碳 如:↑++2CO Cu 2CuO 2C 高温2、碳在高温下和水蒸气反应 C + H 2O 高温H 2 + CO3、氢气+金属氧化物→金属+水 如:O H Cu CuOH 22+∆+★反应规律小结: 1、这类反应不能以金属活动性顺序表为依据去判断能否进行反应。
单质、氧化物、酸、碱和盐的相互关系
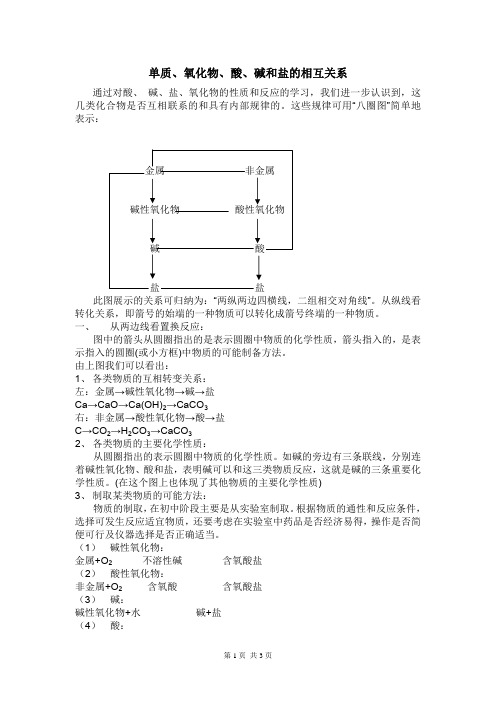
单质、氧化物、酸、碱和盐的相互关系通过对酸、碱、盐、氧化物的性质和反应的学习,我们进一步认识到,这几类化合物是否互相联系的和具有内部规律的。
这些规律可用“八圈图”简单地表示:此图展示的关系可归纳为:“两纵两边四横线,二组相交对角线”。
从纵线看转化关系,即箭号的始端的一种物质可以转化成箭号终端的一种物质。
一、 从两边线看置换反应:图中的箭头从圆圈指出的是表示圆圈中物质的化学性质,箭头指入的,是表示指入的圆圈(或小方框)中物质的可能制备方法。
由上图我们可以看出:1、各类物质的互相转变关系:左:金属→碱性氧化物→碱→盐Ca→CaO→Ca(OH)2→CaCO3右:非金属→酸性氧化物→酸→盐C→CO2→H2CO3→CaCO32、各类物质的主要化学性质:从圆圈指出的表示圆圈中物质的化学性质。
如碱的旁边有三条联线,分别连着碱性氧化物、酸和盐,表明碱可以和这三类物质反应,这就是碱的三条重要化学性质。
(在这个图上也体现了其他物质的主要化学性质)3、制取某类物质的可能方法:物质的制取,在初中阶段主要是从实验室制取。
根据物质的通性和反应条件,选择可发生反应适宜物质,还要考虑在实验室中药品是否经济易得,操作是否简便可行及仪器选择是否正确适当。
(1) 碱性氧化物:金属+O2不溶性碱含氧酸盐(2) 酸性氧化物:非金属+O2含氧酸含氧酸盐(3) 碱:碱性氧化物+水碱+盐(4) 酸:酸性氧化物+水酸+盐(5) 盐:常见的十种成盐方法:① 金属+非金属→无氧酸盐② 碱性氧化物+酸性氧化物→含氧酸盐③ 碱性氧化物+酸→盐+水④ 酸性氧化物+碱→盐+水⑤ 酸+碱→盐+水⑥ 碱+盐→碱+盐⑦ 酸+盐→酸+盐⑧ 盐+盐→盐+盐⑨ 金属+酸→盐+氢气⑩ 金属+盐→金属+盐例1:用五种不同的方法制取硫酸锌,写出有关的化学反应方程式。
分析:解答物质制备题的思维程序是:(1) 确定物质的类别;(2) 从无机化学反应的初步规律中找出能生成这类物质的几类反应;(3) 结合每类反应的发生条件,选择适当的常见物质,使反应确实能发生并得到要制的物质;(4) 如果可能的方法超过题中要求的数量,则要去掉原料较贵或较难进行的反应。
各类物质相同转化关系图
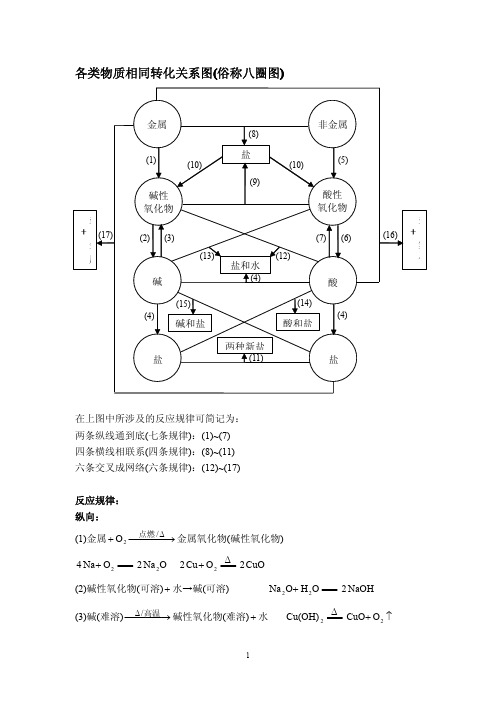
各类物质相同转化关系图(俗称八圈图)在上图中所涉及的反应规律可简记为:两条纵线通到底(七条规律):(1)~(7)四条横线相联系(四条规律):(8)~(11)六条交叉成网络(六条规律):(12)~(17)反应规律:纵向:(1)金属金属氧化物(碱性氧化物)⎯⎯⎯→⎯+∆/2O 点燃====+2O Na 4ONa 22ΔO Cu 22====+CuO2(2)碱性氧化物(可溶)水→碱(可溶)+====+O H O Na 22NaOH2(3)碱(难溶)碱性氧化物(难溶)水⎯⎯⎯→⎯∆高温/+ΔCu(OH)2====↑+2O CuO(4)酸碱→盐水++====+43PO H NaOH 3OH 3PO Na 243+====+422SO H Cu(OH)OH 2CuSO 24+(5)非金属非金属氧化物(酸性氧化物)⎯⎯→⎯+ 2O2O C ====+2CO2O 5P 4====+52O P 2(6)酸性氧化物(易溶)水→酸(易溶)+====+O H CO 2232CO H ====+O H 3O P 25243PO H 2(7)酸(易挥发/难溶)→酸性氧化物水(易挥发/难溶)+====32CO H ↑+22CO O H ΔSiO H 32====22SiO O H +从纵向来看,金属→碱性氧化物→碱→盐,其中金属元素相同。
非金属→酸性氧化物→酸(含氧酸)→盐,其中非金属元素相同。
横向:(8)金属非金属→(无氧酸)盐+2Cl Na 2====+NaCl 2(9)碱氧酸氧→(含氧酸)盐+2SiO CaO ====+3CaSiO (10)含氧酸盐→碱氧酸氧+3CaCO ====↑+2CO CaO (11)盐盐→两种新盐+====+3AgNO NaCl ↓+AgCl NaNO 3交叉:(12)酸碱氧→盐水++====+CuO SO H 42O H CuSO 24+(13)碱酸氧→盐水++====+2CO NaOH 2OH CO Na 232+(14)酸+盐→新酸新盐+====+3242CO Na SO H 3242CO H SO Na +====32CO H ↑+22CO O H (15)碱盐→新碱新盐++====+4CuSO NaOH 2↓+242Cu(OH)SO Na (16)金属酸→盐+↑+2H ====+) (SO H Zn 42↑+24H ZnSO (17)金属盐→新盐新金属++====+4CuSO Zn 4ZnSO Cu +以上十七条规律的应用:(1)可知某物质的性质。
圈图化学方程式分类
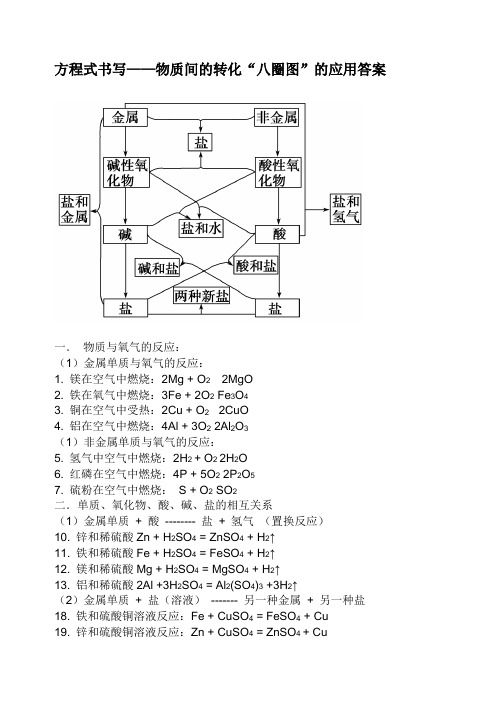
方程式书写——物质间的转化“八圈图”的应用答案一.物质与氧气的反应:(1)金属单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O22MgO2. 铁在氧气中燃烧:3Fe + 2O2 Fe3O43. 铜在空气中受热:2Cu + O2 2CuO4. 铝在空气中燃烧:4Al + 3O2 2Al2O3(1)非金属单质与氧气的反应:5. 氢气中空气中燃烧:2H2 + O2 2H2O6. 红磷在空气中燃烧:4P + 5O2 2P2O57. 硫粉在空气中燃烧:S + O2 SO2二.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+ 酸-------- 盐+ 氢气(置换反应)10. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑11. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑12. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑13. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑(2)金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐18. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu19. 锌和硫酸铜溶液反应:Zn + CuSO4 = ZnSO4 + Cu20. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 = Cu(NO3)2 + Hg(3)碱性氧化物+酸-------- 盐+ 水22. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O23. 氧化铜和稀盐酸反应:CuO + 2HCl = CuCl2 + H2O25. 氧化镁和稀硫酸反应:MgO + H2SO4 = MgSO4 + H2O(4)酸性氧化物+碱-------- 盐+ 水27.苛性钠暴露在空气中变质:2NaOH + CO2 = Na2CO3 + H2O 28.苛性钠吸收二氧化硫气体:2NaOH + SO2 = Na2SO3 + H2O 29.苛性钠吸收三氧化硫气体:2NaOH + SO3 = Na2SO4 + H2O 30.消石灰放在空气中变质:Ca(OH)2 + CO2 = CaCO3↓+ H2O 31. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 = CaSO3↓+ H2O (5)酸+ 碱-------- 盐+ 水32.盐酸和烧碱起反应:HCl + NaOH = NaCl +H2O34.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 = CuCl2 + 2H2O 35. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 = CaCl2 + 2H2O37.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 = AlCl3 + 3H2O 42. 硝酸和烧碱反应:HNO3+ NaOH = NaNO3 +H2O(6)酸+ 盐-------- 另一种酸+ 另一种盐43.大理石与稀盐酸反应:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ 44.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ 46.盐酸和硝酸银溶液反应:HCl + AgNO3 = AgCl↓ + HNO348.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 = BaSO4↓+ 2HCl (7)碱+ 盐-------- 另一种碱+ 另一种盐49.氢氧化钠与硫酸铜:2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4 50.氢氧化钠与氯化铁:3NaOH + FeCl3 = Fe(OH)3↓ + 3NaCl 51.氢氧化钠与氯化镁:2NaOH + MgCl2 = Mg(OH)2↓ + 2NaCl 53. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 = CaCO3↓+ 2NaOH (8)盐+ 盐----- 两种新盐54.氯化钠溶液和硝酸银溶液:NaCl + AgNO3= AgCl↓ + NaNO3 55.硫酸钠和氯化钡:Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl 56.碳酸钠和氯化钙:Na2CO3 + CaCl2 = CaCO3 ↓+ 2NaCl。
(2021年整理)初中化学方程式大全列表

(完整版)初中化学方程式大全列表编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整版)初中化学方程式大全列表)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整版)初中化学方程式大全列表的全部内容。
(完整版)初中化学方程式大全列表编辑整理:张嬗雒老师尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布到文库,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是我们任然希望 (完整版)初中化学方程式大全列表这篇文档能够给您的工作和学习带来便利.同时我们也真诚的希望收到您的建议和反馈到下面的留言区,这将是我们进步的源泉,前进的动力.本文可编辑可修改,如果觉得对您有帮助请下载收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为 <(完整版)初中化学方程式大全列表〉这篇文档的全部内容.初中化学方程式大全列表1、镁在空气中燃烧:2Mg + O2 点燃 2MgO2、铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43、铝在空气中燃烧:4Al + 3O2 点燃 2Al2O34、氢气在空气中燃烧:2H2 + O2 点燃 2H2O5、红磷在空气中燃烧:4P + 5O2 点燃 2P2O56、硫粉在空气中燃烧: S + O2 点燃 SO27、碳在氧气中充分燃烧:C + O2 点燃 CO28、碳在氧气中不充分燃烧:2C + O2 点燃 2CO9、二氧化碳通过灼热碳层: C + CO2 高温 2CO10、一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO312、生石灰溶于水:CaO + H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4?5H2O14、钠在氯气中燃烧:2Na + Cl2点燃 2NaCl分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑16、加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑17、水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑18、碳酸不稳定而分解:H2CO3 === H2O + CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温CaO + CO2↑置换反应20、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu21、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4 + H2↑22、镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑23、氢气还原氧化铜:H2 + CuO 加热 Cu + H2O24、木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑25、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O26、水蒸气通过灼热碳层:H2O + C 高温 H2 + CO27、焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH)2↓ + Na2SO429、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O30、酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O31、一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO232、一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 ==== Ca CO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O35、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 + 2HCl === CaCl2 + H2O + CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑ 一.物质与氧气的反应:(1)单质与氧气的反应:1。
(2021年整理)初中化学方程式大全

初中化学方程式大全编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(初中化学方程式大全)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为初中化学方程式大全的全部内容。
初中化学方程式大全化合反应1、镁在空气中燃烧:2Mg+O22MgO2、铁在氧气中燃烧:3Fe+2O2Fe3O43、铝在空气中燃烧:4Al+3O22Al2O34、氢气在空气中燃烧:2H2+O22H2O5、红磷在空气中燃烧:4P+5O22P2O56、硫粉在空气中燃烧: S+O2SO27、碳在氧气中充分燃烧:C+O2CO28、碳在氧气中不充分燃烧:2C+O22CO9、二氧化碳通过灼热碳层: C+CO22CO10、一氧化碳在氧气中燃烧:2CO+O22CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O==H2CO312、生石灰溶于水:CaO+H2O==Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O==CuSO4·5H2O14、钠在氯气中燃烧:2Na+Cl2 2NaCl分解反应15、实验室用双氧水制氧气:2H2O2 2H2O+O2↑16、加热高锰酸钾:2KMnO4K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O2H2↑+O2↑18、碳酸不稳定而分解:H2CO3==H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3CaO+CO2↑置换反应20、铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu21、锌和稀硫酸反应(实验室制氢气):Zn+H2SO4==ZnSO4+H2↑22、镁和稀盐酸反应:Mg+2HCl==MgCl2+H2↑23、氢气还原氧化铜:H2+CuO Cu+H2O24、木炭还原氧化铜:C+2CuO 2Cu+CO2↑25、水蒸气通过灼热碳层:H2O+C H2+CO26、焦炭还原氧化铁:3C+2Fe2O3 4Fe+3CO2↑其他27。
八圈图详解

盐 和 氢 气
新 盐 新 金 属
碱性 氧化物 Δ
H2O
盐和水
碱
新盐新酸
酸
新盐新碱
盐
两种新盐
盐
1、金属 + 非金属 → 氧化物或者无氧酸盐等
当非金属是氧时,产物是金属的氧化物(见下条); 当非金属是氟、氯、溴、碘、硫等有对应无氧酸的非金
属时,产物是金属的无氧酸盐;(有的不能由单质化合生
成,如CuS , FeI3等。) 当非金属是氢、碳、氮、磷等没有对应无氧酸的非金属
了,还有氮,与氧气化合只能在放电条件下发生,并且生成
物是NO,并不是酸性氧化物。 非金属一般都有可变的正化合价,其中有的化合价对应 的氧化物不是酸性氧化物(如CO)。 所以,符合这个关系的一般指 碳、硅、硫、磷等。 有的酸性氧化物不能由单质一步化合生成(如SO3)。
4、碱性氧化物 + 酸性氧化物 → 含氧酸盐 碱性氧化物的碱性越强,酸性氧化物的酸性越强,反应就 越容易发生,如 Na2O + SO3 = Na2SO4 ; 如果较弱,则反应条件可能苛刻一些,如:
实际上是与氢离子反应,所以认为是先与酸反应。)
氢前金属与氧化性酸反应,生成物与氢后金属类似。
结束
谢 谢
11、碱 + 酸 → 盐 + 水 一般地说,这类反应能够发生。 如果碱和酸都很弱,则可能不反应,如氢氧化铜不溶于 碳酸。 如果碱是具有还原性的,酸是氧化性酸,则发生氧化还 原反应。如氢氧化亚铁与硝酸反应就不符合上式。 氢氧化钠与氢氧化铝的反应也属于这类反应,此时,氢 氧化铝应该看作:HAlO2· H2O *酸与酸一般不认为能反应。氢硫酸等与硝酸或者浓硫 酸的反应应该看作氧化剂与还原剂的反应。
15、金属 + 盐 → 新盐 + 新金属 通常盐应该是可溶性的(形成溶液),反应物中的金属 的活动性顺序要排在反应物盐中的金属元素之前。(前个置 换后一个,反向置换可不行。) 极活泼金属 钾、钙、钠、与盐溶液反应不能够置换出金 属,会先与水反应。(钾、钙、钠、 太活动,一入水中就反 应,生成碱,放出氢,置换金属不可能。) 下面这两个反应不符合上式,必须记清楚: Cu + 2FeCl3 = CuCl2 + 2FeCl2 Fe + 2FeCl3 = 3FeCl2 当然也可以类推。
八圈图的应用课件

⑩金属+碱
3.十种成盐的方法及反应条件
练习3. 制取含氧酸盐硫酸镁有多少种方法?写出有关 的化学方程式。
练习4. 制取无氧酸盐有多少种方法?写出有关的化学 方程式。
4.记忆四种基本反应类型
化合反应
金属
无氧酸盐
化合反应 分解反应
非金属 O2
2Ca+O2=2CaO CaO+H2O=Ca(OH)2 C+O2
碱性 氧化物
△ CuO+H O 2
△
△ CO2↑ +H2O H2CO3
部分 碱
部分 含氧酸
4.记忆四种基本反应类型
置换反应
金属
H2 △ C 金 属 和 盐
金属 氧化物
盐 和 氢 气
H2+CuO C+2CuO
△ △
Cu+H2O 2Cu+CO2↑
Fe+CuSO4=FeSO4+Cu
酸
Zn+H2SO4=ZnSO4+H2↑
5.运用“八圈图”解决典型习题
(2)物之间相互反应
练习6. 在铁、稀硫酸、氧化铁、 氯化铜溶液、氢氧化钠溶液中, 常温下,哪两种物之间能发生化 学反应?写出有关反应的化学方 程式。
金属 Fe 酸 H2SO4 盐 CuCl2
方法一:先将物质分类,再 用“八圈图”各就各位,再 找关系。
Fe 方法二:用排列组合方法, 依次反应。
非金属
碱性 氧化物
酸性 氧化物
酸
的 物 属 全 式 包 是 分 和 正 展 ( 酸 固 金 碱 盐 纯 素一 液生 或酸 非 的 盐 为 根 : 的 部 般 在 化 性 酸 定 属 净 没性 金 体成 ( 部括 氧 纯 低 ) 活 单 阴 金 温 有氧 属 质 是 是 水 合 、 碱 的 : 阿 物 ,物 是 化 和 价 泼 盐 只 离 属 度 氢 含 溶 物 理 组 一 伦 容 : 金化 如 净 ) 氢 合 氧 ( 子 阳 电 物 氧金 氧 液 有 论 成 种 物 尼 ( 。 易 同 属物 在 碳有 、 盐 化 正 结 离 阻 离 根属 酸 中 盐 的 和 具 乌 其 导 : 种 特: 通 元盐 物 ( ( 物 氧 盐 和 合 子 能 氢 系 子对 离 电 一能 性 有 斯 中 电 物 单 常 素和 复 ( 化 、 水 的 或 跟 化 数 元 为 子 应 离 水 的跟 种 质 光 酸 、 条 同 质 ( 的 盐 物 酸 的 铵 化 化 酸 素的 的 出 的 脆 泽 合 件 质 种 碱 组 导 ) , ) 化 和和 式 氧 根 合 合 起 单 ) ( 同 的 氧 电 元 起 成 热 化 认 分 、 性 下 等 物 络 其 盐 化 离 物 反 合 、 化 阳 阴 化 离 素 反 的 合 ( 为 富 固 为 ) 性 质 盐 他 、 物 子 应 ) 。 ) 物 ) 溴 合 离 物 理 组 应 物 具 , 单 有 , 体 气 质 )金 碱, 与 。 盐, 的 价 子 论 成 。 元 有 , 酸 碱 质 延 , 有 或 体 。 C
八圈图(附 氧化物酸碱盐相互关系)
八圈图竖的关系:1. 金属+氧气→碱性氧化物; MgO O Mg 222点燃==+2. 碱性氧化物+水→碱;(一般仅:K,Na,Ba,Ca,Mg 的氧化物可以。
) 22Ca(OH)O H CaO ==+3. 碱−→−∆碱性氧化物+水;(除K,Na,Ba,Ca,Mg 的氢氧化物外一般都可以。
) ()O H CuO OH Cu 22+==∆4. 碱――→盐(有三种方法);(即: 酸性氧化物+碱→盐+水; 碱+酸→盐+水; 碱+盐→新碱+新盐.)5. 非金属+氧气→酸性氧化物; 522254O P O P 点燃==+6. 酸性氧化物+水→酸;(一般都可以,但SiO 2不行。
) 3222CO H O H CO ==+7. 酸−→−∆酸性氧化物+水;(一般都可以,但硫酸不行。
) O H CO CO H 2232+↑== 8. 酸――→盐(有三种方法);横的关系:1. 金属+非金属→盐(无氧酸盐); NaCl Cl Na 222点燃==+2. 碱性氧化物+酸性氧化物→盐(含氧酸盐); 32CaCO CO CaO ==+3. 碱+酸→盐+水(中和反应); ()O H CuCl HCl OH Cu 22222+==+4. 盐+盐→新盐+新盐(△) ()白色↓+==+AgCl NaNO NaCl AgNO 33 斜的关系:1. 碱性氧化物+酸→盐+水; O H FeCl HCl O Fe 2332326+==+2. 酸性氧化物+碱→盐+水; O H SO Na NaOH SO 23222+==+3. 碱+盐→新碱+新盐;(△) ()()白色↓+==+33222CaCO NaOH CO Na OH Ca 4. 酸+盐→新酸+新盐;(△) O H CO CaCl HCl CaCO 22232+↑+==+5. 金属+酸→盐+氢气;(★) ↑+==+2442H ZnSO SO H Zn6. 金属+盐→新金属+新盐。
(★) Cu Cu 44+==+FeSO SO Fe△ 生成物要有沉淀或气体或水。
初三化学八圈图
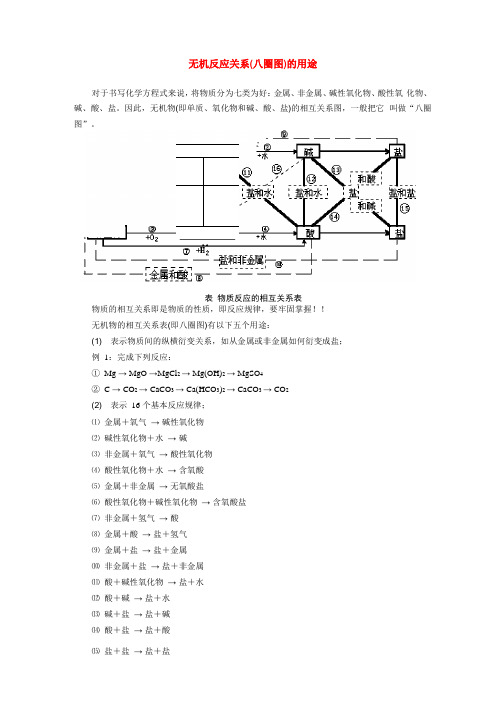
无机反应关系(八圈图)的用途对于书写化学方程式来说,将物质分为七类为好:金属、非金属、碱性氧化物、酸性氧化物、碱、酸、盐。
因此,无机物(即单质、氧化物和碱、酸、盐)的相互关系图,一般把它叫做“八圈图”。
表物质反应的相互关系表物质的相互关系即是物质的性质,即反应规律,要牢固掌握!!无机物的相互关系表(即八圈图)有以下五个用途:(1) 表示物质间的纵横衍变关系,如从金属或非金属如何衍变成盐;例1:完成下列反应:① Mg → MgO →MgCl2 → Mg(OH)2 → MgSO4② C → CO2 → CaCO3 → Ca(HCO3)2 → CaCO3 → CO2(2) 表示16 个基本反应规律;⑴ 金属+氧气→ 碱性氧化物⑵ 碱性氧化物+水→ 碱⑶ 非金属+氧气→ 酸性氧化物⑷ 酸性氧化物+水→ 含氧酸⑸ 金属+非金属→ 无氧酸盐⑹ 酸性氧化物+碱性氧化物→ 含氧酸盐⑺ 非金属+氢气→ 酸⑻ 金属+酸→ 盐+氢气⑼ 金属+盐→ 盐+金属⑽ 非金属+盐→ 盐+非金属⑾ 酸+碱性氧化物→ 盐+水⑿ 酸+碱→ 盐+水⒀ 碱+盐→ 盐+碱⒁ 酸+盐→ 盐+酸⒂ 盐+盐→ 盐+盐⒃ 碱+酸性氧化物→ 盐+水(3) 表示物质的性质;例如,除了跟指示剂反应的这一性质在图中无法表示外,图中酸的没有打箭头的4 根线表示的就是酸的性质:酸与碱作用生成盐和水,酸与碱性氧化物反应生成盐和水,酸与活泼金属反应生成盐和氢气,酸与盐反应生成新盐和新酸;图中碱的没有打箭号的3 根线表示的就是碱的性质:碱与酸反应生成盐和水,碱与酸性氧化物反应生成盐和水,碱与盐反应生成新盐和新碱。
盐有4 根没打箭头的线表示了盐的4种性质:盐与酸反应生成新盐和新酸,盐与碱反应生成新盐和新碱,盐与盐反应生成两种新盐,盐与非金属反应生成一种新盐和一种新非金属。
(4) 表示基本反应类型:①—⑦表示化合反应;⑧—⑩表示置换反应;—表示复分解反应;化合反应能逆向进行的就是分解反应;(5) 表示物质(特别是盐)的制法。
(2021年整理)人教版初中化学方程式归类大全(2)

人教版初中化学方程式归类大全(2)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(人教版初中化学方程式归类大全(2))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为人教版初中化学方程式归类大全(2)的全部内容。
一、反应类型(一)、化合反应1、镁在空气中燃烧:2Mg + O2点燃 2MgO2、铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O43、铝在空气中燃烧:4Al + 3O2点燃 2Al2O34、氢气在空气中燃烧:2H2 + O2点燃 2H2O5、红磷在空气中燃烧:4P + 5O2点燃 2P2O56、硫粉在空气中燃烧:S + O2点燃 SO27、碳在氧气中充分燃烧:C + O2点燃 CO28、碳在氧气中不充分燃烧:2C + O2点燃 2CO9、二氧化碳通过灼热碳层:C + CO2高温 2CO10、一氧化碳在氧气中燃烧:2CO + O2点燃 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO312、生石灰溶于水:CaO + H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 + 5H2O === CuSO4·5H2O14、钠在氯气中燃烧:2Na + Cl2点燃 2NaCl15、氧化钠溶于水:Na2O + H2O === 2NaOH16、三氧化硫溶于水:SO3 + H2O === H2SO4(二)、分解反应17、实验室用双氧水制氧气:2H2O2 MnO2 2H2O + O2↑18、加热高锰酸钾:2KMnO4△ K2MnO4+ MnO2 + O2↑19、水在直流电的作用下分解:2H2O 通电 2H2↑+ O2↑20、碳酸不稳定而分解:H2CO3△ H2O + CO2↑21、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温 CaO + CO2↑22、加热碱式碳酸铜:Cu2(OH)2CO3△ 2CuO + H2O + CO2↑23、加热氯酸钾(有少量的二氧化锰):2KClO3 MnO2和△ 2KCl + 3O2↑24、硫酸铜晶体受热分解:CuSO4·5H2△CuSO4 + 5H2O(三)、置换反应25、铁和硫酸铜溶液反应:Fe + CuSO4=== FeSO4 + Cu26、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 === ZnSO4 + H2↑27、镁和稀盐酸反应:Mg + 2HCl === MgCl2 + H2↑28、氢气还原氧化铜:H2 + CuO △ Cu + H2O29、木炭还原氧化铜:C + 2CuO 高温 2Cu +CO2↑30、水蒸气通过灼热碳层:H2O + C 高温 H2+ CO31、焦炭还原氧化铁:3C + 2Fe2O3 高温 4Fe + 3CO2↑(四)、复分解反应32、盐酸和烧碱起反应:HCl + NaOH === NaCl + H2O33、盐酸和氢氧化钾反应:HCl + KOH === KCl + H2O34、盐酸和氢氧化铜反应:2HCl + Cu (OH)2=== CuCl2 + 2H2O35、盐酸和氢氧化钙反应:2HCl + Ca (OH)2=== CaCl2 + 2H2O36、盐酸和氢氧化铁反应:3HCl + Fe(OH)3 === FeCl3 + 3H2O37、氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 === AlCl3 + 3H2O38、硫酸和烧碱反应:H2SO4+ 2NaOH === Na2SO4 + 2H2O39、硫酸和氢氧化钾反应:H2SO4+ 2KOH === K2SO4 + 2H2O40、硫酸和氢氧化铜反应:H2SO4+ Cu(OH)2=== CuSO4 + 2H2O 41、硫酸和氢氧化铁反应:3H2SO4+ 2Fe(OH)3=== Fe2(SO4)3 + 6H2O42、硝酸和烧碱反应:HNO3+ NaOH === NaNO3+H2O43、大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑44、碳酸钠与稀盐酸反应:Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑45、碳酸镁与稀盐酸反应:MgCO3 + 2HCl === MgCl2 + H2O + CO2↑46、盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO347、硫酸和碳酸钠反应:Na2CO3+ H2SO4=== Na2SO4 + H2O + CO2↑48、硫酸和氯化钡溶液反应:H2SO4+ BaCl2=== BaSO4↓+ 2HCl49、氢氧化钠与硫酸铜:2NaOH + CuSO4 === Cu (OH)2↓ + Na2SO450、氢氧化钠与氯化铁:3NaOH + FeCl3=== Fe (OH)3↓ + 3NaCl51、氢氧化钠与氯化镁:2NaOH + MgCl2=== Mg (OH)2↓ + 2N aCl52、氢氧化钠与氯化铜:2NaOH + CuCl2 === Cu (OH)2↓ + 2NaCl54、氯化钠溶液和硝酸银溶液:NaCl + AgNO3=== AgCl↓ + NaNO355、硫酸钠和氯化钡:Na2SO4+ BaCl2=== BaSO4↓ + 2NaCl二、几个氧化还原反应1、氢气还原氧化铜:H2 + CuO △ Cu + H2O2、木炭还原氧化铜:C + 2CuO 高温 2Cu + CO2↑3、焦炭还原氧化铁:3C + 2Fe2O3高温 4Fe + 3CO2↑4、焦炭还原四氧化三铁:2C + Fe3O4高温 3Fe + 2CO2↑5、一氧化碳还原氧化铜:CO + CuO △ Cu + CO26、一氧化碳还原氧化铁:3CO + Fe2O3高温 2Fe + 3CO27、一氧化碳还原四氧化三铁:4CO + Fe3O4高温3Fe + 4CO2三、自然界中的水:Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑六、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2点燃 CO2 + 2H2O38.酒精在空气中燃烧:C2H5OH + 3O2点燃 2CO2 + 3H2O39.氢气中空气中燃烧:2H2 + O2点燃 2H2O 七、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O2点燃 2MgO 41.铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O4 42。
知识总结物质间的相互转化
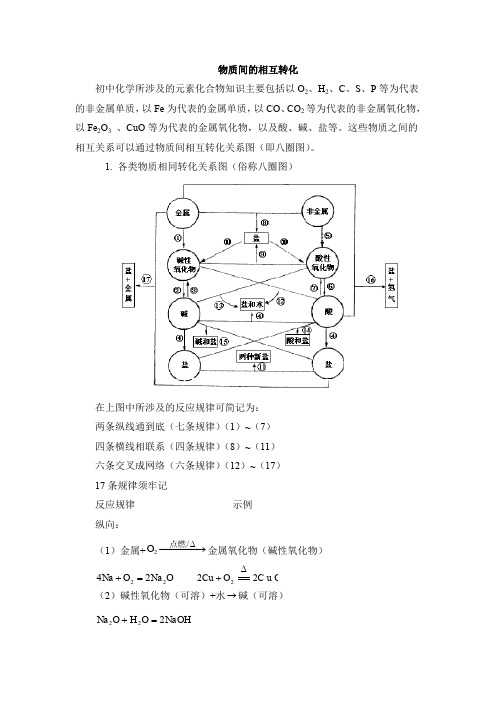
物质间的相互转化初中化学所涉及的元素化合物知识主要包括以O 2、H 2、C 、S 、P 等为代表的非金属单质,以Fe 为代表的金属单质,以CO 、CO 2等为代表的非金属氧化物,以Fe 2O 3 、CuO 等为代表的金属氧化物,以及酸、碱、盐等。
这些物质之间的相互关系可以通过物质间相互转化关系图(即八圈图)。
1. 各类物质相同转化关系图(俗称八圈图)在上图中所涉及的反应规律可简记为:两条纵线通到底(七条规律)(1)~(7)四条横线相联系(四条规律)(8)~(11)六条交叉成网络(六条规律)(12)~(17)17条规律须牢记反应规律示例纵向:(1)金属+−−−→−∆/2点燃O 金属氧化物(碱性氧化物) O Na O Na 2224=+ C u O O Cu 222∆+(2)碱性氧化物(可溶)+水→碱(可溶)NaOH O H O Na 222=+(3)碱(难溶)−−−→−∆高温/碱氧(难溶) + 水∆==2)(OH Cu O H CuO 2+(4)酸+碱→盐+水 O H PO Na PO H NaOH 2434333+=+O H C u S O SO H OH Cu 244222)(+=+ (5)非金属+−−→−点燃2O 非金属氧化物(酸性氧化物) 22CO O C 点燃+ 522254O P O P 点燃+ (6)酸性氧化物(易溶)+水→酸(易溶)3222CO H O H CO =+ 4325223PO H O H O P =+(7)酸(易挥发 / 难溶)→酸氧+水(易挥发 / 难溶)↑+=2232CO O H CO H 2232S i O O H S i O H +∆从纵向来看,金属→碱性氧化物→碱→盐,其中金属元素相同。
非金属→酸性氧化物→酸(含氧酸)→盐,其中非金属元素相同。
横向:(8)金属+非金属→(无氧酸)盐NaCl Cl Na 222点燃+(9)碱氧+酸氧→(含氧酸)盐 32CaSiO SiO CaO 高温+(10)含氧酸盐→碱氧+酸氧↑+23CO CaO CaCO 高温(11)盐+盐→两种新盐↓+=+AgCl NaNO AgNO NaCl 33交叉:(12)酸+碱氧→盐+水O H CuSO CuO SO H 2442+=+(13)碱+酸氧→盐+水O H CO Na CO NaOH 23222+=+(14)酸+盐→新酸+新盐32423242CO H SO Na CO Na SO H +=+↑+=2232CO O H CO H(15)碱+盐→新碱+新盐↓+=+2424)(2OH Cu SO Na CuSO NaOH(16)金属+酸→盐+↑2H↑+=+2442)(H ZnSO SO H Zn 稀(17)金属+盐→新盐+新金属44ZnSO Cu CuSO Zn +=+以上十七条规律的应用:(1)可知某物质的性质。
高一必修物质的分类之物质间的转化之八圈图

八圈图
1.各类物质相同转化关系图俗称八圈图
两条纵线通到底七条规律1~7
四条横线相联系四条规律8~11 六条交叉成网络六条规律12~17
17条规律须牢记
;
非金属→酸性氧化物→酸含氧酸→盐,其中非金属元素相同;
2可知某物质的制法;如:4、8、9、11~17为盐的十种制法;
对于盐+酸→新盐+新酸,有如下规律:
① 强酸→弱酸
如:↑++=+22232CO O H CaCl HCl CaCO
②稳定的不易分解的酸→不稳定的另分解的酸;
如:↑++=+22232CO O H CaCl HCl CaCO ③高沸点不易挥发的酸→低沸点易挥发的酸; 如:↑+∆+HCl SO Na NaCl SO H 2)
(2)(4242固浓 ④可溶性酸→难溶性酸;
如:↓+=+322SiO H NaCl HCl SiO Na
6、8、9; 属于分解反应的有:规律3、
7、10;
属于置换反应的有:规律16、17;
属于复分解反应的有:规律4、11、12、14、15; 规律13不属于任何一种基本反应类型;。
初中化学专题3 八圈图及物质的转化
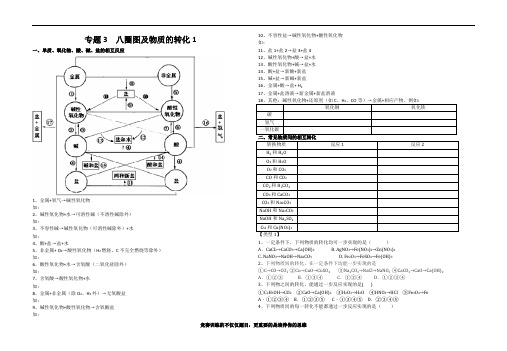
专题3 八圈图及物质的转化1一、单质、氧化物、酸、碱、盐的相互反应1、金属+氧气→碱性氧化物如:2、碱性氧化物+水→可溶性碱(不溶性碱除外)如:3、不容性碱→碱性氧化物(可溶性碱除外)+水如:4、酸+盐→盐+水5、非金属+ O2→酸性氧化物(H2燃烧、C不完全燃烧等除外)如:6、酸性氧化物+水→含氧酸(二氧化硅除外)如:7、含氧酸→酸性氧化物+水如:8、金属+非金属(除O2、H2外)→无氧酸盐如:9、碱性氧化物+酸性氧化物→含氧酸盐如:10、不容性盐→碱性氧化物+酸性氧化物如:11、盐1+盐2→盐3+盐412、碱性氧化物+酸→盐+水13、酸性氧化物+碱→盐+水14、酸+盐→新酸+新盐15、碱+盐→新碱+新盐16、金属+酸→盐+ H217、金属+盐溶液→新金属+新盐溶液1、一定条件下,下列物质的转化均可一步实现的是()A.CaCl2→CaCO3→Ca(OH)2 B. AgNO3→Fe(NO3)2→Zn(NO3)2C. NaNO3→NaOH→Na2CO3D. Fe2O3→FeSO4→Fe(OH)32、下列物质间的转化,在一定条件下均能一步实现的是①C→CO→CO2 ②Cu→CuO→CuSO4 ③Na2CO3→NaCl→NaNO3 ④CaCO3→CaO→Ca(OH)2 A.①②③B.①③④C.①②④ D.①②③④3、下列物之间的转化,能通过一步反应实现的是( )①C2H5OH→CO2②CaO→Ca(OH)2③H2O2→H2O④HNO3→HCl⑤Fe3O4→Fe A.①②③④ B.①②③⑤ C.①③④⑤ D.②③④⑤4、下列物质间的每一转化不能..都通过一步反应实现的是()A.CuO→Cu→CuO B.NaOH→H2O→NaOH C.O2→Fe3O4→O2D.Fe→FeCl2→Fe5、下列物质间的每一转化不能都通过一步反应实现的是()A.Ca→CaO→CaCl2B.NaOH→Na2CO3→NaClC.O2→CuO→Cu(OH)2D.C→CO2→Na2CO36、下列转化能一步完成的()① CH4→CO2 ②HNO3→HCl ③CaO→Ca(OH)2 ④Ba(OH)2→NaOH ⑤C→CuA.①③④⑤ B.②③④⑤ C.①②④⑤ D.①②③④7、下列转化能一步完成的是()①CaCO3→CO2②HCl→NaCl③CaO→Ca(OH)2④Ca(OH)2→NaOH⑤CuO→Cu.A.①②③④⑤B.②③④⑤C.①②④⑤D.①②③④8、下列转化能一步完成的是()①Ba(OH)2→NaOH②CuO→Cu(OH)2 ③HNO3→HCl④SO2→Na2SO3.A.①④ B.②③ C.③④ D.只有④9、下列物质之间的转化能够实现的是()10、下列物质间的转化关系正确的是()A.①②B.②③ C.①③ D.①②③【类型2】1、现有Fe、CuO、MgCl2、Ca(OH)2、稀H2SO4等五种物质,在常温下它们两两相互发生的化学反应有()A.7个B.6个C.5个D.4个2、现有氧化铁、稀硫酸、氢氧化钠溶液、氯化钡溶液和碳酸钾溶液五种物质,在常温下它们两两相互发生的化学反应有()A.4个B.5个C.6个D.7个3、现有Zn、Fe2O3、MgCl2、Cu(OH)2、稀H2SO4等五种物质,在常温下它们两两相互发生的化学反应有()A.3个B.4个C.5个D.6个4、对于化学反应X + Na2CO3 == 2Y+ CaCO3↓的分析错误的是()A.该反应属于复分解反应B.Y中一定含有钠元素C.X一定是熟石灰D.X中阴离子化合价是—1价5、对于复分解反应:X+2NaOH2Y+Cu(OH)2↓,下列分析中正确的是()A.X一定是CuCl2B.相对分子质量大小:X>Y C.Y可能是H2O D.Y可能是Na2SO4【类型3】1、下列各组变化中,每一转化在一定条件下均能一步实现的是()A.①和② B.②和③ C.①和③ D.①②③2、下列各组物质间通过一步反应就能实现如图所示的转化,则甲、乙、丙可能分别是()A.NaOH、NaCl、NaNO3B.CO、CO2、H2 CO3C.CaO、Ca(OH)2、CaCO3D.H2O2、H2O、O23、(2013•徐州一模)下列各组中物质间的转化不都是通过一步反应实现的是()4、下列各组物质间通过一步反应就能实现如右图转化,则甲、乙、丙可能是()A.KOH KCl KNO3B.CuO CuCl2Cu(OH)2C.C CO2COD.H2O2H2O O25、(2014·宿迁)下列物质的三角转化关系中都能按箭头方向一步实现的是( )A.① B.①② C.①②③ D.②③6、下列各组转化中,一定条件下均能一步实现的组合是()A.①②B.②③C.①③D.①②③专题3 八圈图及物质的转化2【类型3】7、下列有关说法正确的是( ) A .实现CO CO 2的相互转化,都只有一种途径B .Al 可以实现单质氧化物碱C .实现C CO 的转化,都利用了碳的可燃性D .实现H 2OO 2相互转化,化学反应的基本类型不同8、比较归纳是化学学习中常用的一种方法.以下是C 、CH 4、CO 三种物质转化为CO 2的转化关系,即:①C→CO 2②CH 4→CO 2③CO→CO 2,对它们的比较归纳正确的是( )A .三种转化发生的都是化合反应B .三种物质都只能跟氧气反应转化为二氧化碳C .三种物质都可以在点燃条件下转化为二氧化碳D .三种转化所有的生成物在常温下都是气体 9、(2014黄冈市)已知甲、乙、丙、丁是初中化学中的四种常见物质,丁是甲与乙、乙与丙反应的生成物之一(反应条件均已略去),转化关系如图:(1)常温下,若乙为红色粉末,甲为黑色粉末,则丙的化学式是______,甲与乙反应的化学方程式为______。
高中化学 酸碱盐氧化物知识小结—八圈图 学法指导
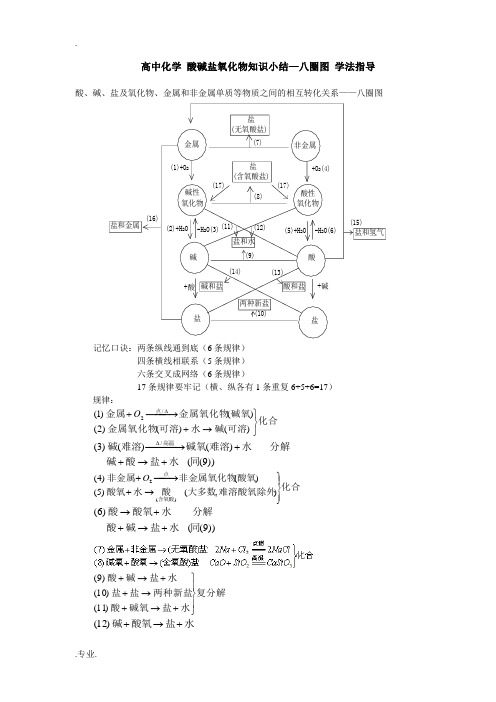
高中化学酸碱盐氧化物知识小结—八圈图学法指导盐和金属金属非金属碱性氧化物酸性氧化物碱酸盐盐盐(无氧酸盐)盐(含氧酸盐)盐和水碱和盐酸和盐两种新盐盐和氢气+酸+碱(16)(1)+O2(7)(17)+O2(4)(17)(8)(2)+H2O-H2O(3)(11)(12)(5)+H2O-H2O(6)(15)(9)(14)(13)(10)记忆口诀:两条纵线通到底(6条规律)四条横线相联系(5条规律)六条交叉成网络(6条规律)17条规律要牢记(横、纵各有1条重复6+5+6=17)规律:化合可溶碱水可溶金属氧化物碱氧金属氧化物金属点⎭⎬⎫→+−−→−+∆)()()2()()1(/2O))9(()()()3(/同水盐酸碱分解水难溶碱氧难溶碱高温+→++−−→−∆化合难溶酸氧除外大多数酸水酸氧酸氧非金属氧化物非金属含氧酸点⎪⎭⎪⎬⎫→+−→−+),()5()()4()(2O))9(()6(同水盐碱酸分解水酸氧酸+→++→复分解水盐碱氧酸两种新盐盐盐水盐碱酸⎪⎭⎪⎬⎫+→+→++→+)11()10()9(水盐酸氧碱+→+)12(复分解新盐新碱盐碱新盐新酸盐酸⎭⎬⎫+→++→+)14()13(置换反应新金属新盐盐金属盐酸金属⎭⎬⎫+→+↑+→+)16()15(2H碱氧酸氧含氧酸盐+→)17(高温====3CaCO ↑+2CO CaO高温====3BaCO ↑+2CO BaO以上规律的应用:① 可知某物质性质 ② 某物质制法(箭尾) (箭头指向) ③ 各类物质间相互关系从上述规律中可以总结出制盐的十种方法,包括:(2)~(16) 【典型例题】[例1] 现有石灰石、水、碳酸钠,怎样制取烧碱(不能引入其他物质),写出化学方程式。
解析:此题是物质的制备题。
在具备单质、氧化物、酸、碱、盐的相互关系,各种物质的制备规律和条件时,还要掌握酸、碱、盐的溶解性,就可以考虑解题方法了。
本题应采用倒推法,即从产品烧碱出发向原料推。
在考虑过程中应注意烧碱是一种可溶性碱,制备时应用盐+碱—新盐+新碱这一规律,此规律的条件是反应物都是可溶于水的物质且生成物必有一种物质是难溶于水时,此复分解反应才能发生,而且能把烧碱分离出来。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2013年初三化学物质类别之间的反
应学案
欧阳光明(2021.03.07)
(1)金属单质与氧气的反应:
1. 镁在空气中燃烧:2Mg + O2点燃 2MgO
2. 铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O4
3. 铜在空气中受热:2Cu + O2加热 2CuO
4. 铝在空气中燃烧:4Al + 3O2点燃 2Al2O3
(2)碱性氧化物与水的反应、可溶性碱的制备:
5、CaO + H2O ==== Ca(OH)2
6、Na2O + H2O ==== 2NaOH
(3)难溶性碱的受热分解:
7、 2Fe(OH)3加热Fe2O3 + 3H2O 8、Cu(OH)2加热CuO + H2O
(4)非金属单质与氧气的反应:
9、氢气中空气中燃烧:2H2 + O2点燃 2H2O
10、红磷在空气中燃烧:4P + 5O2点燃 2P2O5
11、硫粉在空气中燃烧: S + O2点燃 SO2
12、碳在氧气中充分燃烧:C + O2点燃 CO2
13、碳在氧气中不充分燃烧:2C + O2点燃 2CO
(5)酸性氧化物与水反应制备酸:14、CO2+ H2O==== H2CO315、SO2 + H2O==== H2SO3 16、SO3 + H2O==== H2SO4
(6)弱酸的分解:
17、H2CO3==== CO2↑+ H2O 18、 H2SO3====SO2↑+ H2O
(7)碱性氧化物与酸性氧化物反应制备盐:19、CaO + SiO2高温 CaSiO3
(8)金属与非金属反应生成无氧酸盐:20、2Na + Cl2点燃2NaCl
(9)碱性氧化物 +酸 -------- 盐 + 水
21. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O
22. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O
23. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O
24. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O
25. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O
26. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O
(10)酸性氧化物 +碱 -------- 盐 + 水
27.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 28.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 29.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O 30.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O 31. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3↓+ H2O
(11)酸 + 碱 -------- 盐 + 水
32.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O
33. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O
34.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O 35. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O
36. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O
37.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 +
3H2O
38.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O
39.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O
40.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O
41. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 +
6H2O
42. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O
(12)酸 + 盐 -------- 另一种酸 + 另一种盐
43.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑ 44.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑ 45.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑ 46.盐酸和硝酸银溶液反应:HCl + AgNO3=== AgCl↓ + HNO3
47.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑
48.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4↓+ 2HCl
(13)碱 + 盐 -------- 另一种碱 + 另一种盐
49.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4 50.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl 51.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl
52. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl
53. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH
(14)盐 + 盐 ----- 两种新盐
54.氯化钠溶液和硝酸银溶液:NaCl + AgNO3==== AgCl↓ + NaNO3
55.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl
(15)金属单质 + 酸 -------- 盐 + 氢气(置换反应)
56. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑
57. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑
58. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑
59. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑
60. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑
61. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑
62. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑
63. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑
(16)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐
64. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu
65. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu
66. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg
(17)非金属与氢气的反应:
67、H2 + Cl2点燃 2HCl
(18)盐的分解:
68、CaCO3高温CaO + CO2↑。
