【新教材】人教版(2019)高中化学必修 第一册 第一章 第一节物质的分类及转化
人教版2019新教材高中化学必修一第一章第一节物质的分类及转化知识点梳理
第一章物质及其变化
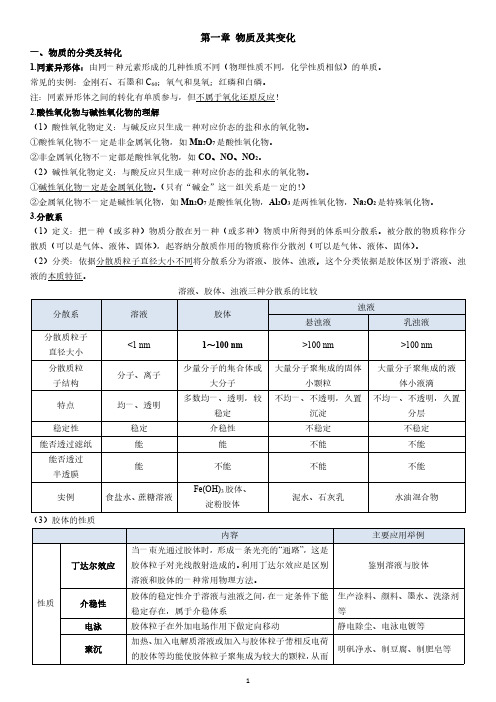
一、物质的分类及转化
1.同素异形体:由同一种元素形成的几种性质不同(物理性质不同,化学性质相似)的单质。
常见的实例:金刚石、石墨和C60;氧气和臭氧;红磷和白磷。
注:同素异形体之间的转化有单质参与,但不属于氧化还原反应!
2.酸性氧化物与碱性氧化物的理解
(1)酸性氧化物定义:与碱反应只生成一种对应价态的盐和水的氧化物。
①酸性氧化物不一定是非金属氧化物,如Mn2O7是酸性氧化物。
②非金属氧化物不一定都是酸性氧化物,如CO、NO、NO2。
(2)碱性氧化物定义:与酸反应只生成一种对应价态的盐和水的氧化物。
①碱性氧化物一定是金属氧化物。(只有“碱金”这一组关系是一定的!)
②金属氧化物不一定是碱性氧化物,如Mn2O7是酸性氧化物,Al2O3是两性氧化物,Na2O2是特殊氧化物。
3.分散系
(1)定义:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系叫分散系。被分散的物质称作分散质(可以是气体、液体、固体),起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体)。
(2)分类:依据分散质粒子直径大小不同将分散系分为溶液、胶体、浊液,这个分类依据是胶体区别于溶液、浊液的本质特征。
溶液、胶体、浊液三种分散系的比较
(3)胶体的性质
形成沉淀从分散剂中析出
提纯渗析由于胶体粒子较大不能通过半透膜,而离子、小分子
较小可通过半透膜,用此法将胶体提纯
用于分离溶液和胶体
(4)胶体部分易错归纳
①胶体的本质是胶体粒子的直径介于1~100nm之间,而不是丁达尔效应。
②胶体本身并不带电,而是由于胶体粒子吸附溶液中的离子而带电。
人教版(2019)高一化学必修第一册第一章 第一节 第二课时:物质的分类及转化(33张PPT)

反应实例(写 出化学方程式 )
反应类型
Fe + H2SO4 =FeSO4 + H2↑ Fe2O3 + 3H2SO4 =Fe2(SO4)3
Cu(OH)2 +H2S+O34H=2COuSO4 +2H2O BaCl2 +H2SO4 =BaSO4 ↓+2HCl 使紫色石蕊试液变红色,无色酚酞试液不变色
2、碱的化学性质
⑤云、雾
A. ②④⑤
B.③④⑤
C.②③④
D. ①③④
2021/1/11
补充:渗析 ①定义:利用半透膜把胶体中混有的离子或分子 从胶体中分离出来的操作,叫做渗析。 ②原理:胶体微粒不能透过半透膜,而溶液中的分 子和离子能透过半透膜。 ③应用:分离和提纯胶体。
2021/1/11
练习2、某混合液中含泥沙、淀粉、氯化钠三种成分,如何将它 们逐一分离开来?(提示:淀粉溶液是胶体)
宏观辨识
组成相似
HCl H2SO4 HNO3
NaOH KOH Ba(OH)2
Na2CO3 K2CO3 (NH4)2CO3
微观探析
H+
OH-
结构 决定 性质
CO32—
【学习任务】物质的转化 从物质的分类角度构建物质转化规律的模型认知
金属
非金属 单质
O2 碱性氧化物
1.1 物质的分类及转化 讲义【新教材】人教版(2019)高中化学必修一

第一章物质及其变化
第一节物质的分类及转化
一、物质分类
1、根据物质的组成和性质分类
任何物质都是有元素组成的,根据元素组成对物质进行分类是常用的方法。
(1)同素异形体:由一种元素形成的几种性质不同的单质。如:金刚石和石墨、白磷(P4)和红磷、氧气和臭氧
【注】①同素异形体之间的转换是化学变化。
②同素异形体之间由于结构不同,物理性质有差异,但由于同种元素组成,化学性质相似或略有差
异。
③由一种元素组成的物质不一定是纯净物。如氧气和臭氧。
2、分类方法
(1)树状分类:对同类事物进行再分类的方法。
单质:O2、Fe、He等
纯净物有机化合物:CH4、葡萄糖、酒精(乙醇)等
酸:电离出的阳离子全部是氢离子
化合物
碱:电离出的阴离子全部是氢氧根
无机化合物
物质盐:由金属阳离子或NH4+与酸根离子结合
氧化物:只含两种元素,其中一种是氧元素
溶液:NaCl溶液、稀硫酸等
混合物胶体:Fe(OH)3胶体、淀粉胶体等
浊液:泥水
【注】冰水混合物、胆矾、明矾、水银等并非混合物,均为纯净物。
①酸的分类:酸可依据电离出氢离子的个数,将酸分为一元酸、二元酸、多元酸。也可按照酸分子中是否含氧元素,将酸分为含氧酸和无氧酸。
一元酸:HCl、HNO3、CH3COOH等含氧酸:HNO3、、H2SO4等
酸二元酸:H2CO3、H2SO4等酸
多元酸:H3PO4无氧酸:HCl、H2S等
②碱的分类:可依据电离出OH-的个数,将酸分为一元碱、二元碱、多元碱。也可按照溶解性,将碱分为可溶性碱、难溶性碱。
一元碱:NaOH、NH3·H2O 可溶性碱:NaOH、Ba(OH)2等
必修一第一章第一节物质的分类及转化下学期高一化学人教版(2019)必修第一册

中是否含有
氧元素
无氧酸盐:NaCl、ZnS等
按组成
正盐:BaSO4、KNO3、NH4Cl等 酸式盐:NaHCO3、KHSO4等 碱式盐:Cu2(OH)2CO3等
下列盐:①Na2CO3 ②NH4HCO3 ③BaSO4 ④ NaH2PO3 ⑤Cu(OH)2CO3 ⑥NaHS ⑦
Mg(OH)Cl
属于正盐的有 ① ③
同素异形体:金刚石和石墨的不同结构
同素异形体之间的转化属于物理变化还是 化学变化?
化学变化。比如:金刚石和石墨的转化过 程中,虽然元素的种类没有变,但它们的结 构却发生了转变。
自主阅读课本第7页,完成导纲上基 础感知中分类法的相关内容。
金属单质
非金属单质 单质
纯净物
物质
稀有气体
无机 化合物 化合物
非金属单质的化学性质
1.与O2发生反应 C+O2 ═点燃 CO2 2.大多数能与金属反应 Fe+Cl2 =∆ FeCl3+H2↑ 3.大多数能够与水反应 Cl2+H2O=HCl+HClO
4.活泼非金属置换不活泼的非金属 Cl2+2HBr=2HCl+Br2
金属单质
非金属单质 单质
纯净物
物质
稀有气体
碱的分类
可溶性碱:NaOH、KOH、Ba(OH)2等
按溶解性
化学人教版(2019)必修第一册1.1物质的分类及转化(共49张ppt)

氧化物
从性质分
酸性氧化物 碱性氧化物 两性氧化物
不成盐氧化物
如:Na2O、CaO、MgO、ZnO、 MnO2、CuO、Fe2O3、Al2O3 如:CO2、SO2、CO、SO3、P2O5)
如:SO2、SO3、CO2、Mn2O7 如:CaO、MgO、CuO、Fe2O3 Al2O3 如:CO、NO、MnO2
硫酸盐 碳酸盐 硝酸盐
……
KNO3、KMnO4、FeSO4
无氧酸盐 NaCl、ZnS、CaCl2
据组成分
正盐 酸式盐 碱式盐
KNO3、KMnO4、FeSO4 、 NaCl、ZnS、CaCl2
NaHCO3、NH4HCO3、NaHSO4 Cu2(OH)2CO3
复盐 KAl(SO4)2、(NH4)2Fe(SO4)2
HNO3
分类并没有唯一性,它会根据分类的标准不同而不同。
6
知识点1:物质的分类方法 1 树状分类法
Cu SO3 BaSO4
CO2 H2SO4 盐酸
CO 纯碱 石墨
CH4 C60 合金
NaOH CaO 金刚石
食盐水 Fe2O3 Al2O3
请对上面物质进行分类,分类形式不限。
7
知识点1:物质的分类方法 1 树状分类法
18
知识点2:碱的分类
从是否溶 于水分
可溶碱 难溶碱
KOH、NaOH、Ca(OH) 2、Ba(OH)2、 NH3·H2O
1.1 物质的分类及转化 讲义【新教材】人教版(2019)高中化学必修一

第一章物质及其变化
第一节物质的分类及转化
一、物质分类
1、根据物质的组成和性质分类
任何物质都是有元素组成的,根据元素组成对物质进行分类是常用的方法。
(1)同素异形体:由一种元素形成的几种性质不同的单质。如:金刚石和石墨、白磷(P4)和红磷、氧气和臭氧
【注】①同素异形体之间的转换是化学变化。
②同素异形体之间由于结构不同,物理性质有差异,但由于同种元素组成,化学性质相似或略有差
异。
③由一种元素组成的物质不一定是纯净物。如氧气和臭氧。
2、分类方法
(1)树状分类:对同类事物进行再分类的方法。
单质:O2、Fe、He等
纯净物有机化合物:CH4、葡萄糖、酒精(乙醇)等
酸:电离出的阳离子全部是氢离子
化合物
碱:电离出的阴离子全部是氢氧根
无机化合物
物质盐:由金属阳离子或NH4+与酸根离子结合
氧化物:只含两种元素,其中一种是氧元素
溶液:NaCl溶液、稀硫酸等
混合物胶体:Fe(OH)3胶体、淀粉胶体等
浊液:泥水
【注】冰水混合物、胆矾、明矾、水银等并非混合物,均为纯净物。
①酸的分类:酸可依据电离出氢离子的个数,将酸分为一元酸、二元酸、多元酸。也可按照酸分子中是否含氧元素,将酸分为含氧酸和无氧酸。
一元酸:HCl、HNO3、CH3COOH等含氧酸:HNO3、、H2SO4等
酸二元酸:H2CO3、H2SO4等酸
多元酸:H3PO4无氧酸:HCl、H2S等
②碱的分类:可依据电离出OH-的个数,将酸分为一元碱、二元碱、多元碱。也可按照溶解性,将碱分为可溶性碱、难溶性碱。
一元碱:NaOH、NH3·H2O 可溶性碱:NaOH、Ba(OH)2等
物质的分类及转化 高一化学人教版(2019)必修第一册

第一节 物质的分类及转化
新教材 必修1 人教版
学习目标
01 了解物质的分类依据
01
02 认识分类方法的应用
02
03 感受分类方法对化学学科研究和学习的重要作用
03
活动一、你能记住多少内容?
生物 春天
五
气体
英语
语文 夏天
三 液体
化学 固体
四
数学
物理
冬天
七
秋天 六
气体 液体 固体
碱性氧化物
能与_酸__反应
生 成
__盐__和_水___的氧化物
两性氧化物
不成盐氧化物
结论:多数金属氧化物属于碱性氧化物; 多数非金属氧化物属于酸性氧化物。
分类法的应用
酸性氧化物
CO2、SO2
氧 化
碱性氧化物
Na2O、CuO、Fe2O3
物
两性氧化物
Al2O3
不成盐氧化物 CO、NO
活动五:写一写
请分别写出以下反应的化学方程式
2、碱性氧化物都是金属氧化物 √
3、酸性氧化物都是非金属氧化物 × Mn2O7酸性氧化物
4、非金属氧化物都是酸性氧化物 × CO、NO不成盐氧化物
分类的方法 2、交叉分类法
活动七:练一练
1、现有:①石油 ②干冰 ③白酒 ④氯酸钾 ⑤硫 ⑥粗盐 ⑦氧气 ⑧水 ⑨氯化钠,其中属于单质的有_⑤__⑦___;属于化合物的有_②__④__⑧___⑨_,其中 _②__④__⑧_属于含氧化合物,_②___⑧____属于氧化物;属于混合物的有 _①___③__⑥_____.
2019人教版新教材高中化学必修一第一章重点知识点归纳总结(物质及其变化)
第一章物质及其变化
第一节物质的分类及转化
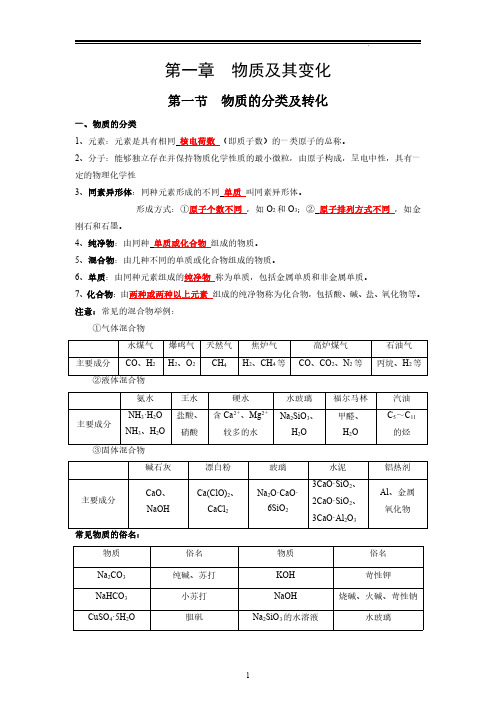
一、物质的分类
1、元素:元素是具有相同核电荷数(即质子数)的一类原子的总称。
2、分子:能够独立存在并保持物质化学性质的最小微粒,由原子构成,呈电中性,具有一定的物理化学性
3、同素异形体:同种元素形成的不同单质叫同素异形体。
形成方式:①原子个数不同,如O2和O3;②原子排列方式不同,如金刚石和石墨。
4、纯净物:由同种单质或化合物组成的物质。
5、混合物:由几种不同的单质或化合物组成的物质。
6、单质:由同种元素组成的纯净物称为单质,包括金属单质和非金属单质。
7、化合物:由两种或两种以上元素组成的纯净物称为化合物,包括酸、碱、盐、氧化物等。注意:常见的混合物举例:
①气体混合物
水煤气爆鸣气天然气焦炉气高炉煤气石油气主要成分CO、H2H2、O2CH4H2、CH4等CO、CO2、N2等丙烷、H2等
②液体混合物
碱石灰漂白粉玻璃水泥铝热剂
主要成分CaO、
NaOH
Ca(ClO)2、
CaCl2
Na2O·CaO·
6SiO2
3CaO·SiO2、
2CaO·SiO2、
3CaO·Al2O3
Al、金属
氧化物
常见物质的俗名:
物质俗名物质俗名
Na2CO3纯碱、苏打KOH苛性钾
NaHCO3小苏打NaOH烧碱、火碱、苛性钠CuSO4·5H2O胆矾Na2SiO3的水溶液水玻璃
FeSO4·7H2O绿矾CH4天然气、沼气KAl(SO4)2·12H2O明矾CH3CH2OH酒精CaCO3石灰石C6H12O6葡萄糖或果糖
CaO生石灰C12H22O11蔗糖或麦芽糖
Ca(OH)2熟石灰、消石灰(C6H10O5)n淀粉或纤维素
人教版2019必修第1册第一章 第一节 物质的分类与转化

第一节物质的分类及转化
第1课时物质的分类及转化
[核心素养发展目标] 1.能从不同层次认识物质的多样性,认识元素可以组成不同种类的物质,根据物质的组成和性质对物质进行分类。2.能从物质类别的角度认识同类物质具有相似性,一定条件下物质可以相互转化。
基础知识梳理总结:
一、物质的分类方法
1.物质分类标准
对物质进行分类,首先要确定分类的标准,然后按标准进行分类。
(1)依据通常状况下物质的存在状态为标准,可分为、、。
(2)依据物质是否由同种物质(分子)组成可分为、。
(3)纯净物是否由同种元素组成可分为、。
(4)单质按照元素种类可分为、。
(5)化合物按照物质的性质可分为、、、、等等。............
2.交叉分类法
对同种物质依据不同的标准进行分类。如:
3.树状分类法
根据物质的组成和性质对物质进行分类:
单质
金属
非金属
酸性氧化物
氢化物
物质纯净物
化合物
氧化物
酸
碱
碱性氧化物
两性氧化物
不成盐氧化物
按酸根分含氧酸
无氧酸
按电离出
的H+数分
一元酸
二元酸
三元酸
按强弱分
强碱
弱碱
按可溶性分
可溶性碱
难溶性碱
正盐
特殊氧化物过氧化物
按强弱分
强酸
弱酸
4、同素异形体及氧化物的概念和分类
(1)同素异形体的概念: (2)物质举例: (3)同素异形体的差异: 5、氧化物的概念:
混合物
溶液:
浊液:
胶体:
(1)单质一定是由同一种元素组成的物质,由同一种元素组成的物质不一定是单质。
(2)化合物一定是由不同种元素组成的纯净物,但纯净物不一定是化合物。
(3)纯净物是由一种成分(分子)组成的物质,有化学式,有固定熔、沸点。
(4)混合物是由多种成分(分子)组成的物质,无化学式,无固定熔、沸点。
第1章第一节物质的分类及转化 高一化学人教版(2019)必修第一册

类地进行深入研究
分类有一定的标准,根据不同的标准,人们对研究对象进行不同的
分类。在高中化学的学习中,对物质及其变化的分类标准将从物质的组成和
性质等宏观视角,拓展到物质的构成、结构和参加化学反应的粒子等微观视
角。
运用分类的方法,可以发现物质及其变化的规律,预测物质的性质
及可能发生的变化。
一、简单分类法及其应用
特点 ﹙ 1 ﹚对同类物质可以进行再分类; ﹙ 2 ﹚从属关系明确; ﹙ 3 ﹚同类物质具有共性。 ﹙ 4﹚同一层次的物质类别间一般是相互独立、没有交 叉的。
化学物质
根据物质组成是否单一
纯净物
根据组成元素的异同
混合物
单
化
质
合
根据性质的差异
物
金
非
有机化合物
无机化合物
属
金
根据组成的差异
单
属
质
单
质
氧
酸碱 盐
1、分类的目的: 方便查找应用 物以类聚,人以群分
2、分类的标准: 根据组成或性质
3、分类的意义: 方便学习和研究
对于工作和生活而言,对物质进行合理分类可以为工作和生活提供 便利,实现高效。
对于化学研究而言,对物质进行合理分类便于了解各类物质的共性 和各类反应的本质。
4、常用分类的方法:
(1)交叉分类法
化学人教版(2019)必修第一册1

物质间的转化
观察下列转化关系,从物质分类的角度,你发现了什么规律?
C→
非金 属
CO2 → H2CO3 →
酸性
氧化 物
酸
CaCO3
盐
Ca →
金属
CaO → Ca(OH)2 →
碱性
氧化
碱
物
CaCO3
盐
不同类别物质之间的反应和转化关系图
思考: 运用“各类物质的反应关系图”设计以K为原料制 备K2SO3的转化路径。
第一章 物质及其变化
第一节 物质的分类及转化
第3课时 物质的转化
核心素养发展目标
熟知酸、碱、盐的性质,会写相关反应的化学方程
PART
01
式,并判断其反应类型。
PART
02
通过物质间的反应关系,认识物质间的变化规律。
认识同类物质具有相似性,学会分析研究物质性质与相
PART
03
互转化的方法,促进“证据推理与模型认知”化学核心
K
K2O KOH
H2SO3
来自百度文库
同学甲设计的方案:
第一步 第二步 第三步
4K + O2 == 2K2O K2O + H2O == 2KOH 2KOH + H2SO3 == K2SO3 + 2H2O
a
K2O
SO2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
稳定
能否通过滤纸
能
介稳性 能
是否具有
丁达尔现象
无
有
能否发生电泳
不能
能
能否透过半透膜
能
不能
浊液
>100nm 许多分子集合体 不均一、不透明
不稳定 不能
无
不能
不能
结论2、胶体能透过滤纸,而悬浊液无法通过滤纸, 说明胶体粒子比悬浊液粒子小。
三、胶体的性质:
1、丁达尔效应:
光束通过胶体,形成一条光亮的通路。
利用丁达尔效应是区分胶体与溶液的一种常用物理方法。
丁达尔效应在日常生活中随处可见
关于胶体的知识拓展
2、介稳性
胶体的稳定性介于溶液和浊液之间,在一定条件能稳定存在。
重要胶粒带电的一般规律:
带正电荷胶粒
金属氢氧化物 金属氧化物 AgI
带负电荷胶粒
金属硫化物(如Sb2S3) 非金属硫化物(如As2S3) 非金属氧化物(如SiO2泥沙)
硅酸盐(土壤和水泥) AgI
胶粒带同种电荷,相互间产生排斥作用,不易结合成更大的沉淀 微粒,这是胶体具有稳定性的主要因素。
总结 胶体稳性的原因是什么?
分散剂
分散质
布朗运动
布朗运动:是指花粉悬浮在水中进行的无秩序、不停的运动。 胶体也作布朗运动。
普遍存在的现象 布朗运动(动力学性质)
3.电泳
外加电场作用下,胶体粒子在分散剂里向电极(阴极 或阳极)做定向移动的现象。
注:电泳现象是物理变化。
分散剂
胶体
电 极
3.电泳现象 (电学性质)
电泳:胶粒细小而具有较大的表面积,能选择性地吸附胶体中的 某种离子带有一定的电荷。在直流电场中,胶体微粒会向带相反 电荷的电极定向移动。
胶体的直径在1-100nm 之间,能使光波发生散 射
CuSO4溶液 无光现象产生
溶液中粒子的直径小于 1nm,散射极其微弱
过滤后的现象
Fe(OH)3胶体
滤纸上无滤渣,滤液颜色不变,(无现象)
泥水
由浑浊变澄清
结论1、胶体有丁达尔效应,溶液没有,可以此区分溶液及胶体。 说明胶体分散质粒子比溶液分散质粒子大,
使胶体聚沉的方法
• 1、加热。增大胶体的运动。使胶粒聚集成大颗粒而沉淀。 • 2、加入电解质。中和胶粒所具有的电荷。 • 3、加入电荷相反的胶体。中和胶体电荷
• 渗析: • 由于胶体直径较大,不能透过半透膜,而离子可以透过
,这样可以将胶体净化。
分散剂
胶体 离子
半 透 膜
视频:渗析
微训练 1.胶体、浊液与溶液的本质区别在于( D )
原因一: 同种胶粒带同种电荷,相互排拆 (主要原因)
原因二: 布朗运动
• 4.聚沉 • 胶体的介稳性被破坏,胶体粒子聚
集成为较大的颗粒(悬浮粒子)而 分散剂 胶体 以沉淀形式从分散剂中析出。
• 中和胶体粒子的电性是使胶体聚沉 的方法。
带电粒子
• 明矾净水,用石膏或盐卤点制豆 腐
胶体发生聚沉作用一般情况下都生成沉淀,但有些胶体聚沉后,胶体 粒子和分散剂凝聚在一起,成为不流动的冻状物,这类物质叫凝胶。 例如,日常食用的豆腐就是以盐卤(主要成分是MgCl2·6H2O)或石膏 (CaSO4·2H2O)为聚沉剂,使豆浆里的蛋白质和水等物质一起聚沉而 制成的一种凝胶。
第一章 物质及其变化
第一节 物质的分类及转化
分散剂是液体时
按分散质粒子的大小分:可分为3种 :
A、溶液(d<1nm)
B、胶体(1nm<d<100nm)
C、浊液(d>100nm) 注:1nm=10-9m d为粒子直径
【思考与交流】 1、回忆物质的分类方法,然后画出分散系的树状分类图? 2、它们的分散质粒子大小不同﹑性质有何区别?
带不同电荷的胶体微粒相互吸引发生电性中和,从而在胶粒 碰撞时发生凝聚,形成沉淀或凝胶。
明矾
加热
温度升高,胶粒的吸附能力减弱,减少了胶粒所吸引的阴离子 或阳离子数量,胶粒所带的电荷数减少,胶粒间的斥力作用减 弱,使得胶粒在碰撞时容易结合成大颗粒,形成沉淀或凝胶。
实例:淀粉溶液加热后凝聚成了浆糊凝胶,蛋清加热后凝聚成了白 色胶状物(同时发生变性)。
Fe(OH)3胶体向阴极移动——带正电荷
原因: 粒子胶体微粒带同种电荷,当胶粒带正电荷时向阴极运动, 当胶粒带负电荷时向阳极运动。
胶体的胶粒有的带电,有电泳现象;有的不带电,没有电泳现象。 应用:①静电除尘;②电泳电镀,利用电泳将油漆、乳胶、橡胶等 粒子均匀地沉积在镀件上。
胶粒带电,但整个胶体分散系是呈电中性的。
4、加入FeCl3后,不可长时间加热,否则Fe(OH)3胶体会产生聚 沉
科学探究 如何区分这三种分散系?
思考: 有些液态胶体也是透明的,用肉眼是很难与溶液
相区别。那么用什么方法才能够区别溶液和胶体的呢?
视频:丁达尔现象
视频:胶体的过滤
光束照射时的现象
原因分析
Fe(OH)3胶体 形成一条光亮的通路
(2)胶体: 气溶胶 分散剂为气体(如:烟、云、雾) 液溶胶 分散剂为液体(如:牛奶、豆浆) 固溶胶 分散剂为固体(如:有色玻璃、宝石)
视频:胶体的制备
注意: 制备Fe(OH)3胶体时 1、必须使用饱和FeCl3,浓度过低不利于Fe(OH)3胶体形成。 2、向沸水中加入饱和FeCl3溶液,并不是直接加热饱和FeCl3溶 液,否则Fe(OH)3浓度过大会产生沉淀。 3、必须使用蒸馏水,使用纯度不高的水,会使胶体产生聚沉。
A.源自文库散系是否有丁达尔现象 B.分散质粒子是否带电荷 C.分散系是否稳定 D.分散质粒子直径的大小
解析 三种分散系的根本区别在于分散质粒子直径的 大小。
小结:
分散系
溶液
胶体
分散质粒子的直径 <1nm
分散质粒子
单个分子或离子
外观
均一、透明
1nm~100nm
分子集合体 或有机高分子
多数均一、透明
稳定性
