制药企业全套检验记录(DOC)
制药企业实验室FDA检查列表(check list)
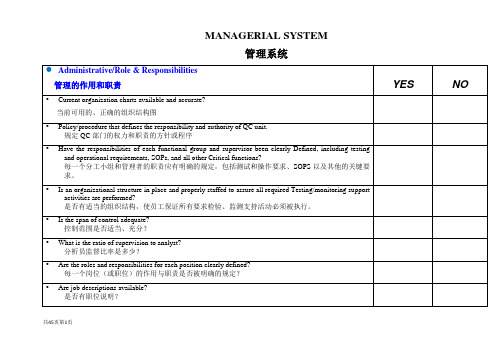
MANAGERIAL SYSTEM
管理系统
共45页第1页
共45页第2页
共45页第3页
共45页第4页
共45页第5页
共45页第6页
共45页第7页
共45页第8页
共45页第9页
共45页第10页
共45页第11页
共45页第12页
共45页第13页
共45页第14页
共45页第15页
共45页第16页
共45页第17页
共45页第18页
共45页第19页
共45页第20页
共45页第21页
共45页第22页
共45页第23页
共45页第24页
共45页第25页
共45页第26页
共45页第27页
共45页第28页
共45页第29页
共45页第30页
共45页第31页
共45页第32页
共45页第33页
共45页第34页
共45页第35页
共45页第36页
共45页第37页
共45页第38页
共45页第39页
共45页第40页
共45页第41页
共45页第42页
共45页第43页
共45页第44页
共45页第45页。
制药企业检验记录

制药企业检验记录制药企业检验记录是指制药企业在生产过程中进行产品质量控制的一种记录方式。
检验记录是制药企业生产过程中非常重要、必不可少的部分,这些记录有助于检验人员进行产品质量控制和监管,确保产品符合国家相关标准和质量要求。
在制药企业生产过程中,检验记录是一个非常重要的步骤。
检验记录可以用来追踪产品的过程和质量控制变化,防止任何污染和质量问题,提高整个过程的质量和生产效率。
制药企业工厂应该建立一个完整的检验记录系统,以便能够在需要的时候迅速找到必要的历史数据。
检验记录必须包含必要的信息和细节。
每个检验记录应当包括以下内容:检查日期、检查员姓名、产品名称、开始检查和结束检查时间、检查成果、检查方法、检查结果、进一步采取的措施等信息。
在检验记录中应记录所有样品的详细信息,以及是否符合质量标准,比如外观、裂纹、强度和化学成分等。
此外,检验人员应该将各个样品的入库时间进行记录,以便能够追溯记录。
检验记录必须保护好。
保护检验记录的方法是将它们放在定时过期的文档保管箱中,锁定保管箱。
此外,使用可视化文件保护设备以及建立加密访问和权限控制系统也可以提供额外的保护。
在生产流程结束后,需要对检验记录进行备份,并确保存档文件的质量和可访问性。
制药企业在进行产品质量控制的时候,首先需要使用标准检验方法来检测产品。
对于不符合标准要求的产物,需要对其进行原因分析,并采取有效措施,以避免质量问题和生产返工率。
另外,还应在整个生产过程中开展质量控制培训和检验人员专业知识的提高工作,来提高产品质量。
总之,制药企业需要严格控制产品的质量,检验记录是重要的质量控制过程之一。
通过建立有效的检验记录系统,可以减少生产中的差错,提高产品质量和效率。
在检验记录中要包含必要信息和细节,并且严格保护检验记录的安全以确保对其进行有序追溯。
只有这样,才能为制药企业的产品质量保障提供坚实保障。
制药公司批检验记录管理制度
XX制药GMP认证文件
一目的:保证兽药批检验记录的管理,明确质管部在检验过程中的任务和职责。
二适用范围:适用于质管部对检验全过程的控制与管理。
三责任者:质管部经理、化验员、质监员。
四正文:
1. 批检验记录包括该批产品所用原辅料及包装材料的检验情况登记表、请验单、半成品、
成品的检验记录及报告单、合格证等。
原辅料、包装材料的检验记录各自成档。
2.检验人员应按规定作好检验操作记录。
2.1 检验操作记录为检验所得数据、记录、运算等原始资料。
2.2 检验结果由检验人签字,另一检验员复核。
检验报告单由质量监督员、质管部经
理分别审核、签字后发放。
质管部要建立各项检验台帐。
2.3 检验操作记录、检验报告单须按批号保存三年或产品有效期后一年。
3.检验中要遵守的记录规则:
3.1 实测后填写所得到的实际数据,不得提前填写数据;要直接填写到记录本(或单)
上,不得誊抄。
要及时填写,不得试验后隔较长时间再填写。
3.2 质量标准中要求有数据的检验项目,检验后要填写被测数据,不要简单地填写“合
格”或“不合格”。
3.3 如果数据填写错误,修改时,要在错误的数字上划一横,并在错误数字的上方填
写正确的数字和签名,使错误的数字仍能被辨认清楚。
3.4 如果检验时操作失误,要实事求是填写失误原因,并应重新进行检验操作。
制药企业验证

四 验证的内容
• 清洗验证 • 检验方法验证 • 产品验证 • 原料药的生产验证 • 物料的验证 • 计算机验证
返回目录
五 怎么来做验证
• 验证工作基本程序
1、验证组织 • 根据不同的验证对象,分别组建由各有关部门人员
参加的验证小组。验证小组由企业验证总负责人, 即主管验证工作的企业领导人担任。 2、验证步骤 a.验证项目的立项
试验系指通过按草拟的标准操作规程(SOP) 进行单机或系统的运行试验, 俗称试车。运行确认是证明设 备或系统各项技术参数能否达到设定要求 的一系列活动。
应注意的几点: 1.计量器具检定/校准 2.功能测试 3.操作规程及培训 主要设备应制订相应的操作、清洗、日常维修SOP,这 些规程一般由设备的使用部门负责起草, 并由质量管理部门 批准。
就生产设备而言,性能确认系指通过系统联动试车的方法, 考察工艺设备运行的可靠性、主要运行参数的稳定性和运行结 果重现性的一系列活动。故其实际意义即指模拟生产。
返回目录
• PQ
性能确认中应注意以下各点: ①流量、压力和温度等监测仪器必须按国家技术监督部门
规定的标准进行校 验,并有校验证书; ②制订详细的取样计划、试验方法和试验周期,并分发到
返回目录
四 验证的内容
• 设备验证
目的 设备验证是指对设计、选型、安装及运行 等准确与否及对产品工艺适应性作出评估,以证实 是否符合设计要求。各企业应根据本企业生产品种、 剂型的不同,对主要设备进行设备验证。
片剂、胶囊剂、颗粒剂需要验证的主要设备有 上料器、混合制粒机、颗粒干燥机(一步制粒机)、 粉碎机、过筛机、混合机、压片机、包衣机、胶囊 填充机、包装机等。
返回目录
• VR
(2020版)药品片剂微生物限度检查法验证记录

(2020版)药品片剂微生物限度检查法验证记录文件编号:XXX-XX-XXXXXX制药有限责任公司XX年XX月XX日XX片微生物限度检查法标准起草说明XX片由XXXXXXXX药材制成,有XXXXX作用。
根据其用药途径和处方,应进行需氧菌总数、霉菌数和酵母菌总数的测定及控制菌大肠埃希菌检查。
本品参照2015版药典进行过方法适用性验证没有发现抑菌性,所以确定需氧菌总数、霉菌数和酵菌总数及大肠埃希菌采用常规法测定。
经对所采用的方法适用性进行试验,符合《中国药典》2020版四部1105非无菌产品微生物限度检查的微生物计数法和1106非无菌产品微生物限度控制菌检查法与1107非无菌药品微生物限度标准,方法可行。
XX片微生物限度检查法标准正文微生物限度:按微生物限度检查法(《中国药典》2020版四部1105非无菌产品微生物限度检查的微生物计数法和1106非无菌产品微生物限度控制菌检查法与1107非无菌药品微生物限度标准。
取样品10克,加PH7.0无菌氯化钠蛋白胨缓冲液稀释至100ml,制备成溶解均匀的1:10供试液。
需氧菌总数、霉菌与酵母菌总数取本品1:10供试液1ml,注皿,平行制备平皿(2个平皿需氧菌总数和2个平皿霉菌与酵母菌总数),按平皿法测定。
大肠埃希菌取本品1:10供试液10ml直接接至100ml胰酪大豆胨液体培养基中,依法检查。
《中国药典》非无菌制剂项下标准规定:需氧菌总数103cfu/g ; 霉菌和酵母菌总数102cfu/g ; 不得检出大肠埃希菌(1g)。
XX片生物限度检查方法适用性试验1、样品名称:XX片批号XXX、XXX、XXX2、验证用菌种:铜绿假单胞菌CMCC﹙B﹚10104、、枯草杆菌CMCC﹙B﹚63501、金黄色葡萄球菌CMCC﹙B﹚26003、白色念珠菌CMCC﹙F﹚98001、黑曲霉CMCC ﹙F﹚98003 大肠埃希菌CMCC﹙B﹚44102.3.实验方法:《中国药典》2015版四部微生物限度方法适用性检查验证实验。
药品生产企业GMP质量检验记录管理规定

质量检验记录管理规定建立检验记录的书写管理规程,规范记录的书写,保证原始性、真实性、准确性。
第一条:记录的书写要求1记录每页都应该签名和日期,记录应字迹清晰、内容真实、数据完整,记录及时不得超前和回忆记录,内容填写齐全、页码连续,不得留有空格,如无内容填时要用“─”表示,并签名,在每页的右上角标明连续的页码。
2应当在执行操作后立刻在所提供的空白处用不褪色墨水笔填写,不得使用铅笔和涂改液,所有的评论、注释均应使用不褪色墨水笔修改。
3记录应包括样品的基本信息及溶液的制备过程,这些信息要能表明分析人员是按照分析方法规定的程序进行的,所出现的偏差应及时记录。
对于开发的新方法,记录的内容能使其他人清楚地理解,过程的描述要能准确并条理清晰。
4检查数据时发现数据有错误可以划一条横线并写上日期和签名,并写上正确的,检验室对任何一次重新称样都要说明足够的理由。
5附在检验记录中的图谱、表格等,应在图谱和表格上写明检验记录的名称、批号及页码,以防止掉落还能找到相应的位置。
第二条:记录的内容1检测程序(如所用SOP编码)和简要的步骤2标准品的信息,包括:批号、来源、纯度/含量、有效期等。
3检测样品信息,包括:生产厂家、批号。
4检测仪器信息,包括:仪器型号、仪器编号、校验有效期。
5对于仪器的校验和使用记录(比如:PH计、卡尔费休滴定仪与天平),需要记录仪器的编号。
6所有的溶液、稀释液的配制应清楚记录,标准与样品的称重及稀释至最后的浓度。
例如:20mg→100mL;稀释10mL→100mL。
7如果使用已经配制的溶液来制备溶液,应在检验记录里写明溶液的来源索引,以便查找。
8重量与浓度应标上正确的单位,并有计算的公式和举例。
9记录溶液的PH值。
10色谱柱信息(如有),包括型号,编号等。
11环境温湿度(如有需要)。
第三条:检查项下各项书写细则1性状:记录样品的色泽、外观、嗅味,应根据实验中观察到的情况如实描述药品的外观,不可照抄标准上的规定。
制药企业全套检验记录()

制药企业全套检验记录背景制药企业作为医药行业的重要组成部分,需要对其生产的药品进行严格的检验,以确保药品的质量和安全性。
本文档旨在介绍制药企业进行全套检验时需要记录的内容和相关流程。
检验内容原材料检验制药企业生产药品所需的原材料需要进行检验,确保其符合相关标准和规定。
原材料检验应包括以下内容:•检查原材料的外观、颜色、气味等•检验原材料的纯度和含量•检验原材料是否存在重金属、农药等有害物质在制品检验在制品检验是指在药品生产过程中需要进行的检验,以确保生产过程中的质量控制得到有效实施。
在制品检验应包括以下内容:•检查在制品外观是否正常•检验在制品的含量和纯度是否符合要求•检验在制品中是否存在杂质等不良物质成品检验成品检验是指对制作成功的药品进行检验,以确保药品符合规定的质量标准。
成品检验应包括以下内容:•检查成品的外观、气味、口感等•检验成品中的含量和纯度是否符合要求•检验成品中是否存在杂质等不良物质检验记录制药企业进行全套检验时需要进行详细的记录,各类型记录的主要内容如下:原材料检验记录原材料检验记录应包括以下内容:•原材料名称、规格、批号等基本信息•检验时间和地点•检验方法和结果•检验员及其资质证书信息•药品质量标准在制品检验记录在制品检验记录应包括以下内容:•在制品名称、规格、生产批次等基本信息•检验时间和地点•检验方法和结果•检验员及其资质证书信息•药品质量标准成品检验记录成品检验记录应包括以下内容:•成品名称、规格、生产批次等基本信息•检验时间和地点•检验方法和结果•检验员及其资质证书信息•药品质量标准检验流程制药企业进行全套检验的流程应包括以下步骤:1.原材料检验2.制剂检验3.包装材料检验4.成品检验每一步的检验内容和记录均需严格按照标准和规定执行,并由专业人员进行管理和操作。
总结制药企业进行全套检验对于保证药品的质量和安全性具有重要作用。
在检验过程中需要注意各项检验内容和相关要求,并进行详细的检验记录,以确保药品质量得到有效保障。
生物制药公司批生产记录完整版

生物制药公司批生产记
录
HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】
XXXXXX有限公司XXXXX批生产记录
品名:
规格:
批号:
理论产量:
成品数:
成品率:
生产日期:
生产部审阅:
质管部审阅:
目录
填表日期:
开工前现场检查表
检查日期:年月
原料药一般生产区岗位清场记录
生产管理员: QA检查:
原料药一般生产区岗位清场记录
生产管理员: QA检查:
中间体检验报告单
检验单号:
原料药一般生产区岗位清场记录
生产管理员: QA检查:
原料药一般生产区岗位清场记录
生产管理员: QA检查:
生产管理员: QA检查员:
XXXXX脱保护基精制岗位生产记录(六)
原料药洁净区岗位清场记录
原料药洁净区岗位清场记录
批包装指令单
日期:
原料药洁净区岗位清场记录
生产管理员: QA检查:
原料药洁净区岗位清场记录
生产管理员: QA检查:
原料药包装岗位清场记录
生产管理员: QA检查:
产品生产检验报告单记录表
日期:年月日
生产管理员: QA检查员:
生产管理员: QA检查员:。
药品厂检报告

药品厂检报告
药品厂检验报告
报告编号:[填写编号]
报告日期:[填写日期]
报告人:[填写报告人]
一、检验目的
经过对[药品厂名称]的药品进行全面检验,以确定它们的质量是否符合相关标准和法规的要求。
二、检验依据
1. 国家药品监管法规;
2. 《药品质量管理规范》;
3. [药品厂名称]公司内部药品质量标准。
三、检验方法
1. 外观检查:对药品的颜色、形态、气味等进行检查;
2. 内容量检验:采用荧光分析法测定药品内含量;
3. 纯度检验:采用高效液相色谱法(HPLC)检测药品中的纯度;
4. 微生物检验:采用布氏杆菌检测法、大肠杆菌检测法、金黄色葡萄球菌检测法等进行微生物检测。
四、检验结果
经检测,[药品厂名称]生产的药品符合国家标准和公司内部标准,测试结果如下:
1. 药品外观:符合相关标准;
2. 药品内含量:符合相关标准;
3. 药品纯度:符合相关标准;
4. 微生物检验:符合相关标准。
五、检验结论
[药品厂名称]生产的药品检测结果良好,符合国家和公司标准要求,可以放心使用。
六、附录
1. 药品检测报告详见附件;
2. 药品质量标准详见附件。
报告人签名:日期:。
保健食品GMP质量体系RD00300片剂生产过程监督检查记录

保健食品GMP质量体系RD00300片剂生产过程监督检查记录日期:XXXX年XX月XX日检查人员:XXX一、设备检查1.检查前一批片剂生产所使用的设备清洁情况,未发现残留物或异物。
2.检查本次生产所使用的设备,设备表面无油污或尘埃,运转正常,无异常噪声。
二、操作人员检查1.检查操作人员穿戴情况,所有操作人员均佩戴统一工作服,无携带私人物品。
2.检查操作人员卫生状况,操作人员手部洗涤干净,无明显的伤口或湿润。
三、原辅材料检查1.核对原材料清单,与实际入库的原辅材料相符,无过期产品。
2.检查原辅材料的包装完整性,无破损、潮湿、霉变等情况。
3.取样检查原辅材料的外观、颜色、气味等指标,未发现异常情况。
4.查看原辅材料的存储条件,符合要求,无直接暴露在阳光下或湿度过高的情况。
四、生产过程检查1.检查称量操作,操作人员准确称取原辅材料,并记录称量值,计算准确无误。
2.检查混料操作,混料时间达到要求,操作人员按工艺要求进行搅拌,在此过程中无异常情况发生。
3.检查压片操作,操作人员按照规范操作,压片机压制平稳,片剂的外观整齐无碎裂,符合要求。
五、设备清洁检查1.检查制药设备的清洁状况,设备表面干净光滑,无残留物或污渍。
2.检查生产区域的清洁情况,地面、墙壁无污垢或粉尘,无异味。
六、记录检查1.检查生产记录完整性,记录齐全,无缺失。
2.检查操作人员的纪律性,记录的填写准确无误。
3.检查记录的签字、日期和审核人员,签字规范,日期和审核人员正确。
七、不合格品处理1.未发现生产过程中的不合格品。
2.若出现不合格品,按照相关制度进行处理,作记录并上报高层管理人员。
八、问题与改进1.本次检查未发现任何问题或改进建议。
2.若发现问题或改进建议,经过记录并上报高层管理层,跟踪处理情况。
本次监督检查中未发现任何不合规、不符合GMP质量体系的情况,片剂生产过程规范、设备清洁、操作人员卫生符合要求。
建议维持当前操作程序和设备状态,确保保健食品生产过程的GMP质量体系运行正常。
药品购进检查验收记录

药品购进检查验收记录日期:xx年 xx月 xx日
1. 药品名称:xxx
药品批号:xxx
药品规格:xxx
药品数量:xxx
药品厂家:xxx
2.药品购进检查验收情况:
-药品外包装是否完整:是/否
-药品有效期是否符合要求:是/否
-药品包装是否密封良好:是/否
-药品外观是否正常:是/否
-药品气味是否正常:是/否
-药品颜色是否正常:是/否
-药品状况是否符合规定:是/否
-药品存储条件是否符合规定:是/否
-药品相对湿度是否符合规定:是/否
-药品存放位置是否符合规定:是/否
-药品包装是否完好:是/否
-药品包装材料是否符合规定:是/否
-药品容器是否符合规定:是/否
3.药品购进检查验收结论:
-如果所有检查项都符合要求,请注明:经检查验收,药品完好,质量符合规定,可接收。
-如果有不符合要求的项,请注明:经检查验收,发现以下不符合要求的情况:(列出具体情况)。
根据采购合同,要求供应商整改并重新验收。
4.其他备注:
对未符合要求的药品情况,需要记录未符合要求的具体原因,并通知供应商进行整改并重新验收。
同时,对该批次药品进行特别标识,以示与其他符合要求的药品区别。
为确保药品质量安全,验收员应妥善保管检查验收记录和相关文件,并通知质控部门进行相关处理。
质控部门负责人签字:________________
验收员签字:________________。
GMP认证全套文件资料010-检验原始记录、检验报告书的管理规定

目的:建立检验原始记录与检验报告书的书写规定,促进质量管理的规范化。
适用范围:检验记录及报告书的书写及签章。
责任:检验人员对本规定的实施负责,检验室主任对本规定的有效执行承担监督检查责任。
内容:1.检验记录1.1检验记录是出具检验报告书的依据,应采用统一印制的表格,用蓝黑墨水书写,做到原始、真实、完整、清晰。
凡用微机打印的记录或图谱,应注明所检验的药品名称、批号和检验人。
1.2检验员在检验前,对检品的名称、规格、批号、数量、生产单位、检验日期、检验依据逐一记录:如无该项内容时,一律用“——”表示,不准空格。
1.3检品的名称应用法定标准的名称,不得简写,规格数量应注明单位,如“g”“mg”“ml”“kg”。
原料药规格可写“药用”、“原料药(供注射用)”。
1.4按检验顺序依次记录各检验项目的内容,如实验条件、简要操作步骤、实验现象、计算公式、检验数据、包括层析图、原始数据严禁事后补记。
记录不得随意涂改,如记录有误,可用单线划去,保持原字迹可辨,在修改处应签章以示负责,不得使用涂改液。
1.5鉴别项下,应将检验过程及现象大致描述,不应只写“依法检验,检出XX”或“依法检验呈正反应”。
1.6每个检验项目应写明标准规定的限度,并作单项结论(符合规定或不符合规定)。
1.7检验记录应字迹清晰、色调一致,书写正确(如1999年5月10日,不应写成99.5.10),不准漏项。
2.检验报告书2.1药品检验报告书是对药品质量作出的技术鉴定,是具有法律效力的技术文件。
要求数据准确无误,结论明确。
2.2报告书的首行应横向列出“检验项目”、“标准规定”、“检验数据”和“项目结论”四个栏目。
[性状]、[鉴别]、[检查]、[含量测定]项目名称需添加括号,每一个大项下所包含的具体检验项目名称和排列顺序应按照质量标准上顺序书写。
2.3外观性状的“标准规定”按质量标准的内容书写,“检验数据”按实物的真实情况描述。
2.4鉴别项下,凡属显色或沉淀反应的“标准规定”栏中应写“呈正反应”,“检验数据”栏中写“呈正反应”或“不呈反应”。
药剂科药品质量管理检查表

相关管理记录
1、温湿度记录是否完整。
2、近效期记录是否完整。
3、出入库记录是否完整.
4、报损记录是否完整.
5、调剂差错记录是否完整.
6、麻精空安瓿回收及销毁记录是否完整。
7、验收记录是否完整。
卫生管理
1、在岗人员是否穿戴整洁、佩戴胸卡。
2、手卫生是否符合规范。
3、摆药架是否整洁,药品外、墙角、窗台、电脑等无积尘。
6、中药药斗是否清洁,无散落药粉。
岗位检查
1、在岗人员是否按排班表上岗。
2、是否有迟到、早退、擅自离岗等行为。
处方调剂检查
1、有无用药交代,是否详尽。
2、药师审核、调配、发药程序是否符合规范。
药剂科药品质量与安全管理检查表
检查项目
检 查 细 项
检查结果
意见及整改措施
安全管理
1、门、窗、监控等安防设施是否正常
2、消防器材是否正常。
药品储存管理
1、药品存放是否符合规定
2、药品储存条件(避光、冷藏等)是否符合规定。
3、药品是否按“先产先出,近效先出”摆放.
4、摆药架有无过期、破损等药品.
5、中药材是否有质量问题(如虫蛀,霉变等)
3、中药分剂量是否按称量减重法,差异为±5%。
4、是否注明患者姓名、药名,用法用量、有效期、注意事项等
5、合理用药咨询服务情况
拆零药品管理
1、拆零药品区域是否整洁,无杂物
2、拆零用具(药匙、药袋等)是否洁净。
3、拆零药品是否标明药名、规格、效期等内容.
4、拆零记录是否完整。
检查人年月日
制药企业检验记录文本

制药企业检验记录文本制药企业检验记录文本是指在制药企业中,对药品和相关原材料进行检验的记录文本。
这些记录是制药企业质量控制体系的重要组成部分,用于确保产品的质量和安全性,并满足相关法规和标准的要求。
以下是一份制药企业检验记录文本的模板,包含了一般的内容要点:2.检验日期和相关人员信息:记录检验的日期和参与检验的人员的姓名及职位。
3.检验目的:明确本次检验的目的,例如检测药品的质量、确认原材料的合格性等。
4.检验项目和方法:列举需要检验的项目和采用的检验方法。
这些项目和方法应当符合相关法规和标准的要求。
5.检验设备和仪器:列举使用的检验设备和仪器的名称和型号。
同时,记录这些设备和仪器的校验和验证情况,确保其准确性和可靠性。
6.样品信息:记录样品的批次号、生产日期、有效期等信息。
7.检验结果:详细记录每个样品在每个检验项目上的结果。
结果应明确标示为合格或不合格,并记录具体数值或数据。
8.判定依据和标准:说明使用的判定依据和标准,以便确定检验结果的合格性。
9.异常情况和处理措施:如有不合格项目或异常情况出现,记录具体的情况,并列出相应的处理措施,以确保进一步的质量控制或调整。
10.检验记录的审核和批准:经过检验的记录需要由专责人员进行审核,并由企业负责人最终批准。
11.记录保存和归档:明确记录的保存方式和周期,以保证记录的完整性和可追溯性。
12.相关附件和资料:列举与检验相关的附件和资料,例如检验报告、分析报告等。
总结:一份完整的制药企业检验记录文本需要包含以上一些要点,以实现对制药过程的全面质量控制。
这些检验记录对于企业合规性和产品质量的保证至关重要,同时,也有助于企业在问题出现时进行调查和追溯,及时采取纠正措施。
制药企业应严格按照相关法规和标准的要求,确保检验记录的准确性、可靠性和有效性。
制药企业全套检验记录

制药企业全套检验记录制药企业的全套检验记录是非常重要的文件,用于记录产品的质量和符合标准要求的证据。
以下是一个示例制药企业的全套检验记录的一些建议内容:2.检验项目及方法:列出每个检验项目的名称和对应的检验方法。
例如,常规物理性质检验、化学成分分析、微生物学检验、药理学实验等。
3.标准与规范:附上适用的国家和行业标准,确保检验项目的执行与评估依据的一致性。
4.检验记录表格:使用表格记录每个检验项目的结果,包括数值和单位。
例如,药物含量、溶出度、颗粒度等。
5.不合格项处理记录:如果发现有检验项目结果超出了规定的标准范围,则应记录下不合格项的相关信息,包括异常的原因和可能的改进措施。
6.设备和仪器校准记录:记录每台使用的设备和仪器的校准日期、结果和校准过程。
确保检验结果的准确性。
7.检验员信息:记录进行检验的人员信息,包括姓名、资质和专业培训等。
8.检验环境条件记录:记录每个检验项目的实验室温度、湿度、光照条件等。
确保检验环境符合要求。
9.质量控制记录:记录每个批次产品的质量控制样本分析结果,确保产品的整体质量。
10.检验的测试数据和结果:确保检验结果的可靠性和一致性,所有的测试数据和结果应当被记录,并经过交叉核查。
11.签名和日期:每个检验记录都应包括相关人员的签名和日期,以证明其真实性和可追溯性。
12.文件管理和存档:确保所有的检验记录被妥善管理和存档,并按照规定的时间周期进行保存。
以上只是一个示例检验记录的一些基本内容,具体的全套检验记录应根据制药企业的具体要求和实际情况进行设计和制定。
在实际操作中,需要在检验过程中多次进行交叉核查和记录验证,以确保检验过程的准确性和可靠性。
同时,制药企业还应制定相关的质量管理和质量保证体系文件,确保检验过程的合规性和可持续性。
制药企业全套检验记录(DOC)

********药业有限公司物料检验记录纸编码:XJJL/QC00102 版本:A/0检验人:复核人:性状、外观、重(装)量差异检验原始记录编码:XJJL/QC00202 版本:A/0检验人:复核人:崩解时限(溶散时限)检验原始记录检验人:复核人:水分测定检验原始记录检验人:复核人:卡尔费休水分测定检验原始记录检验人:复核人:重金属检验原始记录检验人:复核人:砷盐检查法原始记录检验人:复核人:生物显微镜检验原始记录编码:XJJL/QC00802 版本:A/0检验人:复核人:薄层色谱法检验原始记录编码:XJJL/QC00902 版本:A/0检验人:复核人:微生物限度检验原始记录编码:XJJL/QC01002 版本:A/0检验人:复核人:高效液相色谱法原始记录编码:XJJL/QC01102 版本:A/0检验人:复核人:气相色谱法原始记录编码:XJJL/QC01202 版本:A/0检验人:复核人:红外鉴别原始记录编码:XJJL/QC01302 版本:A/0原子吸收分光光度法检验原始记录编码:XJJL/QC01402 版本:A/0检验人:复核人:紫外-可见分光光度法检验原始记录编码:XJJL/QC01502 版本:A/0陕西香菊药业集团有限公司物料检验报告单编码:XJJL/QC01602 检字()号陕西香菊药业集团有限公司半成品检验报告单编码:XJJL/QC01702 检字()号检验人:复核人:陕西香菊药业集团有限公司成品检验报告书编码:XJJL/QC01802 版本:A/0质检负责:复核:检验:物料检验台账外包装材料检验台账半成品、成品检验台账化学试剂分类收发台账仪器使用情况记录仪器维护保养记录计量器具使用情况记录对照品、标准品、对照药材分类收发台账滴定液、标准液、检定菌分发记录培养基分类收发台账溶液、试液配制记录溶液、试液配置记录标准溶液配制记录标准溶液配制记录滴定液配制标定记录培养基配制记录培养基配制记录消毒剂、清洁剂配制记录检定菌使用记录检定菌传代接种记录生化培养箱使用记录高压灭菌锅使用记录微生物限度检查室清洁、消毒记录无菌衣清洁消毒记录传递窗清洁记录进入微生物限度检查室器皿、用具清洁消毒记录空气净化系统滤袋清洁、更换记录编码:XJJL/QC04202 版本:A/0空调运行记录清洁记录。
制药企业生产及管理相关标准和制度-检验记录管理制度

检验记录管理制度
目的:建立一个检验记录管理制度。
范围:所有检验记录的管理。
责任人:检验员、复核员、检测中心负责人。
内容:
1 .检验员按规定把检验内容逐项进行填写好。
2 .记录的内容要真实,把所得到的性状如实地写清楚,语言简骇明白。
3 .做到一切检验用数据说话,保持记录的正确性,严密性,全面性和可靠性。
4 .记录完整,字迹端正,不能有涂改,如确要涂改,应在改动的地方画一横线并签全名,写上日期。
5 .记录要及时,不得事后靠回忆或超前记录。
6 .严格执行检验复核制度。
7 .记录完毕交检测中心负责人保管,以备必要时查阅。
药品检验报告模板_胶囊剂
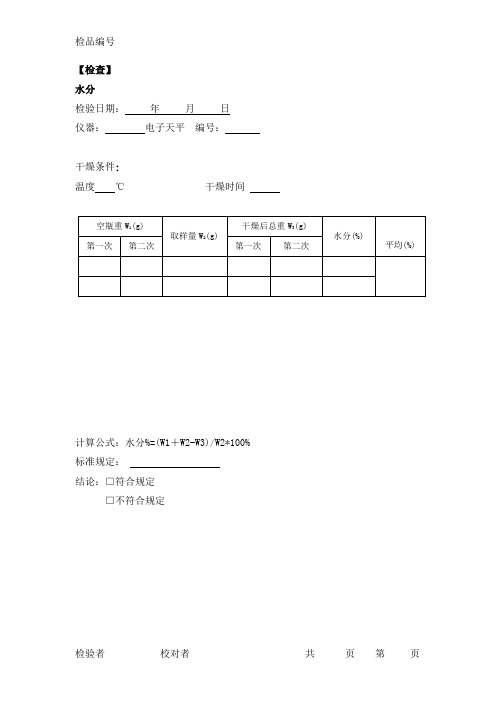
水分
检验日期:年月日
仪器:电子天平编号:
干燥条件:
温度℃干燥时间
计算公式:水分%=(W1+W2-W3)/W2*100% 标准规定:
结论:□符合规定
□不符合规定
检验日期:年月日温度: ℃湿度: %
仪器:电子天平编号:
取供试品10粒,结果:
标示装量:
平均装量:
限度:标示装量(或平均装量)的±10%
上限: ×(1+ %)=
下限: ×(1- %)=
10粒的情况:
标准规定:每粒装量与平均装量相比较,超出装量差异限度的不得多于2粒,并不得有1粒超出装量差异限度1倍。
结论:□符合规定
□不符合规定
崩解时限
检验日期:年月日温度: ℃湿度: %
仪器:ZBS-6E崩解时限仪编号:YWH-003
溶剂:溶剂温度: ℃
是否加挡板□是□否
崩解时间:分钟
崩解情况:片均在分钟内全部崩解
标准规定:□硬胶囊应在30分钟内全部崩解
□软胶囊应在1小时内全部崩解
□肠溶胶囊先不加挡板在盐酸溶液(9→1000)中检查2小时,每粒的囊壳均不得有裂缝或崩解现象,继加入挡板在人工肠液中检查,1小时内应全部崩解
结论:□符合规定
□不符合规定
微生物限度见微生物限度检查表。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
********药业有限公司物料检验记录纸编码:XJJL/QC00102版本:A/0检品名称批号检品编号检验目的收验日期检验依据请验单位批量检品数量检验项目报告日期检验人:复核人:□性状、外观、重(装)量差异检验原始记录编码:XJJL/QC00202版本:A/0样品名称规 格 温度批 号数 量相对湿度样品编号检验日期报告日期检验依据性状外观□中国药典 2010 年版 部附录( )□其他天平型号仪器编号检验项目标示量□重量差异装量差异 最低装量差异限度 ±%g ~ g ± %g ~ g重(装)量差异实测结果标准规定平均重量超出重量差异限度的不得多于2 份,并不得有 1 份超出限度 1 倍。
不少于标示装量的 %超出装量差异限度的不得多于 2 份,并不得有 1 份超 出限度 1 倍。
结 论□ (均)符合规定 □ (均)不符合规定检验人: 复核人:崩解时限(溶散时限)检验原始记录编码:XJJL/QC00302版本:A/0样品名称规格温度批号数量相对湿度样品编号检验日期报告日期检验项目崩解时限□溶散时限□中国药典2010年版一部附录ⅫA/二部附录ⅩA检验依据□其他仪器型号仪器编号筛网直径0.42mm□1.0mm□2.0mm□其他□水□0.1mol/L盐酸□人工胃液介质□其他挡板加□不加水浴温度(℃)实测结果在分钟内均崩解(溶散)完全。
□其他标准规定应在________分钟内崩解(溶散)完全。
结论(均)符合规定□(均)不符合规定检验人:复核人:水分测定检验原始记录编码:XJJL/QC00402版本:A/0样品名称规格温度批号数量相对湿度样品编号检验日期报告日期检验依据□中国药典2010年版一部附录ⅨH/二部附录ⅧM□其他仪器型号天平型号干燥条件仪器编号仪器编号温度:℃干燥时间□小时□至恒重测定编号称量瓶恒重W(g)样品称重W1(g)干燥后恒重或称重W2(g)水分(%)□烘干法计算公式样品称重W(g)水分(%)=(W+W1-W2)/W1×100%水的体积V(ml)水分(%)□甲苯法计算公式水分(%)=V/W×100%仪器型号□快速水分测定法干燥条件水分(%)仪器编号温度:℃干燥时间□□15分钟30分钟标准规定结论(均)符合规定□(均)不符合规定检验人:复核人:卡尔费休水分测定检验原始记录编码:XJJL/QC00502版本:A/0样品名称规格温度检验依据仪器型号天平型号批号数量相对湿度□中国药典2010年版二部ⅧM第一法A□其他仪器编号仪器编号样品编号检验日期报告日期取样量(mg)消耗滴定液体积(ml)滴定度(mg/ml)费休氏试剂标定平均值:mg/ml RSD:样品编号取样量(g)消耗滴定液体积(ml)结果(%)平均值(%)标准规定结论□(均)符合规定□(均)不符合规定检验人:复核人:重金属检验原始记录编码:XJJL/QC00602版本:A/0样品名称规格温度批号数量相对湿度样品编号检验日期报告日期检验依据□中国药典2010年版一部附录IXE/二部附录VⅢH□其他天平型号天平编号□A中国药典2010年版一部附录IX E/.二部附录VIII H标准铅溶液浓度:含Pb10μg/ml□第一法:取25ml纳氏比色管支,甲管中加标准铅溶液ml与醋酸盐缓冲液(Ph3.5)2ml,加稀释成25ml,乙管中加入按各品种项下规定的方法制成的供试品溶液25ml,丙管中加入与乙管相同量的供试品,加配制供试品溶液的溶剂适量使溶解,再加与甲管相同量的标准铅溶液与醋酸盐缓冲液(pH3.5)2ml后,用溶剂稀释成25ml;若供试品溶液带颜色,可在甲管中滴加少量的稀焦糖溶液或其他无干扰的有色溶液,使之与乙管、丙管一致,再在甲、乙、丙三管中分别加硫代乙酰胺试液各2ml,摇匀,放置2分钟,同置白纸上,自上向下透视,当丙管中显出的颜色不浅于甲管时,乙管中显示的颜色与甲管比较,不得更深。
如丙管中显出的颜色浅于甲管,应取样按第二法重新检查。
检验方法与操作步骤如在甲管中滴加稀焦糖溶液或其他无干扰的有色溶液,仍不能使颜色一致时,应取样按第二法检查。
供试品如含高铁盐影响重金属检查时,可在甲、乙、丙三管中分别加入相同量的维生素C0.5~1.0g,再照上述方法检查。
配制供试品溶液时,如使用的盐酸超过1ml,氨试液超过2ml,或加入其他试剂进行处理者,除另有规定外,甲管溶液应取同样同量的试剂置瓷皿中蒸干后,加醋酸盐缓冲液(pH3.5)2ml与水15ml,微热溶解后,移置纳氏比色管中,加标准铅溶液一定量,再用水或各品种项下规定的溶剂稀释成25ml。
□第二法:□a:取炽灼残渣项下遗留的残渣,加硝酸0.5ml,蒸干,至氧化氮蒸气除尽后,放冷,加盐酸2ml,置水浴上蒸干后加水15ml,滴加氨试液至对酚酞指示剂现中性,再加醋酸盐缓冲液(pH3.5)2ml,微热溶解后,移置纳氏比色管中,加水稀释成25ml;另取配制供试品溶液的试剂,置瓷皿中蒸干后,加醋酸盐缓冲液(pH3.5)2ml与水15ml,微热溶解后,移置纳氏比色管中,加标准铅溶液ml,再用水稀释成25ml;照上述第一法检查。
□b:取供试品适量(见称量数据中),缓缓炽灼至完全炭化,放冷,加硫酸ml,使恰润湿,用低温加热至硫酸除尽后,加硝酸0.5ml,蒸干,至氧化氮蒸气除尽后,放冷,再500-600℃炽灼使完全灰化,自“放冷,加盐酸2ml,…”起,同a法操作。
□第三法:取本品适量(见称量数据中),加氢氧化钠试液5ml与水20ml溶解后,置纳氏比色管中,加硫化钠试液5滴,摇匀,与标准铅溶液ml经同样处理后的颜色比较。
检验方法与操作步骤称量数据与供试品溶液制备实测结果标准规定结论□供试品管中所显颜色于甲管(标准管)。
□供试品溶液所生成的铅斑于标准铅斑。
□其他:□供试品管所显颜色与甲管(标准管)比较,不得更深。
(含重金属不得过)□其他:□(均)符合规定□(均)不符合规定检验人:复核人:砷盐检查法原始记录编码:XJJL/QC00702版本:A/0样品名称规格温度批号数量相对湿度样品编号检验日期报告日期检验依据中国药典2010年版一部附录ⅨF/二部附录ⅧJ□其他仪器型号天平型号操作步骤仪器编号仪器编号□A:中国药典2010年版一部附录ⅨF/二部附录ⅧJ标准砷溶液:含As1μg/ml□第一法:取供试品适量(见称量数据)置A瓶中,加盐酸5ml,水21ml,再加碘化钾试液5ml与酸性氯化亚锡试液5滴,在室温放置10分钟后,加锌粒2g,立即将准备好的导气管C密塞于A瓶上,并将A瓶置25~40℃水浴中反应45分钟,取出溴化汞试纸,即得。
标准砷斑制备精密量取标准砷溶液ml,置A瓶中,加盐酸5ml 与水21ml,自“加碘化钾试液5ml”起同法操作,即得。
将供试品砷斑与标准砷斑进行比较。
□第二法:取供试品适量(见称量数据)置A瓶中,加盐酸5ml,水21ml,加碘化钾试液5ml与酸性氯化亚锡试液5滴,在室温放置10分钟后,加锌粒2g,立即将准备好的导气管C与A瓶密塞,使生成的砷化氢气体导入D管中,并将A瓶置25~40℃水浴中反应45分钟,取出D管,添加氯仿至刻度,混匀,即得。
标准砷对照液的制备精密量取标准砷溶液ml,置A瓶中,加盐酸5ml与水21ml,自“加碘化钾试液5ml”起同法操作,即得。
□将供试品溶液与标准砷对照液同置白色背景上,从D管上方向下观察,比较。
□将供试品溶液转移置1cm吸收池中,在510nm波长处测定吸收称量数据及供试品按操作步骤操作溶液制备□取本品置坩埚中,用小火炽灼至炭化,置500~600℃炽灼使完全灰化,从“加水至21ml,盐酸5ml…”起,按操作步骤操作。
实测结果标准规定□第一法:供试品溶液所产生的砷斑于标准砷斑。
□第二法:□供试品溶液所显颜色于标准砷对照液。
□供试品溶液测得的吸收度于标准砷对照液测得的吸收度。
标准砷对照液吸收度:供试品溶液测得的吸收度:□第一法:供试品溶液所产生的砷斑应不深于标准砷斑。
(限度)□第二法:□供试品溶液所显颜色应不深于标准砷对照液。
(限度)□供试品溶液测得的吸收度应不大于标准砷对照液测得的吸收度。
(限度)结论(均)符合规定□(均)不符合规定检验人:复核人:生物显微镜检验原始记录编码:XJJL/QC00802版本:A/0样品名称规格温度检验依据批号数量相对湿度样品编号检验日期报告日期仪器型号放大倍数(目镜×物镜)制作方法仪器编号□10×10倍,目镜量尺每一小格相当于μm□10×20倍,目镜量尺每一小格相当于μm□10×40倍,目镜量尺每一小格相当于μm□10×100倍,目镜量尺每一小格相当于μm□横切片或纵切片□粉末制片□表面制片□解离组织制片□磨片制片□水合氯醛试液□甘油醋酸试液□氢氧化钾液□甘油乙醇试液实测结果标准规定结论(均)符合规定(均)不符合规定检验人:复核人:薄层色谱法检验原始记录编码:XJJL/QC00902版本:A/0样品名称规格温度批号数量相对湿度样品编号检验日期报告日期检验项目检验依据展开剂□鉴别□检查(项目名称:)□含量测定□中国药典2010年版一部附录ⅥB□中国药典2010年版二部附录ⅤB□其他固定相天平型号仪器编号供试品溶液的制备对照品/药材溶液的制备对照品/药材批号点样量检出条件□日光下□紫外光下nm □碘蒸汽熏蒸□其他标准规定点样编号:1.2.3.4.5.6.结果结论□(均)符合规定□(均)不符合规定检验人:复核人:对照10BL增菌MUG-Indole镜检IMVic乳糖微生物限度检验原始记录编码:XJJL/QC01002版本:A/0样品编号样品名称批号规格取样量检验日期供试液制备方法温度相对湿度请验单位检验目的检验依据报告日期细菌数:常规法□稀释法□离心沉淀集菌法□薄膜过滤法□中和法□霉菌酵母菌数:常规法□稀释法□离心沉淀集菌法□薄膜过滤法□中和法□大肠埃希菌检查:常规法□检查结果项目细菌数霉菌酵母菌数平稀(30-35℃,培养时间72小时)(23--28℃,培养时间120小时)板释数度原液10-110-210-3阴性原液10-1-210-3阴性对照1234平均值菌落数(cfu/g或ml)大肠埃希菌检查(30-35℃)供试液EMB或MacC 制备平板染色发酵培养时间阴性对照阳性对照供试品18-24h18-24h18-24h18-24h24-48h24-48h结论:检出□未检出大肠菌群检查(30-35℃,18-24h)供试品的检出结果0.1g或0.1ml0.01g或0.01ml0.001g或0.001ml 可能的大肠菌群数N(个/g或ml)阴性对照注:+检出大肠菌群-未检出大肠菌群结论:检出□未检出沙门氏菌检查肉汤增菌四硫磺酸钠亮绿胆盐硫乳或Macc平板三糖铁琼脂斜面培养时间18-24h阴性对照阳性对照供试品结论:检出□未检出活螨检查18-24h18-24h18-24h方法结果其他检验方法:直接法漂浮法分离法结论(均)符合规定□(均)不符合规定检验人:复核人:高效液相色谱法原始记录编码:XJJL/QC01102版本:A/0样品名称规格温度批号数量相对湿度样品编号检验日期报告日期检验项目检验依据仪器名称天平型号□鉴别□检查(项目名称:)□含量测定□其他□中国药典2010年版一部附录ⅥD/二部附录ⅤD□其他仪器编号天平编号色谱柱固定相类型:□C18□C8□TMS□CN□NH2□Si□其他()色谱柱编号:____粒径:____μm_____×_____mm 柱温:_____℃预柱:□紫外检测器:_____nm□其他检测器:流动相组成:□恒比例:色谱条件梯度洗脱:流速:_____ml/min进样量:_____μl衰减:_____灵敏度:_____纸速:_____系统适用理论板数(N):_______拖尾因子:_______性分析方法分离度(R):_______容量因子:_______□外标法□内标法□归一化法□其他()对照品溶液的制备及校正因子供试品溶液的制备计算公式实测结果标准规定结论□(均)符合规定□(均)不符合规定检验人:复核人:□ □气相色谱法原始记录编码:XJJL/QC01202版本:A/0样品名称规格温度批 号数 量相对湿度样品编号检验日期报告日期检验项目检验依据仪器名称天平型号载气类型□鉴别 □检查(项目名称: ) □含量测定 □其他□ 中国药典 2010 年版一部附录ⅥE /二部附录ⅤE □ 其他仪器编号仪器编号□氮气 □氦气 □其他( )顶空进样法 顶 空 瓶 加 热 温 度 : ______ ℃ 定量管温度: ______ ℃进 样 方psi 传输管温度:_____ ℃ 顶空瓶压力控制值:______顶空瓶加热平衡时间:______ min式色 谱 条 件□溶液法 进样体积:_____ μl 进样口温度:_____ ℃□不分流 分流 分流比 _____:1□毛细管柱 □不锈钢填充柱 □玻璃填充柱柱编号: 柱长:_____ m 柱内径:_______ mm 担体名称 : _________________________固定液名称: _________________________ 固定液膜厚度: _____ μm涂布浓度: 柱温:□恒温 温度:_____ ℃ □ 程序升温:分析模式□恒流 :_______ ml/min □恒压: _______ psi□其它:()衰减:_____ 灵敏度:_____检测器信息栏□FID□TCD□ECD□μ-ECD□NPD检测器温度:______℃氢气:______ml/min空气:______ml/min尾吹气或柱气流+尾吹气:________ml/min参比气:________ ml/min系统适用性理论板数(n):_______拖尾因子(T):_______分离度(R):_______分析方法对照品溶液的制备及校正因子供试品溶液的制备□外标法□内标法□归一化法□其他()计算公式实测结果标准规定结论□(均)符合规定□(均)不符合规定检验人:复核人:红外鉴别原始记录编码:XJJL/QC01302版本:A/0样品名称规格温度批号数量相对湿度样品编号检验日期报告日期检验依据仪器型号扫描次数□中国药典2010年版一部附录ⅤC/二部附录ⅣC □其他仪器编号前处理试样制备压片法(□溴化钾□氯化钾)□糊法□膜法方法□溶液法:溶剂________池厚____mm□________红外光谱图___与《药品红外光谱集》第___卷()收载的的红外光谱图基本一致。
