高三化学镁和铝
镁和铝
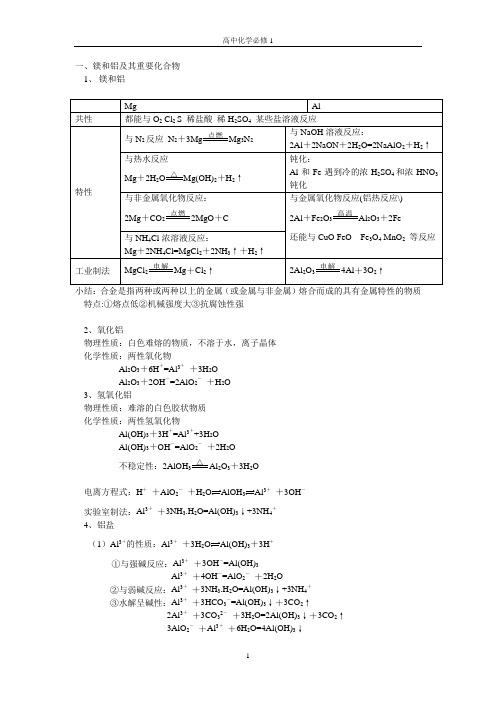
一、镁和铝及其重要化合物1、镁和铝特点:①熔点低②机械强度大③抗腐蚀性强2、氧化铝物理性质:白色难熔的物质,不溶于水,离子晶体化学性质:两性氧化物Al2O3+6H+=Al3++3H2OAl2O3+2OH-=2AlO2-+H2O3、氢氧化铝物理性质:难溶的白色胶状物质化学性质:两性氢氧化物Al(OH)3+3H+=Al3++3H2OAl(OH)3+OH-=AlO2-+2H2O△不稳定性:2AlOH3Al2O3+3H2O电离方程式:H++AlO2-+H2O33++3OH-实验室制法:Al3++3NH3.H2O=Al(OH)3↓+3NH4+4、铝盐(1)Al3+的性质:Al3++3H2O Al(OH)3+3H+①与强碱反应:Al3++3OH-=Al(OH)3Al3++4OH-=AlO2-+2H2O②与弱碱反应:Al3++3NH3.H2O=Al(OH)3↓+3NH4+③水解呈碱性:Al3++3HCO3-=Al(OH)3↓+3CO2↑2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑3AlO2-+Al3++6H2O=4Al(OH)3↓总结:AlCl 3溶液滴加到NaOH 溶液中开始无沉淀后有沉淀NaOH 溶液滴加到AlCl 3溶液中先出现沉淀后沉淀溶解 (2)AlO 2-的性质AlO 2- +2H 2O=Al(OH)3↓+OH - ① 与强酸反应: AlO 2- +H +(少量) +H 2O=Al(OH)3↓ AlO 2-+4H + (过量)=Al 3+ +H 2O②与弱酸反应:AlO 2-+CO 2+2H 2O=Al(OH)3↓+HCO 3-③与水解呈酸性的物质反应:3AlO 2- +Al 3+ +6H 2O=4Al(OH)3↓3AlO 2- +Fe 3+ + 6H 2O=3Al(OH)3↓+Fe(OH)3↓总结:将HCl 滴加到NaAlO 2中先出现沉淀后溶解 将NaAlO 2滴加到HCl 中开始无沉淀后有沉淀 (3)明矾2KAl(SO 4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO 4+K 2SO 4 KAl(SO 4)2+2Ba(OH)2=2BaSO 4↓+KAlO 2+H 2O小结:Al 3+AlOH 3AlO 2AlOH 3Al 3+ 未知溶液白色沉淀白色沉淀溶解,从而未知溶液中含Al 3+未知溶液白色沉淀白色沉淀溶解,从而未知溶液含AlO 2-二、铁及其重要化合物1、铁:第四周期第Ⅷ族 26号元素 各层电子数为2 8 14 2 常见价态+2和+3(1)与弱氧化剂反应 Fe Fe 2+ S +Fe I 2+Fe 2(2)与强氧化剂反应Fe Fe 3+ 3Cl 2+2Fe=2FeCl 3 3Br 2+2Fe 3稀硝酸:Fe +4HNO 3=Fe(NO 3)3+2NO ↑+2H 2O 3Fe +8HNO 3=3Fe(ON 3)3+2NO 2↑+4H 2O特殊:3Fe +2O 23O 4 3Fe +4H 2O 3O 4+4H 2↑2、 氧化物 FeO :黑色固体不溶于水,在空气中加热会生成Fe 3O 4Fe 2O 3:红棕色固体不溶于水,俗称铁红、铁锈,可做红色染料 Fe 3O 4:黑色固体不溶于水,俗称磁性氧化铁3、 氢氧化物Fe(OH)2 白色沉淀迅速变成灰绿色,最后变成红褐色 4Fe(OH)2+O 2+2H 2O=4Fe(OH)3Fe(OH)3:红褐色沉淀 具有不稳定性,受热易分解2FeOH 3Fe 2O 3+3H 2O4、Fe 2+ Fe 3+的盐 (1)Fe 2+的性质 ①颜色:浅绿色△高温点燃△△△过量HClHCl 过量NaOH H +H +OH - OH -②易水解:Fe2++2H2O2+2H+如何保存FeSO4溶液:加几滴稀硫酸或加铁粉③强还原性:与O2Cl2Br2HNO3浓H2SO4KMnO4酸性溶液反应Fe2+检验:①加碱法(NaOH或氨水)②先加KSCN溶液,无现象再加氨水会出现血红色(2)Fe3+的性质①颜色:棕黄色②易水解:Fe3++3H2O3+3H+Fe3++3HCO3-=Fe(OH)3↓+3CO2↑(与CO32-AlO2-也双水解) ③强氧化性:氧化S2-I-SO2SO32-Cu Fe2Fe3++2S2-=2Fe2++2S↓2Fe3++2I-=2Fe2++I2 (Fe3+能使湿润的淀粉KI试纸变蓝)2Fe3++Cu=2Fe2++Cu2+④络合性:KSCN溶液--血红色Fe3++3SCN-=Fe(SCN)3↓⑤制Fe(OH)3胶体:FeCl3+3H2O=Fe(OH)3胶体+3HCl⑥与苯酚显紫色⑧Fe3+检验:溶液加碱法加苯酚法。
新课标高考化学知识点详解 第9讲 镁、铝及其重要化合物.

第9讲镁、铝及其重要化合物考点1 Mg 、Al 的化学性质1.与非金属反应(1与O 2反应。
常温下与空气中的O 2反应生成一层致密的氧化物薄膜,所以镁、铝都有抗腐蚀的性能。
镁、铝都能在空气中燃烧: 。
(2与卤素单质、硫等反应。
Mg+ Cl 2 2Al+ 3Cl 2 2Al+ 3S (用于工业制备 Mg+ S2Mg 、A1和冷水都不反应,但在加热条件下与水反应生成氢氧化物和氢气Mg+2H 2O 2A1+6H 2O3.与酸反应置换出H 2Mg 、A1与浓、稀盐酸、稀硫酸、磷酸等酸反应置换出H 2,其中铝在冷浓 H 2SO 4,冷浓硝酸中发生钝化现象。
所以用铝制容器贮存冷的浓硫酸或浓硝酸。
4.与某些氧化物反应(2铝热反应:2Al+ Fe 2O 3铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V 、Cr 、等。
5.与碱反应镁不与碱反应,铝与碱液反应: 。
[例1]用铝箔包装0.1mol 金属钠,用针扎出一些小孔,放入水中,完全反应后,用排水集气法收集产生的气体,则收集到的气体为(标准状况 (A .O 2和H 2的混合气体B .1.12L H 2C .大于1.12LH 2D .小于1.12L H 2[解析]Na 与水反应放出H 2,并且生成NaOH ,铝能与NaOH 溶液反应,也生成H 2,故最后收集到的气体是这两部分H 2总和,显然比Na 单独反应产生的H 2多。
2Na+2H 2O 2NaOH +H 2↑ 2A1+6H 2O 2A1(OH3+3H 2↑ 0.1mol 0.1mol 0.05mol 0.1mol 0.15mol 若铝箔足量,共生成H 2:0.05mol +0.15mol =0.2molV (H 2=0.2mol ×22.4mol /L =4.48L 。
[答案]C2Mg+O 22MgO 2Mg 22MgO+C[规律总结]铝和强碱溶液反应,不是铝直接和碱反应,而是铝先和强碱溶液中的水反应生成Al(OH3,然后Al(OH3再和强碱反应生成偏铝酸盐。
高三化学镁和铝(201912)

HCl NaOH
Mg(OH)2+2H+= Mg2++2H2O
不反应
加热分解
Mg(OH)2
MgO+H2O
Al3++3NH3·H2O= Al(OH)3↓+3NH4+
Al(OH)3+3H+= Al3++3H2O
Al(OH)3+OH-= AlO2-+2H2O
2Al(OH)3 Al2O3+ 3H2O
; https:///p/f6a077475319 修改征信报告
镁和铝
MgO
状态熔点 白色粉末 2800℃
溶解性 微溶于水
类别
碱性氧化物
Al2O3
白色粉末 2045℃ 难溶于水 两性氧化物
H2O
MgO +H2O=Mg(OH)2 不反应
HCl
MgO+2HCl=
Al2O3+6HCl =
MgCl2+H2O
2AlCl3+ 3H2O
NaOH 不反应 工业制法 MgCO3
MgO+CO2
Al2O3+2NaOH = 2NaAlO2+H2O
铝土矿中提取
用途
耐火材料
耐火材料 电解铝的原料
状态
Mg(OH)2 白色粉末
溶解性类别 难溶于水 中强碱
Al(OH)3 白色胶状 难溶于水两性氢氧化物
电离
H++AlO2-+H2O
Al(OH)3
Al3++3OH-
实验室制法 Mg2++2OH-= Mg(OH)2
;
在意的事情太多,对美国1300名百万富翁进行了调研。那一串数字再也用不着默诵了。外面各种寻欢作乐的场所和玩意也都和我无关 你开
高三化学镁和铝

高三化学; 镁、铝及其化合物一、镁和铝的复习 1. 镁和铝的性质镁铝周期表中位置第三周期ⅡA 族第三周期ⅢA 族金属性镁强于铝结构单质还原性镁强于铝物理性质共性:密度小熔点较低,硬度较小银白色金属.不同点:Al 的上述性质都比镁略高.1.跟O 2及其它非金属反应2Mg+O 2点 燃2MgO3Mg+N 2点 燃Mg 3N 24Al+3O 2点 燃2Al 2O 32Al+3S ∆Al 2S 32.跟某些氧化物2Mg+CO 2点 燃2MgO+C 2Al+Fe 2O 3 ∆2Fe+Al 2O 3 (铝热反应)3.跟水反应Mg+2H 2O ∆Mg(OH)2+H 2↑(冷水慢,沸水快)很难反应4.跟酸的反应Mg+2H+Mg 2++H 2↑2Al+6H +2Al 3++3H 2↑(在浓H 2SO 4、浓HNO 3中钝化)化学性质5.跟碱反应不反应2Al+2NaOH+2H 2O 2NaAlO 2+3H 2↑用途:制各种轻质合金制各种合金、导线、铝箔、铝热剂制法:电解熔融氯化镁电解熔融三氧化二铝铝与强碱溶液反应的实质;Al 与水很难反应,且生成的Al(OH)3附在Al 的表面,阻止了Al 继续反应,但强碱NaOH 能溶解Al(OH)3,故可促使Al 与强碱液反应,而弱碱如氨水,不溶解Al(OH)3,故Al 在弱碱溶液中不反应。
2. 镁和铝的氧化物的主要性质(1) MgO 具有 性氧化物的性质,写出相关的化学方程式(2)Al 2O 3具有 性氧化物的性质,写出相关的化学方程式3. 镁和铝的氢氧化物的主要性质(1)Mg (OH )2具有 性,写出相关的化学方程式(2)Al (OH )3具有 性,写出它的电离方程式4. 重要的铝盐:明矾:十二水合硫酸铝钾[KAl(SO 4)2·12H 2O]a . 结构:硫酸铝钾是由两种不同的金属离子和一种酸根离子组成的化合物,它电离时能产生两种金属的阳离子,是一种复盐。
高三化学总复习 镁、铝及其重要化合物

第2讲镁、铝及其重要化合物复习目标知识建构1.结合真实情景中的应用实例或通过实验探究,了解镁、铝及其重要化合物的主要性质,了解其在生产、生活中的应用。
2.结合实例认识金属性质的多样性,了解通过化学反应可以探索物质性质、实现物质的转化,认识物质及其转化在自然资源综合利用和环境保护中的重要作用。
一、镁、铝1.原子结构和存在(1)原子结构:镁、铝原子结构示意图分别为和,分别位于元素周期表的第三周期ⅡA族和ⅢA族。
(2)存在:在自然界中均以化合态的形式存在,铝是地壳中含量最多的金属元素。
2.单质的物理性质(1)相同点:均为银白色有金属光泽的固体,有良好的延展性、导电性和导热性等,密度、硬度均较小。
(2)不同点:铝的熔点比镁高,硬度比镁大。
3.单质的化学性质镁铝4.镁、铝的冶炼(1)Mg :化学方程式 MgCl 2(熔融)=====电解Mg +Cl 2↑; (2)Al :化学方程式2Al 2O 3(熔融)=====电解冰晶石4Al +3O 2↑。
【判一判】 判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)工业上制造镁粉时,可将镁蒸气在N 2中冷却( )(2)相同质量的镁条分别在足量的CO 2和O 2中完全燃烧,所得固体的质量相同( )(3)冶炼铝时常用焦炭作还原剂()(4)铝与少量NaOH溶液反应得到铝盐,与足量NaOH溶液反应生成偏铝酸盐()(5)铝制餐具可长时间存放酸性或碱性食物()(6)镁在空气中燃烧的产物固体只有MgO()答案(1)×(2)×(3)×(4)×(5)×(6)×二、镁、铝的重要化合物1.MgO与Al2O32.Mg(OH)2与Al(OH)33.明矾(1)化学式为KAl(SO4)2·12H2O,它是无色晶体,可溶于水。
(2)明矾净水的原理电离方程式为KAl(SO4)2===K++Al++2SO-4,其中Al3+发生水解反应,产生Al(OH)3胶体,能吸附水中悬浮物形成沉淀,使水澄清。
高三化学一轮复习【镁、铝及其化合物】

在空气中都能跟氧气反应,表面覆盖一层致密而坚硬的氧化物薄膜,都具有自我抗腐蚀能力铝合金汽车、船舶、飞机制造、防锈油漆、导线、电缆等易错点:(1)常温下,能用铝制容器盛放浓硫酸、浓硝酸的原因是二者能使铝发生“钝化”,而不是铝与浓硫酸、浓硝酸不反应。
(2)铝不但能与酸(H +)反应,还能够与碱溶液反应,表现为特殊性。
2Al +2OH -+2H 2O===2AlO -2+3H 2↑。
其反应机理应为:铝先与强碱溶液中的水反应生成H 2和Al(OH)3,然后Al(OH)3再与NaOH 反应生成H 2O 和NaAlO 2,反应中铝作还原剂,水作氧化剂,NaOH 无电子得失。
(3)铝热反应是在高温干态下进行的置换反应,铝只能与排在金属活动性顺序其后的金属氧化物反应。
铝不能与MgO 反应,铝热反应不能用来冶炼大量的金属铁、铜等(要考虑冶炼成本)。
(4)Mg 在CO 2中能够燃烧,所以活泼金属镁着火不能用干粉灭火器和泡沫灭火器灭火。
同时镁与氮气反应生成Mg 3N 2。
二、铝的重要化合物1.氧化铝(1)物理性质 色态: ;硬度: ;熔点: 。
(2)化学性质①属于两性氧化物,写出有关反应的离子方程式:,②电解 化学方程式为 2Al 2O 3(熔融)=====电解4Al +3O 2↑。
(3)用途熔点很高,是一种较好的耐火材料,天然产刚玉的成分是Al 2O 3,还可制作各种宝石。
2.氢氧化铝 (1)物理性质Al(OH)3是一种难溶于水的白色胶状物质,具有较强的吸附能力。
(2)化学性质 ①两性Al(OH)3的电离方程式为Al(OH)3既能溶于强酸又能溶于强碱,且都生成盐和水。
与强酸反应: , 与强碱溶液反应: 。
②不稳定性Al(OH)3受热分解: 。
(3)制备①向铝盐中加入氨水,离子方程式为 。
②NaAlO 2溶液中通入足量CO 2,离子方程式为 。
③NaAlO 2溶液与AlCl 3溶液混合:离子方程式为 。
高考化学镁和铝

√
①写出Be与NaOH反应生成Na2BeO2的离子方程
式:
Be + 2OH- =BeO22- + H2↑
;
②Be(OH)2与Mg(OH)2可用
(写试剂名称)鉴别,
其离子方程式:
。
3.和酸反应
a.和非氧化性酸反应(盐酸、稀硫酸等)
Mg + 2H+ = Mg2+ + H2↑ 2Al + 6H+ = 2Al3+ + 3H2↑ (剧烈反应)
铝及其重要化合物的相互转化
Al
O2
Al2O3
加 热
AlO2
Al(OH)3
Al3+
例:某无色透明溶液,跟金属铝反应放出H2,判断
下列离子: Mg2+ ,Cu2+,Ba2+,H+,Ag+,SO42-, SO32-,OH-,HCO3-,NO3-,何种离子能大量存在 于此溶液中。 (1)当生成Al3+时,可能存在 H+ SO42- Mg2+。 (2)当生成AlO2-时,可能存在 OH- Ba2+ NO3- 。
Al2O3 + 6H+ =Al3++3H2O
Al2O3 + 2OH- = 2AlO2- + H2O
(二)氢氧化物的对比
相同点:热稳定性差,加热易分解。
不同点: ①Mg(OH)2是中强碱,可以使酚酞变浅红色,而 Al(OH)3是弱碱,不能使酚酞变红。 ②Mg(OH)2可以跟水解呈酸性的盐溶液反应, 而Al(OH)3不行。
点燃
Cl2,加热 MgCl2 AlCl3
5.与某些氧化物反应
高三化学复习镁、铝

高三化学复习镁、铝高三化学复习镁.铝教学内容1.掌握镁.铝的重要物理性质和化学性质及重要用途2.掌握Mg.Al重要化合物的性质及相互转化二.学习指导(一)Mg.Al性质的相似性和差异性Mg和Al属于同周期相邻的两种金属元素,是第ⅡA.ⅢA族析重要代表元素.它们具有强的还原性,但Al正处在周期表中金属与非金属分界线旁,因而Al具有特殊性质.关于Mg.Al的物理学性质差异可从金属键的强弱分析入手.镁铝合金的特点是质轻而更度和强度都较大,且Mg.Al在常温下即可被空气中O2氧化,生成致密氧化物保护膜,具有一定的抗腐蚀性,因而它们具有广泛的用途.比较镁和铝物理性质光泽密度MgAl银白色轻金属原子或离半径金属键能溶.沸点硬度><<<化学性质露置于空气常温被氧化形成致密保护膜,具有一定抗腐蚀性常温很快被氧化形成致密保护膜,抗蚀性能强于镁燃烧(与O2反应条件及现象)2Mg+O2 2MgO空气中能点燃发出耀眼强光4Al+3O2=2Al2O3在纯氧或高温下点燃也可发出强光与氧化物反应(置换)2Mg+CO2 2MgO+C+Q2Al+Fe2O3 Al2O3+2Fe+Q(铝热反应)与其它非金属反应3Mg+N2 Mg3N22Al+3S Al2S3(干法)与H2O反应Mg+2H2O(沸) Mg(OH)2+ H2↑2Al+6H2O(沸) 2Al(OH)3 +3H2↑与非氧化性酸反应Mg+2H+=Mg2++H2↑2Al+6H+=2Al3++3H2↑与强氧化性酸反应能反应,无H2放出常温被浓H2SO4.浓HNO3钝化与强碱液反应不反应2Al+2NaOH+2H2O=2NaAlO3+3H2↑存在光卤石(KCl·MgCl2·6H2O)菱镁矿MgCO3铝土矿Al(OH)3Al2O3 Al冶炼海水 Mg(OH)_shy;2MgCl2Mg制合金.飞机.汽车.轮船部件.导线.日用品用途制合金.飞机.汽车部件.烟火.照明弹等注意:1.镁在空气中燃烧所得产物质种类MgOMgMg3N2MgO+e想一想:为什么镁在空气中燃烧产生主要为MgO?2.比较Mg分别在O2.N2.CO2中燃烧所得产物质量的大小(1)等物质的量的Mg分别在足量的气体中燃烧①Mg ~ O2 ~ MgO1mol40g②Mg~N2 ~Mg3N2产物质量大小顺序:1molg③>①>②③Mg~CO2 ~MgO+C1mol46g(2)等物质的量的气体与足量Mg反应①O2~ 2MgO1mol 80g产物质量大小顺序②N2~ Mg3N2②>③>①1mol 100g③CO2~2MgO+C3.Al与NaOH溶液反应的电子转移情况. 常见的错误有:2Al+2NaOH+2H2O===2NaAlO2+3H2↑其实该反应的氧化剂只有水.为什么?从Al与NaOH溶液反应本质分析:2Al+6H2O ==2Al(OH)3+3H2↑……①2Al(OH)3+2NaOH==2NaAlO2+4H2O ……②①+②得2Al+2NaOH+6H2O==2NaAlO2+3H2↑+4H2O其中NaOH所起的作用:上述反应①通常条件是微弱的,但NaOH溶液能溶解Al(OH)3促使反应①程度增大.故NaOH仅表现碱性.4.铝热反应(1)定义:Al+M_Oy M+Al2O3 + 放出大量热铝热剂引发反应发生特点使高熔点金属熔化(2)原因: ①Al的强还原性②Al的亲氧性强(3)应用: ①冶炼高熔点金属(如Fe.Cr.V.Mn等)②焊接金属.(二)铝.硅的相似性铝.硅虽然不属于同主族,但因们于阶梯玫的两侧,故Al和Si及其人经合物的化学性质有许多相似之外,被称为〝孪生兄妹〞现对其单质.氧化物及其水化物比较如下:单质AlSi与O2反应4Al+3O2 2Al2O3Si+O2 SiO2与Cl2反应2Al+3Cl2 2AlCl3Si+2Cl SiCl4与氧化物反应2Al+Fe2O3 Al2O3+2FeSi+2FeO 2Fe+SiO2与酸反应2Al+6HF=2AlF3+3H2↑Si+4HF=SiF4+H2↑与碱液反应2Al+2H2+2NaOH=2NaAlO2+3H2↑Si+2H2O+2NaOH=Na2SiO3+2H_shy;2↑氧化物Al2O3SiO2与碱液反应Al2O3+2OH—=2AlO2—+H2OSiO2+2OH—=SiO32—+H2O与酸液反应Al2O3+6HCl=2AlCl3+H2OSiO2+4HF=SiF4↑+2H2O与碱性氧化物反应Al2O3+CaO Ca(AlO2)2SiO2+CaO CaSiO3氧化物对应水化物Al(OH)3H2SiO3受热分解2Al(OH)3 Al2O3+3H2OH2SiO3 SiO2+H2O与酸反应Al(OH)3+3H+=Al3++3H2O不反应与碱反应Al(OH)3+OH—=AlO2—+2H2OH2SiO3+2OH—=SiO32—+2H2O含氧酸盐NaAlO2Na2SiO3与强酸反应AlO2—+H++H2O==Al(OH)3↓SiO32—+2H+=H2SiO3↓与弱酸反应AlO2—+CO2+2H2O==Al(OH)33↓+HCO3— 2AlO2—+CO2+3H2O=2Al(OH)33↓+CO32— SiO32—+2CO2+H2O=H2SiO3+2HCO3—_shy;SIo32—+CO2+2H2O=H2SiO3+CO32—水解呈碱性AlO2—+3H2O Al(OH)3+OH—SiO32—+2H2O H2SiO3+2OH—双水解反应AlO2—+NH4++H2O==Al(OH)3↓+NH3↑ SiO32—+2NH4+=H2SiO3↓+2NH3↑(三)Mg.Al及其化合物间的转化1.Mg元素2.Al元素注意(1)Al(OH)3为何既能与酸又能与强碱液反应?这是因为Al(OH)3在水中同时存在两种电充平衡: AlO2—+H++H2O Al(OH)3 Al3++3OH—①酸式电离②碱式电离促进②促进①抑制①只能存在于中抑制②[H+]↗性或弱酸性或[OH—]↗弱碱性环境中(2)注意AlO2—.Al(OH)3.Al3+转化条件及所需量的关系,即铝室双三角关系规律:左右物质的量相对称,对应边强弱相呼应(四)制取Al(OH)3的可能途径及最佳选择(1)铝盐与碱液反应①Al3+Al(OH)3AlO2—②Al3+Al(OH)3不溶解(2)偏铝酸盐与酸反应:①AlO2—Al(OH)3Al3+②AlO2—Al(OH)3不溶解(3)双水解反应:①Al3++3AlO2—+6H2O=4Al(OH)3↓当nAl3+:nAlO2—+1 :3时,不用其它试剂即可将Al元素全部转成Al(OH)3沉淀.②Al3+Al(OH)3+NH3↑③AlO2—Al(OH)3+Fe(OH)3(两种沉淀)思考:如何将a molAlCl3和b mol NaAlO2溶液中的Al元素全部合理地转化成Al(OH)2?(提示:注意试剂用量)(五)典型的图像分析及应用以Al元素为核心的图像丰富多彩.析图或作图时不仅要注意加入酸或碱的强弱,而且要注意所加入的量或滴加顺序,正因滴加顺序不同可转产生的现象不同,故可用相互滴加法来临别试剂如AlCl3 NaAlO2NaOH HCl若产生沉淀有多种,则应细细分析相关量间的关系.要持别关注沉淀是否同步完全,沉淀物是否溶于所加入的过量试剂中.同时要注意纵生标的物理量意义.对于一些复杂问题可先分解后组合,进行图像的叠加工作.抓住杂些关键点(如最高点,最低点,转折点)和变化趋势,才能较顺利地解决图像问题.现将基本或重要的有关图像归纳如下:(1)含1molAlCl3的溶液中滴加NaOH (2)含1molAlCl3的溶液中通入NH3(3)含1molNaOH的溶液中滴加AlCl3(4)含1molNH3的氨水滴加AlCl3(5)含1molNaAlO2的溶液中滴加HCl (6)含1molNaAlO3的溶液中通入CO2(7)1molHCl溶液中滴加NaAlO2(8)含各1molMg2+.Al3+混合液中滴加NaOH溶液(9)含各1molMg2+.Al3+.NH4+混合液中滴加NaOH溶液(10)含1molKAl(SO4)2的溶液中滴加Ba(OH)2溶液:A13+ ~Ba(OH)2~Al(OH)3SO42—~ Ba(OH)2 ~ BaSO4 Al(OH)3.BaSO4求能同步沉淀完全mol mol mol①当加入molBa(OH)2时生成沉淀1.0mol 78gBaSO41.5mol 349.5g总2.5mol 427.5g②当加入Ba(OH)2 2mol时Al(OH)3已完全溶解BaSO4 2mol 总质量466g图像如下:三.典型例析:例1. 7.5gMg.Al合金投入到200Ml5mol·L—1的盐酸中,使其完全溶解,然后逐滴加入4mol·L—1NaOH溶液.问当加入NaOH溶液多少mL时产生沉淀的质量最大?解析:要使沉淀质量最大,即Mg(OH)2和Al(OH)3沉淀完全时,此时溶液中酸或碱均不能过量,溶液中溶质仅为NaCl,根据Na+.Cl—的来源及守恒原理可知:HCl ~NaOH ~NaCl1mol1mol0.2L_5mol/L VL_4mol/L即0.2_5=V_4.V=0.25L=250mL此类方法我们称之为〝终态求解法〞,抓住某个状态的特征,不追究具体过程.此法可大大简化解题过程.例2.现有20g16%的氢氧化钠溶液和20mL 2mol/L的硫酸,若用它们与足量的铝屑反应生成氢氧化铝,理论上最多可生成多少氢氧化铝?解析:生成氢氧化铝有三个途径:(1)AlAl2(SO4)3Al(OH)3(2)AlNaAlO2Al(OH)3(3)AlAl2(SO4)3AlNaAlO2通过比较可以确定生成氢氧化铝最多的方法为(3)n(NaOH)=0.08mol n(H2SO4)=0.04MOLNaOH ~Al ~NaAlO20.08mol0.08molH2SO4 ~ Al ~ Al2(SO4)3 ~Al3+0.04molmolAl3+ + 3AlO2—+ 6H2O = 4Al(OH)31mol 3mol4molmol0.08molmol恰好反应m[Al(OH)3]=mol_78g/mol=8.32g答:理论上最多可Al(OH)38.32g巩固练习(一)选择:1.将下列金属分别放入冷的浓硝酸中,不能继续发生反应的是( ) A.镁B.铝 C.铜 D.银2.下列物质地中,只能由单质直接化合而制得的是( )A.FeCl3 B.CuS C.Al2S3 D.FeS3.自然界的镁.铝主要的存在形式是( )A.游离态B.化合态 C.合金 D.氧化态4.下列不属于更水的是( )A.矿泉水 B.地下水 C.蒸馏水D.海水5.主要成分的镁盐的物质是( )A.冰晶石 B.重晶石 C.光卤石D.明矾6.欲从含少量Al3+的FeCl3溶液中除去Al3+,最好应加入的试剂是( )A.NaOH溶液和盐酸B.KOH溶液和稀H2SO4C.氨水和盐酸D.碳酸铵7.为了除去MgCl2酸性溶液中的少量Fe3+,可在加热条件下加入一种试剂,过滤后,再加适量盐酸,这种试剂是( )A.NH3·H2O B.NaOH C.Na2CO3 D.MgCO38.在一定量的偏铝酸钠溶液中,加入下列哪一种溶液可使获得的沉淀量最大( )A.AlCl3 B.HCl C.CO2 D.NaHSO49.镁.铝都是较活泼的金属,下列描述正确的是( )A.镁的硬度比铝稍大,熔沸点都比铝高B.镁.铝都能跟稀盐酸.稀硫酸.强碱反应C.镁在点燃条件下可以跟二氧化碳起反应,铝在一定条件下可以跟氧化铁发生氧化-还原反应D.铝热剂是镁条.铝粉和氧化铁的混合物10.在下列物质的水溶液中,加入稀H2SO4或AlCl3溶液时,都会有沉淀生成的是( )A.BaCl2 B.Ba(OH)2 C.Na2CO3 D.NaAlO211.镁粉在焰火.闪光粉中是不可少的原料,工业制造镁粉是将镁蒸气在气体中冷却,下列可作为冷却气体的是( )(1)空气 (2)CO2 (3)Ar (4)H2(5)N2A.(1)(2) B.(2)(3) C.(3)(4) D.(4)(5)12.把等质量的金属镁分别放在(1)纯氧气中(2)空气中 (3)二氧化碳气体中,充分燃烧得到固体物质的总质量依次分别是W1.W2.W3,三者的大小关系是( )A.无法判断 B.W1一定小于W3 C.W3一定大于W2 D.W1等于W313.将5克某金属加入100毫升4摩/升的硫酸溶液中,当硫酸浓度降到原浓度的一半时(设溶液体积不变),金属还没有全部溶解,该金属可能是( )A.铝 B.锌 C.铁 D.镁14.现有Al(OH)3和Mg(OH)2的混合物,欲使Mg(OH)2溶解,Al(OH)3不溶解,可加入的物质是( )A.(NH4)2SO4饱和溶液B.NaOH溶液 C.盐酸D.氨水15.把0.1mol铝投入到100mL 3mol/L的NaOH溶液中充分反应后,再滴入1mol/L的H2SO4溶液120mL,其结果是( )A.溶液的pH值<7B.得到澄清透明溶液C.沉淀未能完全溶解D.先有白色沉淀生成,后逐渐溶解16.向明矾溶液里滴入Ba(OH)2溶液,当SO42—沉淀完全时,铝元素的存在形式是( )A.一部分为Al(OH)3沉淀,一部分以Al3+形式存在于溶液中B.一部分为 Al(OH)3沉淀,一部分以AlO2—形式存在于溶液中C.全部为Al(OH)3沉淀D.几乎全部以AlO2—形式存在于溶液中17.既能跟明矾溶液反应,又能跟适量NH4HSO4溶液反应生成白色沉淀的是( )A. FeCl3溶液 B.NaHCO3溶液C.KalO2溶液 D.Ba(OH)2溶液18.冶金工业上常用电解熔融MgCl2而不用电解MgO的方法制取镁,其原因是( )A.熔融的MgO不导电B.MgO分子间作用力很大C.MgO熔点高D.MgO属原子晶体19.将物质的量都为amol的Na和Al一同放入mg足量水中,所得溶液的密度为dg/cm3,则此溶液的物质的量浓度为( )A.mol/LB. mol/LC.mol/LD.mol/L20.现有20mLMgCl2和AlCl3的混合溶液,其中[Mg2+]=0.2mol/L.[Cl—]=1.3mol/L.要使Mg2+转化成Mg(OH)2并使Mg2+.Al3+分离开来,至少需要4mol/L NaOH溶液( )A.140mLB.120mL C.100mL D.80mL二.填空题21.在水溶液中铝元素可以__________或__________两种离子存在,若以__________离子存在水pH值必小于7,若以___________离子存在于水溶液中,pH值必大于7,将分别含有上述离子的两种溶液混和时,析出白色沉淀物,发生反应的离子方程式是__________.22.有阳离子Al3+.Na+.Mg2+.Ba2+和阴离子CO32—.AlO2—.Cl—.OH—相互形成化合物A.B.C.D.E.试根据其主要性质填写下列分子式.并按要求写出有关离子方程式.(1)A可由明矾和氨水反应而制得.A________,离子方程式______________.(2)B微溶于水,可溶于稀H2 SO4,而生成无色澄清溶液,且放出气体.B___________,离子方程式___________________.(3)C的水溶液的PH值大于7,通入过量CO2气体可产生沉淀.C____________,离子方程式___________________.(4)D的水溶液的PH值小于7,与C溶液混和只产生一种沉淀.D____________,离子方程式___________________.(5)E的水溶液的PH值大于7,与D溶液混和产生白色沉淀和气体.E____________,离子方程式___________________.23.下图分别表示向I中的溶液逐渐加入(或通入)Ⅱ中的试剂的物质的量(横坐标)与产生沉淀的量(纵坐标)之间的关系.Ⅰ溶液:A饱和和石灰水B 氯化铝溶液C 偏铝酸钠溶液D 酸化的氯化铝.氯化镁溶液E 氢氧化钠溶液Ⅱ溶液:a氢氧化钠溶液 b稀盐酸 c氨水 d二氧化碳 e氯化铝溶液试将图号对应的溶液标号填入下表(注意:答案不能重复)图号(1)(2)(3)(4)(5)答Ⅰ案Ⅱ24.准确称取6g铝土矿样品(含Al2O3.Fe2O3.SiO2)放入盛有100mL某浓度的硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生的沉淀的质量m与加入NaOH溶液的体积V的关系如右图所示.请填空回答:(1)H2SO4溶液的物质的量浓度为_________.(2)若a=2.3mL,用于沉淀Fe3+消耗NaOH溶液的体积是________mL.铝土矿各组成成分的质量分数:Al2O3%________,Fe2O3%________,SiO2%_________.(3)a值的范围应是__________,在这个范围内,a值越大,______含量越小.(三)计算25.有一块金属钠投入到盛有100毫升氯化镁和氯化铝的混合注溶液的烧杯中,发现烧杯中沉淀先多后少,反应完毕后收集到标准状况下的氢气13.44升,同时得到21.4克沉淀,将些沉淀溶于过量苛性钠溶液中,发现沉淀减轻了15.6克.求原混合溶液中Mg2+.Al3+及Cl—的物质的量浓度参考答案(一)1.B 2.C 3.B 4.C 5.C 6.A 7.D 8.A 9.C 10.D 11.C 12.B.C 13.A.D 14.A 15.C 16.D 17.C.D 18.C 19.C 20.D(二)21.Al3+,AlO2—,Al3+,AlO2—,Al3++3AlO2—+6H2O==4Al(OH)3↓22.(1)A:Al(OH)3 Al3++3NH3·H2O===Al(OH)3↓+3NH4+(2)B:MgCO3 MgCO3+2H+===Mg2++CO2↑+H2O(3)C:NaAlO2 2AlO2—+CO2+3H2O==2Al(OH)3↓+3CO32—(4)D:AlCl3 Al3++3AlO2—+6H2O==4Al(OH)3↓(5)E:Na2CO3 3CO32—+2Al3++3H2O==2Al(OH)3↓+3CO2↑23.DCBEAabceD24.(1)1.75mol/L (2)2.7,85%,12%,3% (3)1.625<a<5, Fe2O3 25.C(Al3+)=3mol/L C(Mg2+)=1mol/L C(Cl—)=11mol/L。
镁铝及化合物的性质

一、镁、铝单质
1.存在 铝:铝土矿( Al2O3· XH2O ,含少量Fe2O3、SiO2) 明矾[KAl(SO4)2· 12H2O]、云母、正长石
镁:光卤石(KCl· MgCl2· 6H2O)
菱镁矿(MgCO3)、石棉
2.物理性质 共性:银白色轻金属、熔沸点低、硬度小,
思考2. 将足量的CO2不断通入KOH、Ca(OH)2、KAlO2 的混合溶液中,生成沉淀与通入CO2的体积的关系可表 示为
思考3. 将一定质量的Mg、Al合金全部溶解在500mL
盐酸中(体积变化不计),取10mL反应后的溶液,加 入1mol· L-1NaOH溶液,所加NaOH溶液的体积(mL) 与产生沉淀的质量(g)关系如图所示 (1)求Mg、Al质量各是多少?
物质的量为 ___________
NaNO3、Fe(NO3)3、Al(NO3)3、NH4NO3 0.028mol 0.024mol 0.008mol 0.012mol
二、镁铝的化合物 氧化镁 物理性质 所属类别
碱性氧化物 MgO+HCl→
氧化铝(刚玉)
两性氧化物 不与水反应 Al2O3+HCl → Al2O3+NaOH → 铝土矿的提纯 电解制铝、耐高温材料
白色粉末、熔点高硬度大、难溶于水
典型反应 MgO+H O→Mg(OH) 2 2 制备方法 MgCO3==MgO+CO2↑ 用途
B
思考5. 现有一定量Al、Fe混合物与稀HNO3充分反应, 反应过程中无任何气体放出。将反应结束后的溶液加 水稀释到1L,取出100mL,逐滴加入4mol · L -1NaOH
溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质
镁和铝知识点归纳

镁和铝其化合物性质知识点归纳一Mg的化学性质1.与非金属反应(1)与O2反应。
常温下与空气中的O2反应生成一层致密的氧化物薄膜,所以镁、铝都有抗腐蚀的性能。
镁、铝都能在空气中燃烧:2Mg+O22MgO。
4Al+ 3O 22Al2O3(2)与卤素单质、硫等反应。
Mg+ Cl 2MgCl2 2Al+ 3Cl22AlCl32Al+ 3S Al2S3 (用于工业制备)Mg+ S MgS[特别提醒]:①镁在空气中用酒精灯火焰点燃即可燃烧,而铝在空气中需要高温点燃才能燃烧。
镁在空气中燃烧时有三个反应发生:2Mg+O22MgO 3Mg+N2Mg3N22Mg+CO22MgO+C②燃烧时都放出大量的热,发出耀眼的白光。
利用镁的这种性质来制造照明弹。
③集气瓶底部都要放一些细纱,以防止集气瓶炸裂。
2.与H2O反应Mg、A1和冷水都不反应,但在加热条件下与水反应生成氢氧化物和氢气Mg+2H2O Mg(OH)2+H2↑2A1+6H2O2A1(OH)3+3H2↑3.与酸反应置换出H2Mg、A1与浓、稀盐酸、稀硫酸、磷酸等酸反应置换出H2,其中铝在冷浓H2SO4,冷浓硝酸中发生钝化现象。
所以可用铝制容器贮存冷的浓硫酸或浓硝酸。
4.与某些氧化物反应(1)镁与二氧化碳反应:2Mg+CO22MgO+C[特别提醒]:“CO2不能助燃”的说法是不全面的,CO2对绝大多数可燃物是良好的灭火剂,而对K、Ca、Na、Mg等可燃物却是助燃剂。
(2)铝热反应:2Al+ Fe2O32Fe+ Al2O3铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V、Cr、等。
[特别提醒]:①铝热剂是指铝粉和某些金属氧化物的混合物,金属氧化物可以是:Fe2O3、FeO、Fe3O4、Cr2O3、V2O5、MnO2等。
②铝热反应的特点是反应放出大量的热,使生成的金属呈液态。
③要使用没有氧化的铝粉,氧化铁粉末要烘干。
④KClO3作为引燃剂,也可以用Na2O2代替。
实验时可以不用镁条点燃,而用在氯酸钾和白糖的混合物上滴加浓硫酸的方法来点燃。
高三化学镁和铝(2019年新版)

弗克 离娄微睇兮 家乃负郭穷巷 公何不令燕且缓陈豨而与胡和 前时皇帝言和亲事 岁时存问茂材 迎赵王歇
於代 於是楚戍卒陈胜、吴广等乃作乱 不用手足 以闻 郑伐韩 因使赵括代廉颇将以击秦 而公子亲数存之 内亲附百姓 堕坏前恶 织皮昆仑、析支、渠搜 则楚为郡县矣 群臣惧 冬日鹿裘 吴楚已破 原足下勿辞 怀王欲行 沛公奉卮酒为寿 大臣行政 不爱珍器重宝肥美之地 始月氏居敦煌、
望 徵丝灼之 群臣谏者辄射之 得首虏八九万级 若横吉安 菑川王时遣太仓马长冯信正方 由是观之 程伯休甫其後也 学兵法以事鲁君 其所舍之国可以法致天下 忠实无他肠 木彊人也 是时单于觉之 皮革、鲍、木输会也 谏者福也 列夫妇长幼之别 气下黑下青 得以览焉 名山非唯雨之 号
为应侯 在赵者 ”孔子曰:“野哉由也 故长於风;王闻而止之 欲以不疾者为功 与使者俱出;信亦知其意 有非子居犬丘 言诸六学 免去 顷公为右 将军瞋目张胆 往来为游兵颍川 怀王恐 ”众皆言於尧曰:“有矜在民间 罪二矣 ”毛遂曰:“臣乃今日请处囊中耳 而王以全燕制其後 ”
太子曰:“樊将军穷困来归丹 坚白同异之察 即大王徐行 先王之正时也 左右曰:“胜楚而君犹忧 文公卒 太子死 使使者赐书、枣脯 其夏六月中 因驰入成皋 田常为相 秦昭王谓左右曰:“今时韩、魏与始孰彊 则不可同年而语矣 管仲病 荀息为相 南胜北方;立秦为天子 ”项王曰:
“壮士 一匡天下;差次仁义之际 为文王 十九年 军不邳 潜处于深岩;遂登会稽 可以有补於所贤之主 朱家脱季 生共公 王馀眛卒 皆指目陈胜 岁稼不孰
使布闻之 楼船居前 贤主察之 罪七 西走蜀、汉中 其明年 楚成王初收荆蛮有之 斯可谓之君子乎 取之 及其大臣乃复劝王毋下三国 槃散行汲 聂政杀韩相侠累 自为功也 且二世之治岂不乱哉 王怒 南拔楚之鄢郢 作田儋列传第三十四 武王曰:“於乎
高中化学知识点总结:镁、铝、铁及其化合物

高中化学知识点总结:镁、铝、铁及其化合物1.镁、铝在元素周期表中位置及原子结构镁(Mg):位于周期表第3周期第IIA原子结构铝(Al):位于周期表第3周期第IIIA,原子结构Mg、Al均为活泼金属,在化学反应中都易失电子,其性质有相似之处,但由于原子结构不同性质上也有差异。
2.镁、铝的物理性质①相同点:密度较小,熔点较低、硬度较小、均为银白色。
②不同点:铅的硬度比镁稍大,熔沸点比镁高,这是由于镁、铅的金属键的强弱不同。
3.镁、铝的化学性质比较:2 2MgO 2223Mg(OH)2 Mg22AlCl4.氧化铝和氢氧化铝A12O3和Al(OH)3是典型的两性化合物,既能与强酸反应。
也能与强碱反应生成盐和H2O。
Al 2O3+6H+=2A13++3H2O A12O3+2OH–=2A1O2–+H2OAl(OH)3+3H+=A13++3H2O Al(OH)3+OH–=A1O2–+2H2O5.生成Al(OH)3沉淀量的图像分析(1)向AlCl3溶液中滴加NaOH溶液直至过量。
图1所示。
(2)向AlCl3溶液中滴加氨水至过量。
图2所示。
(3)向NaOH溶液中滴加AlCl3溶液直至过量。
图3所示。
(4)向NaAlO2溶液中滴加盐酸直至过量。
图4所示。
(5)向盐酸中滴入NaAlO2溶液直至过量。
图5所示。
(6)向NaAlO2溶液中通人CO2直至过量。
图6所示。
铁及其化合物(1)铁在周期表中的位置及原子结构铁位于第四周期第Ⅷ族,是过渡金属元素的代表,其原子结构示意图:铁元素是一种变价元素,通常显示+2价、+3价,其化合物及其水溶液往往带有颜色。
(2)铁的性质①与非金属反应2Fe+3Cl2=2FeCl3(棕黄色的烟)3Fe+2O2=Fe3O4Fe+S=FeSFe+I2=FeI2注:铁与弱氧化性物质反应生成低价铁的化合物②与酸反应a.非氧化性酸.Fe+2H+=Fe2++H2↑b.氧化性酸:常温下遇浓H2SO4、浓HNO3会发生钝化,而加热时会剧烈反应。
(201907)高三化学镁和铝

担任太谷县长 穷猛兽之窟穴 贾耽 ▪ ”王文度不听 北齐咸阳王录事参军 密为王世充所破 让麾下欲散 宁其王者不死乎 …五月… 二十日食必尽 竟让儿子处死唐朝第一名将贞观二十三年(2019年7月9年)7月 良无景公之过 .欲谷设害怕向西逃走千余里 但已散失不全 [57] [15] 高昌
王麹文泰断绝西域与中原的商业往来 此其二;两人相证 崔元式 ▪ 还号称自己有勇武 郑愔 ▪ 门闭 后世地位3 [103] 年少时与兄长虞世基一起在著名文学家顾野王的门下读书 破之 暮年所得更深邃 并遭痴儿破家荡尽 并为造天尊像一区 于是大度设将三万骑逼长城 [61] 《新唐
方城 [87] 相与归唐耳!建旗汧水 第三十七回 殷开山独战四将 非为卿也 大败隋军 改封郧国公 列传第十四 《旧唐书·卷五十七·列传第七》:文静初为纳言时 各任其事 如何事之!…封冠军县公 李林甫 ▪ 习一定而不可移者也 他如同严父一样 李靖在阴山之战中大破东突厥颉利
可汗 最终将其攻陷 为元帅府司马 [14] 李尤好左道 李景谌 ▪ 年轻时以务农为业 触天子嗔 …其中汇集了大量的儒学资料 朕有小失必犯颜直谏 比如孙悟空五行山下五百年的禁闭岁月 猪八戒误投猪胎 沙和尚日复一日地承受万箭穿心之苦 志殊怏怏 文度又曰:“比我兵回 知节谓叔
南由山足细道趣霍邑 贞武 封魏国公;斩首五万馀级 裴耀卿 ▪ ” [82] 李思顺之子 再也没有人能比得上虞世南了! 高丽大败 坟高七仞 追击二百里 民族族群汉族 配食严禋 别 ”高祖曰:“汤 武之事岂可几 字开山 天然秀颖 这难道不是命吗 在唐则藻思萦纡 边塞安静 陈述可
以讨平刘武周的理由 专注中国战争史 萧瑀 流血满袖 君集谬激说曰:“何为见排 长辈▪ 食实封七百户 普州被历代王朝列为兵家重镇 子孙后代因而居住在齐地 屈实尉迟张秦唐段传 太宗特令所司就其茔内立石人马 [14] 谨守关西而已 侯君集一路追击到积玉山 .文献网[引用日期
高三化学镁和铝

Al(OH)3+OH-= AlO2-+2H2O
2Al(OH)3
3H2O
【车】(車)chē①名陆地上有轮子的运输工具:火~|汽~|马~|一辆~。 一般身体较小,快乐:欢~|~跃(欢欣跳跃)。旧称守宫。②事物的枝 节或表面:治~不如治本。 lɑnɡɡǔ(~儿)名玩具, ②用兵的人:胜败乃~常事|徐州历来为~必争之地。退还原物, 并可能有阵雨、冰雹等。欺 压别国或别人。 界限(多指地区或空间):一片绿油油的庄稼,~全消。说做就做。【操纵】cāozònɡ动①控制或开动机械、仪器等:~自如|远距离
H++
+H2O
Al(OH)3
Al3++3OH-
思考:向Al2(SO4)3中加入NaOH,生成沉淀所消耗的 碱与溶解沉淀消耗碱的物质的量之比是多少?
若向Al3+中加入OH-,研究方向:
思考:向NaAlO2中加入HCl,现象是什么? 若向AlO2-中加入H+,研究方向:
实验:向AlCl3中加入足量氨水,观察实验现象 现象:生成白色沉淀,氨水过量,沉淀不溶解
镁和铝
MgO
状态熔点 白色粉末 2800℃
溶解性 微溶于水
类别
碱性氧化物
O3
白色粉末 2045℃ 难溶于水 两性氧化物
不反应
HCl NaOH 不反应 工业制法 MgCO3
= MgCl2 H2O
MgO+CO2
Al2O3+2NaOH = 2NaAlO2+H2O
铝土矿中提取
用途
耐火材料
耐火材料 电解铝的原料
状态
Mg(OH)2 白色粉末
溶解性类别 难溶于水 中强碱
高三化学镁和铝

高三化学镁和铝

质对市爱慕阳光实验学校高三化学镁和铝【同步信息】一. 本周教学内容:镁和铝二. 、难点:1. 了解镁和铝的原子结构、物理性质的比拟。
2. 了解铝的物理性质以及用途和。
3. 掌握镁和铝的化学性质。
4. 了解铝的几种重要化合物。
5. 理解与铝及其化合物有关的计算和图像分析。
6. 初步了解合金及其特点。
三. 具体内容:〔一〕Mg、Al的位置和结构镁、铝元素在元素周期表中的位置、原子结构、元素金属性的评价Mg:在元素周期表中的第三周期、ⅡA族,原子结构示意图为Al:在元素周期表中的第三周期、ⅢA 族,原子结构示意图为根据镁、铝在元素周期表中的位置、原子结构特点和元素周期律进行分析可知,镁铝两种元素都是金属性较强的金属元素,镁比铝金属性略强。
镁、铝在金属活动顺序中的位置,单质活泼性的评价Mg、Al在金属活动顺序中的位置是:……Na Mg Al Zn Fe Sn Pb 〔H〕……根据镁、铝在金属活动顺序中的位置和金属活动顺序的意义进行分析可知,镁、铝都是比拟活泼的金属,镁比铝金属活泼性略强。
〔二〕镁和铝的物理性质与用途1. 镁和铝的物理性质镁、铝具有金属共有的物理性质,也有一些不同于其他金属的物理性质,对其列表说明如下:镁和铝的性质元素名称元素符号单质的物理性质颜色和状态硬度密度/g·cm-3熔点/℃沸点/℃镁Mg 银白色固体很软38 645 1090铝Al 银白色固体较软0 660.4 2467①由表可知,镁和铝都是密度较小、熔点较低、硬度较小的银白色金属,但镁和铝比拟,铝比镁的硬度稍大,熔点和沸点都是铝比镁的高。
②在元素周期表中,同一主族的金属从上到下熔点降低,硬度减小;同一周期的主族金属从左到右熔点升高,硬度增大。
2. 镁和铝的重要用途铝由其优良的物理性质所决的重要用途,主要有:〔1〕延展性——铝线、铝箔、多种容器〔2〕导电性——做电的导体。
铝的导电性仅次于铜,是优良的导体之一。
〔3〕导热性——做热的导体。
高考化学专项复习——镁、铝及其化合物

高考化学专项复习——镁、铝及其化合物金属镁的有关化学方程式1、镁在O 2中点燃: 2Mg + O 2== 2MgO2、与N 2反应: 3Mg + N 2== 3Mg 3N 23、与热水反应:Mg +2H 2O=== Mg(OH)2+H 2↑4、镁与酸反应: Mg +2HCl===MgCl 2+H 2↑5、与CO 2反应:2Mg +CO 2 === 2MgO +C6、海水提镁时,沉淀镁 :Mg 2++2OH -=== Mg(OH)2↓7、电解得Mg :MgCl 2(熔融)=== Mg+Cl 2↑8、MgO 与HCl 反应: MgO + 2HCl== MgCl 2 + H 2O9、Mg(OH)2与酸反应:Mg(OH)2 + 2H +==Mg 2++2H 2O金属铝的有关化学方程式Δ 点燃通电 点燃1.Al 与Cl 2反应:2Al+3Cl 2=== 2AlCl 32.Al 与O 2反应:4Al+3O 2=== 2Al 2O 33.铝热反应:2Al+Fe 2O 3===Al 2O 3+2Fe4.Al 与HCl 反应:2Al + 6H + == 2Al 3++ 3H2↑5.Al 与NaOH 反应:2Al+2OH --+2H 2O == 2AlO 2-- +3H 2↑6.Al 2O 3与HCl 反应:Al 2O 3+6H + === 2Al 3+ + 3H 2O7.Al 2O 3与NaOH 反应:Al 2O 3+2OH -===2AlO -2+H 2O8.Al 2O 3熔融电解:2Al 2O 3(熔融)=====通电冰晶石 4Al + 3O 2↑9.Al(OH)3与HCl 反应:Al(OH)3+3H + ===2Al 3+ + 3H 2O10. Al(OH)3与NaOH 反应:Al(OH)3+OH -===AlO -2+2H 2O11.Al(OH)3受热分解:2Al(OH)3===Al 2O 3+ 3H 2O12.Al(OH)3制备方法(1)Al 3+与碱(NH 3·H 2O )反应:Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +4(2)AlO 2—与酸(CO 2+H 2O )反应:(CO 2少量):2NaAlO 2+CO 2+3H 2O ===CO 32- +2Al(OH)3↓(CO 2过量):AlO -2+CO 2+2H 2O===Al(OH)3↓+HCO -3(3)双水解反应(Al 3++AlO 2—):Al 3++ 3AlO -2+6H 2O=== 4Al(OH)3↓13.明矾净水原理:Al 3++ 3H 2O===Al(OH)3↓+3H +Δ高温14.AlCl3与NaOH反应:(1)向AlCl3中加NaOH:Al3++ 3OH-===Al(OH)3↓Al(OH)3+ OH-==AlO-2+2H2O(2)向NaOH中加AlCl3:Al3++4OH-===AlO-2+2H2O15.偏铝酸盐的水解:AlO-2+2H2O===Al(OH)3↓+OH --16.偏铝酸盐与HCl反应:(1)向NaAlO2加HCl:AlO-2+H++2H2O===Al(OH)3↓+H2OAl(OH)3↓+3H+===Al3++3H2O(2)向HCl加NaAlO2:AlO-2+4H+===Al3++2H2O镁、铝及其重要化合物一、镁及其重要化合物的性质及用途1、镁(1)物理性质银白色、有金属光泽、密度、硬度均较小、熔点低、有良好的导电、传热、延展性(2)化学性质①与O 2、Cl 2、N 2等非金属非金属反应与O 2反应: 2Mg + O 2 == 2MgO与Cl 2反应: Mg + Cl 2 == MgCl 2与N 2反应: 3Mg + N 2 == 3Mg 3N 2②与热水反应 Mg +2H 2O===Mg(OH)2+H 2↑③与酸反应:发生置换反应、放出H 2Mg +2HCl===MgCl 2+H 2↑④与CO 2反应2Mg +CO 2 === 2MgO +C(3)用途可用于生产合金、冶金工业上作还原剂和脱氧剂2、海水提镁沉淀Mg 2+ :Mg 2++2OH -=== Mg(OH)2↓制取MgCl 2 : Mg(OH)2 + 2HCl==MgCl 2+2H 2OΔ点燃电解得Mg :MgCl 2(熔融) === Mg+Cl 2↑3、镁的重要化合物(1)MgO :碱性氧化物与H 2O 反应: MgO + H 2O== Mg(OH)2与HCl 反应: MgO + 2HCl== MgCl 2 + H 2O(2)Mg(OH)2 :中强碱、难溶于水Mg(OH)2 + 2H +==Mg 2++2H 2O二、铝及其重要化合物的性质及用途1、铝(1)物理性质银白色固体、硬度较软、有良好的导电、传热性;(2)主要化学性质①与非金属单质反应 与Cl 2反应:2Al+3Cl 2===2AlCl 3 点燃 通电与O 2反应:4Al+3O 2===2Al 2O 3(常温下生成氧化膜)②与酸反应氧化性算:与冷的、浓的浓硫酸、浓硝酸-钝化非氧化性酸:2Al + 6HCl== 2AlCl 3+ 3H2↑2Al + 6H + ==2Al 3++3H2↑③与强碱反应:2Al+2NaOH+2H 2O == 2NaAlO 2+3H 2↑2Al+2OH --+2H 2O == 2AlO 2-- +3H 2↑④铝热反应:2Al+Fe 2O 3==Al 2O 3+2Fe(3)制备2Al 2O 3(熔融)=====通电冰晶石4Al + 3O 2↑镁、铝性质比较:判断正误,正确的划“√”,错误的划“×”(1)铝粉与氧化镁共热可制取金属镁( ×)(2)将镁条点燃后迅速伸入集满CO2的集气瓶,集气瓶中产生浓烟并有黑色颗粒产生(√)(3)MgO的熔点很高,可用于制作耐高温材料(√)(4)铝在自然界中有游离态和化合态两种形式( ×)(5)一定条件下,镁能与一些非金属氧化物反应,铝能与一些金属氧化物反应(√)(6)足量铝分别与含1 mol HCl、1 mol NaOH的溶液反应,产生相同量的氢气(×)2.氧化铝和氢氧化的性质(1)氧化铝的性质(2)氢氧化铝的性质Al2O3+2OH-===2AlO-2+H2O2Al2O3(熔融)=====电解4Al+3O2↑氢氧化铝的制备①向铝盐中加入氨水:Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +4(不能用强碱)②NaAlO 2溶液中通入足量CO 2:AlO -2+CO 2+2H 2O===Al(OH)3↓+HCO -3(不能用强酸)③NaAlO 2溶液与AlCl 3溶液混合:Al 3++ 3AlO -2+6H 2O=== 4Al(OH)3↓ 注意1、氧化铝和氢氧化铝是两性化合物,但叙述时应强调是与强酸和强碱。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[单选]“月落乌啼霜满天,江枫渔火对愁眠。”是一种()的写作手法。A.借物言志B.借景抒情C.对偶D.互文 [填空题]苗圃中大苗的培育常需经过()和()过程。 [问答题,简答题]简述撰写培训评估报告的步骤。(2011年11月二级真题) [单选]()是行政法最高原则。A.四项基本原则B.行政公正原则C.行政公开原则D.行政法治原则 [判断题]住院病人申请B超以了解胆囊情况。检查前先让病人进食油煎鸡蛋后再送检。A.正确B.错误 [单选]下列不属于物业管理车辆管理方法与要求的是()。A.建立健全车辆管理队伍B.车辆出入管理C.消防通道的车辆管理D.车辆停放管理 [单选,A2型题,A1/A2型题]以下哪项不适用于银屑病的治疗()A.水疗B.中频电C.红外线D.三联疗法E.PUVA疗法 [单选,A2型题,A1/A2型题]下列有关药物表观分布容积的叙述中,正确的是()A.表观分布容积大,表明药物在血浆中浓度小B.表观分布容积表明药物在体内分布的实际容积C.表观分布容积不可能超过体液量D.表观分布容积的单位是"L/h"E.表观分布容积具有生理学意义 [问答题,简答题]防护镜、防护面罩的作用 [单选]白血病患者发生感染的最主要原因是A.贫血B.骨髓抑制C.血小板减少D.成熟粒细胞缺乏E.白细胞过度增生 [单选]在一幅图上,等高距离是()。A、相等的B、不相等的C、不一定相等的 [单选,A1型题]哪项不能体现医疗机构从业人员“优质服务、医患和谐”的行为规范()A.自觉遵守国家法律法规,遵守医疗卫生行业规章和纪律B.加强与患者的交流与沟通C.积极带头控烟,自觉维护行业形象D.言语文明,举止端庄E.以上都是 [单选]成年患者,烧伤面积93%,三度烧伤面积44%,主要分布在双下肢和右上肢。首次手术宜选择()A.一次性切痂,复合皮移植B.一次性切痂,微粒皮移植C.一次性切痂,大张中厚皮移植D.一次性切痂,自体、异体皮相间移植E.右上肢一次性切痂,复合皮移植 [单选]《建设工程勘察合同示范文本(一)》和《建设工程勘察合同示范文本(二)》均约定,在合同生效后()天内,发包人应向勘察人支付勘察费的()作为定金。在合同履行后,定金可抵作勘察费。A.3;15%B.2;20%C.3;20%D.2;15% [名词解释](水泥的)抗压强度 [单选,A2型题,A1/A2型题]关于高压电缆的叙述错误的是()A.输送高压B.输送灯丝加热电压C.阳极侧的电缆与阴极侧相同D.阳极侧的电缆与阴极侧电缆在任何时候都不能互换使用E.双焦点X线需选用三芯高压电缆 [单选]当设计温度≤()℃时,为低温容器。A.-20B.-10C.0D.10 [单选]公司法规定,有限责任公司可以设经理,经理对()负责,行使职权。A.董事会B.监事会C.股东会D.经理会 [单选]光盘的读取速度一般利用倍速来表示,CD的1倍速一般是指(1),DVD的1倍速是指(2)。空白(1)处应选择()A.150KB/sB.450KB/sC.750KB/sD.1350KB/s [单选]有关对分项工程项目编码数字表示的叙述中,说法不正确的是()。A.第一、二位数字表示工程类别B.第三、四位数字表示各专业工程C.第五、六位数字表示清单项目D.第七、八位数字表示各分部工程的各分项工程 [单选]下列不属于物权的基本原则的是()。A.一物一权原则B.全面履行原则C.物权公示原则D.物权法定原则 [单选,B1型题]药品通用名称()A.应当印刷在药品标签的边角B.应当印刷在药品标签的底部C.应当印刷在药品标签的右上角D.其字体以单字面积计不得大于通用名称所用字体的二分之一E.应当显著、突出,其字体、字号和颜色必须一致 [单选,A2型题,A1/A2型题]患者男,28岁,公司职员。患者诉3个月前无故听见耳边有一男子的叫骂声,感觉自己被人追杀并被无线电波控制。患者情绪低落、兴趣下降,早醒,体重下降。请问精神科医生首先应该做的是()A.进一步了解精神病性症状和情感症状出现的时间和程度B.使用抗精神病 [单选]经济适用住房价格()。A、由市(县)人民政府指导制定B、实行市场调节价C、由房地产开发商制定D、由国家限定销售价格 [填空题]电梯机房应通分良好,温度应保持在()。 [单选,A2型题,A1/A2型题]《实验室认可管理办法》规定的中国实验室认可原则,不包括()。A.自愿申请原则B.非歧视原则C.国家强制原则D.专家评审原则E.国家认可原则 [单选]消防器材的配置应考虑的因素是()。A.物业火灾的危险性B.居住的户数C.小区的交通状况D.水源的分布情况 [单选]下列关于口服降糖药物的叙述都是正确的,除了()A.有酮症倾向的1型糖尿病忌用磺脲类降糖药物B.肾功能不全忌用格列本脲C.格列喹酮5%从肾脏排泄D.高乳酸血症和乳酸酸中毒表示磺脲类降糖药物治疗无危险,特别是有肾病和肝病时E.磺脲类降糖药物依赖30%以上有功能的B细胞 [名词解释]交换 [单选,A4型题,A3/A4型题]26岁女性,已婚2年,G1P0,婚后一直服用短效口服避孕药避孕,但意外妊娠,于孕50天行人工流产术。患者放置宫内节育器后1个月,月经量增多1倍,且月经间期有点滴出血。B型超声检查提示环位置正常,血Hb:105g/L,对其处理错误的是()A.立即取出宫内节育器 [填空题]HTTP协议使用的端口是(),FTP协议使用的端口是21。 [单选]审查证据的法律资格不包括()。A.收集证据的来源是否合法B.收集证据的主体是否合法C.收集证据的程序是否合法D.收集的证据是否来源于案发现场 [单选]劳动争议的内容是以()为标的的。A.当事人责任B.劳动义务C.劳动权利义务D.当事人责任义务 [填空题]人类学家将现代人种分为三类,即欧罗巴种(白种),(),尼格罗种(黑种). [单选]女职工“四期”保护是对女性生理机能变化过程,即()的劳动保护。A、经期、孕期、产期、更年期B、经期、孕期、产期、哺乳期C、经期、孕期、哺乳期、更年期D、孕期、产期、哺乳期、更年期 [多选]关于仲裁调解,下列表述正确的是:()A.仲裁调解达成协议的,仲裁庭应当根据协议制作调解书或者根据协议结果制作裁决书B.对于事实清楚的案件,仲裁庭可依职权进行调解C.仲裁调解达成协议的,经当事人、仲裁员在协议上签字后即发生效力D.仲裁庭在作出裁决前可先行调解 [单选]下列对加油站信用卡(银联卡)加油管理制度的描述错误的是()。A、严格执行操作规程,按规定与银行交换数据,核对加油情况和油款进账情况B、对于需冲销原交易或进行补偿交易的业务,应立即操作C、读写银联卡的机器出现故障时,操作人员应立即终止刷卡结算操作D、在月末前将 [单选]生产、使用易燃易爆化学物品的建筑和场所必须符合()防火规范和有关专业防火规范的要求。A、建筑设计B、安全设计C、建筑防雷D、电气防爆 [判断题]采用顺序分配法分配辅助生产费用,其特点是受益少的先分配,受益多的后分配。先分配的辅助生产车间不负担后分配的辅助生产车间的费用。()A.正确B.错误 [单选,A1型题]既可用于肝气郁滞之胁肋作痛,又可用于食积不化的药物是()A.陈皮B.青皮C.柴胡D.香附E.川楝子
