药物合成反应 第07章 还原反应2011-05-10原
药物合成反应_第七章_还原反应

肼NH2-NH2或二酰亚胺NH=NH,可选择性还原非极性重键(如C=C、碳碳叁键、N=N), 而不影响极性重键(如C=N、腈基、硝基等)。
Ph
C
C
Ph
NH2 NH2 Cu2 + 空气
Ph CH2CH2 Ph
(80%)
烯 ︑ 炔 烃 的 还 原
C7H7SO2NHNH2 CH2 CH CH2 S S CH2 CH CH2 △ C3H7SSC3H7
硝基可被还原为氨基,常用的条件为铁粉+酸、锌或锡+酸、硫化物(如Na2S,Na2S2等)。
O2N
C C C H H O COOEt Fe/HOAc EtOH+H2O NO2
NH2 COOEt
Fe/NH4Cl
H2N
C C C H H O NH2 Na2S
NH2
NO2
硝 基 的 还 原
NO2 NH2
NO2
NaBH4-AlCl3不影响硝基;
HOOO (CH2)4 COOEt
B2H6 / THF -18 C, 10h
0
HOCH2 (CH2)4 COOEt
(88%)
硼烷或乙硼烷与羧基反应最快,如果控制低温和用量,可选择性优先还原羧基而不影响硝
基、卤素、酰卤、氰基、酯基、醛、酮等,选择性非常优秀。
4
硝基的还原 肟和亚甲胺的还原 偶氮、叠氮的还原
OH
NO2
饱 和 醛 酮 的 活 性 大 于 α,β-不 饱 和 醛 酮
2
醇铝为还原剂(Meerwein-Ponndorf-Verley反应)
在异丙醇铝中,醛、酮被还原为醇,取而代之的是异丙醇被氧化为丙酮;此反应可看做是 Oppenauer氧化的逆反应。
药物合成反应第七章还原反应

NiBH4 / NaOH aq,EtOH / 250C
Ni2B + H2
(乙醇中制备P-2型,水中制备P-1型)
CH CH2 Ni2B(P-2) / H2 EtOH
CH2 CH3 (98%)
Raney Ni / H2
R
R
HH
CH2 OH N(CH3)2 OH
OH
OH O Cl O O CONH2
Pd / CaCO3 / H2 /DMF / 喹啉硫 2kg / cm2, 50-550C
B
B
Me Me CH CH2 2 BH
57% 95%
43% 5%
(3) 利用上述性质可制备醇或酮
BH3 3n-C8H17 CH CH2 250C
H2O2 / NaOH H2O
3n-C8H17 CH2 CH2 OH
(95%)
CH3
B3H6 / Et2O 250C
CH3
CH3
CrO3 / H3O / EtOH
Ph C C Ph
NH2 NH2 Cu2 + 空气
Ph CH2CH2Ph
(80%)
NH2 NH2 CH2 CH (CH2)8 COOH K3Fe(CN)6 CH3 (CH2)9 COOH
(69%)
(C=C取代基增多,氢化明显下降)
C7H7SO2NHNH2
CH2 CH CH2 S S CH2 CH CH2
第七章 还原反应
有机物分子中碳原子总的氧化态(Oxidation Stete)
降低的反应为还原反应,即加上H或减少O。 多相催化氢化(Heterogeneous Hydrogenation) 转移氢化(Trandfer Hydrogenation)
药物合成反应-还原反应共59页文档

21、静念园林好,人间良可辞。 22、步步寻往迹,有处特依依。 23、望云惭高鸟,临木愧游鱼。 24、结庐在人境,而无车马喧;问君 何能尔 ?心远 地自偏 。 25、人生归有道,衣食固其端。
▪
26、要使整个人生都过得舒适、愉快,这是不可能的,因为人类必须具备一种能应付逆境的态度。——卢梭
▪
27、只有把抱怨环境的心情,化为上进的力量,才是成功的保证。——罗曼·罗兰
▪
28、知之者不如好之者,好之者不如乐之者。——孔子
▪
29、勇猛、大胆和坚定的决心能够抵得上武器的精良。——达·芬奇
▪
30、意志是一个强壮的盲人,倚靠在明眼的跛子肩上。——叔本华
谢谢!
59
药物合成反应(全) PPT

H2N
COOCH2CH2N(C2H5)2 . HCl
二氢吡啶钙离子拮抗剂的合成
➢ 具有很强的扩血管作用,适用于冠脉痉挛、高血压、 心肌梗死等症。
➢ 本品化学名为1,4-二氢-2,6-二甲基-4-2-硝基苯基)-吡
啶-3,5-二羧酸二乙酯
NO2
➢ 化学结构式为:
CH 3CH 2OOC
COOCH 2CH 3
药物合成反应(全) PPT
药物合成反应教学内容
绪论 第1章 卤化反应 第2章 烃化反应 第3章 缩合反应 第4章 氧化反应 第5章 还原反应 第6章 重排反应 第7章 官能团保护反应 第8章 药物合成反应路线设计
Chapter 1 概论
水杨酰苯胺(Salicylanilide)的合成
➢ 水杨酸类解热镇痛药 ➢ 用于发热、头痛、神经痛、关节痛及活动性风湿症 ➢ 作用较阿司匹林强,副作用小 ➢ 化学名为邻羟基苯甲酰苯胺 ➢ 化学结构式为:
巴比妥(Barbital)的合成
➢ 巴比妥为长时间作用的催眠药。 ➢ 主要用于神经过度兴奋、狂躁或忧虑引起的失眠。 ➢ 学名为5,5-二乙基巴比妥酸,化学结构式为:
O
C2H 5 C2H 5
O
NH O
NH
合成路线如下
H2C
COOC2H5
COOC2H5+C2H5Br
C2H5ONa
C2H5 C2H5
C
CONH
OH
合成路线如下:
OH
OH
COOH
+
PCl3
OH COO
OH COO
NH2
+
CONH OH
苯妥英钠(PHenytoin Sodium)的合成
[药学]还原反应
![[药学]还原反应](https://img.taocdn.com/s3/m/c5fda839fad6195f312ba634.png)
第九章还原反应在还原剂的作用下使有机物分子中增加氢原子或减少氧原子,或者两者兼而有之的反应称为还原反应。
而将硝基、亚硝基、羟氨基、等含碳—氮键的化合物在还原剂作用下制得胺类的方法是还原反应中重要的一类。
同时,不饱和烃的还原、芳烃的还原、羰基的还原、羧酸及其衍生物的还原在药物合成中也有很重要的作用。
还原反应根据所用还原剂及操作方法不同,基本上可分为三类。
凡是使用化学物质包括元素、化合物等作还原剂所进行的还原反应称为化学还原反应,其中包括电化学还原反应。
化学还原反应按机理分主要分为负氢离子转移还原反应和电子转移还原反应。
另一种在催化剂存在下,借助于分子氢进行的还原反应称为催化氢化还原或催化加氢还原。
还有一种利用微生物发酵或活性酶进行的还原反应称为生物还原反应,这里不介绍。
9.1 化学还原反应化学还原反应常有的还原剂有无机和有机还原剂,前者应用更广泛。
9.1.1 金属还原剂1. 底物与进攻试剂金属还原剂包括活泼金属、它们的合金及其盐类。
一般用于还原反应的活泼金属有碱金属、碱土金属、以及铝、锡、铁等。
合金包括钠汞齐、锌汞齐、铝汞齐、镁汞齐等。
金属盐有硫酸亚铁、氯化亚锡等。
金属还原剂在不同的条件下可还原一系列物质,不同的金属还原的应用场合有所差别。
2. 反应机理及影响因素金属还原剂在进行还原时均有电子得失的过程,且同时产生质子的转移。
金属是电子的供给者,而质子供给者是水、醇、酸等化合物。
其还原机理是电子-质子的转移过程。
如羰基化合物用金属还原为差羟基化合物的过程中,是羰基首先自金属原子得到一个电子,五项原则负离子自由基,后者再由金属得到一个电子,形成二价负离子,二价负离子由质子供给者提供质子生成羟基化合物:CO +MC MM-eC MHCH OH(1)铁和低价铁盐为还原剂铁屑在酸性条件下为强还原剂,可将芳香族硝基、脂肪族硝基以及其它含氮氧功能团(亚硝基、羟氨基等)还原成氨基,将偶氮化合物还原成两个胺,将磺酰氯还原成巯基。
药物合成反应(全)

加成反应
总结词
加成反应是一种在药物合成中常见的反应类型,涉及有机化合物中的双键或三键与其它原子或基团结合生成新分 子的过程。
详细描述
在药物合成中,加成反应通常用于制备含有双键或三键的化合物。例如,烯烃中的双键可以与卤素、醇、酸等发 生加成反应,生成相应的卤代烃、醇、酯等化合物。此外,炔烃中的三键也可以与氢气等发生加成反应,生成烯 烃或烷烃。
详细描述
光化学反应通常需要在特定的光源照射下进行,利用光能激发分子使其跃迁至激发态,进而发生化学变化。光化 学反应具有高选择性、高活性和环保等优点,因此在药物合成中常用于合成一些具有特定结构的化合物。
酶催化反应
总结词
酶催化反应是一种利用酶作为催化剂来加速生物体内生化反应的特殊反应。
详细描述
酶是生物体内的一种蛋白质,具有高度专一性和高效性,能够加速生物体内的生化反应。酶催化反应 具有高选择性、高活性和低污染等优点,因此在药物合成中常用于合成一些具有复杂结构的天然产物 或类似物。
压力条件
01
02
03
常压反应
大多数药物合成反应在常 压下进行,操作简便,设 备要求低。
பைடு நூலகம்
加压反应
在高压下,可以提高反应 速度和产率,缩短反应时 间。但加压设备成本高, 操作复杂。
真空反应
在真空条件下,可以降低 反应温度,减少副反应, 提高产物纯度。但真空设 备成本高,操作复杂。
溶剂选择与控制
溶剂的种类
实验废弃物的处理与环保
实验废弃物的分类
根据废弃物的性质和危害程度,将其分为一般废弃物、有害废弃物和危险废弃 物,并采取相应的处理措施。
废弃物处理
对于一般废弃物,可进行简单的分类和处置;对于有害废弃物和危险废弃物, 应按照相关规定进行无害化处理和处置,以降低对环境和人体健康的危害。
药物合成方程式+名词解释+反应机理 石皮 石...
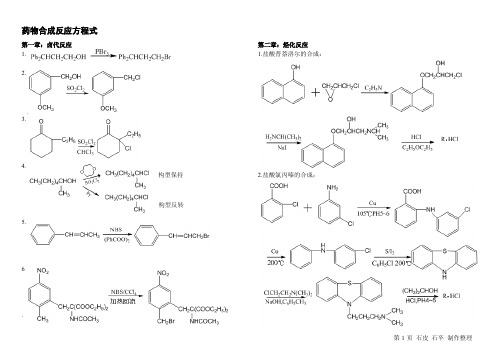
药物合成反应方程式第一章:卤代反应1.2.3.4.5.6.第二章:烃化反应1.盐酸普萘洛尔的合成:2.盐酸氯丙嗪的合成:构型保持构型反转4.第三章:酰化反应 1. 2. 3. 4第四章:缩合反应 1. 2. 3 4.6.7.8.9.10.11. 13.第五章:重排反应1.2.3.4.5.7.8.9. 11.12.13.14.15.17.第六章:氧化反应 一、完成下列反应: 1. 2. 3. 4. 5. 6. 7. 8. 9. 10.℃℃11.12.13.14.二、写出下列反应的主要试剂和反应条件:1.2. 3.4.5.6.7.8.9.第七章:还原反应 一、完成下列反应: 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11.二、写出下列反应的化学试剂和反应条件: 1.2.3.4.5. 其他:1.在利尿药氯噻酮的中间体对氯苯甲酸的制备中,为什么1mol的邻苯二甲酸酐要用2.4mol的AlCl3为催化剂?若傅克酰化反应中用酰氯为酰化剂,催化剂AlCl3的用量如何?反应结束后,产物如何从反应中分离?2.下列两种甾醇以鉻酸氧化时,哪一种速度快,为什么?药物合成名词解释1.Adams’ catalyst (Adams催化剂):将氯铂酸铵与硝酸钠混合均匀后灼热熔融,氧化过程中有大量二氧化氮放出,经洗涤等处理后即得二氧化铂催化剂。
2.Arndt-E istert reaction (Arndt-E istert重排):Arndt-Eistert等用酰氯与重氮甲烷反应得α-重氮酮,再经Wollf重排,生成比原酰氯多一个碳的羧酸,该反应环称Arndt-Eistert反应。
3.Baeyer-Villiger oxidation (Baeyer-Villiger氧化反应):在酸催化下,醛或酮与过氧酸作用,在烃基与羰基之间插入氧生成酯的反应称为Baeyer-V illiger氧化重排。
4.Beckmann rearrangement (Beckmann重排):醛肟或酮肟在酸性催化剂作用下重排成取代酰胺的反应称Beckmann重排。
《药物合成反应》课件

智能化合成
通过自动化和智能化技术 ,实现药物合成的连续化 、高效化和安全化。
组合合成
利用组合化学的方法,快 速发现和优化具有生物活 性的小分子药物。
生物合成
利用生物系统进行药物合 成,降低生产成本,提高 生产效率。
对药物合成反应的期许与展望
创新药物的研发
期待通过药物合成反应的创新, 开发出更多具有自主知识产权的
安全防护措施
根据实验可能产生的危险和污染,准备相应的防护用品,如化学防护 眼镜、实验服、化学防护手套等,确保实验操作人员的安全。
实验操作步骤
实验操作流程
实验数据记录
按照实验步骤逐步进行实验操作,注意控 制反应温度、压力、时间等参数,确保实 验条件的一致性和准确性。
在实验过程中及时记录实验数据,如反应 温度、压力、物料投加量、产物产量等, 以便后续数据处理和分析。
应急措施
实验人员应了解可能发生的意外情况 ,并掌握相应的应急处理措施,如火 灾、化学品泄漏等。
环保要求
减少废物产生
通过优化实验设计和采 用更环保的试剂来减少
废物的产生。
废液分类处理
将废液按照性质进行分 类,并采取相应的处理 措施,如回收、焚烧或
安全填埋。
节能减排
合理利用能源和资源, 减少实验过程中的能源
醚化反应实例
总结词
醚化反应是醇与卤代烷在酸催化下生成醚和卤化物的反应, 也是药物合成中常用的反应类型之一。
详细描述
醚化反应实例包括乙醇与溴乙烷在硫酸催化下生成乙基溴化 镁和溴化物,以及甲醇与氯甲烷在硫酸催化下生成甲基氯化 镁和氯化物。这些醚化反应在药物合成中常用于制备醚类化 合物,如局部麻醉药和抗肿瘤药等。
反应条件
(优选)药物合成反应第七章还原反应

饱 和 醛 酮 的 活 性 大 于 α,β-不 饱 和 醛 酮
还 原 为 醇
2
p 醇铝为还原剂(Meerwein-Ponndorf-Verley反应) 在异丙醇铝中,醛、酮被还原为醇,取而代之的是异丙醇被氧化为丙酮;此反应可看做是 Oppenauer氧化的逆反应。
O2N
O NHAc
(i-PrO)3Al
还
原
胺
化
3
酰卤的还原 酯及酰胺的还原 腈的还原
羧酸&酸酐的还原
l 应用特点:
酰
Rosenmund还原:钯分散于BaSO4中,并以喹啉-硫抑制催化活性,选择性还原到醛。
卤
H2/Pd-BaSO4
的
PhHC
CH COCl 喹啉-硫/二甲苯 PhHC
NO2
H2/Pd-BaSO4
NO2
CH CHO
还 原
喹啉-硫/二甲苯
不同官能团加氢还原的一般顺序:
烯、炔烃的还原 芳烃的还原
l 应用特点:
p 常见的过渡态金属催化剂有镍类(如Ni、Raney镍),铂类(如铂黑、PtO2),钯类(如
O
Pb/C、林德拉Lindlar催化剂)
例如:
AcO
O Pd/CaCO3, H2
1atm, 45℃
O OCO CH3
+
AcO H
Pd-C / EtOH △ 5h
O OCO CH3
(65%)
O
受氢体
供氢体
O
CH3
CH3
常见的供氢体还有环己二烯、四氢化萘、乙醇、异丙醇。
烯 、 炔 烃 的 还 原
1
CH2OH Pb-CaCO3/H2/喹啉 OH
药物合成反应讲义还原反应课件

COOH H2,Rh/C 5Kg/cm2
NH2
COOH NH2
OH H3C
Pd-C/H2
O H3C
CH3
CH3
34
芳烃的还原反应
2. Birch反应
芳香化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙 醇或仲丁醇)的混合液中还原,苯环可被还原成非共轭的1,4-环 己二烯化合物。
1 Clemmensen还原(酸性条件下反应)
O Zn-Hg/Zn
C HCl
Zn-Hg 活性>Zn
CH2
HgCl2+HCl+Zn
碳离子中间体过程:
Zn-Hg
38
醛、酮的还原反应---还原成烃
1、羧基,酯, 酰胺羰基不影响
2、α-酮酸酯只能被还原为-OH;β-或γ-酮酸酯能被很 好的还原
39
醛、酮的还原反应---还原成烃
Yes
• aldehydes or ketones ( C=O )
But, RCOOH, RCOOR’, and RCONHR’ No
5
Heterogeneous Hydrogenation Relative reactivity of the Functional Groups by Catalytic Hydrogenation(-不同功能团氢化难易顺序表)
O OCOCH3
+ O
CH3
Pd-C / EtOH ,5h
O OCOCH3
65%
O CH3
7
二. Homogeneous Hydrogenation
均相催化剂:
Metal: VIII( Ru, Rh, Co, Ir, Pt) Ligand: Cl, CN, H, Ph3P,CO,NO
还原反应 药物合成反应课件

O
CH3 CH2
85%H2NNH2.H2O/KOH/TEG
180~200
HO
HO
(85%)
O
OH H2NNH2/KOH
AcO
△ AcO
Br
Br
H2NNH2/KOH
O
△
H
H
O
C 的 α位 有 离 去 基 团 -X,-OH, O ,消 除 反 应 后 得 不 饱 和 化 合 物
使催化剂中毒的物质称毒剂,使其阻化的物质称抑制剂。对 氢化常用催化剂来说,毒剂主要是指硫、磷、砷、铋、碘等 离子以及某些有机硫化物和有机胺类。
炔、烯的选择性加氢及立体化学
炔键及烯键均为易于氢化还原的官能团。通常用钯、铂和 Raney镍为催化剂,在温和条件下即可反应。 除酰卤和芳硝基外,分子中存在其它可还原官能团时,均 可用氢化法选择性地还原炔键和烯键。
H2/5%Pd-C COOH 145~160 ,3.92MPa
[31]
COOH (95%)
2. 化学还原法
Birch反应
芳香族化合物在液氨中用钠(锂或钾)还原生成非共轭 二烯的反应称Birch反应。 一取代苯,若取代基为释电子基化合物(25),生成1– 取代–1,4–环己二烯;若为吸电子基(26),则生成 1–取代–2,5–环己二烯。
Zn-Hg/HCl Heat
OH
[39]
CH2 (CH2)5 CH3 (86%)
所有芳香脂肪酮
Clemmensen还原反应,几乎可应用于所有芳香脂肪 酮的还原,反应易于进行且产率较高。底物分子中有羧 酸、酯、酰胺等羰基存在时,可不受影响。
药物合成还原反应

键或羰基还原。
02 药物合成中的还原反应
碳碳双键的还原
总结词
碳碳双键是常见的有机化合物结构,还原碳碳双键是药物合成中的重要反应。
详细描述
碳碳双键的还原可以通过催化加氢、金属氢化物、硅氢化物等还原剂实现,得 到相应的饱和烃。在药物合成中,还原碳碳双键可以用于制备多种类型的化合 物,如甾体激素类药物、抗生素类药物等。
神类药物等。
酰胺的还原
总结词
酰胺是一类含有氨基和羰基的有机化 合物,还原酰胺是药物合成中的重要 反应。
详细描述
酰胺的还原可以通过金属氢化物、醇 铝等还原剂实现,得到相应的胺。在 药物合成中,还原酰胺可以用于制备 多种类型的化合物,如抗感染类药物、 抗肿瘤类药物等。
03 药物合成还原反应的机理
加氢还原机理
高效催化剂的开发与应用
挑战
开发高效催化剂是实现药物合成还原反应的关键,但 寻找具有高活性、高选择性和高稳定性的催化剂仍具 有挑战性。
解决方案
通过材料科学、化学和生物学等多学科交叉研究,探 索新型高效催化剂,并优化催化剂的制备方法和反应 条件,以提高药物合成还原反应的效率和产率。同时 ,加强催化剂的循环使用和废弃物处理,降低生产成 本和环境负担。
硫化物还原机理
总结词
利用硫化物如硫化钠、硫氢化钠等作为还原 剂,将有机化合物中的碳碳双键或碳碳三键 还原为单键或零键。
详细描述
硫化物还原反应中,硫化物与有机化合物反 应,通过转移硫原子将双键或三键还原为单 键或零键,该反应通常在酸性条件下进行。
金属酸性还原机理
总结词
利用金属酸性物质如锌、镁等与酸反应,产 生氢气并还原有机化合物中的碳碳双键或碳 碳三键。
环境友好型反应条件的探索与实践
药物合成反应-还原反应

2014-7-29
2. 二酰亚胺还原
二酰亚胺(HN=NH)为选择性较好的还原试剂,可有效地还原非极性重键(如C=C, N=N等),而极性重键(如C=N, NO2等)不受影响;其也可以作为氢转移试剂。
(1)通式:
(2)机理:其反应机理为,不饱和键与二酰亚胺通过一个非极性环状过渡态,然后,氢转移 不饱和键并放出氮而完成还原反应,因而其加氢也为同向加氢。
钯C(Pd/C)
Lindlar(林德拉)催化剂 Pd/BaSO4/喹啉 炔 Lindlar 烯
2014-7-29
③铂(Pt)为催化剂
铂 Na2PtCl6 + 2HCl + 6NaOH H2PtCl6 + NaBH4 Pt PtO2 + 4NaCl + 2NH4Cl + 4NO2 + O2
亚当斯催化剂 (Adams) PtO2
1. NaBH4 2. H+, H 2 O R
OH
H 2NNH 2 HO-, Δ
R
H2 C
R
脱氧或加氢的反应称为还原
2014-7-29
O R H
H2 CrO4 R
O OH
an aldehyde OH R R an alcohol H2 CrO4 R O C
R
加氧或脱氢的反应称为氧化
2014-7-29
CH2CH2CH2COOH
羧基不被还原
2014-7-29
2 . 黄鸣龙还原(碱性条件下还原)
R R C O + H2N
R R C
B
NH2
△
R R
CH2 + N2
TEG or DEG(三 甘 醇 、 二 甘 醇 ) 120℃( 蒸 出 H2O)
《药物合成反应》第七章还原反应-revised

7%
29
EtOH/KOH
35-50%
65~50%
转移氢化
❖ 有机物为供氢体
计划生育药安宫黄体酮(Medroxyprogesterone)的制备
O O CO CH3
+ O
CH3
Pd-C/EtO H , 5h O
O O CO CH3
CH3
30
转移氢化
❖ 二酰亚胺为氢转移试剂
HN NH +
CC
HH NN
酶催化法
4
一. 非均相催化氢化
❖ 催化剂自成一相(固相) ❖ 氢源:
➢ H2(多相催化氢化,Heterogeneous hydrogenation), ➢ 有机物(转移氢化,Transfer hydrogenation ).
❖ 溶剂
5
1. 多相催化氢化
P t/H 2
H 2 C C H 2
C H 3 C H 3
历程: ❖ 氢分子与催化剂活性中心化学吸附 ❖ 烯烃与催化剂活性中心化学吸附,双键被活化 ❖ 活化氢分步加成,得到半氢化中间产物 ❖ 氢順式加成得烷烃 ❖ 产物分子由催化剂表面解吸
6
影响因素
❖ 化学吸附
➢ 电性因素 催化剂金属最外层d轨道占有8~9个电子最合适; 空d轨道过少不易吸附,过多不易解吸; (Ni、 Cu、 Pt、Pd、Rh等)
1.金属氢化物为还原剂
❖ 本类还原剂是以K、Na、Li离子和B、Al等复氢负离子 形成的复盐,如LiAlH4 、LiBH4 、KBH4、NaBH4、 (CH3CH2CH(CH3)-)3BHLi 等。 硼氢负离子作为亲核基团,机理如下:
H
R
H B H+O C
R
颜范勇-第七章还原反应-全

美国化学协会(American Chemical Society) 通信地址:1155 Sixteenth St., N.W., Wsshington,D.C. 10036,U.S.A
24
• (2) 多相催化氢化影响因素: ①作用物的结构 ②作用物的纯度 ③催化剂的种类和用量 ④溶剂和介质的酸碱度 ⑤温度 ⑥压力 ⑦接触时间 ⑧搅拌
9
底物的化学吸附形式:
• (a) 氢的吸附:解离吸附。氢分子在催化剂表面
时,解离成氢原子(* 代表催化剂的活性中心)
H2 + 2
*
2H
*
10
• (b) 烯的二σ吸附:π 键打开重新形成σ键
RaCH=CHRb+ 2 * RaCH * CH Rb *
烯的π 吸附:形成π 化合物
R CH=CHR + *
H2C CH2
COOH COOH 80%
NH2NH2/Cu2+/Oc CuSO4 100%
36
• (5) 炔烃的氢化
• 炔键易被氢化,首先氢与炔进行顺式加成, 生成烯烃;然后进一步氢化,生成烷烃。 • 炔烃还原所用的催化剂通常为Raney Ni 、钯、 铂等,在常温常压下能迅速反应。控制适当 条件可优先还原炔键,分子中的其它基团 (芳硝基和酰卤除外)往往能保留下来 ,当 分子中有多个炔键时,末端的炔键优先被还 原,位阻小的炔键比位阻大的优先还原。
• 优点:
• • • • 较高的选择性; 不对称还原; 对毒剂不敏感,不易中毒; 不伴随发生异构化、氢解等副反应。
43
末端双键易氧化
单取代>双取代>三取代>四取代
OH
H2/TTC
OH
PhH RT
易氢化末端双键 90%
药物合成导图-还原反应

对脂肪酮、醛或脂环酮的还原
对酸、热敏感底物的还原:条件需温和
Wolf-黄鸣龙反应
醛、酮在强碱性条件下和水合肼加热,还原成烃
反应通式
反应机理 影响因素 应用特点
水合肼向醛、酮羰基亲核进攻 介质对反应的影响:85%的水合肼、氢氧化钾反应 介质中含有水对反应的影响:腙在分解前应尽量去除水分 醛、酮还原为烃:弥补了clemmensen的不足,适用于对酸敏感的物质 腙还原为烃
酸性条件,用锌汞齐或锌粉将醛基、酮基为甲基和亚甲基
反应通式: 反应机理
应用特点
碳离子中间体历程 自由基中间体历程
应用范围:适用于所有芳香酮或者脂肪酮的还原
存在选择性:羧酸、酯、酰胺不受影响
对酮酸及其酯的还原:α位,羟基;β位,亚甲基
对不饱和酮的还原
与羰基共轭的双键同时被还原 与酯基共轭的双键被仅双键被还原
应用特点:分子中含有烯键、炔键、硝基、氰基及卤素均无影响
三、四
多想催化氢化还原
反应通式 应用特点
还原剂种类:Raney镍、铂、钯等过渡金属 脂肪族醛、酮的还原:Raney镍和铂 芳香醛、酮的还原:Raney镍和钯
均相催化氢化
反应通式 应用特点:Ru、Ir和有机磷形成络合物,有机磷-BINAP
还原胺化反应
羰基的还原胺化反应
反应通式 反应机理:亲核加成反应机理 影响因素:催化氢化活泼金属与酸、金属氢化物、甲酸及其衍生物等 应用特点:制备伯仲叔胺
LW和EC反应
LW反应:过量甲酸存在下,羰基化合物与氨、胺的还原胺化反应
EC反应:过量甲酸作用下,甲醛与伯胺、仲胺反应生成甲基化胺的反应
反应通式
影响因素
还原剂及介质:甲酸、甲酸铵或甲酰胺的反应 反应条件:一般不用溶剂,特殊情况去水即可
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
用量% 1~2 10~20
催化剂 Raney Ni Pd-SrCO3
用量% 10~20 1~2
☆应根据被氢化物以及反应设备条件来选择合适的催化 剂。催化剂的用量与被氢化物的结构、催化剂的种类、 活性以及反应条件多种因素有关。
第二节 不饱和烃的还原
▲ 一.炔烃、烯烃的还原 非均相催化氢化反应影响因素 3 溶剂和介质的酸碱性 在低压催化氢化反应中,溶剂对催化剂的活化作用顺序为: 石油醚<环己烷<苯<甲苯<乙醚<乙酸乙酯<丙酮<乙醇<水< 甲醇<醋酸。可用于高压氢化的溶剂有乙醇、环已烷、甲
第二节 不饱和烃的还原
▲ 一.炔烃、烯烃的还原 非均相催化氢化反应影响因素
1 被氢化物的结构与性质
R COCl > ( > R CHO ( ( > PhOH2OR RCOOR' > ( R CHO ) > R NO2 ( R CH2OH) > R CH CH PhMe ROH ) > RCN( R NH2 ) > R C R' ( C R' ( R CH CH R' ) R CH2CH2 R' ) > RCOR' ( ( ( R C(OH)R') ) > )
概 述
分类 催 化 氢 化 多 相 催 化 氢 化 ( d轨 道 Co,Rh,Pd,Pt…) H2↑ 均 相 催 化 氢 化 ( 将 催 化 剂 变 为 络 合 物 ) 两 相 H2↑/液 相 TTC 转 移 氢 化 ( 采 用 有 机 氢 源 H2NNH2·H2O 无机还原剂 化学还原 有机还原剂 KBH4 NaBH4
O
) HN
NH
HC NH2
意 义 : NO2
NH2
O C
OH C H C C CH CH OH
第二节 不饱和烃的还原
概 述
化学还原法
• 化学还原法是使用化学物质作为还原剂的
还原方法。化学还原剂种类繁多,本章则
主要介绍目前在药物合成工业中常用的几
种。主要包括金属和低价金属盐还原、金
属氢化物还原、非金属化合物为还原剂的
还原等。
概 述
催化还原
• 在催化剂存在下,有机化合物与氢的反应称为催
化氢化。其中催化剂以固体状态存在于反应体系 中的反应体系中的称为非均相催化氢化,而催化 剂溶解于反应介质的称为均相催化氢化。 • 从反应结果来看,催化氢化又分为两大类,即催 化加氢和催化氢解。
概 述
生物还原
• 生物还原技术就是利用微生物代谢过程中产生的酶,来选 择性地催化底物,实现底物还原过程的一种方法,其在还 原、特别是不对称还原领域具有重要的应用。虽然基于过
等都不起作用。
机理:
O
C C
NH2
NH2
HN
NH H
C
C H
N2
C H
C H
N N
第二节 不饱和烃的还原
▲ 一.炔烃、烯烃的还原
3 二酰亚胺(联亚胺)还原
影响因素与应用特点: 联亚胺氢化反应通常是从不对称烯烃空间位阻小的一侧进行 加成的。它的反应性受烯烃分子中取代基数目和性质的影响, 通常反式烯烃的还原速率要比顺式烯烃大。因此,在有机合 成中,可进行适当控制,仅还原反式烯键而保留顺式双键,
物中的烯键氢化困难得多。 但相对苯环来说,芳稠环如萘、蒽、菲的活性要高一 些。
4 H2 3 H2
3 H2
3 H2
4 H2
3 H2
第二节 不饱和烃的还原
▲ 二.芳烃的还原反应
2 化学还原( Birch,伯奇还原)
芳香化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇)
的混合液中还原,苯环可被还原成非共轭的1,4-环己二烯化合物。
第二节 不饱和烃的还原
▲ 一.炔烃、烯烃的还原
1 多相催化氢化法 ---催化剂 Ni , Pd , Pt
①镍为催化剂: RNi(Raney Ni)(活性Ni): H2 O
Al-Ni+NaOH
Na2AlO4+Ni+H2↑
第二节 不饱和烃的还原
▲ 一.炔烃、烯烃的还原
1 多相催化氢化法 ---催化剂 Ni , Pd , Pt
与助催化剂相对应,有些物质则能使催化剂降低或失去活性或
选择性,这些物质称作抑剂。元素周期表中IVB族(Zr、Hf等) 及VA族(N、P、As、Sb、Bi)的化合物、硫化物、氰化物等都
可以抑制催化剂的活性。这些物质可以与催化剂的活性中心发生强
烈的化学吸附,从而使催化剂活性丧失或降低。
第二节 不饱和烃的还原
Birch
Li
K
Na( 液 NH3)
第二节 不饱和烃的还原
▲ 二.芳烃的还原反应
2 化学还原( Birch,伯奇还原)
机理:
R e R NH3
H
H
H
H
H
H
R
e
R NH3
R
H
H
影响因素:
Birch反应为电子转移类型机理,当环上有吸电子基存在时, 能加速反应;当有供电子基存在时,则阻碍反应的进行。
第三节 醛、酮的还原反应
TTC本 身 就 是 络 合 物 不 会 使 催 化 剂 中 毒
第二节 不饱和烃的还原
▲ 一.炔烃、烯烃的还原
3 二酰亚胺(联亚胺)还原
联亚胺氢化的选择性特别强,它能与 起氢化作用;对于 C S S O, C N, C C C , N, C N C O O , , N N O, N S , O O O
(2)羰基选择性高,只对酮羰基起作用,对酯羰基、酰
胺中羰基无还原作用;
(3)不饱和羰基物的还原情况
ⅰ孤立双键不受影响;ⅱ酮羰基共轭双键,同被还原;ⅲ
酯羰基共轭双键,仅双键被还原
第三节 醛、酮的还原反应
▲ 一.还原成烃的反应
2 黄鸣龙还原(碱性条件下还原)
R C R O
+ H2N
NH2
B
△
R R CH2
第三节 醛、酮的还原反应
▲ 一.还原成烃的反应
1 Clemmensen还原(酸性条件下反应)
O C
Zn-Hg/Zn HCl
CH2
Zn-Hg 活性>Zn
HgCl2+HCl+Zn
Zn-Hg
O H3CCHC C H O PhC C CCH3 Hg-Zn HCl PhHC C H CH2CH3 Hg-Zn HCl α,β -不饱和醛酮同时被还原 H3 CH2CH2CH2C
第二节 不饱和烃的还原
▲ 一.炔烃、烯烃的还原
4 硼氢化反应
特点二:立体选择性高
H B
BH3 H 2O2 , NaOH
OH
顺式加成
应用:
RCH
CH2
BH3
(RCH2CH2)3B
C2H5COOH
3RCH2CH3
第二节 不饱和烃的还原
▲ 二.芳烃的还原反应
1 催化氢化 (高压条件下)
R R
H 2/Ni
Lindlar(林德拉)催化剂 Pd/BaSO4/喹啉 炔
烯
第二节 不饱和烃的还原
▲ 一.炔烃、烯烃的还原
1 多相催化氢化法 ---催化剂 Ni , Pd , Pt
(3)Pt Na2PtCl6 + 2HCl + 6NaOH + CH 2O H2PtCl6 + NaBH4 PtO2 Adams (NH4)2PtCl6 + 4NaNO 3 PtO2 + 4NaCl + 2NH 4Cl + 4NO 2 + O2 Pt Pt + 2HCOONa + 6NaCl + 4H2O
起到双键选择性还原的目的。
第二节 不饱和烃的还原
▲ 一.炔烃、烯烃的还原
4 硼氢化反应
机理:
(
C C
BH3
O(CH2CH2OCH 3)2
C C H BH2
C C BH2
C C H
)3B
H3O
3
C C H H
B(OH)3
特点一:区域选择性高
7% 93% CH3 CH2 CH CH2 CH3 CH2 1% 99% C CH3 CH2 0%100% C CH3 CH2
RCH2NH2) >
RCH2OH
R'OH ) > RCONHR'(
RCH2NHR') >
对烯烃和炔烃而言,位阻较小的的不饱和键活性大于位 阻较大的不饱和键。
第二节 不饱和烃的还原
▲ 一.炔烃、烯烃的还原 非均相催化氢化反应影响因素
2 催化剂种类及用量
催化剂 5%Pt-C, Pd-C, Rh-C RuO2
H3CHC OH
COOEt
α-酮 酸 酯 只 能 被 还 原 为 -HO 对比 β-酮 酸 酯 能 很 好 的 被 还 原
CH3COCH2COOEt
CH3CH2CH2COOEt
第三节 醛、酮的还原反应
▲ 一.还原成烃的反应
1 Clemmensen还原(酸性条件下反应)
特点: (1)适用范围广,几乎可适用于所有酮类化合物;
+ N2
▲ 一.炔烃、烯烃的还原
2 均相催化反应
(Ph3P)3RhCl, TTC(氯化(三苯瞵)合铑)、(Ph3P)3RuCl、苯、EtOH 、丙酮 末端双键易氧化 单取代>双取代>三取代>四取代
OH
H 2/TTC
OH
PhH RT
易氢化末端双键 90%
S CH2CH=CH2
H2 TTC
