大肠杆菌(E.coli)酶联免疫分析
酶联免疫分析的基本类型和原理

酶联免疫分析的基本类型和原理酶联免疫分析(Enzyme-Linked Immunosorbent Assay,ELISA)是一种灵敏的免疫学分析方法,广泛应用于生物医学领域,包括基础研究、临床诊断、药物筛选等。
该方法基于抗原-抗体的特异性结合反应,将酶与抗体或抗原的结合,通过酶促反应的放大效应,实现对蛋白质的灵敏检测。
一、酶联免疫分析的基本类型根据实验设计的不同,酶联免疫分析可以分为直接法和间接法两大类。
1.直接法:将酶标记的抗体直接与抗原反应,通过检测抗原-抗体-酶复合物的吸光度来定量抗原。
这种方法适用于检测抗原含量较高的样品,如病毒、细菌等。
2.间接法:将酶标记的抗抗体与特异性抗体反应,通过检测抗抗体-抗体-酶复合物的吸光度来定量特异性抗体。
这种方法适用于检测特异性抗体含量较高的样品,如血清、血浆等。
二、酶联免疫分析的原理酶联免疫分析的原理是利用抗原-抗体的特异性结合反应,将酶与抗体或抗原的结合,通过酶促反应的放大效应,实现对蛋白质的灵敏检测。
具体步骤如下:1.包被:将抗原或抗体包被在固相载体(如聚苯乙烯酶标板孔)上,使其与样品中的抗原或抗体结合。
2.温育:将包被后的样品放入温育箱中,保持一定温度和湿度,使抗原-抗体结合反应充分进行。
3.洗涤:洗涤未结合的游离抗原或抗体,去除未结合的物质,使后续步骤中的酶促反应更加特异。
4.加入酶标抗体或酶标抗原:将酶标记的抗体或抗原加入到洗涤后的样品中,使其与已结合的抗原或抗体特异性结合。
5.温育:将样品再次放入温育箱中,保持一定温度和湿度,使酶促反应充分进行。
6.洗涤:洗涤未结合的游离酶标抗体或酶标抗原,去除未结合的物质,使后续步骤中的显色反应更加特异。
7.显色:加入底物溶液,使其与已结合的酶标抗体或酶标抗原中的酶发生显色反应,生成有色产物。
8.终止反应:加入终止液,停止显色反应,使有色产物不再生成。
9.检测:用酶标仪测定各孔的光密度值,通过与标准曲线比较,计算出样品中待测抗原或抗体的浓度。
酶联免疫检测方法

酶联免疫检测方法
酶联免疫检测是一种常用的生物技术方法,它结合了酶标记和免疫反
应的原理,可用于检测生物样品中特定分子的含量,如蛋白质、抗体、激
素等。
具体步骤如下:
1.准备样品:从生物样品中提取目标分子,例如血液、尿液、细胞等。
2.免疫反应:将一定浓度的目标分子加入到反应孔中,并加入与目标
分子特异性的抗体,使两者发生免疫反应。
3.洗涤:对反应孔进行洗涤,以去除未与抗体结合的杂质以及剩余的
抗体。
4.添加荧光标记的二抗:向反应孔中加入荧光标记的二抗,使其与已
结合的抗体形成复合物。
5.洗涤:对反应孔进行再次洗涤,以去除未结合的荧光标记的二抗。
6.酶标记:向反应孔中加入用酶标记的物质(如酶标记的抗体),使
其与已结合的荧光标记的二抗形成复合物。
7.洗涤:对反应孔进行最后一次洗涤,以去除未结合的酶标记化合物。
8.反应染色:向反应孔中加入染色物质,使其与酶标记化合物发生颜
色反应,形成分析结果。
最终,检测结果可以通过测量反应孔中染色物质的光密度或荧光强度
来评估样品中目标分子的浓度。
酶联免疫检测方法具有高灵敏度、高特异
性和高通量等优点,广泛应用于医学、生物工程、食品安全等领域。
酶联免疫吸附试验方法类型及反应原理

酶联免疫吸附试验方法类型及反应原理酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)是一种常用的生物化学分析方法,用于检测并定量测定生物样品中的抗体或抗原。
ELISA方法包括直接ELISA、间接ELISA、竞争ELISA和间接竞争ELISA等。
下面将对这些方法的类型和反应原理进行详细介绍。
1.直接ELISA直接ELISA是最简单的ELISA方法之一、在这种方法中,微孔板表面上涂覆有抗原,然后加入待检测样品,如血清等。
待检测样品中的抗体与涂覆的抗原结合,形成抗原-抗体复合物。
然后加入特异性抗体,这些抗体已标记有酶,比如辣根过氧化物酶(horse radish peroxidase,HRP),然后加入适当的底物。
酶与底物反应产生比色或荧光信号,信号的强度与待测样品中抗原或抗体的浓度成正比。
2.间接ELISA间接ELISA是常用的ELISA方法之一,比直接ELISA灵敏度更高。
在这种方法中,微孔板表面上涂覆有抗原,然后加入待检测样品,如血清等。
待检测样品中的抗体与涂覆的抗原结合,形成抗原-抗体复合物。
然后加入与待测抗体特异性的二抗,这些二抗已标记有酶,如HRP,再加入适当的底物。
酶与底物反应产生比色或荧光信号,信号的强度与待测样品中抗原或抗体的浓度成正比。
3.竞争ELISA竞争ELISA是一种用于测定样品中抗原或抗体浓度的ELISA方法。
在这种方法中,微孔板表面上涂覆有特异性抗体,然后加入待检测样品和已标记的抗原或抗体。
待检测样品中的抗原或抗体与涂覆的抗体竞争结合,形成复合物。
然后加入特异性的抗原或抗体,这些抗原或抗体已标记有酶,比如HRP,继续竞争与涂覆抗体结合。
酶与底物反应产生比色或荧光信号,信号的强度与待测样品中抗原或抗体的浓度成反比。
4.间接竞争ELISA间接竞争ELISA是一种用于测定样品中抗原或抗体浓度的高灵敏度ELISA方法。
在这种方法中,微孔板表面上涂覆有抗原。
大肠埃希菌的临床分布及其耐药性分析

大肠埃希菌的临床分布及其耐药性分析大肠埃希菌(Escherichia coli)是肠道常见菌群中的成员之一,同时也是人体和动物肠道中数量最多的细菌。
在很多情况下,大肠杆菌不会对人体产生任何不良影响,但是某些菌株会引起疾病。
这些致病性大肠杆菌主要包括肠致病性大肠杆菌(enterohemorrhagic Escherichia coli,EHEC)、产生肠毒素的大肠杆菌(enterotoxigenic Escherichia coli,ETEC)等。
本文将对大肠埃希菌的临床分布及其耐药性进行分析。
大肠杆菌(E. coli)常常是肠道常见菌群的成员之一,但在某些情况下,这些微生物会被发现在其他区域或组织中。
以下是大肠杆菌在人体中的临床分布:1. 泌尿生殖道感染大肠杆菌是人体泌尿生殖系统中最常见的致病菌之一,据研究,80%以上的泌尿系统感染都是由大肠杆菌引起的。
2. 腹泻大肠杆菌也是腹泻病原菌之一。
产生肠毒素的大肠杆菌(ETEC)和肠致病性大肠杆菌(EHEC)是许多腹泻和食物中毒的元凶。
肠道感染通常通过口-粪途径传播,常常发生在卫生条件较差的地区,如发展中国家。
3. 呼吸道感染大肠杆菌在呼吸道感染中也偶尔被发现,特别是在患者的免疫系统受到抑制的情况下。
由于呼吸道感染通常被其他致病菌占据,因此大肠杆菌在这方面的作用很小,不过在研究中仍有发现。
4. 脑膜炎大脑膜炎是一种由感染性微生物引起的严重疾病。
虽然大肠杆菌通常是肠道菌群的成员之一,但偶尔也会引起脑膜炎。
感染虽然比较罕见,但是非常危险。
5. 其他大肠杆菌还偶尔被发现在胆囊、脾脏和其他组织中。
尽管大肠杆菌的分布范围很广,但在这些区域的感染相对罕见。
大肠杆菌耐药性是世界卫生组织所关注的一项严峻问题。
肠道菌群中的一些E. coli菌株可能会对一些抗生素产生抗性。
以下是大肠杆菌的耐药性分析:1. β-内酰胺类抗生素耐药(如氨苄西林)许多大肠杆菌对β-内酰胺类抗生素具有耐药性。
检测大肠杆菌的方法

检测大肠杆菌的方法
检测大肠杆菌的方法包括以下几种:
1. 化学方法:使用化学试剂检测大肠杆菌的生长产物,例如检测β-半乳糖苷酶(β-galactosidase)或亚硝酸盐的产生。
2. 免疫学方法:使用抗原抗体反应来检测大肠杆菌的存在。
可以通过免疫层析试纸、酶联免疫吸附试验(ELISA)或免疫荧光染色等技术进行检测。
3. 分子生物学方法:使用DNA提取和PCR扩增技术,通过特定基因的检测来确定大肠杆菌的存在。
常用的是检测16S rRNA基因。
4. 血液培养法:将样品接种到含有适合大肠杆菌生长的培养基上,经过一段时间后观察是否有菌落形成。
5. 基于大肠杆菌特定生理和生化特征的传统方法:根据大肠杆菌在营养琼脂培养基上形成金属光泽、产生气泡、使用L-色氨酸作为唯一氮源,以及产生酸和气体等特征来进行初步检验。
这些方法可以单独或结合使用来对大肠杆菌进行检测,并能够提供快速、准确的结果。
大肠杆菌及其检验

大肠杆菌及其检验大肠杆菌的生物学特性∙简介:大肠埃希氏菌习惯称为大肠杆菌,分类于肠杆菌科,归属于埃希氏菌属,并且大肠杆菌株ATCC 11775是该属的模式菌种。
附:肠杆菌科各属大肠杆菌的不同菌株间DNA相关性为80%,而与同科的志贺氏菌属(除鲍氏志贺氏菌外)的DNA相关性可达80-87%。
大肠杆菌为人和动物肠道中的常居菌,一般多不致病,在一定条件下可引起肠道外感染。
∙形态与染色大小0.4~0.7×1~3um,无芽胞,大多数菌株有动力。
有普通菌毛与性菌毛,有些菌株有多糖类包膜,革兰氏阴性杆菌。
附:有动力是什么意思?请看动力试验。
革兰氏阴性杆菌是什么意思?请看革兰氏染色介绍。
大肠杆菌扫描电镜照片大肠杆菌透射电镜照片大肠杆菌分裂照片最新:大肠杆菌革兰氏染色照片∙培养特性由于此菌合成代谢能力强,在含无机盐、胺盐、葡萄糖的普通培养基上生长良好。
最适生长温度为37℃,在42-44℃条件下仍能生长,生长温度范围为15-46℃。
在普通营养琼脂上生长表现3种菌落形态:(1)光滑型:菌落边缘整齐,表面有光泽、湿润、光滑、呈灰色,在生理盐水中容易分散。
(2)粗糙型:菌落扁平、干涩、边缘不整齐,易在生理盐水中自凝。
(3)粘液型:常为含有荚膜的菌株。
此菌兼性厌氧,在有氧条件下生长良好,最适生长pH为6.8-8.0,所用培养基pH为7.0-7.5,若pH值低于6.0或高于8.0则生长缓慢。
附:菌落形态有什么用处?菌落形态学生化反应大部分菌株发酵乳糖产酸产气,并发酵葡萄糖、麦芽胞、甘露醇、木胶糖、阿拉伯胶等产酸产气。
IMViC试验为“+、+、-、-”。
即为典型大肠杆菌。
∙抗原构造比较复杂,主要由菌体O抗原、鞭毛H抗原、夹膜K抗原组成。
∙抵抗力该菌对热的抵抗力较其他肠道杆菌强,55℃经60分钟或60℃加热15分钟仍有部分细菌存活。
在自然界的水中可存活数周至数月,在温度较低的粪便中存活更久。
对磺胺类、链霉素、氯霉素等敏感,但易耐药,是由带有R因子的质粒转移而获得的。
大肠杆菌表达的重组蛋白外源性E.coli宿主残留DNA检测方法研究

大肠杆菌表达的重组蛋白外源性E.coli 宿主残留DNA检测方法研究摘要:目的:建立大肠杆菌表达的重组蛋白外源性E.coli宿主残留DNA的检测方法用于生产过程以及最终产品的质量控制。
方法:参考试剂盒相关说明书,样品加标回收了率无法达到2020版中国药典(Ch.P)第四部3407章节和美国药典(USP)1130章节的要求,通过对药物浓度、处理温度、糖原的蛋白酶K的使用量以及不同的加标量的优化,即将样品稀释10倍后,加30pg的E.coli标准品,20μl的蛋白酶K消化1h,选择15μl PCR反应体系。
结果:回收率满足在50%~150%之间。
结论:借助商品化的试剂盒,优化的外源性DNA提取条件满足法规要求、操作简便,非常适用于大肠杆菌表达的重组蛋白生产过程以及最终产品的外源性残留DNA的检测。
关键词:大肠杆菌表达的重组蛋白大肠杆菌外源性DNA背景介绍:本文所述大肠杆菌表达的重组蛋白的的制备工艺是通过质粒重组、转染、大肠杆菌发酵并纯化得到;根据CDE 2003年3月20日颁布的《人用重组DNA制品质量控制技术指导原则》最终产品控制这部分的内容,外源性残留DNA属于工艺相关杂质,存在潜在的传染性、免疫原性、致癌性以及影响正常基因的激活和抑制。
EMA[1]对外源性DNA残留也做出了相应规定,指出外源DNA残留量是纯化工艺验证的重要指标。
WHO[2]规定非口服的生物制品DNA残留量为10ng每人份剂量,并规定了外源性残留DNA的片段大小一般要小于200bp。
我国在2020年9月发布《基因治疗产品药学研究与评价技术指导原则》的征求意见稿也对外源性DNA残留量做出了建议,一般要求控制在10ng/剂以内,片段大小控制在200bp以内,FDA[3]要求生物制品每剂量外源性DNA残留量小于100pg,大剂量放宽至10ng每人份剂量。
综合法规及指导原则要求,我们的产品的残留DNA的接受标准定为10ng/剂,选择相较于DNA探针杂交法和荧光染色法更快捷、灵敏、准确的qPCR(实时荧光定量聚合酶链式反应)法作为研究目标,通过对残留DNA提取效率和检测灵敏度的优化以适应各国法规要求来保障产品的质量。
简述食品中大肠杆菌的快速检测方法相关研究进展

简述食品中大肠杆菌的快速检测方法相关研究进展摘要:大肠菌群的快速检测是食品、药品卫生监督检验迫切需求,本文从免疫学技术,酶学的技术,分子生物学技术,传统检测方法改进技术,物理化学技术,其它技术方面对大肠菌群快速检测方法研究进展进行综述,并对其存在问题及应用前景进行分析。
这些方法各有优缺点,免疫学技术和分子生物学技术灵敏度高,但假阳性率高,无法区分死活菌;酶学的技术和物理化学技术特异性好,省时省力,但这些方法成本较高,不适合基层实验室使用;传统检测方法改进技术结果准确,但费时费力。
因此,仍需要发展一种新的方法解决所存在的问题。
要真正实现大肠菌群的快速检测还需要不断进行科学研究,以寻找一种能够真正实现成本低、灵敏度好、准确性高并且检测速度快的更合适的方法。
关键词:食品;大肠菌群;快速检测;研究1引言大肠菌群为一群在37C、24h能发酵乳糖,产酸、产气,需氧和兼性厌氧的革兰阴性无芽胞杆菌的统称。
这些细菌多存在于温血动物粪便中,人、畜粪便对外界环境的污染是大肠菌群在自然存在的主要原因。
因此,大肠菌群被国际上公认为检测各种水质、医药及食品在流行病学上安全性的指示菌。
如果检测到大肠菌群呈阳性结果,那么便表明食品、药品或者水质存在大肠菌群,已经被粪便污染。
大肠菌群的数量与受到的污染程度成正比,数量越多,受污染越严重。
目前我国国家标准主要用多管发酵法来检测大肠菌群多管发酵法作为一种传统的检测方法已沿用多年,其准确性、权威性无可质疑,但该方法费时费力,而且检测所需的费用较高,已无法满足人们对食品、药品安全现场监测的要求,因此,现在食品、药品卫生监督检验迫切需要一种更加有效、快速的大肠菌群检测方法。
近年来,世界各国针对大肠菌群的快速、定量检测技术都进行了专门的研究,本文综述了大肠菌群快速检测技术的研究进展,并对其存在问题及应用前景进行分析。
2大肠菌群主要的快速检测方法2.1免疫学技术免疫学方法检测原理是依据抗原和抗体特异性反应。
大肠杆菌检测细菌的原理

大肠杆菌检测细菌的原理大肠杆菌(Escherichia coli)是一种最常见的细菌之一,它存在于人体和动物的肠道中。
大肠杆菌的检测主要是为了评估水、食物、环境等样品是否受到大肠杆菌的污染,从而判断其卫生质量。
大肠杆菌检测的原理可以简单地归纳为以下几个方面:1. 大肠杆菌的特征:大肠杆菌是革兰氏阴性杆菌,属于肠杆菌科,可以通过一系列特征来进行检测和鉴定。
例如,大肠杆菌通常是乳酸阴性,证明能产生气体,能发酵果糖等。
2. 典型培养基:大肠杆菌的检测一般使用典型培养基进行,如MacConkey培养基、VRBD培养基等。
这些培养基含有特定的成分,如乳糖、无机盐、指示剂等,能够促进大肠杆菌的生长,并显示其典型的反应。
3. 选择性培养基:为了增强对大肠杆菌的选择性,常常还需要使用一些选择性培养基,如Eosin Methylene Blue(EMB)培养基、脱氧胆盐琼脂培养基(DCM)等。
这些培养基在含有抑制其他细菌生长的成分的同时,对大肠杆菌有选择地促进其生长。
4. 确认试验:大肠杆菌的检测还需要进行一系列确认试验,以确认所得结果的准确性。
常用的确认试验包括牛磺胆酸发酵试验、甲状腺脱色酶试验等。
通过这些试验可以确保检测结果是准确可靠的。
除了以上的传统方法,现代生物技术也为大肠杆菌的检测提供了更加快速和精确的手段。
例如,PCR(聚合酶链反应)是通过扩增大肠杆菌的特定片段来鉴定其存在与否。
其操作步骤主要包括:提取目标DNA片段,设计合适的引物,扩增DNA,检测扩增产物并鉴定大肠杆菌。
此外,还可以利用蛋白质分析技术,如质谱分析和酶联免疫吸附检测(ELISA),来检测大肠杆菌污染。
这些技术通过检测大肠杆菌特有的蛋白质组成或抗原来确定其存在与否。
总的来说,大肠杆菌的检测原理可以归纳为传统培养、生物技术PCR扩增和蛋白质分析等多种方法。
这些方法能够准确快速地鉴定出大肠杆菌的存在与否,为卫生质量的评估和控制提供有力的手段。
EGFP在大肠杆菌E.coli中的表达与检测

质粒:携带目的基因的载体用于将目的基因导入E.coli细胞
启动子:控制目的基因表达的DN序列通常位于质粒上
终止子:控制目的基因表达的DN序列通常位于质粒上
复制子:用于复制质粒的DN序列通常位于质粒上
抗性基因:用于筛选含有目的基因的E.coli细胞的DN序列通常位于质粒上
表达条件的优化
温度:选择适宜的温度如37℃
培养基:选择含有丰富营养物质的培养基如LB培养基
诱导剂:选择合适的诱导剂如IPTG
培养时间:选择合适的培养时间如12-24小时
检测方法:选择灵敏度高、特异性强的检测方法如荧光显微镜或Western blotting
表达产物的检测与鉴定
荧光显微镜观察:观察荧光蛋白的表达情况
单击此处添加标题
单击此处添加标题
单击此处添加标题
单击此处添加标题
拓展EGFP的应用领域与范围
生物医学领域:用于细胞标记、基因表达检测等
生物制药领域:用于药物研发、药物筛选等
食品科学领域:用于食品检测、食品安全等
生物技术领域:用于基因工程、蛋白质工程等
农业科学领域:用于植物基因工程、抗病抗虫等
环境科学领域:用于水质监测、污染检测等
步骤:样品制备、抗原抗体孵育、酶催化底物显色、结果观察
优点:灵敏度高、特异性强、操作简便
应用:广泛应用于蛋白质、多肽、激素等生物大分子的检测
其他检测方法
荧光显微镜检测:通过观察荧光信号强度判断表达产物量
放射性标记检测:通过放射性标记检测表达产物量
生物传感器检测:通过生物传感器检测表达产物量
酶联免疫吸附试验(ELIS):通过酶催化反应检测表达产物量
在药物筛选与开发中的应用
ecoli表达体系

ecoli表达体系E. coli表达体系引言:E. coli(大肠杆菌)是一种常见的细菌,广泛应用于基因工程和蛋白质表达领域。
其独特的表达体系为科学家们在基因工程研究中提供了强大的工具。
本文将介绍 E. coli表达体系及其在蛋白质表达中的应用。
一、E. coli表达体系的基本原理E. coli表达体系是利用大肠杆菌作为宿主细胞来表达外源基因的一种方法。
其基本原理是将目标基因插入到表达载体中,然后将载体转化到E. coli细胞中,通过细胞的代谢和转录机制来实现目标基因的表达。
E. coli表达体系具有高效、简便、经济的特点,因此被广泛应用于基因工程领域。
二、E. coli表达体系的关键组成部分1. 表达载体:表达载体是E. coli表达体系的核心部分,通常由启动子、多克隆位点、选择标记和复制起始子等功能元件组成。
启动子用于启动目标基因的转录,多克隆位点用于插入目标基因,选择标记用于筛选转化成功的细菌,复制起始子用于维持载体的复制。
常用的表达载体有pET、pBAD、pGEX等。
2. 宿主细胞:E. coli细胞是E. coli表达体系的宿主细胞,其具有较高的生长速度和简单的培养条件,能够满足大规模表达的需求。
同时,E. coli细胞也具有较高的遗传稳定性和表达效率,使其成为理想的表达宿主。
3. 外源基因:外源基因是指需要表达的目标基因,可以是来自其他物种的基因序列,也可以是人工设计的合成基因。
外源基因的选择应根据研究目的和需求进行合理设计。
三、E. coli表达体系的应用E. coli表达体系在蛋白质表达领域具有广泛的应用前景。
以下是几个常见的应用领域:1. 重组蛋白表达:利用E. coli表达体系可以高效表达各种重组蛋白,如药物、酶、抗体等。
通过对目标基因的合理设计和优化表达条件,可以实现大规模的蛋白质产量,并且具有较高的纯度和活性。
2. 代谢工程:E. coli表达体系在代谢工程中也发挥着重要的作用。
大肠杆菌标准

大肠杆菌标准概述大肠杆菌(Escherichia coli)是一种常见的肠道细菌,对人类和动物的健康有着重要影响。
因此,制订大肠杆菌标准至关重要,用以确保食品和水源的安全,预防疾病传播。
大肠杆菌分类大肠杆菌存在多种血清型,根据其特性进行分类。
大肠杆菌按照血清型分为O抗原和H抗原,其中O抗原是外膜的多糖类物质,H抗原是鞭毛的蛋白质。
根据不同血清型的组合,可以得到不同的大肠杆菌血清型,如O157:H7。
大肠杆菌的检测方法为了保证食品和水源的安全,检测大肠杆菌的方法非常关键。
以下是常用的大肠杆菌检测方法:1. 培养法培养法是一种传统且常用的大肠杆菌检测方法。
样本(如食物或水样)被接种在适当的培养基上,培养一段时间后,观察是否有大肠杆菌的生长。
2. PCR法PCR法(聚合酶链反应)是一种高效的大肠杆菌检测方法。
通过扩增大肠杆菌特有的基因序列,可以快速检测样本中是否有大肠杆菌的存在。
3. 免疫法免疫法利用抗体与大肠杆菌特定抗原的结合来检测大肠杆菌。
常见的免疫法包括酶联免疫吸附试验(ELISA)和免疫层析试验(immunochromatography assay)。
大肠杆菌标准的制定制定大肠杆菌标准是为了确保食品和水源的质量和安全。
以下是制定大肠杆菌标准的一些重要考虑因素:1. 卫生标准制定大肠杆菌标准需要参考卫生标准,确保其符合卫生要求,减少食品和水源中大肠杆菌的污染和传播风险。
2. 国际标准制定大肠杆菌标准时,需要考虑国际标准,以便与国际接轨,在国际市场上有更好的竞争力。
3. 监测方法大肠杆菌标准需要明确监测方法,包括采样方法、样本处理、检测方法等。
这样可以确保各个实验室在检测时的一致性和可比性。
大肠杆菌标准的应用大肠杆菌标准广泛应用于食品工业和水处理领域,以下是一些应用场景:1. 食品工业大肠杆菌标准被用于检测食品中的污染情况,尤其是那些与生食有关的食品,如生肉、生蔬菜等。
通过检测大肠杆菌数量,可以评估食品是否符合卫生标准,并采取相应的措施进行食品安全管理。
试剂盒使用说明书

大肠杆菌菌体蛋白残留量(E.coli DH-5α)酶联免疫分析(ELISA)试剂盒使用说明书本试剂盒仅供研究使用。
1使用目的:本试剂盒用于饲料、鱼、虾和肉类组织(如鸡、牛肉和猪肉),药物、血清和尿样中大肠杆菌菌体蛋白残留量(E.coli DH-5α)残留的定量检测。
2实验原理本试剂盒采用竞争ELISA方法,在微孔板包被有大肠杆菌菌体蛋白残留量(E.coli DH-5α)偶联抗原,加入大肠杆菌菌体蛋白残留量(E.coli DH-5α)标准品或样品,游离大肠杆菌菌体蛋白残留量(E.coli DH-5α)与微孔条上预包被的大肠杆菌菌体蛋白残留量(E.coli DH-5α)偶联抗原互相竞争抗大肠杆菌菌体蛋白残留量(E.coli DH-5α)抗体酶标记物,用TMB底物显色,加入终止液后颜色由蓝色变为黄色,用酶标仪在450nm波长下进行检测,吸光值与样品中大肠杆菌菌体蛋白残留量(E.coli DH-5α)含量成反比,通过标准曲线计算样品中大肠杆菌菌体蛋白残留量(E.coli DH-5α)的含量。
3试剂盒组成3.1预包被的大肠杆菌菌体蛋白残留量(E.coli DH-5α)偶联抗原的可拆酶标板:1块(12孔×8条)。
3.2大肠杆菌菌体蛋白残留量(E.coli DH-5α)标准品:6瓶(1ml/瓶),含量分别是:0ug/ml, 0.1ug/ml,0.3ug/ml,0.9ug/ml,2.7ug/ml,8.1ug/ml3.3抗大肠杆菌菌体蛋白残留量(E.coli DH-5α)抗体酶结合物:1瓶(6ml)。
3.4显色液A:1瓶(6ml)。
3.5显色液B:1瓶(6ml)。
3.6终止液:1瓶(6ml),2M硫酸。
3.7样本稀释液:1瓶(10×,6ml),用于样品稀释用。
3.8浓缩洗涤液:1瓶(20×,20ml),用于洗板。
3.9说明书一份。
4需要而未提供的材料4.1设备4.1.1波长450nm酶标仪。
动物大肠杆菌病检测技术

动物大肠杆菌病检测技术
动物大肠杆菌病是一种由大肠杆菌引起的常见动物感染疾病。
以下是几种常用的动物大肠杆菌病检测技术:
1.细菌培养:这是最常用的检测方法之一。
样品(如血液、
粪便、尿液、组织)首先被接种到含有适当营养物质的培养基上,然后在适当的温度和氧气条件下孵育,以促使大肠杆菌生长和繁殖。
观察培养基上是否出现典型的大肠杆菌菌落形态,进一步进行鉴定和鉴定。
2.PCR检测:聚合酶链式反应(PCR)是一种通过扩增目标
DNA片段来检测大肠杆菌的技术。
通过使用特定的引物和酶来扩增和检测大肠杆菌特异性的基因片段,从而确定其存在与否。
PCR技术具有高度敏感性和特异性,可以快速检测大肠杆菌。
3.ELISA检测:酶联免疫吸附测定(ELISA)是一种通过检测
抗原抗体相互作用来检测大肠杆菌的技术。
样品中的大肠杆菌抗原与特异性抗体结合,然后添加酶标记的二抗或底物,观察是否发生颜色变化以确定检测结果。
ELISA技术具有高度灵敏性和选择性,并且可以同时检测多个样品。
4.DNA测序:DNA测序技术可以用来确定大肠杆菌菌株的遗
传信息。
通过分析细菌的基因组DNA序列,可以确定其属种、亚种以及潜在的耐药性和毒力因子。
这些是常见的动物大肠杆菌病检测技术,每种技术都有其优缺
点和适用范围。
为了确诊和控制动物大肠杆菌病,通常需要综合使用多种不同的检测方法。
同时,准确采集样品和严格遵循实验室操作规范也对检测结果的准确性和可靠性至关重要。
大肠埃希菌的生物危害评估报告

大肠埃希菌的生物危害评估报告一、大肠埃希菌的传播与致病埃希菌属包括多种细菌,临床上以大肠埃希菌最为常见。
大肠埃希菌(E.coli)通称大肠杆菌,是所有哺乳动物大肠中的正常寄生菌,一方面能合成维生素B及K供机体吸收利用。
另一方面能抑制腐败菌及病原菌和真菌的过度增殖。
但当它们离开肠道的寄生部位,进入到机体其他部位时,能引起感染发病。
有些菌型有致病性,引起肠道或尿路感染性疾患。
大肠埃希菌所引起的食源性疾病主要由动物性食品引起,常见中毒食品为:各类熟肉制品、蛋及蛋制品、生牛奶及奶制品、汉堡包、乳酪,其次为蔬菜、水果、鲜榨果汁、饮料等。
中毒原因主要是食品未经彻底加热,或加工过程中造成的交叉污染,老人及婴幼儿为易感人群。
大肠埃希菌可以引起肠道外感染如泌尿系感染、菌血症、胆囊炎、肺炎及新生儿脑膜炎等,也会造成从轻微腹泻到霍乱样严重腹泻乃至引起致死性的并发症如溶血性尿毒综合征(HUS),根据其不同的血清型别、毒力和所致临床症状的不同,可以将导致腹泻的大肠埃希菌分为5类:(1)产肠毒性大肠杆菌(enterotoxigenicE.coli,ETEC):是许多发展中国家儿童及旅游者腹泻常见病原菌,热带尤为常见。
由食入污染食物和水而致病。
本菌可产生大量耐热和非耐热肠毒素,患者腹泻呈水样便,伴有恶心、腹痛、发热等症。
(2)肠致病性大肠杆菌(enteropathogenic E.coli,EPEC):可引起婴儿肠炎,夏季腹泻及婴儿霍乱。
本菌具有很强传染性,可引起院内暴发流行,也可引起成人腹泻。
传染源来自食品操作人员或粪便污染供水设施。
(3)肠侵袭性大肠杆菌(enteroinvasive E.coli,EIEC):由人-人传染而致病(推测为粪-口途径)。
因具有侵袭性,侵入人体肠粘膜上皮细胞后可迅速繁殖,破坏肠粘膜及其基底膜,出现粘膜溃疡,发病多呈散在性。
与痢疾杆菌相似,引起痢疾样腹泻。
(4)肠出血性大肠杆菌(enterohemorrhagic E.coli,EHEC):可引起暴发或散在性出血性结肠炎。
大肠杆菌(Ecoli)酶联免疫分析
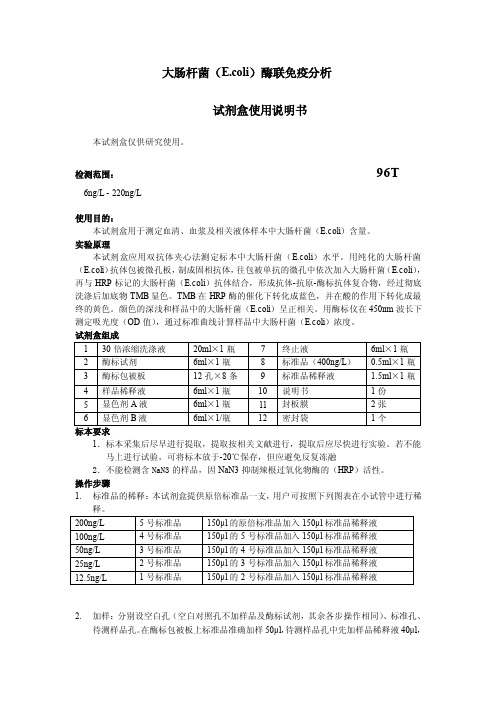
大肠杆菌(E.coli)酶联免疫分析试剂盒使用说明书本试剂盒仅供研究使用。
检测范围:96T6ng/L - 220ng/L使用目的:本试剂盒用于测定血清、血浆及相关液体样本中大肠杆菌(E.coli)含量。
实验原理本试剂盒应用双抗体夹心法测定标本中大肠杆菌(E.coli)水平。
用纯化的大肠杆菌(E.coli)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入大肠杆菌(E.coli),再与HRP标记的大肠杆菌(E.coli)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的大肠杆菌(E.coli)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中大肠杆菌(E.coli)浓度。
试剂盒组成标本要求1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP)活性。
操作步骤1.标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀2.加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。
在酶标包被板上标准品准确加样50μl,待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl(样品最终稀释度为5倍)。
加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
3.温育:用封板膜封板后置37℃温育30分钟。
4.配液:将30倍浓缩洗涤液用蒸馏水30倍稀释后备用5.洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复5次,拍干。
6.加酶:每孔加入酶标试剂50μl,空白孔除外。
7.温育:操作同3。
8.洗涤:操作同5。
9.显色:每孔先加入显色剂A50μl,再加入显色剂B50μl,轻轻震荡混匀,37℃避光显色15分钟.10.终止:每孔加终止液50μl,终止反应(此时蓝色立转黄色)。
大肠杆菌vero毒素(E.coli Verotoxin)-NEWA

本试剂盒只能用于科学研究,不得用于医学诊断大肠杆菌vero毒素(E.coli Verotoxin) ELISA检测试剂盒使用说明书检测原理试剂盒采用双抗体一步夹心法酶联免疫吸附试验(ELISA)。
往预先包被大肠杆菌vero毒素E.coli Verotoxin抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。
用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的大肠杆菌vero毒素E.coli Verotoxin呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD 值),计算样品浓度。
样品收集、处理及保存方法1. 血清:使用不含热原和内毒素的试管,操作过程中避免任何细胞刺激,收集血液后,3000转离心10分钟将血清和红细胞迅速小心地分离。
2. 血浆:EDTA、柠檬酸盐或肝素抗凝。
3000转离心30分钟取上清。
3. 细胞上清液:3000转离心10分钟去除颗粒和聚合物。
4. 组织匀浆:将组织加入适量生理盐水捣碎。
3000转离心10分钟取上清。
5. 保存:如果样本收集后不及时检测,请按一次用量分装,冻存于-20℃,避免反复冻融,在室温下解冻并确保样品均匀地充分解冻。
自备物品1.酶标仪(450nm)2.高精度加样器及枪头:0.5-10uL、2-20uL、20-200uL、200-1000uL3.37℃恒温箱操作注意事项1. 试剂盒保存在2-8℃,使用前室温平衡20分钟。
从冰箱取出的浓缩洗涤液会有结晶,这属于正常现象,水浴加热使结晶完全溶解后再使用。
2. 实验中不用的板条应立即放回自封袋中,密封(低温干燥)保存。
3. 浓度为0的S0号标准品即可视为阴性对照或者空白;按照说明书操作时样本已经稀释5倍,最终结果乘以5才是样本实际浓度。
4. 严格按照说明书中标明的时间、加液量及顺序进行温育操作。
5. 所有液体组分使用前充分摇匀。
大肠杆菌Exonuclease I(E. coli)说明书

版本号:M16B01V1.0 Exonuclease I(E.coli)目录号:RK20531规格:1,500U/3,000U/15,000U浓度:20,000U/mL产品组成Exonuclease I(E.coli)(20,000U/mL)RM20519 10X Exonuclease I Reaction Buffer RM20130产品说明Exonuclease I(E.coli)沿3’-5’方向降解单链DNA上的单核苷酸,不会降解由磷酰基团或乙酰基团封闭了3’-OH末端的DNA单链。
Exonuclease I能从含有双链延伸产物的反应混合物中降解多余的单链寡核苷酸引物;能分析是否存在含3’-OH 末端的单链DNA。
产品来源E.coli NM554来源的Exonuclease I基因在大肠杆菌中表达并分离纯化得到。
活性定义1活性单位(U)是指在50μL反应体系中,将37°C30min内催化0.17mg/mL[3H]-ssDNA释放10nmol酸不溶性物质所需的酶量。
反应条件1X Exonuclease I Reaction Buffer,37°C反应1X Exonuclease I Reaction Buffer组成67mM Glycine-KOH,6.7mM MgCl2,10mMβ-ME,pH9.5 @25°C保存温度-20°C酶存储液10mM Tris-HCl,100mM NaCl,5mMβ-ME,0.5mM EDTA, 100μg/mL BSA,50%Glycerol,pH7.5@25°C热失活80°C加热20min 操作说明Exonuclease I清除PCR引物操作流程1.向5μL PCR扩增产物中加入0.5μL Exonuclease I和1μL 重组虾碱性磷酸酶(rSAP)。
2.混匀并瞬时离心,在37°C反应15min。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大肠杆菌(E.coli)酶联免疫分析
试剂盒使用说明书
本试剂盒仅供研究使用。
检测范围:96T
6ng/L - 220ng/L
使用目的:
本试剂盒用于测定血清、血浆及相关液体样本中大肠杆菌(E.coli)含量。
实验原理
本试剂盒应用双抗体夹心法测定标本中大肠杆菌(E.coli)水平。
用纯化的大肠杆菌(E.coli)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入大肠杆菌(E.coli),再与HRP标记的大肠杆菌(E.coli)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的大肠杆菌(E.coli)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中大肠杆菌(E.coli)浓度。
试剂盒组成
标本要求
1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融
2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP)活性。
操作步骤
1.标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀
2.加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、
待测样品孔。
在酶标包被板上标准品准确加样50μl,待测样品孔中先加样品稀释液40μl,
然后再加待测样品10μl(样品最终稀释度为5倍)。
加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
3.温育:用封板膜封板后置37℃温育30分钟。
4.配液:将30倍浓缩洗涤液用蒸馏水30倍稀释后备用
5.洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此
重复5次,拍干。
6.加酶:每孔加入酶标试剂50μl,空白孔除外。
7.温育:操作同3。
8.洗涤:操作同5。
9.显色:每孔先加入显色剂A50μl,再加入显色剂B50μl,轻轻震荡混匀,37℃避光显色
15分钟.
10.终止:每孔加终止液50μl,终止反应(此时蓝色立转黄色)。
11.测定:以空白空调零,450nm波长依序测量各孔的吸光度(OD值)。
测定应在加终止
液后15分钟以内进行。
操作程序总结:
计算
以标准物的浓度为横坐标,OD值为纵坐标,在坐标纸上绘出标准曲线,根据样品的OD值由标准曲线查出相应的浓度;再乘以稀释倍数;或用标准物的浓度与OD值计算出标准曲线的直线回归方程式,将样品的OD值代入方程式,计算出样品浓度,再乘以稀释倍数,
即为样品的实际浓度。
注意事项
1.试剂盒从冷藏环境中取出应在室温平衡15-30分钟后方可使用,酶标包被板开封后如未用完,板条应装入密封袋中保存。
2.浓洗涤液可能会有结晶析出,稀释时可在水浴中加温助溶,洗涤时不影响结果。
3.各步加样均应使用加样器,并经常校对其准确性,以避免试验误差。
一次加样时间最好控制在5分钟内,如标本数量多,推荐使用排枪加样。
4.请每次测定的同时做标准曲线,最好做复孔。
如标本中待测物质含量过高(样本OD值大于标准品孔第一孔的OD值),请先用样品稀释液稀释一定倍数(n倍)后再测定,计算时请最后乘以总稀释倍数(×n×5)。
5.封板膜只限一次性使用,以避免交叉污染。
6.底物请避光保存。
7.严格按照说明书的操作进行,试验结果判定必须以酶标仪读数为准.
8.所有样品,洗涤液和各种废弃物都应按传染物处理。
9.本试剂不同批号组分不得混用。
10. 如与英文说明书有异,以英文说明书为准。
保存条件及有效期
1.试剂盒保存:;2-8℃。
2.有效期:6个月。
