腐蚀电化学第一讲(03)
§1.1 金属电化学腐蚀的基本概念(3) 腐蚀电池的类型
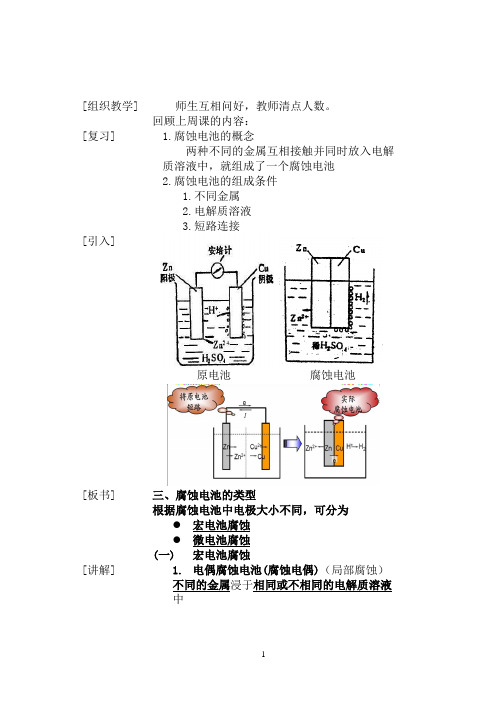
[组织教学] [复习][引入][板书] [讲解]师生互相问好,教师清点人数。
回顾上周课的内容:1.腐蚀电池的概念两种不同的金属互相接触并同时放入电解质溶液中,就组成了一个腐蚀电池2.腐蚀电池的组成条件1.不同金属2.电解质溶液3.短路连接原电池腐蚀电池三、腐蚀电池的类型根据腐蚀电池中电极大小不同,可分为●宏电池腐蚀●微电池腐蚀(一)宏电池腐蚀1.电偶腐蚀电池(腐蚀电偶)(局部腐蚀)不同的金属浸于相同或不相同的电解质溶液中[举例][板书] [讲解][举例][板书] [讲解][举例]轮船船尾部分结构1-船壳(钢板) 2- 推进器(青铜)2.浓差电池1)金属离子浓差电池(铜):同一金属与不同金属离子浓度的电解质溶液相接触金属离子浓差电池Cu在稀溶液中易失电子。
溶液中金属离子浓度越稀,电极电位越低;浓度越大,电极电位越高电子由金属离子的低浓度区(阳极)流向高浓度区(阴极)。
2)氧浓差电池(铁):同一金属与不同含氧量的电解质溶液相接触→形成缝隙腐蚀或水线腐蚀.[板书] [讲解][举例][板书] [讲解][举例] 造成缝隙腐蚀的主要因素,危害性大。
O2+2H2O+4e → 4OH- (阴极反应)氧的分压越高,电极电位越高。
介质中溶解氧浓度越大,氧电极电位越高;而氧浓度较小处则电极电位较低称为腐蚀电池的阳极。
(一)微电池腐蚀金属表面的电化学的不均匀性形成的自发而又均匀的腐蚀。
1)金属化学成分的不均匀性(Fe3C和石墨;FeZn7)例如,工业生产中,纯锌-FeZn7、碳钢- Fe3C、铸铁-石墨等杂质,在腐蚀介质中,金属表面就会形成许多微阴极、微阳极,因此导致腐蚀。
2)组织结构的不均匀性(金属或合金组织内晶粒与晶界的电极电位不同)比如,金属表面存在裂纹的情况[板书] [讲解][举例][板书] [讲解][举例] [课堂小结] [作业] 例如:晶粒-晶界腐蚀微电池,晶界作为阳极而优先发生腐蚀<缝隙腐蚀>3)金属物理状态的不均匀性各部分应力分布不均匀或形变不均匀,钢板弯曲处、铆钉头部区域容易发生腐蚀。
《电化学腐蚀动力学》课件

电化学腐蚀的定义
总结词
电化学腐蚀是指金属与电解质溶液发生 电化学反应,导致金属逐渐被破坏的过 程。
VS
详细描述
电化学腐蚀是指金属与电解质溶液接触时 ,由于金属内部电子分布不均匀,形成电 位差,从而引发电化学反应。在反应过程 中,金属原子逐渐失去电子成为阳离子, 而电子则被电解质溶液中的阴离子所接受 ,形成电流。随着时间的推移,金属逐渐 被破坏,表现为金属表面的腐蚀现象。
电化学腐蚀动力学是研究电化学腐蚀过程中反应速率和反应机制的学科,对于预防和控制金属腐蚀具有 重要意义。
经过多年的研究和发展,电化学腐蚀动力学在理论和实践方面取得了一系列重要成果,包括电化学反应 动力学模型、腐蚀速率预测、腐蚀产物形成机制等方面。
电化学腐蚀研究的展望
未来电化学腐蚀动力学的研究将更加注重实际应 用和工业生产中的问题,如高强度钢、铝合金等 新型材料的腐蚀行为和防护技术。
环境因素的影响
氧气浓度
氧气是电化学腐蚀过程中重要的氧化剂,因此环境中的氧气浓度 对腐蚀速率有很大影响。
pH值
pH值影响溶液的电导率和腐蚀产物的溶解度,从而影响腐蚀速 率。一般来说,酸性环境更容易促进腐蚀。
温度和压力
温度和压力的变化会影响化学反应速率,从而影响电化学腐蚀速 率。
电化学腐蚀的防护措施
电化学腐蚀的机理
总结词
电化学腐蚀的机理主要包括阳极反应和阴极反应两个 过程,其中阳极反应是金属失去电子的过程,阴极反 应则是氧化剂得到电子的过程。
详细描述
电化学腐蚀的机理主要包括阳极反应和阴极反应两个 过程。阳极反应是金属失去电子的过程,通常表现为 金属原子失去电子成为阳离子,进入电解质溶液中。 这个过程释放出的电子则流向阴极反应区域。阴极反 应则是氧化剂得到电子的过程,通常表现为电解质溶 液中的氧化剂接受来自阳极反应的电子,发生还原反 应。阳极反应和阴极反应共同构成了电化学腐蚀的完 整过程。
腐蚀电化学原理、方法及应用第3章金属腐蚀动力学

交换电流密度的意义
• i 0数值很大,表明电极上可以通过很大的外 电流,而电极电位改变很小,表明这种电 极反应的可逆性大;
i 0数值很小,说明电极上只要有少量的外电流 通过,就会引起电极电位较大的改变,表明这 种电极反应的可逆性小,
意义:可以根据交换电流密度的大小估计某一 电极的可逆性以及衡量电化学平衡到达的速度。
=Q / StnF =It / StnF = i / nF
V与电流密度的关系
i = nFv
i 的单位: A/m2 ,v 的单位: mol/m2s, F = 96500C/mol
电极上的电流密度与化学反应速度成正比 • 常用电流密度(单位电极截面上通过的电流,SI单
位为Am-2)来表示电化学反应速度的大小。
3.1.3 交换电流密度
• 如果电极上没有净电流通过,电极处于平衡状态, 其电极电位为平衡电位Ee。
O + ne
R
此平衡电位下,阴极反应速度和阳极反应速度相等,
方向相反,即
i i i0
交换电流密度
• 在平衡状态下,同一电极上大小相等、方 向相反的电流密度称为交换电流密度,简 称交换电流,以i0表示。
• 电极的两种状态
1. 平衡状态 电学极参反数应)。处氧于化平方衡向状和态还,原其方电向位的为反平应衡速电度位相E等e(热,其力 大小称为交换电流密度,记为i0。
i0 i i
• 2.极化状态 对电极系统通入外电流,电极反应的平衡状态被打 破叫极,化电电位流偏。离平衡电位Ee达到极化电位E。外电流又
• 对应于腐蚀电位的电流密度称为腐蚀电流密度或 腐蚀电流密度,用符号icorr表示。
• 平衡电极→平衡电位
• 非平衡电极→非平衡电位
电化学腐蚀课件(公开课课件)

阳极保护技术原理与实践
阳极保护原理
将被保护金属与外加电源正极相连,使其成为阳极并发生钝化 现象,从而阻止金属进一步腐蚀。
阳极保护实践
阳极保护技术适用于易钝化金属(如不锈钢、钛等)的防腐。 实施阳极保护时,需控制阳极电位在钝化区间内,避免金属发 生过钝化或活化现象。
涂层防护技术原理与实践
涂层防护原理
高温腐蚀的机理
金属在高温环境中的腐蚀主要是由于金属与高温气体中的氧化性物 质发生化学反应,导致金属表面氧化、硫化等。
影响高温腐蚀的因素
温度、气氛成分(如氧含量、硫含量等)、压力以及金属材料的种 类和表面状态等。
高温腐蚀的防护措施
采用耐高温腐蚀的合金材料、表面涂层保护、控制气氛成分等方法, 以及降低温度、减少氧化性物质含量等措施。
腐蚀电池工作原理
腐蚀电池的形成
当金属与电解质溶液接触时,由于金属表面存在电化学不均匀性,会形成许多 微小的原电池,即腐蚀电池。
腐蚀电池的工作过程
在腐蚀电池中,阳极发生氧化反应,金属溶解进入溶液;阴极发生还原反应, 氧化剂接受电子。电子通过金属从阳极流向阴极,形成电流,从而加速了金属 的腐蚀过程。
影响电化学腐蚀因素
盐类等发生化学反应,导致金属表面氧化、生锈等。
影响土壤腐蚀的因素
02
土壤的理化性质(如含水量、透气性、酸碱度等)、微生物活
动以及金属材料的种类和表面状态等。
土壤腐蚀的防护措施
03
采用耐土壤腐蚀的合金材料、阴极保护、涂覆防腐涂料等方法,
以及改善土壤环境(如降低含水量、提高酸碱度)等。
高温环境中金属腐蚀
土壤中的水分、盐分等导致管道腐蚀。
02
阴极保护系统设计
通过埋设牺牲阳极或外加电流阴极保护系统,为管道提供保护电流。
电化学腐蚀
电化学腐蚀编辑电化学腐蚀就就是金属与电解质组成两个电极,组成腐蚀原电池。
例如铁与氧,因为铁的电极电位总比氧的电极电位低,所以铁就是阳极,遭到腐蚀。
特征就是在发生氧腐蚀的表面会形成许多直径不等的小鼓包,次层就是黑色粉末状溃疡腐蚀坑陷。
1基本介绍2相关原理3方程式4现象危害5解决办法6电化学7除氧方法▪热力除氧▪真空除氧▪铁屑除氧▪解吸除氧▪树脂除氧▪化学药剂除氧基本介绍编辑不纯的金属跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子而被氧化,这种腐蚀叫做电化学腐蚀。
钢铁在潮湿的空气中所发生的腐蚀就是电化学腐蚀最突出的例子。
我们知道,钢铁在干燥的空气里长时间不易腐蚀,但潮湿的空气中却很快就会腐蚀。
原来,在潮湿的空气里,钢铁的表面吸附了一层薄薄的水膜,这层水膜里含有少量的氢离子与氢氧根离子,还溶解了氧气等气体,结果在钢铁表面形成了一层电解质溶液,它跟钢铁里的铁与少量的碳恰好形成无数微小的原电池。
在这些原电池里,铁就是负极,碳就是正极。
铁失去电子而被氧化、电化学腐蚀就是造成钢铁腐蚀的主要原因。
金属材料与电解质溶液接触, 通过电极反应产生的腐蚀。
电化学腐蚀反应就是一种氧化还原反应。
在反应中,金属失去电子而被氧化,其反应过程称为阳极反应过程,反应产物就是进入介质中的金属离子或覆盖在金属表面上的金属氧化物(或金属难溶盐);介质中的物质从金属表面获得电子而被还原,其反应过程称为阴极反应过程。
在阴极反应过程中,获得电子而被还原的物质习惯上称为去极化剂。
在均匀腐蚀时,金属表面上各处进行阳极反应与阴极反应的概率没有显著差别,进行两种反应的表面位置不断地随机变动。
如果金属表面有某些区域主要进行阳极反应,其余表面区域主要进行阴极反应,则称前者为阳极区,后者为阴极区,阳极区与阴极区组成了腐蚀电池。
直接造成金属材料破坏的就是阳极反应,故常采用外接电源或用导线将被保护金属与另一块电极电位较低的金属相联接,以使腐蚀发生在电位较低的金属上。
电化学腐蚀1ppt课件

在桥梁防腐中,采用外加电流法对被保护钢构桥梁进行阴极保护。通过在桥梁基础部位设置辅助阳极和参比电极 ,并连接外加电源负极和正极,组成外加电流阴极保护系统。通过调整外加电源的输出电压和电流,使桥梁钢构 处于阴极保护状态。
04 表面处理技术在电化学腐蚀防护中应用
涂层技术种类和选择依据
涂层技术种类
面临的挑战与解决方案
探讨目前新型抗电化学腐蚀材料研究所面临 的挑战,如材料性能与成本的平衡、制备工 艺的改进等,并提出可能的解决方案和发展
建议。
06 实验方法与检测设备在电化学腐蚀研究中应用
实验方法设计思路和实施步骤
设计思路
根据电化学腐蚀的原理和影响因素,设计合 理的实验方案,包括电极材料的选择、电解 质的配制、实验条件的控制等。
05 新型抗电化学腐蚀材料研究进展
耐蚀合金材料研究进展
1 2 3
耐蚀合金材料的种类与特性
介绍常见的耐蚀合金材料,如不锈钢、镍基合金 、钛合金等,并分析其耐蚀性能及适用环境。
耐蚀合金材料的制备工艺
阐述耐蚀合金材料的制备方法,如粉末冶金、电 镀、化学镀等,并探讨不同工艺对材料性能的影 响。
耐蚀合金材料的应用领域
数据处理
对实验数据进行整理、筛选和分类,提取有效信息。
结果分析
运用统计学方法对数据进行分析,揭示电化学腐蚀的规 律和影响因素。结合实验现象和理论知识,对实验结果 进行解释和讨论。
THANKS 感谢观看
速率较慢。
潮大气腐蚀
在潮湿的大气环境中,金属表面 水膜连续且较薄,氧的扩散和金 属氧化物的形成加速,腐蚀速率
增加。
湿大气腐蚀
在湿润的大气环境中,金属表面 水膜较厚,氧的扩散和金属氧化 物的形成进一步加速,同时水膜 中可能含有腐蚀性离子,导致腐
电化学腐蚀(第一讲)

6
在金属和合金的实际腐蚀中,可以发 生一个以上氧化反应。例如合金中有几个 组元,他们的离子可分别进入溶液中。还 可产生一个以上的还原反应。
7
3、腐蚀的次生过程
例如:在中性的3%NaCl 溶液中,铁、 铜的接触腐蚀行为: 阴极反应 O2+2H2O+4e——4OH阳极反应 Fe-2e —— Fe2+
第二章 电化学腐蚀基础
第一节 腐蚀原电池过程 第二节 电极电位
1
1、腐蚀原电池过程 (1)原电池 电极反应:
阳极:2H+ + 2e —— H2 阴极:Zn - 2e —— Zn 2+ 反应速度: V=ΔM/St; (Q=ΔM·F/N )=N·Q/S·t·F
=k·i
I
碳棒 锌片
NH4Cl
2
(2)腐蚀原电池
4
2、腐蚀电池的化学反应
腐蚀电池由四部分构成:阳极,阴极, 外回路,电解液;
阳极过程: Me —— Men+ + ne 阴极过程: D + ne —— [D·ne] 电流流动: 溶液中离子迁移, 在回路上电
子运动
5
常见一些阴极反应
O2+4H++4e——2H2O O2+2H2O+4e——4OH 2H++2e——H2
度为1,进行1/2H2——H+ + e的可逆反应的电极 体系。人为规定氢电极的标准电位为0。
20
(2)平衡电极电位:指当金属电极与溶液界面的电极过 程建立起平衡反应:
Men+ ne + mH2O — Men+mH2O + ne 该电极反应的电量和物质量在氧化、还原反应中都 达到平衡时的电极电位(E)。 若仅仅是电量平衡,而无物 质的平衡则称做稳态电位(ER)。 平衡电极电位 (电量,物质量平衡)是在可逆电池中,可 逆反应建立起来的电位。
6-金属腐蚀电化学理论基础(析氢-吸氧)-3

i i i
电化学极化控制下的腐蚀动力学方程
设电极反应的阻力主要来自电子转移步骤,液相传质容易
进行,这种电极反应称为受活化极化控制的电极反应。
电位变化对电极反应活化能的影响 电极反应在电极界面进行,因为电极反应中带电粒子要穿
越界面双电层,故反应活化能中应包括克服电场力所做的功。
化曲线,是研究金属腐蚀 机理和腐蚀控制的基本方 法之一。
4
腐蚀极化图(可以通过实验测定二者关系确定腐蚀速度)
R K 高阻电压表 A V
测Zn电极电位的电 K开路时,没有电流
路没画出来。
通过,测到的电位分别为 阴极和阳极的静止电位 EeC(Cu),EeA(Zn)。 K闭路,电流通过,
Zn
Cu
e A E EA
浓差极化控制下的腐蚀动力学方程 电流通过电极时,如果电子转移步骤快于反应物或产物的
液相传质步骤,则电极表面和溶液深处的反应物和产物的浓度 将出现差别,由于这种浓度差引起的电极电位的变化,称为浓 差极化。 为简便起见,在讨论浓度极化时,假设电化学步骤及其它 化学步骤没有任何困难,整个电极反应过程的速度仅为液相传 质步骤控制。 液相传质过程有三种方式:对流、扩散和电迁移。
15
析氢反应的机理——迟缓放电理论 1)与材料无关(吸附作用影响小) 迟缓放电机理:电化学过程最慢,是析氢腐蚀的控制步骤 电化学步骤(慢)+ 化学脱附(快)
电化学步骤(慢)+ 电化学脱附(快)
2)与材料有关(吸附作用影响大) 复合机理:化学脱附最慢,是析氢腐蚀的控制步骤
电化学步骤(快)+ 化学脱附(慢)
内容回顾
腐蚀电池的极化现象(极化程度和电流即腐蚀速度有一定关系)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
主要参考资料 Nhomakorabea
腐蚀电化学研究方法 宋诗哲编著 腐蚀电化学原理 曹楚南编著 Corrrosion and corrosion control R. Winston Revie 腐蚀工程 M.G.方坦纳 金属腐蚀理论及应用 魏宝明主编 材料腐蚀学原理 肖纪美,曹楚南. 腐蚀工程手册 Pierre R.Roberge.
(4) 腐蚀电流密度表示。
对于电化学腐蚀,当无其它副反应存在时, 金属的腐蚀速度可用阳极电流密度来表示。 如果能够测得腐蚀电流密度值,那么根据 法拉第定律就可以准确计算金属腐蚀速度,因 此可以用腐蚀电流密度表示电化学腐蚀速度。
iM 失重= nF
腐蚀原电池
腐蚀电池的定义:只能导致金属材料破坏 而不能对外界作功的短路原电池。
主要内容
腐蚀的电化学研究方法 典型局部腐蚀 非金属腐蚀 电化学保护 电化学表面处理技术
第一章 腐蚀的电化学研究方法
稳态极化曲线的测量及其在腐蚀研究中的应用 电化学阻抗谱原理及其在腐蚀研究中的应用 暂态电化学方法在腐蚀研究中应用
稳态极化曲线的测量及其在腐蚀研究 中的应用
应用腐蚀电化学
国内主要专业杂志
中国腐蚀与防护学报 腐蚀与防护 腐蚀科学与防护技术 材料保护 表面技术 全面腐蚀控制 物理化学 金属学报 材料科学进展 电化学
国外主要专业杂志
Corrosion Material Performance Corrosion Science British Corrosion Journal Journal of the Electrochemical Society Oxidation of Metals Progress in Organic Coatings Journal of Materials Science
(2)厚度法 用金属发生全面腐蚀后金属厚度的平均减 薄来表示金属的平均腐蚀速度。它与失重法测得的腐蚀 速度的换算关系式为:
vd=
v失重 8.76
(mm/y)
式中,vd是采用平均厚度变化指标表示的金属的平均腐蚀速度, 单位为mm· y-1,ρ是金属材料的密度,单位g· cm-3,8.76是与失重法 测得的腐蚀速度进行单位换算后的系数 根据年腐蚀深度,材料耐蚀性可分三级:
均匀腐蚀速度的表示
(1)重量法 .可用失重或增重方法表示
W0 - W1 v失重= St
W2 - W0 v增重= St
式中, v失重表示使用失重方式表示的金属平均腐 蚀速度,单位g· m-2· h-1;W0为试样原始重量,单位g; W1为试样清除腐蚀产物后的重量,单位g;S为试样 的表面积,单位m2;t为腐蚀时间,单位h; v增重表示使用增重方式表示的金属平均腐蚀速度, 单位g· m-2· h-1;W2未清除腐蚀产物时试样重量,单位 g。
H2 ( 气 泡) HCl溶液
杂质
锌
锌在稀盐酸中腐蚀示意图
A
K
Zn
Cu
Zn
Cu
Cu
Cu
Cu
HCl溶液
(a)Zn块和Cu块通 过导线联接 负极Zn: 正极Cu:
HCl溶液
(b)Zn块和Cu块直 接接触(短路) Zn → Zn2++2e (氧化反应) 2H++2e → H2 ↑(还原反应)
Zn
(c)Cu作为杂质分 布在Zn表面
腐蚀电池的构成
腐蚀电池的特点:
1、 腐蚀电池的阳极反应是金属的氧化反 应,结果造成金属材料的破坏。 2、腐蚀电池是短路的原电池,电池反应 是以最大限度的不可逆方式进行的,电 池产生的电流全部消耗在内部,转变为 热,不对外做功。 3、阴极、阳极反应相对独立,但又必须 耦合,无净电荷积累。
宏观电池: 用肉眼可以观察到的电极组成的腐 蚀电池称为宏观电池 (阴、阳极区可分辨, 稳定) 微观电池:金属表面的电化学不均匀性,会在 金属表面形成许多微小的电极,由这些微小电 极形成的电池称为微观电池 。(不能用肉眼 区分腐蚀电池的两极,不稳定)
金属腐蚀概论 稳态极化曲线的测量 稳态极化曲线在腐蚀研究中的应用
金属腐蚀概论
定义:金属材料和周围环境发生化学或 电化学 的作用而破坏。它是自发过程,是冶金的逆过 程。
广义定义:工程材料和周围环境发生相互作用 而破坏。如高分子材料、混凝土等。
腐蚀的分类 按按腐蚀的反应历程分类 (1)化学腐蚀 化学腐蚀是金属和环境的介质由于化学反应而 发生的腐蚀现象,在化学反应过程中没有腐蚀 电流产生,它服从多相反应的化学动力学规律。 例如金属在干燥气体中的腐蚀。 (2)电化学腐蚀 电化学腐蚀是金属在离子导电的介质中由于发 生电化学反应而发生的腐蚀现象,有腐蚀电流 产生,它服从电化学动力学规律。例如,在土 壤、海水、潮湿大气中的腐蚀。
一级 耐蚀
二级 可用
< 0.1 mm/y
0.1~1.0 mm/y
三级 不耐蚀 >1.0 mm/y
(3)容量法 对于金属在不含溶解氧的非氧化性酸中 的均匀腐蚀,也可用析出腐蚀产物氢气的体积变化来表 示平均腐蚀速度。
V0 v容量= (cm 3 cm 2 h 1 ) St
式中, v容量是析出腐蚀产物氢气的体积变化来表示平均 腐蚀速度指标,单位cm3· cm-2· h-1;V0为换算为0℃和1 个标准大气压时腐蚀气体产物的体积,单位cm3;S为 试样的表面积,单位m2;t为腐蚀时间,单位h。
Al +CCl4
AlCl4
Al
AlCl4
非导电介质
CCl4
e Me e
Men+
导电介质
H+-H2
按腐蚀的形态分类
(1)全面腐蚀 金属材料表面皆发生腐蚀。全面腐蚀又可分 为均匀的全面腐蚀和非均匀的全面腐蚀。 (2)局部腐蚀 金属材料表面局部区域严重腐蚀,其它区域 不腐蚀或腐蚀轻微。局部腐蚀又可分为电偶腐 蚀、点腐蚀、缝隙腐蚀、晶间腐蚀、选择性腐 蚀、应力腐蚀和腐蚀疲劳等。
腐蚀金属电极和腐蚀电位
腐蚀金属电极:一个金属或合金,如果在它所 接触的介质中发生电化学腐蚀,而我们对这一 块金属或合金在该介质中进行电化学测量时, 这一金属或合金就叫做腐蚀金属电极。 在测量时,没有外电流从腐蚀金属电极流 入或流出,腐蚀金属电极的外电流为零。这样 的电极称为孤立的电极。对于孤立的电极的电 化学测量只能测量一个变量:电极的电位。对 于孤立的腐蚀金属电极,测得的电位叫腐蚀电 位。
